Method Article
Создание Sub-50 Нм нанофлюидика переходов в PDMS микрожидкостных Chip с помощью процесса самосборки коллоидных частиц
В этой статье
Резюме
We propose a simple self-assembly technique of silica colloidal nanoparticles to create a nanofluidic junction between two microchannels in polydimethylsiloxane (PDMS). Using this technique, a nanoporous bead membrane with a pore size down to ~45 nm was built inside a microchannel and applied to electrokinetic preconcentration of DNA samples.
Аннотация
Полидиметилсилоксан (ПДМС), является преобладающим строительным материалом, чтобы сделать микрожидкостных устройств из-за своей простоты формования и склеивания, а также его прозрачности. Из-за мягкости материала PDMS, тем не менее, оно является сложной задачей использовать PDMS для построения наноканалов. Каналы, как правило, легко разрушаются при плазменном связи. В этой статье мы представляем испарительную управляемый метод самосборки наночастиц кремнезема коллоидных для создания нанофлюидика перекрестки с суб-50 нм пор между двумя микроканалов. Размер пор, а также поверхностный заряд нанофлюидика-перехода перестраиваемый просто путем изменения коллоидного кремнезема Размер шарика и функционализации поверхности снаружи собранного микрожидком устройства во флакон перед процессом самосборки. С помощью самосборки наночастиц с размером борта шины 300 нм, 500 нм и 900 нм, можно было изготовить пористую мембрану с размером пор ~ 45 нм, ~ 75 нм и ~ 135 нм, соответственно. Под электрическималь потенциал, эта нанопористых мембрана инициирована концентрация ионов поляризация (ICP), действующий в качестве катиона селективные мембраны концентрировать ДНК в ~ 1700 раз в течение 15 мин. Это не-литографических процесс Nanofabrication открывает новую возможность построить перестраиваемого нанофлюидика стык для изучения наноразмерных процессов переноса ионов и молекул внутри микрожидком чипа PDMS.
Введение
Нанофлюидики является развивающейся областью исследований , ЗЯ , TAS (Micro Всего Analysis Systems) для изучения биологических процессов или явлений переноса ионов и молекул в масштабе длины 10 1 - 10 2 нм. С появлением нанофлюидика инструментов , таких как наноканалах, процессы переноса молекул и ионов можно контролировать с беспрецедентной точностью и манипулировать ими, в случае необходимости, за счет использования возможностей, которые доступны только в этом масштабе длины для разделения и обнаружения. 1,2 Один из эти характерные черты наноразмерные является высокое отношение поверхности к объемного заряда (или номер Духин) в наноканалах , что может привести к дисбалансу заряда и инициировать поляризацию концентрации ионов (ICP) между наноканалом и микроканалов. 3
Общая платформа устройства для изучения нанофлюидика явлений состоит из системы двух микроканалов , соединенных массивом наноканалах в качестве перехода. 4-6 Материал выбора для создания такого устройства нанофлюидика является кремний из - за его высокой жесткости , что предотвращает канал от разрушения во время связывания процессов. 7 Тем не менее, изготовление устройства кремния требует дорогостоящих масок и значительное количество обработки в чистых помещениях объекта. 8- 10 из - за удобства изготовления устройства посредством формования и плазменной сварки, полидиметилсилоксана (PDMS) широко принят в качестве строительного материала для микрофлюидики и было бы идеальным материалом для нанофлюидики , а также. Тем не менее, модуль упругости его низкой Юнга вокруг 360-870 КПа, делает канал PDMS легко разборные во время плазменной сварки. Минимальный коэффициент формы наноканале (отношение ширины к глубине) должна быть меньше, чем 10: 1, что означает, что изготовление устройств PDMS через стандартные фотолитографии будет чрезвычайно сложной задачей, если глубина наноканальных должна быть ниже 100 нм, требующих ширины канала меньше, чем текущий предел photolithграфия около 1 мкм. Чтобы преодолеть это ограничение, были попытки создать наноканалов в PDMS с использованием не-lithographical методы , такие как растяжение , чтобы инициировать трещины со средней глубиной 78 нм 11 или для образования морщин после плазменной обработки. 12 схлопывании канал PDMS с механическим давлением позволило высота наноканальных по цене от 60 нм. 13
Даже если эти весьма изобретательные не-литографических методов позволили построить наноканалов ниже 100 нм в глубину, размерная управляемость при изготовлении наноканалом до сих пор представляет собой препятствие для широкого признания PDMS в качестве строительного материала для нанофлюидика устройств. Другой важной проблемой из наноканалах, будь то в кремнии или PDMS, является функционализации поверхности в случае, если есть необходимость изменить поверхностный заряд на стенке канала для манипулирования ионов или молекул. После сборки устройства через связи, что наноканалах чрезвычайно труднотянутся к поверхности функционализации из-за ограниченной диффузией транспорта. Для создания наноразмерных канал с высокой размерной точностью и легкому функционализации поверхности, метод самосборки коллоидных частиц , индуцируемых испарением 14-16 в микрофлюидальных устройств может быть одним из многообещающих подходов. К тому же контролируемости размеров пор и поверхностной собственности, есть даже возможность настройки размера поры при использовании на месте коллоидные частицы , покрытые полиэлектролитов путем регулирования температуры, 17 рН, 18,19 и ионной силы раствора . 18 Из них преимущества, метод самосборки коллоидных частиц уже нашли применение для электрохроматографии, 20 биосенсоров, концентрация 21 белков 22 и разделения белков и ДНК в микрофлюидики. 14,23 в этом исследовании мы развернули этот метод самосборки , чтобы построить электрокинетическая концентрирование устройство вPDMS , которая требует нанофлюидика соединение между двумя микроканалов. 24 Основным механизмом за электрокинетического концентрации основана на концентрации ионов поляризации (ICP). 25 Подробное описание изготовления и сборки ступеней входит в следующий протокол.
протокол
1. Получение кремнезема коллоидных бисера подвесов
- Получение 300 нм и 500 нм бортов суспензий кремнезема
- Vortex кремнезем шарик запас подвеска (10% вес / объем в воде) в течение 30 сек. для получения гомогенной суспензии. Пипетировать в общей сложности 600 мкл смеси суспензии в 1,5 мл пробирку и центрифугируйте при 2,600 мкг в течение 1 мин.
- Подставим супернатант с 400 мкл 1 мМ натрий-фосфатном буфере (PB, рН 7,0).
- Приостановка диоксида кремния, гранул, в конечной концентрации 15% в 1 мМ растворе фосфата натрия при рН 7,0 с помощью встряхивания.
- Поверхность функционализации 500 нм кремнезема карбоксильные шарики с поли (аллиламин гидрохлорид, PAH), а также с поли (натрий сульфонат стирола, PSS) полиэлектролиты
- Приостановка 0,1 г 500 нм диоксида кремния бусинок с карбоксильной группой с 10 мл 1 М NaCl (рН 7,0) в течение 1% (вес / объем) суспензионной.
- Готовят 0,4% PAH (MW 65K) в 1 М наКл путем растворения 300 мкл исходного раствора (20% вес / об в воде) в 15 мл 1 М NaCl. Готовят 0,9% PSS (MW 70K) в 1 М раствора NaCl путем растворения 0,18 г PSS в 20 мл раствора 1 М NaCl. Vortex оба решения в течение 1 мин. чтобы полностью растворить полиэлектролитов.
- Добавить 200 мкл раствора ФАГ до 9,8 мл 1% диоксида кремния карбоксильными бусами в 15 мл трубки для осаждения положительно заряженного полиэлектролита слой на диоксиде кремния бусинок с карбоксильной функциональной группой. Vortex шарик суспензии в течение 1 мин. и инкубировать ее на ротатор пробирке в течение 60 мин. при комнатной температуре.
- Центрифуга шарик суспензии при 1801 мкг в течение 1 мин. и смыть несвязанных PAH пять раз дистиллированной водой 10 мл. После каждого центрифуге и удаления супернатанта, гранулы плотно упакованы в нижней части трубы. Лишить шарик комочек энергичным пипеткой 2 мл деионизированной воды перед добавлением 8 мл дистиллированной воды, так, что шарики могут быть повторно суспендирован и смывается до следующего шага центрифуге.
- следитьДействия, описанные в 1.2.3 и 1.2.4 для PSS покрытия для осаждения отрицательно заряженный слой на шариках. Повторное приостановить бусин в 9,8 мл 1 М NaCl перед осаждением PSS после удаления надосадочной жидкости деионизованной воды с 5 - й стадии промывки 1.2.4.
- Используйте ту же самую энергичную раскапывания, используя 2 мл 1 М NaCl, чтобы разбить шарик комок на дне 15 мл пробирку, а затем добавляют 8 мл 1 М NaCl. Добавить 200 мкл раствора PSS до 9,8 мл диоксида кремния, осажденных шариков с одним слоем ПАГ. После интенсивного перемешивания в течение 1 мин. и инкубации в течение 60 мин. на ротатор трубки, повторите 5 стадии промывки дистиллированной водой.
- Мера дзета-потенциал гранул до и после каждого полиэлектролита покрытия с помощью системы динамического рассеяния света в соответствии с протоколом производителя для проверки процедуры осаждения полиэлектролита была выполнена правильно (см таблицу 1).
- Повторите пять шагов промыванием дистиллированной водой следующие один слой PSSосаждения и повторно приостанавливать бисером в 650 мкл 1 мМ натрий-фосфатного буфера с 0,05% твина 20 (15% вес / объем) перед использованием в микрожидком устройстве для повышения его сыпучесть.
- Выполните процедуру, описанную выше, от 1.2.5 до 1.2.6 на 500 нм кремнезема шариков с аминной функциональной группой для нанесения одного слоя ПСС.
2. Изготовление из PDMS микрожидкостных Chip
- Микротехнологий мастера кремния
- Изготовить мастер кремния для PDMS литья с использованием технологии изготовления микроструктур следующим образом.
- Спин пальто 1 мкм тонкие фоторезиста при 4000 оборотах в минуту на кремниевой пластине. Шаблон слой с помощью проекционной литографии (время экспозиции 170 мсек.) И травление 700 нм глубокие и широкие плоские 2 мкм наноканалов (действующий в качестве nanotraps для силикатных шариков) с реактивным ионным травлением.
- Используйте следующие параметры травления для достижения скорости травления 3,5 нм / с: CHF 3 (45 SCCM), CF 4 (15 SCCM), Ar (100 SCCM), давление 100 мТорр, ВЧ - мощность 200 Вт
- Спин пальто второй толщиной 1 мкм слой фоторезиста при 2000 оборотах в минуту и выполнить выравнивание с ранее узорчатых nanotraps. Шаблон микроканалы с помощью контактной литографии и глубокого реактивного ионного травления (DRIE) кремния. Используйте параметры DRIE 26 в таблице 2.
- Изготовить мастер кремния для PDMS литья с использованием технологии изготовления микроструктур следующим образом.
- Изготовление пресс - формы PDMS
- Silanize мастер кремния с трихлорсилана (50 мкл) в вакуумной банке O / N.
ВНИМАНИЕ: Tricholorosilane является токсичным и коррозионных материалов. Всегда используйте его в химической капот с соответствующим оборудованием индивидуальной защиты. - Смешайте основание с отвердителем в соотношении 10: 1 и литых PDMS на силанизированном мастера кремния и вылечить его при температуре 70 ° С в течение 2 ч в конвекционной печи.
- Удалите плиту PDMS от мастера кремния с ножом и плазменной связью его на пустой пластины с помощью пылесоса плазмы после плЛечение Асма в очистителя плазмы в течение 1 мин. Приложить ленты вдоль края, чтобы отметить раздел линию для следующих PDMS шаг литья.
- Silanize плесень PDMS в вакуумной баночке с трихлорсилана (50 мкл) O / N.
- Литой PDMS (основа: отвердитель в соотношении 10: 1) на силанизированном PDMS плесень и вылечить ее при температуре 70 ° С в течение 2 ч в конвекционной печи.
- Silanize мастер кремния с трихлорсилана (50 мкл) в вакуумной банке O / N.
- Изготовление устройства PDMS
- Снимают отвержденного PDMS плиты из формы PDMS вдоль разделительной линии, отмеченной лентой.
- Панч пластовые отверстия с трепанобиопсия 1,5 мм, чистый с лентой, промыть изопропиловым спиртом (IPA) и сухим азотом.
- Плазменный связь, то ПДМС устройство на х 75 мм, предметное стекло микроскопа 25 мм после плазменной обработки в чистой плазмы в течение 1 мин.
- Ultrasonicate шарик суспензии в течение 60 мин. в ультразвуковой ванне перед заполнением. Пипетировать 10 мкл шарик подвес (300 нм без функционализированного кремнезема бытьобъявления, или 500 нм кремнезема карбоксильные шарики с PAH-PSS слоев, или 500 бусин аминные нм диоксида кремния с PSS слоем) в бухтах 4 и 6 каждая (см Рисунок 1 А, В) сразу же после плазменной связи чипа PDMS другу по электронной стеклянная подложка. Нажмите мягко на чипе PDMS с кончика пипетки для улучшения упаковки шарик.
- После заполнения каналов доставки шарик, охватывают все входные отверстия для 1 и 9 с лентой, за исключением. Высушите устройство в течение 3 ч и хранить при +4 ° C до использования. Рисунок 2 дает шаг за шагом схему коллоидного процесса самосборки.
3. Эксперимент для электрокинетического Концентрация ДНК
- Заполните резервуары 3, 7 буферным раствором (10 мкл 1 мМ PB) и резервуар 5 с образцом ДНК (10 мкл 10 нМ в 1 мМ PB) и применить мягкое отрицательное давление с перевернутой наконечником пипетки на коллекторах 2 , 8 и 10, чтобы заполнить каналы с растворами, без пузырьков (см Фигура 1В).
- Добавляют 10 мкл 1 мМ PB в резервуарах 2 и 8 и 10 мкл 10 нМ до ДНК резервуар 10, чтобы уравновесить давление и ждать в течение 5 мин. для достижения равновесия.
- Вставьте провода Pt в резервуары 3, 5, 7, 10.
- Подайте напряжение через нанофлюидика перехода с помощью делителя напряжения, подключенного к измерителю источника и проводов Pt. Сначала нанесите 30 V на водохранилищах 5, 10 и GND на коллекторах 3, 7.
- Уменьшение напряжения до 25 В на резервуаре 10 после ~ 30 сек.
- Используйте механический затвор с периодическим открытием в каждые 5 секунд, чтобы свести к минимуму фотообесцвечивание образца при записи сигналов флуоресценции от ДНК.
Результаты
Электрокинетическая чип Концентратор в PDMS , который содержит самоорганизующуюся нанофлюидика соединение между двумя микроканалов показан на рисунке 1А). Канал в середине устройства заполнена раствором образца ДНК и между двух буферный раствор каналов на каждой стороне через 50 мкм широкий доставки бусинка канала (Фиг.1В). Диоксид кремния коллоидная суспензия втекает кромочной канал доставки сразу после плазменной связи для создания нанофлюидика стык между образцом и каналом буферного раствора. Массив nanotrap, состоящий из 700 нм глубокой и 2 мкм шириной наноканалах используется для улавливания коллоидные частицы. Его сканированное изображение получено с поверхностным Profiler бесконтактным показано на фиг.1C). Коллоидные шарик мембраны после испарения показаны на рис 1D). СЭМ на рисунке 1E) показывает Кремнезем шарики ловушкуPED на плоском массиве nanotrap, отделяющей канал выборки из канала доставки шарик. 300 нм кремнезема шарик упаковка показывает высокоупорядоченную гексагональную упаковку с некоторыми незначительными дефектами , которые могут привести к изменению в поведении концентрации (рис 1F). Конструкция обогатительной чипа PDMS с его размерами можно найти здесь и в дополнительные файлы.

Рисунок 1. Микрожидкостных Концентратор в PDMS с интегрированным суб-50 нм нанопористых перехода. (A) Фотография PDMS концентратором устройства. (В) Схема микро-нанофлюидика устройства с каналом подачи шарика между каналом раствора образца и буфера. При этом напряжение подается через бусинки мембранами между каналом образца и ч буферного раствораAnnels. (C) профиль поверхности массива nanotrap в PDMS с шириной 2 мкм и глубиной 700 нм. (D) Микрофотография устройства с коллоидным сборки частиц внутри канала подачи шарика после испарения. (Е) микроснимок из самоорганизованными 300 нм частиц кремнезема коллоидных с nanotrap массивами между образцом и буферный канал. В 300 нм шарики оказались в ловушке у входа в nanotraps за счет поверхностного натяжения. (F) шестиугольной упаковано 300 нм кремнезема шарики внутри микроканала доставки шарик после испарения. (Адаптировано из работы. 25 с разрешения Королевского химического общества) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Схема шагов микроструктур для concentrato PDMSг устройство показано на рисунке 2. Чтобы сделать PDMS устройство, требуется двойное литье PDMS. Процесс заполнения шарика в концентраторе PDMS показано на рисунке 3. Детали для микротехнологий и процесса заполнения можно найти в протоколе. Дзета-потенциал диоксида кремния бусин без планки и с полиэлектролита покрытием показано в таблице 1.
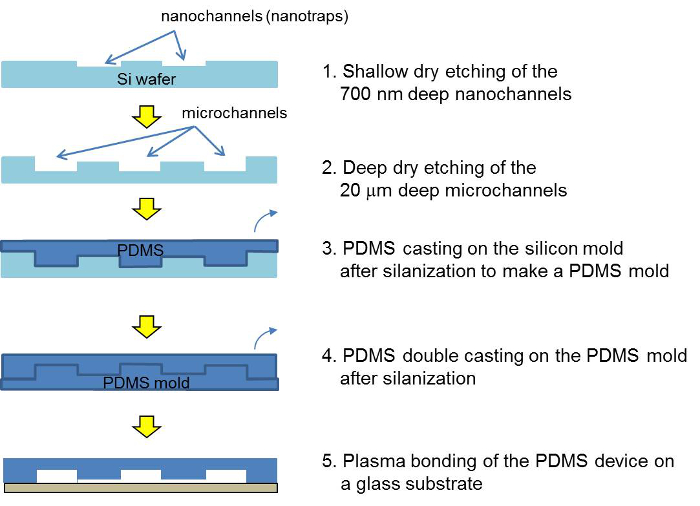
Рисунок 2. Схема процесса изготовления для мастера кремния, мастер PDMS и устройством PDMS концентратором. После двух фотолитографии и травления, мастер кремния отливается с PDMS. После двойного формования, то PDMS устройство собрано с помощью плазменного склеивания и заполнены шариковой подвеской. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Шаг за шагом Схема для самосборки коллоидных кремнезема шариков. 10 мкл бисерной суспензии пипеткой к каналам доставки шарик сразу после плазменной обработки. После того, как канал доставки шарик был заполнен, все, кроме двух входных отверстий 1 и 9 были покрыты лентой и устройствами сушили на воздухе в течение 3 ч до использования. (Воспроизводится из работы. 25 с разрешения Королевского химического общества) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Коллоидные частицы (500 нм) | Дзета-потенциал (мВ) |
| кремнезем | -2,04 |
| Silica амин | 19,6 |
| Silica карбоксильная | -19,73 |
| Диоксид кремния сarboxyl, PAH с покрытием | 31,8 |
| Silica карбоксил, PAH, PSS с покрытием | -28,5 |
| Silica амин, PSS с покрытием | -31,2 |
Таблица 1. дзета - потенциал кремнезема бусинок при 25 ° C. 0,1% (вес / объем) коллоидные растворы использовали для измерений (п = 3).
Изображения СЭМ берутся из канала шарика упаковки после высыхания показывают размер пор в диапазоне от 60 нм, 91 нм и 170 нм, как показано на рисунке 4. Размер пор соответствует примерно 20% от размеров гранул, 300 нм, 500 нм и 900 нм, соответственно (15% от диаметра борта теоретический размер пор).

Рисунок 4. СЭМ изображения самоорганизующейся 300 нм (А), 500 нм (В) и 900 нм (C) , диоксид кремния коллоидный шарик упаковки. PDMS устройства были соединены обратимо предметные стекла и бусин втекает в канал с использованием отрицательного давления. После воздушной сушки устройства O / N, то PDMS устройства были очищены из стекла тщательно и образ. Эти размеры пор, по оценкам, 60 ± 2, 91 ± 5 и 170 ± 7 нм на 300 нм, 500 нм и 900 нм соответственно бусин (п = 9). Эти размеры пор были близки к теоретическому размеру, ~ 15% от диаметра борта. (Адаптировано из работы. 25 с разрешения Королевского химического общества) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
При подаче напряжения 30 В через бортовое мембрану 300 нм, наблюдалась вблизи коллоидной мембраны Зону истощение ионов внутри микроканала, наполненныйфлуоресцентный меченый ДНК (рис 5 А, В). При снижении напряжения до 25 В на левой стороне, молекулы ДНК получили аккумулируется в виде пробки и его концентрация увеличивается за счет электроосмотического потока обусловлен разностью напряжений 30 V - 25 V поперек канала образца (рис 5 С , D).

Рисунок 5. Время покадровой микрофотографии показывают формирование области обеднения иона вблизи нанофлюидика коллоидных переходов в канале , заполненном ДНК (начальная концентрация 10 нМ). Обедненной области ионов было инициировано при Т = 10 с и концентрированной ДНК пробки образовывался при V2 = 30 V и V1 = 25 V поперек канала образца в то время как буферные каналы были заземлены. Пунктирные линии были использованы для выделения каналов стены. Коэффициент концентрации ~ 1,700 складок было достигнуто в течение 15 мин. Uспоет 300 нм коллоидного мембрану. (Воспроизводится из работы. 25 с разрешения Королевского химического общества) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
На основе диоксида кремния мембраны с размером шарика 300 нм и 500 нм показал самый высокий коэффициент концентрации в ~ 1700 раз для Cy 5 меченый ДНК (CAA CCG ATG CCA CAT CAT TAG CTA C) в течение 15 мин. (Рисунок 6 А, В). Полиэлектролита покрытием шарик мембраны кремнезема приводит к 200- 1000-кратное увеличение концентрации ДНК через 15 мин. (Рисунок 6 , С, D).
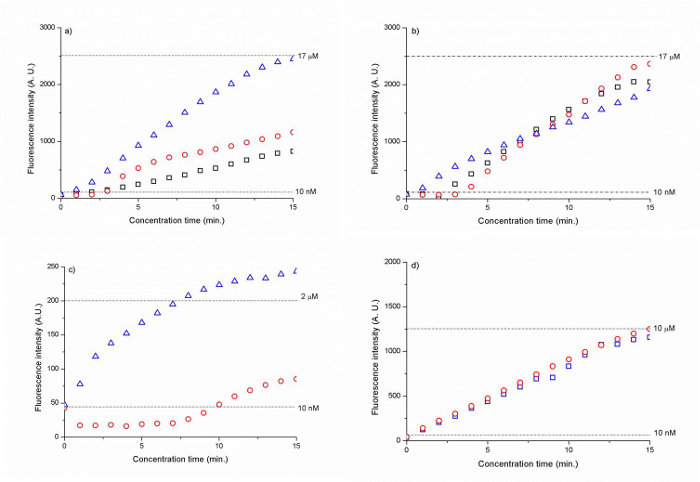
Рисунок 6. Интенсивность флуоресценции ДНК как функции времени для (А) 300 нм диоксида кремния бусинок (В) 500 нм диоксида кремния бусинкиd (C) 500 нм шарики амина PSS покрытием из диоксида кремния и (D) 500 нм PAH / PSS с покрытием диоксид кремния карбоксильные шарики. Пунктирные линии обозначают уровень интенсивности сигнала флуоресценции для 10 нм (A, B, C, D), 17 мкМ (а, В), 2 мкМ (C) и 10 мкМ (D) ДНК. Результаты были нормированы на фоновой флуоресценции. (Воспроизводится из работы. 25 с разрешения Королевского химического общества) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| время процесса | Etch режим | режим пассивация |
| время процесса | 6 лет | 4.5 s |
| перерасход | 0,5 с | 0 s |
| Валик Генератор | 80 Вт | 60 Вт |
| Катушка Генератор | 600 Вт | 600 Вт |
| газ | SF 6 70 SCCM | C 4 F 8 35 SCCM |
| Etch скорость | 1,47 мкм / мин | |
Таблица 2. Параметры DRIE.
Обсуждение
После общего устройства расчетную схему для изучения нанофлюидики, мы изготовили нанофлюидика соединение между двумя микроканалов с помощью испарения управляемой самосборки коллоидных наночастиц вместо литографически кучность массив наноканалах. При протекании коллоидные частицы в бисерной канала доставки, массив nanotraps с глубиной 700 нм и шириной 2 мкм по обе стороны от канала подачи шарика, при общей ширине 100 мкм предотвратили суспензионной от втекающий в буфер и образец канала из-за поверхностного натяжения на nanotraps. После того, как в ловушке, коллоидные частицы, загружаемый в бисерной канала доставки быстро и сформировал нанопористого стык между образцом и буферный канал.
Важно, чтобы немедленно загружать суспензионной после плазменной склеивание так, что капиллярная сила приводит в движение кремнезем суспензионной до входа в выпускном гeservoirs в временно гидрофильного канала доставки шарик. Для того, чтобы предотвратить воздушный пузырь блокирующий поток во впускном коллекторе, настоятельно рекомендуется, чтобы достичь дна резервуара с наконечником пипетки, а затем отпустить шарик суспензии в резервуар. В случае поверхностно-функционализированные бусы с полиэлектролитов, их сыпучесть резко сократилось по сравнению с кремнеземных бусин без поверхности функционализации и имели тенденцию к более легко агрегировать и прилипают к поверхности канала во время процесса заполнения. Для того, чтобы предотвратить засорение канала с полиэлектролита покрытием бусин, мы добавили поверхностно-активное вещество, 0,05% твин 20, к суспензионной. В случае, если по-прежнему существует проблема забивания во время наполнения, нежный постукивание на чипе PDMS с наконечником пипетки в целом помогли решить ее.
Кроме того, важно, чтобы суспензионной не была полностью высохшей после испарения, так как это было бы трудно инфiltrate бортовое мембрану в буферный раствор фосфата натрия снова. Таким образом, после того, как 3 ч частичного испарения, все Входные и выходные отверстия устройства PDMS были записаны на пленку, и выдерживали при 4 ° С для хранения до использования, так что шарик упаковка остается влажной. В ходе экспериментов концентрирование, самостоятельно собранный шарик сохраняет свою структурную стабильность в течение большей части. Тем не менее, в ряде случаев мы наблюдали смещение шариков, которые указывали дефектную упаковку шариков в микроканалов. В самосборкой бусинки диоксида кремния в диапазоне от диаметра 900 нм до 300 нм после самосборки можно увидеть на рисунке 4. Теоретический размер пор кромочной упаковки составляет ~ 45 нм, примерно ~ 15% коллоидной частицы диаметр. Мы могли бы подтвердить размер пор с помощью анализа РЭМ и измеренный размер пор приблизительно 20% от диаметра борта шины после того, как упаковка.
Использование самоорганизующихся 300 нм и 500 нм мембран коллоидных частиц как ион-селективные наnoporous перехода, мы могли бы начать ионный обедненной области на 30 В и концентрат 10 нМ Cy5 меченый ДНК (CAA CCG ATG CCA CAT CAT TAG CTA C) в 1 мМ натрий-фосфатного буфера (рисунок 5). Непрерывно протекающий образец ДНК в сторону зоны обеднения иона с электроосмотического потока при разности потенциалов V 2 -V 1 = 5 В, мы могли бы увеличить начальную концентрацию ДНК на ~ 1,700 складок в течение 15 мин. (Рисунок 6а, б). 500 нм бусин позволило более устойчивую концентрацию ДНК, чем 300 нм бусинами, как показано на рисунке 6, б). Поскольку концентрация электрокинетического основана на балансе сил между электроосмоса силы и сильно нелинейных электрофоретических сил, в результате чего коэффициент концентрации определяется степенью , в которой эта сила баланс может поддерживаться в течение электрокинетического концентрации. 27
Еще одним существенным преимуществом развертывания коллоидных частиц для создания нанофлюидика стык является легкость, с которой его Surfacе функционализации может быть выполнена. Вместо того чтобы создавать наноканале путем склеивания, а затем выполняя функционализации поверхности на ней, можно просто поверхность функционализации частицы коллоидных в ампулу снаружи устройства, а затем поток их в канал для самосборки. На основе этого подхода, мы могли бы инициировать ВЧД с использованием частиц диоксида кремния амин 500 нм, покрытые одним слоем PSS и 500 нм карбоксильных частиц диоксида кремния, покрытого слоем PAH и PSS (рисунок 6 в и г), при более низком напряжении (8 В и 10 В, соответственно), чем коллоидных частиц без поверхности функционализации (30 В). Этот результат показывает, что поверхность функционализации коллоидных частиц до самосборки был эффективным для увеличения заряда поверхности коллоидных частиц и привело к более высоким ПМС. Тем не менее, с точки зрения фактора, полученного концентратором, то нанофлюидика стык поверхности функционализированный шариков был менее эффективен, чем не-функционализированного сиLiCa бисер. В / PSS-шарики с покрытием аминов включен фактор ~ 200, в то время как карбоксильная / PAH / PSS шарик мембраны показал 1000-кратное увеличение через 15 мин. (Рисунок 6D). Этот результат можно объяснить более высокой поверхностным зарядом поверхности функционализированный нанопор, которые привели к увеличению длины обедненной области ионного толкающей концентрации образца вилку подальше от борта мембраны и, следовательно, менее стабильной концентрации. Мы считаем, что сокращение общей ширины нанопористых мембраны шарика с нынешних 1 мм (секция борта мембраны параллельно каналу образца) может смягчить эту проблему нестабильности. Согласно нашему предыдущему исследованию, ширина нанопористых развязке определяет величину ионного тока , проходящего через него. 28 , как ширина увеличивается, ионный ток возрастает , а так как более катионов могут мигрировать через мембрану, длина увеличивается с износом и концентрации пробки далее оттолкнулся от нанопористых перехода. Therefore, накопление происходит в менее ограниченном образом, и образец пробка становится менее стабильным. Эмпирически нанопористого узел должен быть ~ 100-400 мкм в ширину. Еще одна особенность, чтобы улучшить была недостаточная толщина стенки PDMS 15 мкм между каналом образца и доставки бортового кольца. Этот тонкий срез PDMS привело к недостаточной связи, что позволило ионный ток между буфером и канала образца. Поэтому весь шарик мембраны секции параллельно каналу образца (1 мм в ширину), действуя в качестве нанопористых перехода, хотя только 100 мкм борта была задумана как нанопористых соединения мембраны в соответствии с общей шириной массива nanotrap. Толщина стенки PDMS должна составлять не менее 25 мкм или выше.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа была поддержана NIH R21 EB008177-01A2 и Нью-Йоркского университета Абу-Даби (NYUAD) исследовательского фонда Enhancement 2013 г. Мы выражаем нашу благодарность техническому персоналу MIT MTL за их поддержку во время микротехнологий и Джеймсом Уэстон и Николаса Giakoumidis из NYUAD для их поддержка в съемке SEM и построения делителя напряжения, соответственно. Изготовление устройства в PDMS проводилось в основной микротехнологий средстве NYUAD. И наконец, мы хотели бы поблагодарить Ребекку Pittam из NYUAD Центра Digital Стипендия для видео съемки и редактирования.
Материалы
| Name | Company | Catalog Number | Comments |
| Poly(Styrenesulfonic Acid) Sodium Salt | Polysciences | 08772 | |
| Poly(allylamine) Solution | Sigma Aldrich | 479144-5G | |
| Silica Microsphere - 300 nm | Polysciences | 24321 | |
| Silica Microsphere - 500 nm | Polysciences | 24323 | |
| Silica Microsphere Carboxyl Functional - 500 nm | Polysciences | 24753 | |
| Silica Microsphere Amine Functional - 500 nm | Polysciences | 24756 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | ||
| Trichlorosilane | Sigma Aldrich | 175552 | |
| Ultrasonic Cleaner | Branson | 3510 | |
| Tube Rotator | VWR | 10136-084 | |
| Vortex Mixer | WiseMix | VM-10 | |
| Microcentrifuge | VWR | Micro 1207 | |
| Plasma Cleaner | Harrick Plasma | PDC-001-HP | |
| PDMS Mixer | Thinky | ARE-250 | |
| Oven | Thermo Scientific | PR305220M | |
| Epi-fluorescence Microscope | Nikon | Eclipse Ti | |
| CCD Camera | Andor | Clara | |
| Platinum Electrodes | Alfa Aesar | 43014 | |
| Source Meter | Keithley | 2400 | |
| Digital Multimeter | Extech | 410 | |
| Microscopy Glass Slides | Thermo Scientific | 2951-001 | |
| Tween 20 | Merck Millipore | 822184 | |
| Sodium chloride | Fisher Scientific | 7646-14-5 | |
| Sodium phosphate monobasic | Sigma Aldrich | 71505 | |
| Sodium phosphate dibasic | Sigma Aldrich | S3264 | |
| DNA | IDT | CAA CCG ATG CCA CAT CAT TAG CTA C | |
| B-Phycoerythrin | Life Technologies | P-800 | |
| Dynamic light scattering system for Zeta Potential Measurement | Malvern | Zetasizer Nano S | |
| Photoresist | Shipley | SPR700-1.0 | |
| Projection lithography | Nikon | NSR2005i9 | |
| Reactive Ion Etcher | Applied Materials | AME P5000 | |
| ICP deep reactive ion etcher | STS | STS-6" | |
| Contact lithography | Electronic Visions | EV620 | |
| Photoresist Coater Developer | SSI | SSI 150 | |
| Non-contact surface profiler | Wyko | NT 9800 |
Ссылки
- Mawatari, K., Kazoe, Y., Shimizu, H., Pihosh, Y., Kitamori, T. Extended-Nanofluidics: Fundamental Technologies, Unique Liquid Properties, and Application in Chemical and Bio Analysis Methods and Devices. Anal Chem. 86, 4068-4077 (2014).
- Tsukahara, T., Mawatari, K., Kitamori, T. Integrated extended-nano chemical systems on a chip. Chem Soc Rev. 39, 1000-1013 (2010).
- Mani, A., Zangle, T. A., Santiago, J. G. On the Propagation of Concentration Polarization from Microchannel-Nanochannel Interfaces Part I: Analytical Model and Characteristic Analysis. Langmuir. 25, 3898-3908 (2009).
- Aizel, K., et al. Enrichment of nanoparticles and bacteria using electroless and manual actuation modes of a bypass nanofluidic device. Lab Chip. 13, 4476-4485 (2013).
- Wang, Y. C., Stevens, A. L., Han, J. Million-fold preconcentration of proteins and peptides by nanofluidic filter. Anal Chem. 77, 4293-4299 (2005).
- Karnik, R., et al. Electrostatic control of ions and molecules in nanofluidic transistors. Nano letters. 5, 943-948 (2005).
- Mao, P., Han, J. Y. Fabrication and characterization of 20 nm planar nanofluidic channels by glass-glass and glass-silicon bonding. Lab Chip. 5, 837-844 (2005).
- Mao, P., Han, J. Massively-parallel ultra-high-aspect-ratio nanochannels as mesoporous membranes. Lab Chip. 9, 586-591 (2009).
- Balducci, A., Mao, P., Han, J. Y., Doyle, P. S. Double-stranded DNA diffusion in slitlike nanochannels. Macromolecules. 39, 6273-6281 (2006).
- Yamada, M., Mao, P., Fu, J. P., Han, J. Y. Rapid Quantification of Disease-Marker Proteins Using Continuous-Flow Immunoseparation in a Nanosieve Fluidic Device. Anal Chem. 81, 7067-7074 (2009).
- Huh, D., et al. Tuneable elastomeric nanochannels for nanofluidic manipulation. Nat Mater. 6, 424-428 (2007).
- Chung, S., Lee, J. H., Moon, M. W., Han, J., Kamm, R. D. Non-lithographic wrinkle nanochannels for protein preconcentration. Adv Mater. 20, 3011-3016 (2008).
- Park, S. M., Huh, Y. S., Craighead, H. G., Erickson, D. A method for nanofluidic device prototyping using elastomeric collapse. Proc Natl Acad Sci. 106, 15549-15554 (2009).
- Zeng, Y., Harrison, D. J. Self-assembled colloidal arrays as three-dimensional nanofluidic sieves for separation of biomolecules on microchips. Anal Chem. 79, 2289-2295 (2007).
- Malekpourkoupaei, A., Kostiuk, L. W., Harrison, D. J. Fabrication of Binary Opal Lattices in Microfluidic Devices. Chem Mat. 25, 3808-3815 (2013).
- Merlin, A., Salmon, J. -. B., Leng, J. Microfluidic-assisted growth of colloidal crystals. Soft Matter. 8, 3526-3537 (2012).
- Schepelina, O., Zharov, I. PNIPAAM-modified nanoporous colloidal films with positive and negative temperature gating. Langmuir. 23, 12704-12709 (2007).
- Schepelina, O., Zharov, I. Poly(2-(dimethylamino)ethyl methacrylate)-Modified Nanoporous Colloidal Films with pH and Ion Response. Langmuir. 24, 14188-14194 (2008).
- Smith, J. J., Zharov, I. Ion transport in sulfonated nanoporous colloidal films. Langmuir. 24, 2650-2654 (2008).
- Gaspar, A., Hernandez, L., Stevens, S., Gomez, F. A. Electrochromatography in microchips packed with conventional reversed-phase silica particles. Electrophoresis. 29, 1638-1642 (2008).
- Lee, S. Y., et al. High-Fidelity Optofluidic On-Chip Sensors Using Well-Defined Gold Nanowell Crystals. Anal Chem. 83, 9174-9180 (2011).
- Hu, Y. L., et al. Interconnected ordered nanoporous networks of colloidal crystals integrated on a microfluidic chip for highly efficient protein concentration. Electrophoresis. 32, 3424-3430 (2011).
- Zhang, D. -. W., et al. Microfabrication-free fused silica nanofluidic interface for on chip electrokinetic stacking of DNA. Microfluid Nanofluid. 14, 69-76 (2013).
- Syed, A., Mangano, L., Mao, P., Han, J., Song, Y. A. Creating sub-50 nm nanofluidic junctions in a PDMS microchip via self-assembly process of colloidal silica beads for electrokinetic concentration of biomolecules. Lab Chip. 14, 4455-4460 (2014).
- Kim, S. J., Song, Y. A., Han, J. Nanofluidic concentration devices for biomolecules utilizing ion concentration polarization: theory, fabrication, and applications. Chem Soc Rev. 39, 912-922 (2010).
- Fu, J. P., Mao, P., Han, J. Y. Continuous-flow bioseparation using microfabricated anisotropic nanofluidic sieving structures. Nat Protoc. 4, 1681-1698 (2009).
- Plecis, A., Nanteuil, C., Haghiri-Gosnet, A. M., Chen, Y. Electropreconcentration with Charge-Selective Nanochannels. Anal Chem. 80, 9542-9550 (2008).
- Ko, S. H., et al. Nanofluidic preconcentration device in a straight microchannel using ion concentration polarization. Lab Chip. 12, 4472-4482 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены