Method Article
コロイド粒子の自己組織化プロセスを介して、PDMSマイクロ流体チップ内のサブ50 Nmのナノ流体ジャンクションを作成します
要約
We propose a simple self-assembly technique of silica colloidal nanoparticles to create a nanofluidic junction between two microchannels in polydimethylsiloxane (PDMS). Using this technique, a nanoporous bead membrane with a pore size down to ~45 nm was built inside a microchannel and applied to electrokinetic preconcentration of DNA samples.
要約
ポリジメチルシロキサン(PDMS)が原因で成形及び接合の容易さだけでなく、その透明性にマイクロ流体デバイスを作るために現行の建築材料です。 PDMS材料の柔らかさに、しかし、ナノチャネルの構築にPDMSを使用することは困難です。チャネルは、プラズマ接合時に容易に崩壊する傾向があります。本稿では、2マイクロチャネルの間nm孔サブ50とナノ流体ジャンクションを作成するために、シリカコロイド状ナノ粒子の蒸発主導の自己組織化法を提案します。細孔径、ならびにナノ流体接合の表面電荷は、単に、自己組織化プロセスの前にバイアルに組み立てられたマイクロ流体デバイスの外部コロイダルシリカビーズの大きさ及び表面機能化を変更することにより調整可能です。ビーズ300nmの大きさ、500ナノメートル、900ナノメートルを有するナノ粒子の自己集合を使用して、それぞれ、〜45nmで、〜75 nmおよび〜135ナノメートルの細孔サイズを有する多孔質膜を作製することが可能でした。電気の下でアル電位は、陽イオン選択性膜として、このナノ多孔膜開始イオン濃度分極(ICP)作用は、15分以内〜1700倍のDNAを濃縮します。この非リソグラフィナノファブリケーションプロセスは、PDMSマイクロ流体チップ内部のイオンや分子のナノスケールの輸送過程の研究のための調整可能なナノ流体接合を構築するための新しい機会を開きます。
概要
10 2 nmの-ナノ流体工学は、10 1の長さスケールでのイオンや分子の生物学的プロセスまたは輸送現象を研究するためにμTAS(マイクロトータル分析システム)の新興研究領域です。必要であれば、このようなナノチャンネルのようなナノ流体ツールの出現により、分子やイオンの輸送過程だけ分離および検出のために、この長さスケールで使用可能な機能を利用することにより、前例のない精度で監視し、操作することができます。1,2つのこれらの特徴的なナノスケールの特徴は、電荷不均衡を引き起こし、ナノチャネルとマイクロチャネルとの間のイオンの濃度分極(ICP)を開始することができるナノチャンネル内のバルク充電(またはDukhin番号)に対する表面の比率が高いです。3
ナノ流体現象の研究のための一般的なデバイスプラットフォームは、接合部としてナノチャネルのアレイによって接続された2-マイクロチャネルシステムで構成されています。4-6 そのようなナノ流体デバイスを構築するために選択される材料をので、接合プロセスの間に崩壊するチャネルを防止する高い剛性のシリコンである。7しかし、シリコンデバイスの製造は、高価なマスク及びクリーンルーム施設での処理のかなりの量を必要とします。8-これにより、成形およびプラズマボンディング、ポリジメチルシロキサン(PDMS)を介して、デバイス製造の利便性への10は広くマイクロ流体のための建築材料として受け入れられており、それは同様にナノ流体工学のための理想的な材料であろう。しかし、低ヤング率は、360から870キロパスカルの周囲に、プラズマ接合時PDMSチャネルは容易に折りたたみ可能なります。ナノチャネルの深さが100nm以下である必要がある場合、標準的なフォトリソグラフィを介してPDMSデバイスの製造は、チャネル幅を必要とする、非常に挑戦的になることを意味し、1:ナノチャネル(深さ、幅)の最小アスペクト比が10未満でなければなりませんphotolithの電流制限値未満1μm程度でography。この制限を克服するために、78 nmの11の平均深さを有する亀裂を開始するために、プラズマ処理後のしわを形成するために延伸非リソグラフィ法を用いてPDMSにナノチャネルを作成するための試みがなされてきた。12機械的圧力とPDMSチャネルを崩壊許さ60 nmと低いナノチャネルの高さ。13
これらの高度に本発明の非リソグラフィー法は、深さ100 nm以下のナノチャンネルを構築する許可されていても、ナノチャンネル製作の寸法制御は、依然としてナノ流体デバイスのための建築材料としてPDMSの広く受け入れへの障害をもたらします。ナノチャネルの別の重大な問題は、シリコンまたはPDMSで、ケース内表面機能であるか否かのイオンまたは分子の操作のためのチャネル壁上の表面電荷を変化させる必要があります。結合を介してデバイスアセンブリの後、ナノチャンネルはに非常に困難であり、拡散制限輸送による表面機能化のために達します。高次元の忠実度と容易な表面官能持つナノスケールのチャネルを作成するには、マイクロ流体デバイス中で蒸発14-16によって誘導されたコロイド粒子の自己組織化法は有望なアプローチの1つであることができます。細孔サイズおよび表面特性の制御に加えて、調整する可能性は、温度、pHは17、18,19及びイオン強度を制御することにより、高分子電解質で被覆されたコロイド粒子を使用してその場で孔の大きさもある。そのため、これらの18利点、コロイド粒子の自己組織化法はすでにエレクトロ、20バイオセンサー、21タンパク質濃度22とマイクロ流体中のタンパク質やDNAの分離のためのアプリケーションを発見した。本研究では14,23、我々はANを構築するために、この自己組織化法を導入しました中電学的予備濃縮装置2マイクロチャネル間のナノ流体接合を必要とするPDMS。24動電濃度の背後にある基本的なメカニズムは、イオン濃度分極(ICP)に基づくものである。製造及び組立工程の25詳細な説明は以下のプロトコルに含まれています。
プロトコル
シリカコロイドビーズ懸濁液の調製
- 300 nmおよび500 nmのシリカビーズ懸濁液の調製
- 30秒間ボルテックスシリカビーズストック懸濁液(水中のw / vの10%)を。均一な懸濁液を得ました。 1.5ミリリットルチューブに600μlのストック懸濁液の合計をピペットで、1分間2600×gでそれを遠心します。
- 1 mMリン酸ナトリウム緩衝液(PB、pHは7.0)の400μlの上清を代入します。
- ボルテックスを通してpH7.0で1 mMのリン酸ナトリウム溶液中で15%の最終濃度にシリカビーズを一時停止します。
- ポリ表面官能500nmシリカカルボキシルビーズ(アリルアミン塩酸塩、PAH)、及びポリ(スチレンスルホン酸ナトリウム、PSS)高分子電解質
- 1%の10mlの1MのNaCl(pH7.0)で、カルボキシル基を有する500nmのシリカビーズを0.1gを懸濁ビーズ懸濁液(w / v)の。
- 1 M NACで0.4%PAH(MW 65K)を準備1MのNaClの15ミリリットルでストック溶液(20%重量/体積水中)の300μLを溶解することによりリットル。 20ミリリットルの1M NaCl溶液中に0.18グラムのPSSを溶解することにより、1 M NaCl溶液中に0.9%PSS(MW 70K)を準備します。 1分間の両方のソリューション渦。完全に高分子電解質を溶解します。
- カルボキシル官能基を有するシリカビーズ上の正に荷電した高分子電解質層を堆積させるために15mlチューブ中の1%のシリカカルボキシルビーズを9.8 mlのPAH溶液200μlを加えます。 1分間ビーズ懸濁液をVORTEX。そして60分間チューブ回転でそれをインキュベートします。 RTで。
- 1分間1801×gでビーズ懸濁液を遠心します。そして10ミリリットルのDI水と結合していないPAH 5回洗い落とします。各遠心分離し、上清を除去した後、ビーズを密にチューブの底部に充填しました。ビーズを再懸濁し、次の遠心分離工程の前に洗浄除去することができるように、脱イオン水8mlを添加する前に、脱イオン水2mlで激しいピペッティングによりビーズ塊を破壊します。
- 続きますPSSコーティングのための1.2.3と1.2.4の手順では、ビーズ上に負に帯電した層を堆積させます。 PSSの堆積前1.2.4の5 回目の洗浄工程からのDI水の上澄みを除去した後、1MのNaClの9.8ミリリットルでビーズを再懸濁します。
- 15ミリリットルチューブの底にビーズ塊を破砕した後、1MのNaClの8ミリリットルを追加するために1MのNaClの2ミリリットルを使用して、同じ活発なピペッティングステップを使用してください。単一PAH層を堆積したシリカビーズの9.8ミリリットルにPSS溶液200μlを追加します。 1分間ボルテックスした後。 60分間のインキュベーション。チューブローテーター上、DI水で5回の洗浄工程を繰り返します。
- 正しく行われた高分子電解質の堆積手順を確認するために、製造業者のプロトコルに従って、動的光散乱装置を用いて、それぞれの高分子電解質コーティングの前と後のビーズのゼータ電位を測定した(表1参照)。
- 単一PSS層以下のDI水で5回の洗浄工程を繰り返し、0.05%のTween 20(15%w / v)の前に、その流動性を向上させるために、マイクロ流体デバイスで使用すると堆積し、1 mMリン酸ナトリウム緩衝液650μLに再懸濁ビーズ。
- PSSの単層を堆積させるために、アミン官能基を有する500nmのシリカビーズのために1.2.5から1.2.6に上記の手順に従ってください。
PDMSマイクロ流体チップの2製作
- シリコンマスターの微細加工
- 次のように微細加工技術を用いて、PDMS成形用シリコンマスターを作ります。
- スピンコートシリコンウェーハ上に4,000rpmで1ミクロンの薄いフォトレジスト。パターンは、投影リソグラフィ(露光時間170ミリ秒)及び700nmの深さ2μmの幅の広い平面ナノチャネルをエッチングを用いて層を反応性イオンエッチングで(シリカビーズnanotrapsとして作用します)。
- CHF 3(45 SCCM:3.5ナノメートル/秒のエッチング速度を達成するために、次のエッチングパラメータを使用)、CF 4(15 SCCM)は、Ar(100 SCCM)、圧力100ミリトール、RFパワー200Wで
- スピン2,000 rpmでコート第二の厚さ1μmのフォトレジスト層と、以前にパターン化nanotrapsにアライメントを行います。マイクロチャネルコンタクトリソグラフィビアおよびシリコンの深い反応性イオンエッチング(DRIE)によるパターン。 DRIEは、表2の26のパラメータを使用します。
- 次のように微細加工技術を用いて、PDMS成形用シリコンマスターを作ります。
- PDMSモールドの作製
- 真空瓶O / Nでトリクロロシラン(50μl)を有するシリコンマスターをSilanize。
注意:Tricholorosilaneは、有毒で腐食性の材料です。常に適切な個人用保護機器との化学フードでそれを使用しています。 - シラン化シリコンマスター上で1の割合とキャストPDMSと対流式オーブン中で2時間、70℃で、それを治す:10での硬化剤にベースを混ぜます。
- それは、PL後にプラズマクリーナーを使用して空白のウェハ上にナイフとプラズマ結合を有するシリコンマスターからPDMSスラブを削除します1分間のプラズマクリーナーでASMA処理。ステップを鋳造次PDMSのための仕切り線をマークするために縁に沿ってテープを取り付けます。
- トリクロロシランを有する真空瓶(50μl)をO / NでPDMSモールドをSilanize。
- PDMSをキャスト(ベース:1の比率:10で硬化剤)シラン化PDMSモールド上と対流式オーブン中で2時間、70℃で、それを治します。
- 真空瓶O / Nでトリクロロシラン(50μl)を有するシリコンマスターをSilanize。
- PDMSデバイスの作製
- テープでマークされた仕切り線に沿ってPDMSモールドから硬化PDMSスラブをはがし。
- テープできれいに1.5ミリメートル生検パンチとパンチ溜め穴は、イソプロピルアルコール(IPA)および窒素で乾燥ですすいでください。
- 1分間のプラズマクリーナーにおけるプラズマ処理後の25ミリメートル×75mmの顕微鏡ガラススライド上にプラズマ結合PDMSデバイス。
- Ultrasonicate 60分間ビーズ懸濁液。充填する超音波浴中で前に。 10μlのビーズ懸濁液をピペット(300nmの非官能基化シリカがあること広告、またはPAH-PSS層を有する500 nmのシリカカルボキシルビーズ、または入口4,6にPSS層に500 nmのシリカアミンビーズ)がそれぞれ( 図1 A、B)直ちにPDMSチップのプラズマ接合した後に表示しますガラス基板。ビーズ充填を向上させるためにピペットチップを用いてPDMSチップを軽くタップします。
- ビーズ配信チャネルを充填した後、テープ1と9を除く全ての入口を覆います。 。使用前+4℃で3時間および貯蔵するための装置を風乾し2コロイド自己組織化プロセスを順を追って模式図を与える図 。
DNAの電濃度3.実験
- DNAサンプル(1 mMのPB中の10 nMの10μlの)と緩衝液(1mMのPBを10μl)と貯水池3、7とリザーバ5を記入し、貯水池2に反転ピペットチップで穏やかな負圧を適用します、泡なしのソリューションとのチャネルを埋めるために8および10(参照図1B)。
- 圧力のバランスを取り、5分間待つように10をリザーバに10 nMのDNAの2と8と10μlの貯水池に1 mMのPBの10μLを加えます。平衡に到達します。
- 貯水池3、5、7、10内に白金線を挿入します。
- ソースメータとPt線に接続された電圧分圧器を使用してナノ流体接合部の両端の電圧を適用します。まず貯水池貯水池3、7上5、10とGNDの30 Vを適用します。
- 〜30秒後に、リザーバ10に25 Vの電圧を下げます。
- DNAからの蛍光信号を記録する際、試料の光退色を最小限にするために5秒ごとに周期的な開口部を有するメカニカルシャッターを使用してください。
結果
2マイクロチャネル間の自己組織化ナノ流体接合部が含まれているPDMSにおける動電コンセントレータチップ)は、図1Aに示されています。装置の中央のチャネルは、DNAサンプル溶液を充填し、50μm幅のビード配信チャネル( 図1B)を介してそれぞれの側に2つの緩衝液流路に隣接しています。シリカのコロイド状懸濁液を試料と緩衝液路との間にナノ流体接合部を作成するために、すぐにプラズマ接合後ビーズ配信チャネルに流入されます。 700nmの深さ2μmの広いナノチャンネルからなるnanotrap配列は、トラップコロイド粒子に使用されます。非接触表面形状で得られ、そのスキャン画像)が、図1Cに示されています。蒸発後コロイドビーズ膜)は、図1Dに示されています。 図1EにおけるSEM)は、シリカビーズトラップを示していますビーズ配信チャネルからサンプルチャネルを分離する平面nanotrapアレイでペッド。 300 nmのシリカビーズ充填は、濃度の挙動( 図1F)の変動を引き起こす可能性がいくつかのマイナーな欠陥が非常に規則正しい六角形のパッキングを示しています。その寸法のPDMSコンセントレータチップの設計を見つけることができ、ここで補足ファイルに。

図1.統合されたサブ50nmのナノ多孔性接合を有するPDMS中のマイクロ流体コンセントレータ。(A) PDMSコンセントレータデバイスの写真。 (B)試料と緩衝液流路との間にビード送達チャネルを有するマイクロナノ流体デバイスの概略図。電圧がサンプル流路と緩衝液のCH間ビード膜を横切って印加されますannels。 (C)2ミクロンの幅と深さ700nmのPDMSでnanotrapアレイの表面形状。 (D)を蒸 発させた後、ビーズ配信チャネル内部のコロイド粒子アセンブリとデバイスの顕微鏡写真。 (E)サンプルとチャネルバッファ間のnanotrapアレイを有する自己組織300 nmのシリカコロイド粒子の電子顕微鏡写真をスキャンします。 300nmのビーズは表面張力によりnanotrapsの入り口にトラップされます。 (F)六角形は、蒸発後に、ビーズ配信マイクロチャネル内部の300 nmのシリカビーズを充填しました。 (化学の王立協会の許可を得て参考文献25から適応) この図の拡大版をご覧になるにはこちらをクリックしてください。
PDMS concentratoのための微細加工手順の概略Rデバイスは、図2に示されている。PDMSデバイスを作製するために、二重PDMSキャスティングが必要とされます。 PDMS濃縮でビーズ充填工程は、 図3に示されている。微細加工及び充填プロセスの詳細は、プロトコルに見出すことができます。なく、高分子電解質コーティングを有するシリカビーズのゼータ電位を表1に示します。
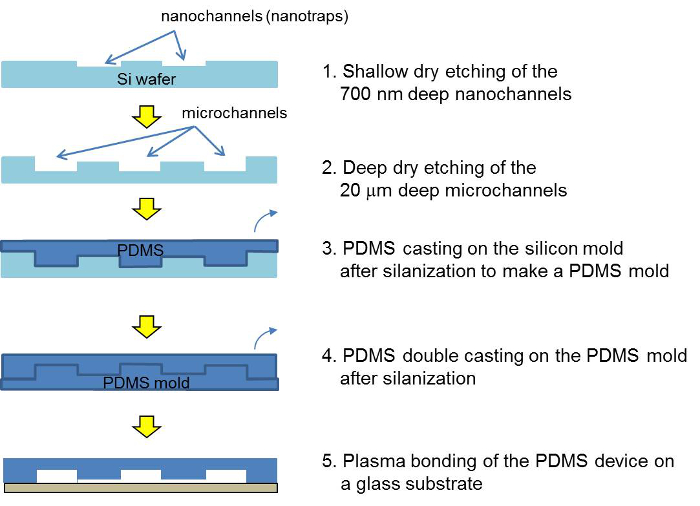
シリコンマスター、PDMSのマスターとPDMSコンセントレータ装置の製造工程の図2の回路図を。2、フォトリソグラフィとエッチング工程の後、シリコンマスターはPDMSで鋳造されます。二重成形した後、PDMSデバイスは、プラズマ結合を介して組み立てられ、ビーズ懸濁液を充填した。 この図の拡大版をご覧になるにはこちらをクリックしてください。

コロイダルシリカビーズの自己組織化のために、図3のステップバイステップの概略図。ビーズ懸濁液10μlを直ちにプラズマ処理後のビーズの配信チャネルににピペッティングしました。ビーズ配信チャネルを充填した後、2つの入口1,9すべてがテープで覆われ、機器空気は、使用前に3時間乾燥しました。 (化学の王立協会の許可を得て参考文献25から転載) この図の拡大版をご覧になるにはこちらをクリックしてください。
| コロイド粒子(500ナノメートル) | ゼータ電位(MV) |
| シリカ | -2.04 |
| シリカアミン | 19.6 |
| シリカカルボキシル | -19.73 |
| シリカCarboxyl、PAHコーティングされました | 31.8 |
| シリカカルボキシル、PAH、PSSコーティングされました | -28.5 |
| PSS被覆シリカアミン、 | -31.2 |
25℃でのシリカビーズの 表1 ゼータ電位。 0.1%(w / v)のコロイド溶液は、測定に使用した(n = 3)。
図4に示すように、乾燥後のビーズ充填チャネルから取られたSEM画像は、60ナノメートル、91ナノメートルと170ナノメートルの範囲の孔径を示す。細孔サイズは、ビーズの大きさの約20%、300nmで、500に対応しますそれぞれnmおよび900 nmで、(ビーズ径の15%が、理論上の細孔サイズです)。

図4.自己組織300nmの (A)、500nmで のSEM像 G>(B) 及び900 nmの (C) シリカコロイドビーズ梱包 PDMSデバイスは、可逆的に負圧を使用してチャネルに流入し、ガラススライド、ビーズに結合しました。空気乾燥装置O / Nは、PDMSデバイスは、慎重にガラスから剥離して画像化した後。この孔の大きさは、それぞれ300 nmで、500 nmおよび900 nmのビーズのために60±2、91±5と170±7nmであると推定された(n = 9)しました。これらの細孔サイズは、ビーズ径の〜15%、理論上のサイズに近かったです。 (化学の王立協会の許可を得て参考文献25から適応) この図の拡大版をご覧になるにはこちらをクリックしてください。
300nmのビーズ膜を横切って30 Vの電圧を印加すると、イオン欠乏ゾーンは、で満たされ、マイクロチャネル内部のコロイド膜付近に観察されました蛍光標識DNA( 図5 A、B)。左側の25 Vに電圧を下げたときに、DNA分子は、プラグの形で蓄積され、その濃度は、試料流路を横切って30 V- 25 Vの電圧差によって駆動される電気浸透流( 図5 Cに起因して増加してしまいました、D)。

図5.タイムラプス顕微鏡写真は、DNA(10 nMでの初期濃度)を充填したチャンネルにナノ流体コロイド状の接合部付近のイオン空乏領域の形成を示す。イオン空乏領域をt = 10秒、濃縮DNAプラグで開始しました。 = 30 V V2で生成され、バッファチャンネルが接地している間、V1は、サンプル流路を横切って25 Vを=しました。点線は、チャンネルの壁を強調するために使用されています。 〜1700ひだの濃縮係数は、15分以内に達成されました。 U300 nmのコロイド状の膜を歌います。 (化学の王立協会の許可を得て参考文献25から転載) この図の拡大版をご覧になるにはこちらをクリックしてください。
Cyの5のために〜で1700回を最高濃度係数を示したnmの300 nmおよび500のビーズ径を有するシリカ膜は、15分以内にDNA(CAA CCG ATG CCAのCAT CATタグCTA C)をタグ付けされました。 ( 図6のA、B)。高分子電解質コーティングされたシリカビーズの膜は、15分後のDNA濃度の200〜1,000倍の増加につながりました。 ( 図6 C、D)。
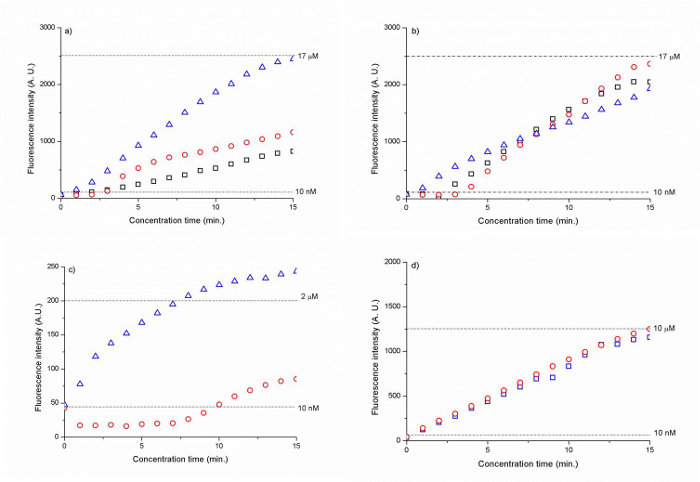
(A)300nmのシリカビーズ(B)500nmのシリカビーズについての、時間の関数としてのDNAの図6蛍光強度D(C)は500nm PSS被覆シリカアミンビーズと、(D)は500nm PAH / PSS被覆シリカカルボキシルビーズ。点線は17μM、10 nMの(A、B、C、D)についての蛍光シグナルの強度レベルを表します(A、B)、2μM(C)および10μM(D)DNA。結果は、バックグラウンド蛍光に対して正規化されています。 (化学の王立協会の許可を得て参考文献25から転載) この図の拡大版をご覧になるにはこちらをクリックしてください。
| 工程所要時間 | エッチモード | 不動態化モード |
| 工程所要時間 | 6秒 | 4.5秒 |
| オーバーラン | 0.5秒 | 0秒 |
| プラテン発電電力 | 80 W | 60 W |
| コイル発電機のパワー | 600 W | 600 W |
| ガス | SF 6 70 SCCM | C 4 F 8 35 SCCM |
| エッチ速度 | 1.47ミクロン/分 | |
表2 DRIEパラメータ。
ディスカッション
ナノ流体工学を研究するための一般的なデバイスの設計方式に続いて、我々は、コロイド状のナノ粒子の蒸発主導の自己集合を使用しての代わりに、リソグラフィナノチャネルのアレイをパターニングすることにより、2つのマイクロ流体チャネルとの間にナノ流体接合部を作製しました。ビーズ配信チャネル、700ナノメートルの深さおよび100μmの全幅にビーズ配信チャネルの両側に2μmの幅nanotrapsの配列にコロイド粒子を流れるときに流入ビーズ懸濁液を防止nanotrapsにおける表面張力にチャンネルをバッファリングし、サンプル。一度、迅速ビーズ配信チャネルに充填コロイド粒子をトラップし、試料とナノ多孔質接合を形成されたチャネルをバッファリング。
毛細管力が出口rの入り口にシリカビーズ懸濁液を駆動するように、プラズマボンディング直後にビーズ懸濁液をロードすることが重要です一時的に親水性ビーズ配信チャネルでeservoirs。入口リザーバ内の流れを遮断する気泡を防止するためには、高度にピペットチップを用いて容器の底部に到達した後、リザーバ内にビーズ懸濁液を放出することが推奨されます。高分子電解質で表面官能化ビーズの場合には、その流動性が大幅に表面官能なしシリカビーズと比較して減少し、より容易に凝集して、充填プロセス中にチャネル表面に付着する傾向がありました。高分子電解質でコーティングされたビーズとチャネルの目詰まりを防止するために、我々は、ビーズの懸濁液に、ツイーン20、0.05%の界面活性剤を添加しました。ケースでは目詰まりの問題は、一般的に、それを解決するのに役立ったピペットチップで、PDMSチップ上の穏やかなタッピングを充填中に残っていました。
また、INFに困難であるため、ビーズ懸濁液を完全に蒸発させた後に乾燥されなかったことが重要です再びリン酸ナトリウム緩衝液でビーズ膜iltrate。したがって、部分的な蒸発の3時間後に、PDMSデバイスのすべての入口および出口はテーピングし、ビーズ充填が湿ったままので、使用前に保存のために4℃で維持しました。前濃縮実験の間、自己組織化ビーズは大部分の構造的安定性を維持します。しかし、少数の例では、我々はマイクロチャンネル中のビーズの不良パッキングを示したビーズの転位を観察しました。自己集合は、ビーズ充填物の理論的な孔径は〜45nmで、コロイド粒子の約〜15%であった。図4に見ることができた後に300nmでのダウン900nmの直径の範囲の自己組織化シリカビーズ直径。我々は、SEM分析を使用して、細孔サイズを確認し、充填後、約ビーズ径の20%の細孔径を測定できました。
Na等の自己集合300 nmおよび500 nmのコロイド粒子膜を用いてイオン選択noporous接合は、我々は、30 Vのイオン空乏領域を開始し、10 nMのCy5の1 mMのリン酸ナトリウム緩衝液中でDNA(CAA CCG ATG CCA CATのCATのTAG CTA C)がタグ付けされた(図5)を濃縮することができました。連続的に電圧差V = 5 V 2 -V 1、我々は15分以内〜1700倍に初期DNA濃度を高めることができるで電気浸透流とイオン欠乏ゾーンに向かってDNA試料を流すことによって。 (図6A、B)。図6bに示されるように)、300nmのビーズよりも堅牢DNA濃度許可500nmのビーズ。電濃度は電気浸透力および高非線形電気泳動力の間の力のバランスに基づいているので、得られた濃縮係数は、この力のバランスが電集中中に維持することができる程度によって決定される。27
ナノ流体接合を構築するためのコロイド粒子を展開するもう一つの重要な利点は、そのsurfacとの容易さでありますE官能化を行うことができます。代わりに、最初の結合を介してナノチャンネルを作成し、その上に表面機能を実行するので、私たちは、単に最初のデバイスの外にバイアル中のコロイド粒子を官能表面することができ、その後、自己組織化のためのチャネルにそれらを流します。このアプローチに基づいて、我々は、PSSの単層でコーティングされた500nmシリカアミン粒子と低電圧(8におけるPAHとPSS(図6 CおよびD)の層で被覆された500nmシリカカルボキシル粒子を使用してICPを開始することができます表面機能なしのコロイド粒子(30 V)よりも、それぞれVおよび10 V、)。この結果は、自己集合の前に、コロイド粒子の表面の官能化は、コロイド粒子の表面電荷を増加させるのに効果的であり、高いICPをもたらしたことを示しています。しかし、得られた濃縮器係数の点で、表面官能化ビーズのナノ流体接合部は非官能SIよりも有効でしたLICAビーズ。カルボキシル/ PAH / PSSビーズ膜は15分後の千倍の増加を示したアミン/ PSS被覆ビーズは、〜200倍を可能にしました。 (図6d)。この結果は、より安定した濃度の遠いビード膜から、したがって、サンプル濃度のプラグを押すイオン空乏領域の増大した長さにつながった表面官能化ナノ細孔の高い表面電荷によって説明することができます。我々は現在、1ミリメートル(サンプルチャネルへのビーズ膜並列のセクション)からナノ多孔質ビーズ、膜の全体の幅を短くし、この不安定性の問題を軽減することができると信じています。我々の以前の研究によると、ナノ多孔性接合部の幅は、それを通してイオン電流通過量を決定する。28の幅が増加すると、イオン電流が増加し、より多くの陽イオンは、膜を通って移動することができるので、空乏長さが増加し、濃度プラグさらに離れナノポーラス接合部から押し出されます。 Therefore、蓄積が少ない限られた方法で発生し、サンプルプラグが少なく安定します。経験的には、ナノ多孔性接合部の幅は〜100-400ミクロンであるべきです。改善するためのもう一つの特徴は、サンプル流路とビード配信間の15ミクロンのPDMS壁の不十分な厚さでした。この薄いPDMSセクションは、バッファとサンプルチャネル間のイオン電流を有効に不十分な接着につながりました。そのため、サンプル流路(幅1mm)にビード全体膜平行な断面は100ミクロンのビーズのがnanotrap配列の合計幅に応じて、ナノ多孔質接合膜として意図されていたにもかかわらず、ナノ多孔性接合として作用していました。 PDMSの壁の厚さは、少なくとも25マイクロメートル以上である必要があります。
開示事項
The authors have nothing to disclose.
謝辞
この作品は、NIH R21 EB008177-01A2とニューヨーク大学アブダビ(NYUAD)研究強化基金2013我々は、微細加工時の彼らのサポートのためのMIT MTLの技術スタッフに感謝を表明し、ジェームズ・ウェストンとそののためのNYUADのニコラスGiakoumidisによってサポートされていましたSEM写真を撮影し、それぞれ、分圧器を構築する上でのサポート。 PDMSでデバイス製造をNYUADの微細コア施設で行いました。最後に、我々はビデオ撮影・編集のためのデジタル奨学金NYUADセンターからレベッカPittamに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Poly(Styrenesulfonic Acid) Sodium Salt | Polysciences | 08772 | |
| Poly(allylamine) Solution | Sigma Aldrich | 479144-5G | |
| Silica Microsphere - 300 nm | Polysciences | 24321 | |
| Silica Microsphere - 500 nm | Polysciences | 24323 | |
| Silica Microsphere Carboxyl Functional - 500 nm | Polysciences | 24753 | |
| Silica Microsphere Amine Functional - 500 nm | Polysciences | 24756 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | ||
| Trichlorosilane | Sigma Aldrich | 175552 | |
| Ultrasonic Cleaner | Branson | 3510 | |
| Tube Rotator | VWR | 10136-084 | |
| Vortex Mixer | WiseMix | VM-10 | |
| Microcentrifuge | VWR | Micro 1207 | |
| Plasma Cleaner | Harrick Plasma | PDC-001-HP | |
| PDMS Mixer | Thinky | ARE-250 | |
| Oven | Thermo Scientific | PR305220M | |
| Epi-fluorescence Microscope | Nikon | Eclipse Ti | |
| CCD Camera | Andor | Clara | |
| Platinum Electrodes | Alfa Aesar | 43014 | |
| Source Meter | Keithley | 2400 | |
| Digital Multimeter | Extech | 410 | |
| Microscopy Glass Slides | Thermo Scientific | 2951-001 | |
| Tween 20 | Merck Millipore | 822184 | |
| Sodium chloride | Fisher Scientific | 7646-14-5 | |
| Sodium phosphate monobasic | Sigma Aldrich | 71505 | |
| Sodium phosphate dibasic | Sigma Aldrich | S3264 | |
| DNA | IDT | CAA CCG ATG CCA CAT CAT TAG CTA C | |
| B-Phycoerythrin | Life Technologies | P-800 | |
| Dynamic light scattering system for Zeta Potential Measurement | Malvern | Zetasizer Nano S | |
| Photoresist | Shipley | SPR700-1.0 | |
| Projection lithography | Nikon | NSR2005i9 | |
| Reactive Ion Etcher | Applied Materials | AME P5000 | |
| ICP deep reactive ion etcher | STS | STS-6" | |
| Contact lithography | Electronic Visions | EV620 | |
| Photoresist Coater Developer | SSI | SSI 150 | |
| Non-contact surface profiler | Wyko | NT 9800 |
参考文献
- Mawatari, K., Kazoe, Y., Shimizu, H., Pihosh, Y., Kitamori, T. Extended-Nanofluidics: Fundamental Technologies, Unique Liquid Properties, and Application in Chemical and Bio Analysis Methods and Devices. Anal Chem. 86, 4068-4077 (2014).
- Tsukahara, T., Mawatari, K., Kitamori, T. Integrated extended-nano chemical systems on a chip. Chem Soc Rev. 39, 1000-1013 (2010).
- Mani, A., Zangle, T. A., Santiago, J. G. On the Propagation of Concentration Polarization from Microchannel-Nanochannel Interfaces Part I: Analytical Model and Characteristic Analysis. Langmuir. 25, 3898-3908 (2009).
- Aizel, K., et al. Enrichment of nanoparticles and bacteria using electroless and manual actuation modes of a bypass nanofluidic device. Lab Chip. 13, 4476-4485 (2013).
- Wang, Y. C., Stevens, A. L., Han, J. Million-fold preconcentration of proteins and peptides by nanofluidic filter. Anal Chem. 77, 4293-4299 (2005).
- Karnik, R., et al. Electrostatic control of ions and molecules in nanofluidic transistors. Nano letters. 5, 943-948 (2005).
- Mao, P., Han, J. Y. Fabrication and characterization of 20 nm planar nanofluidic channels by glass-glass and glass-silicon bonding. Lab Chip. 5, 837-844 (2005).
- Mao, P., Han, J. Massively-parallel ultra-high-aspect-ratio nanochannels as mesoporous membranes. Lab Chip. 9, 586-591 (2009).
- Balducci, A., Mao, P., Han, J. Y., Doyle, P. S. Double-stranded DNA diffusion in slitlike nanochannels. Macromolecules. 39, 6273-6281 (2006).
- Yamada, M., Mao, P., Fu, J. P., Han, J. Y. Rapid Quantification of Disease-Marker Proteins Using Continuous-Flow Immunoseparation in a Nanosieve Fluidic Device. Anal Chem. 81, 7067-7074 (2009).
- Huh, D., et al. Tuneable elastomeric nanochannels for nanofluidic manipulation. Nat Mater. 6, 424-428 (2007).
- Chung, S., Lee, J. H., Moon, M. W., Han, J., Kamm, R. D. Non-lithographic wrinkle nanochannels for protein preconcentration. Adv Mater. 20, 3011-3016 (2008).
- Park, S. M., Huh, Y. S., Craighead, H. G., Erickson, D. A method for nanofluidic device prototyping using elastomeric collapse. Proc Natl Acad Sci. 106, 15549-15554 (2009).
- Zeng, Y., Harrison, D. J. Self-assembled colloidal arrays as three-dimensional nanofluidic sieves for separation of biomolecules on microchips. Anal Chem. 79, 2289-2295 (2007).
- Malekpourkoupaei, A., Kostiuk, L. W., Harrison, D. J. Fabrication of Binary Opal Lattices in Microfluidic Devices. Chem Mat. 25, 3808-3815 (2013).
- Merlin, A., Salmon, J. -. B., Leng, J. Microfluidic-assisted growth of colloidal crystals. Soft Matter. 8, 3526-3537 (2012).
- Schepelina, O., Zharov, I. PNIPAAM-modified nanoporous colloidal films with positive and negative temperature gating. Langmuir. 23, 12704-12709 (2007).
- Schepelina, O., Zharov, I. Poly(2-(dimethylamino)ethyl methacrylate)-Modified Nanoporous Colloidal Films with pH and Ion Response. Langmuir. 24, 14188-14194 (2008).
- Smith, J. J., Zharov, I. Ion transport in sulfonated nanoporous colloidal films. Langmuir. 24, 2650-2654 (2008).
- Gaspar, A., Hernandez, L., Stevens, S., Gomez, F. A. Electrochromatography in microchips packed with conventional reversed-phase silica particles. Electrophoresis. 29, 1638-1642 (2008).
- Lee, S. Y., et al. High-Fidelity Optofluidic On-Chip Sensors Using Well-Defined Gold Nanowell Crystals. Anal Chem. 83, 9174-9180 (2011).
- Hu, Y. L., et al. Interconnected ordered nanoporous networks of colloidal crystals integrated on a microfluidic chip for highly efficient protein concentration. Electrophoresis. 32, 3424-3430 (2011).
- Zhang, D. -. W., et al. Microfabrication-free fused silica nanofluidic interface for on chip electrokinetic stacking of DNA. Microfluid Nanofluid. 14, 69-76 (2013).
- Syed, A., Mangano, L., Mao, P., Han, J., Song, Y. A. Creating sub-50 nm nanofluidic junctions in a PDMS microchip via self-assembly process of colloidal silica beads for electrokinetic concentration of biomolecules. Lab Chip. 14, 4455-4460 (2014).
- Kim, S. J., Song, Y. A., Han, J. Nanofluidic concentration devices for biomolecules utilizing ion concentration polarization: theory, fabrication, and applications. Chem Soc Rev. 39, 912-922 (2010).
- Fu, J. P., Mao, P., Han, J. Y. Continuous-flow bioseparation using microfabricated anisotropic nanofluidic sieving structures. Nat Protoc. 4, 1681-1698 (2009).
- Plecis, A., Nanteuil, C., Haghiri-Gosnet, A. M., Chen, Y. Electropreconcentration with Charge-Selective Nanochannels. Anal Chem. 80, 9542-9550 (2008).
- Ko, S. H., et al. Nanofluidic preconcentration device in a straight microchannel using ion concentration polarization. Lab Chip. 12, 4472-4482 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved