Method Article
Criação de Sub-50 nm nanofluidic Junções em PDMS Microfluidic Chip via processo de automontagem de coloidal Particles
Neste Artigo
Resumo
We propose a simple self-assembly technique of silica colloidal nanoparticles to create a nanofluidic junction between two microchannels in polydimethylsiloxane (PDMS). Using this technique, a nanoporous bead membrane with a pore size down to ~45 nm was built inside a microchannel and applied to electrokinetic preconcentration of DNA samples.
Resumo
Polidimetilsiloxano (PDMS) é o material de construção predominante para tornar os dispositivos de microfluidos, devido à sua facilidade de moldagem e de ligação, bem como a sua transparência. Devido à suavidade do material de PDMS, no entanto, que é difícil de utilizar para a construção de nanocanais PDMS. Os canais tendem a entrar em colapso facilmente durante a ligação do plasma. Neste artigo, apresentamos um método de auto-montagem orientada por evaporação de nanopartículas de sílica coloidal para criar junções nanofluidic com sub-50 nm poros entre dois microcanais. A carga da superfície da junção nanofluidic de poros, bem como o tamanho é sintonizável simplesmente mudando a sílica coloidal e o tamanho do grânulo funcionalização de superfície exterior do dispositivo de microfluidos montados num frasco antes de o processo de auto-montagem. Utilizando o auto-montagem de nanopartículas com um tamanho de esfera de 300 nm, 500 nm e 900 nm, que era possível fabricar uma membrana porosa com um tamanho de poro de ~ 45 nM, ~ 75 nm e ~ 135 nm, respectivamente. sob elétricaal potencial, esta membrana iniciado polarização por concentração de íons (ICP) atuando nanoporous como uma membrana cátion-seletiva para concentrar DNA por ~ 1.700 vezes dentro de 15 min. Este processo de nanofabricação não litográfica abre uma nova oportunidade de construir uma junção nanofluidic sintonizável para o estudo de processos de transporte em nanoescala de íons e moléculas dentro de um chip microfluídico PDMS.
Introdução
Nanofluidics é uma área emergente de pesquisa de u TAS (Micro Systems Analysis total) para estudar os processos biológicos ou fenómenos de transporte de íons e moléculas na escala de comprimento de 10 janeiro - 10 fevereiro nm. Com o advento das ferramentas nanofluidic como nanocanais, processos de transporte de moléculas e íons podem ser monitorizados com uma precisão sem precedentes e manipulado, se necessário, através da exploração de recursos que estão disponíveis apenas nesta escala de comprimento para a separação e detecção. 1,2 Um dos estas características em nanoescala característica é um elevado rácio de superfície de carga a granel (ou número Dukhin) em nanocanais que pode causar um desequilíbrio de carga e iniciar a polarização da concentração de iões (ICP) entre o nanochannel e 3 microcanal.
Uma plataforma dispositivo comum para o estudo de fenómenos nanofluidic consiste de um sistema de dois microcanais ligados por uma matriz de nanocanais como uma junção 4-6. O material de escolha para a construção de um dispositivo, tal nanofluidic é o silício devido à sua elevada rigidez, que evita que o canal de entrar em colapso durante o processo de colagem. 7 No entanto, o dispositivo de fabricação de silício requer máscaras caros e quantidade substancial de tratamento na instalação de salas limpas. 8- 10 Devido à facilidade de fabricação do dispositivo de moldagem por meio de colagem e de plasma, de polidimetilsiloxano (PDMS) tem sido amplamente aceite como um material de construção para microfluidos e seria um material ideal para nanofluidics bem. No entanto, módulo de sua baixa de Young em torno de 360-870 kPa, torna o canal PDMS facilmente desmontável durante a ligação de plasma. A razão mínima aspecto da nanochannel (largura de profundidade) tem de ser inferior a 10: 1, o que significa que o fabrico de dispositivos PDMS via fotolitografia padrão irá tornar-se extremamente difícil se a profundidade nanochannel tem de ser inferior a 100 nm, o que requer uma largura de canal menos do que o limite atual de fotolitoografia em cerca de 1 uM. Para superar essa limitação, tem havido tentativas de criar nanocanais em PDMS usando métodos não-litografia, como alongamento para iniciar rachaduras com profundidade média de 78 nm 11 ou para formar rugas após o tratamento de plasma. 12 desmoronamento de um canal de PDMS com pressão mecânica permitiu uma altura nanochannel tão baixo quanto 60 nm. 13
Mesmo que esses métodos não litográficas altamente inventivos permitido nanocanais construção abaixo de 100 nm em profundidade, a controlabilidade dimensional da fabricação nanochannel ainda representa um obstáculo para uma ampla aceitação de PDMS como material de construção para dispositivos nanofluidic. Outro problema crítico das nanocanais, quer em silício ou PDMS, a funcionalização da superfície é no caso de haver uma necessidade de alterar a carga de superfície na parede do canal para a manipulação de iões ou moléculas. Após a montagem do dispositivo por meio de ligação, os nanocanais são extremamente difíceis dechegar para a funcionalização da superfície devido ao transporte limita-difusão. Para criar um canal de nanoescala com alta fidelidade dimensional e funcionalização da superfície fácil, o método de auto-montagem de partículas coloidais induzidas por evaporação 14-16 em microcanais pode ser uma das abordagens promissoras. Além da capacidade de controlo de tamanho de poro e propriedades de superfície, existe ainda a possibilidade de ajustar o tamanho do poro in situ pelo uso de partículas coloidais revestidos com polielectrólitos, controlando a temperatura, pH 17, 18,19 e força iónica. 18 Devido a estes aplicações vantagens, o método de auto-montagem de partículas coloidais já encontrados para electrocromatograf, 20 biossensores, a concentração de proteína de 21 e 22 de separação de proteínas e de DNA em microfluidics. 14,23 neste estudo, foram implantados este método de auto-montagem para construir um dispositivo de pré-concentração electrokinetic emPDMS que requer uma junção entre duas nanofluidic microcanais. 24 o mecanismo fundamental para trás a concentração electrocinético é baseado em polarização de concentração de iões (ICP). 25 Uma descrição mais detalhada das etapas de fabricação e de montagem está incluído no seguinte protocolo.
Protocolo
1. Preparação da sílica coloidal Bead Suspensões
- Preparação de 300 nm e 500 nm de sílica suspensões grânulo
- Vortex a suspensão de pasta talão de sílica (10% w / v em água) durante 30 seg. para se obter uma suspensão homogénea. Pipetar um total de 600 ul da suspensão para um tubo de 1,5 mL e centrifuga-se que em 2600 xg durante 1 min.
- Substituir o sobrenadante com 400 ul de tampão de fosfato de sódio 1 mM (PB, pH 7,0).
- Suspender os grânulos de sílica para uma concentração final de 15% em solução de fosfato de sódio 1 mM, a pH 7,0 através de agitação em vórtice.
- Funcionalizar a superfície contas de 500 nm de sílica carboxilo com poli (cloridrato de alilamina, PAH), e com poli polielectr�itos (estireno sulfonato de sódio, PSS)
- Suspender 0,1 g de esferas de sílica de 500 nm com um grupo carboxilo, com 10 mL de NaCl 1 M (pH 7,0) para 1% (w / v) de suspensão de pérolas.
- Prepare 0,4% HAP (MW 65K) em 1 M NaCl por dissolução de 300 ul da solução-mãe (20% w / v em água) em 15 ml de 1 M de NaCl. Prepare 0,9% PSS (PM 70 K) em solução de 1 M de NaCl através da dissolução de 0,18 g PSS em 20 ml de solução 1 M de NaCl. Ambas as soluções Vortex durante 1 minuto. para dissolver os polielectrólitos completamente.
- Adicionar 200 uL de solução de HAP a 9,8 ml de 1% de partículas de sílica carboxilo em um tubo de 15 mL para depositar uma camada de polielectrólito de carga positiva em grânulos de sílica com grupo funcional carboxilo. Vortex a suspensão de esferas durante 1 minuto. e incubar-lo no tubo de um rotor durante 60 min. à TA.
- Centrifugar a suspensão do grânulo em 1801 xg durante 1 min. e lave os não ligados PAH cinco vezes com 10 ml de água DI. Depois de cada centrifugação e remoção do sobrenadante, as esferas foram densamente compactados na parte inferior do tubo. Interromper o grânulo aglomerado por pipetagem vigorosa com 2 ml de água desionizada antes da adição de 8 ml de água desionizada de modo a que as esferas podem ser re-suspenso e lavado antes do próximo passo de centrifugação.
- Segueos passos em 1.2.3 e 1.2.4 para revestimento PSS para depositar uma camada carregada negativamente sobre os grânulos. Re-suspender as pérolas em 9,8 ml de NaCl 1 M antes da deposição PSS após a remoção do sobrenadante de água Dl a partir do passo de lavagem de 5 th 1.2.4.
- Utilizar o mesmo passo de pipetagem vigorosa com 2 ml de NaCl a 1 M para quebrar a aglomeração do grânulo na parte inferior do tubo de 15 ml e, em seguida, adicionar 8 mL de 1 M de NaCl. Adicionar 200 uL de solução de PSS para 9,8 ml das pérolas depositado sobre sílica com uma camada única de HAP. Após vortex durante 1 min. e incubação durante 60 min. na rotator tubo, repita 5 etapas de lavagem com água DI.
- Medir o potencial zeta dos grânulos, antes e depois de cada revestimento polielectrólito utilizando um sistema de dispersão de luz dinâmica, de acordo com o protocolo do fabricante para verificar o procedimento de deposição de polielectrólito foi efectuado correctamente (ver Tabela 1).
- Repita cinco etapas de lavagem com água DI seguintes a camada PSS únicadeposição e re-suspender as pérolas em 650 ul de tampão de fosfato de sódio 1 mM com 0,05% de Tween 20 (15% w / v) antes da sua utilização no dispositivo de microfluidos para aumentar a sua fluidez.
- Siga o procedimento descrito acima 1.2.5 a 1.2.6 para 500 nm esferas de sílica com grupo funcional amina para depositar uma camada única de PSS.
2. Fabricação do PDMS Microfluidic Chip
- Microfabricação do mestre de silício
- Fabricar o mestre de silício para PDMS moldagem usando técnicas de microfabricação como segue.
- Spin revestimento de um fotorresiste fina 1 mm a 4.000 rpm em um wafer de silício. Padrão da camada usando projeção litografia (tempo de exposição de 170 ms.) E gravar 700 nanocanais planas profundas e 2 m de largura nm (atuando como nanoarmadilhas para as esferas de sílica) com gravação iónica reativa.
- Utilize os seguintes parâmetros de gravura para alcançar uma taxa de corrosão de 3,5 nm / s: CHF 3 (45 sccm), (15 sccm) 4 CF, Ar (100 sccm), pressão de 100 mTorr, de potência de RF de 200 W.
- Spin revestir a segunda camada de fotorresiste de espessura 1 mm a 2.000 rpm e realizar um alinhamento com as nanoarmadilhas previamente modelados. Pattern os microcanais via litografia contato e por ataque profunda reativa iônica (DRIE) de silício. Utilizar a DRIE parâmetros 26 na Tabela 2.
- Fabricar o mestre de silício para PDMS moldagem usando técnicas de microfabricação como segue.
- Fabricação de PDMS molde
- Silanizar o mestre de silício com trichlorosilane (50 ul) em um frasco de vácuo O / N.
CUIDADO: Tricholorosilane é um material tóxico e corrosivo. Sempre usá-lo em uma capa química com equipamento adequado de proteção pessoal. - Misture a base para o agente de cura a 10: 1 de razão e elenco PDMS no mestre de silício silanizada e curá-la a 70 ° C durante 2 horas num forno de convecção.
- Remova a placa de PDMS do mestre de silício com uma ligação faca e plasma-lo em um wafer em branco usando um aspirador de plasma depois de um pltratamento de asma num aspirador de plasma durante 1 min. Anexar fitas ao longo da borda para marcar uma linha de partição para os seguintes PDMS passo de fundição.
- Silanizar o molde PDMS em um frasco de vácuo com trichlorosilane (50 ul) O / N.
- Fundido PDMS (base: agente de cura na proporção de 10: 1) sobre o molde PDMS silanizada e curá-la a 70 ° C durante 2 horas num forno de convecção.
- Silanizar o mestre de silício com trichlorosilane (50 ul) em um frasco de vácuo O / N.
- Fabrico do dispositivo de PDMS
- Retire a laje PDMS curado a partir do molde PDMS ao longo da linha de partição marcada com a fita.
- furos reservatórios perfurados com socos biópsia 1,5 mm, limpo, com uma fita, lavar com álcool isopropílico (IPA) e secar com azoto.
- Plasma ligação do dispositivo de PDMS em um x 75 mm lâmina de microscópio de vidro de 25 mm após um tratamento com plasma em um aspirador de plasma para 1 min.
- Ultrasonicate da suspensão de esferas durante 60 minutos. num banho de ultra-sons antes do enchimento. Pipetar uma suspensão de esferas 10 ul (300 nm de sílica não-funcionalizado seranúncios, ou 500 nm esferas de sílica carboxilo com camadas HAP-PSS, ou 500 esferas de amina nm de sílica com uma camada PSS) para as entradas 4 e 6 cada (ver Figura 1 A, B), imediatamente após a colagem do plasma do chip PDMS a um substrato de vidro. Toque suavemente sobre o chip PDMS com uma ponta de pipeta para melhorar a embalagem do grânulo.
- Após o preenchimento dos canais de entrega de talão, cobrir todas as entradas, exceto para 1 e 9 com fita adesiva. Secar o dispositivo durante 3 h e armazenar a 4 ° C antes de usar. A Figura 2 apresenta um esquema passo-a-passo do processo de auto-montagem coloidal.
3. Experiência por eletrocinéticas Concentração de DNA
- Encher os reservatórios 3, 7 com uma solução tampão (10 ul de PB 1 mM) e reservatório 5 com uma amostra de ADN (10 uL de 10 nM em PB 1 mM) e aplica uma pressão negativa suave com uma ponta de pipeta invertido em reservatórios 2 , 8 e 10 para preencher os canais com as soluções sem bolhas (ver Figura 1B).
- Adicionar 10 ml de PB 1 mM de reservatórios 2 e 8 e 10 ul de 10 nM DNA ao reservatório 10 para equilibrar a pressão e esperar por 5 min. para atingir o equilíbrio.
- Insira os fios Pt em reservatórios 3, 5, 7, 10.
- Aplicar a tensão através da junção nanofluidic utilizando um divisor de tensão ligado a um medidor de fonte e fios de Pt. Primeiro aplique 30 V em reservatórios 5, 10 e GND em reservatórios 3, 7.
- Diminuir a tensão de 25 V no reservatório após 10 ~ 30 seg.
- Usar um obturador mecânico com uma abertura periódica em cada 5 s para minimizar fotobranqueamento da amostra ao gravar os sinais de fluorescência do ADN.
Resultados
Um chip concentrador electrocinético PDMS em que contém uma junção nanofluidic auto-montados entre dois microcanais é mostrado na Figura 1A). O canal no meio do dispositivo é preenchido com uma solução de amostra de ADN e flanqueado por dois canais de solução tampão de cada lado por meio de um 50 um canal de largura de entrega talão (Figura 1B). A suspensão de sílica coloidal é levado para o canal de entrega grânulo imediatamente após a colagem do plasma para criar uma junção nanofluidic entre a amostra e o canal de solução tampão. A matriz nanotrap consistindo de 700 nm de profundidade e 2 mm de largura nanocanais é utilizado para interceptar as partículas coloidais. A sua imagem digitalizada obtido com um perfilador de superfície não-contacto é mostrado na Figura 1C). As membranas do grânulo coloidais após evaporação são mostrados na Figura 1D). O SEM da Figura 1E) mostra a armadilha de grânulos de sílicaPED na matriz nanotrap plana separando o canal de amostra do canal de entrega do grânulo. A 300 nm embalagem de sílica talão mostra altamente ordenada embalagem hexagonal com alguns pequenos defeitos que podem causar uma variação no comportamento concentração (Figura 1F). O design do chip concentrador de PDMS com as suas dimensões podem ser encontrados aqui e em arquivos Suplementar.

Figura 1. concentrador Microfluidic em PDMS com uma sub-50 nm de junção nanoporoso integrada. (A) Foto do dispositivo PDMS concentrador. (B) Esquema do dispositivo de micro-nanofluidic com um canal de entrega talão entre a amostra e o tampão do canal solução. A tensão é aplicada através das membranas do grânulo entre o canal de amostra e a solução de tampão de CHannels. (C) o perfil da superfície da matriz nanotrap em PDMS com uma largura de 2 ^ m e uma profundidade de 700 nm. (D) A fotomicrografia do dispositivo com um conjunto de partículas coloidal no interior do canal de distribuição, após a evaporação do grânulo. (E) micrografia eletrônica de varredura dos 300 nm partículas de sílica coloidais auto-montadas com as matrizes nanotrap entre a amostra e tampão canal. Os grânulos 300 nm está preso na entrada dos nanoarmadilhas devido à tensão superficial. (F) hexagonal embalado 300 esferas de sílica nm dentro do microcanal entrega talão após a evaporação. (Adaptado de Ref. 25 com permissão da The Royal Society of Chemistry) Por favor clique aqui para ver uma versão maior desta figura.
Um esquema dos passos de microfabricação para o Concentrado de PDMSDispositivo r é mostrado na Figura 2. Para fazer com que um dispositivo de PDMS, um vazamento dupla PDMS é necessária. O processo de enchimento do grânulo no concentrador PDMS é mostrado na Figura 3. Os detalhes para a microfabricação e do processo de enchimento pode ser encontrado no protocolo. O potencial zeta das esferas de silicone sem e com revestimento de polielectrólito é mostrada na Tabela 1.
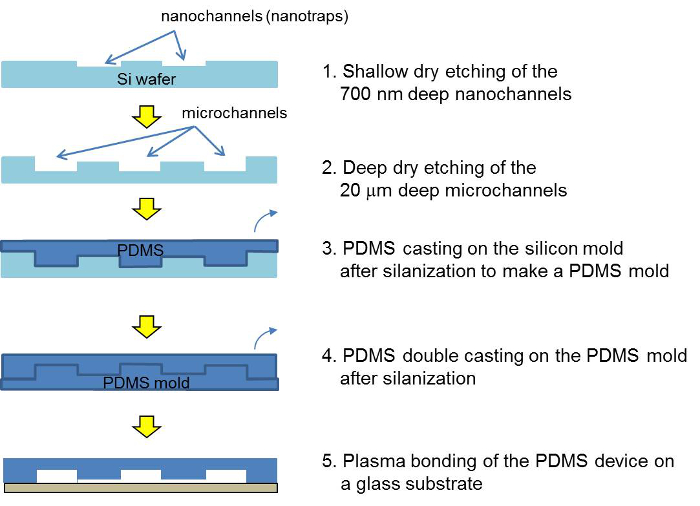
Figura 2. Representação esquemática do processo de fabricação para o mestre de silício, o mestre PDMS e o dispositivo PDMS concentrador. Depois de duas etapas de fotolitografia e gravura, o mestre de silício é moldado com PDMS. Depois de um double-ligas, o dispositivo PDMS é montado por meio de ligação de plasma e preenchido com uma suspensão de esferas. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Passo-a-passo esquemática para a auto-montagem de grânulos de sílica coloidal. 10 ul da suspensão de esferas foi pipetada para os canais de entrega grânulo imediatamente depois do tratamento de plasma. Uma vez que o canal de entrega grânulo foi preenchido, mas tudo duas entradas 1 e 9 foram cobertas com fita adesiva e o ar dispositivos seco durante 3 h antes de ser utilizado. (Reproduzido de Ref. 25 com permissão da The Royal Society of Chemistry) Por favor clique aqui para ver uma versão maior desta figura.
| partículas coloidais (500 nm) | Potencial zeta (mV) |
| Sílica | -2,04 |
| amina de sílica | 19,6 |
| carboxilo de sílica | -19,73 |
| sílica carboxyl, PAH revestido | 31,8 |
| carboxilo de sílica, PAH, PSS revestido | -28.5 |
| amina de sílica, PSS revestido | -31,2 |
Tabela 1. potencial zeta de grânulos de sílica a 25 ° C. 0,1% (w / v), soluções coloidais foram usadas para as medições (n = 3).
As imagens SEM tiradas a partir do canal de talão de embalagem, após secagem a mostrar um tamanho de poro que varia entre 60 nm, 91 nm e 170 nm, como mostrado na Figura 4. O tamanho dos poros corresponde a aproximadamente 20% do tamanho do grânulo, 300 nm, 500 nm e 900 nm, respectivamente (15% do diâmetro do grânulo é o tamanho de poro teórico).

Figura 4. As imagens SEM de auto-montagem 300 nm (A), 500 nm (B) e 900 nm (C) sílica coloidal embalagem talão. dispositivos PDMS foram reversivelmente ligado a lâminas de vidro e esferas voaram para dentro do canal usando pressão negativa. Após os dispositivos de O / N-secagem ao ar, os dispositivos PDMS foram descascadas do vidro cuidadosamente e fotografada. Este tamanho de poros foram estimadas como sendo de 60 ± 2, 91 ± 5 170 ± e 7 nm para 300 nm, 500 nm e 900 nm esferas, respectivamente (n = 9). Estes tamanhos de poro estavam perto com o tamanho teórico, ~ 15% do diâmetro do grânulo. (Adaptado de Ref. 25 com permissão da The Royal Society of Chemistry) Por favor clique aqui para ver uma versão maior desta figura.
Quando se aplica tensão de 30 V através da membrana do grânulo de 300 nm, uma zona de depleção de ião foi observada perto da membrana coloidal no interior de um microcanal preenchido com umfluorescente de ADN marcado (Figura 5 A, B). Ao abaixar a tensão de 25 V do lado esquerdo, as moléculas de ADN foi acumulada sob a forma de um tampão e a sua concentração aumentada devido ao fluxo electro-osmótico impulsionado por uma diferença de tensão de 30 V-25 V através do canal de amostra (Figura 5 C , D).

Figura 5. micrografias lapso de tempo mostram a formação de uma região de depleção de ião perto das junções coloidais nanofluidic no canal preenchido com DNA (concentração inicial de 10 nM). A região de depleção de ião foi iniciada no instante t = 10 s e um tampão de ADN concentrado foi gerado pelo V2 = 30 V e V1 = 25 V através do canal de amostra, enquanto os canais tampão foram cancelados. As linhas a tracejado têm sido utilizados para destacar as paredes de canais. Um fator de concentração de ~ 1.700 dobras foi alcançada dentro de 15 min. vocêcantar uma nm membrana coloidal 300. (Reproduzido de Ref. 25 com permissão da The Royal Society of Chemistry) Por favor clique aqui para ver uma versão maior desta figura.
As membranas de sílica com um tamanho de esfera de 300 nm e 500 nm apresentou a maior factor de concentração em ~ 1.700 vezes para o Cy 5 etiquetado ADN (CAA CCG ATG CCA CAT CAT CTA TAG C) dentro de 15 min. (Figura 6 A, B). As membranas do grânulo silica revestida com polielectrólitos levou a uma de 200 a 1000 vezes aumento na concentração de ADN após 15 min. (Figura 6 C, D).
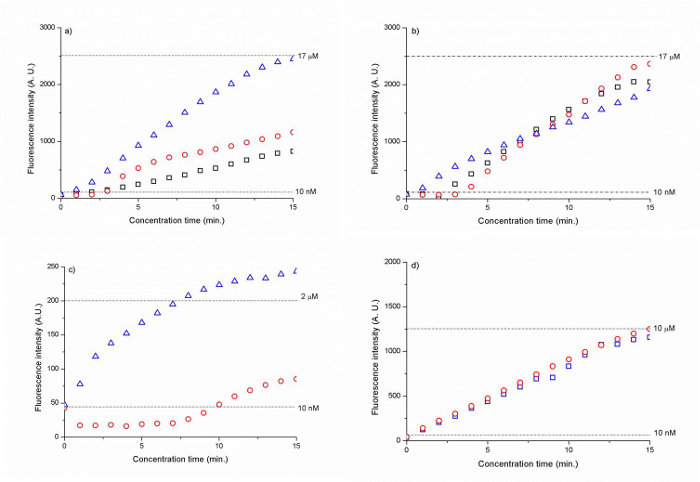
Figura 6. intensidade de fluorescência de ADN como uma função do tempo para 300 nm esferas de sílica (A) (B) 500 nm grânulos de sílica umad (C) a 500 esferas de amina de sílica PSS-revestidos nm e (D) 500 nm HAP / PSS esferas revestidas de sílica carboxilo. As linhas a tracejado representam o nível de intensidade de sinal de fluorescência por 10 nm (A, B, C, D), 17 uM (A, B), 2 uM (C) e 10 ^ M (D) de ADN. Os resultados foram normalizados contra a fluorescência de fundo. (Reproduzido de Ref. 25 com permissão da The Royal Society of Chemistry) Por favor clique aqui para ver uma versão maior desta figura.
| O tempo de processamento | modo etch | modo passivation |
| O tempo de processamento | 6 s | 4.5 s |
| invadir | 0,5 s | 0 s |
| Poder gerador de Platen | 80 W | 60 W |
| Poder gerador de bobina | 600 W | 600 W |
| Gás | SF 6 70 sccm | C 4 F 8 35 sccm |
| taxa de corrosão | 1,47? M / min | |
Tabela 2. Parâmetros DRIE.
Discussão
Seguindo o esquema de design do dispositivo comum para estudar nanofluidics, que fabricou uma junção nanofluidic entre dois canais microfluídicos usando a auto-montagem orientada por evaporação de nanopartículas coloidais em vez de lithographically padronização uma matriz de nanocanais. Quando fluir as partículas coloidais para dentro do canal de entrega do grânulo, uma matriz de nanoarmadilhas com uma profundidade de 700 nm e uma largura de 2 m em ambos os lados do canal de distribuição de pérolas a uma largura total de 100 mm impediu a suspensão de pérolas de fluir para o e tampão de amostra do canal devido à tensão superficial nos nanoarmadilhas. Uma vez preso, as partículas coloidais embalados no canal de distribuição do grânulo e rapidamente formada uma junção nanoporoso entre a amostra e o tampão do canal.
É importante para carregar a suspensão de esferas imediatamente após a colagem do plasma de modo a que a força capilar de sílica conduz a suspensão do grânulo até à entrada da tomada reservoirs no canal de parto talão temporariamente hidrofílico. A fim de evitar que uma bolha de ar a bloquear o fluxo de entrada no reservatório, é altamente recomendável para atingir o fundo do reservatório, com uma ponta de pipeta e depois libertar a suspensão de pérolas para dentro do reservatório. No caso dos grânulos de superfície funcionalizada com polielectrólitos, a sua capacidade de escoamento foi drasticamente reduzida em comparação com os grânulos de silicone sem funcionalização de superfície e tendem a agregar com mais facilidade e aderem à superfície do canal durante o processo de enchimento. A fim de evitar um entupimento do canal com as esferas revestidas com polielectrólitos, que adicionado um agente tensioactivo, 0,05% de Tween 20, para a suspensão do grânulo. No caso de ainda havia um problema de entupimento durante o enchimento, um toque suave no chip PDMS com uma ponteira geralmente ajudou a resolvê-lo.
Além disso, é importante que a suspensão de pérolas não foi completamente seca após a evaporação uma vez que seria difícil de infiltrate a membrana do grânulo com a solução tampão de fosfato de sódio novamente. Portanto, depois de 3 horas de evaporação parcial, todas as entradas e saídas do dispositivo de PDMS foram gravadas e mantidas a 4 ° C para armazenamento antes da utilização de modo que a embalagem permanece grânulo húmido. Durante as experiências de pré-concentração, o cordão de auto-montados manteve a sua estabilidade estrutural para a maior parte. No entanto, em alguns casos, observou-se um deslocamento dos grânulos que indicavam uma embalagem defeituosa dos grânulos em microcanais. Os grânulos de sílica auto-montadas que variam a partir de um diâmetro de 900 nm até 300 nm após a auto-montagem pode ser visto na Figura 4. O tamanho de poro teórico da embalagem da conta era de ~ 45 nM, cerca de ~ 15% da partícula coloidal diâmetro. Poderíamos confirmar o tamanho de poro utilizando uma análise SEM e medido um tamanho de poro de aproximadamente 20% do diâmetro das pérolas após a embalagem.
Usando as auto-montadas 300 nm e 500 nm membranas de partículas coloidais como um íon-seletivo nanoporous junção, que poderia iniciar a região de depleção de ião a 30 V e concentra-se 10 nM de ADN etiquetado com Cy5 (CAA CCG ATG CCA CAT CAT CTA TAG C) em tampão de fosfato de sódio 1 mM (Figura 5). Por fluindo continuamente a amostra de ADN para a zona de depleção de iões com um fluxo electro-osmótico com uma diferença de tensão V 2 -V 1 = 5 V, que se poderia aumentar a concentração inicial de ADN por ~ 1.700 dobras dentro de 15 min. (Figura 6a, b). 500 nm esferas permitida uma concentração de DNA mais robusta do que 300 nm esferas, como mostrado na Figura 6b). Uma vez que a concentração electrocinético baseia-se num equilíbrio de forças entre a força electro-osmótica e as forças electroforéticas altamente não-lineares, o factor de concentração resultante é determinada pelo grau em que pode ser mantida durante este equilíbrio de forças concentração electrocinético 27.
Outra vantagem significativa da implantação de partículas coloidais para a construção de uma junção nanofluidic é a facilidade com que o surface funcionalização podem ser realizadas. Em vez de criar uma ligação através nanochannel primeiro e, em seguida, executar uma funcionalização da superfície sobre ele, que pode simplesmente superfície funcionalizar as partículas coloidais em um frasco exterior do dispositivo em primeiro lugar e, em seguida, eles fluem para dentro do canal para auto-montagem. Com base nesta abordagem, que poderiam iniciar ICP usando os 500 nm partículas de sílica de amina revestidas com uma camada única de PSS e 500 partículas carboxilo sílica nm revestidas com uma camada de HAP e PSS (Figura 6 c e d), a voltagens mais baixas (8 V e 10 V, respectivamente) do que as partículas coloidais sem funcionalização da superfície (30 V). Este resultado mostra que a funcionalização da superfície das partículas coloidais anteriores para a auto-montagem foi eficaz para aumentar a carga de superfície das partículas coloidais e resultou em maior ICP. No entanto, em termos de o factor obtido concentrador, a junção nanofluidic das esferas funcionalizadas superfície foi menos eficaz do que o Si não funcionalizadogrânulos Lica. Os grânulos / PSS-revestidas de amina activada num factor de ~ 200, enquanto o carboxilo / HAP / PSS membrana do grânulo mostrou um aumento de 1000 vezes após 15 min. (Figura 6d). Este resultado pode ser explicado por uma maior carga de superfície das nanoporos funcionalizado superfície que levaram a um aumento do comprimento da zona de depleção do ião de empurrar o bujão de concentração da amostra mais longe a partir da membrana do grânulo e, por conseguinte, a concentração de menos estável. Acreditamos que a redução da largura total da membrana do grânulo de nanoporoso actualmente de 1 mm (a secção da membrana do grânulo paralelo ao canal de amostra) pode mitigar este problema da instabilidade. De acordo com o nosso estudo anterior, a largura da junção nanoporoso determina a quantidade de passagem de corrente iónica através dele. 28 À medida que a largura aumenta, as iónicos corrente aumenta e desde mais catiões pode migrar através da membrana, o comprimento de depleção aumenta e o tampão de concentração é ainda mais se afastou da junção nanoporous. Tor conseguinte, a acumulação ocorre de uma forma menos confinado e o êmbolo da amostra torna-se menos estável. Empiricamente, a junção nanoporoso deve ser ~ 100-400 uM de largura. Uma outra característica para melhorar era uma espessura suficiente da parede PDMS de 15 um canal entre a amostra e a entrega do grânulo. Esta seção PDMS fina levou a uma ligação insuficiente que permitiu uma corrente iônica entre o tampão e canal de amostra. Portanto, toda a membrana do grânulo de corte paralelo ao canal de amostra (1 mm de largura) foi agindo como uma junção nanoporoso, apesar de apenas 100 uM do grânulo foi concebida como uma membrana de junção nanoporoso de acordo com a largura total da matriz nanotrap. A espessura da parede PDMS devem ser, pelo menos, 25 uM ou superior.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Este trabalho foi financiado pelo NIH R21 EB008177-01A2 e New York University Abu Dhabi (NYUAD) Research Fund Enhancement 2013. Nós expressamos os nossos agradecimentos à equipe técnica do MIT MTL por seu apoio durante microfabricação e James Weston e Nikolas Giakoumidis de NYUAD para a sua apoio na tomada de SEM imagens e construir um divisor de tensão, respectivamente. A fabricação do dispositivo em PDMS foi realizada na unidade do núcleo de microfabricação NYUAD. Por fim, gostaríamos de agradecer a Rebecca Pittam a partir do Centro NYUAD para Scholarship Digital para a gravação de vídeo e edição.
Materiais
| Name | Company | Catalog Number | Comments |
| Poly(Styrenesulfonic Acid) Sodium Salt | Polysciences | 08772 | |
| Poly(allylamine) Solution | Sigma Aldrich | 479144-5G | |
| Silica Microsphere - 300 nm | Polysciences | 24321 | |
| Silica Microsphere - 500 nm | Polysciences | 24323 | |
| Silica Microsphere Carboxyl Functional - 500 nm | Polysciences | 24753 | |
| Silica Microsphere Amine Functional - 500 nm | Polysciences | 24756 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | ||
| Trichlorosilane | Sigma Aldrich | 175552 | |
| Ultrasonic Cleaner | Branson | 3510 | |
| Tube Rotator | VWR | 10136-084 | |
| Vortex Mixer | WiseMix | VM-10 | |
| Microcentrifuge | VWR | Micro 1207 | |
| Plasma Cleaner | Harrick Plasma | PDC-001-HP | |
| PDMS Mixer | Thinky | ARE-250 | |
| Oven | Thermo Scientific | PR305220M | |
| Epi-fluorescence Microscope | Nikon | Eclipse Ti | |
| CCD Camera | Andor | Clara | |
| Platinum Electrodes | Alfa Aesar | 43014 | |
| Source Meter | Keithley | 2400 | |
| Digital Multimeter | Extech | 410 | |
| Microscopy Glass Slides | Thermo Scientific | 2951-001 | |
| Tween 20 | Merck Millipore | 822184 | |
| Sodium chloride | Fisher Scientific | 7646-14-5 | |
| Sodium phosphate monobasic | Sigma Aldrich | 71505 | |
| Sodium phosphate dibasic | Sigma Aldrich | S3264 | |
| DNA | IDT | CAA CCG ATG CCA CAT CAT TAG CTA C | |
| B-Phycoerythrin | Life Technologies | P-800 | |
| Dynamic light scattering system for Zeta Potential Measurement | Malvern | Zetasizer Nano S | |
| Photoresist | Shipley | SPR700-1.0 | |
| Projection lithography | Nikon | NSR2005i9 | |
| Reactive Ion Etcher | Applied Materials | AME P5000 | |
| ICP deep reactive ion etcher | STS | STS-6" | |
| Contact lithography | Electronic Visions | EV620 | |
| Photoresist Coater Developer | SSI | SSI 150 | |
| Non-contact surface profiler | Wyko | NT 9800 |
Referências
- Mawatari, K., Kazoe, Y., Shimizu, H., Pihosh, Y., Kitamori, T. Extended-Nanofluidics: Fundamental Technologies, Unique Liquid Properties, and Application in Chemical and Bio Analysis Methods and Devices. Anal Chem. 86, 4068-4077 (2014).
- Tsukahara, T., Mawatari, K., Kitamori, T. Integrated extended-nano chemical systems on a chip. Chem Soc Rev. 39, 1000-1013 (2010).
- Mani, A., Zangle, T. A., Santiago, J. G. On the Propagation of Concentration Polarization from Microchannel-Nanochannel Interfaces Part I: Analytical Model and Characteristic Analysis. Langmuir. 25, 3898-3908 (2009).
- Aizel, K., et al. Enrichment of nanoparticles and bacteria using electroless and manual actuation modes of a bypass nanofluidic device. Lab Chip. 13, 4476-4485 (2013).
- Wang, Y. C., Stevens, A. L., Han, J. Million-fold preconcentration of proteins and peptides by nanofluidic filter. Anal Chem. 77, 4293-4299 (2005).
- Karnik, R., et al. Electrostatic control of ions and molecules in nanofluidic transistors. Nano letters. 5, 943-948 (2005).
- Mao, P., Han, J. Y. Fabrication and characterization of 20 nm planar nanofluidic channels by glass-glass and glass-silicon bonding. Lab Chip. 5, 837-844 (2005).
- Mao, P., Han, J. Massively-parallel ultra-high-aspect-ratio nanochannels as mesoporous membranes. Lab Chip. 9, 586-591 (2009).
- Balducci, A., Mao, P., Han, J. Y., Doyle, P. S. Double-stranded DNA diffusion in slitlike nanochannels. Macromolecules. 39, 6273-6281 (2006).
- Yamada, M., Mao, P., Fu, J. P., Han, J. Y. Rapid Quantification of Disease-Marker Proteins Using Continuous-Flow Immunoseparation in a Nanosieve Fluidic Device. Anal Chem. 81, 7067-7074 (2009).
- Huh, D., et al. Tuneable elastomeric nanochannels for nanofluidic manipulation. Nat Mater. 6, 424-428 (2007).
- Chung, S., Lee, J. H., Moon, M. W., Han, J., Kamm, R. D. Non-lithographic wrinkle nanochannels for protein preconcentration. Adv Mater. 20, 3011-3016 (2008).
- Park, S. M., Huh, Y. S., Craighead, H. G., Erickson, D. A method for nanofluidic device prototyping using elastomeric collapse. Proc Natl Acad Sci. 106, 15549-15554 (2009).
- Zeng, Y., Harrison, D. J. Self-assembled colloidal arrays as three-dimensional nanofluidic sieves for separation of biomolecules on microchips. Anal Chem. 79, 2289-2295 (2007).
- Malekpourkoupaei, A., Kostiuk, L. W., Harrison, D. J. Fabrication of Binary Opal Lattices in Microfluidic Devices. Chem Mat. 25, 3808-3815 (2013).
- Merlin, A., Salmon, J. -. B., Leng, J. Microfluidic-assisted growth of colloidal crystals. Soft Matter. 8, 3526-3537 (2012).
- Schepelina, O., Zharov, I. PNIPAAM-modified nanoporous colloidal films with positive and negative temperature gating. Langmuir. 23, 12704-12709 (2007).
- Schepelina, O., Zharov, I. Poly(2-(dimethylamino)ethyl methacrylate)-Modified Nanoporous Colloidal Films with pH and Ion Response. Langmuir. 24, 14188-14194 (2008).
- Smith, J. J., Zharov, I. Ion transport in sulfonated nanoporous colloidal films. Langmuir. 24, 2650-2654 (2008).
- Gaspar, A., Hernandez, L., Stevens, S., Gomez, F. A. Electrochromatography in microchips packed with conventional reversed-phase silica particles. Electrophoresis. 29, 1638-1642 (2008).
- Lee, S. Y., et al. High-Fidelity Optofluidic On-Chip Sensors Using Well-Defined Gold Nanowell Crystals. Anal Chem. 83, 9174-9180 (2011).
- Hu, Y. L., et al. Interconnected ordered nanoporous networks of colloidal crystals integrated on a microfluidic chip for highly efficient protein concentration. Electrophoresis. 32, 3424-3430 (2011).
- Zhang, D. -. W., et al. Microfabrication-free fused silica nanofluidic interface for on chip electrokinetic stacking of DNA. Microfluid Nanofluid. 14, 69-76 (2013).
- Syed, A., Mangano, L., Mao, P., Han, J., Song, Y. A. Creating sub-50 nm nanofluidic junctions in a PDMS microchip via self-assembly process of colloidal silica beads for electrokinetic concentration of biomolecules. Lab Chip. 14, 4455-4460 (2014).
- Kim, S. J., Song, Y. A., Han, J. Nanofluidic concentration devices for biomolecules utilizing ion concentration polarization: theory, fabrication, and applications. Chem Soc Rev. 39, 912-922 (2010).
- Fu, J. P., Mao, P., Han, J. Y. Continuous-flow bioseparation using microfabricated anisotropic nanofluidic sieving structures. Nat Protoc. 4, 1681-1698 (2009).
- Plecis, A., Nanteuil, C., Haghiri-Gosnet, A. M., Chen, Y. Electropreconcentration with Charge-Selective Nanochannels. Anal Chem. 80, 9542-9550 (2008).
- Ko, S. H., et al. Nanofluidic preconcentration device in a straight microchannel using ion concentration polarization. Lab Chip. 12, 4472-4482 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados