Method Article
Erstellen von Unter 50 Nm nanofluidische Junctions in PDMS mikrofluidischen Chip über Selbstorganisation von kolloidalen Teilchen
In diesem Artikel
Zusammenfassung
We propose a simple self-assembly technique of silica colloidal nanoparticles to create a nanofluidic junction between two microchannels in polydimethylsiloxane (PDMS). Using this technique, a nanoporous bead membrane with a pore size down to ~45 nm was built inside a microchannel and applied to electrokinetic preconcentration of DNA samples.
Zusammenfassung
Polydimethylsiloxan (PDMS) ist die vorherrschende Baustoff mikrofluidische Vorrichtungen herzustellen aufgrund seiner einfachen Formgebung und Verklebung sowie ihre Transparenz. Aufgrund der Weichheit des PDMS-Material, jedoch ist es schwierig PDMS Nanokanäle für den Aufbau zu verwenden. Die Kanäle sind in der Regel leicht während der Plasma-Bindung zu kollabieren. In diesem Papier präsentieren wir eine Verdampfungsgesteuerte Selbstzusammenbauverfahren von Silika kolloidale Nanopartikel nanofluidic junctions mit Sub-50 nm zwischen zwei Mikroporen zu schaffen. Die Porengröße sowie die Oberflächenladung des nanofluidic Übergang abstimmbar ist, indem einfach die kolloidale Kieselsäure Perlgröße und Oberflächenfunktionalisierung ändernden außerhalb der zusammengebauten mikroströmungstechnische Vorrichtung in einer Phiole vor dem Selbstorganisationsprozess. Verwendung der Selbstorganisation von Nanopartikeln mit einer Perlengröße von 300 nm, 500 nm und 900 nm, war es möglich, eine poröse Membran mit einer Porengröße von 45 nm ~, ~ 75 nm und ~ 135 nm bzw. herzustellen. Unter Elektroal Potential, diese nanoporöse Membran initiiert Ionenkonzentrationspolarisation (ICP), die als eine kationenselektive Membran DNA von ~ 1.700-mal innerhalb von 15 min zu konzentrieren. Diese nicht-lithographischen Nanofabrikationsprozess eröffnet eine neue Chance auf einen abstimmbaren nanofluidic Knotenpunkt für die Untersuchung von nanoskaligen Transportprozesse von Ionen und Molekülen in einem PDMS mikrofluidischen Chips zu bauen.
Einleitung
Nanofluidik ist ein aufstrebendes Forschungsgebiet der μ TAS (Micro Gesamtanalysesysteme) biologische Prozesse oder Transportphänomene von Ionen und Molekülen auf der Längenskala von 10 1 zu studieren - 10 2 nm. Mit dem Aufkommen der nanofluidic Werkzeuge wie Nanokanälen, Transportprozesse von Molekülen und Ionen können mit bisher unerreichter Genauigkeit und manipuliert überwacht werden, falls erforderlich, durch Merkmale auszunutzen , die nur in diesem Längenskala für die Trennung und den Nachweis verfügbar sind. Eine 1,2 Diese charakteristischen Merkmale nanoskaligen ist ein hohes Verhältnis von Oberfläche zu Masse Ladung (oder Dukhin Nummer) in Nanokanälen , die ein Ladungsungleichgewicht und initiieren Ionenkonzentrationspolarisation (ICP) zwischen dem Nanokanal und Mikrokanal verursachen. 3
Eine gemeinsame Geräteplattform für die Untersuchung von Phänomenen nanofluidic besteht aus einem Zwei-Mikrokanalsystem durch ein Array von Nanokanälen als Kreuzung verbunden ist . 4-6 Das Material der Wahl eines solchen nanofluidic Vorrichtung zum Gebäude ist das Silizium aufgrund seiner hohen Steifigkeit , die ein Kollabieren während des Bondprozesse den Kanal verhindert. 7 jedoch Siliziumvorrichtungsherstellung teuer Masken und erhebliche Menge an Verarbeitung in der Reinraumanlage erfordert. 8- 10 Wegen der Bequemlichkeit der Herstellung der Vorrichtung durch Formen und Plasma - Bindung, Polydimethylsiloxan (PDMS) hat für die Mikrofluidik als Baumaterial akzeptiert , und es wäre ein ideales Material für Nanofluidik ebenso weit ist. Doch seine niedrigen Elastizitätsmodul um 360-870 KPa, macht der PDMS-Kanal leicht zusammenklappbar während der Plasma-Bindung. Die minimale Seitenverhältnis der Nanokanal (Breite zu Tiefe) muss weniger als 10: 1, was bedeutet, dass die Herstellung von PDMS-Geräte über Standard-Photolithographie äußerst herausfordernd sein wird, wenn die Nanokanaltiefe unter 100 nm sein muss, erfordert eine Kanalbreite kleiner als der aktuelle Grenzwert von photolithgraphie bei etwa 1 um. Um diese Einschränkung zu überwinden, wurden Versuche unternommen, Nanokanäle in PDMS zu schaffen unter Verwendung von nicht-lithographische Verfahren wie Verstrecken Risse mit einer mittleren Tiefe von 78 nm 11 zu initiieren oder zu Falten nach der Plasmabehandlung bilden. 12 Einstürzen ein PDMS - Kanal mit mechanischem Druck erlaubt eine Nanokanalhöhe nur 60 nm. 13
Obwohl diese hoch erfindungsgemäßen nicht-lithographische Verfahren Gebäude Nanokanäle unterhalb 100 nm in der Tiefe erlaubt, die Abmessungs Steuerbarkeit der Nanokanalherstellungs stellt weiterhin ein Hindernis für eine breite Akzeptanz von PDMS als Baumaterial für Nanofluidikbauteilen. Ein weiteres kritisches Problem der Nanokanälen, ob in Silizium oder PDMS, ist die Oberflächenfunktionalisierung falls es notwendig ist, die Oberflächenladung auf der Kanalwand für die Manipulation von Ionen oder Molekülen zu verändern. Nach dem Gerätemontage durch Kleben, sind die Nanokanäle äußerst schwierig,für die Oberflächenfunktionalisierung erreichen aufgrund der diffusionsbegrenzten Transport. Durch Verdampfen 14-16 in mikrofluidischen Systemen induziert , um einen nanoskopische Kanal mit hoher Dimensionstreue und leichten Oberflächenfunktionalisierung, die Selbstorganisation Methode von kolloidalen Teilchen erzeugen kann eine der vielversprechenden Ansätze sein. Neben der Kontrollierbarkeit der Porengröße und Oberflächeneigenschaft, gibt es sogar eine Möglichkeit zum Abstimmen der Größe der Pore in-situ als kolloidalen Teilchen unter Verwendung von mit Polyelektrolyten beschichtet durch Steuern von Temperatur, pH 17, 18,19 und Ionenstärke. 18 Aufgrund dieser Vorteile hat die Selbstzusammenbauverfahren von kolloidalen Partikeln bereits gefunden Anwendungen für Elektrochromatographie, 20 Biosensoren, 21 Proteinkonzentration 22 und Trennung von Proteinen und DNA in der Mikrofluidik. 14,23 in dieser Studie eingesetzt wir diese Selbstzusammenbauverfahren ein zu bauen elektro preconcentration Gerät inPDMS , die eine nanofluidic Verbindung zwischen zwei Mikrokanäle erfordert. 24 Der grundlegende Mechanismus , der hinter der elektro Konzentration wird basierend auf Ionenkonzentrationspolarisation (ICP). 25. Eine detaillierte Beschreibung der Herstellung und der Montageschritte ist in dem folgenden Protokoll enthalten.
Protokoll
1. Herstellung der Silica Kolloidales Bead Suspensions
- Herstellung von 300 nm und 500 nm Siliciumoxid bead Suspensionen
- Vortex die Kieselsäure Perle Stoffsuspension (10% w / v in Wasser) für 30 Sekunden. um eine homogene Suspension zu erhalten. Pipette insgesamt 600 ul Stoffsuspension in ein 1,5-ml-Röhrchen und Zentrifuge es bei 2.600 × g für 1 min.
- Ersetzen den Überstand mit 400 ul 1 mM Natriumphosphatpuffer (PB, pH 7,0).
- Suspendieren die Silicakügelchen in einer Endkonzentration von 15% in 1 mM Natriumphosphatlösung bei pH 7,0 durch Vortexen.
- Oberflächen funktionalisieren 500 nm Kieselsäure Carboxy Perlen mit Poly (allylaminhydrochlorid, PAH), und mit Poly (Natriumstyrolsulfonat, PSS) Polyelektrolyte
- Suspend 0,1 g von 500 nm Siliciumdioxidperlen mit Carboxylgruppe mit 10 ml 1 M NaCl (pH 7,0) für 1% (w / v) Beadsuspension.
- Bereiten Sie 0,4% PAH (MW 65K) in 1 M NaCll von 300 & mgr; l der Stammlösung aufgelöst (20% w / v in Wasser) in 15 ml 1 M NaCl. Bereiten 0,9% PSS (MW 70K) in 1 M NaCl-Lösung durch Auflösen von 0,18 g PSS in 20 ml 1 M NaCl-Lösung. Vortex beide Lösungen für 1 min. den Polyelektrolyten vollständig aufzulösen.
- Mit 200 & mgr; l von PAH-Lösung auf 9,8 ml 1% Kieselsäure Carboxyl Kügelchen in einem 15-ml-Röhrchen mit einer positiv geladenen Polyelektrolytschicht auf Silicakügelchen mit carboxylfunktionellen Gruppe abzuscheiden. Vortex die Beadsuspension für 1 min. und brüten sie auf einem Rohr Rotator für 60 min. bei RT.
- Zentrifugieren Sie die Beadsuspension bei 1801 × g für 1 min. und waschen Sie die ungebundenen PAH fünfmal mit 10 ml DI Wasser. Nach jeder Zentrifuge und Entfernung des Überstands wurden die Perlen an der Unterseite des Rohres dicht gepackt. Stören die bead clump durch heftiges Pipettieren mit 2 ml DI-Wasser vor der Zugabe von 8 ml VE-Wasser, so dass die Kügelchen resuspendiert und gewaschen werden können vor dem nächsten Schritt Zentrifuge ab.
- Folgendie Schritte in 1.2.3 und 1.2.4 für PSS-Beschichtung eine negativ geladene Schicht auf den Kügelchen zu deponieren. Resuspendieren der Kügelchen in 9,8 ml 1 M NaCl vor der PSS Abscheidung nach dem DI - Wasser - Überstand aus dem 5. Waschschritt 1.2.4 entfernen.
- Verwenden Sie die gleiche heftiges Pipettieren Schritt unter Verwendung von 2 ml 1 M NaCl den Wulst Klumpen am Boden des 15-ml-Röhrchen zu brechen und fügen Sie dann 8 ml 1 M NaCl. In 200 ul PSS-Lösung auf 9,8 ml der Siliciumdioxid-Kügelchen mit einer einzigen PAH-Schicht abgeschieden. Nach 1 min verwirbelt. und Inkubation für 60 min. auf dem Rohr Rotator, wiederholen Sie 5 Waschschritte mit DI-Wasser.
- Messung des Zeta-Potentials der Kügelchen vor und nach jeder Beschichtung Polyelektrolyt ein dynamisches Lichtstreuungssystem nach Herstellerprotokoll das Polyelektrolyt Ablagerungsverfahren zur Überprüfung korrekt ausgeführt wurde (siehe Tabelle 1).
- Wiederholen Sie fünf Waschschritte mit DI-Wasser im Anschluss an die einzelnen PSS-SchichtAblagerung und resuspendieren die Kügelchen in 650 & mgr; l von 1 mM Natriumphosphatpuffer mit 0,05% Tween 20 (15% w / v) vor in der mikrofluidischen Vorrichtung zu verwenden, seine Fließfähigkeit zu verbessern.
- Folgen Sie dem oben beschriebenen Verfahren von 1.2.5 bis 1.2.6 für 500 nm Silicabeads mit Aminfunktion eine einzelne Schicht aus PSS zu deponieren.
2. Die Herstellung des PDMS mikrofluidischen Chip
- Mikrofertigung des Silizium - Master
- Fabrizieren des Silizium-Master für PDMS Form mit Mikrofabrikationstechniken wie folgt.
- Schleuderbeschichtung ein 1 & mgr; m dünnen Photoresist bei 4.000 Umdrehungen pro Minute auf einem Siliziumwafer. Muster der Schicht unter Verwendung von Projektionslithographie (Belichtungszeit 170 ms.) Und ätzen 700 nm tief und 2 & mgr; m breiten planaren Nanokanäle (die als nanotraps für die Silica-Kügelchen) mit Reactive Ion Etching.
- Verwenden Sie die folgenden Ätzparametern eine Ätzrate von 3,5 nm / s zu erreichen: CHF 3 (45 sccm), CF 4 (15 sccm), Ar (100 sccm), Druck 100 mTorr, HF - Leistung 200 W.
- Spin Mantel der zweite 1 um dicke Photoresist-Schicht bei 2000 Umdrehungen pro Minute und eine Ausrichtung auf die zuvor strukturierten nanotraps auszuführen. Muster die Mikrokanäle über Kontaktlithographie und durch tiefes reaktives Ionenätzen (DRIE) von Silizium. Verwenden Sie die DRIE - Parameter 26 in Tabelle 2.
- Fabrizieren des Silizium-Master für PDMS Form mit Mikrofabrikationstechniken wie folgt.
- Die Herstellung von PDMS - Form
- Silanisieren die Silizium-Master mit Trichlorsilan (50 ul) in einer O / N Vakuumgefäß.
ACHTUNG: Tricholorosilane ist ein giftiges und ätzendes Material. Verwenden Sie immer es in einer chemischen Haube mit der richtigen persönlichen Schutzausrüstung. - Mischen Sie die Basis mit dem Härter bei 10: 1-Verhältnis und Guss PDMS auf der silanisierten Silizium-Master und härten bei 70 ° C für 2 Stunden in einem Umluftofen.
- Entfernen Sie die PDMS-Platte aus dem Silizium-Master mit einem Messer und Plasma-Bindung auf einem leeren Wafer mit einem Plasma-Reiniger nach einem pl mitAsma Behandlung in einem Plasma-Reiniger für 1 min. Bringen Sie Bänder entlang der Kante eine Trennlinie für die folgenden PDMS zu markieren Gießschritt.
- Silanisieren die PDMS-Form in einem Vakuumgefäß mit Trichlorsilan (50 ul) O / N.
- Cast PDMS (Basis: 1-Verhältnis: Mittel bei 10 Härtung) auf der silanisierten PDMS-Form und Heilung bei 70 ° C für 2 Stunden in einem Umluftofen.
- Silanisieren die Silizium-Master mit Trichlorsilan (50 ul) in einer O / N Vakuumgefäß.
- Die Herstellung der PDMS - Gerät
- Ziehen Sie die gehärtete PDMS Platte aus der PDMS-Form entlang der Trennlinie mit dem Band markiert.
- Durchschlags-Reservoir Löcher mit 1,5 mm Biopsie Punsch, sauber und mit einem Band, Spülen mit Isopropylalkohol (IPA) und mit Stickstoff trocken.
- Plasma-Bindung der PDMS-Gerät auf einem 25 mm x 75 mm Mikroskopobjektträger aus Glas nach einer Plasmabehandlung in einem Plasma-Reiniger für 1 min.
- Ultrasonicate der Perlensuspension für 60 min. in einem Ultraschallbad vor dem Füllen. Pipettieren Sie 10 ul Beadsuspension (300 nm nicht funktionalisierte Kieselsäure seinAnzeigen oder 500 nm Kieselsäure Carboxy Perlen mit PAH-PSS Schichten oder 500 nm Siliziumdioxid Amin Perlen mit einer PSS - Schicht) in die Einlässe 4 und 6 jeweils (Abbildung 1 A, B) unmittelbar nach der Plasma Bindung des PDMS - Chip ein absolutes Glassubstrat. Durch leichtes Klopfen auf der PDMS-Chip mit einer Pipettenspitze, um den Wulst Verpackung zu verbessern.
- die Perle Lieferkanäle Nach dem Befüllen decken alle Eingänge mit Ausnahme von 1 und 9 mit Klebeband. Air-Trocknen Sie das Gerät für 3 Stunden und lagern bei 4 ° C vor der Verwendung. Abbildung 2 einen Schritt- für -Schritt gibt Schema der kolloidalen Selbstorganisation.
3. Experiment für Elektrokinetische Konzentration der DNA
- Füllen der Reservoire 3, 7 mit einer Pufferlösung (10 ul 1 mM PB) und dem Vorratsbehälter 5 mit einer DNA-Probe (10 ul von 10 nM in 1 mM PB) und eine sanfte Unterdruck mit einem invertierten Pipettenspitze anwenden auf Reservoire 2 , 8 und 10, die Kanäle mit den Lösungen ohne Blasen zu füllen (siehe 1B).
- Zugabe von 10 ul 1 mM PB zu Reservoire 2 und 8 und 10 ul 10 nM DNA 10 zum Reservoir den Druck auszugleichen und für 5 min warten. zu erreichen Gleichgewicht.
- Legen Sie die Pt-Drähte in Reservoirs 3, 5, 7, 10.
- Gelten Spannung über dem nanofluidic Übergang einen Spannungsteiler mit einer Quelle Messer und Pt-Drähte verbunden werden. Die ersten 30 gelten V auf Reservoirs 5, 10 und GND auf Reservoire 3, 7.
- Verringern Sie die Spannung bis 25 V auf Reservoir 10 nach ~ 30 sec.
- Verwenden, um einen mechanischen Verschluß mit einer periodischen Öffnung in alle 5 s Bleichen der Probe zu minimieren, wenn die Fluoreszenzsignale von der DNA-Aufnahme.
Ergebnisse
Ein elektro Konzentrator Chip in PDMS , die eine selbstorganisierende nanofluidic Verbindung zwischen zwei Mikrokanäle enthält , ist in Figur 1A) gezeigt. Der Kanal in der Mitte der Vorrichtung ist mit einer DNA - Probenlösung und flankiert von zwei Pufferlösung Kanäle auf jeder Seite über einen breiten Sicke Abgabekanal (1B) 50 & mgr; m gefüllt. Das Silika kolloidale Suspension wird in den Kanal bead Lieferung geflogen unmittelbar nach der Plasmabindungs eine nanofluidic Übergang zwischen der Probe und der Pufferlösung Kanal zu schaffen. Die nanotrap Array, bestehend aus 700 nm tief und 2 & mgr; m breit Nanokanäle wird die kolloidalen Teilchen zu stoppen verwendet. Seine abgetastete Bild mit einer berührungslosen Oberflächenprofil erhalten wird in 1C) gezeigt. Die kolloidalen bead Membranen nach der Verdampfung sind in Figur 1D) dargestellt. Die SEM in 1E) zeigt die Silicabeads Falleped an der planaren nanotrap Anordnung der Probenkanal von dem Wulst Ausgabekanal trennt. Die 300 nm Kieselsäure Perle Verpackung zeigt sehr hexagonale Packung mit einigen geringfügigen Mängeln bestellt , die eine Variation der Konzentration Verhalten (Abbildung 1F) führen könnte. Das Design des PDMS - Konzentrator - Chip mit seinen Dimensionen gefunden werden kann hier und in der Zusatzdateien.

Abbildung 1. Mikrofluidik - Konzentrator in PDMS mit einer integrierten Unter 50 nm nanoporösem Kreuzung. (A) Foto des PDMS-Konzentrator-Gerät. (B) Schematische Darstellung des Mikro nanofluidic Vorrichtung mit einem Wulst Lieferkanal zwischen der Probe und der Pufferlösung Kanal. Die Spannung wird über den Wulst Membranen zwischen den Probenkanal und der Pufferlösung ch angewendetannels. (C) Oberflächenprofil des nanotrap Array in PDMS mit einer Breite von 2 & mgr; m und einer Tiefe von 700 nm. (D) Mikroskopische Aufnahme der Vorrichtung mit einer kolloidalen Partikel Baugruppe im Inneren des Wulstes Förderkanal nach dem Verdunsten. (E) Die rasterelektronenmikroskopische Aufnahme der selbstorganisierenden 300 nm Siliciumoxid kolloidale Teilchen mit den nanotrap Arrays zwischen der Probe und der Pufferkanal. Die 300 nm-Perlen sind am Eingang der nanotraps aufgrund der Oberflächenspannung gefangen. (F) hexagonal 300 nm Silicabeads innerhalb der Wulst Lieferung Mikrokanal nach dem Verdunsten. (Aus Lit.. 25 mit Genehmigung der Royal Society of Chemistry) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Eine schematische Darstellung der Mikrofabrikationsschritte für die PDMS concentrator Gerät ist in Abbildung 2 dargestellt. Um ein PDMS Gerät zu machen, ein Doppel PDMS Gießen erforderlich ist . Der Wulst Füllvorgang in der PDMS - Konzentrator ist in Abbildung 3 dargestellt. Die Details für die Mikroherstellung und der Füllvorgang kann in dem Protokoll zu finden. Das Zeta-Potential der Silicakügelchen ohne und mit Polyelektrolyt-Beschichtung ist in Tabelle 1 gezeigt.
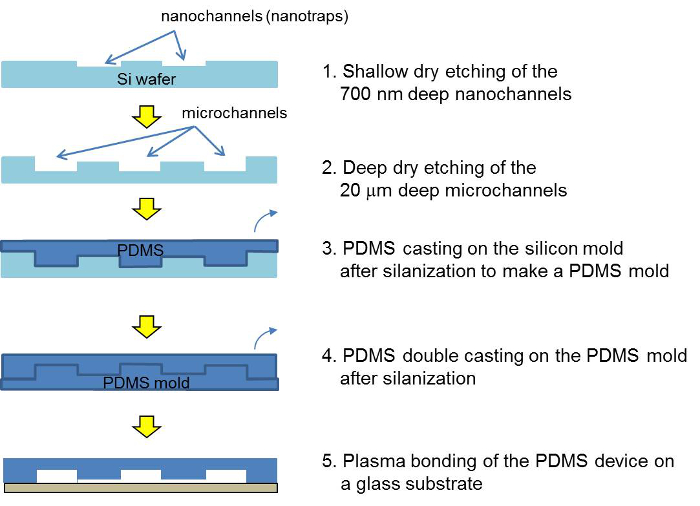
Abbildung 2. Schematische Darstellung des Herstellungsprozesses für das Silizium - Master, der PDMS - Master und der PDMS - Konzentrator - Gerät. Nach zwei Photolithographie- und Ätzschritte wird das Silizium - Master mit PDMS gegossen. Nach einer zwei Formen wird das PDMS - Gerät über Plasma - Bindung montiert und mit einer Beadsuspension gefüllt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Figur 3. Schritt- für -Schritt - Schema für die Selbstorganisation von kolloidalen Silicakügelchen. 10 ul der Perlensuspension wurde in den bead Lieferkanäle unmittelbar nach der Plasmabehandlung pipettiert. Sobald der Wulst Ausgabekanal gefüllt, alle bis auf zwei Einlässe 1 und 9 wurden mit Klebeband und die Geräte Luft für 3 Stunden vor der Verwendung getrocknet bedeckt. (Übernommen aus Ref. 25 mit Genehmigung der Royal Society of Chemistry) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
| Kolloidale Teilchen (500 nm) | Zeta-Potential (mV) |
| Kieselerde | -2,04 |
| Silica Amin | 19,6 |
| Silica Carboxy | -19,73 |
| Silica carboxyl, PAH beschichtet | 31.8 |
| Silica Carboxy, PAH, PSS beschichtete | -28.5 |
| Silica Amin, PSS beschichtete | -31,2 |
Tabelle 1 Zeta - Potential von Silika - Perlen bei 25 ° C. 0,1% (w / v) wurden kolloidale Lösungen für die Messungen verwendet (n = 3).
Die SEM - Bilder von dem Wulst Packungskanal entnommen nach dem Trocknen zeigen , um eine Porengröße im Bereich zwischen 60 nm, 91 nm und 170 nm, wie in Figur 4 gezeigt ist . Die Porengröße entspricht etwa 20% der Perlengrße, 300 nm, 500 nm und 900 nm, bzw. (15% des Kugeldurchmesser ist der theoretische Porengröße).

Abbildung 4. REM - Aufnahmen von selbstorganisierenden 300 nm (A), 500 nm (B) und 900 nm (C) Verpackung Perle Siliciumdioxid kolloidales. PDMS - Geräte wurden auf Objektträger aus Glas und Perlen in den Kanal unter Verwendung von Unterdruck geflogen reversibel verklebt. Nach dem Lufttrocknen der Vorrichtungen O / N wurden die PDMS-Geräte des Glases abgezogen sorgfältig und abgebildet. Diese Porengrößen geschätzt jeweils 300 nm, 500 nm und 900 nm Kügelchen 60 ± 2 91 ± 5 bis 170 ± 7 nm (n = 9). Diese Porengrößen wurden in der Nähe der theoretischen Größe, ~ 15% des Kugeldurchmesser. (Aus Lit.. 25 mit Genehmigung der Royal Society of Chemistry) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Wenn eine Spannung von 30 V über die 300 nm bead Membran Auftragen wurde eine Ionenverarmungszone in der Nähe der kolloidalen Membran in einem Mikrokanal mit einem gefüllten beobachtetfluoreszenzmarkierte DNA (Figur 5 A, B). Wenn die Spannung auf 25 V auf der linken Seite gesenkt, wurde die DNA - Moleküle in Form eines Stopfens akkumulierte und seiner Konzentration aufgrund von einer Spannungsdifferenz von 30 V - 25 V über den Probenkanal (Abbildung 5 C angetrieben elektroosmotischen Fluss erhöhte , D).

Abbildung 5. Zeitraffer Aufnahmen zeigen die Bildung eines Ionenverarmungsbereich in der Nähe der nanofluidic kolloidalen junctions in dem Kanal mit DNA (Anfangskonzentration von 10 nM) gefüllt ist . Die Ionenverarmungsbereich wurde bei t = 10 s eingeleitet und eine konzentrierte DNA - Plug bei V2 erzeugt wurde = 30 V und V1 = 25 V über den Probenkanal, während die Pufferkanäle geerdet wurden. Die gepunkteten Linien wurden verwendet, um die Kanäle Wände zu markieren. Ein Konzentrationsfaktor von ~ 1.700 Falten wurde innerhalb von 15 Minuten erreicht. ueine 300 nm kolloidale Membran singen. (Übernommen aus Ref. 25 mit Genehmigung der Royal Society of Chemistry) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Die Silica-Membranen mit einer Perlengröße von 300 nm und 500 nm den höchsten Konzentrationsfaktor bei ~ 1.700-mal für die Cy zeigte 5 markierte DNA (CAA CCG ATG CCA CAT CAT TAG CTA C) innerhalb von 15 min. (Abbildung 6 A, B). Der Polyelektrolyt-beschichtete Silica-bead-Membranen zu einer 200- bis 1000-fache Erhöhung der DNA-Konzentration nach 15 min führte. (Abbildung 6 C, D).
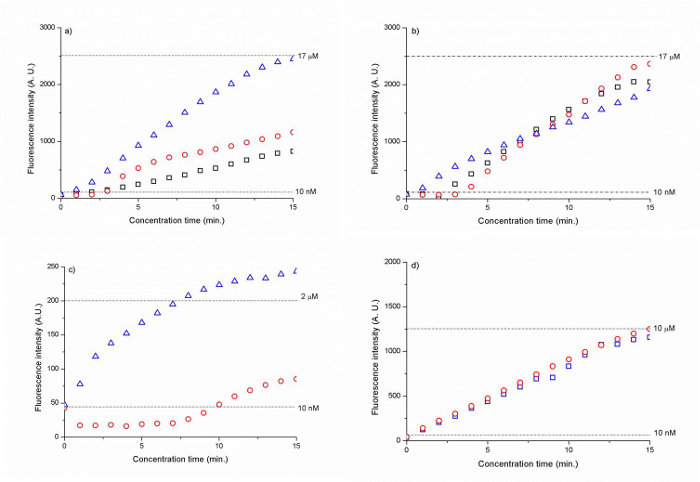
Abbildung 6 : Fluoreszenzintensität von DNA als eine Funktion der Zeit für die (A) 300 nm Silicakügelchen (B) 500 nm Siliciumdioxidperlen eind (C) 500 nm PSS beschichtetes Siliciumdioxid Amin Perlen und (D) 500 nm PAH / PSS beschichtete Silica Carboxy - Perlen. Die gepunkteten Linien stellen die Fluoreszenzsignalstärke für 10 nM (A, B, C, D), 17 & mgr; M (A, B), 2 & mgr; M (C) und 10 uM (D) DNA. Die Ergebnisse wurden gegen die Hintergrundfluoreszenz normalisiert. (Übernommen aus Ref. 25 mit Genehmigung der Royal Society of Chemistry) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
| Prozess Zeit | Etch-Modus | Passivieren Modus |
| Prozess Zeit | 6 s | 4,5 s |
| überrennen | 0,5 s | 0 s |
| Platen Generator Strom | 80 W | 60 W |
| Coil-Generator Strom | 600 W | 600 W |
| Gas | SF 6 70 sccm | C 4 8 35 sccm |
| Ätzrate | 1,47 & mgr; m / min | |
Tabelle 2. DRIE Parameter.
Diskussion
Im Anschluss an die gemeinsame Einrichtung Design-Schema zu Nanofluidik studieren, hergestellt wir eine nanofluidic Verbindung zwischen zwei mikrofluidische Kanäle unter Verwendung des Verdampfungsgesteuerten Selbstorganisation von kolloidalen Nanopartikeln statt lithographisch einer Anordnung von Nanokanälen Mustern. Wenn die kolloidalen Partikel in dem Wulst Abgabekanal fließt, einer Reihe von nanotraps mit einer Tiefe von 700 nm und einer Breite von 2 & mgr; m auf beiden Seiten des Wulstes Lieferkanal mit einer Gesamtbreite von 100 um verhinderte die Perlensuspension in die Fließen Puffer und Probenkanal aufgrund der Oberflächenspannung an der nanotraps. Einmal eingefangen, um die kolloidalen Teilchen in dem Wulst Abgabekanal gepackt schnell und bildete eine nanoporösem Übergang zwischen der Probe und der Kanalpuffer.
Es ist wichtig, die Bead-Suspension unmittelbar nach der Plasmabindungs zu laden, so dass die Kapillarkraft des Siliciumdioxids Beadsuspension bis zum Eingang des Auslasses r antreibteservoirs in dem vorübergehend hydrophilen Wulst Ausgabekanal. Um eine Luftblase blockiert die Strömung im Einlassreservoir zu verhindern, ist es sehr empfehlenswert, den Boden des Behälters mit einer Pipettenspitze zu erreichen, und lassen Sie dann die Beadsuspension in den Behälter. Im Fall der oberflächen funktionalisierten Kügelchen mit Polyelektrolyte, wurde ihre Fließfähigkeit drastisch auf die Silicabeads ohne Oberflächenfunktionalisierung reduziert verglichen und neigten dazu, leichter und sich an der Kanaloberfläche während des Abfüllprozesses zu aggregieren. Um ein Verstopfen des Kanals mit den Polyelektrolyt-beschichtete Kügelchen zu verhindern, haben wir eine Tensid, 0,05% Tween 20, auf die Kügelchensuspension. Falls es beim Befüllen ein leichtes Klopfen auf dem PDMS-Chip mit einer Pipettenspitze noch ein Verstopfungsproblem war im Allgemeinen dazu beigetragen, es zu lösen.
Auch ist es wichtig, dass die Perlensuspension wurde nicht vollständig nach der Verdampfung getrocknet, da es schwierig wäre, zu infiltrate des Wulstes Membran mit dem Natriumphosphatpuffer-Lösung wieder. Deshalb wird nach 3 h partieller Verdampfung, alle Ein- und Ausgänge des PDMS Vorrichtung wurden aufgezeichnet und aufbewahrt bei 4 ° C für die Lagerung vor der Wulst so Verpackung feucht bleibt zu verwenden. Während der preconcentration Experimente hielt der selbstorganisierenden Wulst seine strukturelle Stabilität für den größten Teil. Jedoch in einigen Fällen beobachteten wir eine Dislokation der Kügelchen, die eine fehlerhafte Packung der Kügelchen in Mikrokanälen angegeben. Die selbstorganisierende Siliciumdioxidperlen von einem Durchmesser von 900 nm bis hinunter zu 300 nm nach der Selbstorganisation kann in Abbildung 4. Die theoretischen Porengröße des Wulstes Packungs ~ 45 nm, betrug etwa ~ 15% des kolloidalen Teilchen gesehen werden Durchmesser. Wir könnten die Porengröße unter Verwendung einer SEM-Analyse bestätigt und gemessen mit einer Porengröße etwa 20% des Kugeldurchmesser nach der Verpackung.
Mit Hilfe der selbstorganisierenden 300 nm und 500 nm kolloidalen Teilchen Membranen als eine ionenselektive nanoporous Kreuzung, könnten wir Ionenverarmungsbereich bei 30 V und konzentrieren sich 10 nM Cy5 markierte DNA (CAA CCG ATG CCA CAT CAT TAG CTA C) in 1 mM Natriumphosphat-Puffer (Abbildung 5) einzuleiten. Durch kontinuierlich die DNA - Probe in Richtung der Ionenverarmungszone mit einer elektroosmotischen Flusses bei einer Spannungsdifferenz V 2 -V 1 = 5 V fließt, wir die anfängliche DNA - Konzentration von ~ 1.700 Faltungen innerhalb von 15 min erhöhen könnte. (6a, b). 500 nm Perlen robuster DNA-Konzentration als 300 nm Kügelchen erlaubt, wie in Abbildung 6b). Da die elektro Konzentration auf einem Kräftegleichgewicht zwischen der elektroosmotischen Kraft sowie die stark nichtlineare elektrophoretische Kräfte beruht, wird die sich ergebende Konzentrationsfaktor durch den Grad bestimmt , zu dem dieser Kraftausgleich während elektrokinetischer Konzentration aufrechterhalten werden kann. 27
Ein weiterer wesentlicher Vorteil der kolloidalen Teilchen bereitstellen für einen nanofluidic Kreuzung Aufbau ist die Leichtigkeit, mit der seine surface Funktionalisierung kann durchgeführt werden. Statt zunächst einen Nanokanal durch Bindung zu schaffen und dann eine Oberflächenfunktionalisierung auf sie durchgeführt wird, können wir einfach die Oberfläche außerhalb des Gerätes zuerst die kolloidalen Teilchen in einem Fläschchen funktionalisieren und sie fließen dann in den Kanal zur Selbstmontage. Basierend auf diesem Ansatz konnten wir ICP unter Verwendung der 500 nm Siliziumdioxid Amin Teilchen mit einer einzigen Schicht von PSS und 500 nm Kieselsäure Carboxy-Partikeln beschichtet mit einer Schicht aus PAH und PSS (Abbildung 6 c und d), bei niedrigeren Spannungen (8 beschichtet initiieren V und 10 V, beziehungsweise) als die kolloidalen Teilchen ohne Oberflächenfunktionalisierung (30 V). Dieses Ergebnis zeigt, dass die Oberflächenfunktionalisierung der kolloidalen Teilchen vor der Selbstorganisation wirksam war, die Oberflächenladung der kolloidalen Teilchen zu erhöhen und in höheren ICP ergab. Jedoch erhalten in Bezug auf den Konzentrator Faktor, der nanofluidic Kreuzung der Oberfläche funktionalisierten Kügelchen war weniger wirksam als die nicht-funktionalisierten siLica Perlen. Die Amin / PSS-beschichteten Kügelchen ermöglicht einen Faktor von ~ 200, während der Carboxy / PAH / PSS Wulst Membran mit einer 1000-fachen Anstieg nach 15 min zeigte. (Figur 6d). Dieses Ergebnis kann durch eine höhere Oberflächenladung der Oberfläche funktionalisiert nanopores erklärt werden, die zu einer erhöhten Länge der Ionenverarmungsbereich führte die Probenkonzentration Stecker weiter weg von der Wulst-Membran und daher zu weniger stabilen Konzentrations schieben. Wir glauben, dass von derzeit 1 mm, die Gesamtbreite der nanoporösen Membran bead Verkürzen (der Abschnitt des Wulstes Membran parallel zu den Probenkanal) könnte diese Instabilität Problem mildern. Nach unseren früheren Studie, bestimmt die Breite des nanoporösem Übergang der Menge an ionischer Strom , der durch sie. 28 ist wie die Breite zunimmt, nimmt der Ionenstrom erhöht sich, und da mehrere Kationen können durch die Membran wandern, die Verarmungslänge zunimmt und die Konzentration Steck weiter geschoben wird von der Kreuzung entfernt nanoporösem. Therefore tritt die Akkumulation in einer weniger beschränkt Weise und die Probe Stecker wird weniger stabil. Empirisch sollte die nanoporösem Übergang ~ 100-400 & mgr; m breit sein. Ein weiteres Merkmal zu verbessern war eine unzureichende Dicke der PDMS Wand von 15 & mgr; m zwischen den Probenkanal und dem Wulst Lieferung. Dieser dünne PDMS Abschnitt führte zu einer unzureichenden Bindung, die einen Ionenstrom zwischen dem Puffer und Probenkanal aktiviert. Daher handelte die gesamte Raupe Membranabschnitt parallel zur Probenkanal (1 mm Breite) als nanoporöse Kreuzung, obwohl nur 100 & mgr; m der Raupe wurde als nanoporöse Gangsmembran soll entsprechend der Gesamtbreite des nanotrap Array. Die PDMS Wandstärke sollte mindestens 25 & mgr; m oder höher sein.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde von NIH R21 EB008177-01A2 und der New York University Abu Dhabi (NYUAD) Forschungs Enhancement Fonds unterstützt 2013 Wir danken dem technischen Personal des MIT MTL für ihre Unterstützung während der Mikrofabrikations und James Weston und Nikolas Giakoumidis von NYUAD für ihre REM-Aufnahmen Unterstützung bei der Aufnahme und einen Spannungsteiler bauen sind. Die Herstellung der Vorrichtung in PDMS wurde in der Mikrokern Einrichtung von NYUAD durchgeführt. Schließlich möchten wir für Digital-Stipendium für Videoaufnahmen und Bearbeitung von Rebecca Pittam vom NYUAD-Center zu danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Poly(Styrenesulfonic Acid) Sodium Salt | Polysciences | 08772 | |
| Poly(allylamine) Solution | Sigma Aldrich | 479144-5G | |
| Silica Microsphere - 300 nm | Polysciences | 24321 | |
| Silica Microsphere - 500 nm | Polysciences | 24323 | |
| Silica Microsphere Carboxyl Functional - 500 nm | Polysciences | 24753 | |
| Silica Microsphere Amine Functional - 500 nm | Polysciences | 24756 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | ||
| Trichlorosilane | Sigma Aldrich | 175552 | |
| Ultrasonic Cleaner | Branson | 3510 | |
| Tube Rotator | VWR | 10136-084 | |
| Vortex Mixer | WiseMix | VM-10 | |
| Microcentrifuge | VWR | Micro 1207 | |
| Plasma Cleaner | Harrick Plasma | PDC-001-HP | |
| PDMS Mixer | Thinky | ARE-250 | |
| Oven | Thermo Scientific | PR305220M | |
| Epi-fluorescence Microscope | Nikon | Eclipse Ti | |
| CCD Camera | Andor | Clara | |
| Platinum Electrodes | Alfa Aesar | 43014 | |
| Source Meter | Keithley | 2400 | |
| Digital Multimeter | Extech | 410 | |
| Microscopy Glass Slides | Thermo Scientific | 2951-001 | |
| Tween 20 | Merck Millipore | 822184 | |
| Sodium chloride | Fisher Scientific | 7646-14-5 | |
| Sodium phosphate monobasic | Sigma Aldrich | 71505 | |
| Sodium phosphate dibasic | Sigma Aldrich | S3264 | |
| DNA | IDT | CAA CCG ATG CCA CAT CAT TAG CTA C | |
| B-Phycoerythrin | Life Technologies | P-800 | |
| Dynamic light scattering system for Zeta Potential Measurement | Malvern | Zetasizer Nano S | |
| Photoresist | Shipley | SPR700-1.0 | |
| Projection lithography | Nikon | NSR2005i9 | |
| Reactive Ion Etcher | Applied Materials | AME P5000 | |
| ICP deep reactive ion etcher | STS | STS-6" | |
| Contact lithography | Electronic Visions | EV620 | |
| Photoresist Coater Developer | SSI | SSI 150 | |
| Non-contact surface profiler | Wyko | NT 9800 |
Referenzen
- Mawatari, K., Kazoe, Y., Shimizu, H., Pihosh, Y., Kitamori, T. Extended-Nanofluidics: Fundamental Technologies, Unique Liquid Properties, and Application in Chemical and Bio Analysis Methods and Devices. Anal Chem. 86, 4068-4077 (2014).
- Tsukahara, T., Mawatari, K., Kitamori, T. Integrated extended-nano chemical systems on a chip. Chem Soc Rev. 39, 1000-1013 (2010).
- Mani, A., Zangle, T. A., Santiago, J. G. On the Propagation of Concentration Polarization from Microchannel-Nanochannel Interfaces Part I: Analytical Model and Characteristic Analysis. Langmuir. 25, 3898-3908 (2009).
- Aizel, K., et al. Enrichment of nanoparticles and bacteria using electroless and manual actuation modes of a bypass nanofluidic device. Lab Chip. 13, 4476-4485 (2013).
- Wang, Y. C., Stevens, A. L., Han, J. Million-fold preconcentration of proteins and peptides by nanofluidic filter. Anal Chem. 77, 4293-4299 (2005).
- Karnik, R., et al. Electrostatic control of ions and molecules in nanofluidic transistors. Nano letters. 5, 943-948 (2005).
- Mao, P., Han, J. Y. Fabrication and characterization of 20 nm planar nanofluidic channels by glass-glass and glass-silicon bonding. Lab Chip. 5, 837-844 (2005).
- Mao, P., Han, J. Massively-parallel ultra-high-aspect-ratio nanochannels as mesoporous membranes. Lab Chip. 9, 586-591 (2009).
- Balducci, A., Mao, P., Han, J. Y., Doyle, P. S. Double-stranded DNA diffusion in slitlike nanochannels. Macromolecules. 39, 6273-6281 (2006).
- Yamada, M., Mao, P., Fu, J. P., Han, J. Y. Rapid Quantification of Disease-Marker Proteins Using Continuous-Flow Immunoseparation in a Nanosieve Fluidic Device. Anal Chem. 81, 7067-7074 (2009).
- Huh, D., et al. Tuneable elastomeric nanochannels for nanofluidic manipulation. Nat Mater. 6, 424-428 (2007).
- Chung, S., Lee, J. H., Moon, M. W., Han, J., Kamm, R. D. Non-lithographic wrinkle nanochannels for protein preconcentration. Adv Mater. 20, 3011-3016 (2008).
- Park, S. M., Huh, Y. S., Craighead, H. G., Erickson, D. A method for nanofluidic device prototyping using elastomeric collapse. Proc Natl Acad Sci. 106, 15549-15554 (2009).
- Zeng, Y., Harrison, D. J. Self-assembled colloidal arrays as three-dimensional nanofluidic sieves for separation of biomolecules on microchips. Anal Chem. 79, 2289-2295 (2007).
- Malekpourkoupaei, A., Kostiuk, L. W., Harrison, D. J. Fabrication of Binary Opal Lattices in Microfluidic Devices. Chem Mat. 25, 3808-3815 (2013).
- Merlin, A., Salmon, J. -. B., Leng, J. Microfluidic-assisted growth of colloidal crystals. Soft Matter. 8, 3526-3537 (2012).
- Schepelina, O., Zharov, I. PNIPAAM-modified nanoporous colloidal films with positive and negative temperature gating. Langmuir. 23, 12704-12709 (2007).
- Schepelina, O., Zharov, I. Poly(2-(dimethylamino)ethyl methacrylate)-Modified Nanoporous Colloidal Films with pH and Ion Response. Langmuir. 24, 14188-14194 (2008).
- Smith, J. J., Zharov, I. Ion transport in sulfonated nanoporous colloidal films. Langmuir. 24, 2650-2654 (2008).
- Gaspar, A., Hernandez, L., Stevens, S., Gomez, F. A. Electrochromatography in microchips packed with conventional reversed-phase silica particles. Electrophoresis. 29, 1638-1642 (2008).
- Lee, S. Y., et al. High-Fidelity Optofluidic On-Chip Sensors Using Well-Defined Gold Nanowell Crystals. Anal Chem. 83, 9174-9180 (2011).
- Hu, Y. L., et al. Interconnected ordered nanoporous networks of colloidal crystals integrated on a microfluidic chip for highly efficient protein concentration. Electrophoresis. 32, 3424-3430 (2011).
- Zhang, D. -. W., et al. Microfabrication-free fused silica nanofluidic interface for on chip electrokinetic stacking of DNA. Microfluid Nanofluid. 14, 69-76 (2013).
- Syed, A., Mangano, L., Mao, P., Han, J., Song, Y. A. Creating sub-50 nm nanofluidic junctions in a PDMS microchip via self-assembly process of colloidal silica beads for electrokinetic concentration of biomolecules. Lab Chip. 14, 4455-4460 (2014).
- Kim, S. J., Song, Y. A., Han, J. Nanofluidic concentration devices for biomolecules utilizing ion concentration polarization: theory, fabrication, and applications. Chem Soc Rev. 39, 912-922 (2010).
- Fu, J. P., Mao, P., Han, J. Y. Continuous-flow bioseparation using microfabricated anisotropic nanofluidic sieving structures. Nat Protoc. 4, 1681-1698 (2009).
- Plecis, A., Nanteuil, C., Haghiri-Gosnet, A. M., Chen, Y. Electropreconcentration with Charge-Selective Nanochannels. Anal Chem. 80, 9542-9550 (2008).
- Ko, S. H., et al. Nanofluidic preconcentration device in a straight microchannel using ion concentration polarization. Lab Chip. 12, 4472-4482 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten