Method Article
콜로이드 입자의 자기 조립 과정을 통해 PDMS 미세 유체 칩의 하위 50 Nm의 나노 유체 접합 만들기
요약
We propose a simple self-assembly technique of silica colloidal nanoparticles to create a nanofluidic junction between two microchannels in polydimethylsiloxane (PDMS). Using this technique, a nanoporous bead membrane with a pore size down to ~45 nm was built inside a microchannel and applied to electrokinetic preconcentration of DNA samples.
초록
폴리 디메틸 실록산 (PDMS)의 성형으로 인해 결합의 용이성뿐만 아니라 투명성 마이크로 유체 장치를 만드는 일반적인 건축 재료이다. 때문에 PDMS 재료의 부드러움, 그러나 나노 채널을 구축 PDMS를 사용하기 어려운 것이다. 채널 플라즈마 본딩시 쉽게 붕괴되는 경향이있다. 본 논문에서는 하위 50 개의 마이크로 사이에 기공 나노와 나노 유체 접합을 만들 수있는 실리카 콜로이드 나노 입자의 증발 중심의 자기 조립 방법을 제시한다. 기공 크기뿐만 아니라 나노 유체 접합 표면 전하 단순히 자기 조립 공정 전에 바이알 조립 미세 유동 장치의 외부 콜로이드 실리카 비드 크기 및 표면 작용을 변화시킴으로써 튜닝된다. 300 내지 500 나노 미터, 900 나노 미터의 비드 크기를 갖는 나노 입자의 자기 조립 (self-assembly)을 사용하여, 각각의 기공 (45) 내지 ~의 크기, ~ 75 nm이고, ~ 135 nm의 다공질 막을 제조하는 것이 가능했다. 전기에서알 전위 양이온 - 선택성 막으로서,이 나노 다공성 막을 개시 이온 농도 분극 (ICP) 작용을 15 분 이내에 ~ 1,700 배까지 농축하는 DNA. 이 아닌 나노 리소그래피 처리는 PDMS 마이크로 유체 칩 내부 이온 및 분자의 나노 전송 프로세스 연구를위한 가변 나노 유체 접합을 구축하기 위해 새로운 기회를 열어.
서문
10 2 나노 - Nanofluidics 10 (1)의 길이 규모에서 생물학적 과정 또는 이온의 수송 현상과 분자를 연구하는 μ의 TAS의 새로운 연구 영역 (마이크로 총 분석 시스템)입니다. 필요한 경우 이러한 나노 채널과 나노 유체 도구의 출현으로, 분자 및 이온의 수송 과정은 분리 및 검출이 길이 규모에서 사용할 수있는 기능을 이용하여, 전례없는 정밀도로 모니터링 및 조작 할 수 있습니다. 1, 2 분의 이러한 특성 나노 기능 전하 불균형을 일으켜 나노 채널 및 마이크로 채널 사이의 이온 농도 분극 (ICP)를 개시 할 수있는 나노 채널 벌크 전하 (또는 Dukhin 번호) 표면에 높은 비율이다. (3)
나노 유체 현상의 연구를위한 일반적인 장치 플랫폼은 접합 등의 나노 채널의 배열에 의해 연결된 두 개의 마이크로 시스템으로 구성되어 있습니다. 4-6 이러한 나노 유체 장치를 구축하기위한 선택의 재료로 인해 접합 과정에서 붕괴 채널을 방지 높은 강성의 실리콘이다. 7 그러나, 실리콘 소자 제조 비싼 마스크와 클린 룸 시설에서 처리 상당한 양을 필요로한다. 8 때문에 성형 플라즈마 본딩, 폴리 디메틸 실록산 (PDMS)을 통해 장치의 제조의 편의 10 널리 마이크로 유체 용 건축 재료로서 허용되었으며 그것뿐만 아니라 nanofluidics 이상적인 물질 일 수있다. 그러나, 낮은 영률 360-870 KPa가 주위 플라즈마 본딩 동안 PDMS 채널을 쉽게 접을 수있다. 나노 채널의 깊이는 100 nm의 아래해야 할 경우 표준 포토 리소그래피 기술을 통해 PDMS 소자의 제조는 채널 폭을 요구하는 매우 어려운 될 것이라는 것을 의미 1 : 나노 채널 (깊이와 넓이)의 최소 종횡비는 10 미만이어야 포토리스의 전류 한계 이하에서 약 1 μm의 ography. 이러한 한계를 극복하기 위해, 플라즈마 처리 후 78 내지 11 또는 형성하는 주름의 평균 깊이와 크랙을 개시 연신 비의 리소그래피 방법을 이용하여 PDMS의 나노 채널을 생성하기위한 시도가 있었다. (12)이 기계적 압력 PDMS 채널 수 붕괴 60 나노 미터의 낮은 나노 채널의 높이입니다. (13)
이러한 고도로 발명 비 리소그래피 방법 깊이 100nm로 이하 건물 나노 채널을 허용하더라도, 나노 채널 제작의 치수 제어 성이 여전히 나노 유체 장치 등의 건축 재료 PDMS의 광범위한 수용을 장애가된다. 나노 채널의 또 다른 중요한 문제는, 실리콘 또는 PDMS 여부에 이온 또는 분자의 조작에 대한 채널 벽면의 표면 전하를 변경할 필요가있는 경우에, 표면 기능화된다. 결합을 통해 장치 조립 후, 나노 채널은 매우 어렵다때문에 확산 제한 전송에 표면 기능화 도달. 높은 치수 정확도 및 용이 한 표면 기능화와 나노 스케일 채널을 생성하기 위해 마이크로 유체 소자에 증착 14-16에 의한 콜로이드 입자의 자기 조립 방법은 유망한 접근 방법 중 하나가 될 수있다. 기공 크기 및 표면 특성의 제어 외에, 튜닝 가능성은 온도 17의 pH, 18, 19 및 이온 세기를 조절함으로써 고분자 전해질로 코팅 된 콜로이드 입자를 사용하여 반응계 공극의 크기도있다.이 때문에 이러한 18 electrochromatography 20 바이오 센서 21 단백질 농도 22 마이크로 유체 단백질 및 DNA의 분리. 14,23 본 연구에 대한 장점, 콜로이드 입자의 자기 조립 방법은 아직 발견 애플리케이션, 우리는 구축이 자기 조립 방법을 배포 에서 동 전기 농축 장치이 마이크로 나노 유체 간의 접합을 필요 PDMS. 24 기적 농도 뒤에 기본적인 메커니즘은 이온 농도 분극 (ICP)에 기초한다. 제조 및 조립 단계 (25)의 상세한 설명은 다음의 프로토콜에 포함된다.
프로토콜
실리카 콜로이드 비드 정학 1. 준비
- 300 nm 내지 500 nm의 실리카 비드 현탁액의 제조
- 소용돌이 30 초 동안 실리카 비드 재고 서스펜션 (w 10 % / 물 V). 균일 한 현탁액을 얻었다. 1 분 동안 2,600 XG에 1.5 ML 튜브와 원심 분리기를에 600 ㎕의 재고 현탁액의 총을 피펫.
- 1 mM의 인산 나트륨 완충액 (PB, pH를 7.0) 400 μL로 뜨는을 대체합니다.
- 텍싱 통해 pH가 7.0에서 1 mM의 인산 나트륨 용액 15 %의 최종 농도로 실리카 비드를 일시.
- 폴리와 표면 기능화 500nm의 실리카 비드 카르복실기 (알릴 아민 염산염, PAH), 폴리로 (소듐 스티렌 설포 네이트, PSS) 고분자 전해질
- 1 %를위한 10 ml의 1 M의 NaCl (PH 7.0) (w / v)의 비드 서스펜션이 장착 된 카르복실기 500 nm의 실리카 비드의 0.1 g을 일시 중단합니다.
- 1 M NAC 0.4 % PAH (MW 65K)를 준비1 M NaCl을 15 mL의 원액을 300 μL (20 % w / 물 V)를 용해시켜 L. 20 ㎖의 1 M NaCl 용액에 0.18 g의 PSS를 용해시켜 1 M NaCl 용액에 0.9 % PSS (MW 70K)를 준비한다. 소용돌이 모두 1 분을위한 솔루션을 제공합니다. 완전히 고분자 전해질을 용해한다.
- 카복실 작용기를 갖는 실리카 비드에 양전하 고분자 전해질 층을 증착하기 위해 15 ㎖의 튜브에 1 % 실리카 카복실 비드 9.8 ml의 PAH 용액 200 μL를 추가한다. 1 분 동안 비드 현탁액을 소용돌이. 60 분 동안 튜브 회전에 품어. RT에서.
- 1 분 동안 1,801 XG에서 비드 현탁액을 원심 분리기. 10 mL의 탈 이온수와 바인드 PAH 다섯 번 씻어. 각 원심 분리하고 상청액을 제거한 후, 비드 조밀 튜브의 하단에 충전 하였다. 비드를 재현 탁하고, 다음 원심 분리 단계에 앞서 씻어되도록 DI 물 8 ml를 첨가하기 전에 DI 물 2 ㎖와 함께 강하게 피펫 팅 비드 덩어리를 방해.
- 따르다PSS 코팅 1.2.3과 1.2.4의 단계는 구슬에 음전하 층을 증착한다. PSS 증착하기 전에 1.2.4의 5 번째 세척 단계에서 DI 물 상층 액을 제거한 후 1 M NaCl을 9.8 ml의 구슬을 다시 일시 중지합니다.
- 15 ML 튜브의 하단에있는 구슬 덩어리를 분해 한 후 1 M NaCl을 8 ml에 추가 1 M NaCl을 2 ㎖를 사용하여 동일한 활발한 피펫 팅 단계를 사용합니다. 하나의 PAH 층 증착 된 실리카 비드의 9.8 ml의 PSS 용액 200 μl를 추가합니다. 1 분 동안 텍싱 후. 60 분 동안 배양. 튜브 회전에, DI 물 5 세척 단계를 반복합니다.
- 올바르게 수행 된 고분자 전해질 증착 과정을 확인 제조자 프로토콜에 따라 동적 광산란 장치를 이용하여 각각의 고분자 전해질 코팅 전후의 비드의 제타 전위를 측정한다 (표 1 참조).
- 단일 PSS 층 다음 DI 워터와 다섯 세척 단계를 반복합니다증착 및 0.05 % 트윈 20 종래의 유동성을 향상시키기 위해 미세 유체 소자에 사용하는 (V / w 15 %)와 1 mM의 인산 나트륨 완충액 650 μL의 비드를 재 - 보류.
- PSS의 단일 층을 증착하는 아민 작용기 500 나노 실리카 비드를 위해 1.2.6에 1.2.5에서 위에서 설명한 절차를 따르십시오.
PDMS 미세 유체 칩의 제조 (2)
- 실리콘 마스터의 미세
- 다음과 같은 미세 가공 기술을 이용하여 PDMS 성형 용 실리콘 마스터를 제작.
- 스핀 코팅 실리콘 웨이퍼 상에 4000 rpm에서 1 μm의 얇은 포토 레지스트. 패턴 투영 노광 (노광 시간 170 밀리 초). 700 nm의 깊이와 2 ㎛ 폭 평면 나노 채널 에칭을 이용하여 층을 반응성 이온 에칭 (실리카 비드 nanotraps 역할).
- CHF 3 (45 SCCM : 3.5 ㎚ / (S)의 에칭 율을 달성하기 위해 다음의 에칭 파라미터를 사용하여), CF 4 (15 SCCM), 아르곤 (100 SCCM), 압력 100 mTorr로, RF 전력 200 W.
- 스핀 코트 제 1 μm의 두께 포토 레지스트 2,000 rpm에서 층과 이전 패턴 nanotraps에 정렬을 수행합니다. 마이크로 콘택트 리소그래피를 통해 실리콘 깊은 반응성 이온 에칭 (DRIE)에 의해 패턴. DRIE는 표 2에 26 매개 변수 사용합니다.
- 다음과 같은 미세 가공 기술을 이용하여 PDMS 성형 용 실리콘 마스터를 제작.
- PDMS 몰드의 제조
- 진공 항아리 O의 / n에서 트리클로로 실란 (50 μL)와 실리콘 마스터를 silanization합니다.
주의 : Tricholorosilane는 독성 및 부식성 물질이다. 항상 적절한 개인 보호 장비와 화학 후드에서 사용. - 10 경화제베이스 믹스 : 실란 실리콘 마스터 1의 비율로 주조 PDMS 및 대류 오븐에서 2 시간 동안 70 ° C에서이를 경화.
- PL 후 플라즈마 세정기를 사용하여 빈 웨이퍼에 칼 플라즈마 결합 그것으로 실리콘 마스터에서 PDMS의 슬래브를 제거1 분 동안 플라즈마 클리너에 ASMA 처리. 단계를 캐스팅 다음 PDMS에 대한 파티션 라인을 표시하는 가장자리를 따라 테이프를 부착합니다.
- 트리클로로 실란 (50 μL) O / N과 진공 항아리에 PDMS 금형을 silanization합니다.
- PDMS 캐스트 (베이스 : 1 비율 : 10 경화제) 실란 PDMS 몰드와 대류 오븐에서 2 시간 동안 70 ° C에서이를 경화.
- 진공 항아리 O의 / n에서 트리클로로 실란 (50 μL)와 실리콘 마스터를 silanization합니다.
- PDMS 소자의 제조
- 테이프로 표시된 분할 선을 따라 PDMS 금형에서 경화 된 PDMS의 슬래브 떼어.
- 테이프 깨끗한 1.5 mm 생검 펀치와 펀치 구멍 저장조, 이소 프로필 알콜 (IPA) 및 건조 질소로 씻어.
- 플라즈마 본드 1 분 동안 플라즈마 세정기의 플라즈마 처리 후의 25mm X 75mm 현미경 유리 슬라이드에 PDMS 소자.
- 초음파 처리 60 분 비드 서스펜션. 충전에 초음파 목욕 전에. 10 μl의 비드 현탁액을 피펫 (300 nm의 비 기능화 된 실리카는 수광고 또는 PAH-PSS 층과 500 nm의 실리카 카복실 비드, 또는 흡입구 (4) 및 (6)에 PSS 층과 500 nm의 실리카 아민 비즈) 각각 (도 1 A, B) 바로에 PDMS 칩 플라즈마 본딩 후 볼 유리 기판. 비드 포장을 향상시키기 위해 피펫 팁과 PDMS 칩에 부드럽게 누릅니다.
- 비드 전달 채널을 충전 한 후, 테이프 1과 9 제외한 모든 입구를 다룹니다. . 사용하기 전에 4 ° C에서 3 시간 및 저장을위한 장치를 공기 - 건조 2 콜로이드 자기 조립 과정을 단계별로 개략적 도표를 제공.
DNA의 동 전기 농도 3. 실험
- 저수지 3, 7 완충 용액 (1 mM의 PB의 10 μL) 및 저장 (5) DNA 샘플 (1 mM의 PB 10 nM의 10 μl를) 작성 및 저수지 2 역 피펫 팁과 부드러운 음의 압력을 , 8, 10 참조 (거품없이 솔루션 채널을 채우기 위해 그림 1B).
- 압력 균형을 5 분 동안 기다려야 10 리저버 저장조 (2)와도 8 및 10 나노 DNA 10 ㎕를 1 mM의 PB 10 μL를 추가한다. 평형에 도달합니다.
- 저장조 3, 5, 7, 10 편에 와이어를 삽입한다.
- 소스 미터 및 Pt 와이어에 연결된 전압 분배기를 이용하여 나노 유체 접합부를 가로 질러 전압을인가한다. 우선 저수지 5, 저수지 3, 7, 10 및 GND에 30 V를 적용합니다.
- ~ 30 초 후 저수지 (10)에 25 V의 전압을 낮 춥니 다.
- DNA의 형광 신호를 기록 할 때 샘플의 광표백을 최소화하기 위해 매 5 년주기의 개구와 기계적 셔터를 사용한다.
결과
두 마이크로 간의 자기 조립 된 나노 유체 접합을 포함 PDMS에 집중 기적 칩)는도 1a에 도시된다. 장치의 중앙 채널은 50 ㎛ 폭 비드 전달 채널 (도 1b)을 통해 DNA 시료 용액으로 채워지고 양쪽에 각각 2 완충액 채널 어귀된다. 실리카 콜로이드 현탁액 샘플 완충액 나노 유체 채널 간의 접합을 만들 즉시 플라즈마 본딩 후 비드 전달 채널로 유입된다. 깊은 700 nm의 2 ㎛ 폭 나노 채널로 구성된 nanotrap 배열은 트랩 콜로이드 입자를 사용한다. 비접촉 표면 프로파일 얻어 그 스캔 이미지)는도 1c에 도시되어있다. 증발시킨 후, 콜로이드 비드 막)은도 1d에 도시되어있다. 그림 1E의 SEM)은 실리카 비드 트랩을 보여줍니다비드 전달 채널로부터 샘플 채널 분리 nanotrap 평면 어레이에서 PED. 300 nm의 실리카 비드 포장은 높은 농도의 동작 (그림 1 층)의 변화를 일으킬 수있는 몇 가지 사소한 결함이 육각형 포장을 주문을 보여줍니다. 그 크기와 PDMS 집중 칩의 디자인은 찾을 수 있습니다 여기 및 보조 파일에.

통합 하위 50 nm의 나노 다공성 접합와 PDMS 그림 1. 미세 유체 집중. (A) PDMS 집중 장치의 사진입니다. 샘플 완충액 채널 사이 비드 전달 채널과 상기 마이크로 나노 유체 장치 (B) 회로도. 전압은 샘플 채널 완충액 CH 사이 비드 세포막을 가로 질러인가annels. 2 ㎛의 폭과 700 nm의 깊이와 PDMS의 nanotrap 배열의 (C) 표면 프로파일. 증발시킨 후 비드 전달 채널 내부 콜로이드 입자 어셈블리 장치 (D) 현미경 사진. (E) 주사 전자 샘플 사이 nanotrap 어레이로 자기 조립 300 nm의 콜로 이달 실리카 입자의 현미경 사진 채널 버퍼. 300 nm의 구슬은 표면 장력에 의한 nanotraps의 입구에 갇혀있다. (F)은 육방 증발시킨 후 비드 전달 마이크로 내부 300nm의 실리카 비드를 충전. (참조에서 적응. 화학의 왕립 학회의 허가 25)를 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
PDMS의 concentrato위한 미세 공정 개략도R 장치가도 2에 도시되어있다. PDMS 장치하려면 두 PDMS 캐스트 요구된다. PDMS 농축기에서 비드 충전 공정은도 3에 도시되어있다. 미세과 충전 공정을위한 정보는 프로토콜에서 찾을 수있다. 없이 고분자 전해질로 코팅 된 실리카 비드의 제타 전위를 표 1에 나타낸다.
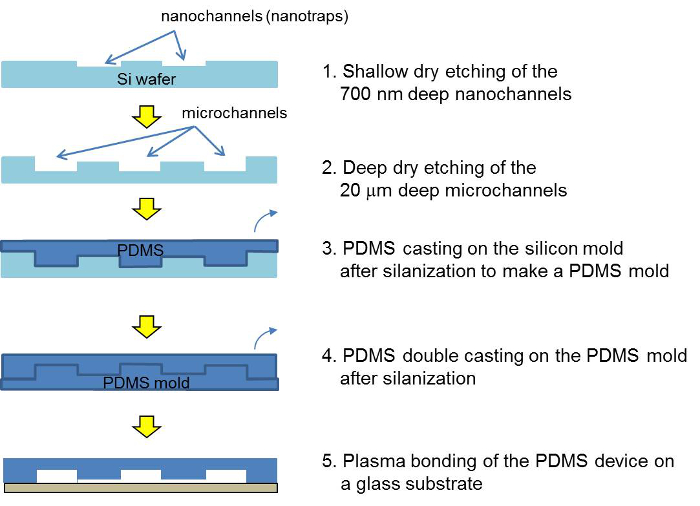
실리콘 마스터 PDMS 마스터와 PDMS 집중 장치의 제조 공정도 2 개략도. 두 개의 포토 리소그래피 단계 및 에칭 후에 실리콘 마스터 PDMS로 캐스팅된다. 이중 성형 후, PDMS 장치는 플라즈마 결합을 통해 조립 및 비드 서스펜션 가득합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

콜로이드 실리카 비드의 자기 조립을위한도 3 단계별 개략도. 비드 현탁액 10 μL 즉시 플라즈마 처리 후의 비드 전달 채널에 피펫 팅 하였다. 비드 전달 채널이 충전되자 개의 유입구 1-9 제외한 모든 테이프를 사용하기 전에 3 시간 동안 건조 장치 공기로 덮었다. (참고로 재현. (25) 화학의 왕립 학회의 허가) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 콜로이드 입자 (500 ㎚) | 제타 전위 (MV) |
| 규토 | -2.04 |
| 실리카 아민 | 19.6 |
| 실리카 카르 복실 | -19.73 |
| 실리카 Carboxyl, PAH 코팅 | 31.8 |
| 실리카 카르복실기, PAH, PSS 코팅 | -28.5 |
| 실리카 아민, PSS 코팅 | -31.2 |
25 ° C에서 실리카 비드 표 1. 제타 전위. 0.1 %는 (W / V)의 콜로이드 용액을 측정 하였다 (N = 3).
도 4에 도시 된 바와 같이 건조 후 비드 포장 채널에서 찍은 SEM 이미지는 60 내지 91 nm 내지 170 nm의 사이의 범위의 기공 크기를 나타낸다. 공경 비드 크기의 약 20 %, 300 내지 500에 대응 nm 내지 900 nm의 각각 (비드 직경의 15 %는 이론적 기공 크기이다).

도 4 자기 조립 300nm의 (A)의 500 nm의 SEM 이미지 (B) 및 900 nm의 (C), 콜로이드 실리카 비드 포장. PDMS 소자는 가역적 부압을 이용하여 상기 채널에 유입 된 유리 슬라이드 비드에 결합시켰다. 풍건 장치 O / N은 PDMS 장치 신중 유리 박리 결상시킨 후. 이러한 기공 크기는 60 ± 2로 추정 된 91 ± 5 각각 300 내지 500 nm 내지 900 nm의 비드 170 ± 7 내지 (N = 9). 이러한 기공 크기는 비드 직경 ~ 15 %, 이론적 크기로 확대 하였다. (참조에서 적응. 화학의 왕립 학회의 허가 25)를 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
300 나노 비드 세포막 30 V의 전압을인가하면, 이온 공핍 영역은 마이크로 채널을 가득 내부 콜로이드 막 근처 관찰형광 표지 된 DNA (그림 5 A, B). 왼쪽에 25 V로 전압을 강하 할 때, DNA 분자는 플러그 형태의 축적 농도는 샘플 채널을 통해 30 V- 25 V의 전압 차에 의해 구동되는 전기의 흐름 (도 5 C로 인해 증가있어 , D).

도 5 시간 경과 현미경은 DNA (10 nM의 초기 농도)로 채워진 채널 나노 유체 콜로이드 접합부 근처 이온 고갈 영역의 형성을 나타낸다. 이온 공핍 영역은 t = 10 초 및 농축 DNA 플러그에서 시작된 V2에서 생성 된 것은 30 V를 = 샘플 채널을 통해 V1 = 25 V 버퍼 채널을 접지 동안. 점선은 채널의 벽을 강조하기 위해 사용되어왔다. ~ 1700 접기 집중 계수는 15 분 이내에 달성되었다. 유300 nm의 콜로이드 막 노래. (참고로 재현. (25) 화학의 왕립 학회의 허가) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
사이클 5 ~ 1,700 배 높은 농도 계수를 보였다 내지 300 nm 내지 500의 비드 크기를 갖는 실리카 멤브레인을 15 분 이내에 DNA (CAA CCG ATG CCA CAT 고양이 TAG CTA C)를 태그. (그림 6 A, B). 고분자 전해질 피복 된 실리카 비드 멤브레인을 15 분 후의 DNA 농도가 200 ~ 1,000 배까지 증가되었다. (그림 6 C, D).
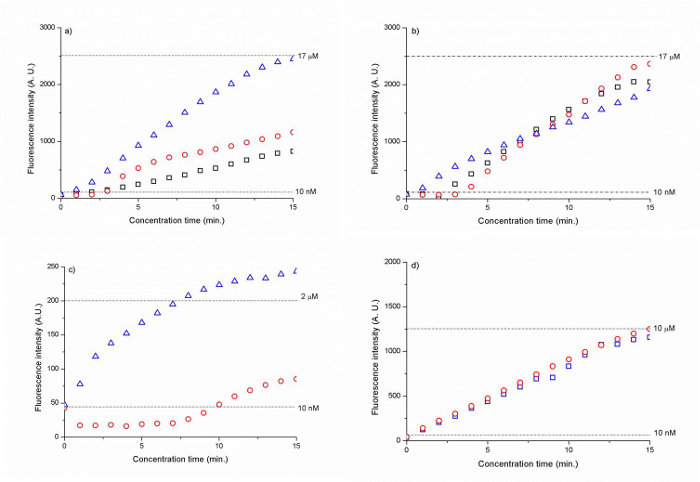
(A) 300 nm의 실리카 비드 (B) 500 nm의 실리카 비드에 대한 시간의 함수로서도 6 DNA의 형광 강도(D) (C) 500 nm의 PSS 피복 실리카 아민 구슬 및 (D) 500 nm의 PAH / PSS 피복 실리카 카복실 구슬. 점선은 10 nM의 (A, B, C, D), 17 μM위한 형광 신호 강도 레벨을 나타내는 (A, B), 2 μM (C), 10 μM (D) DNA. 결과는 배경 형광에 대하여 정규화되었다. (참고로 재현. (25) 화학의 왕립 학회의 허가) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 처리 시간 | 에칭 모드 | 보호 모드 |
| 처리 시간 | 6의 | 4.5의 |
| 오버런 | 0.5 초 | 0의 |
| 플래 튼 발전기 전원 | 80 W | 60 W |
| 코일 발전기 전원 | 600 W | 600 W |
| 가스 | SF 6 70 SCCM | C 4 F 8 35 SCCM |
| 에칭 속도 | / 분 1.47 μm의 | |
표 2. DRIE 매개 변수를 설정합니다.
토론
nanofluidics을 연구 일반 기기 설계 방식에 따라, 우리는 나노 채널의 어레이를 패터닝하는 리소그래피 콜로이드 성 나노 입자의 증착 구동 자기 조립을 사용하는 대신 두 개의 미세 채널에서 나노 유체 사이의 접합을 제작. 비드 전달 채널, 700 nm의 깊이가 100 ㎛의 전체 폭에 비드 전달 채널의 양쪽에 2 ㎛의 폭 nanotraps의 배열 콜로이드 입자를 흐르는 경우에 흐르는 비드 현탁액을 방지 인해 nanotraps에서 표면 장력 채널 버퍼 샘플. 일단 빠르게 비드 배달 채널에 포장 콜로이드 입자를 포집 및 샘플 사이의 나노 다공성 접합을 형성하고 채널 버퍼.
모세관 력이 배출구 (R)의 입구 실리카 비드 현탁액을 구동 있도록 플라즈마 본딩 직후의 비드 현탁액을로드하는 것이 중요일시적으로 친수성 비드 전달 채널에 eservoirs. 입구 저수지 흐름을 차단하는 공기 방울을 방지하기 위해, 높은 피펫 팁 저장조의 바닥에 도달 한 후 저장고에 비드 현탁액을 해제 할 것을 권장한다. 고분자 전해질과 표면 기능화 비드의 경우, 그 유동성이 크게 작용하지 않고, 표면 실리카 비드에 비해보다 쉽게 응집 및 충전 과정 동안 채널 표면에 부착하는 경향을 감소시켰다. 고분자 전해질 피복 비즈 채널의 막힘을 방지하기 위해, 우리는 비드 현탁액에, 트윈 20, 0.05 %의 계면 활성제를 첨가. 경우 아직 작성 중에 막힘 문제가 있었다, 피펫 팁과 PDMS 칩에 부드러운 도청은 일반적으로 그것을 해결하는 데 도움이.
또한,이 INF 어려울 것이기 때문에 비드 현탁액을 완전히 증발시킨 후에 건조하지 않은 것이 중요다시 인산 나트륨 완충액으로 비드 막을 iltrate. 따라서, 부분적으로 증발 3 시간 후, 모든 IN- 및 PDMS 소자의 출구 녹화하고 비드 포장 촉촉한 유지하므로 사용 전에 저장 4 ℃에서 보관. 농축 실험 동안, 자기 조립 비드 대부분의 구조적 안정성을 유지 하였다. 그러나, 몇 가지 경우에, 우리는 마이크로 채널에서 구슬의 결함 포장을 나타내는 구슬의 전위를 관찰했다. 다운 자기 조립 후 300 내지 900 nm의 직경에서부터 자기 조립 실리카 비드는도 4 비드 포장했다 ~ 45 nm 인 이론적 기공 크기의 콜로이드 입자의 약 ~ 15 % 알 수 직경. 우리는 SEM 분석을 이용하여 세공 직경을 확인하고, 포장 후 약 비드 직경의 20 %의 기공 크기를 측정 할 수있다.
NA로 자기 조립 300 nm 내지 500 nm의 콜로이드 입자를 사용하여 멤브레인을 이온 선택성noporous 접합, 우리는 30 V에서 이온 고갈 영역을 초기화 내지 10㎚ Cy5에 1 mM의 인산 나트륨 완충액에서 DNA (CAA CCG ATG CCA CAT 고양이 TAG CTA C)를 태그 (도 5)를 농축 할 수있다. 연속적으로 전압 차 V = 5 V 2 -V 한 우리는 15 분 이내에 ~ 1,700 접힘에 의해 초기 DNA 농도를 증가시킬 수에 전기 흐름 이온 공핍 영역을 향해 DNA 샘플을 흘려. (도 6a, b). 도 6B)에 나타낸 바와 같이 500 nm의 비드는 비드가 300nm보다 강력한 DNA 농도를 허용했다. 기적 농도는 전기의 힘과 높은 비선형 전기 힘과 힘의 평형에 기초하기 때문에, 결과적인 집중 계수는이 힘의 평형 농도가 기적 동안 유지 될 수있는 정도에 따라 결정된다. (27)
나노 유체 접합을 구축하기위한 콜로이드 입자를 배포하는 또 다른 중요한 장점은 SURFAC과 용이성전자 작용이 수행 될 수있다. 대신 제 1 본딩을 통해 나노 채널을 생성 한 다음에 표면 기능화를 수행하는, 우리는 단순히 첫 번째 장치의 외부 유리 병의 콜로이드 입자를 기능화 표면 수 후 자기 조립을위한 채널로 흐름. 이 방법에 기초하여, 우리는 (낮은 전압에서 PAH와 PSS (도 6 C 및 D)의 층으로 코팅 PSS의 단일 층 및 500nm의 실리카 카복실 입자로 코팅 된 500 nm의 실리카 아민 입자를 사용하여 8 ICP를 시작할 수도 V 및 표면 기능화 (30 V)없이 콜로이드 입자보다 10 V, 각각). 이 결과는 자기 조립에 앞서 콜로이드 입자의 표면 기능화 콜로이드 입자의 표면 전하를 증가시키는 것이 효과적이라는 높은 ICP 결과 보여준다. 그러나, 수득 된 농축 계수의 관점에서, 표면 기능화 된 비드의 나노 유체 접합부 비 관능 실리콘보다 덜 효과적이었다lica 구슬입니다. 카르복실기가 / PAH / PSS 비드 막을 15 분 후 1000 배의 증가를 보였다 아민 / PSS 코팅 비드 ~ 200의 인자 할 수 있었다. (그림 6D). 이 결과, 적은 안정된 농도 멀리 비드 막으로부터 따라서 시료 농도 플러그를 밀어 이온 공핍 영역의 증가 된 길이에지도 표면 기능화 된 나노 기공의 높은 표면 전하에 의해 설명 될 수있다. 현재는 1mm (샘플 채널 비드 막 평행 부)에서 비드 나노 다공성 막의 전체 폭을 짧게하는 것은이 불안정 문제를 완화시킬 수 있다고 믿는다. 이전의 연구에 따르면, 나노 다공성 접합부의 폭. 그것을 통해 폭 증가 이온 전류가 증가함에 따라 (28)을 이온 통과하는 전류의 양을 결정하고, 더 양이온 막 공핍 길이가 증가하고 농도 플러그를 통해 이전 할 수 있기 때문에 더 멀리 나노 다공성 접합에서 푸시됩니다. 티herefore, 축적 덜 제한된 방식으로 발생하는 샘플 플러그 덜 안정된다. 경험적으로, 나노 다공성 접합 폭 ~ 100-400 μm의이어야한다. 개선하는 또 다른 특징은 샘플 채널과 비드 (15) 사이에 전달 ㎛ 인 PDMS 벽의 두께가 불충분했다. 이 얇은 PDMS 섹션은 버퍼와 샘플 채널 사이의 이온 전류를 사용 불충분 한 결합되었다. 따라서, 샘플 채널 전체 비드 막 부 평행 (폭 1mm)은 나노 다공성 접합 역할에도 비드의 100 ㎛의은 nanotrap 어레이의 전체 폭에 따른 나노 다공성 접합 막을 마련되었지만. PDMS 벽 두께가 적어도 25 ㎛의 이상이어야한다.
공개
The authors have nothing to disclose.
감사의 말
이 작품은 NIH R21 EB008177-01A2 뉴욕 대학 아부 다비 (NYUAD) 연구 증진 기금 2013 년 우리는 미세 동안 그들의 지원을위한 MIT MTL의 기술 직원에 대한 우리의 감사를 표현하고 제임스 웨스턴과를위한 NYUAD의 니콜라스 Giakoumidis에 의해 지원되었다 SEM의 사진을 찍고 각각 전압 분배기를 구축을 지원합니다. PDMS의 디바이스 제조가 NYUAD의 미세 코어 시설에서 실시되었다. 마지막으로, 우리는 비디오 촬영 및 편집을위한 디지털 장학금 NYUAD 센터에서 레베카 Pittam에게 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| Poly(Styrenesulfonic Acid) Sodium Salt | Polysciences | 08772 | |
| Poly(allylamine) Solution | Sigma Aldrich | 479144-5G | |
| Silica Microsphere - 300 nm | Polysciences | 24321 | |
| Silica Microsphere - 500 nm | Polysciences | 24323 | |
| Silica Microsphere Carboxyl Functional - 500 nm | Polysciences | 24753 | |
| Silica Microsphere Amine Functional - 500 nm | Polysciences | 24756 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | ||
| Trichlorosilane | Sigma Aldrich | 175552 | |
| Ultrasonic Cleaner | Branson | 3510 | |
| Tube Rotator | VWR | 10136-084 | |
| Vortex Mixer | WiseMix | VM-10 | |
| Microcentrifuge | VWR | Micro 1207 | |
| Plasma Cleaner | Harrick Plasma | PDC-001-HP | |
| PDMS Mixer | Thinky | ARE-250 | |
| Oven | Thermo Scientific | PR305220M | |
| Epi-fluorescence Microscope | Nikon | Eclipse Ti | |
| CCD Camera | Andor | Clara | |
| Platinum Electrodes | Alfa Aesar | 43014 | |
| Source Meter | Keithley | 2400 | |
| Digital Multimeter | Extech | 410 | |
| Microscopy Glass Slides | Thermo Scientific | 2951-001 | |
| Tween 20 | Merck Millipore | 822184 | |
| Sodium chloride | Fisher Scientific | 7646-14-5 | |
| Sodium phosphate monobasic | Sigma Aldrich | 71505 | |
| Sodium phosphate dibasic | Sigma Aldrich | S3264 | |
| DNA | IDT | CAA CCG ATG CCA CAT CAT TAG CTA C | |
| B-Phycoerythrin | Life Technologies | P-800 | |
| Dynamic light scattering system for Zeta Potential Measurement | Malvern | Zetasizer Nano S | |
| Photoresist | Shipley | SPR700-1.0 | |
| Projection lithography | Nikon | NSR2005i9 | |
| Reactive Ion Etcher | Applied Materials | AME P5000 | |
| ICP deep reactive ion etcher | STS | STS-6" | |
| Contact lithography | Electronic Visions | EV620 | |
| Photoresist Coater Developer | SSI | SSI 150 | |
| Non-contact surface profiler | Wyko | NT 9800 |
참고문헌
- Mawatari, K., Kazoe, Y., Shimizu, H., Pihosh, Y., Kitamori, T. Extended-Nanofluidics: Fundamental Technologies, Unique Liquid Properties, and Application in Chemical and Bio Analysis Methods and Devices. Anal Chem. 86, 4068-4077 (2014).
- Tsukahara, T., Mawatari, K., Kitamori, T. Integrated extended-nano chemical systems on a chip. Chem Soc Rev. 39, 1000-1013 (2010).
- Mani, A., Zangle, T. A., Santiago, J. G. On the Propagation of Concentration Polarization from Microchannel-Nanochannel Interfaces Part I: Analytical Model and Characteristic Analysis. Langmuir. 25, 3898-3908 (2009).
- Aizel, K., et al. Enrichment of nanoparticles and bacteria using electroless and manual actuation modes of a bypass nanofluidic device. Lab Chip. 13, 4476-4485 (2013).
- Wang, Y. C., Stevens, A. L., Han, J. Million-fold preconcentration of proteins and peptides by nanofluidic filter. Anal Chem. 77, 4293-4299 (2005).
- Karnik, R., et al. Electrostatic control of ions and molecules in nanofluidic transistors. Nano letters. 5, 943-948 (2005).
- Mao, P., Han, J. Y. Fabrication and characterization of 20 nm planar nanofluidic channels by glass-glass and glass-silicon bonding. Lab Chip. 5, 837-844 (2005).
- Mao, P., Han, J. Massively-parallel ultra-high-aspect-ratio nanochannels as mesoporous membranes. Lab Chip. 9, 586-591 (2009).
- Balducci, A., Mao, P., Han, J. Y., Doyle, P. S. Double-stranded DNA diffusion in slitlike nanochannels. Macromolecules. 39, 6273-6281 (2006).
- Yamada, M., Mao, P., Fu, J. P., Han, J. Y. Rapid Quantification of Disease-Marker Proteins Using Continuous-Flow Immunoseparation in a Nanosieve Fluidic Device. Anal Chem. 81, 7067-7074 (2009).
- Huh, D., et al. Tuneable elastomeric nanochannels for nanofluidic manipulation. Nat Mater. 6, 424-428 (2007).
- Chung, S., Lee, J. H., Moon, M. W., Han, J., Kamm, R. D. Non-lithographic wrinkle nanochannels for protein preconcentration. Adv Mater. 20, 3011-3016 (2008).
- Park, S. M., Huh, Y. S., Craighead, H. G., Erickson, D. A method for nanofluidic device prototyping using elastomeric collapse. Proc Natl Acad Sci. 106, 15549-15554 (2009).
- Zeng, Y., Harrison, D. J. Self-assembled colloidal arrays as three-dimensional nanofluidic sieves for separation of biomolecules on microchips. Anal Chem. 79, 2289-2295 (2007).
- Malekpourkoupaei, A., Kostiuk, L. W., Harrison, D. J. Fabrication of Binary Opal Lattices in Microfluidic Devices. Chem Mat. 25, 3808-3815 (2013).
- Merlin, A., Salmon, J. -. B., Leng, J. Microfluidic-assisted growth of colloidal crystals. Soft Matter. 8, 3526-3537 (2012).
- Schepelina, O., Zharov, I. PNIPAAM-modified nanoporous colloidal films with positive and negative temperature gating. Langmuir. 23, 12704-12709 (2007).
- Schepelina, O., Zharov, I. Poly(2-(dimethylamino)ethyl methacrylate)-Modified Nanoporous Colloidal Films with pH and Ion Response. Langmuir. 24, 14188-14194 (2008).
- Smith, J. J., Zharov, I. Ion transport in sulfonated nanoporous colloidal films. Langmuir. 24, 2650-2654 (2008).
- Gaspar, A., Hernandez, L., Stevens, S., Gomez, F. A. Electrochromatography in microchips packed with conventional reversed-phase silica particles. Electrophoresis. 29, 1638-1642 (2008).
- Lee, S. Y., et al. High-Fidelity Optofluidic On-Chip Sensors Using Well-Defined Gold Nanowell Crystals. Anal Chem. 83, 9174-9180 (2011).
- Hu, Y. L., et al. Interconnected ordered nanoporous networks of colloidal crystals integrated on a microfluidic chip for highly efficient protein concentration. Electrophoresis. 32, 3424-3430 (2011).
- Zhang, D. -. W., et al. Microfabrication-free fused silica nanofluidic interface for on chip electrokinetic stacking of DNA. Microfluid Nanofluid. 14, 69-76 (2013).
- Syed, A., Mangano, L., Mao, P., Han, J., Song, Y. A. Creating sub-50 nm nanofluidic junctions in a PDMS microchip via self-assembly process of colloidal silica beads for electrokinetic concentration of biomolecules. Lab Chip. 14, 4455-4460 (2014).
- Kim, S. J., Song, Y. A., Han, J. Nanofluidic concentration devices for biomolecules utilizing ion concentration polarization: theory, fabrication, and applications. Chem Soc Rev. 39, 912-922 (2010).
- Fu, J. P., Mao, P., Han, J. Y. Continuous-flow bioseparation using microfabricated anisotropic nanofluidic sieving structures. Nat Protoc. 4, 1681-1698 (2009).
- Plecis, A., Nanteuil, C., Haghiri-Gosnet, A. M., Chen, Y. Electropreconcentration with Charge-Selective Nanochannels. Anal Chem. 80, 9542-9550 (2008).
- Ko, S. H., et al. Nanofluidic preconcentration device in a straight microchannel using ion concentration polarization. Lab Chip. 12, 4472-4482 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유