Method Article
通过胶体粒子自组装过程创建在PDMS微流控芯片分50纳米的纳米流体结
摘要
We propose a simple self-assembly technique of silica colloidal nanoparticles to create a nanofluidic junction between two microchannels in polydimethylsiloxane (PDMS). Using this technique, a nanoporous bead membrane with a pore size down to ~45 nm was built inside a microchannel and applied to electrokinetic preconcentration of DNA samples.
摘要
聚二甲基硅氧烷(PDMS)是普遍的建筑材料,使微流体装置,因为它易于成型和粘合的以及它的透明度。由于PDMS材料的柔软性,但是,它是具有挑战性的使用PDMS用于构建纳米通道。渠道往往等离子体结合过程中容易崩溃。在本文中,我们提出了二氧化硅胶体纳米粒子的蒸发驱动的自组装方法与子50 2微之间50nm孔纳流控创建路口。孔尺寸以及表面电荷的纳米流体交界的是可调简单地由自组装过程之前,改变组装微流体装置的外胶体二氧化硅珠尺寸和表面官能在小瓶中。使用具有300纳米,500纳米,900纳米的珠粒度的纳米颗粒的自组装,有可能分别与〜45纳米的孔隙尺寸,〜75 nm和〜135毫微米,制作多孔膜。在电人的潜力,这种纳米膜发起离子浓差极化(ICP)作为阳离子选择性膜15分钟内集中精力靠〜1700倍的DNA。这种非光刻纳米制造工艺开辟了建立一个PDMS微流控芯片内的离子和分子纳米运输过程的研究可调谐纳米流体结了新的契机。
引言
纳流控是μTAS的一个新兴的研究领域(微全分析系统)在10 1的长度尺度来研究生物过程或离子的迁移现象和分子- 10 2纳米。用的纳米流体的工具,如纳米通道的到来,分子和离子的输运过程可以以前所未有的精度进行监测和操纵,如果需要的话,通过利用只在该长度尺度对分离和检测是可用的功能。1,2之一这些特征纳米级特征是表面以在纳米通道散装电荷(或Dukhin数)的高比例,可能会导致电荷不平衡,并启动纳米通道和微通道之间的离子浓度极化(ICP)。3
对于纳米流体现象的研究一种常见的设备平台包括由纳米通道作为结的阵列连接的两个微通道系统。4-6 用于构建这样的纳米流体装置的选择的材料是硅,因为它的高刚度,防止信道从期间接合工艺倒塌7然而,硅器件制造需要昂贵的掩模和在洁净室设备处理的大量。8- 10由于装置制造的,通过模制和等离子体结合,聚二甲基硅氧烷(PDMS)的便利性已被广泛接受的作为建筑材料为微流体,这将是对纳米流体的理想材料为好。然而,它的杨氏模量低周围360-870千帕,使得等离子体接合时与PDMS通道容易可折叠的。纳米通道(宽深)的最小长宽比必须小于10:1,这意味着通过标准光刻PDMS器件的制造会变得极具挑战性的,如果纳通道深度必须小于100纳米,需要一个信道宽度小于photolith的电流限制地理学在约1微米。为了克服这一限制,已经尝试来创建使用非光刻方法在PDMS纳通道如拉伸以引发裂纹等离子处理后的78纳米11或形成皱纹平均深度12塌陷允许用机械压力将PDMS通道一纳通道的高度低至60纳米。13
即使这些高度发明的非光刻方法允许低于100nm建筑纳通道中的深度,纳米通道制造的尺寸可控性仍对阻碍一个广泛接受的PDMS作为建筑材料为纳米流体装置。纳米通道的另一个关键问题,无论是在硅或PDMS,是在壳体的表面官能有必要改变对离子或分子的操纵通道壁的表面电荷。通过连接装置组装后,纳米通道是非常困难达到表面官能由于扩散限制运输。创建具有高尺寸精确度的和容易的表面官能纳米级信道,在微流体装置引起的蒸发14-16胶体粒子的自组装法可以是有前途的方法之一。除了 孔尺寸和表面特性的可控性,甚至有可能以调谐使用涂有聚电解质的胶体粒子时在原位通过控制温度,17的pH值,18,19和离子强度的细孔的尺寸。18由于这些对于毛细管电,20生物传感器,21蛋白浓度22以及微流体蛋白质和DNA的分离。14,23在这项研究中的优势,胶体粒子的自组装方法已经找到的应用程序,我们部署这种自组装方法来构建在电动富集装置PDMS需要两个微通道之间的纳米流体结24的电动浓度背后的基本机制是基于离子浓度极化(ICP)。包括在以下方案25的制造和装配步骤的详细描述。
研究方案
1.胶体二氧化硅悬浮液珠的制备
- 为300nm和500nm的硅石珠粒悬浮液制剂
- 涡旋二氧化硅珠纸浆悬浮液(10%w / v的水溶液)30秒。以获得均匀悬浮液。共600微升储备悬浮液吸取到1.5ml试管离心它2600 xg离心1分钟。
- 替换上清液用400μl1 mM磷酸钠缓冲液(PB,pH7.0)中。
- 暂停硅珠成的15%,以1 mM磷酸钠溶液在pH 7.0经涡旋的最终浓度。
- 聚表面官能化500纳米的二氧化硅羧基珠子(烯丙胺盐酸盐,PAH),并与聚(苯乙烯磺酸钠,PSS)聚电解质
- 暂停0.1用10ml 1M NaCl的(pH 7.0)中为1%(重量/体积)珠悬浮克与羧基500nm的二氧化硅珠粒。
- 在1M NAC准备0.4%PAH(MW 65K)升通过在15ml 1M NaCl的溶解原液的300微升(20%w / v的水溶液)。通过在20毫升的1M NaCl溶液0.18克PSS溶解在1M NaCl的溶液制备0.9%的PSS(MW 70K)。涡旋都为1分钟的解决方案。以完全溶解聚电解质。
- 加入200微升的PAH溶液9.8毫升1%的二氧化硅羧基珠子在15ml管以沉积具有羧基官能团上的二氧化硅珠粒带正电荷的聚电解质层。 VORTEX珠悬挂1分钟。孵育它在管旋转60分钟。在室温。
- 离心珠悬浮液在1801 XG 1分钟。并用10毫升去离子水洗掉未结合的PAH五次。每个离心和除去上清液后,被致密地填充在管底部的小珠。加入8毫升DI水,以使珠可重悬于和到下一个离心机步骤洗掉现有之前破坏通过用2ml DI水剧烈移液珠丛。
- 跟随对于PSS涂敷在1.2.3和1.2.4的步骤在珠子上沉积带负电荷的层。从1.2.4第5 次洗涤步骤除去DI水上清液之前的PSS的沉积后重新悬浮珠子9.8毫升1- M氯化钠的。
- 使用使用2-毫升1- M氯化钠的打破了珠丛在15ml试管的底部,然后加入8毫升1- M氯化钠的相同的蓬勃移液步骤。加入200μl的PSS的溶液9.8毫升沉积有单一的PAH层的二氧化硅珠粒。涡旋1分钟后和温育60分钟。在试管旋转器中,重复用DI水5洗涤步骤。
- 使用根据制造商的方案,动态光散射系统,以验证已正确执行了聚电解质沉积过程测量之前和之后的每个聚电解质涂层珠的ζ电位(见表1)。
- 重复用DI水的单一的PSS层以下五个洗涤步骤用0.05%吐温20(15%重量/体积)中的微流体装置在使用之前,以提高其流动性的沉积和再悬浮于650微升1mM的磷酸钠缓冲液中的珠。
- 按照从1.2.5如上所述1.2.6为与胺官能团为500nm的二氧化硅珠粒沉积的PSS的单层的步骤。
2.将PDMS微流控芯片的制备
- 硅主的微细
- 制造用的微细加工技术如下PDMS成型硅主。
- 旋涂1μm的薄光致抗蚀剂以4000rpm在硅片上。图案使用投影光刻(曝光时间170毫秒)和蚀刻700nm的深和2微米宽的平面纳米通道的层(作为nanotraps为二氧化硅珠)用反应性离子蚀刻。
- 使用以下蚀刻参数达到3.5纳米/秒的刻蚀速率:CHF 3(45 SCCM),CF 4(15标准立方厘米),Ar(气体为100sccm),压力100毫乇,RF功率200W。
- 旋转涂布,以2000rpm的转速第二个为1微米厚的光刻胶层和执行对准先前图案nanotraps。通过接触光刻和硅的深反应离子蚀刻(DRIE)的微通道图案。使用DRIE参数26在表2中。
- 制造用的微细加工技术如下PDMS成型硅主。
- PDMS模具的制作
- Silanize在真空罐O / N三氯硅烷(50微升)的硅主人。
注意:Tricholorosilane是有毒和腐蚀性的材料。总是在化学罩与适当的个人防护装备使用。 - 在10混合基与固化剂:在硅烷化硅母1的比例,并投PDMS和在70℃下固化它用于在对流烘箱2小时。
- 用后一个PL的等离子净化器取下,用小刀和等离子债券它的空白晶圆上的芯片主的PDMS板阿斯玛治疗在1分钟的等离子体清洁器。连接带沿边缘标记以下PDMS铸造步骤分割线。
- 在真空罐子三氯硅烷(50微升)O / N Silanize的PDMS模具。
- 施放的PDMS(碱:1的比例:在10固化剂)的硅烷化的PDMS模具,并在70℃下固化它用于在对流烘箱2小时。
- Silanize在真空罐O / N三氯硅烷(50微升)的硅主人。
- 与PDMS器件的制造
- 剥去一起打上胶带分割线的PDMS模具硫化硅橡胶板。
- 为1.5mm活检穿孔,清洁用胶带冲贮存器孔,冲洗用异丙醇(IPA)中,用氮气干燥。
- 等离子体键上在等离子体清洁器的等离子体处理1分钟后25毫米×75毫米的显微镜载玻片的PDMS设备。
- Ultrasonicate珠停牌60分钟。在超声浴中之前填充。吸管10微升悬浮微珠(300 nm的非功能化的二氧化硅是广告,或500纳米的二氧化硅羧基珠PAH-PSS层,或500与PSS层纳米二氧化硅胺珠)进入入口4和6的每个(参见图1的A,B)的PDMS芯片的等离子体接合到后,立即玻璃衬底。轻轻拍打PDMS芯片用枪头上提升珠包装。
- 填充珠的供货渠道后,覆盖除了1和9,用胶带所有的入口。空气干燥设备3小时并储存在+ 4℃下在使用前, 图2给出了胶体自组装过程的一个步骤的分步示意图。
3.试验研究DNA的浓度电动
- 填充储层3,7用缓冲溶液(10微升1mM的PB)和储存器5用DNA样品(10微升在1mM的PB为10nM),并应用一个轻柔的负压与储2倒置枪头,8和10来填充用的溶液中的信道没有气泡(见的图1B)。
- 加10微升1mM的的PB到水库2和8和10μl10nM的DNA的储层10来平衡压力,并等待5分钟。以达到平衡。
- 将铂针入储层3,5,7,10。
- 横跨使用连接到源米和Pt线的分压器纳米流体结施加电压。先上水库5座,10和GND上水库3,7适用30 V。
- 约30秒后,减少对水库10的电压25 V。
- 使用机械快门,在每5秒一周期开口记录从DNA的荧光信号时,以减少样品的光漂白。
结果
在PDMS一个电动集中器芯片包含两个微通道之间的自组装纳米流体结在图1A中示出)。在该装置的中部的通道是通过一个50微米的宽珠输送通道( 图1B)填充有DNA样品溶液并通过在每侧的两个缓冲溶液的通道两侧。二氧化硅胶体悬浮液流入到珠输送通道等离子体接合后立即创建样品和缓冲液通道之间的纳米流体交界处。由700毫微米深和2微米宽的纳通道的nanotrap阵列用于套住胶体粒子。用非接触表面轮廓获得其扫描的图像在图1C示出)。蒸发后的胶体珠膜在图1D中示出)。在图1E进行SEM)示出硅珠陷阱PED在平面nanotrap阵列分离从胎圈输送通道样品通道。 300纳米的二氧化硅珠包装显示了高度有序的六边形包装有可能导致集中行为( 图1F)的变化一些小的缺陷。与PDMS集中器芯片,其尺寸的设计可以找到这里 ,并在补充文件。

图1的微流体集中在PDMS具有集成子50毫微米纳米结。(A)中 在PDMS浓缩设备的照片。 (B)的与样品和缓冲液通道之间的小珠输送通道的微纳米流体装置的示意图。电压样品通道和缓冲溶液通道之间穿过珠子膜施加annels。 (C)的PDMS中的nanotrap阵列的2微米的宽度和700nm的深度的表面轮廓。该装置(D)的显微照片与蒸发后的珠输送通道内的胶粒组件。 (E)与样品之间的nanotrap阵列的自组装300nm的二氧化硅胶体粒子的扫描电子显微照片和缓冲通道。在300纳米珠被截留在由于表面张力的nanotraps的入口。 (F)的六边形填充蒸发后的珠递送微通道内300nm的二氧化硅珠粒。 (从参考改编。25从皇家化学学会许可) 点击此处查看该图的放大版本。
为PDMS concentrato在微步骤示意图ř装置示于图2。为了使PDMS设备,需要一个双PDMS铸造。在PDMS浓缩胎圈填充过程示于图3中 。在微和填充过程的细节可以在协议中找到。的硅石珠粒没有和有聚电解质涂层zeta电位示于表1。
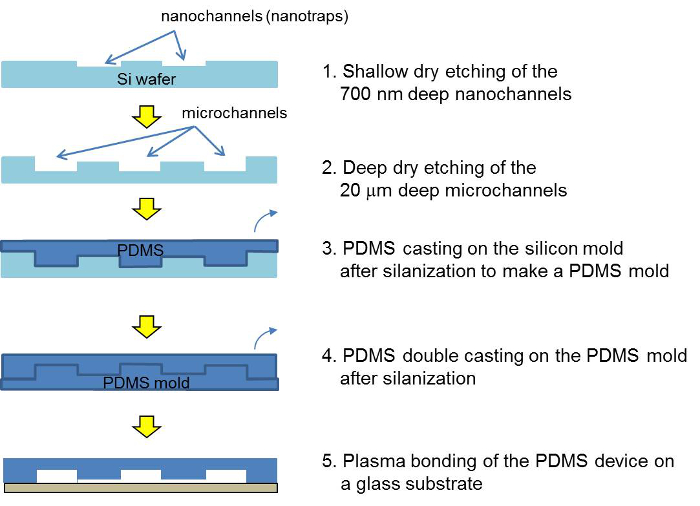
图2.为硅主,与PDMS主站和PDMS集中器装置的制造工艺的示意图。经过两次光刻和蚀刻步骤中,硅主铸有PDMS。双成型后,PDMS设备通过等离子体结合装配和充满微珠悬浮液。 请点击此处查看该图的放大版本。

图3.步一步示意为胶体二氧化硅珠粒自组装。将10μl珠悬浮液等离子体处理后,立即移液到珠递送通道。一旦珠交付渠道中弥漫,除了两个入口1和9覆盖用胶带和使用前3小时干燥设备的空气。 (从参考转载。25从皇家化学学会许可) 点击此处查看该图的放大版本。
| 胶体粒子(500纳米) | ζ电位(毫伏) |
| 二氧化硅 | -2.04 |
| 硅胺 | 19.6 |
| 硅羧基 | -19.73 |
| 二氧化硅çarboxyl,涂PAH | 31.8 |
| 二氧化硅羧基,PAH,PSS涂层 | -28.5 |
| 二氧化硅胺,PSS涂层 | -31.2 |
在25℃的硅珠 表1 Zeta电位。 0.1%(重量/体积)的胶体溶液用于测量(N = 3)。
晒出后从胎圈填料通道拍摄的SEM图像示出了孔径60纳米,91纳米和170纳米之间的范围内, 如图4的孔径对应于珠尺寸的大约20%,300纳米,500纳米和分别900纳米,(珠直径的15%,为理论孔径)。

图4的自组装300纳米 (A)中,500纳米 SEM图像 的(B) 和900纳米 (C)的二氧化硅胶体珠填料。PDMS装置被可逆地结合到流入使用负压通道载玻片和珠。后空气干燥该设备的O / N中,PDMS装置进行了仔细剥离玻璃和成像。此孔径估计为60±2,91±5和300纳米,500纳米和900纳米珠分别170±7纳米(N = 9)。这些孔径是接近理论尺寸,珠直径的〜15%。 (从参考改编。25从皇家化学学会许可) 点击此处查看该图的放大版本。
当横跨300nm的珠粒膜施加30伏电压时,观察到的离子耗尽区的胶体膜靠近填充有微通道内荧光标记的DNA( 图5 A,B)。当降低电压到25 V于左侧,DNA分子得到积累在一个插头的形式,并且由于其浓度增加至电渗流通过30 V-25 V在样品通道的电压差驱动( 图5℃ ,D)。

图5.定时显微照片显示出离子耗尽区的近中填有DNA(10纳米的初始浓度)的信道的纳米流体胶体结的形成。该离子耗尽区是在t = 10秒和浓缩的DNA插头发起在V2生成= 30 V和V1 = 25 V在样品通道,而缓冲渠道停飞。虚线已经用于突出显示频道的壁。 〜1700倍的浓度因素是在15分钟内完成。 ü唱了300纳米的胶体膜。 (从参考转载。25从皇家化学学会许可) 点击此处查看该图的放大版本。
为300纳米和500的珠粒度纳米显示最高浓度因子在约1700倍的赛扬5二氧化硅膜在15分钟内标记的DNA(CAA CCG ATG CCA CAT CAT TAG CTA℃)。 ( 图6 A,B)。聚电解质包覆二氧化硅珠的膜导致15分钟后200到1000倍的增加的DNA浓度。 ( 图6 C,D)。
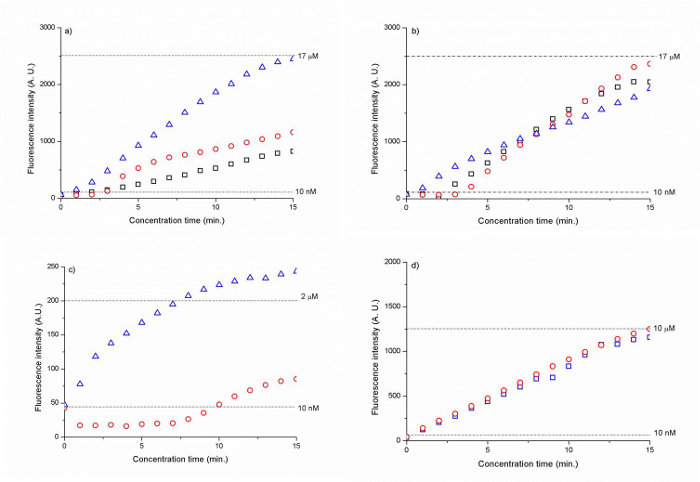
图6.荧光的DNA强度作为时间(A)的300纳米的二氧化硅珠(B)的500纳米的二氧化硅珠粒的功能的D(℃)500纳米的PSS包覆二氧化硅胺珠和(D)的500纳米的PAH / PSS涂覆的二氧化硅羧基珠子。虚线表示为10nM的(A,B,C,D),17μM的荧光信号强度电平(A,B),2微米(C)和10微米(D)的DNA。结果已经正常化对背景荧光。 (从参考转载。25从皇家化学学会许可) 点击此处查看该图的放大版本。
| 处理时间 | 蚀刻模式 | 钝化模式 |
| 处理时间 | 6秒 | 4.5小号 |
| 泛滥 | 0.5秒 | 0秒 |
| 稿台发电机功率 | 80瓦 | 60瓦 |
| 线圈发电机功率 | 600瓦 | 600瓦 |
| 气体 | SF 6 70 SCCM | C 4 F 8 35 SCCM |
| 刻蚀速率 | 1.47微米/分钟 | |
表2. DRIE参数。
讨论
继通用设备设计方案,研究纳米流体,我们用胶体纳米粒子的蒸发驱动的自组装,而不是光刻图案纳米通道阵列制造的两微流体通道之间的纳米流体连接处。当流动的胶体粒子进入珠输送通道,nanotraps的具有700nm的深度和2微米的小珠传送通道的两侧,在100微米的总宽度的宽度的阵列防止珠悬浮液流入缓冲液和样品通道由于在nanotraps的表面张力。一旦捕获,装在胎圈输送通道迅速胶体粒子和形成在样品之间的纳米多孔结和缓冲通道。
它以等离子体粘合后立即加载珠悬浮液是重要的,使得毛细管力驱动二氧化硅珠悬浮液至出口r的入口eservoirs在暂时亲水珠传送信道。为了防止气泡阻塞在入口储的流动,这是强烈建议以达到用枪头贮存器的底部,然后释放珠悬浮液进入储存。在与聚电解质的表面官能化珠的情况下,其流动性被大大降低相比于硅珠没有表面官能化和往往更容易聚集并在填充过程附着到通道表面。为了防止与聚电解质涂覆珠的信道的堵塞,我们添加表面活性剂,0.05%吐温20,与珠悬浮液。如果仍有填充过程中堵塞问题,PDMS芯片上轻轻敲击用枪头一般帮助解决这个问题。
此外,重要的是,胎圈悬浮液不完全蒸发后干燥出来,因为这将是困难的INF再次iltrate用磷酸钠缓冲溶液的珠粒膜。因此,后部分蒸发的3小时,所有的入口和所述PDMS设备的出口均录音,并保持在4℃下使用,因此胎圈填料保持湿润事先存储。期间富集实验中,自组装珠保持其结构稳定性的大部分。然而,在少数情况下,我们观察到的这表明在微珠粒有缺陷的填充珠子的位错。自组装的二氧化硅珠粒,从直径为900纳米至自组装后300nm的可在图4中的胎圈填料为〜45纳米的理论孔径可以看出,胶体粒子的约〜15%的直径。我们可以确认使用SEM分析孔尺寸和填充之后测量的孔径大约珠直径的20%。
使用自组装300纳米和500纳米的胶体粒子的膜作为离子选择性娜noporous交界处,我们可以在30 V开始离子耗尽区,集中10纳米的Cy5在1磷酸钠缓冲标记的DNA(CAA CCG ATG CCA猫猫TAG CTA C)(图5)。通过用电渗流在电压差V 2 -V 1 = 5伏,我们可以增加在15分钟内由〜1700倍的初始DNA浓度连续流动朝向离子耗尽区的DNA样品。 (图6a,b)中。 500纳米珠粒允许大于300nm珠子更健壮的DNA浓度,如图图6b)。由于电动浓度是基于电渗力和高度非线性电泳力之间的力平衡,将所得浓度因子由到该力平衡可以电动浓度期间保持度27来确定。
为构建一个纳米流体结部署胶体粒子的另一个显著优点是易于与它的面传热可以进行ê功能化。代替首先创建通过接合一个纳通道,然后在其上进行表面官能化,我们可以简单地表第一官能装置外部在小瓶中的胶体粒子,然后将它们流入为自组装的通道。基于这种方法,我们可以使用涂覆有PSS的单层和涂有的PAH和PSS(图6 c和d)层500纳米的二氧化硅羧基粒子500nm的二氧化硅胺颗粒,在较低的电压启动ICP(8 V和10V,分别)比胶体粒子未经表面官能(30伏)。这一结果表明,现有的自组装的胶体粒子的表面官能化是有效的,以增加表面电荷的胶体粒子的,并导致较高的ICP。然而,在得到的浓缩因子的计算,表面官能化珠的纳米流体交界比非官能SI不太有效LICA珠。胺/ PSS涂覆的珠粒启用〜200的因子,而羧基/ PAH / PSS珠膜显示15分钟后1000倍。 (图6d)。这个结果可以通过较高的表面电荷表面官能化的纳米孔,导致了离子耗尽区推动样品浓度插头远离珠膜和因此的长度增加来解释,以较少的稳定的浓度。我们认为,从当前为1毫米(平行于样品通道胎圈膜的部分)缩短该纳米珠膜的总宽度可以减轻这种不稳定性问题。根据我们以前的研究中,纳米多孔结的宽度通过它确定离子电流流通的量。28随着宽度的增加,离子电流的增加,并且自多种阳离子可透过膜,耗尽长度增加,浓度插头迁移被进一步推离该纳米结程。 ŧherefore,累积发生在一个较不局限的方式与样品插头变得不太稳定。凭经验,纳米多孔结应为〜100-400微米的宽度。改善的另一个特点是样品通道和胎圈交付之间15微米的PDMS墙的厚度不够。这本薄薄的PDMS部分导致了粘接不充分,使该缓冲区和样品通道之间的离子电流。因此,珠膜平行于样品通道的整个部分(1毫米宽度)被用作纳米多孔结,即使只有100胎圈的微米被按照nanotrap阵列的总宽度打算作为纳米多孔结膜。将PDMS壁厚应至少为25微米或更高。
披露声明
The authors have nothing to disclose.
致谢
这项工作是由美国国立卫生研究院R21 EB008177-01A2和纽约大学阿布扎比(NYUAD)加强研究2013年基金微细加工,我们在表示感谢MIT的MTL的鼎力支持技术人员和詹姆斯·韦斯顿和NYUAD的尼古拉Giakoumidis他们的支持支持采取SEM照片分别建立一个分压器。在PDMS的设备制造在NYUAD的微细核心设施进行。最后,我们想从NYUAD中心感谢丽贝卡Pittam为视频拍摄和编辑数字奖学金。
材料
| Name | Company | Catalog Number | Comments |
| Poly(Styrenesulfonic Acid) Sodium Salt | Polysciences | 08772 | |
| Poly(allylamine) Solution | Sigma Aldrich | 479144-5G | |
| Silica Microsphere - 300 nm | Polysciences | 24321 | |
| Silica Microsphere - 500 nm | Polysciences | 24323 | |
| Silica Microsphere Carboxyl Functional - 500 nm | Polysciences | 24753 | |
| Silica Microsphere Amine Functional - 500 nm | Polysciences | 24756 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | ||
| Trichlorosilane | Sigma Aldrich | 175552 | |
| Ultrasonic Cleaner | Branson | 3510 | |
| Tube Rotator | VWR | 10136-084 | |
| Vortex Mixer | WiseMix | VM-10 | |
| Microcentrifuge | VWR | Micro 1207 | |
| Plasma Cleaner | Harrick Plasma | PDC-001-HP | |
| PDMS Mixer | Thinky | ARE-250 | |
| Oven | Thermo Scientific | PR305220M | |
| Epi-fluorescence Microscope | Nikon | Eclipse Ti | |
| CCD Camera | Andor | Clara | |
| Platinum Electrodes | Alfa Aesar | 43014 | |
| Source Meter | Keithley | 2400 | |
| Digital Multimeter | Extech | 410 | |
| Microscopy Glass Slides | Thermo Scientific | 2951-001 | |
| Tween 20 | Merck Millipore | 822184 | |
| Sodium chloride | Fisher Scientific | 7646-14-5 | |
| Sodium phosphate monobasic | Sigma Aldrich | 71505 | |
| Sodium phosphate dibasic | Sigma Aldrich | S3264 | |
| DNA | IDT | CAA CCG ATG CCA CAT CAT TAG CTA C | |
| B-Phycoerythrin | Life Technologies | P-800 | |
| Dynamic light scattering system for Zeta Potential Measurement | Malvern | Zetasizer Nano S | |
| Photoresist | Shipley | SPR700-1.0 | |
| Projection lithography | Nikon | NSR2005i9 | |
| Reactive Ion Etcher | Applied Materials | AME P5000 | |
| ICP deep reactive ion etcher | STS | STS-6" | |
| Contact lithography | Electronic Visions | EV620 | |
| Photoresist Coater Developer | SSI | SSI 150 | |
| Non-contact surface profiler | Wyko | NT 9800 |
参考文献
- Mawatari, K., Kazoe, Y., Shimizu, H., Pihosh, Y., Kitamori, T. Extended-Nanofluidics: Fundamental Technologies, Unique Liquid Properties, and Application in Chemical and Bio Analysis Methods and Devices. Anal Chem. 86, 4068-4077 (2014).
- Tsukahara, T., Mawatari, K., Kitamori, T. Integrated extended-nano chemical systems on a chip. Chem Soc Rev. 39, 1000-1013 (2010).
- Mani, A., Zangle, T. A., Santiago, J. G. On the Propagation of Concentration Polarization from Microchannel-Nanochannel Interfaces Part I: Analytical Model and Characteristic Analysis. Langmuir. 25, 3898-3908 (2009).
- Aizel, K., et al. Enrichment of nanoparticles and bacteria using electroless and manual actuation modes of a bypass nanofluidic device. Lab Chip. 13, 4476-4485 (2013).
- Wang, Y. C., Stevens, A. L., Han, J. Million-fold preconcentration of proteins and peptides by nanofluidic filter. Anal Chem. 77, 4293-4299 (2005).
- Karnik, R., et al. Electrostatic control of ions and molecules in nanofluidic transistors. Nano letters. 5, 943-948 (2005).
- Mao, P., Han, J. Y. Fabrication and characterization of 20 nm planar nanofluidic channels by glass-glass and glass-silicon bonding. Lab Chip. 5, 837-844 (2005).
- Mao, P., Han, J. Massively-parallel ultra-high-aspect-ratio nanochannels as mesoporous membranes. Lab Chip. 9, 586-591 (2009).
- Balducci, A., Mao, P., Han, J. Y., Doyle, P. S. Double-stranded DNA diffusion in slitlike nanochannels. Macromolecules. 39, 6273-6281 (2006).
- Yamada, M., Mao, P., Fu, J. P., Han, J. Y. Rapid Quantification of Disease-Marker Proteins Using Continuous-Flow Immunoseparation in a Nanosieve Fluidic Device. Anal Chem. 81, 7067-7074 (2009).
- Huh, D., et al. Tuneable elastomeric nanochannels for nanofluidic manipulation. Nat Mater. 6, 424-428 (2007).
- Chung, S., Lee, J. H., Moon, M. W., Han, J., Kamm, R. D. Non-lithographic wrinkle nanochannels for protein preconcentration. Adv Mater. 20, 3011-3016 (2008).
- Park, S. M., Huh, Y. S., Craighead, H. G., Erickson, D. A method for nanofluidic device prototyping using elastomeric collapse. Proc Natl Acad Sci. 106, 15549-15554 (2009).
- Zeng, Y., Harrison, D. J. Self-assembled colloidal arrays as three-dimensional nanofluidic sieves for separation of biomolecules on microchips. Anal Chem. 79, 2289-2295 (2007).
- Malekpourkoupaei, A., Kostiuk, L. W., Harrison, D. J. Fabrication of Binary Opal Lattices in Microfluidic Devices. Chem Mat. 25, 3808-3815 (2013).
- Merlin, A., Salmon, J. -B., Leng, J. Microfluidic-assisted growth of colloidal crystals. Soft Matter. 8, 3526-3537 (2012).
- Schepelina, O., Zharov, I. PNIPAAM-modified nanoporous colloidal films with positive and negative temperature gating. Langmuir. 23, 12704-12709 (2007).
- Schepelina, O., Zharov, I. Poly(2-(dimethylamino)ethyl methacrylate)-Modified Nanoporous Colloidal Films with pH and Ion Response. Langmuir. 24, 14188-14194 (2008).
- Smith, J. J., Zharov, I. Ion transport in sulfonated nanoporous colloidal films. Langmuir. 24, 2650-2654 (2008).
- Gaspar, A., Hernandez, L., Stevens, S., Gomez, F. A. Electrochromatography in microchips packed with conventional reversed-phase silica particles. Electrophoresis. 29, 1638-1642 (2008).
- Lee, S. Y., et al. High-Fidelity Optofluidic On-Chip Sensors Using Well-Defined Gold Nanowell Crystals. Anal Chem. 83, 9174-9180 (2011).
- Hu, Y. L., et al. Interconnected ordered nanoporous networks of colloidal crystals integrated on a microfluidic chip for highly efficient protein concentration. Electrophoresis. 32, 3424-3430 (2011).
- Zhang, D. -W., et al. Microfabrication-free fused silica nanofluidic interface for on chip electrokinetic stacking of DNA. Microfluid Nanofluid. 14, 69-76 (2013).
- Syed, A., Mangano, L., Mao, P., Han, J., Song, Y. A. Creating sub-50 nm nanofluidic junctions in a PDMS microchip via self-assembly process of colloidal silica beads for electrokinetic concentration of biomolecules. Lab Chip. 14, 4455-4460 (2014).
- Kim, S. J., Song, Y. A., Han, J. Nanofluidic concentration devices for biomolecules utilizing ion concentration polarization: theory, fabrication, and applications. Chem Soc Rev. 39, 912-922 (2010).
- Fu, J. P., Mao, P., Han, J. Y. Continuous-flow bioseparation using microfabricated anisotropic nanofluidic sieving structures. Nat Protoc. 4, 1681-1698 (2009).
- Plecis, A., Nanteuil, C., Haghiri-Gosnet, A. M., Chen, Y. Electropreconcentration with Charge-Selective Nanochannels. Anal Chem. 80, 9542-9550 (2008).
- Ko, S. H., et al. Nanofluidic preconcentration device in a straight microchannel using ion concentration polarization. Lab Chip. 12, 4472-4482 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。