Method Article
Glycan Узел Анализ: снизу вверх подход к Glycomics
В этой статье
Резюме
This article presents an enhanced form of a novel bottom-up glycomics technique designed to analyze the pooled compositional profile of glycans in unfractionated biofluids through the chemical breakdown of glycans into their constituent linkage-specific monosaccharides for detection by GC-MS. Potential applications include early detection of cancer and other glycan-affective disorders.
Аннотация
Synthesized in a non-template-driven process by enzymes called glycosyltransferases, glycans are key players in various significant intra- and extracellular events. Many pathological conditions, notably cancer, affect gene expression, which can in turn deregulate the relative abundance and activity levels of glycoside hydrolase and glycosyltransferase enzymes. Unique aberrant whole glycans resulting from deregulated glycosyltransferase(s) are often present in trace quantities within complex biofluids, making their detection difficult and sometimes stochastic. However, with proper sample preparation, one of the oldest forms of mass spectrometry (gas chromatography-mass spectrometry, GC-MS) can routinely detect the collection of branch-point and linkage-specific monosaccharides ("glycan nodes") present in complex biofluids. Complementary to traditional top-down glycomics techniques, the approach discussed herein involves the collection and condensation of each constituent glycan node in a sample into a single independent analytical signal, which provides detailed structural and quantitative information about changes to the glycome as a whole and reveals potentially deregulated glycosyltransferases. Improvements to the permethylation and subsequent liquid/liquid extraction stages provided herein enhance reproducibility and overall yield by facilitating minimal exposure of permethylated glycans to alkaline aqueous conditions. Modifications to the acetylation stage further increase the extent of reaction and overall yield. Despite their reproducibility, the overall yields of N-acetylhexosamine (HexNAc) partially permethylated alditol acetates (PMAAs) are shown to be inherently lower than their expected theoretical value relative to hexose PMAAs. Calculating the ratio of the area under the extracted ion chromatogram (XIC) for each individual hexose PMAA (or HexNAc PMAA) to the sum of such XIC areas for all hexoses (or HexNAcs) provides a new normalization method that facilitates relative quantification of individual glycan nodes in a sample. Although presently constrained in terms of its absolute limits of detection, this method expedites the analysis of clinical biofluids and shows considerable promise as a complementary approach to traditional top-down glycomics.
Введение
Гликолипиды, гликопротеины, протеогликаны и гликозаминогликаны представляют собой четыре основных класса сложных гетерогенных углеводов под общим названием гликанов. Как вездесущие и неотъемлемыми компонентами плазматической мембраны, гликокаликсом и внеклеточного матрикса и жидкостей, гликаны принять участие в таких разнообразных биохимических процессов как эндоцитоза, внутриклеточного транспорта, подвижности клеток, трансдукции сигнала, молекулярного распознавания, активации рецептора, клеточной адгезии, хозяин-патоген взаимодействия , связь, иммунологического и иммунной инициация межклеточное ответ. 1 Present почти в каждой области жизни, ферменты , известные как гликозилтрансферазами , которые строят гликанов полимеры действуют в тандеме с гликозидных гидролаз (также известный как гликозидазы, расщепляющих гликаны) построить, реконструируют, и в конечном счете производят окончательно гликанов полимеров 2. Хотя каждая гликозилтрансферазу может работать на разных гликоконъюгатами, гликозилтрансферазукак правило , кует linkage- и аномера специфические гликозидной связь путем передачи моносахаридную фрагмент определенного активированного нуклеотидного сахарного донора (например, ВВП-фукозы) к определенной категории нуклеофильных акцепторов (например, липидами, полипептида, нуклеиновой кислоты, или растет олигосахарид). Было подсчитано , что более 50% белков (особенно мембранных и секреторных белков) являются посттрансляционно модифицированный гликозилирования 3 Элементарные комбинаторные расчеты дают высокую оценку значительной изменчивости, универсальности и специфичности, оказанное гликопротеинов гликозилирования. например, если полипептид субстрат имеет только 10 сайтов гликозилирования , и каждый узел может образовывать гликозидной связи с 1 из только 3 -х различных моносахаридов восстанавливающих концах, то, теоретически, окончательный гликопротеин можно предположить , 3 10 = 59049 отличные тождества. В гликопротеинов, гликозидных связей обычно образуют с боковой цепи азота OF аспарагина в последовательности Asn-X-Ser / Thr , (Х может быть любой аминокислотой , за исключением пролина) с получением N -glycans 2 и боковой цепи гидроксильные группы серина и треонина с получением O -glycans 4. Состав glycome содержимым ячейки (то есть, его дополнение гликозилирования продуктов) является уникальным и ограниченным , потому что, за немногими исключениями, гликозилтрансфераз проявляют строгую донор, акцептор, и рычажный специфичность. 5 Важные и обильные плазмы крови гликопротеинов страдают аномальным гликозилирование как нижестоящий следствие аномальной экспрессии гликозилтрансферазной и активности из - за многих патологических состо ний , особенно рака и воспалительных заболеваний. 6-24
В основном за счет эпигенетических факторов glycome значительно более разнообразным, динамичным и сложным , чем протеома и транскриптом. 25,26 В то время как примерно 1% генома млекопитающих кодирует образование, модификацию исборка гликанах, 27 гликозилирования протекает в нешаблонном-ориентировкой-заметному отличие от полипептида и биосинтез нуклеиновых кислот. Взаимодействие между относительного количества и активности ферментов гликозилирования и таких экологических факторов , как питательных веществ и прекурсоров доступности в конечном счете , определяет характер, скорость и степень гликозилирования. 5,28 эмбриогенез (например, определение и дифференциация), клеточная активация, и прогрессия через экспрессия гена влияния клеточного цикла (т.е., транскрипции и трансляции) и изменить характер и количество доступных гликозилтрансферазами, чья активность является непосредственным фактором , определяющим перед гликановой профилем клетки. Потому что (некоторые) пролиферативные, клей и инвазивные свойства раковых клеток напоминают обычные эмбриогенные клетки, специфические изменения в гликанов биосинтетических путей (например, накопление предшественника, дерегулирование экспрессии, aberranт модификация, структурная усечение, или роман формирования) служат универсальные биомаркеры рака , которые указывают на различные этапы формирования опухоли, прогрессии, миграции и инвазии 29 Хотя гликозилирования является очень сложным, очевидно , лишь немногие изменения в гликозилирования могут позволить канцерогенеза и метастазирования. по- видимому, некоторые "аномальным" гликозилирования продукты действительно выгоду раковые клетки, позволяя им уклоняться от иммунной признания и выжить требования миграции в негостеприимных внутрисосудистых и метастатических средах. 28,30,31 Не удивительно, что эксперименты показали , что нарушения или предотвращения моделей изменены экспрессии генов и аберрантное гликан образование может остановить туморогенез. 29 Тем не менее, отклоняющиеся гликаны , обнаруженные в биожидкости образце (например, моча, слюна, и плазмы крови или сыворотки) не могут быть прямыми индикаторами рака (или другое заболевание), а скорее вниз по течению результаты тонкий, но значительнаяизменения в иммунной системе или количественному разветвлений пагубного состояния в непредсказуемом органе. 32
Несмотря на то, что они обеспечивают универсальную информацию о glycome, много молекулярных методов взаимодействия на основе glycomics (например, лектин / массивы антител и метаболические / ковалентную маркировка) зависит от обнаружения целых структур гликанов и не обеспечивают подробную структурную информацию об отдельных гликанов. В противоположность, масс-спектрометрия (МС) может помочь идентифицировать и количественно отдельных гликанов структур и выявить такую структурную информацию в качестве крепежных участков к полипептидных сердечников. Дерегулируемых экспрессию или активность только одного гликозилтрансферазы может инициировать каскад вредных молекулярных событий в нескольких путей гликозилирования. Поскольку каждый гликозилтрансферазу может работать на более чем одной гликоконъюгации подложки и в различных растущих гликанов полимеров, дерегулирование биосинтетические каскады выход disproporционно повышенное количество только одного гликановой продукта , но несколько разнородных классов аберрантных гликанов в интра- или внеклеточных жидкостей. 33 Тем не менее, такие уникальные аберрантных гликаны иногда считается непрактичным в качестве биомаркеров для рака или других гликанов-аффективных патологий , так как , по сравнению с большим бассейном хорошо регулируется гликаны, эти отклоняющиеся гликаны представляют собой очень малую часть, которая часто может оставаться незаметного даже такими высокочувствительными методами, как масс-спектрометрии. Например, в внутри- и внеклеточной жидкости организма, спектр широкого белка концентрация (которая охватывает восемь порядков) может предотвратить обнаружение дефицитных гликопротеинов, которые замаскированы более распространенных видов. 32 Кроме того, определение гликозилтрансферазной активности остается значительным практическим и теоретическая проблема , потому что многие гликозилтрансферазы отсутствуют в клинических biofluids или становятся неактивными ех естественных условиях. Несмотря на всю сложность состоялоTLY обнаружения и количественной оценки ультра-малых количеств уникальных целых гликанах, практиков масс-спектрометрии добились огромных успехов в направлении применения нетронутыми гликаны как клинических маркеров. Недавно мы разработали дополнительный подход к анализу интактных гликанов, что, используя GC-MS, облегчает обнаружение всех учредительного точку ветвления и рычажный специфических моносахаридов ( "гликановые узлов"), которые в совокупности придают пищевым уникальность каждого Гликан и во многих случаи непосредственно служат в качестве молекулярных суррогаты, которые количественно относительную активность виновном гликозилтрансферазы (ов).
Так как его впервые сообщили непосредственное применение к гликановой анализу в 1958 году, газовой хроматографии (ГХ) доказала мощный метод для анализа каждого-метилированных моно- и дисахаридов, 34 определяют их anomericity и абсолютную конфигурацию, и отделить их для последующего масс - спектрометрического анализа. 35 В период с 1984 по 2007, Ciucanu и коллегвведена и уточнена твердофазного технику Гликан permethylation, применяемому гидроксид натрия и йодистый метил, а затем путем экстракции жидкость / жидкость перметилированных гликанов с использованием воды и хлороформа. 35,36 В период с 2005 по 2008 год, Кан и его коллеги интегрировали экономии времени спин -column подход в стадию permethylation. 37,38 в 2008 году исследовательская группа Гетц разработал количественную твердофазного permethylation методом гликан-профилирование с помощью матричной лазерной десорбцией-ионизацией (MALDI) масс - спектрометрии для сравнения и потенциально различать инвазивной и не -invasive клетки рака молочной железы; 39 затем, в 2009 году команда Гетц в сочетании ферментативная и методы химического высвобождения расщеплять O -glycans из неповрежденных гликопротеинов в сильно щелочном схеме permethylation твердофазного 40 Хотя процедура Гетц способствовала одновременно permethylation и высвобождения химических реагентов. из -glycans O, он был применен только к предварительно изолированных Glycoбелки. Мы модифицировали эту методику в 2013 году и адаптировать его для целых нефракционированного biofluids и образцов гомогенизированных тканей путем включения трифторуксусной кислоты (ТФК) гидролиз, восстановление и ацетилирование шаги. 33 Эти дополнительные шаги также выпуск гликаны из гликолипидов и N -связанной гликаны из гликопротеинов и конвертировать их в частично метилированных полиолов ацетатов (PMAAs, рисунок 1), чьи отличительные узоры метилирования и-ацетилирование облегчают анализ с помощью ГХ-МС и однозначно характеризуют составляющие гликанов узлы в оригинальной неповрежденной гликановой полимера 41 (рисунок 2). 33 в конечном счете, это процедура производит композиционный портрет всех гликанов в сложном биожидкости основанный на прямом, относительной количественной оценки уникальных гликанов функций, таких как «ядро фукозилирования», «6-сиалилирования", "рассекает GlcNAc" и "бета-1-6 ветвление" - каждый полученный из одного ГХ-МС chromatograpик пика. В данной статье представлены дальнейшую оптимизацию permethylation, ацетилирование, изоляцию и очистке этапы наряду с улучшениями в режиме относительной количественной оценки.
протокол
Внимание: Избегать контакта с кожей / зрительный контакт с любым из реагентов , используемых в этом эксперименте. После экспозиции, тщательно промойте пораженный участок водой и немедленно обратитесь к врачу.
1. Permethylation и Glycan Добыча
- Подготовка колонки
- Получить как можно больше единиц микрофужную спина столбцов в качестве образцов для анализа. Перерыв и снять пластиковые колпачки трубки коллектора. Поместите микроцентрифуге мини-фильтр в каждой трубке коллектора. Поместите собранные микроцентрифуге спиновые столбцы (содержащие мини-фильтры) в стойку пробирке.
- Получают запас гидроксида натрия (NaOH) шарики (20-40 меш). Передача некоторое NaOH в небольшой лодке весом или, если влажность вызывает образование комков, горячий фарфоровой ступке в качестве рабочего запаса NaOH. Избегайте использования комки NaOH или измельченных / порошковое бусин NaOH.
Внимание: NaOH является сильным токсином и коррозионное основание. Промывать открытые участки кожи / глаза водой в течение 15 мин. ThorougHLY очистить рабочее место после завершения эксперимента. - С помощью небольшой совок или шпатель, передавать NaOH бусин из рабочего запаса для заполнения микроцентрифуге мини фильтров с помощью NaOH до первой наружной фаской (~ 5 мм ниже краёв). Нажмите заполненные микроцентрифуге фильтры на стендовом для упаковки / конденсироваться бусинки NaOH.
Примечание: На протяжении всего этого эксперимента, чтобы свести к минимуму чрезмерного адсорбции воды с помощью гигроскопических NaOH бусин, поддерживать уровень каких - либо добавленных жидкостей (например, ацетонитрил, диметилсульфоксид, анализируемое вещество раствор) над поверхностью упаковки колонки NaOH и ограничить непосредственный контакт с воздухом. - Получить запас ацетонитриле (ACN). Передача ~ 350 мкл ACN каждому NaOH упакованы микроцентрифуге мини-фильтр. Держите NaOH, погруженную под ACN и удалить большие пузырьки воздуха путем перемешивания с наконечником-гофрированные гель-погрузочной наконечником пипетки.
Внимание: Ацетонитрил является горючим раздражителем. - Колонка Центрифугирование
- Устройте микроцентрифуге столбцы симметрично внутри центрифуге; взвешиваем весами трубку при необходимости. Избегайте попадания каких-либо гранул NaOH в центрифуге. Закройте крышку центрифуги.
- Центрифуга столбцы (содержащие NaOH и ACN) в течение ~ 15 сек при 2400 × г.
- После завершения центрифугирования, удалить микроцентрифуге столбцы из центрифуги и отбросить ACN в контейнер опасных отходов. Держите колонку NaOH упаковки нетронутыми.
- Добавить ~ 350 мкл диметилсульфоксида (ДМСО) в каждом NaOH, упакованные микроцентрифуге мини фильтр. Держите NaOH погружалось в ДМСО и удалить любые крупные пузырьки воздуха с наконечником пипетки. Как было описано ранее, центрифужные колонки в течение ~ 15 сек при 2400 & bull; g, и отбрасывать ДМСО при сохранении NaOH упаковки нетронутыми.
Внимание: ДМСО является мутагенным и раздражителем и легко впитывается через кожу. - Подключите все микроцентрифуге мини-фильтры с пробками, включенных в спиновый фильтрКомплект. Перенести ~ 350 мкл ДМСО каждому NaOH упакованной микроцентрифуге мини-фильтр и использовать 200 мкл пипетки, чтобы удалить пузырьки воздуха в упаковке NaOH, так что ДМСО достигает все регионы в пределах затем NaOH упаковки. Избегайте дробления или чрезмерно выскабливание бусинки NaOH; NaOH, порошок является нежелательным. Закончить этот шаг как можно быстрее.
- Получение контроля качества плазмы (QC) образца (ов)
Примечание: Для обеспечения стабильных результатов через опытных партий, рассмотреть возможность использования по меньшей мере одну аликвоту образца , взятого из большого, однородной объемной коллекции биологического материала , представляющего интерес для анализа в каждой партии. Например, если анализ плазмы крови, используют аликвоту (ы) насыпного сбора плазмы крови в качестве образца QC (ов) в каждой партии. Образцы процесса и контроля качества, таким же образом, как неизвестные образцы.- Центрифуга запас образец плазмы QC в течение 4 мин при ~ 10000 × г. Во время центрифугирования, некоторые осадок высокой плотности может осесть йе дно и некоторое количество осадка с низкой плотностью может плавать на поверхности плазмы. Избегать как при удалении аликвот (ы) плазмы.
- Перейдите к разделу "1.3) Подготовка проб" ниже. Затем вернитесь к этому шагу после плазменного центрифугирования завершена.
- Вывод 9 мкл плазмы центрифугировали QC и передать его на помеченную пробирку 1,5 мл полипропилена, снабженную откидную крышкой (далее именуемые как "1,5-мл пластиковой пробирке"). Добавить 1 мкл деионизированной воды к каждой аликвоте; при желании, использовать это в качестве носителя для внутреннего стандарта (ов).
- Добавить 270 мкл ДМСО для этого контроля плазмы. Вихревой чтобы обеспечить полное растворение.
- Базовые приготовления
- Получить как можно больше 1,5 мл пластиковые пробирки, как число биологических (аналита) образцов.
- Передача 9 мкл каждого биологического (аналита) образца в соответствующий 1,5 мл пластиковую пробирку. Передача 1 мкл деионизированной воды и 270 мкл ДМСО для каждой пробирки.
- Энергично перемешать (например, вихревые и / или многократно пипетка вверх и вниз) выборки , чтобы обеспечить полное растворение в ДМСО.
Внимание: Выполните следующие действия внутри вытяжного шкафа. Используется в следующих шагах, йодистый метил (СН 3 I), дихлорметан (CH 2 Cl 2, также известный как хлористый метилен) и хлороформ (CHCl 3, трихлорметан), представляют собой летучие жидкости , способные растворять некоторые виды пластмасс (например, перчатки из нитрила) , Обязательно используйте растворитель перчатками. Из-за их низкой вязкостью и высокой упругости паров, эти реагенты могут капать из пипетки во время передачи данных. Свести к минимуму потери реагентов и потенциального воздействия путем проведения исходного раствора, прилегающей к приемной емкости. - Перенести достаточный общий объем йодистого в маленькую чистую пробирку. Каждый образец анализируемого вещества потребуется 105 мкл йодистый метил. Передача ~ 500 мкл дихлорметана в Анофэр чистую трубку. Для предотвращения засорения шприца, промойте шприц с дихлорметаном сразу же после передачи йодметана.
Внимание: Иодметан фоточувствителен, изменчивы, и мощный токсин , способный повредить центральную нервную систему или причинение смерти при вдыхании или заглатывании. Дихлорметан является потенциальным канцерогеном, репродуктивный мутагенным и мощным раздражителем способны повредить несколько органов или причинение смерти. - Используйте аналитический шприц, чтобы добавить 105 мкл йодметан для каждого образца анализируемого вещества. Cap анализируемые трубки немедленно свести к минимуму иодметана испарения. Тщательно вихрем и, при необходимости, на короткое время центрифужные все образцы, чтобы гарантировать, что жидкость не остается в крышке. Любое изменение цвета (например, до коричневого цвета, фиолетовый или желтый) сигнализирует о деградации иодметана, что может поставить под угрозу следующую реакцию permethylation.
- Ополосните аналитический шприц, используемый для передачи йодметан дихлорметаном по меньшей мере, 3 раза. Это позволит предотвратить его сюдам засорение. Утилизировать этого полоскание, наряду с дополнительным йодметана и дихлорметаном в органических отходов судна опасных. Поместите используемые пробирки в контейнер для опасных отходов.
- Получить новый набор 2-мл пластиковых труб коллектора. Удалить оснастку крышки, если это необходимо.
- Отключите микроцентрифуге мини-фильтры. Центрифуга Unplugged колонки в течение 15 сек при 2400 × г, а затем выбросить в резервуар трубки вместе с ДМСО стоков.
- Повторно подключить Центрифугированный спиновые столбцы, и поместить их в новых пластовых труб. Число каждый спин колонки и соответствующий резервуар трубки с тем же самым номером образца. Убедитесь в том, что мини-пробки фильтра затянуты; потенциально возможные утечки может воздействовать на следующий шаг. Сведение к минимуму время между удалением ДМСО от спиновых колонн и переноса образцов анализируемого вещества на спиновых колонках.
- Permethylation
- Количественно передачи каждого образца раствора в соответствующий NaOH-бусинка заполненном микрофужную спина соlumn. Используйте 1000 мкл кончиком пипетки для этого шага. После переноса обжимной ~ 2 мм от конца наконечника 200 мкл и оставить его в содержимом столбца, чтобы использовать в качестве мешалки. Повторите эти действия для всех образцов.
Примечание: Низкая вязкость йодометаном может привести к потере образца , так как раствор анализируемого вещества может капать из кончика пипетки во время передачи данных . Удерживая трубку образца и столбец спиновый соседствуют друг с другом с одной стороны, и быстро передавать раствор образца с другой стороны. - Оставляют реакционную смесь permethylation протекать в течение 11 мин. Перемешать каждый образец по меньшей мере, 4-5 раз в течение этого периода. Для повышения эффективности permethylation, которое происходит на поверхности NaOH бусин, используют наконечник извитых гелевые загрузкой пипеток, как мешалка, чтобы аккуратно перемешать содержимое колонки. Агрессивное смешивание может проколоть спиновый фильтр, распылить и приостановить NaOH шарики (которые могут снизить эффективность последующей жидкости / жидкостной экстракции), и / или привести к потере образца (как саmple пропитанный NaOH гранулы могут переливаться из колонки).
- В процессе подготовки к последующей стадии экстракции в системе жидкость / жидкость, приготовить достаточное количество 0,5 М раствора хлорида натрия (NaCl) в фосфатном буфере 0,2 М натрия (рН 7,0), чтобы хранить при комнатной температуре. Каждый образец потребует в общей сложности ~ 12 мл раствора NaCl для всех трех циклов экстракции в системе жидкость / жидкость.
- По завершении 11-минутного периода permethylation, сразу же осторожно отсоединив колонны и отцентрифугированы в течение 15 сек при 2400 х г. Выбросите пробки.
- Количественно передачи каждого образца раствора в соответствующий NaOH-бусинка заполненном микрофужную спина соlumn. Используйте 1000 мкл кончиком пипетки для этого шага. После переноса обжимной ~ 2 мм от конца наконечника 200 мкл и оставить его в содержимом столбца, чтобы использовать в качестве мешалки. Повторите эти действия для всех образцов.
- Немедленно удалите спиновые столбцы из центрифуги и поместите их в новый набор пустых трубок спинового резервуара, в результате чего проточный раствор, содержащий свеже перметилированные гликаны позади. Ничего не выбрасывайте.
- Как можно скорее, добавить 300 мкл ацетонитрила (ACN) к сухим, NaOH заполненных спиновых фильтров. Центрифуга спиновых фильтров в течение 30 секунд при 9,600 × г.
- Immediatelу после этого перенести основное решение permethylation (то есть решение , которое инкубировали с гранулами NaOH в течение 11 мин , затем прядильный через спиновый фильтр в центрифужную пробирку перед добавлением 300 мкл ACN в предыдущем шаге) к силанизированы 13 х 100 мм стеклянные пробирки , содержащие 42 3,5 мл 0,2 М фосфатного буфера натрия , содержащего 0,5 М NaCl, рН 7,0 и перемешать (вихревой) немедленно. Избегайте передачи каких-либо твердых белого остатка на этом этапе. Сделайте это для каждого образца прежде чем перейти к следующему шагу.
- Без задержек, передача (скомбинировать) ACN спин-через в каждой трубке коллектора к (с) остальной части жидкого образца в соответствующей силанизированном стеклянной трубки и сразу перемешать (вихрь). Опять же, избежать переноса каких-либо твердых белого остатка на этом этапе. Cap, трясти, и вихревая стеклянная трубка. Повторите эти действия для каждого образца. Откажитесь колонны NaOH и пипетки Пастера в соответствующих контейнеров для отходов.
- Жидкость / Жидкость Extraфикция и Glycan Очистка
- Внутри вытяжкой, добавьте 1,2 мл хлороформа к каждому образцу. Сразу же после этого, крышка Силанизированные стеклянные трубки и энергично перемешать содержимое.
- Предварительно разогрейте металлические блоки до приблизительно 75 ° С в испарительную коллекторе. Использование нагревательных блоков с колодцами, которые могут вместить 13 × 100 мм стеклянных трубок.
- Получить новый набор силанизированы пипетки Пастера, без силанизированы пипетки Пастера и силанизированы стеклянные пробирки с крышками.
Внимание: Хлороформ (CHCl 3) является раздражителем, мутаген, и потенциальным канцерогеном способные проникать через некоторые типы перчаток. - Кратко центрифуга (~ 3000 × г) образца, содержащего стеклянные трубки для разделения водного и органического слоев.
- Использовать не силанизированы пипетку Пастера, чтобы извлечь достаточно верхнего водного слоя таким образом, что ~ 3 мм водного слоя остается выше нижнего органического слоя.
- Добавить 3,5 мл 0,5 М NaCl раствор в фосфатном буфере 0,2 М натрия (рН 7) в каждой стеклянной трубки, энергично перемешать, и кратко центрифуге (~ 3000 × г). Как и в предыдущем шаге (1.4.3), использовать не-силанизированы пипетки Пастера для извлечения водного слоя.
- Повторите предыдущий шаг (1.4.4), но оставить ~ 1 мл водного слоя.
- Используйте чистую силанизированы пипетки Пастера перенести органический слой на чистую и надлежащим образом маркированных силанизированы 13 × 100 мм стеклянную пробирку. Во избежание загрязнения водной экстракцией следующим образом:
- Возьмитесь обеими руками за текущие и новые тестовые силанизированы стеклянные трубки рядом друг с другом в одной руке. С другой стороны, нажмите пипетку лампу для создания пузырьков при вставке пипеткой вниз через водный слой.
- Оказавшись внутри органического слоя, прекратить создавать пузыри, и держать пипетку лампу устойчивый, чтобы органические и водные слои, чтобы стабилизировать и отделить снова. Затем медленно отпустите лампу, чтобы снять, как большая часть органиC слой, насколько это возможно без какого-либо водного загрязнения.
- Быстро поднимите наконечник пипетки через водный слой, и сопротивление естественному рефлекс слегка отпуская лампу (что приводит к снятии некоторых водного загрязнения), поднимая пипетку из трубки.
- Быстро передавайте органический слой маловязкую к смежной новой трубки. Любой водный загрязнение будет выражаться в виде мелких капель жидкости в верхней части извлеченного органического слоя в новых стеклянных трубок. Если водный / загрязнение NaCl видна, удалите его с помощью пипетки; центрифугировать при необходимости объединить водяных капель в одну каплю.
- Утилизировать старые стеклянные пробирки, пипетки, а также водные и растворов органических отходов. Мытье и утилизация стеклянной трубки крышки.
- Сушат все образцы под слабым и постоянном токе азота в разогретую до испарения коллектора при 75 ° С в течение ~ 5 мин внутри вытяжном шкафу. Для обеспечения испарительного охлаждения в течение всего сухого вниз STEпс, нежный и постоянный поток азота должен нарушить поверхность жидкости без разбрызгивания или разбрызгивание жидкости. Удалить образцы из коллектора испарения при полной сушки конечного образца. Белые пятнышки на дне высохшего стеклянных трубок указывают на загрязнение буфера / NaCl.
- Пауза процедуру здесь, если не оставаясь в день достаточно времени, чтобы закончить стадию гидролиза TFA. Временно (то есть, в течение ночи) хранения сухих образцов при -20 ° С. Для того, чтобы продолжить процедуру после хранения, извлеките образцы из -20 ° C морозильника и дать им возможность полностью прогреть перед тем распечатывания.
- В то время как образцы тепло, в рамках подготовки к трифторуксусной кислоты (ТФУ) гидролиза (следующий этап), установите колбонагревателя таким образом, чтобы температура жидкого содержимого пробирки достигнет 121 ° С. Приготовьте раствор TFA от TFA запаса (см Шаг 2.1 ниже).
2. трифторуксусная кислота (ТФК) Гидролиз
Внимание: трифторуксусная кислота (ТФК) представляет собой едкое вещество органической кислоты и токсичные раздражителем.
- Подготовьте достаточное количество 2,0 М раствора TFA в деионизированной воде. Каждый образец анализируемого вещества потребуется 325 мкл 2,0 М раствора ТФК. Концентрированный ТФК 13,0 M.
- Добавить 325 мкл 2,0 М TFA для каждого образца анализируемого вещества. Для предотвращения TFA испарения и потери пробы в ходе последующей стадии сушки (2.3 ниже), плотно колпачок каждую пробирку сразу после добавления ТФК. Отметить уровень раствора во всех стеклянных трубок. Vortex каждый образец тщательно перед следующей стадией.
- Инкубируйте плотно блокированы пробирки с образцами в течение 2 ч в подходящем нагревательном блоке предварительно нагретую печь или таким образом, что содержимое доводится до температуры 121 ° С. При использовании нагревательного блока вместо духовки, накройте образец трубки с алюминиевой фольгой, чтобы предотвратить конденсацию TFA в верхней части трубы и частичной сушки осадка образца в нижней части трубы. Проверьте уровень раствора образца после 20-30 мин.чтобы обеспечить минимальное испарение ТФК. При необходимости затянуть колпачки дополнительно или заменить колпачки для более плотного прилегания.
- В течение 2-часового ожидания, установки другого испарения коллектора до 75 ° С в течение следующего шага (см 2.4 ниже).
- Когда 2-часовой период нагрева завершена, сухих образцов при 75 ° С при слабом токе газообразного азота в течение ~ 15 мин. Не оставляйте без присмотра образцы в течение более 15 мин. Часто проверяйте образцы, и прекратить нагревание и сушку, когда все образцы являются сухими.
- Пауза процедуру здесь, если не оставаясь в день достаточно времени, чтобы закончить стадию восстановления. Временно (т.е. в течение ночи) образцы хранят при -80 ° С. Для того, чтобы продолжить процедуру после хранения, извлеките образцы из -80 ° C морозильнике, и дать им возможность полностью прогреть перед тем распечатывания.
3. Уменьшение
- Внутри вытяжном шкафу, подготовить достаточное количество 10 г боргидрида а / л натрия (NaBH 4) раствор в 1 М ammoniгидроксид мкм (NH 4 OH). Каждый образец потребует 475 мкл этого раствора. Сделайте свежее решение для каждой партии образцов. Концентрированный гидроксид аммония (27-30% вес / вес NH 3) составляет приблизительно 14,5 М.
Внимание: Натрия боргидрид (NaBH 4) представляет собой гигроскопичный, реагирующее с водой токсин и мощным раздражителем , что выбросы-при контакте с водой сильно горючий паров , которые вызывают серьезные ожоги при контакте вдыхания, проглатывания, или глаз / кожи.
Внимание: гидроксид аммония (NH 4 OH) является коррозионное раздражителем и токсин способен вызвать серьезные ожоги и необратимого повреждения органов при контакте вдыхания, проглатывания, или глаз / кожи. Промойте пораженные участки с водой в течение 30 мин, и предотвратить жертвы от трения или царапать пораженные участки. - Для каждого образца, добавьте 475 мкл 10 г / л NaBH 4 в 1 М NH 4 OH. Образцы тщательно перемешать, чтобы растворить все остатки. Пробирки Cap ипозволяют восстановительную реакцию продолжать в течение 1 часа.
- В течение 1-часового ожидания, установите испарительный коллектор до 75 ° С с подогревом. Используйте нагревательный блок с соответствующими скважинами для стеклянных трубок (см 3.4 ниже).
- Когда период реакции 1-ч завершена, добавляют 63 мкл метанола (MeOH) в каждом образце. Этот шаг и следующий шаг удаления остаточного бора в виде триметилбората - относительно летучей жидкости, которая закипает при температуре 68 ° С.
- Сухие образцы (в предварительно нагретом коллекторе) при 75 ° C в слабом потоке газа азота в течение ~ 15 мин. Часто проверяйте образцы и не оставляйте их без присмотра. Маленькие капельки жидкости в нижней части стеклянных трубок указывают на то, что образец еще не высохнет.
Примечание: Чтобы отличить пузырьки воздуха из капель жидкости, наклоняя пробирку. Только капли жидкости будут двигаться после наклона, но обратное не всегда верно: если пузырь не двигается, он все еще может быть (очень маленький) капля жидкости. - После того, как SAMPLЕ. С. абсолютно сухие, готовят 9: раствор 1 (об / об) метанола (MeOH) и уксусной кислоты (AcOH). Добавить 125 мкл этого MeOH: AcOH решение каждого образца.
- Сухие образцы (в предварительно нагретом коллекторе) при 75 ° С при слабом токе газообразного азота.
- Когда образцы полностью высохли, сушат под вакуумом образцы в течение 20 мин при комнатной температуре: Место образцы в пластиковый вакуумный бак (например, продаваемые FoodSaver), закройте вакуумной крышкой, установите вакуумный регулятор для "вакуума," Подключение вакуумный шланг и включите вакуум. Чтобы разобрать вакуум, обратить вспять эти шаги. Подождите, пока система полностью распаковывать, прежде чем пытаться открыть крышку вакуумной.
- Пауза процедуру здесь, если не оставаясь в день достаточно времени, чтобы закончить стадию восстановления. Временно (т.е. в течение ночи) образцы хранят при -80 ° С. Для того, чтобы продолжить процедуру после хранения, извлеките образцы из -80 ° C морозильнике, и дать им возможность полностью прогреть перед тем uncappinг.
- Во время ожидания образцов вакуумной сухой (или теплым, после хранения), подготовить реагенты к следующему шагу. Получение и число а силанизированы коническим дном пробоотборником (AS), флакон (с крышкой) для каждого образца. Кроме того, предварительного нагрева и нагревательный блок мелководных хорошо AS-флакон и блок стекла трубки глубоко хорошо так, что содержание стеклянная трубка будет нагреваться до температуры 50 ° С.
4. Ацетилирование (Выполняется в вытяжном шкафу)
- Добавьте 18 мкл деионизированной воды для каждого образца. Cap и тщательно вихрь все трубы для полного растворения любых выделений.
- Добавить 250 мкл уксусного ангидрида в каждой стеклянной трубки. Колпачок, тщательно вихрь, и гомогенат, на водяной бане в течение 2 мин, чтобы обеспечить полное растворение любых остатков и осадков.
- Накройте стеклянные трубки с алюминиевой фольгой, и инкубировать при внутренней температуре 50 ° С в течение 10 мин.
- Добавить 230 мкл концентрированный трифторуксусной кислоты (TFA) к каждому образцу. Сразу довершениеd смешивать образцы. Затем, инкубировать образцы, покрытые алюминиевой фольгой-в течение 10 мин при внутренней температуре 50 ° С.
- После инкубации, добавьте 1,8 мл дихлорметана (CH 2 Cl 2) к каждому образцу. Закрывают и хорошо перемешать.
- Добавить 2,0 мл деионизированной воды для каждого образца. Cap и образцы хорошо перемешать. Центрифуга от 0 до 3000 х г для разделения слоев. Использовать не силанизированы пипетки Пастера для выполнения экстракции жидкость / жидкость, как описано в пункте 1.4.6, для предотвращения загрязнения воды.
- Повторите экстракцию еще раз, в общей сложности на двух извлечений. Используйте силанизированы пипетки Пастера перенести органический слой в маркированные силанизированы AS флаконах (надежно удерживается в стойке AS). Заполните флаконах в виде чуть ниже краев.
- Используйте предварительно нагретой, мелководными также нагревательный блок для сухих образцов (в ампулах) AS в течение 15 мин при 40 ° С в атмосфере газообразного азота. Не пересушивайте. Конечные продукты известны как частично метилированные ацетаты альдитов (PMAAs),
5. Газовая хроматография - масс-спектрометрия (ГХ-МС)
- Развести каждый образец в 100 мкл ацетона и хорошо перемешать. Используйте автосамплером вводить по 1 мкл каждого образца в режиме разделения в GC-сплит режиме вкладышем (поддерживается при 280 ° С и содержащий небольшое пробку силанизированного стекловаты). Используйте раздвоение отношение 40. Использование гелия в качестве газа-носителя в режиме постоянного потока при 0,8 мл / мин через 30-м DB-5 мс колонке GC с ID 0,25 мм и 0,25 микрон толщиной пленки.
- Держа начальную температуру ГХ печи при температуре 165 ° С в течение 0,5 мин. После первоначального времени удержания, программа духового шкафа, чтобы нарастить температуру, для каждого запуска, от 165 ° С до 265 ° С со скоростью 10 ° С / мин (что занимает 10 мин), а затем сразу же рампа температура 265 ° C до 325 ° с со скоростью 30 ° с / мин (которое занимает 2 мин) и поддерживают температуру при 325 ° с в течение 3 мин. Общее время работы на одном образце составляет 15,5 мин.
- Используйте профиPerly настроен и откалиброван масс-спектрометр, чтобы подвергать компоненты пробы, вытекающих из колонки ГХ электронной ионизации (ЭИ, 70 эВ при 250 ° C). Для масс - анализатора TOF, анализировать фрагменты из м / г 40 к м / г 800 со скоростью суммирования импульсов 0,1 сек. Установите EI-нити накала время задержки растворителя 2,5 мин.
Анализ 6. Данные
- При использовании масс-анализатора TOF, суммировать наиболее распространенным и / или диагностических ионов фрагмент для каждого ПМАК путем применения масс-окно 0.15 Da получить извлекаемого ионного хроматограмм. Целевые ионы для каждого ПМАК были опубликованы в другом месте, 33 но следующие изменения были сделаны: ионы трет-GLC теперь 145,1 + 205,1; 2 Человек-ионы 161,1 + 189,1; 3-Gal ионы 161,1 + 233,1, 6-Gal ионы 161,1 + 189,1 + 233,1; 2,6-Man ион 189,1; Ионы 3,6-Man являются 189,1 + 233,1.
- Используйте QuanLynx или другое программное обеспечение для автоматической интеграции площади пиков для каждого ПОДВЕДЕНЫ извлекаемого ионного хроматограмму. Вручную проверить результаты интеграции, рассматривая каждый интегрированный извлекаемого ионного хроматограмму. Затем экспортировать данные пика интеграции в электронную таблицу для дальнейшего анализа и нормализации данных, который включает в себя деление площади каждого отдельного гексозной Xic по сумме всех областей гексозная Xic; Подобным же образом, площадь каждого отдельного HexNAc Xic делится на сумму всех областей HexNAc Xic. Эта процедура производит нормированных содержаний для каждого отдельного гексозы и HexNAc.
Результаты
Ток Хроматограмма ионов общей (TIC) показывает успешный permethylation гидролиз, восстановление и ацетилирования образцов плазмы крови человека по отношению к случаям , в которых были выполнены неправильно два важных шага permethylation показаны на рисунке 3.
Абсолютный выход HexNAcs По отношению к гексоз:
N -acetylhexosamine (HexNAc) частично метилированные ацетаты альдитов (PMAAs) , как правило, имеют более низкую доходность , чем гексоз. 43 Для оценки абсолютного выхода HexNAcs относительно гексоз, шесть 10-мкг образцов N -acetyllactosamine (а Gal1-4GlcNAc дисахарида) в анализировали по 10 мкл воды. интегрировались TIC площади пиков для терминала галактозы (трет-Gal) и 4-GlcNAc. Процент 4-GlcNAc по отношению к общему количеству трет-Gal и 4-GlcNAc составила 11,3 ± 0,7%(СЭМ). Хотя урожайность HexNAc воспроизводимы (см ниже), тот факт, что эта величина значительно меньше, чем теоретическое значение 0,5 указывает на то, что выход HexNAcs принципиально ниже, чем у гексоз. (Теоретический выход HexNAc составляет 0,5 , потому что N -acetyllactosamine является 1: 1. Гексозная-HexNAc дисахарид)
Внутри- и межпробная Воспроизводимость:
Внутри- и межпробная воспроизводимости для всех гликанов узлов , способствующих , по меньшей мере 1% от общего гексозы или сигнала HexNAc, приведены в таблице 1. Эти данные были получены с помощью 3 -х отдельных аналитиков на 3 отдельных дней, используя один и тот же запас ЭДТА плазмы. Данные о стабильности пробоотборник в соответствии с настоящим оптимизированного протокола для 18 наиболее распространенных гликанов узлов в плазме крови человека (то есть те , с> 1% от общего гексозы или HexNAc сигнала) предусмотрены на рисунке 4.
Другие важные замечания:
При оптимизации методологии permethylation, мы обнаружили, что это не является необходимым для предотвращения адсорбции воды с помощью NaOH бусинами до первоначального промыванием ацетонитрилом. Мы также обнаружили, что присутствие небольшого количества воды во время конечной стадии ацетилирования в комбинации с короткого периода нагрева с уксусным ангидридом без TFA помогает облегчить полное завершение реакции. И, наконец, высокая разрешающая способность времени пролета (TOF) масс-спектрометрии не является необходимым для успешного анализа гликановой узла: Начальные результаты, основанные на параллельной инъекции того же самого набора образцов на GC-TOF-MS и традиционной квадрупольного передачи основанное ГХ-МС работает в выбранном режиме мониторинга ионов (SIM), демонстрируют сходные результаты, с точки зрения окончательного нормализованного гексозы и относительного содержания HexNAc.
er.within-страница = "1"> 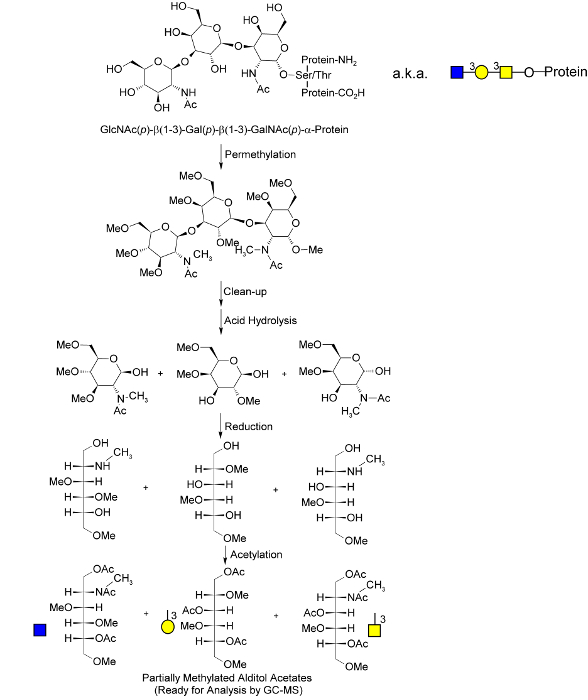
. Рисунок 1. Обзор Молекулярный глобальной процедуры гликановой анализа метилирования Уплотнительное -связанной Гликан иллюстрированные; их высвобождении в процессе permethylation, который был адаптирован из Гоец 40 . После permethylation и гидролиза, моносахариды уменьшаются и формирующиеся гидроксильных групп " , отмеченные" ацетилированием. Уникальная картина метилирования и ацетилирования в конечных частично метилированных полиолов ацетатов (PMAAs) соответствует уникальному "гликановой узла" в оригинальном неповрежденного полимера и обеспечивает молекулярную основу для разделения и количественного определения с помощью ГХ-МС. N -связанной и гликолипидов гликаны выпускаются в качестве сцепления с обозначенным моносахаридов во время кислотного гидролиза. Взято из Borges и др. 33 с разрешения.> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2. концептуальный обзор аналитической концепции. Активируемых гликозилтрансферазу (например, GNT-V) , приводит к увеличению количества конкретного, однозначно связанного гликановой моносахаридов остатка (2,6-связанный маннозными «узел» в данном примере) -Какой, через последующее действие других гликозилтрансферазами, может привести к образованию смеси гетерогенных целого гликанов структур при низком числе копий каждый-каждый из которых может быть трудно обнаружить и количественно в обычном порядке. Аналитически объединение вместе "гликанов узлы" из числа всех аберрантных гликанов структур обеспечивает более прямой суррогатной измерение GnT-V активности, чем любая другая неповрежденных гликана. Одновременное измерение N -, O - и липидный связанный "Glyc Н. узлы "в целом biospecimens , как описано здесь (и первоначально в другом месте 33) представляет собой концептуально новые средства , с помощью которых для выявления и мониторинга Гликан-аффективных заболеваний , таких как рак. Фактические извлекаемого ионного хроматограммы из 10 микролитров образцов плазмы крови показаны. Числа , примыкающие к моносахаридных остатков в гликанов структурах указывают положение , при котором выше остаток связан с нижним остатком. Если нет позиции сцепления не указаны на хроматограмме аннотацию остаток находится либо в концевом положении или в растворе в свободном (например, глюкоза). Все остатки . , кроме ссылки сиаловой кислоты вниз через их 1- м положении; звеньев сиаловой кислоты вниз через его 2- м положении Split в хроматограмме показывает изменение извлекаемых ионов хроматограмм: m / z 117 +129 для гексозы остатков и т / г 116 + 158 для N - ацетилгексозамин (HexNAc) остатки. адаптировано из Borges и др. 33 с разрешения автора .61 / 53961fig2highres.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Представитель Результаты. Тока хроматограммы Всего ион (тиков) для анализа гликанов узла одного и того же человека образца ЭДТА плазме крови , в которой А) образец был обработан правильно, В) белый осадок в растворе permethylation , который формуют через NaOH колонки проводили в последующей смеси для экстракции в системе жидкость / жидкость, и с) permethylation решение , которое формуют через колонку раствора NaOH был добавлен в фосфатный буфер , но не тщательно перемешаны перед добавлением хлороформа для экстракции в системе жидкость / жидкость. Легенда при условии , на рисунке 2. Пожалуйста , нажмите часERE для просмотра увеличенной версии этой фигуры.

Рисунок 4. Стабильность пробоотборник Стабильность. AutoSampler в течение 48 часов для 18 наиболее распространенных гликанов узлов в плазме крови человека. В 22 ч образец был полностью высушен и восстанавливали в 120 мкл ацетона. Каждый кластер точек данных представляет собой четыре последовательные инъекции одного и того же образца. Черные линии охватывают ± 15% от среднего нормированного значения для каждого гликановой узла. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Таблица 1. внутри- и межпробная воспроизводимости. Значения представляют% CV от общего гексозы или общей HexNАс-нормированные отдельные гликановые узлы. Все узлы гликановые , способствующие не менее 1% от общего гексозы или сигнала HexNAc перечислены. Данные были получены с помощью 3-х отдельных аналитиков на 3 отдельных дней, используя один и тот же запас ЭДТА плазмы. N = 6 образцов на партию. Пожалуйста , нажмите здесь , чтобы загрузить эту таблицу в таблицу Excel.
Обсуждение
В целом, успешное производство частично метилированных полиолов ацетатов (PMAAs) от гексозы чревато меньшими трудностями и более надежна , чем успешного производства N -acetylhexosamine (HexNAc) PMAAs. Точный механизм этого явления позади , как он играет на каждом этапе этой процедуры неизвестна, но должна относиться к уникальной химии -он группы N (а не гидроксильной группой) , которая является уникальной для HexNAcs относительно гексоз. Механизм позади этого явления , как он относится к кислотному гидролизу объясняется в другом месте. 43 Короче говоря, способность к N -methylacetamido стать положительно заряженными во время кислотного гидролиза делает гликозидной связи устойчив к кислотного гидролиза. Это объясняет низкий выход HexNAc по отношению к гексозы (11,3% от общего HexNAc + гексозной сигнала, а не 50% от общего числа) , как описано выше для анализа N -acetyllactosamine. Примечательно, что это относительно лВыход Ауэр из HexNAcs не делает их трудно обнаружить в сложных biofluids и тканей, или исключает легкое обнаружение гликанов узлов , полученных из больших и сложных гликанов (например, 2,4-Man, 2,6-Man, 3,4,6 -Man, и 3,4-GlcNAc, рисунок 2). 33 Учитывая то , каким образом XIC площади пиков гликанов узлов нормируются (этап 6.3), до тех пор , как относительный выход каждого отдельного HexNAc остается неизменным по сравнению с другими HexNAcs ( что она делает, таблица 1), полезную информацию об относительных количеств различных HexNAcs между различными образцами могут быть получены. Это справедливо для гексоз, а также. Кроме того, мы ранее показали , что отношение к гексоз HexNAcs отображать последовательное количественное поведение, а 33 - это явление , которое постоянно контролируется с помощью включения образца QC (ов) в каждой партии.
Порядок, в котором осуществляется permethylation оказывает наибольшее влияние наобщий выход и воспроизводимость HexNAc PMAAs. В частности, большое внимание должно быть принято, чтобы полностью исключить воздействие перметилированные гликанах до щелочных водных условиях. Два ключевых шагов в этом направлении являются 1) оставляя все белый осадок в спин-преимущества решений позади (Steps 1.3.13 и 1.3.14), и 2) сразу же смешивание спин-через решения, как только они будут добавлены в фосфатный буфер ( шаги 1.3.13 и 1.3.14). Буфер, а не простой раствор соли включен на данном этапе, и для последующих стадий жидкость / жидкостной экстракции для предотвращения непреднамеренного подщелачивание водного раствора. Мы подозреваем, что в щелочных условиях ацетильная группа метилированных и ацетилированный 2-аминогруппы HexNAcs может подвергаться гидролизу, что приводит к более полярным вторичного амина, который снижает общую эффективность экстракции ассоциированного гликана в хлороформе.
Наиболее легко узнаваемым особенность неудачно перметилированных HexNAcs являетсяинтенсивность 4-связанной GlcNAc (4-GlcNAc) хроматографического пика по отношению к тем , 6-Гал, 3,6-Man, и базовая интенсивность фона во время последней колонке испечь-аута (рисунок 3). Когда абсолютное изобилие 4-GlcNAc ПМАК низка, то его нормализованное обилие по отношению ко всем остальным HexNAcs также имеет тенденцию к снижению, с сопутствующим увеличением (наиболее заметно) 3,4-GlcNAc.
Несколько изменений , разработанных для оптимизации общей доходности и анализа надежности были сделаны , так как наша первоначальная публикация , описывающая этот аналитический подход 33 Одним из таких изменений является способ , в котором интегральная извлекаемого ионного хроматограмм (XICs) нормированы:. Для простоты, мы теперь разделить площадь каждого отдельного гексозы Xic по сумме всех областей гексозную Xic; Подобным же образом, площадь каждого отдельного HexNAc Xic делится на сумму всех областей HexNAc Xic. Как видно из таблицы 1, в целом межпробная / между аналитик reproducibilности для всех гликанов узлов, которые вносят вклад в> 1% от их соответствующих гексоз или HexNAc сигнала составляет в среднем 13% CV.
Насколько нам известно, это единственное воплощение истинно снизу вверх glycomics, в котором гликаны сначала разбиты, а затем их компоненты проанализированы для построения количественной выборки в масштабах всей портрет гликановой композиции. Здесь вместо традиционного выпуска ферментативной, процесс permethylation не-восстановительное устраняет (выпуски) O -связанной гликаны из их соответствующих белков, в то время как 40 N -связанной гликаны , выделяющихся при кислотного гидролиза. 33 В качестве дополнительного подхода к традиционным нисходящих glycomics , такой подход способен объединить уникальные гликанов черты, представляющие интерес, такие как "основной фукозилирования", "6-сиалилирования", "рассекает GlcNAc" и "бета-1-6 разветвлений" на отдельные аналитические сигналы (см, 4,6-GlcNAc , 6-Гал, 3,4,6-Man и 2,6-Man узлы на рисунке 2, respectively). В традиционных подходах сверху вниз, такие функции, как эти , которые в конечном счете зависят от уникальных деятельности одного или двух ключевых гликозилтрансферазами 33 , как правило , распределены по десяткам интактных гликанов , а иногда может быть трудно или невозможно решить (например, 3-сиалилирование vs. 6-сиалилирование) в связи с вырождением некоторых интактных гликанов масс. Кроме того, подход снизу вверх , представленные здесь продемонстрировала первоначальное обещание в неинвазивной диагностики рака легких. 33 Дальнейшие исследования ведутся для проверки этих первоначальных выводов, а также дополнительные, но неопубликованные результаты , относящиеся к обнаружению других форм рака.
Наибольшее ограничение описанного подхода является то, что она ограничена с точки зрения его пределов обнаружения, если бы она была применена к предварительно изолированных гликопротеинов. На основе неопубликованных анализа отдельных гликанов стандартов без белка-носителя, пределы количественного определения оптоволоконныйг отдельные гликаны по всей видимости, лежат в низком диапазоне микрограмм. Они ни в коем случае не низкие LOQs в абсолютном выражении, но этот факт не имеет значения в отношении первоначально запланированного объема анализа-который не был разработан и не имеет необходимости достичь низких LOQs (по крайней мере, для целей, описанных здесь и в нашей предыдущей публикации 33). На самом деле, человеческая плазма / сыворотка содержит гликопротеиды в 10с от концентрации в мг / мл диапазона это означает , что для анализа плазмы крови / сыворотке мы только впрыснуть ~ 1/100 конечного объема образца и разделен на 40 из 41 частей что небольшое количество, чтобы тратить в порту ГХ инжектора. Без этой практики, некоторые из Гликан узлов может насытить детектор. Пмоль количества гликопротеинов, которые могут привести к неадекватному интактных гликанов сигналы обычным сверху вниз MALDI-MS или LC-MS подходы, основанные не могут быть обнаружены с помощью этого подхода. Дальнейшее совершенствование методологии ведется для устранения этого ограничения.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by the College of Liberal Arts and Sciences of Arizona State University in the form of laboratory startup funds to CRB. It was also supported by a grant from Flinn Foundation (Grant No. 1977) and by the National Cancer Institute of the National Institutes of Health under Award Number R33CA191110. JA was supported by the National Institute of General Medical Sciences of the National Institutes of Health Postbaccalalureate Research Education Program (PREP) under award number R25GM071798. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium hydroxide beads | 367176 | Sigma-Aldrich | 20-40 mesh, reagent grade 97% |
| 0.9 ml Spin column | 69705 | Pierce division of ThermoFisher Scientific | Includes plugs and polyethylene frits |
| GC-MS autosampler vial (silanized)* | C4000-9 | ThermoFisher Scientific | Target DP High Recovery Vial, 1.5 ml, 12 mm x 32 mm, includes Teflon-lined pierceable caps |
| 1.5 ml polypropylene test tubes | 05-402-25 | ThermoFisher Scientific | Snap-cap lid |
| 2 ml polypropylene test tubes | 05-408-138 | ThermoFisher Scientific | Snap-cap lid |
| Dimethyl Sulfoxide (DMSO) | D8418 | Sigma-Aldrich | BioReagent for molecular biology, reagent grade >99.0% |
| Iodomethane | I8507 | Sigma-Aldrich | Contains copper as stabilizer, ReagentPlus 99% |
| Acetonitrile | A955-4 | ThermoFisher Scientific | Optima LC/MS |
| Microcentrifuge | 75002436: Sorvall Legend Micro 17 Centrifuge | ThermoFisher Scientific | 24 x 1.5/2.0 rotor with ClickSeal biocontainment lid. Rotor catalog number: 75003424 |
| 13 x 100 glass test tube (silanized)* | 53283-800 | VWR | 13 mm x 100 mm borosilicate glass test tubes with screw-cap finish |
| Caps for glass test tubes | 14-930-15D | ThermoFisher Scientific | Kimble™ Black Phenolic Screw Caps; 13 mm-415 GPI thread; PTFE-faced rubber liner. |
| Sodium chloride | S7653 | Sigma-Aldrich | >99.5% pure |
| Chloroform | 4440-08 | Macron Fine Chemicals | |
| Trifluoroacetic acid | 299537 | Sigma-Aldrich | 99% purified by redistillation for protein sequencing |
| Sodium borohydride | 71321 | Fluka Analytical | 99% |
| Ammonium hydroxide solution | 320145 | Sigma-Aldrich | NH3 content: 28.0-30.0% |
| Methanol | AH230-4 | Honeywell Burdick & Jackson | HPLC grade |
| Acetic acid | 320099 | Sigma-Aldrich | 99.70% |
| Plastic vacuum desiccator | Any model of adequate size | FoodSaver | |
| Acetic anhydride | 539996 | Sigma-Aldrich | 99.50% |
| Dichloromethane | D143SK-4 | ThermoFisher Scientific | Stabilized HPLC grade |
| Acetone | 9006-03 | J.T.Baker | Baker Analyzed |
| Heated evaporation manifold (main unit) | pi18823 | ThermoFisher Scientific | Thermo Scientific* Reacti-Therm* Heating and Stirring Module; Triple-block Model with Heating and Stirring Function |
| Heated evaporation manifold (overhead evaporator) | pi18826 | ThermoFisher Scientific | ThermoScientific* Reacti-Vap Evaporator, 27-port; For use with triple-block Reacti-Therm heating module |
| Aluminum sample-holder blocks for evaporation manifold | pi18816 | ThermoFisher Scientific | Block, Aluminum, Reacti-Block S-1, Holds 13 mm dia test tubes, 13 holes (14 mm dia. x 45 mm deep) |
| Gas chromatograph | Model A7890 | Agilent | Equipped with CTC PAL autosampler |
| Mass spectrometer | GCT Premier (Time-of-Flight) | Waters | |
| Split-mode liner (deactivated / silanized) | 5183-4647 | Agilent | Containing a small plug of silanized glass wool |
| DB-5ms GC column | 122-5532 | Agilent | 30 m x 0.25 mm ID x 0.25 micron film thickness |
| Chlorotrimethylsilane | 95541 | Sigma-Aldrich | |
| Glass vacuum desiccator (for glassware silanization) | EW-06536-30 | Cole-Parmer | 12" wide; 230 mm plate size |
| *Glassware silanization is carried out in-house, overnight using chlorotrimethylsilane vapor in a large glass vacuum desiccator. | |||
Ссылки
- Li, M., Song, L., Qin, X. Glycan changes: cancer metastasis and anti-cancer vaccines. J Biosciences. 35 (4), 665-673 (2010).
- Stanley, P., Schachter, H., Taniguchi, N., Varki, A., et al. . Essentials of Glycobiology. , Ch. 8: N-Glycans (2009).
- Apweiler, R., Hermjakob, H., Sharon, N. On the frequency of protein glycosylation, as deduced from analysis of the SWISS-PROT database. Biochim Biophys Acta. 1473 (1), 4-8 (1999).
- Brockhausen, I., Schachter, H., Stanley, P., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Rini, J., Esko, J., Varki, A., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Gercel-Taylor, C., Bazzett, L. B., Taylor, D. D. Presence of aberrant tumor-reactive immunoglobulins in the circulation of patients with ovarian cancer. Gynecol Oncol. 81 (1), 71-76 (2001).
- An, H. J., et al. Profiling of glycans in serum for the discovery of potential biomarkers for ovarian cancer. J Proteome Res. 5 (7), 1626-1635 (2006).
- Kanoh, Y., et al. Changes in serum IgG oligosaccharide chains with prostate cancer progression. Anticancer Res. 24 (5B), 3135-3139 (2004).
- Kyselova, Z., et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res. 6 (5), 1822-1832 (2007).
- Okuyama, N., et al. Fucosylated haptoglobin is a novel marker for pancreatic cancer: a detailed analysis of the oligosaccharide structure and a possible mechanism for fucosylation. Int J Cancer. 118 (11), 2803-2808 (2006).
- Zhao, J., et al. Glycoprotein microarrays with multi-lectin detection: unique lectin binding patterns as a tool for classifying normal, chronic pancreatitis and pancreatic cancer sera. J Proteome Res. 6 (5), 1864-1874 (2007).
- Comunale, M. A., et al. Proteomic analysis of serum associated fucosylated glycoproteins in the development of primary hepatocellular carcinoma. J Proteome Res. 5 (2), 308-315 (2006).
- Goldman, R., et al. Detection of Hepatocellular Carcinoma Using Glycomic Analysis. Clin Cancer Res. 15 (5), 1808-1813 (2009).
- Aurer, I., et al. Aberrant glycosylation of Igg heavy chain in multiple myeloma. Coll Antropol. 31 (1), 247-251 (2007).
- Abd Hamid, U. M., et al. A strategy to reveal potential glycan markers from serum glycoproteins associated with breast cancer progression. Glycobiology. 18 (12), 1105-1118 (2008).
- Kyselova, Z., et al. Breast cancer diagnosis and prognosis through quantitative measurements of serum glycan profiles. Clin Chem. 54 (7), 1166-1175 (2008).
- Hongsachart, P., et al. Glycoproteomic analysis of WGA-bound glycoprotein biomarkers in sera from patients with lung adenocarcinoma. Electrophoresis. 30 (7), 1206-1220 (2009).
- Arnold, J. N., et al. Novel glycan biomarkers for the detection of lung cancer. J Proteome Res. 10 (4), 1755-1764 (2011).
- Bones, J., Mittermayr, S., O'Donoghue, N., Guttman, A., Rudd, P. M. Ultra performance liquid chromatographic profiling of serum N-glycans for fast and efficient identification of cancer associated alterations in glycosylation. Anal Chem. 82 (24), 10208-10215 (2010).
- Kodar, K., Stadlmann, J., Klaamas, K., Sergeyev, B., Kurtenkov, O. Immunoglobulin G Fc N-glycan profiling in patients with gastric cancer by LC-ESI-MS: relation to tumor progression and survival. Glycoconj J. 29 (1), 57-66 (2012).
- Chen, G., et al. Human IgG Fc-glycosylation profiling reveals associations with age, sex, female sex hormones and thyroid cancer. J Proteomics. 75 (10), 2824-2834 (2012).
- Takeda, Y., et al. Fucosylated haptoglobin is a novel type of cancer biomarker linked to the prognosis after an operation in colorectal cancer. Cancer. 118 (12), 3036-3043 (2012).
- Parekh, R. B., et al. Association of rheumatoid arthritis and primary osteoarthritis with changes in the glycosylation pattern of total serum IgG. Nature. 316 (6027), 452-457 (1985).
- Mehta, A. S., et al. Increased levels of galactose-deficient anti-Gal immunoglobulin G in the sera of hepatitis C virus-infected individuals with fibrosis and cirrhosis. J Virol. 82 (3), 1259-1270 (2008).
- Horvat, T., Zoldoš, V., Lauc, G. Evolutional and clinical implications of the epigenetic regulation of protein glycosylation. Clinical Epigenetics. 2 (2), 425-432 (2011).
- Zoldoš, V., Novokmet, M., Bečeheli, I., Lauc, G. Genomics and epigenomics of the human glycome. Glycoconj J. 30 (1), 41-50 (2013).
- Lowe, J. B., Marth, J. D. A genetic approach to Mammalian glycan function. Annu Rev Biochem. 72, 643-691 (2003).
- Tuccillo, F. M., et al. Aberrant Glycosylation as Biomarker for Cancer: Focus on CD43. Biomed Res Int. , (2014).
- Varki, A., Kannagi, R., Toole, B., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Brockhausen, I. Mucin-type O-glycans in human colon and breast cancer: glycodynamics and functions. EMBO reports. 7 (6), 599-604 (2006).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Bertozzi, C. R., Sasisekharan, R., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Borges, C. R., Rehder, D. S., Boffetta, P. Multiplexed surrogate analysis of glycotransferase activity in whole biospecimens. Anal Chem. 85 (5), 2927-2936 (2013).
- Mcinnes, A. G., Ball, D. H., Cooper, F. P., Bishop, C. T. Separation of Carbohydrate Derivatives by Gas-Liquid Partition Chromatography. J Chromatogr. 1 (6), 556-557 (1958).
- Ciucanu, I., Caprita, R. Per-O-methylation of neutral carbohydrates directly from aqueous samples for gas chromatography and mass spectrometry analysis. Anal Chim Acta. 585 (1), 81-85 (2007).
- Ciucanu, I., Kerek, F. A simple and rapid method for the permethylation of carbohydrates. Carbohydr Res. 131, 209-217 (1984).
- Kang, P., Mechref, Y., Klouckova, I., Novotny, M. V. Solid-phase permethylation of glycans for mass spectrometric analysis. Rapid Commun Mass Sp. 19 (23), 3421-3428 (2005).
- Kang, P., Mechref, Y., Novotny, M. V. High-throughput solid-phase permethylation of glycans prior to mass spectrometry. Rapid Commun Mass Sp. 22 (5), 721-734 (2008).
- Goetz, J. A., Mechref, Y., Kang, P., Jeng, M. H., Novotny, M. V. Glycomic profiling of invasive and non-invasive breast cancer cells. Glycoconj J. 26 (2), 117-131 (2009).
- Goetz, J. A., Novotny, M. V., Mechref, Y. Enzymatic/chemical release of O-glycans allowing MS analysis at high sensitivity. Anal Chem. 81 (23), 9546-9552 (2009).
- Mulloy, B., Hart, G. W., Stanley, P., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Seed, B. Silanizing glassware. Curr Protoc Immunol. 21, A.3K.1-A.3K.2 (1997).
- Stellner, K., Saito, H., Hakomori, S. I. Determination of aminosugar linkages in glycolipids by methylation. Aminosugar linkages of ceramide pentasaccharides of rabbit erythrocytes and of Forssman antigen. Arch Biochem Biophys. 155 (2), 464-472 (1973).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены