Method Article
글리 칸 노드 분석 : 글리코 믹스에 대한 상향식 접근
요약
This article presents an enhanced form of a novel bottom-up glycomics technique designed to analyze the pooled compositional profile of glycans in unfractionated biofluids through the chemical breakdown of glycans into their constituent linkage-specific monosaccharides for detection by GC-MS. Potential applications include early detection of cancer and other glycan-affective disorders.
초록
Synthesized in a non-template-driven process by enzymes called glycosyltransferases, glycans are key players in various significant intra- and extracellular events. Many pathological conditions, notably cancer, affect gene expression, which can in turn deregulate the relative abundance and activity levels of glycoside hydrolase and glycosyltransferase enzymes. Unique aberrant whole glycans resulting from deregulated glycosyltransferase(s) are often present in trace quantities within complex biofluids, making their detection difficult and sometimes stochastic. However, with proper sample preparation, one of the oldest forms of mass spectrometry (gas chromatography-mass spectrometry, GC-MS) can routinely detect the collection of branch-point and linkage-specific monosaccharides ("glycan nodes") present in complex biofluids. Complementary to traditional top-down glycomics techniques, the approach discussed herein involves the collection and condensation of each constituent glycan node in a sample into a single independent analytical signal, which provides detailed structural and quantitative information about changes to the glycome as a whole and reveals potentially deregulated glycosyltransferases. Improvements to the permethylation and subsequent liquid/liquid extraction stages provided herein enhance reproducibility and overall yield by facilitating minimal exposure of permethylated glycans to alkaline aqueous conditions. Modifications to the acetylation stage further increase the extent of reaction and overall yield. Despite their reproducibility, the overall yields of N-acetylhexosamine (HexNAc) partially permethylated alditol acetates (PMAAs) are shown to be inherently lower than their expected theoretical value relative to hexose PMAAs. Calculating the ratio of the area under the extracted ion chromatogram (XIC) for each individual hexose PMAA (or HexNAc PMAA) to the sum of such XIC areas for all hexoses (or HexNAcs) provides a new normalization method that facilitates relative quantification of individual glycan nodes in a sample. Although presently constrained in terms of its absolute limits of detection, this method expedites the analysis of clinical biofluids and shows considerable promise as a complementary approach to traditional top-down glycomics.
서문
당지질, 당 단백질, 프로테오글리칸과 글리코 사 미노 글리 칸 일괄 글리 칸으로 알려진 복잡한 이기종 탄수화물의 네 가지 주요 클래스를 구성한다. 마찬가지로 세포막, 글리코 칼 릭스, 세포 외 매트릭스와 유체 유비쿼터스 적분 성분, 글리 칸은 세포 내 이입 세포 내 피킹, 세포 운동성, 신호 전달 분자 인식, 수용체 활성화, 세포 부착, 호스트 병원체 상호 작용 등의 다양한 생화학 적 과정에 참여 삶의 거의 모든 영역에서 세포 간 통신, immunosurveillance 및 면역 반응 개시. 1 현재는, 글리 칸 폴리머를 구축 글리코 실 트랜스퍼 라 아제로 알려진 효소 글리코 시드 구축 (글리 칸을 무너 뜨리는 또한 글리코시다 아제로 알려진) 가수 분해, 개조와 협력하여 행동 궁극적 글리 칸 폴리머 2 최종 생산하고 있습니다. 각 글 라이코 실 트랜스퍼 라제는 다른 복합 당질에서 작동 할 수 있지만하는 글 라이코 실 트랜스퍼 라제일반적 핵성 수용체의 특정 카테고리 (예를 들어, 지질, 폴리펩티드, 핵산, 또는 성장에 특히 활성 뉴클레오티드 당 공여체 (예, GDP 푸 코스)의 단당 잔기를 전송하여 linkage-과 아노 머 특정 글리코 시드 결합을 위조 올리고당). 단백질 (특히 막과 분비 단백질)의 50 % 이상이-병진 후 당화에 의해 수정 된 것으로 추정 된 3 초보 조합 계산이 당화에 의해 당 단백질에게 부여 상당한 변화, 다양성과 특이성에 대한 감사를 제공합니다.; 폴리펩티드 기판 10 글리코 실화 부위를 가지고 있으며, 각 사이트는 단지 3 개의 단당류 환원 말단 1 글리코 시드 결합을 형성 할 경우, 예를 들어, 이론적 최종 당단백 3 10 = 59049 고유 ID를 가정 할 수있다. 당 단백질, 글리코 시드 결합은 일반적으로 측쇄 질소 O를 형성시퀀스에서 Asn-X-빼앗아에서 F 아스파라긴 잔기 /의 Thr N이 O 4 -glycans 수득 세린 및 트레오닌 잔기의 2 측쇄 수산기를 -glycans 수득하는 (X는 프롤린을 제외한 임의의 아미노산 일 수있다). 거의 예외없이, 글리코 엄격한 도너, 억 셉터, 및 결합 특이성을 나타내는 때문에 셀의 glycome의 조성 (즉, 당화 제품의 보수)은 고유 제한된다. 5 중요 풍부한 혈장 당 단백질은 하류 결과로서 비정상적인 당화 고통 이상 글 라이코 실 트랜스퍼 라제의 발현과 활동으로 인해 다수의 병리 적 상태로, 특히 암과 염증성 질환이다. 6-24
주로 후생 유전 학적 요인 탓으로 glycome는 포유류의 게놈의 약 1 %가 형성, 수정을 인코딩하는 동안. 크게 25, 26 프로테옴 및 사체보다 더 다양한 동적, 복잡하고,글리 칸의 조립체는 비 구동 방식 템플릿 - 현저한 콘트라스트 27 당화 진행 폴리펩티드 및 핵산 생합성한다. 당화 효소 및 영양소 및 전구체 가용성과 같은 환경 적 요인의 상대적인 양 및 활성 사이의 상호 작용은 궁극적으로 포도당의 특성상, 속도 및 정도를 결정한다. 5,28 배아 (예를 들어, 판정 및 분화) 세포 활성화 및 진행을 세포주기에 영향을 미치는 유전자 발현 (즉, 전사 및 번역) 및 그 활성 세포의 글리 칸 프로파일의 바로 상류 인 결정 가능한 글리코의 동일성과 양을 변경. (의 일부) 증식하기 때문에, 접착제 및 암 세포의 침략적 속성은 일반 배아 세포, 글리 칸 생합성 경로 (예를 들면, 전구체 축적, 규제 완화 표현, aberran의 특정 변화들과 유사. t 수정, 구조 절단, 또는 소설 형성) 글리코 실화는 분명히 당화에 몇 변경이 발암과 전이를 활성화 할 수 있습니다, 매우 복잡하지만 종양 형성, 진행, 마이그레이션 및 침략 (29)의 다양한 단계를 나타내는 등의 보편적 인 암 바이오 마커를 제공; 분명히, 특정 "비정상적인"글리코 실화 제품이 실제로 면역 인식을 회피하고 험한 혈관 및 전이성 환경에서 마이그레이션의 요구를 생존 할 수 있도록함으로써 암 세포를 혜택을 누릴 수 있습니다. 28,30,31 당연히 실험 변경의 패턴을 방해하거나 방지하는 것이 밝혀졌다 유전자 발현 및 비정상적인 글리 칸 형성은 종양을 중지 할 수 있습니다. (29) 그럼에도 불구하고 biofluid 샘플 (예를 들어, 소변, 타액 및 혈장 또는 혈청)에서 검출 된 비정상적인 글리 칸은 직접 암의 지표 (또는 다른 질병), 오히려 하류하지 않을 수 있습니다 미묘하지만 중요한의 결과면역 시스템 또는 예측 기관의 악성 상태의 정량화 파급 효과의 변화. (32)
그들은 glycome 대한 범용 정보 많은 분자 상호 작용을 기반 글라 이코믹스 기술 (예를 들면, 렉틴 / 항체 어레이 및 대사 / 공유 라벨)를 제공하지만 전체 글리 칸 구조의 검출에 의존 개별 글리 칸에 대한 상세한 구조 정보를 제공하지 않는다. 현저하게 대조적으로, 질량 분석기 (MS)를 식별하고 각각의 글리 칸 구조를 정량화 폴리펩티드 코어의 결합 부위와 같은 구조적 정보를 노출 할 수있다. 규제 완화 식 또는 하나의 글 라이코 실 트랜스퍼 라제의 활동은 여러 당화 경로에 해로운 분자 사건의 폭포를 시작할 수 있습니다. 각 전이 효소가 하나 이상의 glycoconjugate 기판 상에 상이한 성장 글리 칸 중합체에서 작동 할 수 있기 때문에, 규제 완화 생합성 캐스케이드는 dispropor을 수득레이 터는 단 하나의 글리 칸 제품의 양하지만 인트라 또는 세포 외 체액의 비정상적 글리 칸의 여러 이기종 클래스 증가했다. (33) 그러나, 고유의 비정상적인 글리 칸은 때때로 암 또는 때문에 다른 글리 칸 - 정서적 병리에 대한 바이오 마커로 실용적 고려, 대형 수영장에 비해 의 글리 칸을 잘 조절이 비정상적 글리 칸은 수도가 자주도 질량 분석과 같은 매우 민감한 기술에 의해 탐지 남아 매우 작은 부분을 나타냅니다. 예를 들어, 인트라 - 및 세포 외 체액 (크기 여덟 주문 걸쳐) 광범위한 단백질 농도 스펙트럼은 더욱 풍부한 종에 의해 마스크된다 희소 당 단백질의 검출을 방지 할 수있다. (32) 또한, 당 전이 효소의 활성을 측정하는 것이 실용적 상당한 유지 많은 글리코 실 트랜스퍼 라 아제 임상 biofluids에 결석 또는 생체 전 비활성 상태이기 때문에 이론적 도전. consisten의 어려움에도 불구하고TLY 감지하고 독특한 전체 글리 칸의 울트라 분 수량을 정량화, 질량 분석의 실무자는 임상 마커로 그대로 글리 칸을 사용으로 엄청난 진보를 만들었습니다. 최근 GC-MS를 이용 함께 각 당쇄에 많은 고유성 부여 모든 구성 분 지점과 결합 특이 단당류 ( "당쇄 노드")의 검출을 용이하게 그대로 글리 칸의 분석에 상보적인 방법을 개발 경우는 직접 과실 글 라이코 실 트랜스퍼 라제 (들)의 상대 활성을 정량화 분자 대리를 제공합니다.
첫 번째는 1958 년에 글리 칸 분석에 직접 응용 프로그램을보고 있기 때문에, 가스 크로마토 그래피 (GC)는 34 당 메틸화 모노와 이당류를 분석 자신의 anomericity 절대 구성을 결정하고, 이후의 질량 분석 분석을 분리하는 강력한 기술을 입증했다. (35) 1984 년과 2007 년, Ciucanu와 동료 사이도입 된 2005 년과 2008 년 사이에 물과 클로로포름. (35, 36)를 이용하여 메틸화 글리 칸의 액체 / 액체 추출하여 수산화 나트륨 및 아이오도 메탄을 사용 고상 글리 칸과 메틸화 기술, 정제, 강 및 동료는 시간을 절약 스핀 통합 메틸화 단계에 칼 럼 접근. 2008 년 37, 38는 게츠의 연구 그룹은 비교하고 잠재적으로 침습적 및 비 구별하는 매트릭스 보조 레이저 탈착 이온화 (MALDI) 질량 분석기를 사용하여 글리 칸 프로파일 링 방법과 메틸화 정량적 인 고체상을 고안 -invasive 유방암 세포 39는, 2009 년 게츠 팀 합성 효소, 화학적 분리 기술은 높은 알칼리성 고상 메틸화 방식으로 O -glycans 그대로 당 단백질로부터을 절단하는 40을 게츠 절차 동시 메틸화 화학적 분리를 용이 않는다. O의 -glycans, 그것은 단지 미리 절연 글리코에 도포단백질. 우리는 2013 년이 기술을 수정 트리 플루오로 아세트산을 통합하여 전체 미분 획 biofluids 및 균질 조직 샘플을 위해 적응 (TFA)을 가수 분해, 감소, 및 아세틸 화 단계. 또한 당지질 및 N에서 글리 칸을 해제 (33)이 추가 단계는 당 단백질에서 글리 칸을 -linked 및 변환 특유의 메틸화 - 및 - 아세틸 패턴 고유 GC-MS에 의해 분석을 용이하게 원래 그대로 글리 칸 폴리머 (41) (그림 2)로 구성 글리 칸 노드의 특성을 부분적으로 메틸화 된 알디 톨 아세테이트 (PMAAs, 그림 1),로. 33 궁극적으로,이 절차는 "코어 푸코 실화」, 「6 시알 릴", "한 GlcNAc를 이등분"및 "베타 1-6 분기"고유 당쇄 기능 직접 상대 정량에 기초하여 복소 biofluid 모든 글리 칸의 합성 세로 생성 - 각 하나의 GC-MS의 chromatograp에서 파생 된HIC 피크. 이 문서는 또한 메틸화의 최적화, 아세틸, 격리 및 상대 정량 모드의 개선과 함께 청소 단계를 제공합니다.
프로토콜
주의 :이 실험에 사용 된 시약의 피부 / 눈 접촉을 피하십시오. 노출되면, 완전히 물에 영향을받는 지역을 세척하고 즉시 의사의 진단을받을 것.
1. 메틸화 및 글리 칸 추출
- 열 준비
- 샘플을 분석 할만큼의 microfuge 스핀 컬럼 단위를 얻습니다. 휴식 및 플라스틱 저장 튜브의 캡을 분리합니다. 각 저장 튜브에서의 microfuge 미니 필터를 놓습니다. 의 microfuge 튜브 랙 (미니 필터를 포함) 조립의 microfuge 스핀 열을 놓습니다.
- 수산화 나트륨의 재고 (수산화 나트륨) 구슬 (20 ~ 40 메쉬)을 얻었다. 습도가 응집, 수산화 나트륨의 작업 재고로 뜨거운 도자기 박격포를 일으키는 경우, 작은 무게 보트에 약간의 NaOH를 전송하거나. 분말 / 수산화 나트륨 또는 분쇄 NaOH를 구슬 덩어리를 사용하지 마십시오.
주의 : 수산화 나트륨은 강력한 독소 및 부식 기지입니다. 15 분 동안 물로 노출 된 피부 / 눈. Thoroughly 실험을 완료 한 후 워크 벤치를 청소합니다. - 작은 국자 또는 주걱을 사용하여 (~ 가장자리 아래 5mm)를 제 1 외측 경사까지 NaOH를 갖는 미세 원심 미니 필터를 채우는 작업 스톡으로부터의 NaOH 구슬 옮긴다. / 팩의 NaOH 구슬을 응축 할 수있는 벤치 탑에 채워진의 microfuge 필터를 누릅니다.
주 :이 실험을 통하여, 흡습성의 NaOH 비즈 과도한 수분 흡착을 최소화 NaOH를 컬럼 패킹의 표면 위의 임의의 추가 유체의 레벨 (예를 들어, 아세토 니트릴, 디메틸 술폭 시드, 검체 용액)을 유지하고, 공기와 직접 접촉을 제한 할. - 아세토 니트릴 (ACN)의 주식을 취득합니다. 전송 ~ 350 ㎕를 각 NaOH를 포장의 microfuge 미니 필터 ACN. ACN에서 잠긴 NaOH를 유지하고 팁 - 압착 젤 로딩 피펫 팁으로 교반하여 큰 기포를 제거합니다.
주의 : 아세토 니트릴은 가연성 자극이다. - 열 원심 분리
- 대칭 원심 분리기 내부의 microfuge 열을 정렬; 필요한 경우 균형 튜브를 사용합니다. 원심 분리기 내부의 수산화 나트륨 과립을 유출하지 마십시오. 원심 분리기 뚜껑을 닫습니다.
- 원심 분리기는 열 ~ 15 초에 2,400 ×의 g를 위해 (수산화 나트륨과 ACN을 포함).
- 원심 분리가 완료되면, 원심 분리기에서의 microfuge 열을 제거하고, 유해 폐기물 용기에 ACN을 버린다. 그대로 패킹의 NaOH 열을 유지합니다.
- 각 NaOH를 포장의 microfuge 미니 필터 ~ 350 ㎕의 디메틸 설폭 사이드 (DMSO)를 추가합니다. DMSO에서 잠긴 NaOH를 유지하고 피펫 팁 어떤 큰 기포를 제거합니다. 이전에 2400 × g에서 ~ 15 초 동안 원심 분리 컬럼 바와 같이 본래 패킹 NaOH를 유지하면서, 및 DMSO를 버린다.
주의 : DMSO는 돌연변이 및 자극성 쉽게 피부를 통해 흡수된다. - 스핀 필터에 포함 된 플러그 모두의 microfuge 미니 필터를 연결전부. 각 NaOH를 포장의 microfuge 미니 필터에 μl의 DMSO ~ 350 이동 및 DMSO는 다음의 NaOH 포장 내 모든 지역에 도달 할 수 있도록 NaOH를 포장에 공기 방울을 제거하기 위해 200 μL 피펫 팁을 사용합니다. 분쇄 또는 과도하게 NaOH를 구슬을 긁어 피; 수산화 나트륨 분말은 바람직하지 않다. 가능한 빨리이 단계를 완료합니다.
- 플라즈마 품질 관리의 제조 (QC) 샘플 (들)
참고 : 실험 배치에서 일관된 결과를 보장 각 배치에서 분석 할 관심의 생물학적 물질의 크고 균일 한 대량 수집에서 가져온 샘플 중 적어도 하나를 나누어 사용을 고려하십시오. 혈장을 분석하는 경우, 예를 들어, 각 배치에서 QC 샘플 (들)과 같은 혈장 부피 컬렉션의 부분 표본 (들)을 사용한다. 미지 시료와 동일한 방식으로 처리 QC 샘플.- 원심 분리기 ~ 10,000 × g에서 4 분 QC 플라즈마의 재고 샘플. 원심 동안 일부 고밀도 침전물 토륨 정착 수도즉 바닥 일부 저밀도 침전물 플라즈마의 상부에 떠있다. 플라즈마의 제거 나누어지는 (들) 모두를 피하십시오.
- 아래의 "1.3) 샘플 준비"를 진행합니다. 플라즈마 원심 분리가 완료된 후 다음이 단계로 돌아갑니다.
- 원심 QC 플라즈마 9 μL를 철회 스냅 셧 캡 장착 적절하게 표지 된 1.5 ml의 폴리 프로필렌 시험관에 전송 (이하 "1.5 ml의 플라스틱 시험관"라 함). 각 나누어지는을 탈 이온수 1 μl를 추가; 원하는 경우, 내부 표준 (들)에 대한 캐리어로 사용.
- 이 플라즈마 제어에 270 μL의 DMSO를 추가합니다. 소용돌이는 완전히 용해을 보장합니다.
- 샘플 준비
- 생물학적 (검체) 샘플들의 수만큼의 1.5 ml의 플라스틱 시험관을 얻었다.
- 그 대응하는 1.5 ml의 플라스틱 시험관 각 생체 (검체) 시료의 전송 9 μL. 탈 이온수 (27)의 전송 1 μL각 샘플 관 0 μL의 DMSO.
- 적극적으로 샘플을 DMSO에 완전히 용해을 보장하기 위해 (아래 예를 들어, 소용돌이 및 / 또는 반복적으로 피펫 위) 섞는다.
주의 : 흄 후드 내에서 다음 단계를 수행하십시오. 플라스틱의 특정 유형을 용해시킬 수있는 휘발성 액체는 다음 단계, 요오도 메탄 (CH3 I), 디클로로 메탄 (2 CL 2 CH, 메틸렌 클로라이드라고도 함), 클로로포름 (클로로포름, 트리클로로)에 사용 (예를 들면, 니트릴 장갑) . 용매 내성 장갑을 사용하십시오. 때문에 낮은 점도와 높은 증기 압력이 시약은 전송 중에 피펫 팁에서 떨어지지 수 있습니다. 수용 용기에 인접한 원액 유지시킴으로써 시약 손실 및 잠재적 인 노출을 최소화한다. - 작은, 깨끗한 튜브에 요오 충분한 전체 볼륨을 전송합니다. 각각의 분석 시료 105 μL 아이오도 메탄이 필요합니다. anoth로 전송 ~ 500 ㎕를 디클로로 메탄깨끗한 튜브를 어. 주사기 막힘을 방지하기 위해 즉시 요오 전송 한 후 디클로로 메탄으로 주사기를 씻어.
주의 : 아이오도 메탄은, 감광 휘발성이며, 중추 신경계의 손상 또는 흡입 또는 섭취하면 사망을 일으키는 강력한 독소 가능. 디클로로 메탄은 잠재적 인 발암 물질, 생식 돌연변이, 여러 장기의 손상 또는 사망의 원인의 강력한 자극 할 수있다. - 각각의 분석 시료 105 μL의 아이오도 메탄을 추가 분석 주사기를 사용합니다. 캡 분석 튜브 즉시 요오 증발을 최소화한다. 필요한 경우, 간단히 원심 분리기 모든 샘플은 어떤 액체가 캡에 남아 있지 않도록 경우 철저하게, 와동합니다. (퍼플 갈색 또는 황색 등) 색상 변화는 다음과 메틸화 반응을 위태롭게 할 수있다 요오 저하, 신호.
- 디클로로 메탄으로 3 회 이상 요오를 전송하는 데 사용되는 분석 주사기를 씻어. 이 서있는 것을 방지 할m 막힘. 유기 유해 폐기물 용기에 추가 아이오도 메탄, 디클로로 메탄과 함께,이 린스 폐기하십시오. 유해 폐기물 용기에 사용되는 테스트 튜브를 놓습니다.
- 2 ml의 플라스틱 저장 튜브의 새로운 세트를 가져옵니다. 원하는 경우 스냅 캡을 제거합니다.
- 의 microfuge 미니 필터를 분리합니다. 원심 분리기는 15 2,400 × g에서 초,과의 분리 열은 DMSO 유출과 함께 저수지 튜브를 폐기합니다.
- 원심 분리 스핀 열을 다시 연결하고 새로운 저장 튜브 내부에 배치합니다. 각 번호 스핀 컬럼과 동일한 샘플 수에 대응하는 저장조 튜브. 미니 필터 플러그 꽉 있는지 확인; 잠재적 누출은 다음 단계에 영향을 미칠 수있다. 스핀 컬럼에서 DMSO를 제거하고, 스핀 컬럼에 검체 시료를 전송 사이의 시간을 최소화한다.
- 메틸화
- 정량적으로는 해당 NaOH를 구슬로 채워진의 microfuge 스핀 공동으로 각 시료 용액을 전송lumn. 이 단계 1,000 μL 피펫 팁을 사용합니다. 전사 후, 200 μl의 팁의 단부 ~ 2mm 압착 및 교반으로 사용하는 컬럼 내용에두고. 모든 샘플에 대해 반복합니다.
주 : 검체 용액을 전송하는 동안 피펫 팁으로부터 드립 수 있기 요오의 낮은 점도는 샘플 손실을 일으킬 수있다. 샘플 튜브를 한 손으로 서로 인접 스핀 컬럼을 잡고 빠르게 한편 시료 용액 옮긴다. - 메틸화 반응은 11 분 동안 진행 할 수 있습니다. 이 기간 동안 각각의 샘플을 적어도 4-5 번 저어. 교반기 부드럽게 칼럼 내용물을 혼합하도록 NaOH를 구슬의 표면에서 발생하는 효율적인 메틸화를 용이하게하기 위해, 팁 권축 겔 로딩 피펫 팁을 사용한다. 공격적 혼합이 스핀 필터 천공 분쇄하고 (이후, 액체 / 액체 추출의 효과를 감소시킬 수 있음)에 NaOH 구슬을 중단 및 / 또는 SA로 (샘플 손실을 초래할 수있다수산화 나트륨 과립)는 열에서 오버 플로우 수 mple 젖은.
- 이후 액체 / 액체 추출 단계에 대비하여, 0.2 M 인산 나트륨 완충액 (pH 7.0) 0.5 M 염화나트륨 수용액에 충분한 양을 제조 실온에서 보관한다. 각 샘플을 액체 / 액체 추출의 세 사이클 동안 12 ml의 염화나트륨 수용액 ~ 총 요구할 것이다.
- 11 분 메틸화 기간이 완료되면, 즉시 아직 조심스럽게 열을 분리하고 2,400 × g에서 15 초 동안을 원심 분리기. 플러그를 폐기하십시오.
- 정량적으로는 해당 NaOH를 구슬로 채워진의 microfuge 스핀 공동으로 각 시료 용액을 전송lumn. 이 단계 1,000 μL 피펫 팁을 사용합니다. 전사 후, 200 μl의 팁의 단부 ~ 2mm 압착 및 교반으로 사용하는 컬럼 내용에두고. 모든 샘플에 대해 반복합니다.
- 즉시 원심 분리기에서 스핀 열을 제거하고 뒤에 갓 메틸화 글리 칸을 포함하는 흐름을 통해 솔루션을 떠나 빈 스핀 저장 튜브의 새로운 세트에 배치합니다. 아무것도 버리지 마십시오.
- 가능한 한 빨리, 건조, NaOH를 충전 스핀 필터에 300 ㎕를 아세토 니트릴 (ACN)를 추가합니다. 9,600 × g에서 30 초 동안 스핀 필터를 원심 분리기.
- ImmediatelY는 그 후 (예를 들어, 다음 전에 이전 단계 ACN 300 μL 첨가로 원심 분리 튜브에 스핀 필터를 통해 방사 11 분 동안 NaOH를 비드 배양 용액) 13 X 실란 화 메인 메틸화 용액을 전송할 100mm 유리 테스트 튜브 (42) 3.5 ml를 즉시 0.2 M 인산 나트륨 0.5 M의 NaCl, pH가 7.0를 포함하는 버퍼와 혼합 (소용돌이)의 포함. 이 단계에서 어떤 백색 고체 잔류를 전송하지 마십시오. 다음 단계로 진행하기 전에 각 샘플에 대해이 작업을 수행합니다.
- 지체없이 전송 (결합) ()와 그 각각의 실란 화 된 유리 튜브에서 액체 시료의 나머지를 즉시 (소용돌이) 혼합하여 각 저장 튜브의 ACN 스핀 연결. 다시 말하지만,이 단계에서 어떤 백색 고체 잔류를 전송하지 마십시오. 모자, 흔들림, 그리고 소용돌이 유리관. 각 샘플에 대해 반복합니다. 적절한 폐기물 용기에 NaOH를 열 및 파스퇴르 피펫을 폐기하십시오.
- 액체 / 액체 추가를ction 및 글리 칸 정화
- 흄 후드 내에서 각 샘플에 1.2 ml의 클로로포름을 추가합니다. 바로 그 후에, 실란 유리관 캡 격렬 내용물을 혼합한다.
- 증발 매니 폴드 약 75 ° C로 예열 금속 블록. 100mm 유리 튜브 × 13 mm의 수용 할 수있는 우물로 가열 블록을 사용합니다.
- 실란 화 된 파스퇴르 피펫, 비 실란 화 파스퇴르 피펫 및 캡 실란 화 유리 테스트 튜브의 새로운 세트를 가져옵니다.
주의 : 클로로포름 (클로로포름)는 장갑의 일부 유형을 통해 침투 할 수있는 자극, 돌연변이, 잠재적 인 발암 물질이다. - 간단하게 원심 분리 (~ 3,000 × g의) 샘플 - 함유 유리 튜브를 수성 및 유기 층을 분리한다.
- 수성층의 ~ 3mm 바닥 유기층 이상으로 유지되도록 상부 수층을 충분히 추출되지 않은 실란 화 파스퇴르 피펫을 사용한다.
- 0.5 M 나트륨의 3.5 ML을 추가각각 유리 튜브에 0.2 M 인산 나트륨 완충액에서 CL 용액 (pH가 7)를 격렬하게 혼합하고, 간단히 원심 분리 (~ 3000 × g에서). 이전 단계 (1.4.3)에서와 같이, 수층을 추출 비 실란 화 파스퇴르 피펫을 사용한다.
- 이전 단계 (1.4.4)를 반복,하지만 ~ 수성 층을 1 ㎖를 둡니다.
- 깨끗하고 적절하게 레이블 실란 화 13 × 100mm 유리 테스트 튜브에 유기 층을 전송하는 깨끗한 실란 화 된 파스퇴르 피펫을 사용합니다. 다음과 같은 방법으로 추출하여 수성 오염을 방지 :
- 한 손으로 인접 현재 새로운 실란 화 유리 시험관을 모두 잡아. 다른 한편으로, 수성 층을 통해 아래로 피펫을 삽입하는 동안 거품을 만들 수있는 피펫 전구를 누르십시오.
- 일단 유기 층을 내부에 거품을 만드는 중지하고 유기 및 수성 층을 안정화하고 다시 분리 할 수 있도록 꾸준한 피펫 전구를 개최합니다. 그런 다음 천천히 ORGANI의 많은 철회 전구를 해제어떤 수성 오염없이 가능한 C 층.
- 신속, 수성 층을 통해 피펫 팁을 인상하고, 튜브의 피펫을 올리면서 약간 (일부 수성 오염을 인출 결과) 전구를 해제의 자연 반사 저항.
- 신속 인접한 새 튜브에 저점 유기층 옮긴다. 모든 수계 오염은 새로운 유리 튜브에서 추출 된 유기 층의 상단에 작은 액체 방울로 볼 수 있습니다. 수성 / 염화나트륨 오염 보이면 피펫으로 제거; 단일 방울로 수용액 방울을 풀 필요 원심.
- 제대로 된 유리관, 피펫, 수성 및 유기 폐기물 솔루션을 폐기하십시오. 세척 및 유리 튜브 캡을 재활용합니다.
- 흄 후드 안쪽 ~ 5 분 동안 75 ° C로 예열 된 증발 매니 폴드 질소의 부드러운 일정한 스트림에서 모든 샘플을 건조시킵니다. 모든 드라이 다운 인트 동안 증발 냉각을 보장하기 위해PS는 부드러운 질소 일정한 흐름이 튀거나 액체 스퍼터링없이 액면을 방해한다. 최종 시료의 완전한 건조시 증발 매니 폴드에서 샘플을 제거합니다. 건조 유리 튜브의 바닥에 흰 반점 버퍼 / 염화나트륨 오염을 나타냅니다.
- TFA 가수 분해 단계를 완료하기 위해 하루에 남아있는 시간이 충분하지 않은 경우 현재의 절차를 일시. 일시적으로 (즉, 야간) -20 ° C에서 건조 샘플을 저장합니다. 저장 후 절차를 계속 -20 ° C 냉장고에서 샘플을 제거하고 그들을 uncapping 전에 완전히 따뜻하게 할 수 있도록합니다.
- 샘플 따뜻한 트리 플루오로 아세트산 (TFA)의 가수 분해 (다음 단계)에 대비하여, 가열 맨틀을 설정하는 동안 이러한 액체 시험관 내용물의 온도는 121 ° C에 도달 할 것이다. TFA의 재고에서 TFA의 솔루션을 준비합니다 (아래 2.1 단계 참조).
2. 트리 플루오로 아세트산 (TFA) 가수 분해
주의 : 트리 플루오로 아세트산 (TFA)이 부식 유기산 독성 자극제이다.
- 탈 이온수 중 2.0 M TFA 용액에 충분한 양을 준비한다. 각각의 분석 샘플은 2.0 M TFA 용액 325 μl를 필요로 할 것이다. 집중 TFA는 13.0 M.이다
- 각각의 분석 시료에 2.0 M TFA 325 μl를 추가합니다. 그 후의 건조 공정 (2.3 이하) 동안 TFA 증발 샘플 손실을 방지하기 위해 단단히 TFA를 첨가 한 직후 각 시료 튜브를 캡핑. 모든 유리 튜브에 용액 레벨을 표시합니다. 다음 단계 전에 철저하게 각 샘플을 소용돌이.
- 적당한 예열 된 가열 블록에서 2 시간 동안 단단히 캡핑 샘플 튜브 부화 나 내용물을 121 ℃의 온도에 도달되도록 오븐. 가열 블록 대신 오븐을 사용하는 경우, 알루미늄 호일로 커버 샘플 튜브는 튜브의 아래쪽의 튜브 및 샘플 잔여 부분 건조 상단 TFA의 응축을 방지한다. 20 ~ 30 분 후 시료 용액 량을 확인합니다.최소한의 TFA 증발을 보장합니다. 필요한 경우 추가로 캡을 조이거나 타이트한 착용감 캡을 교체합니다.
- 2 시간 대기하는 동안 다음 단계 (아래 2.4 참조) 75 ° C에 또 다른 증발 매니 폴드를 설정합니다.
- 2 시간 가열 시간은 15 분 ~ 질소 가스의 부드러운 흐름하에 75 ℃에서 완전히 건조 된 샘플을 때. 이상 15 분 동안 무인 샘플을 두지 마십시오. 자주 한 번에 모든 샘플은 건조 샘플을 확인하고 가열 및 건조를 중단.
- 환원 단계를 완료하기 위해 하루에 남아있는 시간이 충분하지 않은 경우 현재의 절차를 일시. -80 ° C에서 일시적으로 (즉, 야간) 매장 샘플. 저장 후 절차를 계속 -80 ° C 냉장고에서 샘플을 제거하고 그들을 uncapping 전에 완전히 따뜻하게 할 수 있도록합니다.
3. 감소
- 흄 후드 내에서 1 M ammoni에서 10g / L의 나트륨 보로 하이드 라이드에 충분한 양의 (을 NaBH 4) 용액을 조제UM 수산화물 (NH 4 OH). 각 샘플이 솔루션의 475 μl를 필요로 할 것이다. 샘플의 각 배치를위한 새로운 솔루션을합니다. 진한 수산화 암모늄 약 M. 14.5 (NH 3 W / w 27~30%)
주의 : 나트륨 보로 하이드 라이드 (을 NaBH 4) 흡습성, 물 반응성 독소와 강력한 자극제입니다 출시 -시 흡입, 섭취, 또는 눈 / 피부 접촉시 심각한 화상을 일으킬 물이 높은 가연성 증기와 접촉.
주의 : 암모늄 하이드 록 사이드 (NH 4 OH)은 심한 화상과 흡입, 섭취, 또는 눈 / 피부 접촉시 돌이킬 수없는 장기 손상을 야기 할 수있는 부식성 자극과 독소입니다. 30 분 동안 물에 영향을받는 지역을 세척 및 소독 또는 영향을받는 지역을 긁적에서 피해자를 방지 할 수 있습니다. - 각 샘플에, 1 M NH 4 OH에서 10g / L의 NaBH 4의 475 μl를 추가합니다. 혼합 시료는 철저하게 어떤 잔류 물을 용해한다. 캡 테스트 튜브 및환원 반응은 1 시간 동안 지속 할 수있다.
- 1-시간 대기하는 동안, 75 ° C까지 가열 증발 매니 폴드를 설정합니다. 유리관 적합한 웰 (아래 3.4 참조)와 가열 블록을 사용한다.
- 1- 시간 반응 기간이 완료되면, 각각의 시료에 63 ㎕의 메탄올 (메탄올)을 추가한다. 68 ℃에서 비등 상대적으로 휘발성 액체 -이 단계와 다음 단계는 트리메틸 보레이트 등의 잔류 붕소를 제거합니다.
- 15 분 ~ 대 질소의 부드러운 흐름하에 75 ℃에서 (예열 된 매니 폴드) 건조 샘플. 자주 샘플을 확인하고 무인을 두지 마십시오. 유리관의 바닥에 작은 액적 샘플 아직 건조되지 않기 때문입니다.
참고 : 액체 방울의 기포를 구별 테스트 튜브를 기울하십시오. 오직 액체 방울은 틸팅 후 이동하지만, 그 반대는 항상 사실이 아니다 : 기포가 이동하지 않는 경우, 여전히 (매우 적은) 액 적을 수있다. - SAMPL 번메탄올 (메탄올)과 초산 (아세트산)의 1 (v / v)의 솔루션 : 에스는 9를 준비, 완전히 건조합니다. 각 샘플에 아세트산 용액이 메탄올 125 μl를 추가합니다.
- 질소의 부드러운 흐름하에 75 ℃에서 (예열 된 매니 폴드) 건조 샘플.
- 샘플이 완전히 건조되면 실온에서 20 분 동안 샘플을 진공 - 건조 : (예 : FoodSaver에서 판매하는 것과 같은) 플라스틱 진공 욕조에 장소 샘플, 진공 뚜껑을 닫고, "진공"를 연결하는 진공 다이얼을 설정 진공에 진공 호스 및 회전. 진공을 분해하려면 다음 단계를 역. 완전 진공 뚜껑을 열려고 시도하기 전에 압축을 해제하기 위해 시스템 기다립니다.
- 환원 단계를 완료하기 위해 하루에 남아있는 시간이 충분하지 않은 경우 현재의 절차를 일시. -80 ° C에서 일시적으로 (즉, 야간) 매장 샘플. -80 ° C 냉장고에서 샘플을 제거, 저장 후 절차를 계속 그들을 uncappin 전에 완전히 따뜻하게 할 수 있도록하려면지.
- 샘플을 진공 건조하는 (또는 따뜻하게, 저장 후) 기다리는 동안, 다음 단계의 시약을 준비합니다. 구하여 각 샘플의 수 (캡)를 실란 화 된 원뿔 바닥 오토 샘플러 (AS) 유리 병. 또한, 예열 얕은 웰 AS 바이알 가열 블록과 깊은 웰 유리관 블록 모두 유리 튜브 내용물을 50 ° C의 온도에 도달하도록.
4. 아세틸 (흄 후드에서 수행)
- 각 샘플에 탈 이온수 18 μl를 추가합니다. 모자와 완전히 완전히 어떤 침전물을 용해 모든 튜브를 소용돌이.
- 각각의 유리관에 250 μL 무수 초산을 추가합니다. 2 분 동안 수욕 캡 충분히 와류 및 초음파 처리는 잔류 물 및 석출물의 완전한 용해를 보장한다.
- 알루미늄 호일로 유리관을 덮고, 10 분 동안 50 ℃의 내부 온도에서 배양한다.
- 각 샘플에 230 ㎕의 집중 트리 플루오로 아세트산 (TFA)를 추가합니다. 즉시 모자샘플을 혼합 거라고. 이어서, 샘플 부화 덮인 알루미늄 포일 50 ℃의 내부 온도에서 10 분.
- 배양 후, 각 샘플을 1.8 ml의 다이 클로로 메탄 (CH 2 CL (2))를 추가한다. 모자와 잘 섞는다.
- 각 샘플에 탈 이온수 2.0 ML을 추가합니다. 모자와 잘 혼합 샘플. 0 3,000 ×의 g에서 원심 분리기 레이어를 분리합니다. 수질 오염을 피하는 단계 1.4.6에 명시된 바와 같이, 액체 / 액체 추출을 수행하기 위해 비 - 실란 화 된 파스퇴르 피펫을 사용한다.
- 이 추출의 총 한 번 더 추출을 반복합니다. (AS를 랙에 안전하게 유지) 유리 병 AS 실란 화라고 표시된로 유기층을 전송하는 실란 파스퇴르 피펫을 사용합니다. 바로 아래 가장자리에 AS 튜브를 입력합니다.
- 질소 기체하에 40 ℃에서 15 분 동안 (AS 바이알)에서 건조 샘플에 예열 얕은 웰 가열 블록을 사용한다. 이상 건조하지 마십시오. 최종 제품은 부분적으로 메틸화 된 알디 톨 아세테이트 (PMAAs)로 알려져있다.
5. 가스 크로마토 그래피 - 질량 분석법 (GC-MS)
- 아세톤 100 ㎕의 각 샘플을 재구성하고 잘 섞는다. GC의 분할 모드 (280 ° C로 유지하고 실란 화 된 유리 섬유의 작은 플러그를 포함) 라이너로 분할 모드에서 각 샘플 1 μl를 주입하는 자동 시료 주입기를 사용합니다. 0.25 mm의 ID 및 0.25 미크론의 막 두께로 30 m DB-의 5ms GC 컬럼을 0.8 ㎖ / 분의 일정한 유동 모드에서 캐리어 가스로서 40을 사용하여 헬륨의 분할 비를 사용한다.
- 0.5 분 동안 165 ° C에서 초기 GC 오븐 온도를 잡으십시오. (10 분 소요) 10 ℃ / 분의 속도로 265 ℃까지 165 ° C에서, 각각의 실행에 대해, 온도 진입로 프로그램 오븐 초기 대기 시간을 다음과 즉시 온도 265 ° C를 램프 (2 분 소요), 30 ℃ / min의 속도로 325 ℃로하고 3 분 동안 325 ° C의 온도를 유지한다. 샘플 당 총 실행 시간은 15.5 분이다.
- 프로를 사용하여페를 리 튜닝과 (EI, 250 ° C에서 70 eV의)를 이온화 전자하기 위해 GC 컬럼에서 용출 샘플 구성 요소를 주제 질량 분석기를 교정. TOF 질량 분석기를 들어, 0.1 초 펄스 합산 속도 m / z 800 m / z (40)로부터의 단편을 분석한다. 2.5 분의 EI 필라멘트 용매 지연 시간을 설정합니다.
6. 데이터 분석
- TOF 질량 분석기를 사용하는 경우, 추출 된 이온 크로마토 그램을 얻었다 0.15 다의 질량 윈도우를 적용함으로써 각 PMAA 대한 단편 이온 가장 풍부한 및 / 또는 진단을 합계. 각 PMAA의 대상 이온은 다른 곳에 게시 된, 33 있지만 다음과 같은 변경이되었습니다 : t-Glc를 이온이 지금 145.1 + 205.1이다; 2 맨 이온은 161.1 + 189.1이다; 3 걸 이온은 6 갈 이온은 161.1 + 189.1 + 233.1이고, + 233.1 161.1이다; 2,6- 남자 이온은 189.1이다 3,6 맨 이온은 + 233.1 189.1이다.
- 자동 이온 크로마토 그램을 추출 합해진 각 피크 면적을 통합 QuanLynx 또는 다른 소프트웨어를 사용합니다. 수동으로 각각 통합 추출 이온 크로마토 그램을 확인하여 통합 결과를 확인합니다. 이어서, 상기 분석 모든 육탄 당 XIC 영역의 합으로 각각의 육탄 당 XIC의 영역을 분할 관련 데이터 정규화위한 스프레드 피크 통합 데이터를 내보낼; 마찬가지로, 각 HexNAc XIC 영역 모두 HexNAc XIC 영역의 합으로 나누어진다. 이 절차는 각각의 육탄 당과 HexNAc에 대한 표준화 존재비를 생성합니다.
결과
상대 두 가지 중요한 메틸화 단계가 제대로 실행 된있는 경우에 성공적으로 메틸화, 가수 분해, 감소, 인간 혈장 샘플의 아세틸 화를 보여주는 총 이온 전류 크로마토 그램 (TIC)는 그림 3에 표시됩니다.
탄당에 HexNAcs의 상대의 절대 수율 :
N의 -acetylhexosamine (HexNAc) 부분적으로 메틸화 된 알디 톨 아세테이트 (PMAAs)는 탄당보다 낮은 수율을 가지고하는 경향이있다. (43) 탄당에 HexNAcs 상대의 절대 수익률을 추정하기 위해 N의 -acetyllactosamine (A Gal1-4GlcNAc의 이당류)의 여섯 10 μg의 샘플 물 10 μl를 분석 하였다. 말단 갈락토스 (t-갈) 및 4-GlcNAc에 대한 TIC 피크 면적이 통합되었다. t-갈 4-GlcNAc의 총량에 대하여 4의 GlcNAc의 비율은 11.3 ± 0.7 %였다(SEM). HexNAc 수율 (아래 참조) 재현 가능하지만,이 값이 0.5 이론치보다 훨씬 적다는 사실 HexNAcs의 수율 탄당보다 근본적으로 낮다는 것을 나타낸다. (N의 -acetyllactosamine가 1이기 때문에 HexNAc 이론적 수율은 0.5입니다. 1 육탄 당-HexNAc의 이당류)
인트라 및 Interassay 재현성 :
인트라 및 총 육탄 당 또는 HexNAc 신호의 1 % 이상을 기여하는 모든 글리 칸 노드 interassay 재현성은 표 1에 제공된다. 이러한 데이터는 EDTA 플라즈마의 동일한 주식을 사용, 3 별도의 일에 3 별도의 분석에 의해 인수되었다. (즉, 총 육탄 당 또는 HexNAc 신호의> 1 %에 해당)을 그림 4에 제공되는 인간 혈장에서 18 가장 풍부한 글리 칸 노드에 대해이 최적화 된 프로토콜에 따라 자동 시료 주입기 안정성 데이터입니다.
다른 주목할만한 관찰 : FO 아가씨는 = "jove_content"
메틸화 방법을 최적화하는 동시에, 우리는 아세토 니트릴로 세척 최초 전에 NaOH를 구슬로 물의 흡착을 방지 할 필요가없는 것으로 나타났습니다. 또한 TFA 않고 아세트산 무수물 가열 짧은 기간과 함께 최종 아세틸 화 공정 동안 소량의 물이 존재가 완전한 반응을 촉진하는데 도움하였습니다. 마지막으로, 비행 시간 형 (TOF) 질량 스펙트럼의 높은 해상력 성공적 당쇄 노드 분석 불필요는 다음과 GC-TOF-MS 및 전통적인 송신 중극의 샘플의 동일한 세트의 평행 한 주사에 기초하여 초기 결과 기반 GC-MS를 선택 이온 모니터링 운영 (SIM) 모드는 최종 정규화 된 육탄 당 약관 및 HexNAc 상대 존재비에서 유사한 결과를 보여줍니다.
er.within 페이지 = "1"> 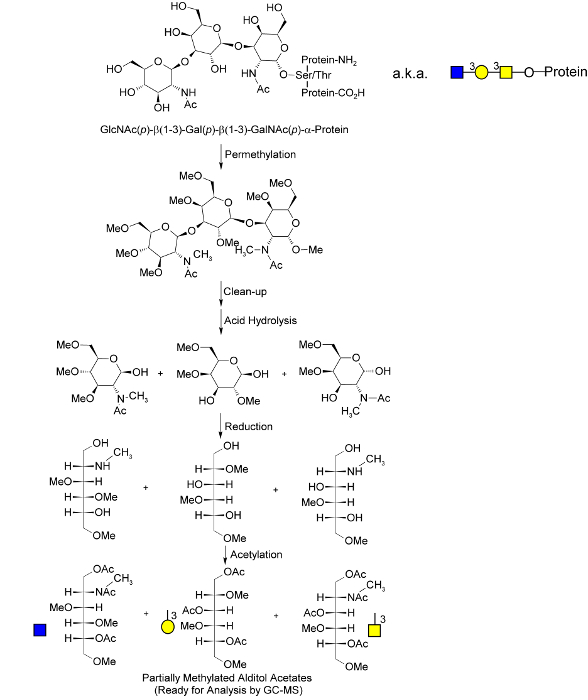
. 글로벌 당쇄 메틸화 분석 절차도 1 분자 개요가 오 글리 칸을 -linked 도시된다; 이들은 메틸화 및 가수 분해 후 게츠. (40)에서 채택 된 메틸화 과정 중에 출시, 단당류가 감소하고, 초기 수산기는 아세틸 화에 의해 "표시". (PMAAs) 최종 부분적으로 메틸화 된 알디 톨 아세테이트의 메틸화 및 아세틸 화의 독특한 패턴은 원래 그대로 폴리머의 독특한 "글리 칸 노드"에 대응하고, 분자 GC-MS. N에 의해 분리 및 정량 기준 -linked 및 당지질 글리 칸을 제공합니다 산 가수 분해시 연결 마크 단당류로 방출된다. 보르헤스 등의 알에서 적응. 허가 33.>이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

분석 개념을도 2 개념적 개관. 상향 조절 전이 효소 (예는 GNT-V)는 특정한 고유 연결된 글리 칸 단당 잔기의 양의 증가 (이 예에서의 2,6- 결합 만노스 "노드")를 야기 - 어떤 다른 글리코의 후속 조치를 통해 감지하고 일상적인 방식으로 정량화하기 어렵다 각-모두 낮은 카피 수의 이종 전체 글리 칸 구조의 혼합물이 형성 될 수 있습니다. 분석적으로 단일 그대로 글리 칸보다 GNT-V 활동의 직접적인 대리 측정 함께 모든 비정상적인 글리 칸 구조 사이에 "글리 칸 노드"에서를 제공 풀링. , O - - 동시 N의 측정 연결, 지질 "glyc 여기에 설명 된 (원래 다른 33)하는 탐지 및 암과 같은 글리 칸 - 정동 질환을 모니터링하기위한 개념적 신규 수단을 나타내므로 전체 biospecimens에서 노드 ". 도시 된 10 ㎕의 혈장 샘플의 실제 추출 된 이온 크로마토 그램. 인접 숫자 글리 칸 구조의 단당 잔기 높은 잔류 하부 잔사에 연결되는 위치를 나타낸다. 어떠한 결합 위치는 크로마토 주석에 표시되지 않는 경우, 잔류 중 단말 위치 또는 용액 (예를 들어, 글루코스) 무료. 모든 잔기이고 .; 아래로 자신의 한 위치를 통해 시알 산 링크를 제외하고 시알 산 링크 아래의 2 위치를 통해 크로마토 그램에 분할 추출 이온 크로마토 그램의 변화를 나타냅니다 육탄 당 잔류 물 및 m / z N 116 + 158에 대한 m / z 117 129를 - acetylhexosamine (HexNAc) 잔류.에서 보르헤스 등. 권한을 가진 33 적응.61 / 53961fig2highres.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3 대표 결과. 시료가 올바르게 처리 된 A)에서 동일한 인간 혈액 EDTA 혈장 시료의 당쇄 노드 분석 총 이온 전류 크로마토 그램 (TICS), B)에 수산화 나트륨을 통해 방사 된 메틸화 용액에 백색 잔사 열은 액체 / 액체 추출에 후속 혼합물에 수행하고, C)를 수산화 나트륨의 컬럼을 통해 방사 된 메틸화 용액을 인산 완충액에 첨가하고 있지만, 액체 / 액체 추출에 클로로포름을 첨가하기 전에 완전히 혼합되지. 그림 2에서 제공하는 전설. 시간을 클릭하세요감수는이 그림의 더 큰 버전을 볼 수 있습니다.

인간 혈장에서 18 가장 풍부한 글리 칸 노드 48 시간 이상 4. 자동 시료 주입기 안정성. 자동 시료 주입기 안정성을줍니다. 22시간에서 시료를 완전히 건조시킨 후 120 ㎕의 아세톤 재구성. 데이터 포인트의 각 클러스터는 동일한 샘플의 네 개의 연속적인 주사를 나타낸다. 검은 색 선이 각 글리 칸 노드의 평균 정규화 된 값의 ± 15 %를 포함한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

표 1. 인트라 및 interassay 재현성. 값은 총 육탄 당 또는 총 HexN의 %의 CV를 나타냅니다AC-정규화 된 개인 글리 칸 노드가. 총 육탄 당 또는 HexNAc 신호의 1 % 이상을 기여하는 모든 글리 칸 노드가 나열됩니다. 데이터는 EDTA 플라즈마의 동일한 주식을 사용, 3 별도의 일에 3 별도의 분석에 의해 인수되었다. 배치 당 N = 6 샘플. Excel 스프레드 시트로이 표를 다운로드하려면 여기를 클릭하십시오.
토론
일반적으로, 탄당에서 부분적으로 메틸화 된 알디 톨 아세테이트의 성공적인 생산 (PMAAs)는 적은 어려움을 내포하고 N의 -acetylhexosamine (HexNAc) PMAAs의 성공적인 생산보다 더 강력합니다. 이 절차의 모든 단계에서 재생 될 때,이 현상의 뒤에 정확한 메커니즘은 알려져 있지만 탄당에 HexNAcs 대하여 고유 (오히려 수산기 이상)이 N의 아세틸 기의 고유 화학에 관련한다. 이 산 가수 분해에 관련된 이러한 현상 뒤에 메커니즘은 한마디로 다른 곳에서. 43 설명, N 개의 -methylacetamido 긍정적으로 산 가수 분해 동안 충전되기위한 능력은 산 가수 분해에 내성 글리코 시드 결합을한다. 이 N의 -acetyllactosamine의 분석에 대해 상기 한 바와 같이 육탄 HexNAc에 비해 낮은 수율 (총 HexNAc + 헥 소오스 신호의 11.3 %, 총보다는 50 %)을 설명한다. 특히,이 비교적 리터HexNAcs의 심고 수익률은 복잡한 biofluids 및 조직에서 검출, 또는 대규모의 복잡한 글리 칸 (예를 들면, 2,4- 남자, 2,6- 남자, 3,4,6-에서 파생 된 글리 칸 노드의 손쉬운 검색을 배제하기가 어렵게하지 않습니다 -man 및 3,4-GlcNAc의도 2). 33 당쇄 노드 XIC 피크 영역을 정규화하는 방법을 감안한다 (단계 6.3)만큼 각 HexNAc의 상대 수율은 다른 HexNAcs 일관성 대하여 (남아 이 않는 얻어 질 수있는 다양한 샘플 사이의 상이한 HexNAcs의 상대적인 양의 표 1)에 유용한 정보를 참조. 이뿐만 아니라 탄당에 대한 진정한 보유하고 있습니다. 지속적으로 모든 일괄 QC 샘플 (들)의 설립을 통해 모니터링 현상 - 또한, 우리는 이전에 HexNAcs에 탄당의 비율이 일치 양적 행동뿐만 아니라 (33)를 표시하는 것으로 나타났습니다.
메틸화가 수행되는 방식에 가장 큰 영향을 미친다HexNAc PMAAs의 전반적인 수율 및 재현성. 특히, 많은주의가 완전히 수성 조건 알칼리성 메틸화 글리 칸의 노출을 방지하기 위해주의해야한다. 이 점에서 두 가지 핵심 단계는 1이다) ((단계 1.3.13 및 1.3.14) 뒤의 스핀을 통해 솔루션의 모든 백색 침전물을 떠나, 그들은 인산 버퍼에 추가되면 2) 바로 스핀을 통해 솔루션을 혼합 ) 1.3.13 및 1.3.14 단계. 버퍼보다는 단순 염 용액이 단계에서, 수성 용액의 부주의 알칼리화 않도록 후속 액체 / 액체 추출 단계를 포함한다. 우리는 알칼리성 조건 하에서 HexNAcs의 메틸화 및 아세틸 -2- 아미노기의 아세틸 기 클로로포름에 연결된 글리 칸의 전체 추출 효율을 감소시키는 극성 차 아민 결과, 가수 분해를 겪는 것으로 의심.
실패 메틸화 HexNAcs의 가장 쉽게 인식 할 수있는 기능입니다4 링크의 GlcNAc (4-의 GlcNAc) 6- 걸, 3,6- 사람의 것과 크로마토 그래피 피크의 상대 강도, 그리고 마지막 열 베이크 아웃 (그림 3) 중 배경의 기준 강도. 4의 GlcNAc PMAA의 절대 존재 량이 적 으면 다른 HexNAcs과의 정규화 풍부 대하여도 (가장 두드러) 3,4-GlcNAc에의 동반 증가로 낮아진다.
전체 수율 및 분석 견고성을 최적화하도록 설계된 몇 가지 변경은 당초 간행물이 해석 방법을 설명 이후 된 변경 (33) 중 하나가 통합 된 추출 된 이온 크로마토 그램 (XICs)을 정규화하는 방법이다. 간략화를 위해, 이제 모든 육탄 당 XIC 영역의 합으로 각각의 육탄 당 XIC의 영역을 분할; 마찬가지로, 각 HexNAc XIC 영역 모두 HexNAc XIC 영역의 합으로 나누어진다. 표 1, 전체 interassay / 간 분석 reproducibil에서 볼 수 있듯이각각의 육탄 당 또는 HexNAc 신호 평균 13 % CV 1>에 %를 기여하는 모든 글리 칸 노드 성만.
우리의 지식에,이 글리 칸이 먼저 분해 된 후 구성 요소가 글리 칸 성분의 정량 시료 전체의 초상화를 구축하기 위해 분석하는 진정한 상향식 (bottom-up) 글라 이코믹스의 유일한 화신이다. 여기에, 대신 기존의 효소 릴리스의의과 메틸화 과정은 비 환원 제거 (해제) O 각각의 단백질, N은 -linked 동안 40 글리 칸이 산 가수 분해 중에 방출된다. (33)를 기존의 하향식 글라 이코믹스에 대한 보완적인 접근 방식으로의 -linked 글리 칸 이 방법은 하나의 분석 신호 (참조 -4,6-의 GlcNAc로 "분기 베타 1-6 ''코어 푸코 실화」, 「6 시알 릴", "한 GlcNAc를 이등분"등과 같은 관심 고유 당쇄 기능을 풀 수있다 그림 2에서 6 갈, 3,4,6- 남자와 2,6- 남자 노드, respectively). 전통적인 하향식 접근법에있어서, 궁극적으로 하나 또는 두 개의 키 글리코 (33)의 유일한 활동에 의존 이와 같은 기능은 일반적으로 그대로 글리 칸 다스 분산되어, 때로는 (예 3 시알 릴 대를 해결하기가 어렵거나 불가능할 수있다 일부 손상 글리 칸 대중의 타락으로 인해 6 시알 릴). 또한, 여기에 제시된 상향식 접근은 비 침습적 폐암 검출에서 최초의 약속을 입증했다. (33) 또한, 연구들은 암의 다른 형태의 검출에 관한 이러한 초기 결과뿐만 아니라, 또 추가적인 미발표 결과를 검증하는 것이 진행되고있다.
여기에 설명 된 방법의 가장 큰 한계는 미리 절연하는 당 단백질에 적용 할 것 인 경우는, 검출 한계의 관점에서 제한된다는 점이다. 캐리어 단백질없이 개인 글리 칸 표준의 게시되지 않은 분석, 정량 한계 FO을 바탕으로R 개별 글리 칸은 낮은 마이크로 그램 범위에서 거짓말을 나타납니다. 이들은 절대 측면에서 낮은 LOQs 의미가 없지만,이 사실은 분석-을 위해 설계와 목적이 여기에 설명 된 이상에 대해 (낮은 LOQs을 달성 할 필요가 없으며되지 않았습니다의 원래 의도 범위와 관련하여 문제가되지 않습니다 이전 게시 33)이다. 실제로, 인간 혈장 / 혈청의 10S의 당 단백질을 포함 ㎎ / ㎖ 농도 범위 선의 혈장 / 혈청의 분석을 위해 우리는 단지 최종 샘플 볼륨 ~ 1/100 제를 주입하고, 41 부에서 40 분할 것을 그 작은 수량은 GC 인젝터 포트에 낭비한다. 이러한 행위없이, 당쇄 노드들 중 일부는 검출기를 포화있다. 종래 하향식 MALDI-MS 또는 LC-MS 기반 접근법에 의해 본래 당쇄 적절한 신호를 생산할 수있는 당 단백질의 피코 몰의 양은이 방법으로 검출 할 수 없다. 방법론의 추가 정제는이 제한을 해결하기 위해 진행되고있다.
공개
The authors have nothing to disclose.
감사의 말
This work was supported by the College of Liberal Arts and Sciences of Arizona State University in the form of laboratory startup funds to CRB. It was also supported by a grant from Flinn Foundation (Grant No. 1977) and by the National Cancer Institute of the National Institutes of Health under Award Number R33CA191110. JA was supported by the National Institute of General Medical Sciences of the National Institutes of Health Postbaccalalureate Research Education Program (PREP) under award number R25GM071798. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
자료
| Name | Company | Catalog Number | Comments |
| Sodium hydroxide beads | 367176 | Sigma-Aldrich | 20-40 mesh, reagent grade 97% |
| 0.9 ml Spin column | 69705 | Pierce division of ThermoFisher Scientific | Includes plugs and polyethylene frits |
| GC-MS autosampler vial (silanized)* | C4000-9 | ThermoFisher Scientific | Target DP High Recovery Vial, 1.5 ml, 12 mm x 32 mm, includes Teflon-lined pierceable caps |
| 1.5 ml polypropylene test tubes | 05-402-25 | ThermoFisher Scientific | Snap-cap lid |
| 2 ml polypropylene test tubes | 05-408-138 | ThermoFisher Scientific | Snap-cap lid |
| Dimethyl Sulfoxide (DMSO) | D8418 | Sigma-Aldrich | BioReagent for molecular biology, reagent grade >99.0% |
| Iodomethane | I8507 | Sigma-Aldrich | Contains copper as stabilizer, ReagentPlus 99% |
| Acetonitrile | A955-4 | ThermoFisher Scientific | Optima LC/MS |
| Microcentrifuge | 75002436: Sorvall Legend Micro 17 Centrifuge | ThermoFisher Scientific | 24 x 1.5/2.0 rotor with ClickSeal biocontainment lid. Rotor catalog number: 75003424 |
| 13 x 100 glass test tube (silanized)* | 53283-800 | VWR | 13 mm x 100 mm borosilicate glass test tubes with screw-cap finish |
| Caps for glass test tubes | 14-930-15D | ThermoFisher Scientific | Kimble™ Black Phenolic Screw Caps; 13 mm-415 GPI thread; PTFE-faced rubber liner. |
| Sodium chloride | S7653 | Sigma-Aldrich | >99.5% pure |
| Chloroform | 4440-08 | Macron Fine Chemicals | |
| Trifluoroacetic acid | 299537 | Sigma-Aldrich | 99% purified by redistillation for protein sequencing |
| Sodium borohydride | 71321 | Fluka Analytical | 99% |
| Ammonium hydroxide solution | 320145 | Sigma-Aldrich | NH3 content: 28.0-30.0% |
| Methanol | AH230-4 | Honeywell Burdick & Jackson | HPLC grade |
| Acetic acid | 320099 | Sigma-Aldrich | 99.70% |
| Plastic vacuum desiccator | Any model of adequate size | FoodSaver | |
| Acetic anhydride | 539996 | Sigma-Aldrich | 99.50% |
| Dichloromethane | D143SK-4 | ThermoFisher Scientific | Stabilized HPLC grade |
| Acetone | 9006-03 | J.T.Baker | Baker Analyzed |
| Heated evaporation manifold (main unit) | pi18823 | ThermoFisher Scientific | Thermo Scientific* Reacti-Therm* Heating and Stirring Module; Triple-block Model with Heating and Stirring Function |
| Heated evaporation manifold (overhead evaporator) | pi18826 | ThermoFisher Scientific | ThermoScientific* Reacti-Vap Evaporator, 27-port; For use with triple-block Reacti-Therm heating module |
| Aluminum sample-holder blocks for evaporation manifold | pi18816 | ThermoFisher Scientific | Block, Aluminum, Reacti-Block S-1, Holds 13 mm dia test tubes, 13 holes (14 mm dia. x 45 mm deep) |
| Gas chromatograph | Model A7890 | Agilent | Equipped with CTC PAL autosampler |
| Mass spectrometer | GCT Premier (Time-of-Flight) | Waters | |
| Split-mode liner (deactivated / silanized) | 5183-4647 | Agilent | Containing a small plug of silanized glass wool |
| DB-5ms GC column | 122-5532 | Agilent | 30 m x 0.25 mm ID x 0.25 micron film thickness |
| Chlorotrimethylsilane | 95541 | Sigma-Aldrich | |
| Glass vacuum desiccator (for glassware silanization) | EW-06536-30 | Cole-Parmer | 12" wide; 230 mm plate size |
| *Glassware silanization is carried out in-house, overnight using chlorotrimethylsilane vapor in a large glass vacuum desiccator. | |||
참고문헌
- Li, M., Song, L., Qin, X. Glycan changes: cancer metastasis and anti-cancer vaccines. J Biosciences. 35 (4), 665-673 (2010).
- Stanley, P., Schachter, H., Taniguchi, N., Varki, A., et al. . Essentials of Glycobiology. , Ch. 8: N-Glycans (2009).
- Apweiler, R., Hermjakob, H., Sharon, N. On the frequency of protein glycosylation, as deduced from analysis of the SWISS-PROT database. Biochim Biophys Acta. 1473 (1), 4-8 (1999).
- Brockhausen, I., Schachter, H., Stanley, P., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Rini, J., Esko, J., Varki, A., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Gercel-Taylor, C., Bazzett, L. B., Taylor, D. D. Presence of aberrant tumor-reactive immunoglobulins in the circulation of patients with ovarian cancer. Gynecol Oncol. 81 (1), 71-76 (2001).
- An, H. J., et al. Profiling of glycans in serum for the discovery of potential biomarkers for ovarian cancer. J Proteome Res. 5 (7), 1626-1635 (2006).
- Kanoh, Y., et al. Changes in serum IgG oligosaccharide chains with prostate cancer progression. Anticancer Res. 24 (5B), 3135-3139 (2004).
- Kyselova, Z., et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res. 6 (5), 1822-1832 (2007).
- Okuyama, N., et al. Fucosylated haptoglobin is a novel marker for pancreatic cancer: a detailed analysis of the oligosaccharide structure and a possible mechanism for fucosylation. Int J Cancer. 118 (11), 2803-2808 (2006).
- Zhao, J., et al. Glycoprotein microarrays with multi-lectin detection: unique lectin binding patterns as a tool for classifying normal, chronic pancreatitis and pancreatic cancer sera. J Proteome Res. 6 (5), 1864-1874 (2007).
- Comunale, M. A., et al. Proteomic analysis of serum associated fucosylated glycoproteins in the development of primary hepatocellular carcinoma. J Proteome Res. 5 (2), 308-315 (2006).
- Goldman, R., et al. Detection of Hepatocellular Carcinoma Using Glycomic Analysis. Clin Cancer Res. 15 (5), 1808-1813 (2009).
- Aurer, I., et al. Aberrant glycosylation of Igg heavy chain in multiple myeloma. Coll Antropol. 31 (1), 247-251 (2007).
- Abd Hamid, U. M., et al. A strategy to reveal potential glycan markers from serum glycoproteins associated with breast cancer progression. Glycobiology. 18 (12), 1105-1118 (2008).
- Kyselova, Z., et al. Breast cancer diagnosis and prognosis through quantitative measurements of serum glycan profiles. Clin Chem. 54 (7), 1166-1175 (2008).
- Hongsachart, P., et al. Glycoproteomic analysis of WGA-bound glycoprotein biomarkers in sera from patients with lung adenocarcinoma. Electrophoresis. 30 (7), 1206-1220 (2009).
- Arnold, J. N., et al. Novel glycan biomarkers for the detection of lung cancer. J Proteome Res. 10 (4), 1755-1764 (2011).
- Bones, J., Mittermayr, S., O'Donoghue, N., Guttman, A., Rudd, P. M. Ultra performance liquid chromatographic profiling of serum N-glycans for fast and efficient identification of cancer associated alterations in glycosylation. Anal Chem. 82 (24), 10208-10215 (2010).
- Kodar, K., Stadlmann, J., Klaamas, K., Sergeyev, B., Kurtenkov, O. Immunoglobulin G Fc N-glycan profiling in patients with gastric cancer by LC-ESI-MS: relation to tumor progression and survival. Glycoconj J. 29 (1), 57-66 (2012).
- Chen, G., et al. Human IgG Fc-glycosylation profiling reveals associations with age, sex, female sex hormones and thyroid cancer. J Proteomics. 75 (10), 2824-2834 (2012).
- Takeda, Y., et al. Fucosylated haptoglobin is a novel type of cancer biomarker linked to the prognosis after an operation in colorectal cancer. Cancer. 118 (12), 3036-3043 (2012).
- Parekh, R. B., et al. Association of rheumatoid arthritis and primary osteoarthritis with changes in the glycosylation pattern of total serum IgG. Nature. 316 (6027), 452-457 (1985).
- Mehta, A. S., et al. Increased levels of galactose-deficient anti-Gal immunoglobulin G in the sera of hepatitis C virus-infected individuals with fibrosis and cirrhosis. J Virol. 82 (3), 1259-1270 (2008).
- Horvat, T., Zoldoš, V., Lauc, G. Evolutional and clinical implications of the epigenetic regulation of protein glycosylation. Clinical Epigenetics. 2 (2), 425-432 (2011).
- Zoldoš, V., Novokmet, M., Bečeheli, I., Lauc, G. Genomics and epigenomics of the human glycome. Glycoconj J. 30 (1), 41-50 (2013).
- Lowe, J. B., Marth, J. D. A genetic approach to Mammalian glycan function. Annu Rev Biochem. 72, 643-691 (2003).
- Tuccillo, F. M., et al. Aberrant Glycosylation as Biomarker for Cancer: Focus on CD43. Biomed Res Int. , (2014).
- Varki, A., Kannagi, R., Toole, B., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Brockhausen, I. Mucin-type O-glycans in human colon and breast cancer: glycodynamics and functions. EMBO reports. 7 (6), 599-604 (2006).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Bertozzi, C. R., Sasisekharan, R., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Borges, C. R., Rehder, D. S., Boffetta, P. Multiplexed surrogate analysis of glycotransferase activity in whole biospecimens. Anal Chem. 85 (5), 2927-2936 (2013).
- Mcinnes, A. G., Ball, D. H., Cooper, F. P., Bishop, C. T. Separation of Carbohydrate Derivatives by Gas-Liquid Partition Chromatography. J Chromatogr. 1 (6), 556-557 (1958).
- Ciucanu, I., Caprita, R. Per-O-methylation of neutral carbohydrates directly from aqueous samples for gas chromatography and mass spectrometry analysis. Anal Chim Acta. 585 (1), 81-85 (2007).
- Ciucanu, I., Kerek, F. A simple and rapid method for the permethylation of carbohydrates. Carbohydr Res. 131, 209-217 (1984).
- Kang, P., Mechref, Y., Klouckova, I., Novotny, M. V. Solid-phase permethylation of glycans for mass spectrometric analysis. Rapid Commun Mass Sp. 19 (23), 3421-3428 (2005).
- Kang, P., Mechref, Y., Novotny, M. V. High-throughput solid-phase permethylation of glycans prior to mass spectrometry. Rapid Commun Mass Sp. 22 (5), 721-734 (2008).
- Goetz, J. A., Mechref, Y., Kang, P., Jeng, M. H., Novotny, M. V. Glycomic profiling of invasive and non-invasive breast cancer cells. Glycoconj J. 26 (2), 117-131 (2009).
- Goetz, J. A., Novotny, M. V., Mechref, Y. Enzymatic/chemical release of O-glycans allowing MS analysis at high sensitivity. Anal Chem. 81 (23), 9546-9552 (2009).
- Mulloy, B., Hart, G. W., Stanley, P., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Seed, B. Silanizing glassware. Curr Protoc Immunol. 21, A.3K.1-A.3K.2 (1997).
- Stellner, K., Saito, H., Hakomori, S. I. Determination of aminosugar linkages in glycolipids by methylation. Aminosugar linkages of ceramide pentasaccharides of rabbit erythrocytes and of Forssman antigen. Arch Biochem Biophys. 155 (2), 464-472 (1973).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유