Method Article
糖鎖ノード分析:グライコミクスへのボトムアップアプローチ
要約
This article presents an enhanced form of a novel bottom-up glycomics technique designed to analyze the pooled compositional profile of glycans in unfractionated biofluids through the chemical breakdown of glycans into their constituent linkage-specific monosaccharides for detection by GC-MS. Potential applications include early detection of cancer and other glycan-affective disorders.
要約
Synthesized in a non-template-driven process by enzymes called glycosyltransferases, glycans are key players in various significant intra- and extracellular events. Many pathological conditions, notably cancer, affect gene expression, which can in turn deregulate the relative abundance and activity levels of glycoside hydrolase and glycosyltransferase enzymes. Unique aberrant whole glycans resulting from deregulated glycosyltransferase(s) are often present in trace quantities within complex biofluids, making their detection difficult and sometimes stochastic. However, with proper sample preparation, one of the oldest forms of mass spectrometry (gas chromatography-mass spectrometry, GC-MS) can routinely detect the collection of branch-point and linkage-specific monosaccharides ("glycan nodes") present in complex biofluids. Complementary to traditional top-down glycomics techniques, the approach discussed herein involves the collection and condensation of each constituent glycan node in a sample into a single independent analytical signal, which provides detailed structural and quantitative information about changes to the glycome as a whole and reveals potentially deregulated glycosyltransferases. Improvements to the permethylation and subsequent liquid/liquid extraction stages provided herein enhance reproducibility and overall yield by facilitating minimal exposure of permethylated glycans to alkaline aqueous conditions. Modifications to the acetylation stage further increase the extent of reaction and overall yield. Despite their reproducibility, the overall yields of N-acetylhexosamine (HexNAc) partially permethylated alditol acetates (PMAAs) are shown to be inherently lower than their expected theoretical value relative to hexose PMAAs. Calculating the ratio of the area under the extracted ion chromatogram (XIC) for each individual hexose PMAA (or HexNAc PMAA) to the sum of such XIC areas for all hexoses (or HexNAcs) provides a new normalization method that facilitates relative quantification of individual glycan nodes in a sample. Although presently constrained in terms of its absolute limits of detection, this method expedites the analysis of clinical biofluids and shows considerable promise as a complementary approach to traditional top-down glycomics.
概要
糖脂質、糖タンパク質、プロテオグリカン、及びグリコサミノグリカンをまとめグリカンとして知られている複雑な、異種の炭水化物の4つの主要なクラスを構成しています。原形質膜、糖衣、細胞外マトリックス及び体液のようなユビキタス及び積分成分、グリカンは、エンドサイトーシス、細胞内輸送、細胞運動性、シグナル伝達、分子認識、受容体活性化、細胞接着、宿主 - 病原体相互作用のような多様な生化学的プロセスに参加、細胞間コミュニケーション、免疫学、および免疫応答の開始。生活のほぼすべてのドメイン内の1本は、グリカンポリマーを構築するグリコシルトランスフェラーゼとして知られている酵素は、改造を構築するために(もグリカンを分解するグリコシダーゼ、として知られている)グリコシドヒドロラーゼと連携して行動しますそして最終的に確定グリカンポリマー2を生成します 。各糖転移酵素は、異なる複合糖質の糖転移酵素を操作することができるが、一般的求核アクセプターの特定のカテゴリ( 例えば、脂質、ポリペプチド、核酸、または成長に特定の活性化されたヌクレオチド糖供与体( 例えば、GDP-フコース)の単糖類部分を転送することによってlinkage-とアノマー固有のグリコシド結合を偽造オリゴ糖)。タンパク質の50%以上(特に膜および分泌タンパク質)は、翻訳後グリコシル化によって修飾されていると推定されている3初歩的な組み合わせの計算がグリコシル化によって糖タンパク質に従うかなりのばらつき、汎用性、および特異性についての評価を提供します。例えば、ポリペプチド基質は、わずか10グリコシル化部位を持っている場合、それぞれのサイトには、還元末端のみ3つの異なる単糖の1でグリコシド結合を形成することができ、その後、理論的には、最終的な糖タンパク質は、3 10 = 59049明確なアイデンティティをとることができます。糖タンパク質では、グリコシド結合は、一般的に、側鎖の窒素Oで形成します配列Asn-X-Ser / Thr中のFのアスパラギン残基(Xはプロリンを除く任意のアミノ酸であり得る)Oの -glycans 4を得N -glycans 2及びセリン及びスレオニン残基の側鎖ヒドロキシルを得ました。いくつかの例外を除いて、グリコシルトランスフェラーゼには厳格なドナー、アクセプター、およびリンケージ特異性を示す、ため、細胞のグライコーム( すなわち、グリコシル化製品のその相補)の組成は、ユニークで制限されています。5重要と豊富な血漿糖タンパク質は、下流の結果として異常なグリコシル化を被ります多くの病理学的状態に起因する異常な糖転移酵素の発現および活性、特に癌および炎症性疾患。6月24日の
主にエピジェネティックな要因に起因して、グライコームは、哺乳動物ゲノムの約1%が形成、変更をコード化しながら。かなり25,26プロテオームとトランスクリプトームよりも、多様でダイナミック、かつ複雑であり、グリカンのアセンブリは、非テンプレート駆動型の方法でマークされた対照的に27のグリコシル化が進行は、ポリペプチドおよび核酸生合成します。グリコシル化酵素や栄養素や前駆体可用性などの環境要因の相対的な量と活動の間の相互作用は、最終的にグリコシル化の性質、速度、および程度を決定する。5,28胚( 例えば、決意と分化)、細胞活性化、および進行を通して細胞周期に影響を与える遺伝子発現( すなわち、転写および翻訳)とは、その活性が、細胞のグリカンプロファイルのすぐ上流の決定要因である利用可能なグリコシルトランスフェラーゼの正体と量を変えます。 (の一部)は、増殖、接着剤、および癌細胞の浸潤特性は、通常の胚形成細胞のもの、グリカン生合成経路の特定の変化( 例えば、前駆体の蓄積、調節解除された表現、aberranに似ているので。トンの変更、構造切り捨て、または新規の形成が)ユニバーサル癌腫瘍形成の様々な段階を示すバイオマーカー、進行、遊走、および浸潤として働く29グリコシル化は非常に複雑であるが、明らかにグリコシル化における唯一の少数の変化は、発癌および転移を有効にすることができます。どう やら、特定の「異常な」グリコシル化製品が実際に免疫認識を回避し、無愛想な血管内および転移性環境での移行の要求を生き残るためにそれらを可能にすることによって、癌細胞に利益をもたらす。28,30,31驚くことではないが、実験では、変更されたのパターンを中断または予防することを明らかにしました遺伝子発現および異常なグリカン形成はそれにもかかわらず。29腫瘍形成を停止させることができ、生体液試料( 例えば、尿、唾液、および血漿または血清)で検出された異常なグリカンは、癌(または別の疾患)の直接的な指標ではないかもしれないが、むしろ下流微妙なまだ重要なの成果免疫系または予測不可能な器官における悪性状態の定量化可能な波及効果の変化。32
彼らはグライコームについて、汎用的に提供するが、多くの分子間相互作用ベースのグライコミクス技術( 例えば、レクチン/抗体アレイおよび代謝/共有結合標識)は、全グリカン構造の検出に依存し、個々のグリカンについての詳細な構造情報を提供していません。著しく対照的に、質量分析(MS)は、個々のグリカン構造を同定し、定量化することができ、そしてポリペプチドのコアへの結合部位のような構造情報を明らかにする。唯一の糖転移酵素の調節解除された発現または活性は、複数のグリコシル化経路における有害な分子事象のカスケードを開始することができます。各糖転移酵素が複数の複合糖質基板上に、異なる成長グリカンポリマー全体に動作することができるので、調節解除された生合成カスケードがdisproporをもたらします一つだけグリカン製品のtionally増加量が、細胞内又は細胞外液中の異常なグリカンのいくつかの不均質なクラス。33大きなプールに比べて、しかし、このようなユニークな異常なグリカンは、時々 、癌または他のグリカン-感情の病状のためのバイオマーカーとして実用的でないと考えられていますよく調整されたグリカン、これらの異常なグリカンは、多くの場合であっても、質量分析などの高感度技術では検出できないままであってもよい非常に小さな割合を表します。例えば、細胞内および細胞外体液中の、(大きさの8オーダーに及ぶ)幅広いタンパク質濃度スペクトルは、より豊富な種によってマスクされる希少糖タンパク質の検出を防止することができる。 図32はまた、グリコシルトランスフェラーゼ活性を決定することは実用的でかなりのままそして多くの糖転移酵素は、臨床生体液中に存在しないか、またはex vivoで非アクティブになっているので、理論上の課題。 consistenの難しさにもかかわらず、TLYユニークな全体グリカンの超微量を検出および定量、質量分析の実践者は、臨床マーカーとしてそのままグリカンを採用に向けて多大な進歩を遂げてきました。我々は最近、一緒に各グリカンに一意性を付与するすべての構成要素の分岐点とリンケージ固有の単糖類(「グリカンノード」)の検出を容易にし、多くのでは、GC-MSを用いて、無傷のグリカンの分析に相補的なアプローチを開発しました例は、直接過失糖転移酵素(複数可)の相対活性を定量化する分子代理としての役割を果たす。
その第一は、1958年グリカン分析への直接適用を報告しているので、ガスクロマトグラフィー(GC)は、34単位のメチル化単糖および二糖の分析それらのアノマーと絶対配置を決定し、その後の質量分析のためにそれらを分離するための強力な技術であることが証明された。35 1984年と2007年、Ciucanuや同僚の間で導入し、水とクロロホルムを使用して、過メチル化グリカンの液/液抽出し、水酸化ナトリウムおよびヨードメタンを用い、固相グリカン過メチル化技術を、洗練された。2005年から2008年の間に35,36、カンと共同研究者は、時間節約のスピンを統合しました過メチル化のステップへ-カラムのアプローチ。2008年には37,38は 、ゲッツの研究グループは、比較し、潜在的に侵襲的および非区別するために、マトリックス支援レーザー脱離イオン化(MALDI)質量分析法を用いた糖鎖プロファイリング法過メチル化定量的な固相を考案しましたその後、2009年に、ゲッツチームを合わせ、酵素および化学リリース技術が高度にアルカリ性の固相過メチル化方式で、無傷の糖タンパク質からO -glycansを切断する39 40ゲッツ手続きが同時過メチル化や化学物質放出を促進しているが、-invasive乳癌細胞。 Oの -glycansの、それだけ予め絶縁糖に適用されましたタンパク質。私たちは2013年にこの技術を修正し、トリフルオロ酢酸(TFA)加水分解、還元、アセチル化手順を組み込むことによって、全体の未分画生体液と均質化した組織サンプルのためにそれを適応さ。33これらの追加の手順はまた、糖脂質からグリカンを放出し、Nは、糖タンパク質および変換からグリカンを-結合しました特徴的なメチル化およびアセチル化パターンを一意的にGC-MSにより分析を容易に元の完全なグリカンポリマー41( 図2)で構成グリカンノードを特徴付ける部分メチル化アルジトールアセテート(PMAAs、 図1)に彼ら。33最終的に、この手順は、「コアのフコシル化」、「6 - シアル化」、「バイセクティングGlcNAc」、および「ベータ1-6分岐」などユニークなグリカンの機能を直接、相対的な定量化に基づく複雑な生体液中のすべてのグリカンの複合肖像画を生成します - 各単一GC-MSのchromatograp由来HICピーク。この記事では、相対定量のモードの改善に伴って、さらに過メチル化の最適化、アセチル化、分離、およびクリーンアップの段階を示しています。
プロトコル
注意:この実験で使用される試薬のいずれかと皮膚/眼への接触を避けること。曝露の際に、水で十分に洗い流し、直ちに医師の診察を受けます。
1.完全メチル化およびグリカンの抽出
- カラム調製
- サンプルを分析するためにできるだけ多くの微量遠心スピンカラムユニットを得ます。ブレイクとプラスチック収容管のキャップを外します。各収容管にマイクロフュージミニフィルタを配置します。マイクロチューブのラックに組み立てられた微量遠心スピンカラム(ミニフィルタを含む)を配置します。
- 水酸化ナトリウム(NaOH)ビーズ(20-40メッシュ)の株式を取得します。湿度が凝集、NaOHを作業用ストックとしてホット磁器モルタルを引き起こしている場合は、小さな計量ボートにいくつかのNaOHを転送したり。 NaOHまたは破砕/粉末状のNaOHビーズの塊を使用することは避けてください。
注意:NaOHを強力毒素および腐食性の拠点となっています。 15分間水で露出した皮膚/目をフラッシュします。 ThorougHLY実験を完了した後でワークベンチを清掃してください。 - 小さなスコップやへらを使用して、第一の外側のベベル(つば以下〜5ミリメートル)までのNaOHでマイクロフュージミニフィルタを埋めるために作業ストックからのNaOHビーズを転送します。 /パックのNaOHビーズを凝縮するベンチトップに満たされた微量遠心フィルターをタップします。
注記:この実験を通じて、吸湿性のNaOHビーズによって過度の水の吸着を最小限に抑えるのNaOHカラムパッキングの表面上の任意の追加の流体のレベル( 例えば、アセトニトリル、ジメチルスルホキシド、検体溶液)を維持し、空気との直接接触を制限します。 - アセトニトリル(ACN)の株式を取得します。それぞれのNaOH満載の微量遠心ミニフィルタに〜350μlのACNを転送します。 ACNの下で水没のNaOHを維持し、先端捲縮ゲルローディングピペットチップで攪拌することにより、大きな気泡を除去。
注意:アセトニトリルは可燃性の刺激剤です。 - カラムの遠心分離
- 対称的に遠心分離機内部のマイクロ遠心カラムをアレンジ。必要に応じてバランスチューブを使用しています。遠心分離器内部のNaOHの顆粒をこぼさないようにしてください。遠心機の蓋を閉じます。
- 2400×gで〜15秒間遠心分離は、列(NaOHおよびACNを含みます)。
- 遠心分離が完了すると、遠心分離器から微量遠心列を削除し、有害廃棄物容器にACNを捨てます。無傷の包装のNaOH列を保管してください。
- それぞれのNaOH満載の微量遠心ミニフィルタに〜350μlのジメチルスルホキシド(DMSO)を追加します。 DMSOの下で水没のNaOHを維持し、ピペットチップで任意の大きな気泡を除去。以前に2400×gで〜15秒間、遠心分離器の列を説明したように、無傷の包装のNaOHを維持しながら、およびDMSOを捨てます。
注意:DMSOは、変異原と刺激性であり、容易に皮膚から吸収されます。 - スピンフィルターに含まれるプラグをすべてマイクロフュージミニフィルタを差し込みキット。それぞれのNaOH満載の微量遠心ミニフィルタにμlのDMSO〜350を転送し、DMSOは、その後のNaOH包装内のすべての領域に到達するように、NaOHの梱包内の気泡を除去するために、200μlのピペットチップを使用します。破砕または過度のNaOHビーズを掻き避けます。水酸化ナトリウム粉末は望ましくありません。可能な限り迅速にこのステップを完了します。
- 血漿品質管理(QC)サンプル(複数可)の調製
注意:実験バッチ全体で一貫性のある結果を確保するために、各バッチで分析しようとする目的の生物学的物質の大規模な、均質なバルクコレクションから採取した試料の少なくとも1つのアリコートを使用することを検討してください。例えば、血漿を分析する場合、各バッチにQC試料(複数可)として血漿のバルク収集のアリコート(複数可)を使用します。未知試料と同様に処理QCサンプル。- 遠心分離〜10,000×gで4分間のQCプラズマの株式サンプル。遠心分離の間、いくつかの高密度の沈殿物を目に落ち着くことができますEの底部と一部の低密度沈殿物がプラズマの最上部に浮くことがあります。プラズマの取り外し一部(複数可)の両方を避けてください。
- 以下の「1.3)試料の調製」に進んでください。プラズマ遠心分離が完了した後に続いて、このステップに戻ります。
- 遠心分離QCプラズマの9μLを撤回し、スナップシャットキャップを装備し適切に標識された1.5 mlのポリプロピレン試験管に移す(以下「1.5 mlのプラスチック試験管」と呼びます)。各アリコートに、脱イオン水1μLを加えます。必要であれば、内部標準(複数可)のためのキャリアとしてこれを使用しています。
- このプラズマ制御に270μlのDMSOを追加します。渦は、完全な溶解を確実にします。
- 試料調製
- 生物学(分析物)のサンプル数と同じ数の1.5 mlのプラスチック試験管を取得します。
- 各生物学(分析物)の転送9μlのそれに対応する1.5 mlのプラスチック試験管にサンプル。脱イオン水および27の転送1μlの各試料管に0μlのDMSO。
- 精力的にDMSOに完全な溶解を確実にするために( 例えば、渦および/ または上下に繰り返しピペット)のサンプルを混ぜます。
注意:ヒュームフードの内側には、次の手順を実行。次のステップで使用し、ヨードメタン(CH 3 I)、ジクロロメタン(塩化メチレン別名を CH 2 Cl 2)、クロロホルム(CHCl 3を、トリクロロメタン)、( 例えば、ニトリル手袋)プラスチックの特定のタイプを溶解することができる揮発性液体であります。耐溶剤性手袋を使用してください。それらの低い粘度と高い蒸気圧のために、これらの試薬は、転送中にピペットの先端から滴下することができます。受け容器に隣接した原液を保持することによって、試薬の損失や潜在的なリスクを最小限に抑えることができます。 - 小さな、きれいなチューブにヨードメタンの十分な総容量を転送します。各検体試料は、105μlのヨードメタンが必要になります。 anothへの転送は〜500μlのジクロロメタンえーきれいなチューブ。注射器の目詰まりを防止するために、すぐにヨードメタン転送した後、ジクロロメタンで注射器をすすいでください。
注意:ヨードメタンは、感光性、揮発性、および中枢神経系に損傷を与えるか、吸入または摂取した場合、死を引き起こすことができる強力な毒素です。ジクロロメタンは、潜在的な発がん性物質、生殖変異原、およびいくつかの器官に損傷を与えるか、死を引き起こすの強力な刺激物が可能です。 - 各検体試料に105μlのヨードメタンを追加するための分析注射器を使用してください。キャップ検体チューブはすぐにヨードメタン蒸発を最小限にします。必要に応じて、徹底的にすべてのサンプルは液体がキャップ内に残っていないことを確実にするために、簡単に遠心分離をボルテックスと。 (、茶色、紫、または黄色に例えば、)任意の色の変化は以下の過メチル化反応を危うくするかもしれヨードメタンの劣化を、信号。
- ジクロロメタンで少なくとも3回のヨードメタンを転送するために使用される分析シリンジを洗い流します。これはあちこちそれを防ぐことができますメートルの目詰まり。有機有害廃棄物容器に余分なヨードメタン、ジクロロメタンとともに、このリンス廃棄してください。有害廃棄物容器に使用される試験管を置きます。
- 2-mlのプラスチック貯留管の新しいセットを取得します。所望であれば、スナップキャップを取り外してください。
- マイクロフュージミニフィルターを取り外してください。遠心分離後、プラグを抜か2400×gで15秒間の列、およびDMSO流出物と一緒に、リザーバチューブを捨てます。
- 遠心分離スピンカラムを再プラグイン、および新しい貯留管の内側に配置します。数各スピンカラムと同じサンプル数とそれに対応する収容管。ミニフィルタプラグが締まっていることを確認してください。潜在的な漏れは、次のステップに影響を与えることができます。スピンカラムからDMSOを除去し、スピンカラム上に、検体サンプルを転送するまでの時間を最小限に抑えます。
- 完全メチル化
- 定量的には、それに対応するNaOHのビーズを充填したマイクロフュージスピン共同に各試料溶液を移しますlumn。このステップでは1,000μlのピペットチップを使用してください。移した後、200μlのチップの先端の〜2ミリメートルを圧着し、攪拌機として使用する列の内容のままにします。すべてのサンプルについて繰り返します。
注:検体溶液は、転送中にピペットの先端から滴下することができますので、ヨードメタンの低粘度は、サンプルの損失を引き起こす可能性があります。片手で試料管と互いに隣接スピンカラムを保持し、急速にもう一方の手で試料溶液を移します。 - 過メチル化反応は11分間進行させます。この期間中に、各サンプルに少なくとも4-5回かき混ぜます。 NaOHをビーズの表面で起こる効率的な過メチル化を、容易にするために、静かに列の内容を混合する撹拌機として、先端捲縮ゲルローディングピペットチップを使用します。積極的な混合は、スピンフィルターを穿刺粉砕し、(その後の液体/液体抽出の有効性を低減することができる)のNaOHビーズを懸濁、および/またはSAとして(サンプルの損失を引き起こす可能性がmpleに浸したのNaOH顆粒)をカラムからオーバーフローすることができます。
- その後の液体/液体抽出工程の準備のために、0.2 Mリン酸ナトリウム緩衝液(pH7.0)中の0.5 M塩化ナトリウム(NaCl)で十分な量の溶液を調製し、室温で保存します。各試料は、液体/液体抽出のすべての3つのサイクルは12 mlのNaCl溶液〜の合計を必要とします。
- 11分間の過メチル化期間が終了すると、すぐにはまだ慎重に列を抜き、2400×gで15秒間、それらを遠心分離します。プラグを捨てます。
- 定量的には、それに対応するNaOHのビーズを充填したマイクロフュージスピン共同に各試料溶液を移しますlumn。このステップでは1,000μlのピペットチップを使用してください。移した後、200μlのチップの先端の〜2ミリメートルを圧着し、攪拌機として使用する列の内容のままにします。すべてのサンプルについて繰り返します。
- すぐに遠心分離機からスピンカラムを削除し、背後にあるたての過メチル化グリカンを含むフロースルーソリューションを残し、空のスピン貯留管の新しいセットに入れます。何かを捨てないでください。
- できるだけ早く、乾燥、水酸化ナトリウムを充填したスピンフィルターに300μlのアセトニトリル(ACN)を追加します。 9600×gで30秒間スピンフィルターを遠心。
- ImmediatelYその後、13×をシラン化する( すなわち 、11分間のNaOHビーズとインキュベートしたソリューションは、次に前に、前のステップでACNを300μlを添加する遠心チューブにスピンフィルターを通して紡糸)メイン過メチル化ソリューションを転送0.5 M NaClを含む五つ星中3.5 mlのM 0.2のリン酸ナトリウム緩衝液を含有する100mMのガラス試験管42、pHが7.0、直ちに(ボルテックス)を混合します。このステップの間に任意の固体白色残渣を転送することは避けてください。次のステップに進む前に、各サンプルのためにこれを行います。
- そのそれぞれのシラン化ガラス管中の液体サンプルの残りの部分(と)にそれぞれ収容管の遅延、転送(結合)ACNスピンスルーせずに、すぐに(ボルテックス)を混ぜます。また、このステップの間に任意の白色固体残留物を転送しないようにしてください。キャップ、シェイク、および渦ガラス管。各サンプルについて、この手順を繰り返します。適切な廃棄物容器中のNaOH列およびパスツールピペットを破棄します。
- 液体/液体エクストラctionと糖鎖精製
- ヒュームフードの内側には、各サンプルに1.2ミリリットルのクロロホルムを追加します。その直後、シラン化ガラス管にキャップをし、激しく内容物を混合。
- 予熱金属ブロック蒸発マニホールド内の約75℃です。 100ミリメートルのガラス管×13ミリメートルを収容することができ、ウェルに加熱ブロックを使用してください。
- シラン化されたパスツールピペット、非シラン化パスツールピペット、およびキャップを有するシラン化ガラス試験管の新しいセットを取得します。
注意:クロロホルム(CHCl 3を )刺激性、変異原、および手袋のいくつかのタイプを透過することができる潜在的な発癌物質です。 - 簡単に言えば遠心分離機(〜3,000×g)をサンプル含有ガラス管は水層と有機層を分離しました。
- 水層の〜3ミリメートルは、底部の有機層の上に残るように上部の水層を十分に抽出するために、非シラン化パスツールピペットを使用してください。
- 0.5 M Naを3.5ミリリットルを追加します。CLの各ガラス管に0.2 Mリン酸ナトリウム緩衝液(pH 7)中の溶液を、激しく混合し、短時間遠心分離(〜3,000×gで)。前のステップ(1.4.3)のように、水層を抽出するために、非シラン化パスツールピペットを使用しています。
- 前のステップ(1.4.4)を繰り返したが、水層の〜1ミリリットルを残します。
- 清潔で適切に標識されたシラン化13×100ミリメートルのガラス試験管に有機層を転送するためにクリーンなシラン化パスツールピペットを使用してください。以下の方法で抽出することにより、水の汚染を避けます:
- 片手に隣接する現在および新たなシラン化ガラス試験管の両方を保持します。水層を通って下方にピペットを挿入しながら、もう一方の手で、泡を作成するために、ピペット電球を押します。
- 一度有機層の内側に、気泡の作成を停止し、有機層と水層が安定し、再び分離することを可能にするのに安定したピペットの電球を保持します。そして、ゆっくりとorganiの限りを撤回する電球をリリース任意の水性汚染することなく、可能な限りC層。
- 急速に水層を介してピペットチップを上げ、そして管からピペットを上昇させながら、わずかに(いくつかの水の汚染を引き出すことになる)電球を放出する自然反射を抵抗します。
- 急速に隣接する新しいチューブに低粘度の有機層を転送します。任意の水性汚染は、新しいガラス管で抽出した有機層の上に小液滴として表示されます。水性/ NaClの汚染が表示されている場合は、ピペットでそれを削除。単一の液滴に水性液滴をプールする必要がある場合遠心します。
- 適切に古いガラスチューブ、ピペット、水と有機廃液の処分。洗い、ガラス管のキャップをリサイクルしています。
- ヒュームフードの内側〜75℃で5分間予熱し蒸発マニホールド内の窒素の穏やかで一定の流れの下ですべてのサンプルを乾燥させます。すべてのドライダウンSTE中に蒸発冷却を確保するために、psのは、穏やかな窒素と一定の流れがはねたり、液体を飛散することなく、液面を乱さなければなりません。最終サンプルを完全に乾燥時に蒸発マニホールドからサンプルを削除します。乾燥したガラス管の下部に白い斑点は、バッファ/ NaClの汚染を示しています。
- TFAの加水分解工程を完了する日に残りの十分な時間がない場合は、ここで手順を一時停止します。一時的に( すなわち 、一晩)-20℃で乾燥試料を保存します。保存した後、手順を続行するには、Cの冷凍庫-20℃からサンプルを削除し、それらをアンキャッピングの前に完全に温めます。
- サンプルは暖かい、トリフルオロ酢酸(TFA)、加水分解(次の段階)の準備のために、加熱マントルを設定するが、このような液体の試験管の内容物の温度が121℃に達すること。 (ステップ以下の2.1を参照)TFAストックからTFA溶液を準備します。
2.トリフルオロ酢酸(TFA)の加水分解
注意:トリフルオロ酢酸(TFA)は、腐食性の有機酸および毒性刺激性です。
- 脱イオン水中の2.0 M TFA溶液の十分な量を準備します。各検体試料は、2.0 M TFA溶液の325μLを必要とします。濃縮TFAは13.0 Mです。
- 各検体試料に2.0 M TFAの325μLを加えます。続く乾燥工程(以下2.3)中TFAの蒸発及びサンプルの損失を防ぐために、しっかりとTFAを添加した直後に、各試料管のキャップ。すべてのガラスチューブ内の溶液レベルをマークします。次のステップの前に徹底的に各サンプルをボルテックスし。
- 適切な予備加熱された加熱ブロック中で2時間、しっかり蓋をサンプルチューブをインキュベートまたは内容物が121℃の温度に達するようにオーブン。代わりに、オーブンの加熱ブロックを使用する場合は、チューブの上部にTFAの凝縮を防止し、チューブの底部での試料残基の部分的乾燥をアルミホイルで試料管を覆います。 20〜30分後に試料溶液のレベルを確認してください。最小限のTFAの蒸発を確保します。必要に応じて、さらにキャップを締めたり、タイトなフィット感のためにキャップを交換してください。
- 2時間の待ち時間の間に、次のステップ(下記2.4を参照)を75℃まで別の蒸発マニホールドを設定します。
- 2時間の加熱期間は〜15分間窒素ガスの穏やかな流れの下で75℃で完全に乾燥したサンプルである場合。 15分以上の無人サンプルを放置しないでください。頻繁に一度、すべてのサンプルが乾燥しているサンプルをチェックし、加熱乾燥を中止してください。
- 還元工程を完了する日に残りの十分な時間がない場合は、ここで手順を一時停止します。 -80℃で一時的に( すなわち 、一晩)店のサンプル。 、貯蔵後の手順を続行-80°Cの冷凍庫からサンプルを削除し、それらをアンキャッピングの前に完全に温まるようにします。
3.削減
- ヒュームフードの内部には、1 M ammoniでは10g / Lの水素化ホウ素ナトリウム(NaBH 4)溶液の十分な量を調製しますええと、水酸化(NH 4 OH)。各サンプルは、このソリューションの475μLを必要とします。サンプルの各バッチの新鮮な溶液を作ります。濃水酸化アンモニウム(NH 3 w / wで27-30%)は約14.5メートルであります
注意:水素化ホウ素ナトリウム(NaBH 4を )吸湿性、水反応性毒素と強力な刺激剤であることのリリース-時の吸入、経口摂取、または眼/皮膚接触の際に深刻なやけどの原因となる水、非常に可燃性蒸気と接触。
注意:水酸化アンモニウム(NH 4 OH)は、重度の火傷や吸入、経口摂取、または眼/皮膚接触の際に不可逆的な臓器障害を引き起こすことができる腐食性の刺激性及び毒素です。 30分間水で患部をフラッシュして、被災地をこすりや傷から被害者を防ぎます。 - 各サンプルに、1 M NH 4 OHで10グラム/ LのNaBH 4の475μlを添加します。任意の残留物を溶解するために徹底的にサンプルを混ぜます。キャップ試験管と還元反応を1時間継続することを可能にします。
- 1時間の待ち時間の間に、75℃に加熱し蒸発マニホールドを設定します。ガラス管のための適切なウェル(下記3.4を参照)と加熱ブロックを使用してください。
- 1時間の反応時間が完了すると、各サンプルに63μlのメタノール(MeOH中)を加えます。 68℃で沸騰する比較的揮発性の液体 - このステップは、次のステップでは、ホウ酸トリメチルなどの残留ホウ素を除去します。
- 〜15分間、窒素ガスの穏やかな流れの下で75℃で乾燥したサンプル(予備加熱マニホールド内)。頻繁にサンプルをチェックして、無人それらを放置しないでください。ガラス管の底部の小液滴は、サンプルがまだ乾いていないことを示しています。
注液滴から気泡を区別するために、試験管が傾け。唯一の液滴は、傾けた後に移動しますが、その逆は必ずしも真ではない:気泡が移動しない場合、それはまだ(非常に小さい)の液滴とすることができます。 - samplいったんesが完全に乾燥している、9準備:1のメタノール(v / v)の溶液(メタノール)および酢酸(AcOH中を)。各サンプルへのAcOH溶液:このメタノール125μlのを追加します。
- 窒素ガスの穏やかな流れの下で75℃で乾燥したサンプル(予備加熱マニホールド内)。
- サンプルが完全に乾燥しているときは、室温で20分間サンプルを真空乾燥:、(そのようなFoodSaverから販売されているような)プラスチックの真空槽内に配置したサンプルを真空蓋を閉じて、「真空、「接続に真空ダイヤルを設定しますバキュームホース、真空をオンにします。真空を分解するために、これらの手順を逆にします。完全真空蓋を開こうとする前に解凍するために、システムのを待ちます。
- 還元工程を完了する日に残りの十分な時間がない場合は、ここで手順を一時停止します。 -80℃で一時的に( すなわち 、一晩)店のサンプル。 -80°Cの冷凍庫からサンプルを削除し、保存後の手順を続行し、そしてそれらをuncappin前に完全に温めるためにできるようにするにはグラム。
- (貯蔵後、またはウォーム)、真空乾燥するサンプルを待っている間、次のステップのための試薬を準備します。入手して、各サンプルの数(キャップ付き)シラン化された円錐形の底オートサンプラー(AS)バイアル。また、予備加熱浅いウェルASバイアル加熱ブロックとガラス管の内容物が50℃の温度に達するようにディープウェルガラス管ブロックの両方。
4.アセチル化(ドラフトチャンバー内で実行されます)
- 各サンプルに脱イオン水を18μlを添加します。徹底的にキャップと完全に任意の沈殿物を溶解するためにすべてのチューブをボルテックス。
- 各ガラス管に250μlの無水酢酸を追加します。キャップ、徹底的にボルテックスし、任意の残留物および沈殿物の完全な溶解を確実にするために2分間水浴中で超音波処理。
- アルミ箔とガラス管を覆い、そして10分間50℃の内部温度でインキュベートします。
- 各サンプルに230μlの集中トリフルオロ酢酸(TFA)を追加します。すぐにキャップサンプルをミックスdは。その後、アルミ箔10分間50℃の内部温度でのサンプルで覆わインキュベートします。
- インキュベーション後、各試料1.8 mlのジクロロメタン(CH 2 Cl 2)を加えます。キャップとよく混ぜます。
- 各サンプルに脱イオン水2.0ミリリットルを追加します。キャップとよくミックスサンプル。層を分離するために0から3000×gで遠心分離します。水の汚染を回避、ステップ1.4.6に概説されるように液体/液体抽出を実行するために、非シラン化パスツールピペットを使用してください。
- 2回の抽出の合計、もう一度抽出を繰り返します。ラベルされた(ASラックにしっかりと保持)バイアルAS シラン化に有機層を転送するためにシラン化パスツールピペットを使用してください。すぐ下縁までASバイアルを記入してください。
- 窒素ガス下で40℃で15分間乾燥試料(ASバイアル中)に予熱した、浅いウェル加熱ブロックを使用してください。過乾燥させないでください。最終製品は、部分的にメチル化アルジトールアセテート(PMAAs)として知られています。
5.ガスクロマトグラフィー - 質量分析(GC-MS)
- アセトン100μlの各サンプルを再構成し、よく混ぜます。 GCスプリットモード(280℃に維持し、シラン化ガラスウールの小さなプラグを含む)ライナーにスプリットモードでの各試料の1μLを注入するためにオートサンプラを使用します。 0.25ミリメートルのIDと0.25ミクロンの膜厚で30メートルDB-5msのGCカラムを通して0.8ml /分で定流量モードでキャリアガスとして40を使用し、ヘリウムの分割比を使用してください。
- 0.5分間、165℃で初期GCオーブン温度を保持します。プログラムは、オーブン(10分かかります)10℃/分の速度で165℃から265℃まで、それぞれの実行のために、温度を上昇し、その後すぐに温度をランプ265°Cには、初期ホールド時間に続いて(2分かかります)30℃/分の速度で325°Cとに3分間325℃に温度を維持します。サンプルあたりの総実行時間は15.5分です。
- プロを使用してくださいperly同調及び(EI、250℃で70 eV)でイオン化を電子するGCカラムから溶出するサンプル成分を供するために、質量分析計を較正。 TOF質量分析器の場合は、0.1秒のパルス総和レートでのm / z 800にのm / z 40からの断片を分析します。 2.5分のEIフィラメント溶剤の遅延時間を設定します。
6.データ解析
- TOF質量分析計を使用する場合、抽出されたイオンクロマトグラムを得るために0.15ダの質量ウィンドウを適用することによって、各PMAAための最も豊富なおよび/または診断フラグメントイオンを合計します。各PMAAのための標的イオンは、他の場所で公開されている、33が、以下の変更が行われていますトン-Glcのイオンは今、145.1 + 205.1です。 2マンイオンは、161.1 + 189.1です。 3-ギャルイオンは161.1 + 233.1であり、6-ギャルイオンは+ 233.1 161.1 + 189.1です。 2,6-マンイオンは189.1です。 3,6-マンイオンは、189.1 + 233.1です。
- 自動的イオンクロマトグラムを抽出加算ごとにピーク面積を統合するQuanLynxまたは他のソフトウェアを使用してください。
- は手動で各集積抽出イオンクロマトグラムを表示することにより、積分結果を確認します。そして、すべてのヘキソースXICの面積の合計によって、各個別のヘキソースXICの領域を分割伴うさらなる分析やデータの正規化のためのスプレッドシートにピーク積分データをエクスポートします。同様に、各個々のHexNAc XICの面積を全てのHexNAc XICの面積の合計で割ます。この手順では、個々のヘキソースとのHexNAcのための正規化された存在量を生成します。
結果
相対的な2つの重要な過メチル化のステップが正しく実行された場合に成功した過メチル化、加水分解、還元、およびヒト血漿サンプルのアセチル化を示す全イオン電流クロマトグラム(TIC)は、 図3に示されています。
ヘキソースへのHexNAcの相対の絶対収量 :
N -acetylhexosamine(のHexNAc)部分メチル化アルジトールアセテート(PMAAs)はヘキソースよりも低い利回りを有する傾向がある。43ヘキソースへのHexNAcの相対的な絶対的な収量を推定するために、N個の -acetyllactosamineの6の10μgのサンプル(Gal1-4GlcNAc二糖)で10μlの水を分析しました。末端ガラクトース(T-GAL)および4-GlcNAcのためのTICピーク面積を積分しました。 T-galおよび4-GlcNAcの総量に対して4-GlcNAcの相対的な割合は、11.3±0.7%でした(SEM)。 HexNAc収量(下記参照)、再現可能であるが、この値は、0.5の理論値よりもはるかに少ないという事実は、のHexNAcの収率はヘキソースよりも基本的に低いことを示しています。 (Nの -acetyllactosamineが1であるためのHexNAc理論収量は0.5:1であるヘキソース-のHexNAc二糖)
内およびアッセイ間再現性 :
内および総ヘキソースまたはのHexNAc信号の少なくとも1%を占め、すべてのグリカンのノードのアッセイ間再現性を表1に提供されている。これらのデータは、EDTA血漿の同じストックを使用して、3つの別々の日に3つの別々のアナリストによって取得しました。ヒト血漿中の18の最も豊富なグリカンのノードに対して、この最適化されたプロトコルの下でオートサンプラの安定性データ( すなわち 、総ヘキソースまたはのHexNAc信号の> 1%のもの)は、図4に設けられています。
その他の注目すべき観察 :
過メチル化方法を最適化しながら、我々はアセトニトリルで洗浄開始前のNaOHビーズによる水の吸着を防止する必要がないことを見出しました。また、TFAなしで無水酢酸と加熱の短い期間との組み合わせで、最終的なアセチル化工程の間に少量の水の存在は完全な反応を促進するのに役立つことがわかりました。最後に、飛行時間型(TOF)質量分析の高い分解能が成功したグリカンノード分析のために必要ではない:GC-TOF-MSと従来の伝送四重極のサンプルの同じ組の平行な注入に基づく初期結果ベースのGC-MSは、選択イオンモニタリング(SIM)モードで動作する最終正規化ヘキソースとのHexNAc相対存在量の点で類似した結果を示します。
er.within-ページ= "1"> 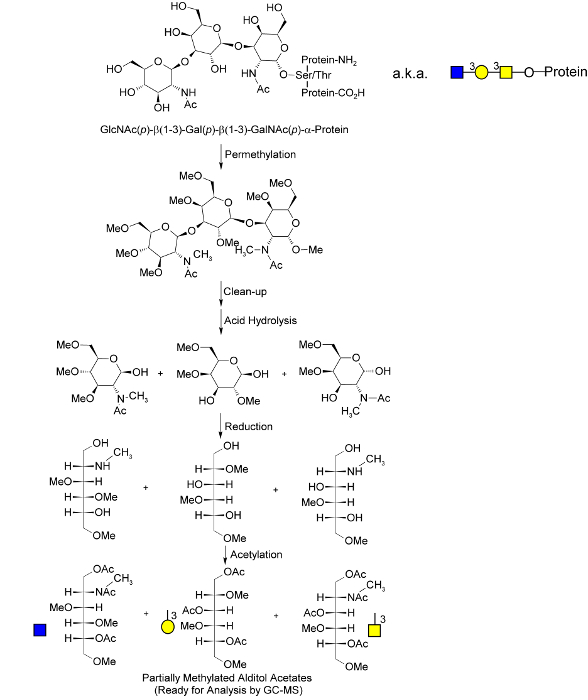
グローバルグリカンメチル化分析手順の図1分子概要アンOはグリカンが-結合が示されています。これらはゲッツから適応された過メチル化のプロセス、の間に放出されている。40過メチル化及び加水分解後、単糖が低減され、発生期の水酸基がアセチル化により「マークされました」。最後の部分メチル化アルジトールアセテート中のメチル化やアセチル化のユニークなパターン(PMAAs)は、元の無傷のポリマー中のユニークな「グリカンノード」に対応し、GC-MSによる分離および定量化のための分子基盤を提供します。Nは -結合や糖脂質グリカン酸加水分解中にリンケージマーク付き単糖類としてリリースされています。許可を得てボルヘスら 33から適応。>この図の拡大版をご覧になるにはこちらをクリックしてください。

図2の分析概念の概念的概要上方制御グリコシルトランスフェラーゼ( 例えば 、のGnT-V)は、特定の一意結合グリカン単糖残基(この例では、2,6-結合マンノース「ノード」)の量の増加を引き起こします-which、他のグリコシルトランスフェラーゼのその後の作用を介して、検出し、日常的な方法で定量化することが困難な場合があり、それぞれ、その全てが低コピー数で異種の全グリカン構造の混合物の形成につながることができます。分析的にはすべての異常なグリカン構造の中から一緒に「グリカンノード」をプーリングすることは、任意の単一の無傷のグリカンよりのGnT-V活性のより直接的な代理測定を提供します。 Nの同時測定- 、O - 、および脂質に連結された」glyc全体の生物試料中のノード「ここに記載されているように(と、もともと他の場所33)は、癌などのグリカン-情動疾患を検出し、監視することにより、概念的小説手段を表している。10マイクロリットルの血漿サンプルから実際の抽出イオンクロマトグラムを示す。に隣接する数字グリカン構造における単糖残基が高い残基が低い残基に連結されている位置を示している。リンケージの位置はクロマトグラムの注釈で示されていない場合残基のいずれかの端末の位置に、または溶液( 例えば、グルコース)で無料。すべての残基でありますそれらの1位を介して下方シアル酸リンクを除いて、その2位を介して下方シアル酸リンククロマトグラムに分割抽出イオンクロマトグラムの変化を示している:ヘキソース残基であり、m / zの116 + Nのための158のためのm / z 117 129を- 。アセチルヘキソサミン(のHexNAc)残基。許可を得てボルヘスら 33から適応。61 / 53961fig2highres.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図3.代表的な結果。サンプルが正しく処理されたA)に同じヒト血液EDTA血漿サンプルのグリカンノード分析のための総イオン電流クロマトグラム(TICを)、B)のNaOHを通して紡糸した過メチル化溶液中の白色残渣カラムは、液体/液体抽出のための後続の混合物中に実施し、C)のNaOHカラムを通して紡糸した過メチル化溶液は、リン酸緩衝液に添加したが、液体/液体抽出のクロロホルムを添加する前に完全に混合しません。 図2に設けられた伝説。 時間をクリックしてくださいこの図の拡大版を表示するには、ERE。

図4.オートサンプラの安定性は、ヒト血漿中で18最も豊富なグリカンのノードに対して48時間にわたって安定性をオートサンプラ。 22時間でサンプルが完全に乾燥し、120μlのアセトン中で再構成しました。データポイントの各クラスタは、同じサンプルの4つの連続注射を表します。黒い線は、各グリカンノードの平均正規化した値の±15%を包含する。 この図の拡大版をご覧になるにはこちらをクリックしてください。

表1内およびアッセイ間再現。値は、総ヘキソースまたは総HexNの%のCVを表します交流-正規化された個々のグリカンのノードは合計ヘキソースまたはのHexNAc信号の少なくとも1%を寄付すべてのグリカンのノードが一覧表示されます。データは、EDTA血漿の同じ株式を使用して、3つの別々の日に3つの別々のアナリストによって取得しました。バッチあたりN = 6のサンプル。 Excelのスプレッドシートとしてこの表をダウンロードするにはこちらをクリックしてください。
ディスカッション
一般的には、ヘキソースから部分的にメチル化アルジトールアセテート(PMAAs)の成功した生産が少ないの困難をはらんでいるとN -acetylhexosamine(のHexNAc)PMAAsの成功の生産よりも堅牢です。それは、この手順のすべての段階で演じているように、この現象の背後にある正確なメカニズムは不明であるが、ヘキソースへのHexNAcの相対的に一意である(という水酸基以外)N -アセチル基のユニークな化学的性質に関係する必要があります。それは酸加水分解に関連するこの現象の背後にあるメカニズムは、要するに他の場所。43について説明したが、N個の -methylacetamidoを積極的酸加水分解中に充電になるための能力は、酸加水分解に耐性のグリコシド結合を作ります。 Nの -acetyllactosamineの分析のために上述したように、これはヘキソースへのHexNAcの相対低収率(合計のHexNAc +ヘキソース信号の11.3%ではなく、全体の50%)を説明します。注目すべきことに、この比較的LHexNAcのowerの収量は、複雑な生体液および組織に検出することは、それらを困難にする、または大規模で複雑 なグリカン( 例えば 、2,4-マン、2,6-マン、3,4,6-由来グリカンのノードを容易に検出することを妨げるものではありませんスパイダーマン、および3,4- GlcNAcを、 図2)。33グリカンのノードのXICのピーク面積は限り各個人のHexNAcの相対収率は(他のHexNAcに一貫した相対ままとして、)(ステップ6.3正規化された方法を考えますそれは、異なるサンプル間で異なるのHexNAcの相対量で) 表1を参照のない、有用な情報を得ることができます。これは、同様にヘキソースにも当てはまります。継続的にすべてのバッチでQCサンプル(複数可)の取り込みを介して監視されている現象を-また、我々は以前のHexNAcにヘキソースの比率が同様に33一貫性の定量的な挙動を示すことが示されています。
過メチル化が実行される方法は、上に最大の影響を有しますHexNAc PMAAsの全体の収率及び再現。具体的には、細心の注意が完全にアルカリ性の水性条件に過メチル化グリカンの露出を避けるために注意すべきです。この点で二つの重要なステップが1である)((ステップ1.3.13および1.3.14)の背後にあるスピン・スルー・ソリューションのすべての白色沈殿物を残して、彼らはリン酸緩衝液に添加された後2)すぐにスピンスルー溶液を混合1.3.13および1.3.14)をステップ。バッファではなく単純な塩溶液は、この段階では、水溶液の不注意なアルカリ化を防ぐために、後続の液体/液体抽出工程のために含まれています。我々は、メチル化のアルカリ条件下でのアセチル基と思われるとのHexNAcの2-アミノ基をクロロホルムに関連したグリカンの全体の抽出効率が低下するより極性の第二級アミンを生じ、加水分解を受けることができるアセチル化。
失敗した完全メチル化のHexNAcの最も容易に認識機能があります4-結合のGlcNAc(4-GlcNAcを)6-Galを、3,6-マンのものとクロマトグラフィーピークの相対強度、および最終列ベークアウト( 図3)中にバックグラウンドのベースライン強度。 4-GlcNAcのPMAAの絶対豊富が低い場合には、他のすべてのHexNAcを基準に、その正規化された存在量はまた、3,4-GlcNAcの同時増加(最も顕著)で、低下する傾向にあります。
全体の収率およびアッセイ堅牢性を最適化するように設計されたいくつかの変更は、私たちの最初の出版物は、この分析的アプローチを説明以降に行われてきたこれらの変化の33つが統合され、抽出イオンクロマトグラム(XICs)は正規化された方法である:。簡単のため、我々は今、すべてのヘキソースXICの面積の合計によって、各個別のヘキソースXICの領域を分割します。同様に、各個々のHexNAc XICの面積を全てのHexNAc XICの面積の合計で割ます。 表1、全体的なアッセイ間/インターアナリストreproducibilに見られるようにそれぞれのヘキソースまたはのHexNAc信号を平均13%のCVの> 1%に貢献し、すべてのグリカンのノードの性。
我々の知る限り、これはグリカンが最初に分解され、その後、それらの成分は、グリカンの組成物の定量的なサンプル全体の肖像画を構築するために分析された真のボトムアップグライコミクスの唯一の化身です。ここでは、代わりに伝統的な酵素の放出を、過メチル化プロセスは、非還元的排除(リリース)Oそれぞれのタンパク質、Nは -結合しながら、40グリカンを酸加水分解の間に放出されている。33を従来のトップダウングライコミクスと相補的なアプローチとしての結合型グリカン、このアプローチは、単一の分析信号(参照、4,6- GlcNAcの中に「分岐ベータ1-6 ""コアフコシル化」、「6 - シアル化」、「バイセクティングGlcNAc」、とのような関心のユニークなグリカンの機能をプールすることができ、 、 図2の6-Galを、3,4,6-男と2,6-マンノード、respectively)。伝統的なトップダウンのアプローチでは、最終的には1または2のキーのグリコシルトランスフェラーゼ33のユニークな活動に依存してこのような機能は、一般的に無傷のグリカンの数十に分散され、時には( 例えば 、3 -シアル化対を解決することは困難または不可能であることができますいくつかの無傷のグリカンの質量の縮重に起因6シアル化)。また、ここで紹介するボトムアップアプローチは、非侵襲的に肺癌を検出する際に、最初の約束を実証してきました。33さらなる研究は、これらの最初の発見だけでなく、他の形態のがんの検出に関連する追加の、まだ未発表の結果を検証するために進行中です。
ここで説明する手法の最大の制限は、それが予め単離された糖タンパク質に適用されるならば、それは、検出の限界の点で制約されることです。キャリアタンパク質、定量FOの制限なしに、個々のグリカン標準の未発表の分析に基づいてrの個々のグリカンは、低マイクログラムの範囲にあるように見えます。これらは、何によって絶対的に低いLOQsがないことを意味しているが、この事実は、アッセイ-用に設計されていなかったの元々意図された範囲に関しては問題ではない、ここでは説明の目的のために、少なくとも低LOQsを達成する必要が(持っていないと私たちの以前の出版物33)インチ実際には、ヒト血漿/血清は血漿/血清の分析のために、我々は唯一の最終サンプル体積の〜100 分の1 を注入し、41部のうち40を分割することmg / mlでの濃度範囲-意味の10Sにおける糖タンパク質が含まれていますGCインジェクタポートに無駄にすること少量。このような行為がなければ、グリカンノードの一部は、検出器を飽和することができます。従来のトップダウンMALDI-MSまたはLC-MSベースのアプローチによって、適切な無傷のグリカンシグナルを生成することができる糖タンパク質のピコモル量は、このアプローチを用いて検出することはできません。方法論のさらなる改良は、この制限を解消するために進行中です。
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by the College of Liberal Arts and Sciences of Arizona State University in the form of laboratory startup funds to CRB. It was also supported by a grant from Flinn Foundation (Grant No. 1977) and by the National Cancer Institute of the National Institutes of Health under Award Number R33CA191110. JA was supported by the National Institute of General Medical Sciences of the National Institutes of Health Postbaccalalureate Research Education Program (PREP) under award number R25GM071798. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
資料
| Name | Company | Catalog Number | Comments |
| Sodium hydroxide beads | 367176 | Sigma-Aldrich | 20-40 mesh, reagent grade 97% |
| 0.9 ml Spin column | 69705 | Pierce division of ThermoFisher Scientific | Includes plugs and polyethylene frits |
| GC-MS autosampler vial (silanized)* | C4000-9 | ThermoFisher Scientific | Target DP High Recovery Vial, 1.5 ml, 12 mm x 32 mm, includes Teflon-lined pierceable caps |
| 1.5 ml polypropylene test tubes | 05-402-25 | ThermoFisher Scientific | Snap-cap lid |
| 2 ml polypropylene test tubes | 05-408-138 | ThermoFisher Scientific | Snap-cap lid |
| Dimethyl Sulfoxide (DMSO) | D8418 | Sigma-Aldrich | BioReagent for molecular biology, reagent grade >99.0% |
| Iodomethane | I8507 | Sigma-Aldrich | Contains copper as stabilizer, ReagentPlus 99% |
| Acetonitrile | A955-4 | ThermoFisher Scientific | Optima LC/MS |
| Microcentrifuge | 75002436: Sorvall Legend Micro 17 Centrifuge | ThermoFisher Scientific | 24 x 1.5/2.0 rotor with ClickSeal biocontainment lid. Rotor catalog number: 75003424 |
| 13 x 100 glass test tube (silanized)* | 53283-800 | VWR | 13 mm x 100 mm borosilicate glass test tubes with screw-cap finish |
| Caps for glass test tubes | 14-930-15D | ThermoFisher Scientific | Kimble™ Black Phenolic Screw Caps; 13 mm-415 GPI thread; PTFE-faced rubber liner. |
| Sodium chloride | S7653 | Sigma-Aldrich | >99.5% pure |
| Chloroform | 4440-08 | Macron Fine Chemicals | |
| Trifluoroacetic acid | 299537 | Sigma-Aldrich | 99% purified by redistillation for protein sequencing |
| Sodium borohydride | 71321 | Fluka Analytical | 99% |
| Ammonium hydroxide solution | 320145 | Sigma-Aldrich | NH3 content: 28.0-30.0% |
| Methanol | AH230-4 | Honeywell Burdick & Jackson | HPLC grade |
| Acetic acid | 320099 | Sigma-Aldrich | 99.70% |
| Plastic vacuum desiccator | Any model of adequate size | FoodSaver | |
| Acetic anhydride | 539996 | Sigma-Aldrich | 99.50% |
| Dichloromethane | D143SK-4 | ThermoFisher Scientific | Stabilized HPLC grade |
| Acetone | 9006-03 | J.T.Baker | Baker Analyzed |
| Heated evaporation manifold (main unit) | pi18823 | ThermoFisher Scientific | Thermo Scientific* Reacti-Therm* Heating and Stirring Module; Triple-block Model with Heating and Stirring Function |
| Heated evaporation manifold (overhead evaporator) | pi18826 | ThermoFisher Scientific | ThermoScientific* Reacti-Vap Evaporator, 27-port; For use with triple-block Reacti-Therm heating module |
| Aluminum sample-holder blocks for evaporation manifold | pi18816 | ThermoFisher Scientific | Block, Aluminum, Reacti-Block S-1, Holds 13 mm dia test tubes, 13 holes (14 mm dia. x 45 mm deep) |
| Gas chromatograph | Model A7890 | Agilent | Equipped with CTC PAL autosampler |
| Mass spectrometer | GCT Premier (Time-of-Flight) | Waters | |
| Split-mode liner (deactivated / silanized) | 5183-4647 | Agilent | Containing a small plug of silanized glass wool |
| DB-5ms GC column | 122-5532 | Agilent | 30 m x 0.25 mm ID x 0.25 micron film thickness |
| Chlorotrimethylsilane | 95541 | Sigma-Aldrich | |
| Glass vacuum desiccator (for glassware silanization) | EW-06536-30 | Cole-Parmer | 12" wide; 230 mm plate size |
| *Glassware silanization is carried out in-house, overnight using chlorotrimethylsilane vapor in a large glass vacuum desiccator. | |||
参考文献
- Li, M., Song, L., Qin, X. Glycan changes: cancer metastasis and anti-cancer vaccines. J Biosciences. 35 (4), 665-673 (2010).
- Stanley, P., Schachter, H., Taniguchi, N., Varki, A., et al. . Essentials of Glycobiology. , Ch. 8: N-Glycans (2009).
- Apweiler, R., Hermjakob, H., Sharon, N. On the frequency of protein glycosylation, as deduced from analysis of the SWISS-PROT database. Biochim Biophys Acta. 1473 (1), 4-8 (1999).
- Brockhausen, I., Schachter, H., Stanley, P., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Rini, J., Esko, J., Varki, A., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Gercel-Taylor, C., Bazzett, L. B., Taylor, D. D. Presence of aberrant tumor-reactive immunoglobulins in the circulation of patients with ovarian cancer. Gynecol Oncol. 81 (1), 71-76 (2001).
- An, H. J., et al. Profiling of glycans in serum for the discovery of potential biomarkers for ovarian cancer. J Proteome Res. 5 (7), 1626-1635 (2006).
- Kanoh, Y., et al. Changes in serum IgG oligosaccharide chains with prostate cancer progression. Anticancer Res. 24 (5B), 3135-3139 (2004).
- Kyselova, Z., et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res. 6 (5), 1822-1832 (2007).
- Okuyama, N., et al. Fucosylated haptoglobin is a novel marker for pancreatic cancer: a detailed analysis of the oligosaccharide structure and a possible mechanism for fucosylation. Int J Cancer. 118 (11), 2803-2808 (2006).
- Zhao, J., et al. Glycoprotein microarrays with multi-lectin detection: unique lectin binding patterns as a tool for classifying normal, chronic pancreatitis and pancreatic cancer sera. J Proteome Res. 6 (5), 1864-1874 (2007).
- Comunale, M. A., et al. Proteomic analysis of serum associated fucosylated glycoproteins in the development of primary hepatocellular carcinoma. J Proteome Res. 5 (2), 308-315 (2006).
- Goldman, R., et al. Detection of Hepatocellular Carcinoma Using Glycomic Analysis. Clin Cancer Res. 15 (5), 1808-1813 (2009).
- Aurer, I., et al. Aberrant glycosylation of Igg heavy chain in multiple myeloma. Coll Antropol. 31 (1), 247-251 (2007).
- Abd Hamid, U. M., et al. A strategy to reveal potential glycan markers from serum glycoproteins associated with breast cancer progression. Glycobiology. 18 (12), 1105-1118 (2008).
- Kyselova, Z., et al. Breast cancer diagnosis and prognosis through quantitative measurements of serum glycan profiles. Clin Chem. 54 (7), 1166-1175 (2008).
- Hongsachart, P., et al. Glycoproteomic analysis of WGA-bound glycoprotein biomarkers in sera from patients with lung adenocarcinoma. Electrophoresis. 30 (7), 1206-1220 (2009).
- Arnold, J. N., et al. Novel glycan biomarkers for the detection of lung cancer. J Proteome Res. 10 (4), 1755-1764 (2011).
- Bones, J., Mittermayr, S., O'Donoghue, N., Guttman, A., Rudd, P. M. Ultra performance liquid chromatographic profiling of serum N-glycans for fast and efficient identification of cancer associated alterations in glycosylation. Anal Chem. 82 (24), 10208-10215 (2010).
- Kodar, K., Stadlmann, J., Klaamas, K., Sergeyev, B., Kurtenkov, O. Immunoglobulin G Fc N-glycan profiling in patients with gastric cancer by LC-ESI-MS: relation to tumor progression and survival. Glycoconj J. 29 (1), 57-66 (2012).
- Chen, G., et al. Human IgG Fc-glycosylation profiling reveals associations with age, sex, female sex hormones and thyroid cancer. J Proteomics. 75 (10), 2824-2834 (2012).
- Takeda, Y., et al. Fucosylated haptoglobin is a novel type of cancer biomarker linked to the prognosis after an operation in colorectal cancer. Cancer. 118 (12), 3036-3043 (2012).
- Parekh, R. B., et al. Association of rheumatoid arthritis and primary osteoarthritis with changes in the glycosylation pattern of total serum IgG. Nature. 316 (6027), 452-457 (1985).
- Mehta, A. S., et al. Increased levels of galactose-deficient anti-Gal immunoglobulin G in the sera of hepatitis C virus-infected individuals with fibrosis and cirrhosis. J Virol. 82 (3), 1259-1270 (2008).
- Horvat, T., Zoldoš, V., Lauc, G. Evolutional and clinical implications of the epigenetic regulation of protein glycosylation. Clinical Epigenetics. 2 (2), 425-432 (2011).
- Zoldoš, V., Novokmet, M., Bečeheli, I., Lauc, G. Genomics and epigenomics of the human glycome. Glycoconj J. 30 (1), 41-50 (2013).
- Lowe, J. B., Marth, J. D. A genetic approach to Mammalian glycan function. Annu Rev Biochem. 72, 643-691 (2003).
- Tuccillo, F. M., et al. Aberrant Glycosylation as Biomarker for Cancer: Focus on CD43. Biomed Res Int. , (2014).
- Varki, A., Kannagi, R., Toole, B., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Brockhausen, I. Mucin-type O-glycans in human colon and breast cancer: glycodynamics and functions. EMBO reports. 7 (6), 599-604 (2006).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Bertozzi, C. R., Sasisekharan, R., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Borges, C. R., Rehder, D. S., Boffetta, P. Multiplexed surrogate analysis of glycotransferase activity in whole biospecimens. Anal Chem. 85 (5), 2927-2936 (2013).
- Mcinnes, A. G., Ball, D. H., Cooper, F. P., Bishop, C. T. Separation of Carbohydrate Derivatives by Gas-Liquid Partition Chromatography. J Chromatogr. 1 (6), 556-557 (1958).
- Ciucanu, I., Caprita, R. Per-O-methylation of neutral carbohydrates directly from aqueous samples for gas chromatography and mass spectrometry analysis. Anal Chim Acta. 585 (1), 81-85 (2007).
- Ciucanu, I., Kerek, F. A simple and rapid method for the permethylation of carbohydrates. Carbohydr Res. 131, 209-217 (1984).
- Kang, P., Mechref, Y., Klouckova, I., Novotny, M. V. Solid-phase permethylation of glycans for mass spectrometric analysis. Rapid Commun Mass Sp. 19 (23), 3421-3428 (2005).
- Kang, P., Mechref, Y., Novotny, M. V. High-throughput solid-phase permethylation of glycans prior to mass spectrometry. Rapid Commun Mass Sp. 22 (5), 721-734 (2008).
- Goetz, J. A., Mechref, Y., Kang, P., Jeng, M. H., Novotny, M. V. Glycomic profiling of invasive and non-invasive breast cancer cells. Glycoconj J. 26 (2), 117-131 (2009).
- Goetz, J. A., Novotny, M. V., Mechref, Y. Enzymatic/chemical release of O-glycans allowing MS analysis at high sensitivity. Anal Chem. 81 (23), 9546-9552 (2009).
- Mulloy, B., Hart, G. W., Stanley, P., Varki, A., et al. . Essentials of Glycobiology. , (2009).
- Seed, B. Silanizing glassware. Curr Protoc Immunol. 21, A.3K.1-A.3K.2 (1997).
- Stellner, K., Saito, H., Hakomori, S. I. Determination of aminosugar linkages in glycolipids by methylation. Aminosugar linkages of ceramide pentasaccharides of rabbit erythrocytes and of Forssman antigen. Arch Biochem Biophys. 155 (2), 464-472 (1973).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved