Method Article
聚糖节点分析:自下而上的方法,以糖原组学
摘要
This article presents an enhanced form of a novel bottom-up glycomics technique designed to analyze the pooled compositional profile of glycans in unfractionated biofluids through the chemical breakdown of glycans into their constituent linkage-specific monosaccharides for detection by GC-MS. Potential applications include early detection of cancer and other glycan-affective disorders.
摘要
Synthesized in a non-template-driven process by enzymes called glycosyltransferases, glycans are key players in various significant intra- and extracellular events. Many pathological conditions, notably cancer, affect gene expression, which can in turn deregulate the relative abundance and activity levels of glycoside hydrolase and glycosyltransferase enzymes. Unique aberrant whole glycans resulting from deregulated glycosyltransferase(s) are often present in trace quantities within complex biofluids, making their detection difficult and sometimes stochastic. However, with proper sample preparation, one of the oldest forms of mass spectrometry (gas chromatography-mass spectrometry, GC-MS) can routinely detect the collection of branch-point and linkage-specific monosaccharides ("glycan nodes") present in complex biofluids. Complementary to traditional top-down glycomics techniques, the approach discussed herein involves the collection and condensation of each constituent glycan node in a sample into a single independent analytical signal, which provides detailed structural and quantitative information about changes to the glycome as a whole and reveals potentially deregulated glycosyltransferases. Improvements to the permethylation and subsequent liquid/liquid extraction stages provided herein enhance reproducibility and overall yield by facilitating minimal exposure of permethylated glycans to alkaline aqueous conditions. Modifications to the acetylation stage further increase the extent of reaction and overall yield. Despite their reproducibility, the overall yields of N-acetylhexosamine (HexNAc) partially permethylated alditol acetates (PMAAs) are shown to be inherently lower than their expected theoretical value relative to hexose PMAAs. Calculating the ratio of the area under the extracted ion chromatogram (XIC) for each individual hexose PMAA (or HexNAc PMAA) to the sum of such XIC areas for all hexoses (or HexNAcs) provides a new normalization method that facilitates relative quantification of individual glycan nodes in a sample. Although presently constrained in terms of its absolute limits of detection, this method expedites the analysis of clinical biofluids and shows considerable promise as a complementary approach to traditional top-down glycomics.
引言
糖脂,糖蛋白,蛋白聚糖,和葡糖胺聚糖构成统称为聚糖复杂的异构碳水化合物的四个主要类。如质膜,多糖包被和细胞外基质和流体的普遍存在和积分分量,聚糖参加等不同生化过程如细胞内吞作用,细胞内运输,细胞运动性,信号转导,分子识别,受体活化,细胞粘附,宿主 - 病原体相互作用,细胞间通讯,免疫监视和免疫反应的启动。1几乎存在于各个领域的生活,被称为糖基转移酶的建立聚糖的聚合物的酶与糖苷水解酶(又称糖苷酶,它分解聚糖)建造,改造串联行动,最终产生敲定聚糖聚合物2。虽然每个糖基转移酶可以在不同的糖结合物进行操作,糖基转移酶通常由特定激活核苷酸的糖供体( 例如,GDP-岩藻糖)的单糖部分转移到亲核受体的某一类别( 例如,脂质,多肽,核酸,或生长伪造linkage-和端基异构体特异性糖苷键低聚糖)。据估计,蛋白质(尤其是膜和分泌蛋白)的50%以上是在翻译后糖基化修饰的3-初步组合计算提供了相当大的变异性,多功能性和特异性给予通过糖基化的糖蛋白的欣赏。例如,如果一个多肽基片具有仅10的糖基化位点和每个站点可以与只有3种不同的单糖还原末端的1糖苷键,那么,从理论上说,最后的糖蛋白可以假定3 10 = 59049不同身份。在糖蛋白糖苷键通常与侧链氮Ø形成序列的Asn-X-丝氨酸f中的天冬酰胺残基/苏氨酸(X可以是除脯氨酸外的任何氨基酸),得到N- -glycans 2和侧链羟基丝氨酸和苏氨酸残基,以得到õ-glycans 4。一个细胞的糖组的组成(即它的糖基化产物补码)是唯一的,有限的,因为,除了少数例外,糖基转移酶表现出严格的供体,受体和联动特异性。5重要和丰富的血浆糖蛋白遭受异常的糖基化作为下游的后果异常糖基转移酶表达和活性的由于许多病理情况下,尤其是癌症和炎性疾病。6-24
主要是由于后生因素的影响,糖组是显著更加多样化,动态和复杂的比蛋白质组和转录组25,26虽然哺乳动物基因组的约1%的编码形成,修改和聚糖的组装,在一个非模板驱动方式-一个明显的对比27的糖基化进行到多肽和核酸的生物合成。糖基化酶和诸如环境因素如营养物和前体的可用性的相对数量和活性之间的相互影响,最终决定的性质,速率,和糖基化的程度。5,28胚胎发生( 例如,测定和分化),细胞活化,和进展通过细胞周期的影响的基因表达( 即,转录和翻译),并改变提供糖基转移酶的特性和量,其活性是细胞的聚糖谱的直接上游的决定因素。因为(部分的)的增殖,粘合剂,和癌细胞的侵入性质类似于那些普通胚发生细胞中,聚糖的生物合成途径( 例如,前体积累,失调的表达,aberran具体变化的吨修改,结构截短,或新颖的形成)作为普遍的癌症生物标志物指示的肿瘤形成,进展,迁移和侵袭29各个阶段虽然糖基化是高度复杂的,显然仅在糖基化几改变可以使发生和转移。显然,某些"异常"糖基化产物的确使他们逃避免疫识别和生存在恶劣的血管和转移性环境迁移的需求,有利于癌细胞。28,30,31毫不奇怪,实验表明,破坏或阻止的模式改变基因表达和异常聚糖形成可阻止肿瘤的发生。29尽管如此,生物流体样本( 例如,尿液,唾液,和血浆或血清)中检测出的异常聚糖可能不是癌症直接指标(或其它疾病),而是下游的微妙而显著成果在免疫系统或以不可预知的器官有害条件量化后果变化。32
虽然它们提供了关于糖组通用的信息,许多分子基于交互的糖组学技术( 例如,外源凝集素/抗 体阵列和代谢/共价标记)取决于检测整个聚糖结构,并且不提供关于单个聚糖的详细结构信息。形成鲜明对比,质谱(MS)可以帮助识别和量化个别聚糖结构并揭示这种结构的信息作为连接位点到多肽芯。失调的表达或仅一个糖基转移酶的活性可以发起在多个糖基化途径有害分子事件的级联。因为每一个糖基转移酶可能不止一个糖缀合物基板上,并在不同的成长多糖聚合物运作,放松管制的生物合成级联产生disproportionally增加只有一个聚糖产品的量,但几个异构类细胞内或细胞外液异常聚糖。33,然而,这些独特的异常聚糖有时被认为是不切实际的作为生物标志物用于癌症或其它聚糖-情感病症,因为,相对于大池的良好调节聚糖,这些异常聚糖代表一小部分是可能甚至常常由这种高度敏感的技术如质谱仍然检测不到。例如,在细胞内和细胞外体液,广泛蛋白质浓度谱(跨越8个数量级)可以防止由该更丰富的物种掩蔽稀少的糖蛋白的检测。32此外,在确定糖基转移酶活仍然相当实用和理论的挑战,因为许多糖基转移酶在临床生物液体缺席或处于非活动状态体外 。尽管consisten难度TLY检测和定量独具特色的聚糖的超微量,质谱的从业者对用人完好聚糖作为临床指标取得了巨大进步。我们最近开发了一种互补的方法来完整聚糖的分析是,采用GC-MS,便于对所有构成分支点和特定键的单糖("聚糖节点"),它们一起赋予唯一每个聚糖并且在许多的检测案件直接服务的量化有罪糖基转移酶(S)的相对活性分子的代理人。
自从其首次报道于1958年的直接应用到聚糖分析,气相色谱(GC)已经证明一个功能强大的技术来分析每甲基化的单-和二糖,34确定其anomericity和绝对构型,并用于随后的质谱分析将它们分开。35从1984年到2007年,Ciucanu和他的同事引入并精制2005至2008年间所采用氢氧化钠和碘甲烷使用水和氯仿。35,36固相聚糖全甲基技术,接着全甲基聚糖的液/液萃取,康和同事集成了省时的旋-column方式进入全甲基一步。37,38在2008年,戈茨研究小组设计了一个定量的固相全甲基聚糖分析方法采用基质辅助激光解吸电离(MALDI)质谱分析比较和区分潜在的侵入性和非-invasive乳腺癌细胞;然后39,2009年,戈茨团队结合酶和化学释放技术40切割Ø-glycans从完整的糖蛋白在强碱性固相全甲基方案虽然格茨程序同时促进和全甲基化学释放。 Ø-glycans的,它仅适用于预分离的糖蛋白质。我们在2013年修改的这种技术和通过掺入三氟乙酸适于它为整个未分级的生物流体和均质化的组织样本(TFA)水解,还原和乙酰化的步骤。33,这些额外的步骤也释放从糖脂和N-聚糖从糖蛋白-连接的聚糖,并转换他们进入部分甲基化的糖醇乙酸酯(PMAAs, 图1),其独特的甲基化和乙酰化的图案便于通过GC-MS和唯一地分析表征原始完整聚糖聚合物41( 图2)中的构成聚糖节点33最终,这过程产生在复杂的生物流体的所有聚糖的复合肖像基于独特的聚糖的功能,如"核心岩藻糖基","6唾液酸化","平分GlcNAc的",和"beta 1-6支链"直接的,相对定量 - 每个从单个GC-MS chromatograp衍生HIC高峰。本文介绍的全甲基的进一步优化,乙酰化,分离,并用在相对定量的方式改进沿着清理阶段。
研究方案
注意:避免与任何在此实验中使用的试剂的皮肤/眼接触。曝光后,用清水彻底冲洗患处,并立即就医。
1.全甲基和聚糖提取
- 柱的制备
- 获得尽可能多的离心旋转柱单元作为待分析的样品。突破并取下塑料水库管帽。将在每个水库管离心过滤器的迷你。放置组装微量离心柱(包含微型过滤器)在一个离心管架。
- 获得氢氧化钠库存氢氧化钠(NaOH)珠(20-40目)。一些转移到氢氧化钠小称重舟,或者,如果湿气是造成结块,热瓷砂浆氢氧化钠的工作液。避免使用氢氧化钠或粉碎/粉状氢氧化钠珠团块。
注意:氢氧化钠是一种强效毒素和腐蚀性基地。冲洗暴露的皮肤/眼睛用清水15分钟。 Thoroug在完成实验后溶血素清洁工作台。 - 使用小铲子或抹刀,来自工作库存转移氢氧化钠珠来填充用NaOH微量离心微型过滤器到所述第一外斜面(〜帽沿低于5毫米)。塔上的台式收拾/凝结氢氧化钠珠填充离心过滤器。
注意:在本实验中,由吸湿性氢氧化钠珠粒最小化过多的水吸附,保持任何添加的流体的氢氧化钠柱填料的表面上方的水平( 例如,乙腈,二甲亚砜,分析物溶液),并限制与空气直接接触。 - 获得乙腈(ACN)的股票。转移〜350微升ACN每个氢氧化钠包装的离心过滤器的迷你。保持ACN下淹没NaOH和通过用尖卷曲凝胶装载枪头,搅拌除去大的气泡。
注意:乙腈是一种易燃刺激性。 - 离心柱
- 排列对称离心机内离心柱;如果需要使用一个平衡管。避免溢出离心机内的任何氢氧化钠颗粒。关闭离心机盖。
- 离心柱(含NaOH和ACN)为〜15秒2400× 克
- 经离心后,从离心机离心除去列,并丢弃到ACN危险废物的容器。保持氢氧化钠栏目包装完好。
- 添加〜350微升二甲基亚砜(DMSO),以每氢氧化钠填充离心微型过滤器。保持DMSO下淹没NaOH和删除任何大气泡用枪头。正如先前2400×G所述,离心列〜15秒,并丢弃DMSO同时保持氢氧化钠包装完好。
注意:二甲基亚砜是诱变剂和刺激性,并且很容易通过皮肤吸收。 - 堵塞所有离心微型过滤器与包括在旋转过滤器的插头套件。转移〜350微升DMSO中,每个氢氧化钠堆积微量微型过滤器,并使用200μl的移液管尖端以去除在该NaOH填料气泡,以便使DMSO到达然后氢氧化钠包装之内的所有区域。避免破碎或过度刮氢氧化钠珠;氢氧化钠粉末是不希望的。尽可能快地完成这个步骤。
- 等离子质量控制的制备(QC)样品(S)
注意:为了确保在整个实验批次一致的结果,可以考虑使用从感兴趣的生物材料的一个大的,均匀的大容量收集所取的样品中的每一批待分析的至少一个等分试样。例如,如果分析血液血浆,使用血浆作为每批的QC样品(多个)的一个大容量收集的等分试样(多个)。过程QC样品中相同的方式为未知的样品。- 离心机QC等离子在〜10,000×G下4分钟的股票样本。在离心过程中,一些高密度沉淀物可能沉淀为thÈ底部和一些低密度沉淀物漂浮到等离子体的顶部。既避免取出时血浆等份(S)。
- 继续执行下面的"1.3)样品制备"。然后,返回到这一步后,血浆离心完成。
- 撤回9微升离心QC血浆,并将其转移到配备有卡扣关闭帽适当标记的1.5毫升聚丙烯试管(以下简称为"1.5毫升塑料试管")。加入1微升的去离子水至每个等分试样;如果需要,以此作为内标(S)的载体。
- 加入270微升DMSO以这种等离子体控制。涡流以确保完全溶解。
- 样品制备
- 获得尽可能多的1.5毫升的塑料试管生物(分析物)的样本数。
- 转印9微升各生物(分析物)的样品到其相应的1.5毫升的塑料试管。转移1μl的去离子水和270微升DMSO中,每个样品管中。
- 剧烈混合( 例如,涡流和/或反复移液器上下)的样品,以确保在DMSO完全溶解。
注意:执行通风柜内的以下步骤。用在下面的步骤,碘甲烷(CH 3 I),二氯甲烷(CH 2 Cl 2中,又名二氯甲烷)和氯仿( 三氯甲烷,三氯甲烷),能够溶解某些类型的塑料的挥发性液体( 例如,丁腈手套) 。一定要使用耐溶剂的手套。由于它们的低粘度和高的蒸汽压,这些试剂可传送期间从一个枪头滴落。通过保持邻接的接收容器中的储液最小化试剂的损失和潜在的接触。 - 转移碘甲烷的足够总体积小,干净的管中。各分析样品需要105微升碘甲烷。转移〜500微升二氯甲烷到anoth呃干净的试管。为了防止注射器堵塞,冲洗用二氯甲烷注射器碘甲烷传输之后。
注意:碘甲烷是感光,易挥发,并能损害中枢神经系统,或者吸入或摄入引起死亡的效力的毒素。二氯甲烷是一种潜在的致癌物质,生殖诱变剂和强刺激性能够损害多个器官或导致死亡。 - 使用分析注射器105微升碘甲烷添加到每个样品分析。章分析管立即以减少碘甲烷蒸发。彻底涡旋和,如有必要,短暂离心所有样品,以确保没有液体残留在帽。任何颜色变化( 比如,棕色,紫色或黄色)信号碘甲烷降解,这可能危及以下全甲基反应。
- 冲洗用于用二氯甲烷至少3次转移碘甲烷的分析注射器。这将防止它来回米堵塞。处理此冲洗,需要额外的碘甲烷和二氯甲烷成一个有机的危险废物容器一起。将用过的试管置于危险废物的容器。
- 购买一套新的2毫升的塑料储管。如果需要删除管理单元帽。
- 拔下离心迷你过滤器。离心2400×g下15秒,然后拔出列丢弃贮存管与DMSO流出物一起。
- 重新插上离心离心柱,并将其放置在新的水库管内。号每个旋转柱并用相同的样品数与其相应的储液管。确保微型过滤嘴是否严密;潜在的泄漏会影响下一个步骤。最小化从离心柱除去DMSO中,所述分析物的样品转移到离心柱之间的时间。
- 全甲基
- 定量各样品溶液转移到其相应的NaOH珠填充离心自旋共lumn。使用1000微升吸头这一步。下列转让,卷曲〜2mm的200微升尖端的端部并使其保持在该列的内容作为一个搅拌器来使用。重复所有样本。
注:碘甲烷的低粘度会导致样品损失,因为分析物溶液可以从在传送过程中的移液管尖端滴落。容纳样品管,并彼此相邻地旋转柱用一只手,并迅速将其传送用另一只手的样品溶液。 - 允许全甲基反应进行11分钟。在此期间,搅拌各样品的至少4-5倍。为了便于高效全甲基,其发生在氢氧化钠珠的表面,可以使用尖卷曲凝胶加载枪头作为搅拌器轻轻混合列内容。进取混合可刺穿旋转过滤器,粉碎和暂停的NaOH珠粒(其可减少后续液/液萃取的效率),和/或导致样品损失(作为山mple浸泡氢氧化钠颗粒可以从柱中溢出)。
- 在用于随后的液体/液体萃取步骤制备,制备0.5M的氯化钠(NaCl)溶液足量的0.2M磷酸钠缓冲液(pH 7.0),也可以在室温下储存。每个样本将需要液/液萃取的所有三个周期总共〜12毫升NaCl溶液。
- 经11分钟全甲基周期结束后,立即还仔细拔出列和离心它们2400×g下15秒。丢弃插头。
- 定量各样品溶液转移到其相应的NaOH珠填充离心自旋共lumn。使用1000微升吸头这一步。下列转让,卷曲〜2mm的200微升尖端的端部并使其保持在该列的内容作为一个搅拌器来使用。重复所有样本。
- 立即从离心机移除离心柱,将它们放入一组新的空的自旋贮存管,留下含有后面新鲜全甲基聚糖流通溶液。不要丢弃任何东西。
- 只要有可能,加300微升乙腈(ACN)到干,氢氧化钠填充自旋过滤器。离心机旋转过滤器在9,600×g下30秒。
- 立即出现ý此后,转移主全甲基溶液( 即 ,用该NaOH珠11分钟,然后通过旋转过滤器加入300微升乙腈中的前一步骤之前,纺成离心管培养溶液),以硅烷化13×百毫米玻璃试管42含3.5毫升含0.5M氯化钠,pH值7.0立即的0.2M磷酸钠缓冲液并混合(涡流)的。避免在这一步转移任何固体白色残留物。这样做对在进行下一步之前,每个样品。
- 无延迟,转移(结合)乙腈自旋通过在每个储存管(带)在其各自的硅烷化玻璃管中的液体样品的其余部分,并立即混合(涡流)。同样,避免在这一步转移任何固体白色残留物。瓶盖,摇匀,涡流玻璃管。重复每个样品。丢弃在适当的废物容器中的氢氧化钠列和巴氏吸管。
- 液体/液体加ction和聚糖净化
- 内部通风柜,添加1.2毫升氯仿至每个样品。紧接着,帽硅烷化玻璃管和剧烈混合内容。
- 预热金属板至约75℃,在蒸发歧管。使用加热块与可以容纳13毫米×100mm的玻璃管的孔中。
- 购买一套新硅烷化的巴氏吸管,非硅烷化巴斯德吸液管,并与盖硅烷化玻璃试管中。
注意:氯仿( 三氯甲烷 )是一种刺激,诱变剂,和可能的能够通过某些类型的手套的渗透的致癌物。 - 短暂离心(〜3000×g下)含有样品的玻璃管向水层和有机层分离。
- 使用非硅烷化巴斯德吸管,该水层的〜3毫米保持底部有机层上方以提取足够的顶部水层这样的。
- 添加3.5毫升0.5米娜在0.2M磷酸钠缓冲Cl溶液(pH 7)中,以各玻璃管,剧烈混合,短暂离心(〜3000×克)。如在先前步骤(1.4.3),使用非硅烷化巴斯德吸管来提取水层。
- 重复上述步骤(1.4.4),但留下约1毫升水层。
- 使用干净的硅烷化巴斯德吸管向有机层转移到一个干净并适当标记硅烷化13×100mm的玻璃试管中。通过以下列方式提取避免水的污染:
- 同时容纳在一方面彼此相邻的当前和新硅烷化的玻璃试管。用另一只手,按下移液器灯泡产生气泡,同时通过水层插入吸管向下。
- 一旦该有机层内,停止产生气泡,并保持吸管灯泡稳定以允许有机和水层来稳定,并再次分离。然后,慢慢松开灯泡撤出尽可能多的organi的ç层尽可能没有任何水的污染。
- 迅速提高通过将水层枪头,和抗蚀剂的稍微释放灯泡(其导致吸一些水性污染),同时提高移液器出管的自然反射。
- 迅速低粘度有机层转移到相邻的新管中。任何水性污染会像在新玻璃管萃取的有机层的顶部小液滴可见。如果水/氯化钠污染是可见的,用吸管将其删除;如果需要的话,以所述水性液滴汇集成一个单一的液滴离心。
- 正确地处理旧玻璃管,吸管,以及水和有机废物的解决方案。清洗和回收玻璃管帽。
- 干燥在氮气中预热蒸发歧管温和和恒定流的所有样品在75℃下在通风橱内〜5分钟。所有干下来STE期间确保蒸发冷却PS,氮气的轻柔和恒定流量必须扰乱液体表面不飞溅或溅射的液体。从在最后的样品完全干燥蒸发歧管中取出样品。在一干燥的玻璃管的底部白斑表明缓冲器/氯化钠污染。
- 此处暂停程序,如果没有剩余的天足够的时间来完成的TFA水解步骤。暂时( 即过夜)在-20℃的干燥储存样本。要继续程序储存后,从-20℃冰箱取出的样品,让他们脱帽之前完全预热。
- 而样品温暖,在用于三氟乙酸(TFA)水解(下一阶段)制备,设置加热套,使得所述液体试管内容物的温度会达到121℃。从准备TFA股票TFA溶液(见下面的步骤2.1)。
2.三氟乙酸(TFA)水解
注意:将三氟乙酸(TFA)是腐蚀性有机酸和有毒的刺激物。
- 制备在去离子水中的2.0M TFA溶液的足够量。每个分析物的样本将需要325微升的2.0M TFA溶液。集中TFA为13.0 M.
- 添加325微升的2.0M TFA的每个分析物的样品。以防止在随后的干燥步骤(2.3以下)的TFA蒸发和样品损失,紧紧加入TFA后立即帽每个样品管中。标志着全玻璃试管溶液水平。下一步之前彻底涡每个样本。
- 孵育2小时的盖紧样品管在一个合适的预加热的加热块或烘箱这样的内容达到121℃的温度。如果使用加热块,而不是一个烘箱,用铝箔覆盖样品管,以防止TFA的缩合在管和样品残留的部分干燥的在管的底部的顶部。后20-30分钟检查样品溶液的水平。以确保最小的TFA蒸发。如果有必要,进一步收紧帽或更换盖帽为一个紧密的配合。
- 在2小时的等待,用于下一步骤(见下文2.4)设置另一个蒸发歧管至75℃。
- 当2小时加热时间是在75℃下完全干燥的样品在氮气缓流为〜15分钟。不要离开无人值守的样本超过15分钟。经常检查样品,并停止加热,干燥,一旦所有样品都干。
- 此处暂停程序,如果没有剩余的天足够的时间来完成该还原步骤。暂时( 即过夜)商店样品在-80℃。要继续程序储存后,从-80℃冰箱取出的样品,并让他们脱帽之前完全预热。
3.减少
- 内部通风橱,准备在1M ammoni 10克硼氢化/ L的钠足够量(加入NaBH 4)溶液嗯氢氧化铵(NH 4 OH)。每个样本将需要475微升的该溶液。使对于每批样品新鲜溶液。浓氢氧化铵(27-30%w / w的氨 )约为14.5 M.
注意:硼氢化钠(NaBH 4还原)是吸湿性,水反应性毒素和强刺激性该释放-在与水高度易燃蒸气引起经吸入,摄取或眼/皮肤接触严重烧伤接触。
注意:氢氧化铵(NH 4 OH)是一种腐蚀性和刺激性的毒素能够导致严重的烧伤和在吸入,食入,或眼睛/皮肤接触不可逆的器官损害。用水冲洗受灾地区30分钟,并防止受害人的摩擦或搔抓受灾地区。 - 向每个样品,在1M 的 NH 4 OH添加475微升10克/升的NaBH 4。混合样品完全溶解任何残留物。帽试管和使还原反应继续1小时。
- 在1小时的等待,设置加热的蒸发歧管至75℃。为此,如果用玻璃管适当的孔(见下文3.4)加热块。
- 当1小时的反应时间结束后,加63微升甲醇(MeOH)至每个样品。此步骤和下面的步骤除去残留的硼作为硼酸三甲酯 - 即沸点在68℃的相对挥发的液体。
- 干的样品(在预加热的歧管)在75℃下在氮气缓流为〜15分钟。经常检查样品,不要离开他们无人值守。在玻璃管的底部小液滴表明样品尚未干燥。
注意:要从液滴区分气泡,倾斜的试管中。只有液滴会后倾动,但反之并不总是正确的:如果一个泡沫不动,它仍然是一个(非常小的)液滴。 - 一旦SAMPLES完全干燥,制得9:甲醇(MeOH)和乙酸(AcOH中)的1(体积/体积)溶液。添加125微升此甲醇:乙酸溶液到各样品中。
- 干的样品(在预先加热的歧管)在75℃下在氮气缓流。
- 当样品完全干燥后,在室温下真空干燥20分钟样品:将样品放置于塑料真空桶(例如由FoodSaver销售),关闭真空盖,将真空转盘转到"真空",连接真空软管,并打开真空。要拆卸真空,扭转这些步骤。等待系统试图打开真空盖之前完全解压缩。
- 此处暂停程序,如果没有剩余的天足够的时间来完成该还原步骤。暂时( 即过夜)商店样品在-80℃。要继续储存后的程序,从-80℃冰箱取出的样品,并允许他们之前uncappin完全预热G。
- 在等待的样品进行真空干燥(或温暖,储存后),制备试剂为下一个步骤。获取并为每个样本数的硅烷化锥形底部自动进样器(AS)瓶(帽)。此外,预热都浅阱的AS-小瓶加热块和一个深孔玻璃管块,使得玻璃管内容将达到50℃的温度。
4.乙酰化(演出在通风橱)
- 添加18微升去离子水到各样品中。盖上盖子并充分振荡试管至完全溶解沉淀的任何。
- 加入250微升乙酸酐向每个玻璃管中。帽,彻底涡流,和超声水浴中2分钟,以确保任何残基和沉淀物的完全溶解。
- 用铝箔覆盖玻璃管,并在50℃下进行10分钟的内部温度下孵育。
- 添加230微升浓三氟乙酸(TFA),以每个样品。立即盖帽Ð混合样品。然后,孵育样品-覆盖有铝箔 - 为在50℃的内部温度下10分钟。
- 温育后,加入1.8毫升二氯甲烷(CH 2 Cl 2中),以每个样品。 CAP和拌匀。
- 加去离子水到各样品2.0毫升。盖上盖子并混合样品好。从0到3000×g下离心分离,以分离各层。使用非硅烷化巴斯德吸管如步骤1.4.6概述的,以避免水的污染进行液/液萃取。
- 重复萃取一次,总共两次萃取的。使用硅烷化的巴斯德移液器向有机层到标记的硅烷化的AS小瓶(AS中的机架牢固地保持)传送。填充样品瓶略低于边缘。
- 在40℃下氮气中使用预先加热的,浅阱加热块到干样品(在小瓶)15分钟。不要过度干燥。最终产品被称为部分甲基化的糖醇乙酸酯(PMAAs)。
5.气相色谱 - 质谱法(GC-MS)
- 每瓶100微升丙酮的每个样本拌匀。使用自动进样器注入1μl的在分离模式下各样品的入GC分割模式衬套(保持在280℃,含有硅烷化玻璃毛的一个小插件)。使用以0.8毫升/分钟40使用氦作为恒流模式载气的分流比通过30米DB-5ms的GC柱与0.25毫米内径和0.25微米的膜厚度。
- 保持在165℃的初始GC烘箱温度0.5分钟。以下初始保持时间,节目烘箱坡道的温度,对于每次运行,从165℃至265℃以10℃/分钟(需要10分钟)的速率,然后立即坡道温度265℃以30℃/分钟(这需要2分钟)的速率325℃,并保持在325℃的温度下3分钟。每样本的总运行时间为15.5分钟。
- 使用PRO佩尔利调谐和校准质谱仪经受样品组分从GC柱洗脱电子电离(EI,在250℃下70伏特)。对于一个TOF质谱分析仪,分析来自M / Z 40片段M / Z 800用0.1秒脉冲求和率。设定的2.5分钟的EI-长丝溶剂延迟时间。
6.数据分析
- 如果使用TOF质谱分析仪,通过将0.15大的质量窗口以获得提取离子色谱总结每个PMAA最丰富和/或诊断碎片离子。目标离子每个PMAA已经在其他地方发表,但33以下的改变已经作出:T-葡萄糖离子现在145.1 + 205.1的; 2人离子是161.1 + 189.1; 3-Gal的离子是161.1 + 233.1,6-Gal的离子是161.1 + 189.1 + 233.1; 2,6-人离子是189.1; 3,6-人离子是189.1 + 233.1。
- 使用QuanLynx或其他软件自动集成每个总结提取离子色谱峰面积。 手动通过查看每个集成提取离子色谱验证积分结果。然后,峰积分数据导出到用于进一步的分析和数据归一化,这涉及除以所有己糖XIC面积总和每个单独的己糖XIC地区的电子表格;同样地,每个单独的HexNAc XIC的区域由所有HexNAc XIC面积的总和除以。此过程产生用于每个单独的己糖和HexNAc归丰度。
结果
共离子流色谱图(TIC)示出相对于在其中两个关键全甲基的步骤被不正确执行的情况下成功全甲基,水解,还原,和人的血浆样品的乙酰化示于图3。
HexNAcs相对于己糖的绝对收益率 :
Ñ-acetylhexosamine(HexNAc)部分甲基化的糖醇乙酸酯(PMAAs)往往比己糖产量低。43为了估计相对于己糖HexNAcs的绝对产率,在N- -acetyllactosamine(一个Gal1-4GlcNAc二糖)六10微克样品的水10微升进行分析。为末端半乳糖(叔半乳糖)和4- GlcNAc的TIC峰面积进行了整合。 4- GlcNAc的相对于叔 - 半乳糖和4- GlcNAc的总量的比例为11.3±0.7%(SEM)。虽然HexNAc产量是可再现的(见下文),但事实上,这个值大于0.5的理论值小得多表示HexNAcs的产率比己糖的根本低。 (该HexNAc理论产量为0.5,因为ñ-acetyllactosamine是1:1,己糖HexNAc糖)
区域内和批间重现性 :
内和分析间为贡献的总己糖或HexNAc信号中的至少1%的所有聚糖节点再现性在表1中提供。这些数据是由3个独立的分析上3个独立的天获得的,使用EDTA血浆的相同的库存。人血浆( 即 ,那些与总己糖或HexNAc信号的> 1%)在图4中所提供的18个最丰富的多糖节点此优化的协议下自动进样器的稳定性数据。
其他值得注意的观察 :
同时优化全甲基方法,我们发现,这是没有必要防止水吸附到初始洗涤,用乙腈现有的氢氧化钠珠。我们还发现,少量水的过程中组合的最后的乙酰化步骤,加热与乙酸酐在短时间内没有TFA的存在有助于促进反应完全。最后,时间飞行(TOF)质谱高分辨力是没有必要的成功聚糖节点分析:基于有关的GC-TOF-MS和传统的传输四极同组样品的平行喷射的初步结果基于GC-MS的选择离子监测工作(SIM)模式展现在最后归己的条款和HexNAc相对丰度相似的结果。
er.within页="1"> 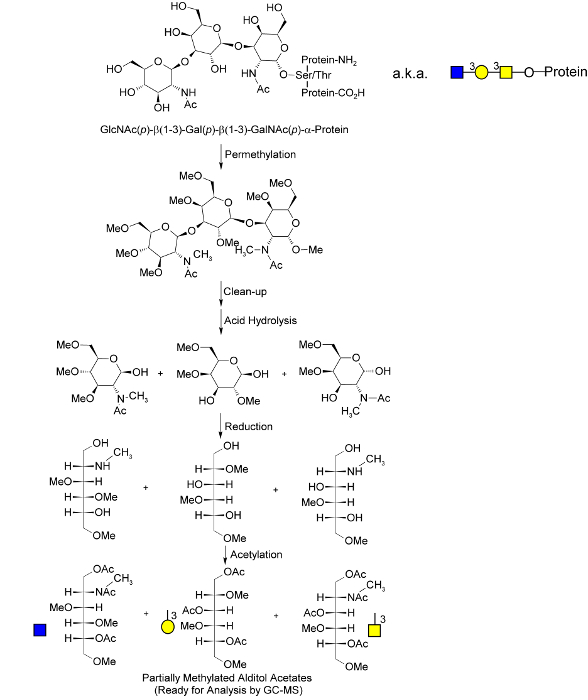
图1.全球聚糖甲基化分析过程的分子概述一个O -连接聚糖图示;这些都在全甲基过程,这已被改编为40 Goetz的继全甲基和水解释放,单糖被减少和新生羟基经乙酰化"标记"。甲基化和乙酰化在最终部分甲基化的糖醇乙酸酯(PMAAs)的独特模式对应于原始完整聚合物在独特的"聚糖节点",并提供了由GC-MS。1.分离和定量-连接的分子基础和糖脂聚糖被释放的酸水解过程中联动标示单糖。从博尔赫斯等人改编。33许可。>点击此处查看该图的放大版本。

图2的分析概念的概念的概述。一种上调糖基转移酶( 例如 ,对GnT-Ⅴ)使在一个特定的,唯一联聚糖的单糖残基的量的增加(在本实施例2,6-连接的甘露糖"节点")哪位,通过其他糖基转移酶的随后的行动,可以导致形成在低拷贝数的异构整个聚糖结构的混合物各-所有这些都可以是难以检测和常规的方式量化。解析汇集在一起"聚糖节点"从在所有的异常聚糖结构提供比任何单一完整聚糖的GnT-V活性的更直接的替代测量。 , 澳 - - 氮同时测量和脂质链接"GLYC在这里所描述(和最初在别处33)表示一个在概念上的新手段来检测和监控聚糖-情感性疾病如癌症整个生物标本的节点"。从10微升血液的血浆样品显示实际提取离子色谱图。相邻数字在聚糖结构单糖残基表示在该较高残基与低残余的位置。如果没有连锁位置在色谱注释表示的残基可以是在终端位置或者在溶液中( 例如,葡萄糖)的分类。所有的残基。除了唾液酸通过其1-位向下链路;经由其2-位向下唾液酸链接分割在色谱表明在提取离子色谱变化:己糖残基和m / z 116 + 158对于N M / Z 117 +129 -乙酰基(HexNAc)残基。从博尔赫斯等 33改编的权限。61 / 53961fig2highres.jpg"目标="_空白">点击此处查看该图的放大版本。

图3代表结果。总离子流色谱图(国际信托)对于其中A)中的样品被正确处理相同的人血EDTA血浆样品的聚糖节点分析,B)中的白色残余物在全甲基的解决方案,通过该NaOH纺柱进行成用于液/液萃取随后的混合物,和C),这是通过该NaOH柱纺全甲基溶液加入到磷酸盐缓冲液,但不充分混合,然后加入氯仿液/液萃取的。在图2中提供的传奇。 请点击^ hERE查看此图的放大版本。

图4.自动进样器的稳定性。自动进样器的稳定性超过48小时的人血浆中18个最丰富的多糖节点。在22小时样品完全干燥并在120微升丙酮重构。数据点的每个集群表示相同样品的四个连续注射。黑线涵盖每个节点聚糖的平均标准值的±15%。 请点击此处查看该图的放大版本。

表1.区域内和批间的重现性。数值代表总己糖或全部HexN的CV%交流归个别聚糖节点。贡献的总己糖或HexNAc信号中的至少1%的所有聚糖节点都已列出。数据由3个独立的分析师3个独立的天收购,使用EDTA血浆的股票一样。每批次N = 6个样品。 请点击此处下载此表为Excel电子表格。
讨论
在一般情况下,成功地生产部分甲基化的糖醇乙酸酯的(PMAAs)从己糖是充满了很多困难,并且比成功制造N- -acetylhexosamine(HexNAc)PMAAs的更稳健。后面,因为它发挥出在这个过程中的每一步该现象的确切机制是未知的,但必须与本-N-乙酰基(而不是羟基)的独特的化学是唯一相对于己糖HexNAcs。后面,因为它涉及酸水解该现象的机制在别处。43说明总之,对于N -methylacetamido成为酸水解期间正电的能力使得该糖苷键,以酸水解抗性。这就解释如上对于N -acetyllactosamine的分析描述HexNAc相对的低产率的己糖(总HexNAc +己糖信号的11.3%,总而不是50%)。值得注意的是,这种相对升HexNAcs的奥尔产量并不能让他们难以在复杂的生物流体和组织进行检测,排除或从大型,复杂的聚糖( 如 2,4-人,2,6-人,3,4,6衍生聚糖节点简便检测-Man和3,4- GlcNAc的, 图2)。33由于以何种方式聚糖节点XIC峰面积进行归一化(步骤6.3),只要各个HexNAc的相对产率仍然相对于其他HexNAcs一致(这是这样,看在不同样品之间的不同HexNAcs的相对量表1),有用的信息可以得到。这适用于己糖也是如此。此外,我们以前曾表明,己糖到HexNAcs比例显示一致的定量行为,以及33 -这是通过在每个批次样品质量控制(S)掺入连续监测的现象。
在其中进行全甲基的方式对影响最大整体收益率和可重复性HexNAc PMAAs的。特别是,大应小心完全避免全甲基聚糖暴露至碱性含水条件。在这方面的两个关键步骤是:1)在离开在后面(步骤1.3.13和1.3.14)自旋通过解所有的白色沉淀,和2)一旦被加入到磷酸盐缓冲液自旋通过溶液立即混合(步骤1.3.13和1.3.14)。缓冲,而不是简单的盐溶液被包括在此阶段和随后的液/液萃取步骤,以防止该水溶液的无意碱化。我们怀疑在碱性条件下HexNAcs的甲基化和乙酰化2-氨基的乙酰基可发生水解,导致在降低相关联聚糖氯仿的整体提取效率的更极性的仲胺。
失败全甲基HexNAcs最容易辨认的特征是相对于那些6-半乳糖,3,6-曼色谱峰的4联的GlcNAc(4- GlcNAc的)的强度,和背景的过程中最后一列烘烤( 图3)的基线强度。当4-GlcNAc的PMAA的绝对丰度低,其归一化相对于所有其它HexNAcs丰度也变低的倾向,以同时增加3,4- GlcNAc的的(最显着)。
旨在优化整体收益率和检测的鲁棒性的一些已经作了修改,因为我们最初发布描述此分析方法33这些变化之一是在综合提取离子色谱(XICs)是标准化的方式:为了简单起见,我们现在除以所有己糖XIC面积总和每个单独的己糖XIC的面积;同样地,每个单独的HexNAc XIC的区域由所有HexNAc XIC面积的总和除以。如在表1中 ,总体分析间/帧间分析师reproducibil看出性支持有助于它们各自的己糖或HexNAc信号平均13%的简历到> 1%的聚糖节点。
据我们所知,这是真正的自下而上糖组学,其中聚糖首先分解,然后其成分分析,以构建聚糖组合物的定量样品宽肖像的唯一的化身。这里,代替传统的酶促释放,该全甲基过程非还原性消除(释放)O从它们各自的蛋白质,40而Ñ -连接的聚糖酸水解期间释放33作为补充的方法,以传统的自上而下糖组学联的聚糖,这种方法是能够汇集的利益独特聚糖的功能,如"核心岩藻糖基","6唾液酸化","平分GlcNAc的",和"beta 1-6支化"到单个分析信号(参见,4,6- GlcNAc的在图2 6-Gal的,3,4,6-满和2,6-曼节点,respe沉着应对)。在传统的自上而下的方法,特征如这些最终依赖于一个或两个键糖基转移酶33的独特的活动通常分布在几十个完整聚糖,有时是困难的或不可能解决( 例如 ,3-唾液酸化对6唾液酸化)由于一些完整聚糖群众的退化。此外,这里提出的自下而上的方法已经证明在非侵入检测肺癌初始承诺。33进一步的研究正在进行中,以验证这些初步结果,以及关于检测的其它形式的癌症更多的,尚未发表的结果。
这里所描述的方法的最大的限制是,它是在检测的极限方面的约束,如果是要施加到预分离糖蛋白。基于对个别聚糖标准,未公布的分析没有载体蛋白,定量限FO- [R个别聚糖似乎在于低微克范围内。这些绝不是绝对值低定量限,但这个事实并不相对于所述检测其并非设计为与已经没有必要实现低定量限(至少对于这里所描述的目的和原先预期范围无关紧要在我们以前的出版物33)。其实,人的血浆/血清中含有的糖蛋白10S毫克/毫升的浓度范围内,这意味着血液血浆/血清的分析中,我们只注入〜1/100的最终样品体积和分裂40出41件小数量在GC进样口浪费。如果没有这种实践中,一些聚糖节点可以饱和检测器。可以通过传统的自上而下的MALDI-MS或LC-MS基础的方法产生足够的完整聚糖信号糖蛋白的数量皮摩尔不能用这种方法检测。该方法的进一步细化正在进行补救此限制。
披露声明
The authors have nothing to disclose.
致谢
This work was supported by the College of Liberal Arts and Sciences of Arizona State University in the form of laboratory startup funds to CRB. It was also supported by a grant from Flinn Foundation (Grant No. 1977) and by the National Cancer Institute of the National Institutes of Health under Award Number R33CA191110. JA was supported by the National Institute of General Medical Sciences of the National Institutes of Health Postbaccalalureate Research Education Program (PREP) under award number R25GM071798. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
材料
| Name | Company | Catalog Number | Comments |
| Sodium hydroxide beads | 367176 | Sigma-Aldrich | 20-40 mesh, reagent grade 97% |
| 0.9 ml Spin column | 69705 | Pierce division of ThermoFisher Scientific | Includes plugs and polyethylene frits |
| GC-MS autosampler vial (silanized)* | C4000-9 | ThermoFisher Scientific | Target DP High Recovery Vial, 1.5 ml, 12 mm x 32 mm, includes Teflon-lined pierceable caps |
| 1.5 ml polypropylene test tubes | 05-402-25 | ThermoFisher Scientific | Snap-cap lid |
| 2 ml polypropylene test tubes | 05-408-138 | ThermoFisher Scientific | Snap-cap lid |
| Dimethyl Sulfoxide (DMSO) | D8418 | Sigma-Aldrich | BioReagent for molecular biology, reagent grade >99.0% |
| Iodomethane | I8507 | Sigma-Aldrich | Contains copper as stabilizer, ReagentPlus 99% |
| Acetonitrile | A955-4 | ThermoFisher Scientific | Optima LC/MS |
| Microcentrifuge | 75002436: Sorvall Legend Micro 17 Centrifuge | ThermoFisher Scientific | 24 x 1.5/2.0 rotor with ClickSeal biocontainment lid. Rotor catalog number: 75003424 |
| 13 x 100 glass test tube (silanized)* | 53283-800 | VWR | 13 mm x 100 mm borosilicate glass test tubes with screw-cap finish |
| Caps for glass test tubes | 14-930-15D | ThermoFisher Scientific | Kimble™ Black Phenolic Screw Caps; 13 mm-415 GPI thread; PTFE-faced rubber liner. |
| Sodium chloride | S7653 | Sigma-Aldrich | >99.5% pure |
| Chloroform | 4440-08 | Macron Fine Chemicals | |
| Trifluoroacetic acid | 299537 | Sigma-Aldrich | 99% purified by redistillation for protein sequencing |
| Sodium borohydride | 71321 | Fluka Analytical | 99% |
| Ammonium hydroxide solution | 320145 | Sigma-Aldrich | NH3 content: 28.0-30.0% |
| Methanol | AH230-4 | Honeywell Burdick & Jackson | HPLC grade |
| Acetic acid | 320099 | Sigma-Aldrich | 99.70% |
| Plastic vacuum desiccator | Any model of adequate size | FoodSaver | |
| Acetic anhydride | 539996 | Sigma-Aldrich | 99.50% |
| Dichloromethane | D143SK-4 | ThermoFisher Scientific | Stabilized HPLC grade |
| Acetone | 9006-03 | J.T.Baker | Baker Analyzed |
| Heated evaporation manifold (main unit) | pi18823 | ThermoFisher Scientific | Thermo Scientific* Reacti-Therm* Heating and Stirring Module; Triple-block Model with Heating and Stirring Function |
| Heated evaporation manifold (overhead evaporator) | pi18826 | ThermoFisher Scientific | ThermoScientific* Reacti-Vap Evaporator, 27-port; For use with triple-block Reacti-Therm heating module |
| Aluminum sample-holder blocks for evaporation manifold | pi18816 | ThermoFisher Scientific | Block, Aluminum, Reacti-Block S-1, Holds 13 mm dia test tubes, 13 holes (14 mm dia. x 45 mm deep) |
| Gas chromatograph | Model A7890 | Agilent | Equipped with CTC PAL autosampler |
| Mass spectrometer | GCT Premier (Time-of-Flight) | Waters | |
| Split-mode liner (deactivated / silanized) | 5183-4647 | Agilent | Containing a small plug of silanized glass wool |
| DB-5ms GC column | 122-5532 | Agilent | 30 m x 0.25 mm ID x 0.25 micron film thickness |
| Chlorotrimethylsilane | 95541 | Sigma-Aldrich | |
| Glass vacuum desiccator (for glassware silanization) | EW-06536-30 | Cole-Parmer | 12" wide; 230 mm plate size |
| *Glassware silanization is carried out in-house, overnight using chlorotrimethylsilane vapor in a large glass vacuum desiccator. | |||
参考文献
- Li, M., Song, L., Qin, X. Glycan changes: cancer metastasis and anti-cancer vaccines. J Biosciences. 35 (4), 665-673 (2010).
- Stanley, P., Schachter, H., Taniguchi, N. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 8: N-Glycans(2009).
- Apweiler, R., Hermjakob, H., Sharon, N. On the frequency of protein glycosylation, as deduced from analysis of the SWISS-PROT database. Biochim Biophys Acta. 1473 (1), 4-8 (1999).
- Brockhausen, I., Schachter, H., Stanley, P. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 9: O-GalNAc Glycans (2009).
- Rini, J., Esko, J., Varki, A. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 5: Glycosyltransferases and Glycan-processing Enzymes (2009).
- Gercel-Taylor, C., Bazzett, L. B., Taylor, D. D. Presence of aberrant tumor-reactive immunoglobulins in the circulation of patients with ovarian cancer. Gynecol Oncol. 81 (1), 71-76 (2001).
- An, H. J., et al. Profiling of glycans in serum for the discovery of potential biomarkers for ovarian cancer. J Proteome Res. 5 (7), 1626-1635 (2006).
- Kanoh, Y., et al. Changes in serum IgG oligosaccharide chains with prostate cancer progression. Anticancer Res. 24 (5B), 3135-3139 (2004).
- Kyselova, Z., et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res. 6 (5), 1822-1832 (2007).
- Okuyama, N., et al. Fucosylated haptoglobin is a novel marker for pancreatic cancer: a detailed analysis of the oligosaccharide structure and a possible mechanism for fucosylation. Int J Cancer. 118 (11), 2803-2808 (2006).
- Zhao, J., et al. Glycoprotein microarrays with multi-lectin detection: unique lectin binding patterns as a tool for classifying normal, chronic pancreatitis and pancreatic cancer sera. J Proteome Res. 6 (5), 1864-1874 (2007).
- Comunale, M. A., et al. Proteomic analysis of serum associated fucosylated glycoproteins in the development of primary hepatocellular carcinoma. J Proteome Res. 5 (2), 308-315 (2006).
- Goldman, R., et al. Detection of Hepatocellular Carcinoma Using Glycomic Analysis. Clin Cancer Res. 15 (5), 1808-1813 (2009).
- Aurer, I., et al. Aberrant glycosylation of Igg heavy chain in multiple myeloma. Coll Antropol. 31 (1), 247-251 (2007).
- Abd Hamid, U. M., et al. A strategy to reveal potential glycan markers from serum glycoproteins associated with breast cancer progression. Glycobiology. 18 (12), 1105-1118 (2008).
- Kyselova, Z., et al. Breast cancer diagnosis and prognosis through quantitative measurements of serum glycan profiles. Clin Chem. 54 (7), 1166-1175 (2008).
- Hongsachart, P., et al. Glycoproteomic analysis of WGA-bound glycoprotein biomarkers in sera from patients with lung adenocarcinoma. Electrophoresis. 30 (7), 1206-1220 (2009).
- Arnold, J. N., et al. Novel glycan biomarkers for the detection of lung cancer. J Proteome Res. 10 (4), 1755-1764 (2011).
- Bones, J., Mittermayr, S., O'Donoghue, N., Guttman, A., Rudd, P. M. Ultra performance liquid chromatographic profiling of serum N-glycans for fast and efficient identification of cancer associated alterations in glycosylation. Anal Chem. 82 (24), 10208-10215 (2010).
- Kodar, K., Stadlmann, J., Klaamas, K., Sergeyev, B., Kurtenkov, O. Immunoglobulin G Fc N-glycan profiling in patients with gastric cancer by LC-ESI-MS: relation to tumor progression and survival. Glycoconj J. 29 (1), 57-66 (2012).
- Chen, G., et al. Human IgG Fc-glycosylation profiling reveals associations with age, sex, female sex hormones and thyroid cancer. J Proteomics. 75 (10), 2824-2834 (2012).
- Takeda, Y., et al. Fucosylated haptoglobin is a novel type of cancer biomarker linked to the prognosis after an operation in colorectal cancer. Cancer. 118 (12), 3036-3043 (2012).
- Parekh, R. B., et al. Association of rheumatoid arthritis and primary osteoarthritis with changes in the glycosylation pattern of total serum IgG. Nature. 316 (6027), 452-457 (1985).
- Mehta, A. S., et al. Increased levels of galactose-deficient anti-Gal immunoglobulin G in the sera of hepatitis C virus-infected individuals with fibrosis and cirrhosis. J Virol. 82 (3), 1259-1270 (2008).
- Horvat, T., Zoldoš, V., Lauc, G. Evolutional and clinical implications of the epigenetic regulation of protein glycosylation. Clinical Epigenetics. 2 (2), 425-432 (2011).
- Zoldoš, V., Novokmet, M., Bečeheli, I., Lauc, G. Genomics and epigenomics of the human glycome. Glycoconj J. 30 (1), 41-50 (2013).
- Lowe, J. B., Marth, J. D. A genetic approach to Mammalian glycan function. Annu Rev Biochem. 72, 643-691 (2003).
- Tuccillo, F. M., et al. Aberrant Glycosylation as Biomarker for Cancer: Focus on CD43. Biomed Res Int. , (2014).
- Varki, A., Kannagi, R., Toole, B. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 44: Glycosylation Changes in Cancer (2009).
- Brockhausen, I. Mucin-type O-glycans in human colon and breast cancer: glycodynamics and functions. EMBO reports. 7 (6), 599-604 (2006).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Bertozzi, C. R., Sasisekharan, R. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch 48 Glycomics (2009).
- Borges, C. R., Rehder, D. S., Boffetta, P. Multiplexed surrogate analysis of glycotransferase activity in whole biospecimens. Anal Chem. 85 (5), 2927-2936 (2013).
- Mcinnes, A. G., Ball, D. H., Cooper, F. P., Bishop, C. T. Separation of Carbohydrate Derivatives by Gas-Liquid Partition Chromatography. J Chromatogr. 1 (6), 556-557 (1958).
- Ciucanu, I., Caprita, R. Per-O-methylation of neutral carbohydrates directly from aqueous samples for gas chromatography and mass spectrometry analysis. Anal Chim Acta. 585 (1), 81-85 (2007).
- Ciucanu, I., Kerek, F. A simple and rapid method for the permethylation of carbohydrates. Carbohydr Res. 131, 209-217 (1984).
- Kang, P., Mechref, Y., Klouckova, I., Novotny, M. V. Solid-phase permethylation of glycans for mass spectrometric analysis. Rapid Commun Mass Sp. 19 (23), 3421-3428 (2005).
- Kang, P., Mechref, Y., Novotny, M. V. High-throughput solid-phase permethylation of glycans prior to mass spectrometry. Rapid Commun Mass Sp. 22 (5), 721-734 (2008).
- Goetz, J. A., Mechref, Y., Kang, P., Jeng, M. H., Novotny, M. V. Glycomic profiling of invasive and non-invasive breast cancer cells. Glycoconj J. 26 (2), 117-131 (2009).
- Goetz, J. A., Novotny, M. V., Mechref, Y. Enzymatic/chemical release of O-glycans allowing MS analysis at high sensitivity. Anal Chem. 81 (23), 9546-9552 (2009).
- Mulloy, B., Hart, G. W., Stanley, P. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. Ch. 47: Structural Analysis of Glycans (2009).
- Seed, B. Silanizing glassware. Curr Protoc Immunol. 21, A.3K.1-A.3K.2 (1997).
- Stellner, K., Saito, H., Hakomori, S. I. Determination of aminosugar linkages in glycolipids by methylation. Aminosugar linkages of ceramide pentasaccharides of rabbit erythrocytes and of Forssman antigen. Arch Biochem Biophys. 155 (2), 464-472 (1973).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。