Method Article
Glycan Knoten Analyse: Ein Bottom-up-Ansatz Glycomics
In diesem Artikel
Zusammenfassung
This article presents an enhanced form of a novel bottom-up glycomics technique designed to analyze the pooled compositional profile of glycans in unfractionated biofluids through the chemical breakdown of glycans into their constituent linkage-specific monosaccharides for detection by GC-MS. Potential applications include early detection of cancer and other glycan-affective disorders.
Zusammenfassung
Synthesized in a non-template-driven process by enzymes called glycosyltransferases, glycans are key players in various significant intra- and extracellular events. Many pathological conditions, notably cancer, affect gene expression, which can in turn deregulate the relative abundance and activity levels of glycoside hydrolase and glycosyltransferase enzymes. Unique aberrant whole glycans resulting from deregulated glycosyltransferase(s) are often present in trace quantities within complex biofluids, making their detection difficult and sometimes stochastic. However, with proper sample preparation, one of the oldest forms of mass spectrometry (gas chromatography-mass spectrometry, GC-MS) can routinely detect the collection of branch-point and linkage-specific monosaccharides ("glycan nodes") present in complex biofluids. Complementary to traditional top-down glycomics techniques, the approach discussed herein involves the collection and condensation of each constituent glycan node in a sample into a single independent analytical signal, which provides detailed structural and quantitative information about changes to the glycome as a whole and reveals potentially deregulated glycosyltransferases. Improvements to the permethylation and subsequent liquid/liquid extraction stages provided herein enhance reproducibility and overall yield by facilitating minimal exposure of permethylated glycans to alkaline aqueous conditions. Modifications to the acetylation stage further increase the extent of reaction and overall yield. Despite their reproducibility, the overall yields of N-acetylhexosamine (HexNAc) partially permethylated alditol acetates (PMAAs) are shown to be inherently lower than their expected theoretical value relative to hexose PMAAs. Calculating the ratio of the area under the extracted ion chromatogram (XIC) for each individual hexose PMAA (or HexNAc PMAA) to the sum of such XIC areas for all hexoses (or HexNAcs) provides a new normalization method that facilitates relative quantification of individual glycan nodes in a sample. Although presently constrained in terms of its absolute limits of detection, this method expedites the analysis of clinical biofluids and shows considerable promise as a complementary approach to traditional top-down glycomics.
Einleitung
Glycolipide, Glycoproteine, Proteoglycane und Glycosaminoglycane bilden die vier Hauptklassen von komplexen, heterogenen Kohlenhydrate als Glykane gemeinsam bekannt. So allgegenwärtig und integrale Bestandteile der Plasmamembran, Glykokalyx, und die extrazelluläre Matrix und Flüssigkeiten, teilzuhaben Glycane in so unterschiedlichen biochemischen Prozesse wie Endozytose intrazellulär Handel, Zellmotilität, Signaltransduktion, molekularen Erkennung, Rezeptoraktivierung, Zelladhäsion, Wechselwirkung Wirt-Pathogen , die interzelluläre Kommunikation, immunosurveillance und Immunantwort Initiation. 1 Präsent in fast jeder Domäne des Lebens, wie Glycosyltransferasen bekannte Enzyme , die Glykan Polymere wirken im Tandem bauen mit Glycosidhydrolasen (auch als Glycosidasen bekannt, die Glykane brechen) zu konstruieren, gestalten, und schließlich produzieren abgeschlossen Glykan Polymere 2. Obwohl jeder Glycosyltransferase auf verschiedenen Glycokonjugaten arbeiten kann, eine Glycosyltransferaseallgemein schmiedet eine linkage- und Anomer-spezifischen glykosidischen Bindung durch die Monosaccharid - Einheit eines bestimmten aktivierten Nucleotidzucker Donator übertragen (beispielsweise GDP-Fucose) zu einer bestimmten Kategorie von nucleophilen Akzeptoren (beispielsweise ein Lipid, Polypeptid, eine Nukleinsäure, oder wachsende Oligosaccharid). Es wurde geschätzt , dass mehr als 50% der Proteine (insbesondere Membran und sekretorischen Proteinen) sind post-translational durch Glykosylierung modifiziert 3 Rudimentäre kombinatorischen Berechnungen eine Anerkennung für die große Variabilität bieten, Vielseitigkeit und Spezifität an Glykoproteine durch Glykosylierung gewährt. Wenn ein Polypeptid Substrat 10 Glykosylierungsstellen zum Beispiel, hat , und jede Seite kann mit 1 von nur 3 verschiedene Monosaccharid des reduzierenden Enden, dann theoretisch die endgültige Glykoprotein kann 3 10 = 59.049 verschiedene Identitäten annehmen eine glycosidische Bindung bilden. In Glykoproteine bilden Glykosidbindungen gemeinsam mit der Seitenketten-Stickstoff of Asparaginresten in der Sequenz Asn-X-Ser / Thr (X ist eine beliebige Aminosäure außer Prolin sein kann) N zu ergeben Glycane 2 und Seitenketten - Hydroxylgruppen von Serin und Threonin - Resten O 4 - Glycane zu ergeben. Die Zusammensetzung einer glycome der Zelle (dh sein Komplement von Glykosylierungsprodukte) ist einzigartig und begrenzt , da mit wenigen Ausnahmen, Glycosyltransferasen strenge Spender zeigen, Akzeptor und Verknüpfung Spezifität. 5 Wichtige und reichlich Blutplasma Glykoproteine anomale Glykosylierung als nachgeschalteter Folge leiden viele pathologische Zustände abnormer Glycosyltransferase Expression und Aktivität aufgrund, insbesondere Krebs und entzündlichen Erkrankungen. 6-24
Vor allem aufgrund der epigenetischen Faktoren ist die glycome wesentlich vielfältiger, dynamischer und komplexer als das Proteom und Transkriptom. 25,26 Während etwa 1% des Säugetiergenoms , die Bildung, Modifikation kodiert, undMontage von Glycanen, 27 Glykosylierung erfolgt in einem nicht-template risch-ein deutlichem Gegensatz zu Polypeptid und Nukleinsäure - Biosynthese. Das Zusammenspiel zwischen der relativen Menge und Aktivität der Glycosylierungsenzyme und solche Umweltfaktoren als Nährstoff und Vorläufer Verfügbarkeit bestimmt letztendlich die Art, die Geschwindigkeit und das Ausmaß der Glykosylierung. 5,28 Embryonalentwicklung (zB Bestimmung und Differenzierung), Zellaktivierung, und die Progression durch der Zellzyklus Einfluss Genexpression (dh Transkription und Translation) und die Identität und die Menge der verfügbaren Glycosyltransferasen ändern, deren Tätigkeit die unmittelbare stromauf Determinante des Glycans Profil der Zelle. Weil (einige) die proliferative, Klebstoff und invasive Eigenschaften von Krebszellen ähneln denen der gewöhnlichen embryogenen Zellen, spezifische Änderungen in Glykan Biosynthesewege (zB Vorläufer Akkumulation, deregulierten Expression aberrant Modifikation, strukturelle Abschneiden oder neuartige Bildung) dienen als universelle Krebs Biomarker , die verschiedenen Stadien der Tumorbildung zeigen, Progression, Migration und Invasion 29 Obwohl Glykosylierung sehr komplex ist, offenbar nur wenige Änderungen in der Glykosylierung der Karzinogenese und Metastasierung ermöglichen kann. offenbar gewisse "anomale" Glykosylierungsprodukte tatsächlich Krebszellen profitieren , indem ihnen die Immunerkennung zu entziehen und die Anforderungen der Migration in unwirtlichen intravaskulären und metastatischen Umgebungen überleben. 28,30,31 nicht überraschend, haben Versuche gezeigt , dass zu stören oder zu verhindern Muster verändert Genexpression und anomale Glykan Bildung kann tumorigenesis stoppen. 29 Dennoch sind die anomalen in einer Biofluid Probe nachgewiesen Glykane (zB Urin, Speichel und Blutplasma oder Serum) kann nicht sein , direkte Indikatoren für Krebs (oder eine andere Krankheit), sondern stromabwärts Ergebnisse der subtilen, aber signifikantVeränderungen im Immunsystem oder quantifizierbaren Auswirkungen eines schädlichen Zustand in einem unberechenbaren Organ. 32
Obwohl sie universal Informationen über die glycome viele molekulare Wechselwirkung basierenden glycomics Techniken (beispielsweise Lectin / Antikörper - Arrays und metabolische / kovalente Markierung) liefern , hängen von der Erkennung von ganzen Glykanstrukturen und liefern keine detaillierte Strukturinformationen zu den einzelnen Glykane. In deutlichem Gegensatz dazu kann der Massenspektrometrie (MS) identifizieren und individuelle Glykanstrukturen quantifizieren und solche strukturellen Informationen wie die Befestigungsstellen an Polypeptid Kerne aufzudecken. Deregulierten Expression oder Aktivität von nur einer Glycosyltransferase kann eine Kaskade von schädlichen molekularen Vorgänge in mehreren Glycosylierungswege initiieren. Da jeder Glycosyltransferase auf mehr als einem Glykokonjugat Substrat und in den verschiedenen wachsenden Glykan Polymere, dereguliert Biosyntheseketten ergeben dispropor arbeiten kanntional erhöhte Mengen von 33 jedoch nur ein Glykan Produkt , sondern mehrere heterogene Klassen von anomalen Glykane in intra- oder extrazellulären Flüssigkeiten., so einzigartig anomale Glykane manchmal gelten als unpraktisch als Biomarker für Krebs oder andere Glykan-affektiven Erkrankungen , da im Vergleich zu den großen Pool von gut regulierten Glykane, diese anomale Glykane nur ein sehr geringer Anteil, der kann oft nicht nachweisbar bleiben, auch durch solche hochempfindliche Techniken wie Massenspektrometrie. Beispielsweise in intra- und extrazellulären Körperflüssigkeiten, die breite Proteinkonzentrations - Spektrum (die acht Grßenordnungen umspannt) können Detektions knapper Glycoproteine zu verhindern , die durch die reichlicher Spezies maskiert sind. 32 Außerdem Glycosyltransferaseaktivität Bestimmung bleibt ein erheblicher praktischer und theoretische Herausforderung , weil viele Glycosyltransferasen fehlen in der klinischen biofluids oder inaktiv ex vivo. Trotz der Schwierigkeit, consistently Erfassung und extrem winzigen Mengen von einzigartigen Ganzen Glykane zu quantifizieren, Praktiker der Massenspektrometrie haben enorme Fortschritte in Richtung auf den Einsatz intakter Glykane als klinischer Marker gemacht. Wir haben vor kurzem einen komplementären Ansatz zur Analyse von intakten Glykane entwickelt, die GC-MS verwendet wird, die Erfassung aller konstituierenden Verzweigungspunkt und bindungsspezifischer Monosaccharide ( "Glykan Knoten"), die zusammen verleihen Einzigartigkeit jedes Glykan und in vielen erleichtert Fälle direkt als molekulare Surrogate dienen, die die relative Aktivität des schuldhaftem Glycosyltransferase (n) zu quantifizieren.
Seit seiner ersten 1958 die direkte Anwendung auf Glykananalyse berichtet, Gaschromatographie (GC) ist eine leistungsfähige Technik erwiesen per-methyliert Mono- und Disacchariden 34 zu analysieren, bestimmen ihre anomericity und absolute Konfiguration und sie für die nachfolgende massenspektrometrische Analyse trennen. 35 zwischen 1984 und 2007, Ciucanu und Kollegeneine Festphasen - Glycan Permethylierung Technik eingeführt und verfeinert , die Natriumhydroxid und Iodmethan verwendet wird , durch Flüssig / Flüssig - Extraktion von permethyliertem Glykane mit Wasser und Chloroform. 35,36 Zwischen 2005 und 2008, Kang und Mitarbeiter integriert , um eine zeitsparende Spin -column Ansatz in den Permethylierung Schritt. 37,38 im Jahr 2008 erarbeitete die Goetz Forschungsgruppe eine quantitative Festphasen - Permethylierung Glykan-Profilierungsverfahren unter Verwendung von Matrix-assistierte Laser - Desorptions-Ionisations (MALDI) Massenspektrometrie zu vergleichen und möglicherweise unterscheiden invasive und nicht -invasive Brustkrebszellen; 39 dann, im Jahr 2009, die Goetz Team kombiniert enzymatische und chemische Release - Techniken zu spalten O - Glycane aus intakten Glykoproteinen in einer stark alkalischen Festphasen Permethylierung Schema 40 Obwohl die Goetz Verfahren gleichzeitige Permethylierung und chemischen Freisetzung erleichtert. O - Glycane, wurde es nur auf vorisolierten Glyco angewendetProteinen. Wir diese Technik im Jahr 2013 modifiziert und angepasst für ganze unfraktioniertem Biofluiden und homogenisiert Gewebeproben von Trifluoressigsäure enthält (TFA) Hydrolyse, Reduktion und Acetylierung Schritte. 33 Diese zusätzlichen Schritte auch Glykane aus Glycolipiden und N lösen -verknüpfte Glykane aus Glykoproteinen und wandeln sie in teilweise methylierte Alditolacetate (PMAAs, Abbildung 1), dessen Unterscheidungs Methylierungs-and-Acetylierung Muster erleichtern die Analyse durch GC-MS und zu charakterisieren , in einzigartiger Weise die konstituierenden Glykan Knoten in der ursprünglichen intakten Glykan Polymer 41 (Abbildung 2). 33 letztlich diese Verfahren erzeugt ein zusammengesetztes Porträt aller Glykane in einem komplexen Biofluid basierend auf direkte, relative Quantifizierung von einzigartigen Glykan Funktionen wie "Kern Fukosylierung", "6-Sialylierung", "bisecting GlcNAc" und "beta 1-6 Verzweigung" - jeweils von einem einzigen GC-MS chromatographic Spitze. Dieser Artikel stellt eine weitere Optimierung der Permethylierung, Acetylierung, Isolation und Clean-up-Phasen zusammen mit Verbesserungen in der Art der relativen Quantifizierung.
Protokoll
Vorsicht: Vermeiden Sie Haut / Augenkontakt mit einem der Reagenzien , die in diesem Experiment verwendet. Bei der Belichtung spülen gründlich den betroffenen Bereich mit Wasser und suchen Sie sofort einen Arzt auf.
1. Permethylierung und Glycan Extraction
- Säulenvorbereitung
- Erhalten, wie viele Mikrofuge spin column Einheiten als die zu analysierenden Proben. Pause und nehmen Sie die Plastikbehälter Rohrkappen. Legen Sie ein Mikrofuge Mini-Filter in jedem Speicherrohr. Platzieren Sie die zusammengebauten Mikrofuge Spinsäulen in einer Mikrorohrgestell (die Mini-Filter enthält).
- Besorgen Sie sich einen Vorrat von Natriumhydroxid (NaOH) Perlen (20-40 mesh). Bringen Sie etwas NaOH auf einen kleinen Wägeschiffchen oder, wenn Feuchtigkeit Verklumpen verursacht, ein heißes Porzellanmörser als Arbeits Bestand an NaOH. Vermeiden Sie Klumpen von NaOH oder zerdrückt / pulverisierte NaOH Perlen verwenden.
Achtung: NaOH ist ein starkes Gift und korrosiven Basis. Flush ausgesetzt Haut / Augen mit Wasser für 15 min. Thorougreinigen hly die Werkbank nach dem Experiment abgeschlossen. - Mit einem kleinen Schaufel oder Spachtel, übertragen NaOH-Perlen aus dem Arbeits Lager der Mikrofuge Mini Filter mit NaOH zu füllen bis zum ersten äußeren Fase (~ 5 mm unter der Krempe). Tippen Sie auf die gefüllten Mikrofuge Filter auf der Bank-Top-Pack / kondensieren die NaOH-Perlen.
Hinweis: In diesem Experiment, übermäßige Wasseraufnahme durch hygroskopische NaOH - Perlen zu minimieren, halten die Höhe der zugesetzter Flüssigkeiten (zB Acetonitril, Dimethylsulfoxid, Analyt - Lösung) über die Oberfläche der Säulenpackung NaOH und begrenzen den direkten Kontakt mit der Luft. - Besorgen Sie sich einen Vorrat von Acetonitril (ACN). Transfer ~ 350 & mgr; l ACN zu jedem NaOH-packed Mikrofuge Mini-Filter. Halten Sie die NaOH unter ACN unter Wasser, und entfernen Sie große Luftblasen, indem sie mit einer Spitze gekräuselten Gel-Ladepipettenspitze gerührt wurde.
Achtung: Acetonitril ist ein brennbares reizend. - Spalte Zentrifugierung
- Ordnen Sie die Mikrofuge Spalten symmetrisch in einer Zentrifuge; verwenden, um eine Ausgleichsrohr, falls erforderlich. Vermeiden Sie verschütten keine NaOH-Granulat in der Zentrifuge. Schließen Sie den Zentrifugendeckel.
- Zentrifuge die Spalten (mit NaOH und ACN) für ~ 15 sec bei 2.400 x g.
- Nach Beendigung der Zentrifugation entfernen Mikrofuge Spalten aus der Zentrifuge und die ACN in einen gefährlichen Abfallbehälter entsorgen. Halten Sie die NaOH Spalte Verpackung intakt.
- In ~ 350 & mgr; l Dimethylsulfoxid (DMSO) zu jedem NaOH-packed Mikrofuge Mini-Filter. Halten Sie die NaOH unter DMSO unter Wasser und entfernen Sie alle großen Luftblasen mit einer Pipettenspitze. Wie zuvor Zentrifugensäulen für ~ 15 Sekunden bei 2.400 × g, beschrieben, und das DMSO zu verwerfen, während die NaOH halten Verpackung intakt.
Achtung: DMSO ist mutagen und reizend und wird leicht durch die Haut absorbiert. - Schließen Sie alle Mikrofuge Mini-Filter mit den Steckern in dem Spin-Filter enthaltenKit. Übertragen ~ 350 & mgr; l DMSO zu jeder NaOH-packed Mikrofuge Mini Filter und mit einem 200 ul Pipettenspitze Luftblasen in der NaOH Verpackung zu entfernen, so dass DMSO alle Regionen erreicht innerhalb dann NaOH Verpackung. Vermeiden Sie Quetschungen oder übermäßig die NaOH-Perlen Schaben; NaOH-Pulver ist unerwünscht. Beenden Sie den Schritt so schnell wie möglich.
- Herstellung von Plasma Qualitätskontrolle (QC) Probe (n)
Hinweis: Um konsistente Ergebnisse in experimentellen Chargen gewährleisten, sollten mindestens ein Aliquot einer Probe aus einem großen, homogenen Masse Sammlung des biologischen Materials von Interesse genommen Verwendung in jeder Charge analysiert werden. Wenn beispielsweise Blutplasma Analyse verwenden Aliquot (s) eines bulk Sammlung von Blutplasma als QC-Probe (n) in jeder Charge. Verfahren QC-Proben in der gleichen Weise wie unbekannten Proben.- Zentrifuge ein Lager Probe von QC Plasma für 4 min bei ~ 10.000 × g. Während der Zentrifugation einige hochdichte Niederschlag kann absetzen zu the Boden und einige niedriger Dichte Niederschlag an die Spitze des Plasmas schweben kann. Vermeiden Sie sowohl beim Entfernen Teilmenge (n) von Plasma.
- Fahren Sie mit "1.3) Probenvorbereitung" weiter unten. Kehren Sie dann zu diesem Schritt nach der Plasma Zentrifugation abgeschlossen ist.
- Ziehen Sie 9 ul zentrifugiert QC Plasma und übertragen sie auf einen entsprechend markierten 1,5-ml-Polypropylen-Teströhrchen mit einem Schnappverschlusskappe ausgestattet (im Folgenden bezeichnet als "1,5-ml-Plastik Reagenzglas"). 1 & mgr; l entsalztem Wasser zu jeder Teilmenge; falls gewünscht, verwenden diese als Träger für internen Standard (s).
- In 270 & mgr; l DMSO zu diesem Plasma Kontrolle. Vortex vollständige Auflösung zu gewährleisten.
- Probenvorbereitung
- Erhalten, wie viele 1,5-ml-Kunststoffteströhrchen als die Anzahl von biologischen (Analyt) Proben.
- Transfer 9 ul jeder biologischen (Analyt) Probe in das entsprechende 1,5-ml-Plastik Reagenzglas. Transfer 1 & mgr; l deionisiertes Wasser und 270 & mgr; l DMSO zu jedem Probenröhrchen.
- Gründlich mischen (zB Wirbel und / oder wiederholt Pipette nach oben und unten) die Proben , um eine vollständige Auflösung in DMSO.
Achtung: Führen Sie die folgenden Schritte innerhalb einer Abzugshaube. Verwendet in den folgenden Schritten Iodmethan (CH 3 I), Dichlormethan (CH 2 Cl 2, aka Methylenchlorid) und Chloroform (CHCl 3, Trichlormethan), sind flüchtige Flüssigkeiten lösen kann bestimmte Arten von Kunststoff (zB Nitrilhandschuhen) . Achten Sie darauf, lösemittelbeständige Handschuhe zu verwenden. Aufgrund ihrer geringen Viskosität und hohen Dampfdruck können diese Reagenzien aus einer Pipettenspitze während der Übertragung tropfen. Minimieren Reagenzienverlust und der möglichen Exposition durch die Stammlösung neben dem Aufnahmebehälter zu halten. - Bringen Sie eine ausreichende Gesamtvolumen von Iodmethan zu einem kleinen, sauberen Rohr. Jeder Analyt-Probe werden 105 & mgr; l Iodmethan erfordern. Transfer ~ 500 & mgr; l Dichlormethan in another sauberes Röhrchen. Um zu verhindern, Spritze Verstopfung, spülen Sie die Spritze mit Dichlormethan unmittelbar nach Iodmethan Übertragung.
Achtung: Iodomethane ist lichtempfindlich, flüchtig und wirksames Gift der Lage , das zentrale Nervensystem schädigen oder den Tod verursachen beim Einatmen oder Verschlucken. Dichlormethan ist ein potenzielles Karzinogen, reproduktive mutagen und potent Reiz Lage, mehrere Organe zu schädigen oder den Tod verursachen. - Verwenden Sie eine analytische Spritze 105 ul Iodmethan zu jeder Analyt-Probe hinzuzufügen. Cap Analyt Rohre sofort Iodmethan Verdunstung zu minimieren. Gründlich vortexen und, falls erforderlich, kurz zentrifugieren alle Proben, um sicherzustellen, dass keine Flüssigkeit in der Kappe verbleibt. Jede Farbwechsel (zB zu braun, lila oder gelb) signalisiert Iodmethan Abbau, die folgende Permethylierung Reaktion gefährden können.
- Spülen Sie die analytische Spritze zu übertragen Iodmethan mit Dichlormethan mindestens 3-mal verwendet wird. Dies verhindert, dass es from Verstopfung. Entsorgen Sie dieses Spülen, zusammen mit zusätzlichen Iodmethan und Dichlormethan in einem organischen gefährlichen Abfallgefäß. Platzieren Sie verwendet Reagenzgläser in einen gefährlichen Abfallbehälter.
- Erhalten Sie einen neuen Satz von 2-ml-Kunststoffbehälter Rohre. Entfernen Sie Snap-Kappen, falls gewünscht.
- Ziehen Sie die Mikrofuge Mini-Filter. Zentrifugieren Sie die unplugged Spalten für 15 Sekunden bei 2.400 × g, und entsorgen Sie dann den Behälter Röhren zusammen mit dem DMSO Abwasser.
- Re-Stecker, die zentrifugiert Spin-Säulen, und sie in den neuen Behälter Rohre legen. Anzahl jeder Spin-Säule und der entsprechenden Speicherrohr mit der gleichen Probennummer. Stellen Sie sicher, dass die Mini-Filterkerzen sind eng; potenzielle Leckage kann den nächsten Schritt auswirken. Minimieren Sie die Zeit DMSO aus den Spin-Säulen zwischen Entfernen und Übertragen der Analytenproben auf die Spin-Säulen.
- Permethylierung
- Quantitativ jeder Probenlösung in das entsprechende NaOH-Kügelchen gefüllt Mikrofuge Spin column. Verwenden Sie eine 1000-ul Pipettenspitze für diesen Schritt. Nach dem Transfer quetschen ~ 2 mm von dem Ende einer 200 ul Spitze und lassen Sie ihn in der Spalte Inhalt als Rührer zu verwenden. Wiederholen Sie dies für alle Proben.
Hinweis: Die niedrige Viskosität von Iodmethan kann Probenverlust verursachen , da der Analyt - Lösung aus der Pipettenspitze während der Übertragung tropfen kann. Halten Sie das Probenröhrchen und die Spin-Säule benachbart zueinander mit einer Hand, und schnell zu übertragen, die Probenlösung mit der anderen Hand. - Lassen Sie die Permethylierung Reaktion für 11 min, um fortzufahren. Rühren jeder Probe mindestens 4-5 mal während dieser Periode. Zur Erleichterung der effizienten Permethylierung, die an der Oberfläche von NaOH Perlen auftritt, verwenden Spitze gekräuselten Gel-Ladepipettenspitzen als Rührwerke, um sanft den Spalteninhalt mischen. Aggressive Mischen kann die Spinfilter durchlöchern, pulverisieren und suspendieren NaOH-Perlen (was die Wirksamkeit der nachfolgenden Flüssig / Flüssig-Extraktion reduzieren können) und / oder Probenverlust verursachen (wie die sample getränkten NaOH Granulat kann aus der Kolonne überlaufen).
- In Vorbereitung für die nachfolgende Flüssig / Flüssig-Extraktionsstufe, eine ausreichende Menge an 0,5 M Natriumchlorid (NaCl) -Lösung in einer 0,2 M Natriumphosphatpuffer (pH 7,0) vorbereitet, um bei Raumtemperatur gelagert werden. Jede Probe wird für alle drei Zyklen der Flüssig / Flüssig-Extraktion mit insgesamt ~ 12 ml NaCl-Lösung erfordern.
- Nach Abschluss der 11-min Permethylierung Zeitraum, sofort noch sorgfältig die Spalten ziehen und sie bei 2.400 × g für 15 Sekunden zentrifugiert werden. Entsorgen Sie die Stecker.
- Quantitativ jeder Probenlösung in das entsprechende NaOH-Kügelchen gefüllt Mikrofuge Spin column. Verwenden Sie eine 1000-ul Pipettenspitze für diesen Schritt. Nach dem Transfer quetschen ~ 2 mm von dem Ende einer 200 ul Spitze und lassen Sie ihn in der Spalte Inhalt als Rührer zu verwenden. Wiederholen Sie dies für alle Proben.
- Unmittelbar Spin-Säulen aus der Zentrifuge entfernen und sie in einen neuen Satz von leeren Spin Reservoir Röhren, also den Durchflußlösung Zurücklassung mit frisch permethyliertem Glykane. Sie nichts wegwerfen.
- So bald wie möglich, fügen Sie 300 ul Acetonitril (ACN) zu den trockenen, NaOH gefüllte Spinfilter. Zentrifugieren Sie die Spinfilter für 30 Sekunden bei 9.600 × g.
- immediately Danach übertragen die Haupt Permethylierung Lösung (dh die Lösung , die für 11 min mit NaOH - Perlen inkubiert wurde dann durch den Spinfilter in ein Zentrifugenröhrchen vor der Zugabe von 300 ul ACN in dem vorherigen Schritt versponnen) 13 x zu silanisiert 100 mm Glasteströhrchen 42 , enthaltend 3,5 ml 0,2 M Natriumphosphatpuffer , enthaltend 0,5 M NaCl, pH 7,0 und mischen (Vortex) sofort. Vermeiden Sie jede feste weiße Rückstand bei diesem Schritt zu übertragen. Tun Sie dies für jede Probe, bevor mit dem nächsten Schritt fortfahren.
- Ohne Verzögerung, Transfer (kombinieren) die ACN-Spin-through in jedem Reservoir Rohr (mit) den Rest der flüssigen Probe in ihrem jeweiligen silanisierten Glasrohr und mischen (Vortex) sofort. Wieder vermeiden bei diesem Schritt alle festen weißen Rückstand zu übertragen. Cap, schütteln und Wirbel das Glasrohr. Wiederholen Sie für jede Probe. Entsorgen Sie die NaOH Spalten und Pasteurpipetten in geeigneten Abfallbehälter.
- Flüssig / Flüssig - Zusatzction und Glycan Reinigung
- Im Inneren der Abzugshaube, fügen Sie 1,2 ml Chloroform zu jeder Probe. Unmittelbar danach wird die Kappe die silanisierten Glasrohre und energisch um den Inhalt zu mischen.
- Vorheizen Metallblöcke auf etwa 75 ° C in eine Verdampfungs mannigfaltig. Verwenden Sie Heizblöcke mit Brunnen, die die 13 mm × 100 mm Glasröhrchen aufnehmen können.
- Erhalten Sie einen neuen Satz von silanisierte Pasteurpipetten, nicht-silanisierte Pasteurpipetten und silanisierten Glasröhrchen mit Kappen.
Achtung: Chloroform (CHCl 3) ist ein Reizmittel , mutagen und potentielle Karzinogen der Lage , durch einige Arten von Handschuhen durchdringt. - Kurz Zentrifuge (~ 3000 × g) Probe enthaltenden Glasröhrchen, die wässrigen und organischen Schichten zu trennen.
- Verwenden Sie eine nicht-silanisierte Pasteurpipette so genug von der oberen wässrigen Schicht zu extrahieren, dass ~ 3 mm der wässrigen Schicht über dem Boden organische Schicht bleibt.
- Fügen 3,5 ml der 0,5 M NaCl-Lösung in einem 0,2 M Natriumphosphatpuffer (pH 7) zu jedem Glasrohr, kräftig zu mischen und kurz zentrifugieren (~ 3000 × g). Wie in der vorherigen Stufe (1.4.3), verwenden eine nicht silanisierte Pasteur pipette die wässrige Schicht zu extrahieren.
- Wiederholen Sie den vorherigen Schritt (1.4.4), aber lassen Sie ~ 1 ml der wässrigen Schicht.
- Verwenden Sie ein sauberes silanisierte Pasteurpipette die organische Schicht auf eine saubere und in geeigneter Weise silanisiert 13 × 100 mm Teströhrchen aus Glas beschriftet zu übertragen. Vermeiden wässrige Verunreinigung durch in der folgenden Weise zu extrahieren:
- Halten Sie sowohl die aktuellen und neuen silanisierten Glasröhrchen nebeneinander liegen in einer Hand. Mit der anderen Hand drücken Sie die Pipettenküvette Blasen zu erzeugen, während die Pipette nach unten durch die wässrige Schicht eingeführt wird.
- Einmal in der organischen Schicht, stoppen Blasen zu schaffen, und halten Sie die Pipettenküvette steady die organischen und wässrigen Schichten zu ermöglichen, wieder zu stabilisieren und zu trennen. Dann lassen Sie langsam die Lampe so viel von der organi zurückzuziehenc Schicht möglichst ohne wässrige Kontamination.
- Schnell erhöhen durch die wässrige Schicht, welche die Pipettenspitze, und widerstehen der natürlichen Reflex leicht die Birne Freigabe (die in Abziehen etwas wässrigen Kontamination führt), während die Pipette aus der Röhre zu erhöhen.
- Schnelle Übertragung von den niedrig viskosen organischen Schicht mit dem benachbarten neuen Schlauch. Jede wässrige Verunreinigung wird als kleine Flüssigkeitströpfchen auf der Oberseite der extrahierten organischen Schicht in den neuen Glasrohren sichtbar. Wenn Wasser / NaCl Kontamination sichtbar ist, entfernen Sie sie mit einer Pipette; Zentrifuge, wenn nötig, um die Wassertröpfchen in einem einzigen Tropfen zu bündeln.
- Entsorgen Sie alte Glasröhrchen, Pipetten und wässrigen und organischen Abfalllösungen. Waschen und Glasrohr Kappen recyceln.
- Trocknen Sie alle Proben unter einem leichten und konstanten Strom von Stickstoff in einem vorgewärmten Verdampfungs mannigfaltig bei 75 ° C für ca. 5 min in einem Abzug durchführen. Um sicherzustellen, Verdunstungskühlung bei allen trockenen Nieder steps, eine sanfte und konstanten Strom von Stickstoff muss die Flüssigkeitsoberfläche ohne zu spritzen oder Verspritzen der Flüssigkeit stören. Entfernen Proben aus dem Verdampfungs Verteiler nach vollständiger Trocknung der Endproben. Weiße Flecken an der Unterseite eines getrockneten Glasröhren zeigen Puffer / NaCl Kontamination.
- Pause hier das Verfahren, wenn es nicht genug Zeit, um in den Tag noch die TFA Hydrolyse Schritt abzuschließen. Vorübergehend (dh über Nacht) trocken lagern Proben bei -20 ° C. Um das Verfahren nach der Lagerung weiter, entfernen Sie die Proben aus dem -20 ° C Gefrierschrank und lassen Sie sie vor dem Aufdecken vollständig erwärmen.
- Während Proben warm, solche in Vorbereitung für Trifluoressigsäure (TFA) Hydrolyse (nächste Stufe), den Heizmantel eingestellt, daß die Temperatur der Flüssigkeit Retorteninhalt werden 121 ° C erreichen. Bereiten Sie die TFA-Lösung von TFA Lager (siehe 2.1 unten Schritt).
2. Trifluoressigsäure (TFA) Hydrolyse
Achtung: Trifluoressigsäure (TFA) ist eine ätzende organische Säure und toxische reizend.
- Eine ausreichende Menge einer 2,0 M TFA-Lösung in entionisiertem Wasser. Jeder Analyt-Probe wird 325 & mgr; l von 2,0 M TFA-Lösung benötigen. Konzentrierte TFA ist 13,0 M.
- In 325 & mgr; l von 2,0 M TFA zu jeder Analyt-Probe. TFA Verdampfung und Probenverlust während des anschließenden Trocknungsschritt (2.3) fest verschließen jedes Probenröhrchen sofort nach der Zugabe von TFA zu verhindern. Markieren Sie die Lösungsebene in allen Glasröhren. Vortex jede Probe gründlich vor dem nächsten Schritt.
- Inkubieren Sie die fest verschlossenen Probenröhrchen für 2 Stunden in einem geeigneten vorgeheizten Heizblock oder Ofen, so dass der Inhalt eine Temperatur von 121 ° C erreichen. einen Heizblock anstelle eines Ofens, Abdeckung Probenröhrchen mit Aluminiumfolie zur Vermeidung von Kondensation der TFA am oberen Ende des Rohres und teilweise Trocknung der Probenrückstand an der Unterseite des Rohres bei Verwendung. Überprüfen Sie die Probenlösung Ebenen nach 20-30 min.minimal TFA Verdampfung zu gewährleisten. Falls erforderlich, ziehen Sie die Kappen weiter oder ersetzen Kappen für einen festeren Sitz.
- Während der 2-stündigen Wartezeit eingestellt andere Verdampfungsverteiler auf 75 ° C für den nächsten Schritt (siehe 2.4 unten).
- Wenn die 2-Stunden Heizperiode abgeschlossen ist, trockene Proben bei 75 ° C unter einem leichten Strom von Stickstoffgas für ~ 15 min. Lassen Sie keine Proben für mehr als 15 Minuten unbeaufsichtigt. Prüfen Sie regelmäßig Proben und beenden Erhitzen und Trocknen, wenn alle Proben trocken sind.
- Pause das Verfahren hier, wenn es nicht genug Zeit, um in den Tag noch die Reduktionsschritt zu vervollständigen. Vorübergehend (dh über Nacht) Proben bei -80 ° C. Um das Verfahren nach der Lagerung weiter, entfernen Sie die Proben aus dem -80 ° C Gefrierschrank und lassen Sie sie vor dem Aufdecken vollständig erwärmen.
3. Reduzierung
- Innerhalb einer Abzugshaube, bereiten eine ausreichende Menge einer 10 g / l Natriumborhydrid (NaBH 4) Lösung in 1 M Ammonium Hydroxid (NH 4 OH). Jede Probe wird 475 ul dieser Lösung erforderlich. Machen Sie eine frische Lösung für jede Charge von Proben. Konzentriertes Ammoniumhydroxid (27-30% w / w NH 3) etwa 14,5 M.
Achtung: Natriumborhydrid (NaBH 4) ist ein hygroskopisch, mit Wasser reagierend Toxin und potente reizend , dass Freisetzungen-bei Kontakt mit Wasser leicht entzündlich Dämpfe , die schwere Verbrennungen beim Einatmen, Verschlucken oder Augen- / Hautkontakt möglich.
Achtung: Ammoniumhydroxid (NH 4 OH) ist eine ätzende reizend und Toxin Lage verursacht schwere Verbrennungen und irreversiblen Organschäden beim Einatmen, Verschlucken oder Augen- / Hautkontakt. Spülen Sie den betroffenen Gebieten mit Wasser für 30 Minuten, und verhindern, dass das Opfer durch Reiben oder die betroffenen Gebiete zu zerkratzen. - Zu jeder Probe, fügen 475 ul der 10 g / l NaBH 4 in 1 M NH 4 OH. Mischen Sie die Proben gründlich irgendwelche Rückstände zu lösen. Cap Reagenzgläsern undermöglichen die Reduktionsreaktion für 1 h fortzusetzen.
- Während der 1-stündigen Wartezeit, stellen Sie den beheizten Verdampfungsverteiler auf 75 ° C. Verwenden Sie einen Heizblock mit geeigneten Vertiefungen für die Glasrohre (siehe 3.4 unten).
- Wenn der 1-stündigen Reaktionszeit abgeschlossen ist, fügen Sie 63 ul Methanol (MeOH) zu jeder Probe. Dieser Schritt und der nachfolgende Schritt Rest Bor als Trimethylborat zu entfernen - eine relativ flüchtige Flüssigkeit, die bei 68 ° C siedet.
- Trockenproben (in den vorgeheizten Verteiler) bei 75 ° C unter einem leichten Stickstoffstrom für ~ 15 min. Überprüfen Sie regelmäßig Proben und sie nicht unbeaufsichtigt lassen. Kleine Flüssigkeitströpfchen an der Unterseite der Glasrohre zeigen an, daß die Probe noch nicht trocken ist.
Hinweis: Um die Luftblasen aus Flüssigkeitströpfchen, kippen Sie das Reagenzglas unterscheiden. Nur Flüssigkeitströpfchen werden nach Kippen bewegen, aber das Gegenteil ist nicht immer wahr: wenn eine Blase sich nicht bewegt, kann es noch eine (sehr kleine) Flüssigkeitstropfen sein. - Sobald samples vollständig trocken sind, eine 9 vor: 1 (v / v) Lösung von Methanol (MeOH) und Essigsäure (AcOH). Hinzufügen 125 ul dieser MeOH: AcOH-Lösung zu jeder Probe.
- Trockenproben (in einem vorgewärmten Verteiler) bei 75 ° C unter einem leichten Stickstoffstrom.
- Wenn die Proben vollständig trocken sind, Vakuum-Trocknung, die Proben für 20 Minuten bei Raumtemperatur: Platz Proben in eine Kunststoff-Vakuum-Wanne (wie die von Foodsaver verkauft), die Vakuumdeckel schließen, stellen Sie das Vakuum-Wahlrad auf "Vakuum", verbinden die Vakuumschlauch, und schalten Sie das Vakuum. Um das Vakuum zu zerlegen, Reverse diese Schritte. Warten Sie auf das System vollständig zu dekomprimieren, bevor Sie den Vakuumdeckel zu öffnen.
- Pause das Verfahren hier, wenn es nicht genug Zeit, um in den Tag noch die Reduktionsschritt zu vervollständigen. Vorübergehend (dh über Nacht) Proben bei -80 ° C. Um das Verfahren nach der Lagerung weiter, entfernen Sie die Proben aus dem -80 ° C Gefrierschrank und lassen Sie sie vollständig, bevor uncappin erwärmenG.
- Während des Wartens auf Proben-Trockensauger (oder warm, nach der Lagerung), die Reagenzien für den nächsten Schritt vorzubereiten. Erhalten und Nummer ein silanisiertes Spitzbodenautosampler (AS) Fläschchen (mit Kappe) für jede Probe. Darüber hinaus Vorheizen sowohl eine flache Vertiefungen AS-Phiole Heizblock und eine Deep-Well-Glas-Rohrblock, so dass die Glasröhre Inhalt wird eine Temperatur von 50 ° C erreichen.
4. Die Acetylierung (Ausgeführt in einer Abzugshaube)
- In 18 ul jeder Probe entsalztes Wasser. Cap und gründlich alle Röhrchen verwirbeln, um vollständig alle Niederschläge aufzulösen.
- In 250 ul Essigsäureanhydrid zu jedem Glasröhrchen. Cap, gründlich Wirbel und beschallen in einem Wasserbad für 2 Minuten zur vollständigen Auflösung von Rückständen und Ausscheidungen zu gewährleisten.
- Decken Sie Glasrohre mit Aluminiumfolie, und Inkubation bei einer Innentemperatur von 50 ° C für 10 min.
- Hinzufügen, 230 & mgr; l konzentrierte Trifluoressigsäure (TFA) zu jeder Probe. Unmittelbar Kappe eind die Proben mischen. Dann inkubieren Proben-bedeckt mit Aluminiumfolie für 10 min bei einer Innentemperatur von 50 ° C.
- Nach der Inkubation fügen 1,8 ml Dichlormethan (CH 2 Cl 2) zu jeder Probe. Cap und gut mischen.
- In 2,0 ml entsalztes Wasser zu jeder Probe. Cap und Proben gut mischen. Zentrifuge von 0 bis 3.000 × g zur Trennung der Schichten. Verwenden Sie eine nicht-silanisierte Pasteurpipette Flüssig / Flüssig-Extraktion durchzuführen, wie in Schritt 1.4.6 skizziert, Wasserverschmutzung zu vermeiden.
- Wiederholen der Extraktion noch einmal, für insgesamt zwei Extraktionen. Verwenden Sie silanisierte Pasteurpipetten die organische Schicht in etikettierte zu übertragen , wie Fläschchen silanisiert (sicher in einem AS - Rack gehalten). Füllen Sie die AS Fläschchen bis knapp unter den Rand.
- Verwenden Sie einen vorgeheizten, flachen Vertiefungen Heizblock auf trockenen Proben (in Ampullen) für 15 min bei 40 ° C unter Stickstoffgas. Geben Sie nicht zu trocken. Endprodukte werden als teilweise methylierte Alditolacetate (PMAAs) bekannt.
5. Gaschromatographie - Massenspektrometrie (GC-MS)
- Rekonstitution jede Probe in 100 ul Aceton und gut mischen. Verwenden Sie ein Autosampler 1 ul jeder Probe im Split-Modus in den GC-Split-Modus Liner zu injizieren (gehalten bei 280 ° C, mit einer kleinen Stecker von silanisierter Glaswolle). Verwenden, um ein Teilungsverhältnis von 40. Verwendung von Helium als Trägergas in konstanter Strömungsmodus bei 0,8 ml / min durch eine 30 m DB-5 ms GC-Säule mit einem 0,25 mm ID und 0,25 um Filmdicke.
- Halten Sie die anfängliche GC-Ofentemperatur bei 165 ° C für 0,5 min. Nach der ersten Haltezeit, Programm der Ofen die Temperatur, Rampe, für jeden Durchlauf von 165 ° C bis 265 ° C mit einer Geschwindigkeit von 10 ° C / min (die 10 min dauert) und dann sofort Rampe die Temperatur 265 ° C bis 325 ° C mit einer Rate von 30 ° C / min (die 2 min dauert) und die Temperatur bei 325 ° C für 3 min halten. Die Gesamtlaufzeit pro Probe beträgt 15,5 min.
- Verwenden Sie ein Profiperly abgestimmt und aus der GC-Säule eluiert Massenspektrometers zu unterziehen, die Probenbestandteile zu kalibrierenden Elektronenionisation (EI, 70 eV bei 250 ° C). Für einen TOF - Massenanalysator, analysieren Fragmente von m / z 40 bis m / z 800 mit einem 0,1-Sekunden - Impuls Summenrate. Legen Sie ein EI-Glühfaden Lösungsmittel Verzögerungszeit von 2,5 min.
6. Datenanalyse
- Wenn ein TOF-Massenanalysator verwenden, ergibt die Summe der am häufigsten vorkommende und / oder diagnostische Fragmentionen für jeden PMAA durch einen Massenfenster von 0,15 Da die Anwendung eines extrahierten Ionenchromatogramms zu erhalten. Zielionen für jede PMAA wurden an anderer Stelle veröffentlicht, 33 aber die folgenden Änderungen vorgenommen wurden: t-Glc - Ionen sind jetzt 145,1 + 205,1; 2-Man-Ionen sind 161,1 + 189,1; 3-Gal-Ionen sind 161,1 + 233,1, 6-Gal-Ionen sind 161,1 + 189,1 + 233,1; 2,6-Man-Ion ist 189,1; 3,6-Man-Ionen sind 189,1 + 233,1.
- Verwenden Sie QuanLynx oder andere Software, um automatisch Spitzenbereiche integrieren für jede summierte Ionenchromatogramms extrahiert.
- Sie manuell die Integrationsergebnisse überprüfen, indem jeder integrierten extrahiert Ionenchromatogramms sehen. Dann exportieren Sie die Peak-Integration Daten in eine Tabelle für die weitere Analyse und Datennormalisierung, die durch die Summe aller Hexose XIC Bereiche der Fläche jedes einzelnen Hexose XIC beinhaltet teilt; Ebenso ist die Fläche jeder einzelnen HexNAc XIC durch die Summe aller HexNAc XIC Bereiche unterteilt. Dieses Verfahren erzeugt normalisierten Abundanzen für jede einzelne Hexose und HexNAc.
Ergebnisse
Ein Gesamtionenstrom - Chromatogramm (TIC) zeigt erfolgreiche Permethylierung, Hydrolyse, Reduktion und Acetylierung von menschlichem Blutplasma - Proben in Bezug auf Fälle , in denen zwei kritische Permethylierung Schritte falsch ausgeführt wurden , sind in Abbildung 3 dargestellt.
Absolute Ausbeute an HexNAcs Bezogen auf Hexosen:
N -acetylhexosamine (HexNAc) teilmethylierte Alditolacetate (PMAAs) sind in der Regel niedrigere Ausbeute zu haben , als Hexosen. 43 Um die absolute Ausbeute an HexNAcs relativ zu Hexosen schätzen, sechs 10-ug - Proben von N -acetyllactosamine (a Gal1-4GlcNAc Disaccharid) in 10 & mgr; l Wasser wurden analysiert. TIC Peakflächen für terminale Galactose (t-Gal) und 4-GlcNAc wurden integriert. Der Prozentsatz von 4-GlcNAc, bezogen auf die Gesamtmenge an t-Gal-GlcNAc und 4 betrug 11,3 ± 0,7%(SEM). Obwohl HexNAc Ausbeuten die Tatsache reproduzierbaren (siehe unten) sind, dass dieser Wert ist viel geringer als der theoretische Wert von 0,5 zeigt an, dass die Ausbeute an HexNAcs als die von Hexosen grundsätzlich geringer ist. (Die HexNAc theoretische Ausbeute beträgt 0,5 weil N -acetyllactosamine eine 1:. 1 Hexose-HexNAc Disaccharid)
Intra- und Inter Reproduzierbarkeit:
Intra- und Inter Reproduzierbarkeit für alle Glykan Knoten mindestens 1% des gesamten Hexose oder HexNAc Signal beitragen , sind in Tabelle 1 zur Verfügung gestellt. Diese Daten wurden durch 3 separate Analysten auf 3 verschiedenen Tagen erworben, das gleiche Lager von EDTA - Plasma verwendet wird . Autosampler Stabilitätsdaten im Rahmen dieses optimiertes Protokoll für die 18 am häufigsten vorkommenden Glykan Knoten im menschlichen Plasma (dh solche mit> 1% des gesamten Hexose oder HexNAc Signal) sind in Abbildung 4 vorgesehen.
Andere Bekannte Beobachtungen:
Während die Permethylierung Methodik Optimierung fanden wir, dass es nicht notwendig ist, die Adsorption von Wasser durch die NaOH-Perlen zu verhindern, vor dem Waschen mit Acetonitril initial. Wir fanden auch, dass die Anwesenheit einer kleinen Menge Wasser in der letzten Acetylierungsschritt in Kombination mit einer kurzen Periode des Erwärmens mit Essigsäureanhydrid ohne TFA hilft, eine vollständige Reaktion zu ermöglichen. Schließlich ist die hohe Auflösungsvermögen der Time-of-Flight (TOF) Massenspektrometrie nicht notwendig für eine erfolgreiche Glykan Knotenanalyse: Erste Ergebnisse basierend auf parallelen Injektion des gleichen Satzes von Proben auf einem GC-TOF-MS und einem traditionellen Übertragung Quadrupol -basierte GC-MS in ausgewählten Ion-Monitoring betrieben (SIM) Modus zeigen ähnliche Ergebnisse hinsichtlich der endgültigen normalisierten Hexose und HexNAc relativen Häufigkeiten.
er.within-page = "1"> 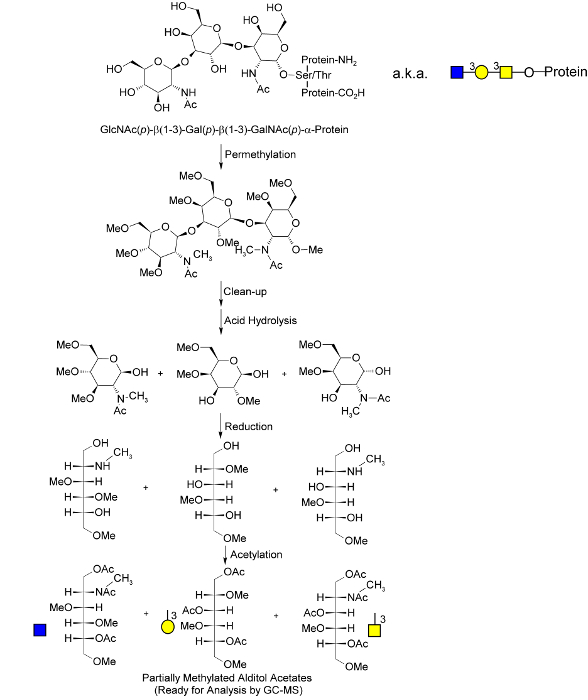
. Abbildung 1. Molekül Überblick über den globalen Glykan - Methylierungsanalyse Verfahren Ein O -verknüpftem Glykan dargestellt ist ; Diese werden während des Permethylierung freigesetzt, die von Goetz angepasst wurde. 40 Nach Permethylierung und Hydrolyse, Monosacchariden reduziert und im Entstehen begriffenen Hydroxylgruppen "markiert" durch Acetylierung. Das einzigartige Muster der Methylierung und Acetylierung in den letzten partiell methylierten Alditolacetate (PMAAs) entspricht der einzigartigen "Glycan - Knoten" in dem ursprünglichen Polymer intakt und stellt die molekulare Basis für die Trennung und Quantifizierung durch GC-MS. N -verknüpften und Glycolipid - Glycane werden als Verknüpfung markierte Monosaccharide bei der sauren Hydrolyse freigesetzt. Angepasst von Borges et al. 33 mit freundlicher Genehmigung.> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Konzeptübersicht des Analysekonzept. Ein hochregulierten Glycosyltransferase (zB GnT-V) bewirkt eine Erhöhung der Menge eines spezifischen, eindeutig verknüpft Glykan Monosaccharidrest (eine 2,6-verknüpfte Mannose "node" in diesem Beispiel) -Welches, durch die nachfolgende Wirkung anderer Glycosyltransferasen können bei niedrigen Kopienzahl zur Bildung einer Mischung von heterogenen Ganz Glykanstrukturen führen each-von denen alle schwierig sein kann, zu erkennen und in routinemäßig quantifizieren. ein direkter Surrogat-Messung von GnT-V-Aktivität als eine einzelne intakte Glykan Pooling Analytisch zusammen, um die "Glykan Knoten" aus unter allen anomalen Glykanstrukturen bietet. Simultane Messung von N -, O - und verknüpfte Lipid "glyc ein Knoten "in ganzen Gewebeproben , wie hier beschrieben (und ursprünglich an anderer Stelle 33) stellt eine konzeptionell neue Mittel , mit dem Glycan-affektiven Erkrankungen zu erkennen und zu überwachen, wie Krebs. Die tatsächlichen extrahiert Ionenchromatogrammen von 10 Mikroliter Blutplasmaproben gezeigt. Zahlen neben Monosaccharidreste in Glykanstrukturen zeigen die Position , an der der höhere Rückstand mit dem unteren Rückstand verknüpft ist. Wenn keine Verknüpfungspositionen im Chromatogramm Annotation angezeigt sind der Rest entweder in der terminalen Position oder frei in Lösung (zB Glukose). Alle Reste . außer Link Sialinsäure nach unten über ihre 1-Position; Sialinsäure Links nach unten über seine 2-Position Split im Chromatogramm zeigt in extrahierten Ionenchromatogrammen Änderung: m / z 117 +129 für Hexoseresten und m / z 116 + 158 für N - Acetylhexosamine (HexNAc) Rückstände. Angepasst von Borges et al. 33 mit freundlicher Genehmigung.61 / 53961fig2highres.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Repräsentative Ergebnisse. Gesamtionenstrom - Chromatogramm (TIC) für Glykan Knotenanalyse des gleichen menschlichen Blut EDTA - Plasmaprobe in denen A) die Probe korrekt verarbeitet wurde, B) der weiße Rückstand in der Permethylierung Lösung , die durch die NaOH versponnen Säule wurde für die Flüssig / Flüssig Extraktion in der nachfolgenden Gemisches, und c) die Permethylierung Lösung , die durch die NaOH - Säule wurde zu dem Phosphatpuffer , aber nicht gründlich gemischt vor der Zugabe von Chloroform für die Flüssig / Flüssig - Extraktion versponnen wurde. Legende zur Verfügung gestellt in Abbildung 2. Bitte klicken hehe eine größere Version dieser Figur zu sehen.

Abbildung 4. Autosampler Stabilität. Autosampler Stabilität über 48 Stunden für die 18 am häufigsten Glykan Knoten in menschlichem Plasma. Bei 22 Stunden wurde die Probe vollständig getrocknet und in 120 ul Aceton rekonstituiert. Jeder Cluster von Datenpunkten repräsentiert vier aufeinanderfolgende Injektionen der gleichen Probe. Schwarze Linien umfassen ± 15% des durchschnittlichen normalisierten Wert für jeden Glykan Knoten. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Tabelle 1. Intra- und Inter Reproduzierbarkeit. Die Werte repräsentieren% CV von insgesamt Hexose oder insgesamt HexNAc-normalisierten einzelnen Glycan - Knoten. Alle Glykan Knoten mindestens 1% des Gesamt Hexose oder HexNAc Signal beitragen aufgeführt. Die Daten wurden durch 3 separate Analysten auf 3 verschiedenen Tagen erworben, das gleiche Lager von EDTA-Plasma verwendet wird. N = 6 Proben pro Charge. Bitte hier klicken , um diese Tabelle als Excel - Tabelle zum Download bereit .
Diskussion
Im Allgemeinen ist die erfolgreiche Herstellung von partiell methylierten Alditolacetate (PMAAs) von Hexosen behaftet mit weniger Schwierigkeiten und ist robuster als die erfolgreiche Produktion von N -acetylhexosamine (HexNAc) PMAAs. Der genaue Mechanismus hinter diesem Phänomen , wie es in jedem Schritt dieses Verfahrens abspielt ist unbekannt, aber die einzigartige Chemie der N - acetyl - Gruppe beziehen muss ( und nicht Hydroxylgruppe), die Hexosen zu HexNAcs relativ einzigartig ist. Der Mechanismus hinter diesem Phänomen , wie es saure Hydrolyse bezieht , wird an anderer Stelle erklärt. 43 Kurz gesagt, für die Fähigkeit , die N -methylacetamido positiv während der sauren Hydrolyse geladen zu werden macht die glycosidische Bindung resistent gegen saure Hydrolyse. Das erklärt die geringe Ausbeute an HexNAc relativ zu Hexose (11,3% der gesamten HexNAc + Hexose Signal, eher als 50% der Gesamtmenge) , wie für die Analyse von N -acetyllactosamine oben beschrieben. Bemerkenswert ist, diese relativ lower Ausbeute von HexNAcs macht sie nicht schwierig in komplexen biologischen Flüssigkeiten und Geweben zu erfassen, oder ausschließen leichte Erfassung von Glycan Knoten abgeleitet von großen, komplexen Glykane (zB 2,4-Man, 2,6-Man, 3,4,6 -man und 3,4-GlcNAc, Abbildung 2). 33 in Anbetracht der Art und Weise, XIC Peakflächen von Glycan Knoten normiert sind (Schritt 6.3), so lange wie die relative Ausbeute jedes einzelnen HexNAc konsistent bleibt im Verhältnis zu anderen HexNAcs ( was es tut, siehe Tabelle 1), nützliche Informationen über die relativen Mengen der verschiedenen HexNAcs zwischen verschiedenen Proben erhalten werden können. Dies gilt sowohl für Hexosen als auch wahr. Darüber hinaus haben wir früher gezeigt , dass die Verhältnisse von Hexosen zu HexNAcs konsistente quantitative Verhalten zeigen auch 33 - ein Phänomen , das kontinuierlich durch den Einbau von QC Probe überwacht (s) in jeder Charge.
Die Art und Weise, in der Permethylierung durchgeführt wird, hat den größten Einfluss aufdie Gesamtausbeute und Reproduzierbarkeit der HexNAc PMAAs. Insbesondere sollte große Sorgfalt darauf verwendet werden, Exposition von permethylierter Glykane vollständig zu vermeiden wässrigen Bedingungen zu alkalisch. Zwei Schlüsselschritte in dieser Hinsicht sind 1) verlassen alle weißen Niederschlag in den Spin-through Lösungen hinter (Schritte 1.3.13 und 1.3.14) und 2) unmittelbar Mischen der spin-Lösungen durch, wenn sie zu dem Phosphatpuffer zugegeben werden ( Die Schritte 1.3.13 und 1.3.14). Ein Puffer anstatt einfache Salzlösung wird in diesem Stadium und für die nachfolgende Flüssig / Flüssig-Extraktionsschritten zur Verhinderung versehentlichen Alkalisierung der wässrigen Lösung enthalten. Wir vermuten, daß unter alkalischen Bedingungen die Acetylgruppe des methylierten und acetylierten 2-Aminogruppe HexNAcs Hydrolyse unterzogen werden, was zu einem stärker polaren sekundären Amin, das die Gesamtextraktionseffizienz des zugehörigen Glycan in Chloroform abnimmt.
Die am leichtesten erkennbaren Merkmal erfolglos permethyliertem HexNAcs istdie Intensität der 4-linked GlcNAc (4-GlcNAc) chromatographischen Peaks relativ zu denjenigen von 6-Gal, 3,6-Man, und die Basislinienintensität des Hintergrunds während der letzten Spalte bake-out (Abbildung 3). Wenn die absolute Häufigkeit des 4-GlcNAc PMAA niedrig ist, neigt seine normalisierten Fluss relativ zu allen anderen HexNAcs auch mit einem gleichzeitigen Anstieg (am deutlichsten) 3,4-GlcNAc niedrig zu sein.
Einige Änderungen ausgelegt Gesamtausbeute und Assay - Robustheit zu optimieren wurden unsere ersten Veröffentlichung der Beschreibung dieser analytischen Ansatz, seit 33 Eine dieser Änderungen die Art und Weise ist , in der die integrierte extrahiert Ionenchromatogrammen (XICS) normalisiert werden . Aus Gründen der Einfachheit, teilen wir nun die Fläche jedes einzelnen Hexose XIC durch die Summe aller Hexose XIC Gebieten; Ebenso ist die Fläche jeder einzelnen HexNAc XIC durch die Summe aller HexNAc XIC Bereiche unterteilt. Wie in Tabelle 1, insgesamt Interassay- / inter-Analyst gesehen reproducibilkeit für alle Glykan Knoten, die zu> 1% ihres jeweiligen Hexose oder HexNAc Signalmittelwerte 13% CV beitragen.
Unseres Wissens ist dies die einzige Inkarnation wirklich Bottom-up-glycomics in denen Glykane zuerst abgebaut werden und dann ihre Komponenten analysiert, um eine quantitative Probe weiten Porträt Glykan Zusammensetzung zu konstruieren. Hier kann anstelle der traditionellen enzymatische Freisetzung, die Permethylierung Prozess nicht reduktiv eliminiert (Releases) O -linked Glykane von ihren jeweiligen Proteine, 40 , während N Glykane -verknüpftem während saure Hydrolyse freigesetzt. 33 Als ergänzende Ansatz der traditionellen Top-down - glycomics dieser Ansatz ist in der Lage einzigartige Glykan Merkmale von Interesse wie "Kern Fukosylierung", "6-Sialylierung" zu bündeln ", bisecting GlcNAc" und "beta 1-6 Verzweigung" in einzelne analytische Signale (siehe 4,6-GlcNAc , 6-Gal, 3,4,6-Man und 2,6-Man Knoten in 2, RESPEctively). In der traditionellen Ansätze Top-down - Funktionen wie diese , die letztlich abhängig von den einzigartigen Aktivitäten von einem oder zwei Schlüssel Glycosyltransferasen 33 sind in der Regel über Dutzende von intakten Glykane verteilt und kann manchmal schwierig oder unmöglich sein (zB zu lösen, 3-Sialylierung vs. 6-Sialylierung) aufgrund der Degeneration von einigen intakten Glykan Massen. Darüber hinaus hat der Bottom-up - Ansatz , der hier präsentierten anfänglichen Versprechen demonstriert in nicht-invasiv Lungenkrebs zu erkennen. 33 Weitere Studien sind im Gange , diese ersten Ergebnisse zu validieren, sowie weitere, noch nicht veröffentlichten Ergebnisse zum Nachweis von anderen Formen von Krebs gehören.
Die größte Einschränkung des hier beschriebenen Ansatz ist, dass es in Bezug auf ihre Nachweisgrenzen eingeschränkt ist, wenn sie angewendet werden sollten, um vorisolierten Glykoproteine. Basierend auf nicht veröffentlichten Analysen einzelner Glycan Standards ohne Trägerprotein, Grenzen der Quantifizierung for einzelne Glykane erscheinen im niedrigen Mikrogramm Bereich zu liegen. Dies sind keineswegs gering LOQs in absoluten Zahlen, aber diese Tatsache keine Rolle spielt im Hinblick auf die ursprünglich beabsichtigten Umfang der Assay, die nicht ausgelegt und hat keine Notwendigkeit niedrigen LOQs zu erreichen (zumindest für die Zwecke hier beschrieben und in unserer früheren Veröffentlichung 33). In der Tat enthält menschliche Plasma / Serum - Glykoproteine in den 10s von mg / ml Konzentrationsbereich-was bedeutet , dass für die Analyse von Blut Plasma / Serum nur wir ~ 1/100 des endgültigen Probenvolumen injizieren und geteilt 40 von 41 Teilen dass kleine Menge in der GC Injektorport zu verschwenden. Ohne diese Praxis können einige der Glycan-Knoten den Detektor sättigt. Picomol Mengen von Glykoproteinen, die ausreichend intakt Glykan Signale durch herkömmliche Top-down-MALDI-MS oder LC-MS basierte Ansätze erbringen, können nicht mit diesem Ansatz nachgewiesen werden. Eine weitere Verfeinerung der Methodik ist im Gange, diese Beschränkung zu beseitigen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by the College of Liberal Arts and Sciences of Arizona State University in the form of laboratory startup funds to CRB. It was also supported by a grant from Flinn Foundation (Grant No. 1977) and by the National Cancer Institute of the National Institutes of Health under Award Number R33CA191110. JA was supported by the National Institute of General Medical Sciences of the National Institutes of Health Postbaccalalureate Research Education Program (PREP) under award number R25GM071798. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Sodium hydroxide beads | 367176 | Sigma-Aldrich | 20-40 mesh, reagent grade 97% |
| 0.9 ml Spin column | 69705 | Pierce division of ThermoFisher Scientific | Includes plugs and polyethylene frits |
| GC-MS autosampler vial (silanized)* | C4000-9 | ThermoFisher Scientific | Target DP High Recovery Vial, 1.5 ml, 12 mm x 32 mm, includes Teflon-lined pierceable caps |
| 1.5 ml polypropylene test tubes | 05-402-25 | ThermoFisher Scientific | Snap-cap lid |
| 2 ml polypropylene test tubes | 05-408-138 | ThermoFisher Scientific | Snap-cap lid |
| Dimethyl Sulfoxide (DMSO) | D8418 | Sigma-Aldrich | BioReagent for molecular biology, reagent grade >99.0% |
| Iodomethane | I8507 | Sigma-Aldrich | Contains copper as stabilizer, ReagentPlus 99% |
| Acetonitrile | A955-4 | ThermoFisher Scientific | Optima LC/MS |
| Microcentrifuge | 75002436: Sorvall Legend Micro 17 Centrifuge | ThermoFisher Scientific | 24 x 1.5/2.0 rotor with ClickSeal biocontainment lid. Rotor catalog number: 75003424 |
| 13 x 100 glass test tube (silanized)* | 53283-800 | VWR | 13 mm x 100 mm borosilicate glass test tubes with screw-cap finish |
| Caps for glass test tubes | 14-930-15D | ThermoFisher Scientific | Kimble™ Black Phenolic Screw Caps; 13 mm-415 GPI thread; PTFE-faced rubber liner. |
| Sodium chloride | S7653 | Sigma-Aldrich | >99.5% pure |
| Chloroform | 4440-08 | Macron Fine Chemicals | |
| Trifluoroacetic acid | 299537 | Sigma-Aldrich | 99% purified by redistillation for protein sequencing |
| Sodium borohydride | 71321 | Fluka Analytical | 99% |
| Ammonium hydroxide solution | 320145 | Sigma-Aldrich | NH3 content: 28.0-30.0% |
| Methanol | AH230-4 | Honeywell Burdick & Jackson | HPLC grade |
| Acetic acid | 320099 | Sigma-Aldrich | 99.70% |
| Plastic vacuum desiccator | Any model of adequate size | FoodSaver | |
| Acetic anhydride | 539996 | Sigma-Aldrich | 99.50% |
| Dichloromethane | D143SK-4 | ThermoFisher Scientific | Stabilized HPLC grade |
| Acetone | 9006-03 | J.T.Baker | Baker Analyzed |
| Heated evaporation manifold (main unit) | pi18823 | ThermoFisher Scientific | Thermo Scientific* Reacti-Therm* Heating and Stirring Module; Triple-block Model with Heating and Stirring Function |
| Heated evaporation manifold (overhead evaporator) | pi18826 | ThermoFisher Scientific | ThermoScientific* Reacti-Vap Evaporator, 27-port; For use with triple-block Reacti-Therm heating module |
| Aluminum sample-holder blocks for evaporation manifold | pi18816 | ThermoFisher Scientific | Block, Aluminum, Reacti-Block S-1, Holds 13 mm dia test tubes, 13 holes (14 mm dia. x 45 mm deep) |
| Gas chromatograph | Model A7890 | Agilent | Equipped with CTC PAL autosampler |
| Mass spectrometer | GCT Premier (Time-of-Flight) | Waters | |
| Split-mode liner (deactivated / silanized) | 5183-4647 | Agilent | Containing a small plug of silanized glass wool |
| DB-5ms GC column | 122-5532 | Agilent | 30 m x 0.25 mm ID x 0.25 micron film thickness |
| Chlorotrimethylsilane | 95541 | Sigma-Aldrich | |
| Glass vacuum desiccator (for glassware silanization) | EW-06536-30 | Cole-Parmer | 12" wide; 230 mm plate size |
| *Glassware silanization is carried out in-house, overnight using chlorotrimethylsilane vapor in a large glass vacuum desiccator. | |||
Referenzen
- Li, M., Song, L., Qin, X. Glycan changes: cancer metastasis and anti-cancer vaccines. J Biosciences. 35 (4), 665-673 (2010).
- Stanley, P., Schachter, H., Taniguchi, N. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 8: N-Glycans(2009).
- Apweiler, R., Hermjakob, H., Sharon, N. On the frequency of protein glycosylation, as deduced from analysis of the SWISS-PROT database. Biochim Biophys Acta. 1473 (1), 4-8 (1999).
- Brockhausen, I., Schachter, H., Stanley, P. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 9: O-GalNAc Glycans (2009).
- Rini, J., Esko, J., Varki, A. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 5: Glycosyltransferases and Glycan-processing Enzymes (2009).
- Gercel-Taylor, C., Bazzett, L. B., Taylor, D. D. Presence of aberrant tumor-reactive immunoglobulins in the circulation of patients with ovarian cancer. Gynecol Oncol. 81 (1), 71-76 (2001).
- An, H. J., et al. Profiling of glycans in serum for the discovery of potential biomarkers for ovarian cancer. J Proteome Res. 5 (7), 1626-1635 (2006).
- Kanoh, Y., et al. Changes in serum IgG oligosaccharide chains with prostate cancer progression. Anticancer Res. 24 (5B), 3135-3139 (2004).
- Kyselova, Z., et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res. 6 (5), 1822-1832 (2007).
- Okuyama, N., et al. Fucosylated haptoglobin is a novel marker for pancreatic cancer: a detailed analysis of the oligosaccharide structure and a possible mechanism for fucosylation. Int J Cancer. 118 (11), 2803-2808 (2006).
- Zhao, J., et al. Glycoprotein microarrays with multi-lectin detection: unique lectin binding patterns as a tool for classifying normal, chronic pancreatitis and pancreatic cancer sera. J Proteome Res. 6 (5), 1864-1874 (2007).
- Comunale, M. A., et al. Proteomic analysis of serum associated fucosylated glycoproteins in the development of primary hepatocellular carcinoma. J Proteome Res. 5 (2), 308-315 (2006).
- Goldman, R., et al. Detection of Hepatocellular Carcinoma Using Glycomic Analysis. Clin Cancer Res. 15 (5), 1808-1813 (2009).
- Aurer, I., et al. Aberrant glycosylation of Igg heavy chain in multiple myeloma. Coll Antropol. 31 (1), 247-251 (2007).
- Abd Hamid, U. M., et al. A strategy to reveal potential glycan markers from serum glycoproteins associated with breast cancer progression. Glycobiology. 18 (12), 1105-1118 (2008).
- Kyselova, Z., et al. Breast cancer diagnosis and prognosis through quantitative measurements of serum glycan profiles. Clin Chem. 54 (7), 1166-1175 (2008).
- Hongsachart, P., et al. Glycoproteomic analysis of WGA-bound glycoprotein biomarkers in sera from patients with lung adenocarcinoma. Electrophoresis. 30 (7), 1206-1220 (2009).
- Arnold, J. N., et al. Novel glycan biomarkers for the detection of lung cancer. J Proteome Res. 10 (4), 1755-1764 (2011).
- Bones, J., Mittermayr, S., O'Donoghue, N., Guttman, A., Rudd, P. M. Ultra performance liquid chromatographic profiling of serum N-glycans for fast and efficient identification of cancer associated alterations in glycosylation. Anal Chem. 82 (24), 10208-10215 (2010).
- Kodar, K., Stadlmann, J., Klaamas, K., Sergeyev, B., Kurtenkov, O. Immunoglobulin G Fc N-glycan profiling in patients with gastric cancer by LC-ESI-MS: relation to tumor progression and survival. Glycoconj J. 29 (1), 57-66 (2012).
- Chen, G., et al. Human IgG Fc-glycosylation profiling reveals associations with age, sex, female sex hormones and thyroid cancer. J Proteomics. 75 (10), 2824-2834 (2012).
- Takeda, Y., et al. Fucosylated haptoglobin is a novel type of cancer biomarker linked to the prognosis after an operation in colorectal cancer. Cancer. 118 (12), 3036-3043 (2012).
- Parekh, R. B., et al. Association of rheumatoid arthritis and primary osteoarthritis with changes in the glycosylation pattern of total serum IgG. Nature. 316 (6027), 452-457 (1985).
- Mehta, A. S., et al. Increased levels of galactose-deficient anti-Gal immunoglobulin G in the sera of hepatitis C virus-infected individuals with fibrosis and cirrhosis. J Virol. 82 (3), 1259-1270 (2008).
- Horvat, T., Zoldoš, V., Lauc, G. Evolutional and clinical implications of the epigenetic regulation of protein glycosylation. Clinical Epigenetics. 2 (2), 425-432 (2011).
- Zoldoš, V., Novokmet, M., Bečeheli, I., Lauc, G. Genomics and epigenomics of the human glycome. Glycoconj J. 30 (1), 41-50 (2013).
- Lowe, J. B., Marth, J. D. A genetic approach to Mammalian glycan function. Annu Rev Biochem. 72, 643-691 (2003).
- Tuccillo, F. M., et al. Aberrant Glycosylation as Biomarker for Cancer: Focus on CD43. Biomed Res Int. , (2014).
- Varki, A., Kannagi, R., Toole, B. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch. 44: Glycosylation Changes in Cancer (2009).
- Brockhausen, I. Mucin-type O-glycans in human colon and breast cancer: glycodynamics and functions. EMBO reports. 7 (6), 599-604 (2006).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Bertozzi, C. R., Sasisekharan, R. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. Ch 48 Glycomics (2009).
- Borges, C. R., Rehder, D. S., Boffetta, P. Multiplexed surrogate analysis of glycotransferase activity in whole biospecimens. Anal Chem. 85 (5), 2927-2936 (2013).
- Mcinnes, A. G., Ball, D. H., Cooper, F. P., Bishop, C. T. Separation of Carbohydrate Derivatives by Gas-Liquid Partition Chromatography. J Chromatogr. 1 (6), 556-557 (1958).
- Ciucanu, I., Caprita, R. Per-O-methylation of neutral carbohydrates directly from aqueous samples for gas chromatography and mass spectrometry analysis. Anal Chim Acta. 585 (1), 81-85 (2007).
- Ciucanu, I., Kerek, F. A simple and rapid method for the permethylation of carbohydrates. Carbohydr Res. 131, 209-217 (1984).
- Kang, P., Mechref, Y., Klouckova, I., Novotny, M. V. Solid-phase permethylation of glycans for mass spectrometric analysis. Rapid Commun Mass Sp. 19 (23), 3421-3428 (2005).
- Kang, P., Mechref, Y., Novotny, M. V. High-throughput solid-phase permethylation of glycans prior to mass spectrometry. Rapid Commun Mass Sp. 22 (5), 721-734 (2008).
- Goetz, J. A., Mechref, Y., Kang, P., Jeng, M. H., Novotny, M. V. Glycomic profiling of invasive and non-invasive breast cancer cells. Glycoconj J. 26 (2), 117-131 (2009).
- Goetz, J. A., Novotny, M. V., Mechref, Y. Enzymatic/chemical release of O-glycans allowing MS analysis at high sensitivity. Anal Chem. 81 (23), 9546-9552 (2009).
- Mulloy, B., Hart, G. W., Stanley, P. Essentials of Glycobiology. Varki, A., et al. , 2nd, Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. Ch. 47: Structural Analysis of Glycans (2009).
- Seed, B. Silanizing glassware. Curr Protoc Immunol. 21, A.3K.1-A.3K.2 (1997).
- Stellner, K., Saito, H., Hakomori, S. I. Determination of aminosugar linkages in glycolipids by methylation. Aminosugar linkages of ceramide pentasaccharides of rabbit erythrocytes and of Forssman antigen. Arch Biochem Biophys. 155 (2), 464-472 (1973).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten