Method Article
Создание рака стволовых клеточных культур от человека обычного остеосаркомы
В этой статье
Резюме
Присутствие раковых стволовых клеток (ЦОК) в костных сарком недавно был связан с их патогенеза. В этой статье мы представляем выделение ЦОК из первичных клеточных культур, полученных из человеческих биопсий обычных остеосаркома (ОС) с использованием способности ЦОК расти в прилипших условиях.
Аннотация
Нынешние улучшения в терапии против остеосаркомы (ОС) продлили жизнь больных раком, но выживаемость пять лет остается на низком уровне, когда произошло метастазирование. (ЦОК) по теории рака стволовых клеток утверждает, что существует подмножество опухолевых клеток в опухоли, которые имеют стержневые подобные характеристики, в том числе способности поддерживать опухоль и противостоять многим лекарственным средствам химиотерапии. Таким образом, лучшее понимание биологии OS и патогенеза необходимо для того, чтобы содействовать развитию целенаправленной терапии для искоренения этого конкретного подмножества и для снижения заболеваемости и смертности среди пациентов. Разделительный CSCs, создание клеточных культур ЦОК, а также изучение их биологии являются важными шагами для улучшения нашего понимания OS биологии и патогенеза. Создание человеческого происхождения OS-ЦОК из биопсий ОС стало возможным с помощью нескольких методов, в том числе потенциала для создания 3-мерных культур стволовых клеток под nonadhereусловия нт. В этих условиях, ОКК способны создавать сферические плавающие колонии, образованные дочерние стволовые клетки; эти колонии называются "клеточные сферы". Здесь мы опишем метод для установления CSC культур из первичных клеточных культур обычной ОС, полученной из биопсий ОС. Мы четко описать несколько проходов, необходимых для выделения и характеристики CSCs.
Введение
Саркомы представляют собой гетерогенную группу редких злокачественных опухолей соединительной ткани , происходящих в основном из эмбриональной мезодермы 1. Различные типы включают костные саркомы и саркомы мягких тканей. Костные саркомы, группа сравнительно редко первичных опухолей, состоят из нескольких подвидов, в том числе остеосаркома (ОС). ОС, одна из наиболее распространенных первичных опухолей костей, является мезенхимальные злокачественности , который проявляет обширные клинические, гистологические и молекулярные гетерогенность 2, 3. К сожалению, ОС происходит преимущественно у детей и молодых взрослых 4, 5 и представляет 60% общие гистологические подтипы саркома кости в детском возрасте 6, 7. ОС , как правило , влияет на скелетные области, которые характеризуются быстрым ростом костей (например, метафиза длинных трубчатых костей). Среди гистологически различных подтипов ОС, обычной ОС, которая также называется медуллярный или центральной ОС, имеет высокую степень злокачественности и квотирования шаповторно 80% 8. Это на 80% состоит из 60% обычной остеобластов OS, 10% chondroblastic OS, и 10% фибробластического OS 6, 8-10. Другие подтипы ОС включают Анапластический, telangiectatic, гигантские клетки, богатые и небольшой ОС клеток. Несмотря на успехи в комбинированной хирургии и химиотерапии в управлении ОС, результат остается на низком уровне , с долгосрочной выживаемости 65-70% у больных без метастазов 11, 12. Отдаленные рецидивы часто происходят в легочных метастазов или, реже, так как метастазы к отдаленным костей и местных рецидивов 13. Метастазы часто устойчивы к стандартным способам лечения. Это сопротивление является причиной того, почему 10-летняя выживаемость без признаков заболевания составляет около 30% у пациентов с метастазами при постановке диагноза 14, 15.
Как и в нормальной ткани, ткани рака состоит из гетерогенной коллекции типов клеток. Клетки внутри опухоли, кажется, соответствуют различным этапам развития. В любом пНПУ ткани проживает субпопуляции клеток с возможностью selfrenew, обеспечивая таким образом клетки-предшественники и зрелые клетки для гомеостаза тканей. Аналогичным образом, рак состоит из подобной гетерогенной популяции клеток на различных стадиях развития, с различной степенью пролиферации и онкогенного потенциала. Часть этих раковых клеток, называемых раковых стволовых клеток (ЦОК), представляет собой резервуар selfsustaining клеток с исключительной способностью selfrenew и поддерживать злокачественный потенциал опухолей, тем самым генерируя различные клоны клеток , которые составляют основную часть 16 опухоли. В 1990 - е годы, исследования по острой миелоидной лейкемии при условии , что первый убедительные доказательства существования CSC субпопуляций 17, 18. ОКК с тех пор были выделены из большого числа солидных опухолей 19, тем самым став одним из наиболее изученных тем в исследованиях рака. ОКК действительно могут возникать из нормальных стволовых клеток, с помощью мутаций в генах, которые делают нормальныйстволовые клетки раковой 20-23. Несколько трансформирующие мутации и взаимодействия с микросреды может также способствовать здоровых клеток-предшественников и зрелых клеток приобретающих selfrenewal емкость и бессмертием, что прообразом CSCs. Есть несколько гипотез об этой трансформации. Здоровые клетки - предшественники, здоровые зрелые клетки и раковые клетки, могут дедифференцироваться стволовые клетки, получение стволовых фенотипу путем активации selfrenewal-ассоциированных генов 24-28. Несмотря на ряд недавних исследований, происхождение ЦОК еще предстоит открыть.
Характерной особенностью ОКК является то, что их способность противостоять подхода с участием многих терапии, которая состоит из комбинированной операции и химиотерапии с различными препаратами. Недавние исследования показали, что ЦОК также могут приобретать устойчивость к цитотоксическим химиотерапевтическим агентам. Возможные объяснения этого сопротивления включают избыточную экспрессию АТФ-связывающего кассетного (ABC) с множественной лекарственной переносчика (то есть,MDR1 и BCRP1), избыточная экспрессия химиотерапии метаболизировать ферментов , таких как альдегиддегидрогеназой 1 (ALDH1), и / или изменения в кинетике клеточного цикла 30-33. Прямым следствием всех этих понятий, которые были описаны до сих пор является то, что терапия рака будет эффективным только тогда, когда субпопуляции CSC были полностью устранены, в то время как местный рецидив или отдаленных метастазов может произойти, если даже один CSC выжил.
Открытие ЦОК в человеческой саркомы 34, в частности , OS 35, или в любых других костных и мягких тканей злокачественных опухолей, имеет большое клиническое значение , поскольку он предлагает возможное объяснение, почему многие методы лечения представляется эффективным на начальном этапе, но пациенты позже рецидив. Таким образом, надежда на будущее бой против обычной ОС, чтобы найти новые и конкретные целевые методы лечения основаны на разработке инновационных лекарственных средств, направленных на OS-ЦОК благодаря молекулярной характеристике данного подпунктанаселения и к изучению биологии CSC.
В 1992 году Рейнольдс и его коллеги, которые вели расследование , было ли подмножество стволовых клеток , присутствующих в головном мозге млекопитающих взрослых, разработан метод выделения клеток , подозреваемых в стволовых подобных клеток 36, 37. Этот метод основан на определенной способности эти клетки с образованием сферических колоний при выращивании в прилипших условиях. Аналогичные методы были использованы Гиббсом и его коллегами в 2005 году для изучения субпопуляции стволовых клеток, как в костной саркомы 38. Для того, чтобы выделить и охарактеризовать ОС-CSCs из первичных культур клеток различных типов обычных ОС, мы решили адаптировать эту методику для клеточных линий OS.
Здесь мы описываем этот адаптированный метод анализа формирования сферы, названный "sarcosphere анализ", который может быть использован для выделения ОС-CSCs от конечных линий первичных клеток, полученных из человеческих биопсий обычной ОС. Мы также описываем все методы ˙UСЭД для проверки стволовых как CSC фенотип линий клеток, выделенных этим анализом: 1) оценка экспрессии генов, которые характеризуют плюрипотентных эмбриональных стволовых клеток (ЭСК) и гена CD133, который является маркером ЦОК; 2) колониеобразующих единицы (КОЕ) анализ; 3) оценка способности этих клеток дифференцироваться в остеобласты и адипоциты при соответствующих условиях дифференцировки; 4) исследование поверхностных маркеров мезенхимальных стволовых клеток (МСК) (т.е. CD44, CD105 и Стро-1) с помощью иммунофлуоресценции окрашивания и с помощью анализа проточной цитометрии; 5) оценка ALDH активности этих клеток.
протокол
Все эксперименты с использованием человеческих тканей, описанных здесь было одобрено местным этическим комитетом (Rif. Н. 141/12). Информированное согласие на сбор образцов тканей и для использования и хранения образцов была получена от доноров на AOUC.
1. Подготовка к культуре
- Готовят культуры роста среды (GM), добавляя 10% фетальной бычьей сыворотки (ФБС), 100 МЕ / мл пенициллина и 100 мкг / мл стрептомицина в модифицированной среде F12 Хама Куна. Фильтр и стерилизовать GM с использованием фильтра 0,22 мкм. Магазин GM до 1 месяца при 4 ° С.
- Готовят коллагеназы среду (СМ), добавляя 20% FBS, 100 МЕ / мл пенициллина, 100 мкг / мл стрептомицина и 3 мг / мл коллагеназы типа II в модифицированной среде F12 Хама Куна. Фильтр и стерилизовать см с помощью 0,22 мкм фильтр. Магазин CM до 1 месяца при -20 ° С.
- Готовят среду для ячейки замораживания (FM), добавляя 40% FBS, 100 МЕ / мл пенициллина, 100 мкг / мл стрептомицина и 60,5% диметилсульфоксида (ДМСО) с модифицированной среде F12 Хама Куна. Фильтр и стерилизовать FM с использованием фильтра 0,22 мкм. Магазин FM до 1 месяца при 4 ° С.
- Готовят среду для КОЕ анализа (CFUM) путем добавления 20% FBS, 100 МЕ / мл пенициллина и 100 мкг / мл стрептомицина в модифицированной среде F12 Хама Куна. Фильтр и стерилизовать CFUM с использованием фильтра 0,22 мкм. Магазин CFUM до 1 месяца при 4 ° С.
- Подготовка трипсин растворением 400 мг трипсина, 200 мг ЭДТА и 1,000 мг D (+) - безводный глюкозы в 1000 мл Дульбекко забуференным фосфатом физиологическим раствором (DPBS) без Са 2+ и Mg 2+.
Примечание: Разделите свежий трипсин-ЭДТА в 50 мл аликвоты в 25 см 2 колбы с помощью фильтра и замораживания 0,22 мкм при -20 ° С в течение до 3 -х месяцев. Магазин размораживают стерилизованным фильтрацией аликвот при температуре 4 ° С без потери активности. - Готовят среду для роста стволовых клеток (SCGM) путем добавления 10% FBS, 100 МЕ / мл пенициллина, 100 мкг / мл streptomycin и 10 нг / мл bFGF (25 мкг / мл стоковый) модифицированной среды F12 Хэма Куна. Фильтр SCGM с использованием 0,22 мкм фильтр и хранят SCGM до 2-х недель при температуре 4 ° C.
- Приготовьте 2% метилцеллюлозы (MC) растворением MC в сверхчистой H 2 O при температуре 4 ° С в течение 3 дней. Когда МС полностью не растворится, автоклаве и хранят при температуре 4 ° С.
Примечание: После того, как MC стерилизуют, он становится твердым. Довести MC в жидкое состояние, хранить при температуре 4 ° С. - Подготовка sarcosphere среды роста (SGM). Подготовка этой среды свежие (не более 2-х недель перед использованием) путем добавления 100 МЕ / мл пенициллина, 100 мкг / мл человеческого bFGF (25 мкг / мл стоковый), 20 нМ прогестерон (10 мкМ акций), 100 мкМ путресцина, 30 нМ селенит натрия (30 мкМ запас), 25 мкг / мл трансферрина (25 мг / мл стоковый), 20 мкг / мл инсулина (20 мг / мл стоковый) и 10 нг / мл человеческого EGF (10 мкг / мл запас) в 2 раза Coon модифицированной среды F12 Хэма. Фильтр и стерилизовать SGM с использованием 0,22 мкм филтер. Хранить в течение 2 недель при температуре 4 ° С.
- Подготовка остеогенной среды (OM), добавляя 10% FBS (южноамериканского происхождения), 100 МЕ / мл пенициллина, 100 мкг / мл стрептомицина, 10 нМ дексаметазона (100 мкМ акций), 0,2 мМ натрий L-аскорбил-2-фосфат (1 M запас), 10 мМ β-глицерофосфата (5 мг / мл стоковый) и 1 мкг / мл кальцеин (200 мкг / мл стоковый) модифицированной среды F12 Хэма Куна. Фильтр и стерилизовать OM с использованием фильтра 0,22 мкм. Хранить при температуре 4 ° С.
Примечание: Храните дексаметазон исходные растворы под жидким азотом для поддержания их активности. Приготовьте свежий ОМ каждые 2 недели, чтобы поддерживать активность дексаметазона с целью поддержания дифференцировку потенциала среды. - Подготовка буфера для лизиса эритроцитов (ELB) путем растворения 1,66 мг NH 4 Cl, 0,2 мг K 2 HPO 4 и 0,007 мг ЭДТА в 200 мл дистиллированной воды (дН 2 O). Фильтр и стерилизовать ELB с использованием фильтра 0,22 мкм. Хранить при температуре 4 °C.
- Подготовьте Adipogenic среду (AM) добавлением 10% FBS (Южная Америка происхождения), 100 МЕ / мл пенициллина, 100 мкг / мл стрептомицина, 1 мкМ дексаметазон (1 мМ исходный), 1 мкМ бычий инсулин (10 мМ маточного), 0,5 мМ изобутилметилксантина (IBMX) (500 мМ маточного) и 100 мкМ индометацин (200 мМ) в модифицированной среде F12 Хама Куна. Фильтр и стерилизовать AM с использованием фильтра 0,22 мкм. Хранить при температуре 4 ° С.
Примечание: Храните дексаметазон исходные растворы под жидким азотом для поддержания их активности. Готовят свежую утра каждые 2 недели, чтобы поддерживать активность дексаметазона с целью поддержания дифференцировку потенциала среды. - Приготовьте 2% бычьим сывороточным альбумином (БСА) в ДЗФР (БСА / DPBS). Растворить 10 г БСА в ДЗФР 500 мл и готовят маточный раствор путем aliquotting 50 мл исходного раствора в 50 мл конические пробирки. Хранить при -20 ° C.
- Готовят раствор 4% параформальдегида (PFA) в DPBS (PFA / ДЗФР). В глemical капюшон, разбавленные параформальдегида в ДЗФР и готовят маточный раствор путем aliquotting 50 мл исходного раствора в 50 мл конические пробирки. Хранить при температуре 4 ° С.
2. Создание основной ОС клеточных культур и ОС конечных клеточных линий (OSA)
Примечание: Первичная культуры OS клеток получали из свежих образцов обычных биопсий ОС , собранных на "Унита Ortopedia Oncologica е Ricostruttiva", AOUC Careggi, Флоренция. Все биопсий, которые были получены с помощью пункции или хирургической резекции небольшого участка опухоли (рис 1а, б), были немедленно помещены в культуральной среде , дополненной 100 МЕ / мл пенициллина и 100 мкг / мл стрептомицина (рН 7,4) и транспортировали в лабораторию, где они были обработаны. Все описанные манипуляции проводились в асептических условиях с использованием колпаке с ламинарным потоком.
- Выделение клеток OS
- Поместите биопсию в100 мм чашки Петри с небольшим объемом GM. Стерильным скальпелем и пинцетом Перри, фарша образцы OS ткани путем разрезания их на куски как можно меньше (0,5 - 1 мм) (рис 2А, В).
- Накройте фрагментов тканей с 10 мл СМ для ферментативного расщепления (рис 2В) и инкубировать в течение 3 ч при 37 ° С, 5% СО 2 инкубатора. Аккуратно удалите суспензию фрагментов с помощью пипетки и переносят его в коническую пробирку 15 мл для немедленного центрифугирования (400 мкг в течение 5 мин) для осаждения фрагментов.
Примечание: После центрифугирования, если биоптаты богаты эритроцитах, красный депозит , состоящий из эритроцитов можно увидеть по фрагментам. Поэтому, прежде чем приступить к механической дисперсии, обработки образца с эритроцитах буфера для лизиса. Удалите супернатант аспирацией и добавьте 5 мл ELB. - Приостановка фрагменты гранул в течение 1 мин и центрифугируют суспензию при 400 мкг в течение 2минимум Удалить супернатант аспирацией. Добавьте 5 мл GM и механически разогнать фрагменты с использованием 10 мл серологические пипетки (размер отверстия, 1,5 мм внутренний Ø) 10 - 20 раз.
- Центрифуга суспензии при 400 мкг в течение 5 мин. Удалить супернатант аспирацией, приостановить осадок клеток с 10 мл GM, а затем передать полученную клеточную суспензию в 100 мм чашки Петри. Выдержите чашку Петри в 37 ° C, 5% СО 2 инкубатора и заменить ГМ со свежей полной GM каждые 3 г.
Примечание: Довольно часто, OS образцы ткани , полученные при пункции очень малы и содержат фрагменты костей, которые не перевариваются путем ферментативного расщепления с помощью коллагеназы. Таким образом, после того, как супернатант был удален, попытка отделить клетки от костной ткани путем затирания фрагменты гранул с помощью пипетки.
- Субкультура
Примечание: Для того, чтобы установить OSA, когда клетки достигают приблизительную слияния, удалить их из Theiг культуральный сосуд, развести, и поместить в свежую пластину, чтобы обеспечить возможность дальнейшего роста. Эта процедура субкультура достигается с помощью ферментативной процедуры трипсинизации называют.- Удалите среду путем аспирации. Для того, чтобы отделить клеточный монослой, добавьте 2 - 3 мл трипсина при комнатной температуре (не более 18 - 20 ° C), слегка встряхните один раз, и сразу же удалить трипсина путем аспирации. Повторите дважды. Инкубируйте клетки при 37 ° С в течение 3 - 4 мин, пока они не начинают отделяться.
Примечание: Хорошо трипсинизации можно увидеть опытный пользователь , как маленькие отверстия , образуя в слегка непрозрачной монослоя , когда блюдо проходит свет. Эта диссоциация также можно контролировать с помощью инвертированного микроскопа; этот подход рекомендуется для начинающих. - Остановить реакцию трипсина путем добавления 10 мл GM и мыть посуду хорошо с помощью пипетки, чтобы снять все клетки. Передача 1 мл суспензии на новый 100 мм чашку Петри и добавляют 9 мл GM (1/10 дроблении клеток).
ЗАМЕТКА: Оставшиеся суспензии клеток могут быть использованы для расширения клеток (переноса на другой 100 мм чашки Петри), может быть крионированным (см раздел 2.3), или может быть расценено и высевают в экспериментальных блюд или лунок для анализов пролиферации или для других целей (см ниже).
- Удалите среду путем аспирации. Для того, чтобы отделить клеточный монослой, добавьте 2 - 3 мл трипсина при комнатной температуре (не более 18 - 20 ° C), слегка встряхните один раз, и сразу же удалить трипсина путем аспирации. Повторите дважды. Инкубируйте клетки при 37 ° С в течение 3 - 4 мин, пока они не начинают отделяться.
- Криоконсервация OS первичных культур и OSA
Примечание: Замораживание один сливающийся 100 мм чашки Петри на 4-5 криопробирок. Процесс криоконсервации должны выполняться быстро, так как ДМСО, который защищает клеточные мембраны при замерзании, является токсичным для клеток при незамерзающих температурах.- Диссоциируют клеточных культур из монослоя трипсином (см раздел 2.2), гранул клеток путем центрифугирования при 400 мкг в течение 5 мин, удалить супернатант с помощью аспирации, а затем быстро приостановить осадок клеток в FM.
- Аликвоты по 1 мл этой суспензии в криогенном флаконе. Немедленно поместите заполненные флаконов в коробке морозильной с рубашкой 2-пропанола и магазин ImmediaДЕТАЛЬ при -80 ° CO / N. Передача криопробирки в жидком азоте на следующий день, для длительного хранения.
- Клеточные линии Размораживание OS и первичные культуры
- клеточные линии Размораживание OS от хранения жидкого азота, оттаиванию криопробирки быстро, помещая их в водяной бане лаборатории при температуре 37 ° C. Передача содержимого криопробирок в 15 мл коническую пробирку и добавляют приблизительно 10 мл GM (см раздел 2.3, чтобы удалить ДМСО). Удалить супернатант аспирацией и приостановить осадок клеток в 10 мл GM. Пластина клеточной суспензии в чашку Петри 100 мм и инкубировать в 37 ° C, 5% СО 2 инкубатора.
3. Анализ Sarcosphere изолировать ОС-ОКК
Примечание: Этот эксперимент проводится на ОАС. Длительность этого эксперимента связана с способность клеток формировать эти сферические колонии (sarcospheres), а диапазон времени 7, 14, 21, и 28 г.
- прикладной часданию из sarcosphere анализа
- Подготовьте камеру гемоцитометра и все реагенты заранее.
- Удалите среду с помощью аспирации и диссоциируют клеток из монослоя трипсином (см раздел 2.2). Смешайте клеточной суспензии тщательно пипеткой, чтобы рассеять любые комки, и собрать 10 мкл с использованием 20 мкл кончиком пипетки.
- Передача суспензии 10 мкл клеток непосредственно в камеру края гемоцитометра, изгнать подвеску, и позволить ему быть обращено под покровное под действием капиллярных сил.
- Обратите внимание на камеру гемоцитометра под фазового контраста. Выберите цель 10X и сосредоточиться на линиях решетки в камере. Граф клеток , лежащих в этом 1 мм 2 площади , с помощью подразделений (также связаны тремя параллельными линиями) и отдельные линии сетки в качестве вспомогательного средства для подсчета.
- Измеряют концентрацию и применить следующее уравнение: 1 мл = N * 10 4 / з (п: целое число клеток во всех подсчитанноеквадраты 1 мм 2; Z: число подсчитанных квадратов 1 мм 2). Рассчитать объем клеточной суспензии, необходимой для номерного знака, общее количество 240000 клеток, разделенную на 40000 клеток на каждую лунку в 6-луночные планшеты со сверхнизким крепления.
ПРИМЕЧАНИЕ: Убедитесь , что пластины правильное количество клеток путем посева клеток в одну дополнительную лунку. Таким образом, общее количество клеток, чтобы быть покрыты является 280000 клеток. - Приготовьте 35 мл SGM добавлением 50% 2% MC (СВП-MC) в 25 см 2 колбу. Подготовьте общий объем SGM с учетом 5 мл дополнительный для того, чтобы пластина один дополнительный колодец.
- Добавить расчетный объем клеточной суспензии, к SGM-MC, полученного в колбе и аккуратно перемешать с помощью пипетки, чтобы разогнать комков. Пластина клеток в 6-луночный планшет со сверхнизким крепления и использовать инвертированный микроскоп, чтобы наблюдать, как появляются клетки после того, как посевом.
- Инкубируйте клетки в 37 ° C, 5% СО 2 инкубатора. Каждый 3 d, добавить фрESH аликвоты bFGF и EGF в каждую лунку, чтобы обновить концентрации факторов роста. Добавьте 2 мкл bFGF и 5 мкл EGF для поддержания как в конечной концентрации 10 нг / мл в каждую лунку.
- Выделение sarcospheres
Примечание: Следите за хороший ход анализа sarcosphere на 7, 14, 21 и 28 дней , чтобы решить , когда необходимо изолировать sarcospheres , что образованные.- Подготовьте все реагенты и оборудование в ламинарный (рис 3А, В). Собирают устройство фильтрации путем размещения сетчатый фильтр диаметром 25 мм и с размером ячеек 40 мкм в держатель мембранного фильтра; стерилизовать автоклавированием (рис 4A-E).
- Для каждой лунки, передача среды, содержащей sarcospheres в шприц со стерильным держателя мембранного фильтра с использованием стерильной пипетки с наконечником 1000 мкл. После полного удаления среды, содержащей sarcospheres, моют хорошо оныхING 5 мл GM, чтобы быть уверенным, чтобы передать все сферы к шприцу. С помощью микроскопа, чтобы подтвердить, были ли восстановлены все sarcospheres. Если нет, то продолжить, повторяя этот шаг.
- Суспензию фильтруют с держателем мембранного фильтра только под действием силы тяжести без давления, с тем, чтобы не повредить сферы и, чтобы избежать пересечения sarcospheres через фильтр, что позволяет избежать потери сфер. Удалите пузырьки воздуха, осторожно с помощью стерильной стеклянной пипетки Пастера.
Примечание: Иногда фильтрация блокируется наличием воздушного пузырька в держателе мембранного фильтра. - Промыть блок фильтрации путем добавления 10 мл GM в шприц и давая ему фильтровать без давления, чтобы быть уверенным, чтобы устранить отдельные клетки. Разберите узел фильтра из шприца и поместить его в чашку Петри.
- Снимите сетчатый фильтр из держателя мембранного фильтра с помощью пинцета Перри и промойте его встряхивая осторожно с помощью пинцета в 60 ммПетри освободить sarcospheres из клубка мембраны. Затем поместите мембрану в скважину и подтверждают микроскопическим наблюдением, что нет больше сфер запутанные в мембране. Если сферы по-прежнему запутанная в мембране, действуйте с другой мойке, как описано в шаге 3.2.4.
- Обратите внимание на выпущенные sarcospheres с помощью микроскопа. Выдержите высвободившиеся sarcospheres в 37 ° C, 5% СО 2 инкубатора. Повторите все действия для каждой лунке 6-луночного планшета со сверхнизким крепления.
4. OS-CSC Линии
Примечание: ОС-ОКК получают из sarcospheres , которые обладают адгезией экспансию реинтродукции и не reculturing эти клетки в монослое после того, как они высевают в небольших 60 мм чашки Петри , больше не находится под сверхнизких условия прилипания.
- OS-CSC культуры
- Для того, чтобы обеспечить возможность дальнейшего роста, субкультуры клетки, когда они достигают примерно 90% слияния в 60мм чашку Петри. Повторите шаг 2.2.1 установить OS-CSC культур.
- Стоп трипсинизации путем добавления 4 мл SCGM и мыть посуду хорошо, с помощью пипетки, чтобы отделить все ячейки. Передача клеточной суспензии в новый 100 мм чашку Петри и добавляют 6 мл SCGM. Когда ОС-ОКК достигают 90% слияния, субкультура, повторяя раздел 2.2.
Примечание: Для анализа ин витро , чтобы охарактеризовать стволовых клеток фенотипу изолированной ОС-ЦОК, клетки могут быть покрыты в различных типах плит. - Сохранение установленных ОС-CSC линии от криоконсервации (повторить все шаги раздела 2.3). Размораживание криоконсервированных OS-CSCs, повторяя все шаги раздела 2.4.
5. В пробирке нализ к характеризации OS-CSCs:
- Получение клеток для иммунофлуоресценции
Примечание: Клетки фиксировали в параформальдегида , когда они достигают правильного степень слияния в каждую лунку ПЛМ 24-луночногот.е. Степень слияния связана с типом экспериментов.- Тарелка ОС-ОКК в 24-луночный планшет для изучения поверхности мезенхимальные маркеры стволовых клеток (МСК) с помощью иммунофлуоресценции. Фикс клетки в каждую лунку, когда они достигают 50 - 60% сплошности. Удалите SCGM аспирацией и мыть дважды в DPBS 24-луночного планшета.
- Под капотом химического, добавьте 500 мкл 4% PFA / DPBS в каждую лунку. Инкубируют при комнатной температуре в течение 10 мин. Удалите PFA / DPBS и промыть 3 раза с сверхчистого дН 2 O. Дайте 24-луночного планшета, чтобы высохнуть в вытяжном шкафу.
- Иммунофлуоресценции для маркеров MSC
Примечание: Иммунофлуоресценции окрашивание ОС-ЦОК фиксировали в 4% PFA / ДЗФР может быть использован для исследования MSC-подобный фенотип OS-ЦОК с использованием антител , направленных против CD44, Стро-1 и CD105. Следующий метод используется обычно авторами.- В химической капот, проницаемыми клетки, которые были зафиксированы в 4% PFA / DPBS путем добавления 500 мкл 0,2% Тритона Х-100 / DPBS в каждую лунку. Инкубируйте клетки при 37 ° С в течение 30 мин. Осторожно промыть клетки 3 раза с ДЗФР. Добавить 300 мкл РНКазы разведенное в соотношении 1/1000 с 2% БСА / ДЗФР к клеткам и инкубируют при температуре 37 ° С в течение 30 мин.
- Осторожно промыть клетки 3 раза с 2% БСА / ДЗФР. Пятно клетки для маркеров MSC. Добавляют первичное антитело, только в лунки, выбранных в качестве положительного контроля для каждого антитела.
- Добавить 300 мкл анти-CD105 разводили 1/10 с 2% BSA / ДЗФР, 300 мкл анти-CD44 разбавленного 1/10 с 2% BSA / ДЗФР, 300 мкл анти-Стро-1 разбавленного 1/10 с 2% BSA / ДЗФР и только 200 мкл 2% БСА / DPBS в лунки, выбранных в качестве отрицательного контроля для каждого антитела.
- Инкубируйте клетки во влажной среде при температуре 4 ° CO / N. Промыть лунки 3 раза с ДЗФР и затем дважды 2% БСА / ДЗФР.
- Выявить первичные антитела путем добавления специфических вторичных антител.
- Добавьте 300 мкл анти-кроличьего IgG (осле против кроличьего IgG [H + L]), разбавленный 1/100с 2% БСА / ДЗФР в каждую лунку выбран в качестве положительного и отрицательного контроля для CD44 и CD105. Добавить 300 мкл FITC анти-мышь IG (FITC-кроличьего анти-мышь IgG [H + L]), разведенный 1/100 с 2% БСА / ДЗФР в каждую лунку выбран в качестве положительного и отрицательного контроля для Стро-1. Инкубируйте клетки в темноте при комнатной температуре в течение 60 мин. Промыть лунки 6 раз с ДЗФР.
- Пятно MSC маркер-позитивных клеток для цитоскелета актина путем добавления 300 мкл фаллоидином разбавленного 1/100 с 2% BSA / ДЗФР в каждую лунку окрашивали MSC маркера иммунофлюоресценции.
- Инкубируйте клетки в течение 40 мин при комнатной температуре. Промыть лунки 3 раза с ДЗФР , а затем мыть их дважды с сверхчистого дН 2 O. Перейдите к counterstaining ядер после окрашивания иммунофлюоресценции, описанного выше. Приготовьте раствор пропидий йодида 10 -5 М в ДЗФР (наличие 1,5 × 10 -3 М) в вытяжном шкафу.
- Добавить 200 мкл раствора пропидийиодидом в каждую лунку окрашены, как описано выше. Выдержите ячейкуs в течение 2 - 3 мин при комнатной температуре. Промыть лунки дважды с сверхчистого дН 2 O.
Примечание: Повторите все шаги в разделах 5.1 - 5.2 на клеточной линии HCT8, первичный непрерывной дифференцированной клеточной линии рака толстой кишки , который используется в качестве отрицательного контроля.
- Добавить 200 мкл раствора пропидийиодидом в каждую лунку окрашены, как описано выше. Выдержите ячейкуs в течение 2 - 3 мин при комнатной температуре. Промыть лунки дважды с сверхчистого дН 2 O.
- Остеогенная анализ дифференциации
Примечание: Остеогенная дифференциация длится в течение 20 г.- Тарелка ОС-ОКК в 24-луночные планшеты при плотности клеток 1 × 10 4 клеток / см 2 в SCCGM. Дайте клеткам расти в SCGM, пока они не достигают 80 - 90% слитности в каждую лунку.
- Начало остеогенной дифференцировки путем изменения SCGM к ОМ. Дайте клеткам расти в ОМ и обновить среду каждые 3 - 4 D. Прекратить остеогенной анализ дифференцировки на 10 D, чтобы оценить наличие щелочной фосфатазы (ALP).
- Fix клетки в 4% PFA / ДЗФР (смотрите раздел 5.1). Оценить остеобластов фенотип цитохимическим окрашивания для ALP и HAиспользуя Ализарин Красный S окрашивание.
- ALP цитохимических окрашивание
Примечание: Подготовьте смесь красителя в химической капот непосредственно перед началом окрашивания.- Растворите 40 мг Быстрый Синий BB или соль Быстрая красный фиолетовый LB в 50 мл Трис-HCl, рН 9 (раствор А). Растворите 5 мг нафтол-AS-MX фосфата натриевой соли в 1 мл ДМСО (раствор Б). Добавить Решение B полностью к раствору А и хорошо перемешать, получая клетки Решение C. Промыть дважды с ДЗФР.
- Добавить 500 мкл - 1 мл раствора С в каждую лунку и инкубировать при температуре 37 ° С и 5% CO 2. Контроль за ходом окрашивания каждые 10 мин путем наблюдения клеток под микроскопом.
- Остановите окрашивание, когда ALP-положительные клетки становятся интенсивно окрашены (синий с быстрой солью Синий BB или красный с Fast Red Violet LB соли), которое обычно происходит в течение 30 мин. Вымойте клетки 3 раза с сверхчистого дН 2 O , чтобы удалить все остатки раствора C. Если осадок пятен IS присутствует, мыть клетки быстро, как только с абсолютным этанолом.
- Перейдем к counterstaining ядер после окрашивания ALP, как описано в шагах 5.2.5 и 5.2.5.1.
- Ализарин красный S цитохимических окрашивание
Примечание: Подготовьте смесь красителя перед началом эксперимента.- Подготовьте 2% ализарин красный S (2 г ализарин красный S в 100 мл сверхчистой H 2 O). Добавить 2,5% NH 3 до 2% ализарина Red S для достижения рН 6,0. Магазин 2% -ного раствора ализарин красный S при температуре 4 ° С. Вымойте клетки один раз с ДЗФР.
- Добавить ализарин Красный S к клеткам в течение всего нескольких секунд.
- Промыть лунки с сверхчистого дН 2 O , чтобы контролировать степень окрашивания; если отложения HA не интенсивно окрашены, повторите шаг 5.3.5.2. Остановите окрашивание, когда HA отложения становятся интенсивно красного цвета, который обычно происходит в течение нескольких минут. Промыть лунки с сверхчистого дН 2 O.
- Adipogenic дифференциация
Примечание: Анализ продолжительность зависит от линий ОС-CSC. Анализ может длиться 14 - 30 д.- Тарелка ОС-ОКК в 24-луночные планшеты при плотности клеток 1 × 10 4 клеток / см 2 в SCGM. Дайте клеткам расти в SCGM, пока они не достигают 80 - 90% слитности в каждую лунку. Инициировать Adipogenic дифференциацию путем изменения SCGM до утра. Дайте клеткам расти в AM и освежить AM два раза в неделю.
- Остановить Adipogenic анализ дифференцировки, когда липидные пузырьки являются видимыми. Оценка Adipogenic фенотип путем окрашивания масляным красным O и гематоксилином по counterstaining для ядер.
- Гематоксилином counterstaining для ядер
Примечание: Подготовьте смесь красителя перед началом эксперимента.- Готовят 5% -ный раствор гематоксилином, который называется Emallume Carazzi 39. Хранить раствор при температуре 4 ° С. Добавить Emallume Carazzi только 2 мин. Вымойте скважин с Ultrapure дН 2 O.
- КОЕ анализ
Примечание: Этот эксперимент должен быть выполнен в трех экземплярах.- Тарелка ОС-ЦОК в 100 мм чашках Петри при плотности клеток 450 клеток / см 2 в CFUM. Инкубируйте клетки в 37 ° C, 5% CO 2 инкубаторе в течение 4 -х недель. Обновить CFUM два раза в неделю.
- Пятно CFUs с толуидиновым синим. Граф цветных колоний с использованием инвертированного микроскопа. Рассчитать эффективность КОЕ в соответствии со следующей формулой: (число колоний, образованных / количество клеток высевали) * 100.
- Анализ активности ALDH
Примечание: ALDH активность оценивали с использованием ALDH активности колориметрического анализа Kit на двух линиях ОС-CSC и на конечной линии фибробластов, который был использован в качестве отрицательного контроля. Этот комплект квантифицирует ALDH ферментативную активность путем поглощение при длине волны 450 нм. Все тесты были выполнены в трех экземплярах.- Диссоциируют клеточных культур из монослоя трипсином (см раздел 2.2). Гранул клетки центрифугированием при 400 х г в течение 5 мин. Следуйте протоколу производителя.
- Цитометрический анализ:
Примечание: одноклеточных суспензий необходимы для оптимального окрашивания образцов для проточной цитометрии. Одна подвеска клетка должна быть готова для каждого антитела, подлежащего испытанию. Диссоциируют клеточных культур из монослоя трипсином (см раздел 2.2).- Поместите суспензию клеток в конической трубе, выполнять подсчет клеток с помощью Бюркера счетнокамерное центрифуга клетки при 400 мкг и ресуспендируют в соответствующем объеме буфера разделения , чтобы получить клеточную суспензию при конечной концентрации клеток 1 × 10 5 клеток / мл.
- Центрифуга клеточной суспензии в течение 5 мин при температуре 4 ° С. Удалите супернатант и промыть осадок с буфером разделения. Повторите этот шаг дважды.
- Пятно клетки для РСМаркеры C (то есть, CD44, CD105 и Стро-1) 40.
- Анализ положительно окрашенных клеточных суспензий в цитометр потока. Анализ отмеченных образцов в течение 1 дня. Выдержите эти образцы при температуре 4 ° С до анализа.
- ОТ-ПЦР
- Извлечение и выделение РНК
- Добавить лизирующего реагента 1 мл в клеточных замороженных упакованных образцов ОС-ОКК и лизиса клеток непосредственно в трубе с помощью пипетки осадок вверх и вниз несколько раз.
- Центрифуга образцов при 12000 х г в течение 1 мин при температуре 4 ° С. Осторожно удалите супернатант. Передача супернатант в новую пробирку, добавляют 200 мкл хлороформа, и колпачок трубки надежно. Встряхивать пробирку энергично в течение 15 сек и инкубировать образца в течение 5 мин при комнатной температуре.
- Центрифуга образцов при 12000 х г в течение 15 мин при температуре 4 ° С. Смесь разделяется на три этапа. РНК исключительно в виде бесцветной верхней водной фазы.
- Будучи годовыхrticularly осторожность, снимите только водную фазу, и передавать эту фазу в новую пробирку для продолжения выделения РНК. Добавить 500 мкл изопропанола в пробирку, содержащую водную фазу. Встряхнуть пробирку осторожно вручную. Инкубируйте образца при комнатной температуре в течение 10 мин. Центрифуга образца при 12000 х г в течение 10 мин при температуре 4 ° С.
Примечание: После того как образец центрифугируют, можно увидеть РНК, которая образует гелеобразный осадок на стороне и на нижней части трубы. - Удалить супернатант из трубки, соблюдая осторожность, чтобы оставить осадок РНК на дне. Добавить 1 мл 75% этанола в пробирку. Вихревая трубка вручную в течение нескольких секунд, а затем отцентрифугировать пробирку при 7500 х г в течение 5 мин при температуре 4 ° С.
- Выбросьте этанол и воздух сухой осадок РНК. Когда осадок высохнет, ресуспендируют осадок РНК в РНКазы без воды (10 - 50 мкл) с помощью пипетки раствор вверх и вниз несколько раз.
- Определить выход и чистоту РНК МЭСйти во время оптическую плотность при длине волны 260 нм и 280 нм с использованием спектрофотометра. Оценка целостности общей РНК на стандартном 1% -ном агарозном геле. Хранить РНК при температуре -80 ° С.
- Обратный полимеразная цепная реакция
- Обобщить первой цепи кДНК из 500 образцов нг РНК с использованием обратной транскрипции набора. Оттепель образцы РНК на льду и оттаивать необходимые решения, входящие в комплект при комнатной температуре. Перейдем к синтезу кДНК в соответствии с протоколом производителя.
- Полуколичественное обратной транскриптазы-полимеразной цепной реакции (ОТ-ПЦР)
- Выполнить все, используя 1 МКП мкл кДНК для каждого образца в качестве матрицы в конечном объеме реакции 24 мкл. С помощью последовательности праймеров , перечисленные в таблице 1 , для амплификации Nanog, октябрь 3/4, Sox2 и CD133 генов.
- Отдельные продукты RT-PCR на 1,8% электрофореза в агарозном геле и окрашивания бромистым этидием. Фотография под действием УФ-Illumминации.
- Извлечение и выделение РНК
Результаты
Образцы OS , полученные пункции или хирургической резекции небольшого участка опухоли (фиг.1А, Б) допускает выделение только одного ОРД , если лечение точно, как описано в разделе Protocol (рис 2А, В). К сожалению, количество клеток, выделенных из биопсий является низким, при этом выходной диапазон от 30 - 50%. Выход зависит от типа и размерности биопсий (рис 5А, В). Эти клетки должны быть обработаны точно. Следовательно, приблизительно один месяц необходимо для первичных культур, чтобы достичь сплошности в 100 мм чашке Петри. По истечении этого времени ОСА получаются из двух образцов ОС отмечен OSA5 и OSA6 (6А, В). Затем необходимо субкультуры линию первичной ячейки, чтобы получить достаточное количество клеток для проведения анализа характеризации и криоконсервируют клетки линэс. На 3 - м прохождении субкультуры, когда оба OSA первичные клеточные линии достигают слитности, они засевали в 6-хорошо сверхнизких крепежных пластин для анализа sarcosphere. Этот тип пластины используется потому, что она позволяет нам поддерживать клетки в подвешенном состоянии, чтобы предотвратить стволовые клетки из крепежного-опосредованной дифференциации, чтобы предотвратить г.Анкориджа-зависимые клетки от деления, и, наконец, чтобы уменьшить привязанность к подложке. Следовательно, их использование позволяет создать стрессовое состояние для раковых клеток, который необходим для выбора ЦОНов. Через 24 ч после начала исследования клетки появляются изолированы друг от друга (рисунок 7). После 7 сут мониторинга прогрессирования анализа, небольшие сферические колонии начали формироваться и видны (рис 8). На 28 дней, несколько больших сферических колоний, которые образуются в каждую лунку можно наблюдать (9А, Б). После того, как sarcospheres ВГАе культивировали в течение 28 дней, эти большие сферические колонии могут быть изолированы. На рисунке 10 показаны шаги для выделения sarcospheres от 6-а сверхнизких крепежных пластин и reculturing их под прилипших условиях. На рисунке 11 показаны плавающие сферические колонии после выделения. Крупные сферические колонии высевали в нормальных крепежных пластин показывают клейкий расширение после изоляции (12А, В). Клетки, которые расширяются из отдельных sarcospheres, вероятно, раковые клетки с клетками, как фенотипа стебля. Таким образом, после выделения, OS-ОКК были вероятно получены. Эти клетки называются OSA5-ОКК и OSA6-ЦОК (13А, В).
На этом этапе необходимо приступить к характеристике клеточной фенотипу стволовой для двух линий ОС-CSC, полученных, как описано выше. Анализы для характеристики стволовых клеток, как фенотипа WERе осуществляется на 4 - й проезд субкультуры после того, как были выделены в sarcospheres для каждой линии ОС-CSC. Две клеточные линии, OSA5-ОКК и OSA6-ЦОК, показал сильную положительности поверхностных маркеров MSC (CD105 и CD44) (рис 14А, В и 15А, В), в то время как они показали умеренное положительности поверхности MSC маркера Stro- 1 (16А, В). Наши наблюдения были подтверждены отрицательными результатами , полученными с коммерческой и дифференцированных клеток рака толстой кишки линии HCT8 (рис 14C, 15C Рисунок, Рисунок 16C). Наблюдалось полное отсутствие специфической и неспецифической окрашивания для этих поверхностных маркеров в HCT8 клеточной линии.
Для оценки MSC фенотип двух ОС-ЦОК, мы также провели анализ проточной цитометрии. Обе линии ОС-CSC выражены высокие уровни CD44 и CD105. Тем не менее, из клеток в обеих клеточных линиях, только 1,14% выразили STRO-1. Таким образом, это повторноеSult подтвердил умеренное присутствие Стро-1, как показано с помощью иммунофлуоресценции окрашивания. В противоположность этому, 99,62% от OSA5-ОКК выразили CD44 и 87,38% этих клеток выражается CD105; 99,88% от OSA6-ЦОК выразил CD44 в и 95,79% этих клеток выражается CD105. Кроме того, обе клеточные линии являются CD45-.
Мы оценивали экспрессию 3 ESC маркеров (Nanog, октябрь 3/4, Sox2) и гена CD133, другой ОКК маркер, с помощью RT-PCR. Мы заметили , что все эти гены были выражены в обеих линиях ОС-КАН (рисунок 17). В Adipogenic и остеогенных дифференцировки анализы показали способность обеих изолированных линий OSA-CSC дифференцироваться в остеобласты (Рисунок 18A - D и Рисунок 19A - D) и в адипоциты (рис 20А - D).
Кроме того, КОЕ ssay (рисунок 21) показал хорошую скорость клоногенного эффективности, с 13% для OSA5-ЦОК и 14% для OSA6-CSC. Несколько недавних исследований показали, что высокие уровни активности ALDH характерны различных видов рака. Этот параметр может быть использован в качестве клеточного маркера раковых стволовых и коррелирует с плохим прогнозом. Анализ ALDH активности показала , что обе линии ОС-CSC имеют высокий уровень активности ALDH (рисунок 22), в то время как ALDH активность наблюдалась в нижней количественному пределу в линии фибробластов , который был использован в качестве отрицательного контроля в этом анализе.

Рисунок 1. Примеры ОС биоптатов. (А). Биопсия образец, полученный пункции. (В). Биопсия образец, полученный путем хирургической резекции части опухоли.884 / 53884fig1large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2. Механические Разбивка пробе , взятой OS. (A) Дробление образца с использованием Перри пинцет и ланцет. (B) Фрагменты взвешенные в СМ (указанном стрелкой). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
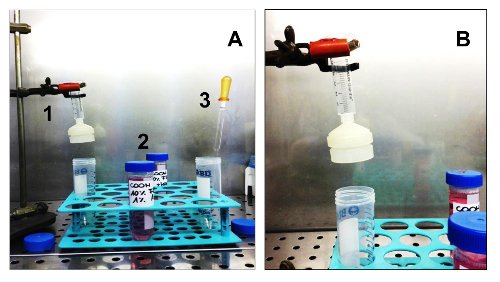
Рисунок 3. Оборудование и расходные материалы, необходимые для Изолировать Sarcospheres. (A). Все оборудование, необходимое для выделения клеток. 1. стерильный шприц со стерильным держателя мембранного фильтра; 2. Два различных средств массовой информации: Г. М.й SCGM; 3. Стерильный стекло пипетки Пастера. (B) Деталь шприца в сборе на опоре, с держателем мембранного фильтра. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4. Блок фильтрации. Несколько компонентов , необходимых для сборки блока фильтрации (А) (чистый фильтр указано стрелкой). Фаза наблюдения контраст сетках 40 мкм (одна сетка обозначена стрелкой) сетчатый фильтр (B). Оригинальное увеличение: 10х. Фильтрацию блок собран (C - D). Блок фильтрации стерилизованы (E). Пожалуйста , нажмите здесь , чтобы увидеть увеличенную веrsion этой фигуры.
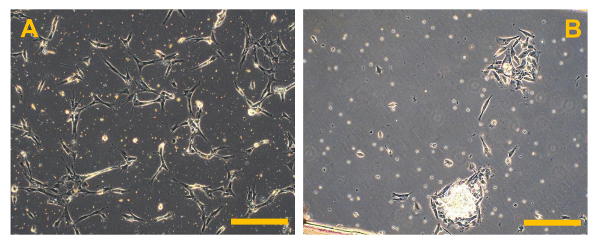
Рисунок 5. Первичные клеточные культуры обычных ОС. Наблюдение фазового контраста первичных клеточных культур высокого класса ОС. В (А), несколько ярких фрагментов кости видны, в то время как в (В), несколько небольших округлых и плавучие эритроцитах присутствуют. Оригинальное увеличение: 10х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
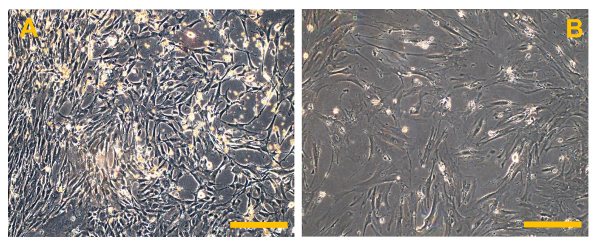
Рисунок 6. Обычные Osteosarcoma Конечные клеточные линии (OSA). (А) OSA5 и (В) OSA6. Наблюдение в фазового контраста.Оригинальное увеличение: 10х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
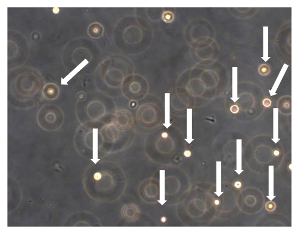
Рисунок 7. Sarcosphere Количественный анализ OSA5 и OSA6. Через 24 ч от начала исследования клетки плавали и изолированы друг от друга (клетки показаны стрелками). Наблюдение в фазового контраста. Оригинальное увеличение:. 20X Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
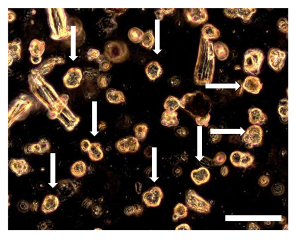
Рисунок 8. Sarcosphere Количественный анализ OSA5 и OSA6 на 7 D. 7 г в анализе, несколько небольших sphericaл колонии, окруженные отдельных клеток можно было наблюдать. В sarcospheres (некоторые из этих sarcospheres обозначены стрелками) появляются плавающие в среде или слегка успокоились на дно колодца. Наблюдение в фазового контраста. Оригинальное увеличение: 20х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
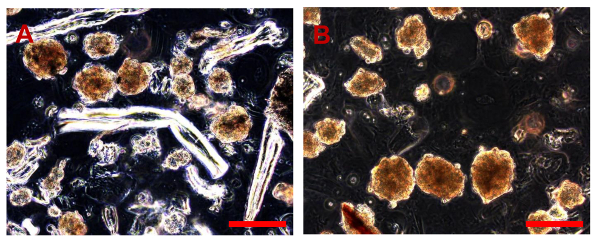
Рисунок 9. Sarcosphere Количественный анализ OSA5 и OSA6 при 28 D. После 28 дней, несколько крупных янтарных sarcospheres наблюдаются в каждую лунку пластин для каждого OSA клеточной линии, OSA5 (А) и OSA6 (B). Размер бар: 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть большую версию этого рисунка.

Рисунок 10. Проходы для выделения Sarcospheres Шаги для изолирующих sarcospheres от 6-хорошо сверхнизких пластин крепления и их reculturing в условиях прилипших показаны (A) Все оборудование , необходимое для изоляции..: 1. Один 6-хорошо сверхнизким пластина с формируемых sarcospheres в каждую лунку 2. шприц с чистым держателем фильтров, 3. пипетки, 4. 1000 мкл стерильные наконечники, 5. 2 стерильные пинцеты Perry, 6. 2 другая культура СМИ , 7. стерильными пипетки Пастера 8. Петри. (B) Коллекция sarcospheres. Среда содержала в каждую лунку собирали с помощью пипетки со стерильным 1000 мкл кончика. (C) Соберите суспензию в шприц. Собранную суспензию переносят в шприц, чтобы начать процесс естественной фильтрации с использованиеммембранный держатель фильтра. (D) Естественная фильтрация. (Е) Дизассемблирование держатель мембранный фильтр из шприца. В конце концов суспензию фильтруют, чистый держатель фильтра разбирают и положить в чашку Петри; (F) Дизассемблирование держатель мембранный фильтр. Sarcospheres содержатся в порах сетчатый фильтр в чистой держателе фильтра, таким образом, они должны быть освобождены с помощью пинцета Перри. (G, H) Удаление sarcospheres из мембранного фильтра. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
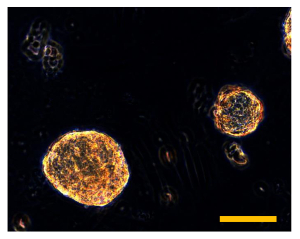
Рисунок 11. Sarcosphere изоляции. Изолированные sarcospheres плавают в среде в 60 мм чашки Петри. Наблюдение в фазе контраста.Оригинальное увеличение: 40х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
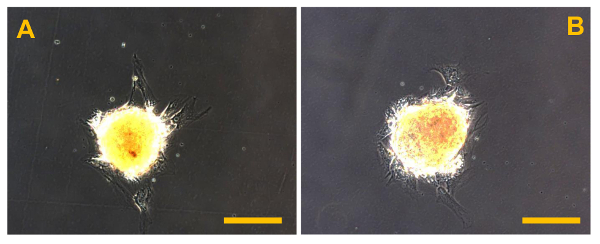
Рисунок 12. Sarcosphere После изоляции. Sarcospheres от OSA5 (А) и OSA6 (B) клеточных линий в начале клейкого расширения следующих реинтродукции и reculturing в монослое при прилипших условиях через 48 часов после выделения. Наблюдение в фазе контраста. Оригинальное увеличение: 20х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
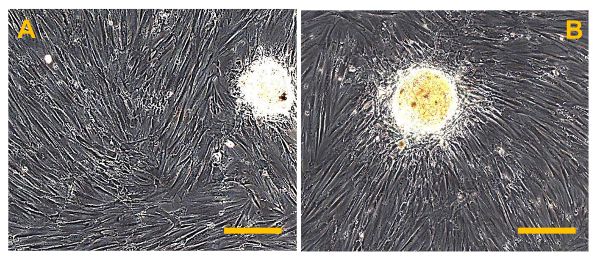
Рисунок 13. Sarcospheres на 7 D После выделения. Sarcospheres из OSA5 (A) и OSA6 (В) клеточных линий показал , прилипший расширение следующих реинтродукции и reculturing в монослое при адгезивных условиях на 7 дней , после выделения. Наблюдение в фазе контраста. Оригинальное увеличение: 20х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
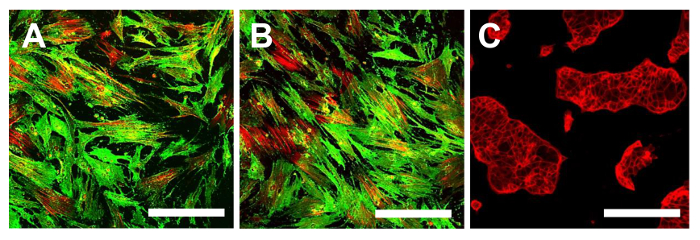
Рисунок 14. иммунофлуоресценции Окрашивание для CD105. Иммунофлуоресценции окрашивания для CD105 в линиях ОСА-CSC OSA5-ЦОК (А) и OSA6-ЦОК (В) и в непрерывной клеточной линии HCT8 (С), который был использован в качестве отрицательного контроля. LSCM в обычном цвете: Зеленый для CD105 и красный для цитоскелета. Оригинальное увеличение: 10х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
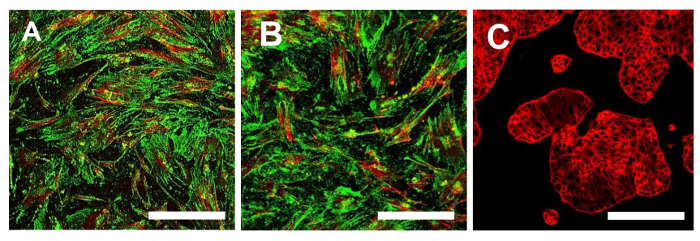
Рисунок 15. иммунофлуоресценции Окрашивание для CD44. Иммунофлуоресценции окрашивание на CD44 в линиях ОСА-CSC OSA5-ЦОК (А) и OSA6-ЦОК (В) и в непрерывной клеточной линии HCT8 (С), который был использован в качестве отрицательного контроля. LSCM в традиционных цветах: зеленый для CD44 и красного для цитоскелета. Оригинальное увеличение: 10х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
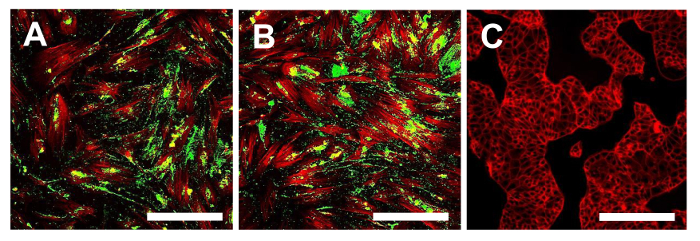
Рисунок 16. иммунофлуоресценции окрашивание иммунофлуоресценции окрашивания Stro1. Для Стро-1 в линиях ОСА-CSC OSA5-ЦОК (А) и OSA6-ЦОК (В) и в непрерывной клеточной линии HCT8 (С), который был использован в качестве отрицательного контроль. LSCM в традиционных цветах: зеленый для Стро-1 и красный для цитоскелета. Оригинальное увеличение: 10х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
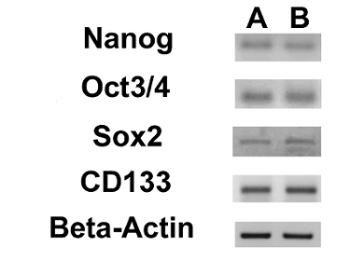
Рисунок 17. Экспрессия ядерных ESC маркеров и из CD133 гена. ОТ-ПЦР , показывающий экспрессию Nanog, октябрь 3/4, Sox2 и CD133 в OSA5-ЦОК (А) и в OSA6-ЦОК ( B). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
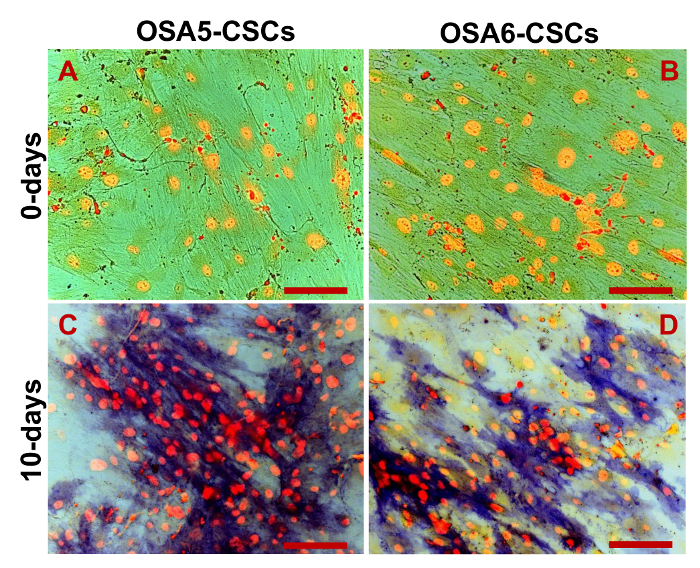
Рисунок 18. Остеогенная Дифференциация анализа -. ALP Остеогенная дифференциация при 0 D (A, B) и после 10 D (C, D) индукции , как определено цитохимической окрашивания для ALP с помощью Fast Синий BB. В синем, ALP + клеток; в красном, ядро контрастному пропидийиодидом. Композитный наблюдение в светлом поле и флуоресценции. Оригинальное увеличение: 20х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 19. Остеогенная Дифференциация анализа. - HA Остеогенная дифференциацию при 0 D (A, B) и после 20 D (C, D) индукции , как определено цитохимической окрашивания для гидроксиапатита (ГА) с ализарин Красной С. Клетки противопоставлены в синий / серый и зернистые отложения HA окрашиваются в красный цвет. Наблюдение в фазового контраста. Оригинальное увеличение: 40х. Размер Bar:. 100 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
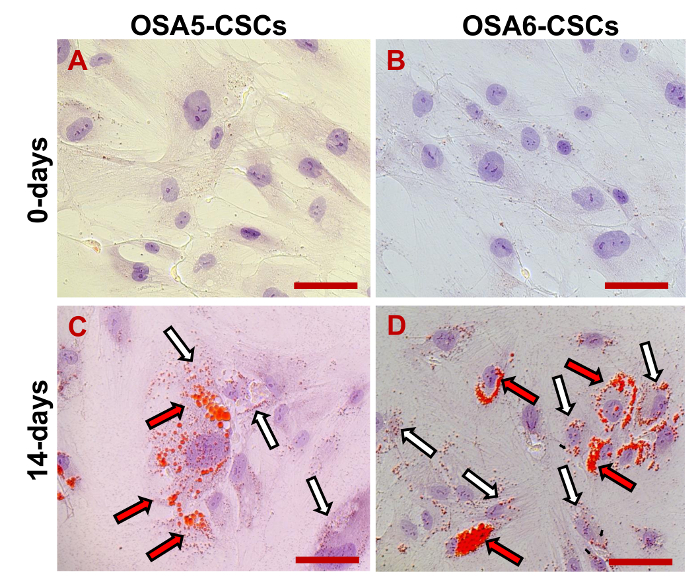
Рисунок 20. Adipogenic Дифференциация анализа. Adipogenic дифференциации при 0 D (A, B) и после того, как 14 г (C, D) индукции , как определено cytochemical окрашивание масляным красным О. красным цветом, липидные везикулы (крупные пузырьки обозначены черные / красные стрелки, мелкие везикулы обозначены белыми / черными стрелками); в синий / фиолетовый, ядра контрастно по гематоксилином. Наблюдение в светлом поле. Оригинальное увеличение: 40х. Размер Bar:. 100 мкМ Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
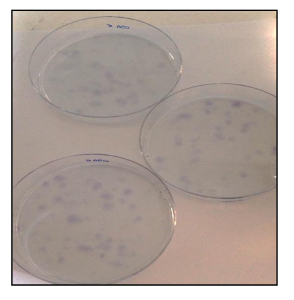
Рисунок 21. КОЕ анализа. КОЕ анализа линий OSA-CSC окрашивали толуидиновым синим. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
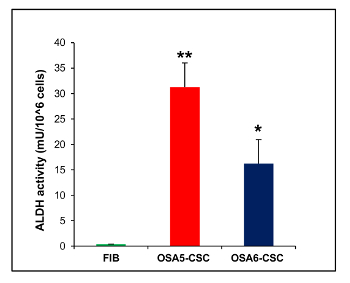 /> Рисунок 22. ALDH Анализ активности. ALDH колориметрический анализ обнаружены высокие уровни ALDH активности в двух линиях ОС-CSC, OSA5-ЦОК и OSA6-ЦОК, в то время анализа обнаружены отсутствие этой активности в конечной дифференцированной клеточной линии фибробластов, FIB. Столбики ошибок: SD. **: Р <0,001 против FIB; *:. Р <0,01 по сравнению с FIB Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
/> Рисунок 22. ALDH Анализ активности. ALDH колориметрический анализ обнаружены высокие уровни ALDH активности в двух линиях ОС-CSC, OSA5-ЦОК и OSA6-ЦОК, в то время анализа обнаружены отсутствие этой активности в конечной дифференцированной клеточной линии фибробластов, FIB. Столбики ошибок: SD. **: Р <0,001 против FIB; *:. Р <0,01 по сравнению с FIB Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Ген | Олигонуклеотиды | Последовательность (5¹-3¹) | Размер Amplicon (п.н.) | Tₐ (° С) | |
| Nanog | Прямой праймер Обратный праймер | 87 | 60 | ||
| октябрь 3/2 | Прямой праймер Обратный праймер | GGGAGGAGCTAGGGAAAGA TCCTTCCTTAGTGAATGAAGAACT | 77 | 60 | |
| Sox2 | Прямой праймер Обратный праймер | TGCAGTACAACTCCATGACC GGACTTGACCACCGAACC | 125 | 55 | |
| CD133 | Прямой праймер Обратный праймер | CCAGAAGCCGGGTCATAAAT ATTCACTCAAGGCACCATCC | 127 | 56 | |
| п.н., пар оснований размера ампликона; Tₐ, отжигтемпература | |||||
Таблица 1. Подробный перечень праймеров для Nanog, октябрь 3/4, Sox2 и CD133 с размером ампликоне и температуры отжига
Обсуждение
ОКК имеют несколько свойств, которые позволяют идентифицировать данного конкретного клеточного подмножества в объеме опухоли. На основе этих характеристик, таких как приобретенную устойчивость к цитотоксической химиотерапии агентов для избыточной экспрессии АТФ-связывающего кассетного ко многим лекарственным эффлюксных транспортеров 28, 32, 33, или для повышающей регуляции экспрессии детоксикацию ферментов , таких как ALDH 32, для выражения определенного маркером поверхности, такие как CD133, CD44, CD34, CD90, и другие 30, 34, 35, 41, несколько различных методов выделения CSCs были разработаны 42-44. Одним из этих методов является сфера Анализ образования, который основан на способности ЦОК расти в неприлипающими условиях.
Способность стволовых клеток и тканей ЦОК для формирования сфер была впервые описана в работах по идентификации нервных стволовых клеток Рейнольдсом и др. 37. Впоследствии, Гиббс и др. 38 насред эти исследования, чтобы начать изоляцию CSCs от солидных опухолей, в частности, из костей сарком. Мы решили использовать метод анализа формирования сферы иллюстрируется Гиббс и др. , Чтобы изолировать CSCs от линий OSA клеток , полученных из обычных биопсий ОС. Мы адаптировали оригинальный метод, чтобы улучшить результаты этого анализа и облегчить его воспроизводимости для других клеточных линий рака. Что касается создания Анализ образования сферы, мы убедились, что покрытие 40000 клеток / лунку является хорошей практикой для поддержания клеток в изоляции в начале анализа. Этот трюк очень важно, чтобы избежать возможности того, что сферические колонии родиной происхождения из клеточной агрегации, а не от конкретного и исключительной способности одного CSC расти в неприлипающими условиях и образуют сферическую колонию. Эта способность является особенно критической точкой этого анализа.
Мы также подтвердил, что, чтобы получить хорошую скорость образования сферы, То достаточно, чтобы обновить аликвотах факторов роста каждые 3 d и не каждый день, как это описано в оригинальном способе. В этом исследовании мы также создали и широко описаны хороший способ выделения сферических колоний, которые образуются, когда культивируют в неприлипающими условиях. Этот шаг имеет решающее значение в этом анализе, потому что очень важно, чтобы попытаться изолировать, поскольку многие из сфер, как это возможно, которые образуются в каждую лунку, не повредив их. Кроме того, важно, чтобы изолировать только сферы, а не на отдельные клетки, которые могут находиться в виде суспензии в течение всего срока анализа. Чтобы преодолеть эти критические точки, мы разработали особый метод изоляции, который, как было показано выше, дал хорошие результаты для CSC изоляции. Очевидно, что существует вероятность того, что не все сферы, которые сформированы, могут быть восстановлены, но процент потерь очень низок. Действительно, у нас также есть возможность использовать фильтр с 40 мкм поры, чтобы изолировать сферы после того, как они становятся большими (формае изд приблизительно 100 - 200 клеток).
Эта изоляция останавливает формирование сферы, но позволяет отдельные клетки, часть остатка метилцеллюлозы, а наименьшее сферы для фильтрации. Эта элиминация проводится путем тщательного фильтрации, как описано в протоколе.
Кроме того, выбор наиболее крупных сферических колоний через сетку 40 мкм с последующей потерей самых маленьких сферических колоний позволяет выбрать CSCs с самой высокой емкости с образованием сферических колоний и с большей стволовости. Все эти модификации были выполнены, чтобы улучшить анализ и помочь исследователям, занимающимся изучением CSCs, чтобы понять и воспроизвести наиболее важный шаг оригинального метода анализа формирования сферы.
Среди исследований , касающихся методов пробирке для выделения ЦОК, это исследование с целью показать , как это адаптированный анализ формирования сферы может быть хорошим способом для выделения из CSCsклеточные линии ОАС. Адаптация к оригинальному способу и детального метод выделения описано повышения его эффективности. В течение короткого времени, большое количество ОКК могут быть получены и использованы в течение нескольких экспериментов. Таким образом, можно быстро подтвердить стволовой как фенотипы и, в частности, для изучения двойной шток фенотипу, характеризующую OS-CSCs. Таким образом, этот модифицированный тест может быть хорошим методом для выделения CSCs и изучения их биологии. В дальнейшем этот метод, с помощью дополнительных приспособлений, также могут быть использованы для выделения CSCs от других линий конечных клеток рака, полученных биоптатов редких солидных опухолей.
Возможность выделения CSCs из редких твердых опухолей, таких как ОС, не только позволяет улучшение исследований в отношении этой конкретной рака, но также распространяется на изучение различных видов рака, чтобы разработать более эффективные методы для их изоляции и будущих исследований биологии это важное подмножество сотовой связи. Поэтому, как мысделали в этом исследовании, важно, чтобы улучшить методы CSC изоляции на основе изучения CSC биологии, с конечной целью поиска молекулярных мишеней и развития очень специфическую противоопухолевую терапию, направленную против этого конкретного клеточного подмножества, которое, вероятно, отвечает за содержание первичной опухоли, развитие ее повторения, и происхождение метастазов в нескольких органах. Изучение биологии CSC также имеет важное значение для поиска методов лечения, которые могут быть проницательный в лечении раковых заболеваний, таких как ОС, для которой коэффициент выживаемости после неоадъювантной лечения остается очень бедным.
Раскрытие информации
The authors declare that they have no competing financial interest.
Благодарности
This study was supported by ITT (Istituto Toscano Tumori) Grant Proposal 2010.
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco's Phosphate Buffered Saline with Ca2+ and Mg2+ (DPBS) | LONZA | BE17-513F | _ |
| Dulbecco's Phosphate Buffered Saline without Ca2+ and Mg2+ (DPBS) | LONZA | BE17-512F | _ |
| Porcine Trypsin 1:250 | BD Difco | 215310 | Solvent: DPBS. Stock concentration: Powder |
| Ethylenediamine tetraacetic acid disodium salt dihydrate(EDTA) | Sigma-Aldrich | E4884 | Solvent: DPBS. Stock concentration: Powder |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C0130 | Solvent: Buffer Solution, pH 7.4. Stock concentration: Powder |
| Dimethyl sulphoxide (DMSO) | BDH Chemicals-VWR | 10323 | _ |
| Nutrient Mixture F-12 Ham | Sigma-Aldrich | F6636 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| 2-Phospho-L-ascorbic acid trisodium salt | Sigma-Aldrich | 49752 | Solvent: DPBS. Stock concentration: 5 mg/mL |
| β-Glycerol phosphate disodium salt pentahydrate | Sigma-Aldrich | 50020 | Solvent: DPBS. Stock concentration: 1 M |
| Insulin. Human Recombinant | Sigma-Aldrich | 91077 | Solvent: NaOH 0.1 M. Stock concentration: 10 mM |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I5879 | Solvent: DMSO. Stock concentration: 500 mM |
| Indomethacin | Sigma-Aldrich | I7378 | Solvent: DMSO. Stock concentration: 200 mM |
| Dexamethasone | Sigma-Aldrich | D4902 | Solvent: DMSO. Stock concentration: 1 mM / 100 µM. Store in liquid nitrogen to maintain the biological activity |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | _ |
| Fetal Bovine Serum South America | EUROCLONE | ECS0180L | _ |
| Penicillin-Streptomycin (PEN-STREP) 10,000 U/mL | LONZA | DE17-602E | _ |
| Methyl cellulose | Sigma-Aldrich | 274429 | Solvent: Ultrapure dH2O. Stock concentration: 2% |
| Putresceine dihydrochloride | Sigma-Aldrich | P5780 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| apo-Transferrin | Sigma-Aldrich | T-1147 | Solvent: DPBS. Stock concentration: 25 mg/mL |
| Human Epidermal Growth Factor (EFGF) | Sigma-Aldrich | E5036 | Solvent: DPBS pH 7.4. Stock concentration: 10 µg/mL |
| Fibroblast Growth Factor-Basic Human | Sigma-Aldrich | F0291 | Solvent: DPBS + 0.2% BSA. Stock concentration: 25 µg/mL |
| Selenous Acid | Sigma-Aldrich | 211176 | Solvent: DPBS. Stock concentration: 30 mM |
| Progesterone | Sigma-Aldrich | P8783 | Solvent: ETOH. Stock concentration: 10 mM |
| Toluidine Blue O | Sigma-Aldrich | 198161 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Oil Red O | ICN Biochemicals | 155984 | Solvent: 2-Propanol. Stock concentration: Powder |
| Naphtol AS-MX Phosphate Disodium Salt | Sigma-Aldrich | N5000 | Solvent: DMSO. Stock concentration: Powder |
| Fast Blue BB Salt | Sigma-Aldrich | F3378 | Solvent: Tris HCL, pH 9.0. Stock concentration: Powder |
| Fast Red Violet LB Salt | Sigma-Aldrich | F3381 | Solvent: Tris HCL, pH 9.1. Stock concentration: Powder |
| Bovine Serum Albumin, Fraction V (BSA) | Sigma-Aldrich | A-4503 | Solvent: DPBS. Stock concentration: 2% |
| Alizarin Red S | ICN Biochemicals | 100375 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Formaldehyde solution | Sigma-Aldrich | 533998 | 4% |
| Triton-100X | MERCK | 11869 | Solvent: DPBS. Stock concentration: 0.2%. Danger - Use only under chemical hood |
| Calcein | MERCK | 2315 | Solvent: DPBS . Stock concentration: 200 µg/mL |
| 2-Propanol | MERCK | 109634 | Danger - Use only under chemical hood |
| Ab-CD105 (Mouse monoclonal [SN6] to CD105 (FITC) | Abcam | ab11415 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD44 (Mouse monoclonal [F10-44-2] to CD44 (PE/Cy7®) ) | Abcam | ab46793 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD45 (Mouse monoclonal [MEM-28] to CD45 (PerCP)) | Abcam | ab65952 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD105 (Human CD105 Purified Antibody) | Invitrogen | MHCD10500 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-CD44 (Anti-CD44 Antibody) | Abcam | EPR1013Y(ab51037) | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-Stro-1 (Mouse anti-STRO-1) | Invitrogen | 398401 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 488 (Anti-Rabbit IgG (Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L)) | Invitrogen | A-21206 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| FITC Anti-Mouse IG (FITC-Rabbit Anti Mouse IgG (H+L)) | Invitrogen | 61-6511 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 635 Phalloidin | Invitrogen | A34054 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| AutoMACS™Running Buffer MACS Separation Buffer | Miltenyi | 130,091,221 | Liquid. Store at 4 °C |
| QIAzol®Lysis Reagent | QIAGEN | 79306 | Danger - Use only under chemical hood |
| QUANTITECT® Reverse Transcription Kit | QIAGEN | 205314 | _ |
| Chlorophorm | Sigma-Aldrich | C2432 | Liquid. Danger - Use only under chemical hood |
| Laminar flow hood | GELAIRE | BSB6A | _ |
| Chemical hood | ARREDI TECNICI Villa | Modello DYNAMICA | _ |
| Centrifuge | EPPENDORF | 5415R | _ |
| Laser Scanning Confocal Microscopy LSM 5109 Meta | ZEISS | _ | _ |
| iCycler PCR Thermalcycler | BIORAD | _ | _ |
| CyFlow®SPACE | (PARTEC) | _ | _ |
| Inverted Micrposcope Axiovert 200M | ZEISS | _ | _ |
| Freezing container , | Nalgene | _ | _ |
| Original Pipet-Aid | pbiBrand | _ | _ |
| Micropipettes | EPPENDORF | _ | _ |
| Glass Pasteur Pipette | SIGMA | _ | _ |
| VICTOR3™ | PERKIN ELMER | _ | _ |
| Conical tubes (15 and 50 mL) | BD FALCON | 352096 (for 15 mL) 352070 (for 50 mL) | _ |
| 24-Well Clear Flat Bottom TC-Treated Multiwell-Cell-Culture-Plate | BD FALCON | 353047 | _ |
| 6-Well Clear Flat Bottom Ultra Low Attachment Multiple-Well-Plates | CORNING | 3471 | _ |
| Serological pipettes (5 and 10 mL) | BD FALCON | 357543 (for 5 mL) 357551 (for 10mL) | _ |
| Syringe (5mL) | B|BRAUN | 4617053V | _ |
| Petri dish 100X20 mm | BD FALCON | 353003 | _ |
| Röhren Tubes (3.5 mL, 55x12mm, PS) | SARSTEDT | 55,484 | _ |
| Petri dish 60X15 mm | BD FALCON | 353004 | _ |
| Cryovials 1.5 mL | NALGENE | 5000-1020 | _ |
| Cell-Culture Flasks 25 cm² | BD FALCON | 353014 | _ |
| Nylon Net Filter, Hydrophilic | MERCK | NY4104700 | _ |
| Swinnex Filter Holder | MERCK | SX0002500 | _ |
| Perry tweezer | _ | _ | _ |
| Lancet | _ | _ | _ |
| Dounce | _ | _ | _ |
Ссылки
- Reddick, R. L., Michelitch, H. J., Levine, A. M., Triche, T. J. Osteogenic sarcoma: a study of the ultrastructure. Cancer. 45 (1), 64-71 (1980).
- Gatta, G., et al. Childhood cancer survival trends in Europe: a EUROCARE Working Group study. J. Clin. Oncol. 23 (16), 3742-3751 (2005).
- Olstad, O. K., et al. Molecular heterogeneity in human osteosarcoma demonstrated by enriched mRNAs isolated by directional tag PCR subtraction cloning. Anticancer. Res. 23 (3B), 2201-2216 (2003).
- Geller, D. S., Gorlick, R. Osteosarcoma: a review of diagnosis, management, and treatment strategies. Clin Adv Hematol Oncol. 8 (10), 705-718 (2010).
- Tang, N., Song, W. X., Luo, J., Haydon, R. C., He, T. C. Osteosarcoma development and stem cell differentiation. Clin. Orthop. Relat. Res. 466 (9), 2114-2130 (2008).
- Kempf-Bielack, B., et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J. Clin. Oncol. 23 (3), 559-568 (2005).
- Meyers, P. A., et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J. Clin. Oncol. 23 (9), 2004-2011 (2005).
- Gorlick, R., et al. Biology of childhood osteogenic sarcoma and potential targets for therapeutic development: meeting summary. Clin. Cancer Res. 9 (15), 5442-5453 (2003).
- Hayden, J. B., Hoang, B. H. Osteosarcoma: basic science and clinical implications. Orthop. Clin. North Am. 37 (1), 1-7 (2006).
- Thomas, D., Kansara, M. Epigenetic modifications in osteogenic differentiation and transformation. J. Cell. Biochem. 98 (4), 757-769 (2006).
- Araki, N., et al. Involvement of the retinoblastoma gene in primary osteosarcomas and other bone and soft-tissue tumors. Clin. Orthop. Relat. Res. 270 (270), 271-277 (1991).
- Chou, A. J., Gorlick, R. Chemotherapy resistance in osteosarcoma: current challenges and future directions. Expert. Rev. Anticancer Ther. 6 (7), 1075-1085 (2006).
- Arndt, C. A. S., Crist, W. M. Common musculoskeletal tumorsof childhood and adolescence. N. Engl. J. Med. 341 (5), 342-352 (1999).
- Longhi, A., Errani, C., De Paolis, M., Mercuri, M., Bacci, G. Primary bone osteosarcoma in the pediatric age: state of the art. Cancer. Treat. Rev. 32 (6), 423-436 (2006).
- Bacci, G., et al. Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at the istituto ortopedico rizzoli according to the istituto ortopedico rizzoli/osteosarcoma-2 protocol: an updated report. J. Clin. Oncol. 18 (24), 4016-4027 (2000).
- Clarke, M. F., et al. Cancer stem cells-perspectives on current status and future directions: AACR workshop on cancer stem cells. Cancer. Res. 66 (19), 9339-9344 (2006).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367 (6464), 645-648 (1994).
- Bonnet, D., Dick, J. E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med. 3 (7), 730-737 (1997).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumors: accumulating evidence and unresolved questions. Nat. Rev. Cancer. 8 (10), 755-768 (2008).
- Bapat, S. A. Evolution of cancer stem cells. Semin. Cancer Biol. 17 (3), 204-213 (2007).
- Rubio, D., et al. Spontaneous human adult stem cell transformation. Cancer. Res. 65 (8), 3035-3039 (2005).
- Burns, J. S., et al. Tumorigenic heterogeneity in cancer stem cells evolved from long-term cultures of telomerase-immortalized human mesenchymal stem cells. Cancer. Res. 65 (8), 3126-3135 (2005).
- Zhang, M., Rosen, J. M. Stem cells in the etiology and treatment of cancer. Curr. Opin. Genet. Dev. 16 (1), 60-64 (2006).
- Li, Y., et al. Evidence that transgenes encoding components of the Wnt signaling pathway preferentially induce mammary cancers from progenitor cells. Proc. Natl Acad. Sci. USA. 100 (26), 15853-15858 (2003).
- Sell, S. Cellular origin of cancer: dedifferentiation or stem cell maturation arrest?. Environ Health Perspect. 101 (Suppl 5), 15-26 (1993).
- Wernig, M., et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448 (7151), 318-324 (2007).
- Niwa, H., Miyazaki, J., Smith, A. G. Quantitative expression of oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat. Genet. 24 (4), 372-376 (2000).
- Hochedlinger, K., Jaenisch, R. Nuclear reprogramming and pluripotency. Nature. 441 (7097), 1061-1067 (2006).
- Dean, M., Fojo, T., Bates, S. Tumor stem cells and drug resistance. Nat. Rev. Cancer. 5 (4), 275-284 (2005).
- Ma, S., Lee, T. K., Zheng, B. J., Chan, K. W., Guan, X. Y. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway. Oncogene. 27 (12), 1749-1758 (2008).
- Wu, C., et al. Side population cells isolated from mesenchymal neoplasms have tumor initiating potential. Cancer. Res. 67 (17), 8216-8222 (2007).
- Ma, I., Allan, A. L. The role of human aldehyde dehydrogenase in normal and cancer stem cells. Stem. Cell. Rev. 7 (2), 292-306 (2011).
- Awad, O., et al. High ALDH activity identifies chemotherapy-resistant Ewing's sarcoma stem cells that retain sensitivity to EWS-FLI1 inhibition. PLoS One. 5 (11), e13943 (2010).
- Fujii, H., et al. Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines. Int. J. Oncol. 34 (5), 1381-1386 (2009).
- Di Fiore, R., et al. Genetic and molecular characterization of the human osteosarcoma 3AB-OS cancer stem cell line: a possible model for studying osteosarcoma origin and stemness. J. Cell. Physiol. 228 (6), 1189-1201 (2013).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonicprogenitor cell produces neurons and astrocytes. J. Neurosci. 12 (11), 4565-4574 (1992).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Gibbs, C. P., et al. Stem-like cells in bone sarcomas: implications for tumorigenesis. Neoplasia. 7 (11), 967-976 (2005).
- Beccari, N., Mazzi, V. . Manuale di tecnica microscopic. Casa Editrice Dr. Francesco Vallardi Società Editrice Libraria. , 99-100 (1966).
- Majumdar, M. K., Thiede, M. A., Mosca, J. D., Moorman, M., Gerson, S. L. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J. Cell. Physiol. 176 (1), 57-66 (1998).
- Tirino, V., et al. Human primary bone sarcomas contain CD133+ cancer stem cells displaying high tumorigenicity in vivo. FASEB J. 25 (6), 2022-2030 (2011).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. FASEB J. 27 (1), 13-24 (2013).
- Martins-Neves, S. R., et al. Therapeutic implications of an enriched cancer stem-like cell population in a human osteosarcoma cell line. BMC Cancer. 12 (1), 139 (2012).
- Tang, Q. L., et al. Enrichment of osteosarcoma stem cells by chemotherapy. Chin. J. Cancer. 30 (6), 426-432 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены