Method Article
がんの確立は、ヒト従来の骨肉腫からの幹細胞培養物
要約
骨肉腫における癌幹細胞(CSCを)の存在は、最近、その病因に関連しています。本稿では、非接着性条件下で増殖するのCSCの能力を用いて、従来の骨肉腫(OS)の人間の生検から得られた初代細胞培養物からのCSCの単離を提示します。
要約
骨肉腫(OS)に対する治療における現在の改善は、癌患者の生命を延長しているが、転移が発生した場合に5年の生存率は悪いまま。癌幹細胞(CSC)理論は、腫瘍を維持し、多剤化学療法に抵抗する能力を含む幹様特性を有する腫瘍内の腫瘍細胞のサブセットが存在することを保持します。したがって、OS生物学および病因論のより良い理解は、この特定のサブセットを根絶し、患者の間で罹患率および死亡率を減少させるために標的治療の開発を進めるために必要とされます。 、のCSCの単離のCSCの細胞培養を確立し、それらの生物学を研究すると、OSの生物学および病因の我々の理解を改善するための重要なステップです。 OSの生検からのヒト由来のOS-のCSCの確立がnonadhere下3次元幹細胞培養物を作成する能力を含むいくつかの方法を用いて可能になりましたNT条件。これらの条件下では、CSCを娘幹細胞によって形成された球状の浮遊コロニーを生成することができます。これらのコロニーは、「細胞球」と呼ばれます。ここでは、OSの生検から得られた従来のOSの初代細胞培養物からのCSCの培養物を確立するための方法を記載しています。我々は明らかにのCSCを分離し、特徴付けるために必要ないくつかの通路を説明します。
概要
肉腫は胚の中胚葉1から主に由来するまれな悪性の結合組織腫瘍の異種群です。異なるタイプの骨肉腫および軟部組織肉腫を含みます。骨肉腫は、比較的まれ原発腫瘍のグループは、骨肉腫(OS)を含むいくつかのサブタイプ、で構成されています。 OS、骨の最も一般的な原発腫瘍の一つは、大規模な臨床、組織学的、および分子不均質2、3を示す間葉系悪性腫瘍である。残念ながら、OSは5、子供におよび若年成人4で主に発生し、60%を占めます小児期における骨肉腫の一般的な組織学的サブタイプは6、7。OSは通常影響を与える急速な骨の成長によって特徴付けられる骨格領域、( 例えば 、長骨の骨幹)。 OS、従来のOSの組織学的に異なるサブタイプの中でも、また髄または中央OSと呼ばれる、悪性度の高いグレードとクォータ社を持っています80%8の再。この80%、60%、従来の骨芽細胞のOS、10%軟骨芽OS、および10%の線維芽OS 6、8-10から構成されています。他のOSのサブタイプは、未分化、毛細血管拡張、巨細胞が豊富で小細胞OSが含まれています。 OS管理で組み合わせ、手術と化学療法の進歩にもかかわらず、結果は転移11、12のない患者では65から70パーセントの長期生存率は、貧しいまま。遠い再発が頻繁に転移として、それほど頻繁に、肺転移として発生したり、遠くの骨や地元の再発13へ。転移は、多くの場合、従来の治療に抵抗性です。この抵抗は、10年の無病生存率は診断14、15に転移性疾患を有する患者では約30%である理由です。
正常組織と同様に、癌組織は、細胞型の異種コレクションから構成されています。腫瘍内の細胞は、発生の異なる段階に対応するように見えます。任意のn個以内ormal組織は、このように組織の恒常性のための前駆細胞および成熟細胞を提供し、selfrenewする能力を有する細胞の亜集団を常駐します。同様に、癌が増殖および腫瘍形成能の程度が異なると、発生の異なる段階における細胞の同様の不均一な集団で構成されています。これらの癌細胞のサブセットは、がん幹細胞(CSCを)と呼ばれる、このようにして腫瘍塊16を構成する種々の細胞系統を生成する、腫瘍の悪性度をselfrenewし維持する排他的な能力を有する細胞をselfsustainingのリザーバを構成しています。 1990年代には、急性骨髄性白血病の研究は、CSCの亜集団17、18の存在のための最初の説得力のある証拠を提供した。CSCがあるため、それによって癌研究の中で最も研究テーマの一つになって、固形腫瘍19の多数から単離されています。 CSCが実際に正常を作る遺伝子の変異により正常な幹細胞から生じる可能性があります20-23癌幹細胞。微小環境を持つ複数の転換の突然変異と相互作用ものCSCを代表するselfrenewal容量と不死を取得し、健康な前駆細胞および成熟細胞に寄与し得ます。この変換に関するいくつかの仮説があります。健康な前駆細胞、健康な成熟細胞、癌細胞は、selfrenewal関連遺伝子24-28を活性化することにより幹様表現型を得る、幹細胞に脱分化することができます。いくつかの最近の研究にもかかわらず、CSCをの起源はまだ発見されなければなりません。
CSCの特定の特性は、その容量は異なる薬剤との併用手術と化学療法で構成されたマルチ治療アプローチを、抵抗することです。最近の研究でのCSCはまた、細胞毒性化学療法剤に対する耐性を獲得することができることを示しています。この抵抗のための可能な説明は、ATP結合カセット(ABC)多剤輸送体( すなわち、の過剰発現を含みますMDR1およびBCRP1)、アルデヒドデヒドロゲナーゼ1(ALDH1)、および/または細胞周期動態30-33の変化として化学療法代謝酵素の過剰発現。これまでに記載されているすべてのこれらの概念の直接的な結果は、CSCの亜集団が完全に排除された場合にのみ、1つでもCSCが生き残った場合は局所再発や遠隔転移が発生する可能性がありながら、癌治療は、効率的であるということです。
それは多くの治療が最初に有効であると思われる理由として可能性のある説明が、患者後に再発していますので、人間の肉腫34、特にOS 35で、または任意の他の骨と軟部組織のがんでのCSCの発見は、大きな臨床的重要性を持っています。そのため、従来のOSに対する今後の戦いのための希望は、このサブの分子特性にOS-のCSCのおかげに向けた革新的な医薬品の開発に基づいて、新しいと特定の標的療法を見つけることです人口とCSC生物学の研究に。
1992年には、幹細胞のサブセットは、成人哺乳類の脳に存在したかどうかを調査したレイノルズらは、幹細胞様細胞36、37であることが疑われる細胞を分離する方法を開発した。この方法は、特定の能力に基づいています非付着条件下で増殖するとき、これらの細胞は球状のコロニーを形成します。同様の技術は、骨肉腫38中の幹細胞様細胞の亜集団を研究するために2005年にギブスらによって採用されました。従来のOSの異なるタイプの初代細胞培養物から、OSのCSCを単離し、特徴づけるために、我々は、OS細胞株は、この技術を適応することを決定しました。
ここでは、球体形成アッセイのこの適合方法を説明し、従来のOSのヒト生検に由来する有限の初代細胞株からOS-のCSCを単離することができる「sarcosphereアッセイ」と呼ばれます。我々はまた、すべての技術のuを記述しますこのアッセイにより単離された細胞株の幹様CSC表現型を検証するためのsed:多能性胚性幹細胞(ESC)を特徴づける遺伝子とのCSCのマーカーであるCD133遺伝子の発現の1)の評価を、 2)コロニー形成単位(CFU)アッセイ。 3)適切な分化条件下での骨芽細胞と脂肪細胞に分化するために、これらの細胞の能力を評価します。間葉系幹細胞(MSC)の表面マーカーの4)研究( すなわち、CD44、CD105及びSTRO-1)の免疫蛍光染色により、フローサイトメトリー分析によって、 5)これらの細胞のALDH活性を評価します。
プロトコル
本明細書に記載されたヒト組織を用いたすべての実験は地域の倫理委員会(リフ。N. 12分の141)によって承認されました。組織サンプルの収集のためのサンプルの使用および貯蔵のためのインフォームドコンセントをAOUCにドナーから得ました。
文化1.準備
- 10%ウシ胎児血清(FBS)、100 IU / mlのペニシリンおよびクーンの改変ハムF12培地に100μg/ mlのストレプトマイシンを追加することによって、成長培地(GM)を準備します。濾過し、0.22μmのフィルターを使用してGMを殺菌。 4℃で1ヶ月まで保存GM。
- クーンの改変ハムF12培地に、20%FBS、100 IU / mlペニシリン、100μg/ mlのストレプトマイシンおよび3 mg / mlでコラゲナーゼII型を追加することによって、コラゲナーゼ培地(CM)を調製します。濾過し、0.22μmのフィルターを使用してCMを殺菌。最大1ヶ月まで-20℃で保存CM。
- 100μg/ mlのストレプトマイシンおよび6、FBS、100IU / mlのペニシリンを40%添加することにより(FM)の凍結細胞のための培地を調製クーンの改変ハムF12培地に.5%のジメチルスルホキシド(DMSO)。フィルタと0.22μmのフィルターを使用してFMを殺菌。最大1ヶ月まで4℃で保存FM。
- クーンの修正されたハムF12培地に20%FBS、100 IU / mlのペニシリンおよび100μg/ mlストレプトマイシンを添加することにより、CFUアッセイ(CFUM)のための媒体を準備します。フィルタと0.22μmのフィルターを使用してCFUMを殺菌。 4℃で1ヶ月まで保存CFUM。
- 2+ の Ca 2+およびMgなし千中のグルコース無水ミリリットルダルベッコのリン酸緩衝生理食塩水(DPBS) - 400 mgのトリプシン、200mgのEDTA及び1,000mgののD(+)を溶解することにより、トリプシンを準備します。
注:0.22μmのフィルターを用いて、25cm 2のフラスコ中の50mlアリコートに、新鮮なトリプシンEDTAを分割し、3ヶ月まで-20℃で凍結します。ストアは、活性の損失なしに4℃で濾過滅菌し、アリコートを解凍しました。 - 、100 IU / mlペニシリン、100μg/ mlのstreptom 10%FBSを添加することにより、幹細胞成長培地(SCGM)を調製クーンの修正されたハムF12培地にycin、および10 ngの/ mlのbFGF(25 / mlのストック)。 4℃で2週間まで0.22μmフィルターとストアSCGMを使用してSCGMをフィルタリングします。
- 3日間4℃での超純H 2 OでMCを溶解させることにより2%メチルセルロース(MC)を準備します。 MCが完全に溶解されたとき、それをオートクレーブし、4℃で保存。
注記:MCは、滅菌された後、それは固体になります。 4℃で液体状態、店にMCをもたらすために。 - sarcosphere成長培地(SGM)を準備します。 100 IU / mlのペニシリンを追加することによって、この培地の新鮮な(使用前にはない2週間以上)を準備し、100μg/ mlのヒトbFGF(25 / mlのストック)、20 nMのプロゲステロン(10μMストック)、100μMのプトレシン、30 nMの亜セレン酸ナトリウム(30μMストック)、25μgの2X / mlのトランスフェリン(25 mg / mlでストック)、20 / mlのインスリン(20 mg / mlでストック)、および10ng / mLのヒトEGF(10μgの/ mLのストック)クーンのは、ハムF12培地を変更しました。 0.22μmのフィルを使用してSGMを濾過し、滅菌ター。 4℃で最大2週間保管してください。
- 、100μg/ mlのストレプトマイシンを100 IU / mlのペニシリンを10%FBS(南アメリカの原点)を追加することにより、骨形成培地(OM)を準備し、10 nMのデキサメタゾン(100μMストック)、0.2 mMのナトリウムL-アスコルビン酸-2-リン酸(1 Mストック)、クーンの修正ハムF12培地に10mMのβグリセロリン酸(5 mg / mlでストック)および1 / mlのカルセイン(200 / mlのストック)。フィルタと0.22μmのフィルターを使用して、OMを殺菌。 4℃で保存。
注:液体窒素下で保存デキサメタゾンストック溶液は、それらの活性を維持します。媒体の分化能を維持するために、デキサメタゾンの活性を維持するために2週間ごとに新鮮なOMを準備します。 - 1.66 mgのNH 4 Clで、水(のdH 2 O)を200mlの蒸留中の0.2mgのK 2 HPO 4および0.007ミリグラムのEDTAを溶解することにより赤血球溶解バッファー(ELB)を準備します。濾過し、0.22μmのフィルターを使用してELBを殺菌。 4°で保存C.
- 追加することによって、脂肪生成培地(AM)を準備し、10%FBS(南米由来)、100 IU / mlのペニシリン、100μg/ mlのストレプトマイシン、1μMデキサメタゾン(1 mMストック)、1μMのウシインスリン(10 mMストック)、0.5 mMのイソブチルメチルキサンチン(IBMX)(500 mMストック)、および100μMのインドメタシン(200 mM)のクーンの修正ハムF12培地に。濾過し、0.22μmのフィルターを使用してAMを殺菌。 4℃で保存。
注:液体窒素下で保存デキサメタゾンストック溶液は、それらの活性を維持します。媒体の分化能を維持するために、デキサメタゾンの活性を維持するために2週間ごとに新鮮なAMを準備します。 - 調製2%DPBSでウシ血清アルブミン(BSA)(BSA / DPBS)。 500ミリリットルのDPBS中の10グラムのBSAを溶解し、50mlコニカルチューブに50ミリリットルストック溶液を等分することによってストック溶液を調製。 -20℃で保管してください。
- DPBS(PFA / DPBS)中の4%パラホルムアルデヒド(PFA)の溶液を調製します。 CHでemicalフードは、DPBS中でパラホルムアルデヒドを希釈し、50ミリリットルコニカルチューブに50ミリリットルストック溶液を等分することによってストック溶液を調製します。 4℃で保存。
2.プライマリOS細胞培養およびOS有限細胞株(OSA)の確立
注:プライマリOS細胞培養物」は、UNITA Ortopedia Oncologica電子のRicostruttiva」、AOUC Careggi、フィレンツェで収集し、従来のOS生検の新鮮なサンプルから調製しました。針吸引または腫瘍( 図1A、B)の小部分の外科的切除によって得られたすべての生検は、すぐに100 IU / mlペニシリンおよび100μg/ mlストレプトマイシン液(pH7.4)で補充した培地中に入れましたそれらが処理された実験室に輸送しました。全て記載操作は、層流フードを使用して無菌条件下で行いました。
- OS細胞の単離
- 生検を配置GMの小容量と100ミリメートルペトリ皿。滅菌ランセット及びペリーピンセットを用いて、できるだけ小さな断片にそれらを切断することにより、OSの組織サンプルをみじん切り(0.8 - 1 mm)の( 図2A、B)。
- 酵素消化( 図2B)を10 mLのCMで組織片を覆い、37℃、5%CO 2インキュベーター内で3時間インキュベートします。静かにピペットを用いて、フラグメントのサスペンションを削除し、その断片をペレット化(5分間400×gで)即時の遠心分離のために15ミリリットルコニカルチューブに移します。
注:生検は、赤血球が豊富であれば遠心分離した後、赤血球から成る赤デポジットが断片上で見ることができます。したがって、機械的分散に進む前に、赤血球溶解緩衝液で試料を処置します。吸引により上清を捨て、5ミリリットルELBを追加します。 - 1分間ペレットの断片を一時停止し、2、400×gで懸濁液を遠心分離分。吸引により上清を取り除きます。 5ミリリットルGMを追加して、機械的に血清学的ピペット(開口サイズ、1.5ミリメートル内部Ø)10ミリリットルを使用して断片を分散させる10から20回。
- 5分間400×gで懸濁液を遠心。 、吸引により上清を除去し10ミリリットルGMと細胞ペレットを中断し、その後100ミリメートルペトリ皿に得られた細胞懸濁液を移します。 37°C、5%CO 2インキュベーター内でペトリ皿をインキュベートし、新鮮な完全GMとGMを3日毎に交換してください。
注意:かなり頻繁に、針吸引によって得られたOSの組織試料は、非常に小さく、コラゲナーゼで酵素消化により消化されていない骨片を含みます。上清を除去した後従って、ピペットでペレット断片を叩解することによって骨組織から細胞を分離することを試みます。
- サブカルチャー
注:細胞がおおよそのコンフルエンスに達したときにOSAを確立するには、theiからそれらを削除r個の培養容器は、希釈し、さらなる成長を可能にするために、新鮮なプレートに配置します。この継代培養手順は、トリプシン処理と呼ばれる酵素の手順を用いて達成されます。- 吸引により培地を除去します。 、 - (20°C最大18)軽く一回振ると、吸引によってすぐにトリプシンを除去し、室温で3 mlのトリプシン - 細胞単層を分離するには、2を追加します。二回繰り返します。彼らはデタッチし始めるまで、4分間 - 3 37℃で細胞をインキュベートします。
注:良いトリプシン処理は、皿が光に保持されているときに小さな穴がわずかに不透明な単層で形成するものとして経験のあるユーザーが見ることができます。この解離はまた、倒立顕微鏡を用いてモニターすることができます。このアプローチは、初心者にお勧めです。 - 10ミリリットルのGMを追加することにより、トリプシン反応を停止し、すべての細胞を剥離するためにピペットを用いてウェルディッシュを洗います。新しい100ミリメートルペトリ皿に移し懸濁液1mlをし、9ミリリットルGM(セルの1/10分割)を追加します。
注意: 残りの細胞懸濁液は、細胞増殖(さらに100 mmのペトリ皿への転送)のために使用することができる(参照(セクション2.3を参照)を凍結保存することができ、または増殖アッセイまたは他の目的のために計数し、実験皿またはウェルに播種することができます以下)。
- 吸引により培地を除去します。 、 - (20°C最大18)軽く一回振ると、吸引によってすぐにトリプシンを除去し、室温で3 mlのトリプシン - 細胞単層を分離するには、2を追加します。二回繰り返します。彼らはデタッチし始めるまで、4分間 - 3 37℃で細胞をインキュベートします。
- OS初代培養およびOSAの凍結保存
注:4-5クライオバイアルに1コンフルエント100ミリメートルペトリ皿をフリーズします。凍結中の細胞膜を保護し、DMSOは、非凍結温度での細胞に毒性であるため、凍結保存の処理が迅速に行わなければなりません。- トリプシン処理により単層からの細胞培養物を解離、5分間400×gで遠心分離することによって、ペレット細胞を(2.2節を参照)吸引により上清を除去し、その後すぐにFMで細胞ペレットを中断。
- アリコート極低温バイアル当たりこの懸濁液の1ミリリットル。すぐに2-プロパノール及び店舗immediaのジャケットを冷凍庫ボックスに充填したバイアルを置きますtely -80 CO / N°。転送は、液体窒素に長期保存のために翌日にクリオバイアル。
- デフロストOS細胞株および初代培養
- 液体窒素保存から解凍OS細胞株を、37℃の実験室の水浴中に置くことにより、急速に解凍クライオバイアル。 (DMSOを除去するために、2.3節を参照してください)15ミリリットルコニカルチューブにクライオバイアルの内容を転送し、GMの約10ミリリットルを追加します。吸引により上清を除去し、10ミリリットルのGMで細胞ペレットを中断。プレート100 mmのペトリ皿中の細胞懸濁液を、37℃、5%CO 2インキュベーター内でインキュベートします。
アイソOS-のCSC 3. Sarcosphereアッセイ
注記:この実験は、OSA上で実行されます。この実験の持続時間は、これらの球コロニー(sarcospheres)を形成する細胞の能力に関連する、時間の範囲、7、14、21、及び28日です。
- ESTABsarcosphereアッセイのlishment
- 血球計室と事前に全ての試薬を準備します。
- (2.2節を参照)を吸引により培地を除去し、トリプシン処理により単層から細胞を解離します。ピペッティングは、任意の塊を分散し、20μLのピペットチップを使用して10μLを収集するために、徹底的に細胞懸濁液を混ぜます。
- 、血球計数器のチャンバの端に直ちに10μlの細胞懸濁液を転送懸濁液を排出し、それは毛管作用によりカバースリップの下で描画することを可能にします。
- 位相コントラストの下で血球計数器チャンバーを観察します。 10倍対物レンズを選択し、チャンバー内のグリッド線に焦点を当てます。カウント用の補助としてサブディビジョン(また、3本の平行線によって結合された)と、単一のグリッド線を使用して、この1ミリメートル2領域に横たわって細胞を数えます。
- 濃度を測定し、次式適用:1ミリリットル= N * 10 4 / Z(nはすべてカウント中の細胞の全体数を正方形1ミリメートル2。 Z:カウント正方形1ミリメートル2)の数。 6穴超低接着プレートにウェル毎に40,000セルに分割24万細胞の総量をプレートに必要な細胞懸濁液の体積を計算します。
注:1つの余分なウェルに細胞をプレーティングすることによって、細胞の正確な数をめっきしてください。そのため、めっきされるべき細胞の総量は28万細胞です。 - 25cm 2のフラスコ中で、2%MC(SGM-MC)の50%を追加することで、35ミリリットルSGMを準備します。 1つの余分な井戸をめっきするために、余分な5ミリリットルを考慮しSGMの全体積を準備します。
- フラスコ中で調製SGM-MCへの細胞懸濁液の計算されたボリュームを追加し、任意の塊を分散させるためにピペットを用いて穏やかに混合します。 6ウェル超低接着プレートに細胞をプレーし、メッキされた後、細胞がどのように表示されるかを観察するために倒立顕微鏡を使用しています。
- 37℃、5%CO 2インキュベーター中で細胞をインキュベートします。すべての3 dは、FRを追加します成長因子の濃度をリフレッシュするために、各ウェルにbFGFおよびEGFのESHアリコート。各ウェル中の10ng / mlの最終濃度での両方を維持するために2μLbFGFおよび5μLEGFを追加します。
- sarcospheresの単離
注:形成されsarcospheresを隔離する必要がある場合を決定するために7、14、21、および28日でsarcosphereアッセイの良好な進行状況を監視します。- 層流フード( 図3A、B)内のすべての試薬や機器を準備します。メンブレンフィルターホルダーに直径25mmと40μmのメッシュのネットフィルタを配置することによって濾過ユニットを組み立てます。オートクレーブ処理( 図4A-E)で滅菌します。
- ウェルごとに1,000μLチップで滅菌ピペットを用いて滅菌メンブレンフィルターホルダーをシリンジにsarcospheresを含む培地を移します。完全sarcospheresを含む培地を除去した後、アドオンによってよく洗います5ミリリットルGMをると、注射器にすべての球を転送するようにしてくださいします。すべてsarcospheresが回復されているかどうかを確認するために顕微鏡を使用してください。そうでない場合、この手順を繰り返して進みます。
- 球体の損傷を防ぐために、それによって球の損失を回避し、フィルターを通して交差sarcospheresを回避するために、圧力をかけず重力のみによってメンブレンフィルターホルダーとサスペンションをフィルタリングします。静かに滅菌ガラスパスツールピペットを使用して気泡を除去。
注:時々ろ過は、膜フィルターホルダーにおける気泡の存在によって遮断されます。 - シリンジに10ミリリットルのGMを追加し、それが単一細胞を排除することを確認するために圧力をかけずフィルタリングさせることによって濾過ユニットを洗ってください。シリンジからフィルターユニットを離れて取り、ペトリ皿に入れて。
- ペリーピンセットを用いた膜フィルターホルダーからネットフィルターを外して60ミリメートルにピンセットで軽く振ってそれを洗います膜のもつれからsarcospheresを解放するためにペトリ皿。その後、ウェル内膜を配置し、膜に絡まっそれ以上の球がないことを顕微鏡観察により確認します。球がまだ膜に絡まっている場合はステップ3.2.4で説明したように、別の洗浄を進めます。
- 顕微鏡を使用してリリースしsarcospheresを守ってください。 37℃、5%CO 2インキュベーターでリリースsarcospheresをインキュベートします。 6ウェル超低接着プレートの各ウェルのためのすべての手順を繰り返します。
4. OS-CSC行
注:OS-のCSCは、それらは、超低接着条件下でもはや小60ミリメートルペトリ皿にプレートされた後、単層でこれらの細胞を再導入しないと再培養することにより接着性、拡張性を示すsarcospheresから得られます。
- OS-CSCの文化
- 彼らは60で約90%コンフルエンスに達したときに、さらなる成長、継代培養細胞を有効にするにはミリメートルペトリ皿。 OS-CSCの文化を確立するための手順を繰り返し2.2.1。
- 4ミリリットルSCGMを追加することにより、トリプシン処理を停止し、すべての細胞を剥離するためにピペットを用いて、ウェルディッシュを洗います。新しい100ミリメートルペトリ皿に細胞懸濁液を移し、6ミリリットルSCGMを追加します。 OS-のCSCは、セクション2.2を繰り返すことにより、90%コンフルエンス、サブカルチャーに達すると。
注:単離されたOS-のCSCの幹細胞様の表現型を特徴付けるためのインビトロ分析のために、細胞をプレートの異なるタイプに播種することができます。 - (セクション2.3のすべての手順を繰り返し)凍結保存によって確立されたOS-CSCラインを保持します。セクション2.4のすべてのステップを繰り返すことによって、凍結保存されたOS-のCSCを解凍。
5. インビトロA nalysis OS-のCSCを特徴付けるために:
- 免疫蛍光のための細胞の調製
注:彼らは24ウェルナンプラーの各ウェルに合流の右等級に達したとき、細胞をパラホルムアルデヒドで固定されています。TE。合流のグレードは、実験の種類に関係しています。- 免疫蛍光法によって表面間葉系幹細胞(MSC)のマーカーを研究するために、24ウェルプレート中のプレートのOS-のCSC。 60%コンフルエンス - 彼らは50に到達したときに、各ウェルの細胞を修正しました。吸引によってSCGMを削除し、DPBS 24ウェルプレート中で二回洗います。
- 化学フードの下で、各ウェルに500μLの4%PFA / DPBSを追加します。室温で10分間インキュベートします。 PFA / DPBSを削除して、超高純度の dH 2 Oで3回洗浄24ウェルプレートは、ドラフト内で乾燥することができます。
- MSCマーカーの免疫蛍光
注:4%PFA / DPBSで固定OS-のCSCの免疫蛍光染色は、CD44、STRO-1およびCD105に対する抗体を用いたOS-のCSCのMSC様の表現型を調べるために使用することができます。以下の方法は、筆者らが日常的に使用されます。- 化学フードでは、500μL0.2を追加することにより、4%PFA / DPBSで固定されている細胞を透過性%トリトンX-100 / DPBSを各ウェルに。 37℃で30分間細胞をインキュベートします。優しく細胞はDPBSで3回洗浄します。追加300μLのRNaseを細胞に2%BSA / DPBSで1 / 1,000に希釈し、30分間37℃でインキュベートします。
- 静かに2%BSA / DPBSで3回細胞を洗浄します。 MSCマーカーについて細胞を染色。唯一の各抗体のための陽性対照として選ばれたウェルに一次抗体を追加します。
- 抗CD105は、2%BSA / DPBSで1/10に希釈し、300μLを追加し、300μL抗CD44は、2%BSA / DPBSで1/10に希釈し、300μLの抗STRO-1の2%BSA / DPBSで1/10に希釈しそして唯一の200μLの2%BSA / DPBS各抗体のための陰性対照として選ばれたウェルに。
- 4°CO / Nで湿潤環境下で細胞をインキュベートします。ウェルを2%BSA / DPBSで二回、その後DPBSで3倍と洗ってください。
- 具体的な二次抗体を添加することにより、一次抗体を明らかにしました。
- 300μLの抗ウサギIgGを(ロバ抗ウサギIgGの[H + 1])を1/100に希釈した追加2%BSA / DPBSで各ウェルCD44およびCD105に対する陽性および陰性対照として選ばへ。追加300μLのFITC抗マウスIg(FITCウサギ抗マウスIgG [H + L])を各ウェルにSTRO-1陽性および陰性対照として選択中の2%BSA / DPBSで1/100に希釈しました。 60分間室温で暗所で細胞をインキュベートします。ウェルをDPBSで6倍洗います。
- 300μLを添加することにより、細胞骨格アクチン染色するMSCマーカー陽性細胞は、MSCマーカー免疫蛍光のために各ウェルに染色に2%BSA / DPBSで1/100に希釈したファロイジン。
- RTで40分間細胞をインキュベートします。ウェルをDPBSで3回洗浄した後、超純の dH 2 Oで二回洗って上記の免疫蛍光染色後の核の対比染色に進みます。ドラフト内でヨウ化プロピジウム溶液をDPBS中10 -5 M(株1.5×10 -3 M)を準備します。
- 上記のようにうまく色のそれぞれに200μLヨウ化プロピジウム溶液を加えます。細胞をインキュベートRTで3分間 - 2秒。超純の dH 2 Oでウェルを2回洗浄
注:セクション5.1のすべての手順を繰り返し- 5.2細胞株HCT8、ネガティブコントロールとして使用される主連続分化した結腸癌細胞株に。
- 上記のようにうまく色のそれぞれに200μLヨウ化プロピジウム溶液を加えます。細胞をインキュベートRTで3分間 - 2秒。超純の dH 2 Oでウェルを2回洗浄
- 骨形成分化アッセイ
注:骨形成分化は20日間持続します。- SCCGM 1×10 4細胞/ cm 2の細胞密度で24ウェルプレート中にプレートOSは、CSCを。各ウェルに90%の密集度 - 彼らは80に達するまで細胞がSCGMに成長することを可能にします。
- OMにSCGMを変更することにより、骨形成分化を開始します。 4日間 - 細胞がOMに成長し、メディアごとに3を更新することができます。アルカリホスファターゼ(ALP)の存在を評価するために、10日間で骨形成分化アッセイを停止します。
- 4%PFA / DPBSで細胞を固定(5.1節を参照してください)。 ALPのためにとHAのために細胞化学染色により骨芽細胞表現型を評価しますアリザリンレッドS染色を用いて。
- ALP細胞化学染色
注:すぐに染色を開始する前に、化学フード内の染料混合物を準備します。- 40 mgのファーストブルーBBまたは50ミリリットルのTris-HCl、pHが9(溶液A)におけるファストレッドバイオレットLB塩を溶解させます。 DMSO 1 ml中(溶液B)中5mgナフトールAS-MXリン酸ナトリウム塩を溶解します。完全に溶液Aに溶液Bを加え、よく混ぜ、DPBSで二回ソリューションC.洗浄細胞を得ます。
- 各ウェルに1ミリリットル溶液Cと37°Cでインキュベートし、5%CO 2から500μLを追加します。顕微鏡下で細胞を観察することにより、10分毎に染色する過程を監視します。
- ALP陽性細胞が激しく、通常30分以内に発生する、(ファストレッドバイオレットLB塩とのファーストブルーBB塩または赤と青)のカラーになったときに、染色を停止します。細胞は染色iの沈殿物場合は溶液Cのすべての残留物を除去するために超高純度のdH 2 Oで3回洗浄し現在のは、無水エタノールで速やかに細胞を1回洗浄します。
- ステップ5.2.5および5.2.5.1に記載されているようにALP染色後の核の対比染色に進みます。
- アリザリンレッドS細胞化学染色
注:実験を開始する前に、染料混合物を準備します。- (超純H 2 Oの100ミリリットルで2グラムアリザリンレッドS)2%アリザリンレッドSを準備します。 pHが6.0に到達するために2%アリザリンレッドSに2.5%NH 3を追加します。 4°Cで保存し、2%アリザリンレッドS溶液。 DPBSで細胞を1回洗浄します。
- ほんの数秒のために細胞にアリザリンレッドSを追加します。
- 染色の程度を制御するために、超高純度のdH 2 Oでウェルを洗浄します。 HA預金が強く着色されていない場合、ステップ5.3.5.2を繰り返します。通常は数分以内に発生したHA預金が着色激しく赤くなり染色を、停止します。超純のdH 2 Oでウェルを洗浄
- 脂肪細胞への分化
注:アッセイ期間は、OS-CSC回線に依存します。 30 D - アッセイは、14を最後にすることができます。- SCGM 1×10 4細胞/ cm 2の細胞密度で24ウェルプレート中にプレートOSは、CSCを。各ウェルに90%の密集度 - 彼らは80に達するまで細胞がSCGMに成長することを可能にします。 AMにSCGMを変更することにより、脂肪細胞への分化を開始します。細胞がAMに成長し、週に2回AMをリフレッシュすることができます。
- 脂質小胞が表示されているときに脂肪細胞への分化アッセイを停止します。オイルレッドO染色による核のために対比ヘマトキシリンにより脂肪生成表現型を評価します。
- 核のためのヘマトキシリンの対比
注:実験を開始する前に、染料混合物を準備します。- Emallume Carazzi 39と呼ばれる5%のヘマトキシリン液を準備します。 4℃で溶液を保管してください。わずか2分間Emallume Carazziを追加します。 ULTでウェルを洗浄rapureのdH 2 O
- CFUアッセイ
注:この実験は三連で実行する必要があります。- プレートOS-CSCを100 mmのペトリ皿中でCFUM / cm 2で450細胞の細胞密度で。 4週間37℃、5%CO 2インキュベーター中で細胞をインキュベートします。週に2回CFUMを更新します。
- トルイジンブルーでのCFUを染色します。倒立顕微鏡を用いて着色されたコロニーを数えます。以下の式に従ってCFU効率を計算する:(コロニー数を形成/播種した細胞の数)* 100。
- ALDHの活性分析
注:ALDH活性は、二つのOS-CSCライン上及び陰性対照として使用した有限の線維芽細胞株、のALDH活性を比色アッセイキットを使用して評価されています。このキットは、450nmで読んだの吸光度によってALDH酵素活性を定量化します。すべての試験は三重に行われています。- トリプシン処理により単層からの細胞培養物を解離(2.2節を参照してください)。 5分間400×gでの遠心分離によって細胞をペレット。製造業者のプロトコルに従ってください。
- フローサイトメトリー分析:
注:単一細胞懸濁液をフローサイトメトリーのためのサンプルの最適な染色のために必要とされます。単一細胞懸濁液は、試験される各抗体のために準備する必要があります。トリプシン処理により単層からの細胞培養物を解離(2.2節を参照してください)。- / 1×10 5細胞の最終細胞濃度で、細胞懸濁液を得るために、分離緩衝液の適切な容積チャンバを数えるBürkerを用いて細胞数、遠心セル400×gで再懸濁を行って、コニカルチューブに細胞懸濁液を置きミリリットル。
- 遠心機で4℃で5分間細胞懸濁液。上清を捨て、分離緩衝液でペレットを洗浄。二回、この手順を繰り返します。
- MSのための染色細胞Cマーカー( すなわち 、CD44、CD105及びSTRO-1)40。
- フローサイトメーターで陽性に染色された細胞懸濁液を分析します。 1 D内でマークされたサンプルを分析します。分析まで4℃でこれらのサンプルをインキュベートします。
- RT-PCR
- RNAの抽出および単離
- OS-のCSCの細胞冷凍パックのサンプルに1ミリリットルの溶解試薬を加え、上下に数回ペレットをピペッティングすることにより、チューブ内で直接細胞を溶解。
- 4℃で1分間、12,000×gでサンプルを遠心。静かに上清を除去します。上清を新しいチューブに移し、200μlのクロロホルムを追加し、安全にチューブをキャップ。 15秒間激しくチューブを振るし、室温で5分間サンプルをインキュベートします。
- 4℃で15分間、12,000×gでサンプルを遠心。混合物は、3つの異なる相に分離します。 RNAは、無色の上部の水相中にもっぱらあります。
- PAビーイングrticularly慎重に、水相のみを除去し、RNA単離を進めるために新しいチューブにこのフェーズを移します。水相を含むチューブに500μLのイソプロパノールを追加します。手で軽くチューブを振ります。室温で10分間サンプルをインキュベートします。 4℃で10分間、12,000×gでサンプルを遠心。
注:サンプルを遠心分離した後、それは側チューブの底にゲル状のペレットを形成するRNAを、見ることが可能です。 - 底のRNAのペレットを残すように注意しながら、チューブから上清を取り除きます。チューブに1ミリリットルの75%エタノールを追加します。ボルテックス数秒間手で管した後、4℃で5分間、7500×gでチューブを遠心します。
- RNAペレットを乾燥エタノールと空気を捨てます。上下に数回ソリューションをピペッティングすることによって - (50μL10)ペレットが乾燥しているときは、RNaseフリー水でRNAペレットを再懸濁します。
- MEASによってRNAの収量および純度を決定260nmで分光光度計を用いて280nmでの吸光度をuring。標準1%アガロースゲル上の全RNAの完全性を評価します。 -80℃でRNAを保管してください。
- 逆ポリメラーゼ連鎖反応
- 逆転写キットを用いて、500 ngのRNAをサンプルから第一鎖cDNAを合成します。氷上で解凍RNAサンプルとは、室温で、キットに含まれ、必要なソリューションを解凍します。製造業者のプロトコルに従ってcDNAを合成するために進んでください。
- 半定量的逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)
- 24μLの最終反応容量で鋳型として各サンプルについて1μLのcDNAを使用して、すべてのPCRを行います。 Nanogを、10月3月4日、SOX2、およびCD133遺伝子の増幅のために、表1に記載されたプライマー配列を使用してください。
- 臭化エチジウムで1.8%アガロースゲル電気泳動および染色によってRT-PCR産物を分離します。 UVイルミネーションの下で写真ネーション。
- RNAの抽出および単離
結果
正確に処理された場合、プロトコル部( 図2A、B)で説明したように、針吸引または腫瘍( 図1A、B)の小部分の外科的切除によって得られたOSサンプルは、唯一のOSAの単離を可能にします。 50% - 残念ながら、生検から単離された細胞の数は30から出力範囲と、低いです。出力タイプと生検( 図5A、B)の大きさに依存します。これらの細胞は正確に処理されなければなりません。初代培養物を100mmペトリ皿にコンフルエントに到達するためにその結果、約1ヶ月が必要です。この時間の後、OSAをOSA5とOSA6( 図6A、B)がマークされている2つのOSのサンプルから得られます。そして、LINのキャラクタリゼーション分析を実行するために、細胞を凍結保存するために、細胞の十分な数を得るために、一次細胞株を継代培養することが必要ですエス。両方のOSA初代細胞株はコンフルエントに達したときに継代培養の第3の通路で、それらはsarcosphereアッセイのために6穴超低接着プレートに播種します。それは私達を許可するため、プレートのこのタイプは、懸濁状態で細胞を維持するために、添付媒介分化の幹細胞を防ぐために、分割の足場依存性細胞を防ぐために、最終的に、基板に付着を低減するために使用されます。したがって、それらの使用は、CSCを選択するために必要である癌細胞にストレス条件を作成するために、私たちを可能にします。 24時間でアッセイを開始した後、細胞( 図7)が互いに分離現れます。アッセイの進行を監視する7日後に、小さな球状のコロニーが形成し始め、目に見える( 図8)があります。 28日で、各ウェル内に形成されているいくつかの大きな球状コロニー( 図9A、B)を観察することができます。 sarcospheresは、肝炎後eは28日間培養され、これらの大きな球状コロニーを単離することができる。10は、6ウェル超低接着プレートからsarcospheresを単離し、付着条件の下でそれらを再培養するための手順を示しています。 図11を分離した後の浮遊球状コロニーを示しています。通常のアタッチメントプレートに入れ、大きな球状コロニーを単離する( 図12A、B)の後に付着した展開を示しています。単一sarcospheresから展開した細胞は、おそらく幹細胞様の表現型を有する癌細胞です。したがって、単離後、OS-のCSCは、おそらく得ました。これらの細胞はOSA5-CSCおよびOSA6-のCSC( 図13A、B)と命名されています。
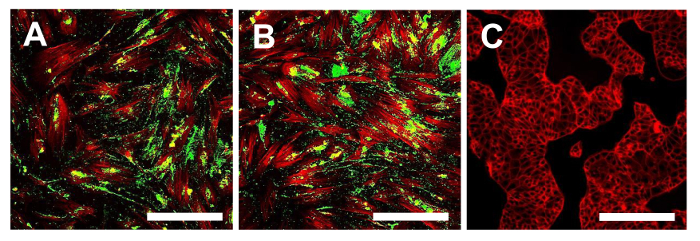
この時点で、上述のように、得られた二OS-CSCラインのための幹細胞様表現型の特徴付けを続行する必要があります。幹細胞様の表現型WERの特徴づけのための分析各OS-CSC回線のsarcospheresを単離した後に電子はサブカルチャーの4 番目の通路上で実行しました。彼らは表面MSCマーカーのための適度な陽性を示した2つの細胞株、OSA5-CSCおよびOSA6-のCSCは、表面MSCマーカー(CD105及びCD44)( 図14A、B及び図15A、B)に対する強い陽性を示したSTRO-1 1(図16A、B)。我々の観察は、商業および分化した結腸癌細胞株HCT8( 図14C、図15C、図16C)を用いて得られた陰性の結果によって確認されています。 HCT8細胞株におけるこれらの表面マーカーに特異的な非特異的染色の完全な欠如が観察されました。
2 OS-のCSCのMSC表現型を評価するために、私たちも行っフローサイトメトリー分析します。両方のOS-CSC株はCD44およびCD105を高レベルで発現しました。しかし、両方の細胞株における細胞のわずか1.14%がSTRO-1を発現しました。したがって、この再免疫蛍光染色によって示されるように、SULTは、STRO-1の中程度の存在を確認しました。これとは対照的に、OSA5-のCSCの99.62パーセントは、CD44を発現し、これらの細胞の87.38パーセントは、CD105を発現しました。 OSA6-のCSCの99.88パーセントは、中でCD44を発現し、これらの細胞の95.79パーセントは、CD105を発現しました。さらに、両方の細胞株は、CD45-です。
我々は、RT-PCRにより、3 ESCマーカー(Nanogの10月3/4、Sox2の)およびCD133遺伝子、別のCSCマーカーの発現を評価しました。私たちは、これらの遺伝子の全てが両方のOS-CSCライン( 図17)で発現させたことに気づきました。 ( 図20A - D)および脂肪細胞に脂肪生成および骨形成分化アッセイは、骨芽細胞(D - - Dおよび 図19A 図18A)への分化の両方孤立OSA-CSC回線の容量を示しました。
さらに、CFU ssay( 図21)は OSA5-CSCのための13%とOSA6-CSCのための14%で、クローン原性効率の良い速度を示しました。いくつかの最近の研究は、ALDH活性の高いレベルは、癌の様々なタイプの特徴であることが示されています。このパラメータは、癌幹細胞マーカーとして使用することができ、予後不良と相関しています。 ALDH活性アッセイは、ALDH活性はこのアッセイで陰性対照として使用した線維芽細胞株において低い定量化限界で観察された両方のOS-CSCラインは、ALDH活性( 図22)の高いレベルを有することを示しました。

OS生検サンプルの図1の実施例(A)。生検試料は針吸引によって得られます。 (B)。腫瘍の一部の外科的切除によって得られた生検試料。884 / 53884fig1large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

OSサンプルの図2.機械的脱凝集。(A)ペリーピンセットを用いて、サンプルの断片化とランセット。 (B)フラグメントは、CM(矢印で示す)に懸濁した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
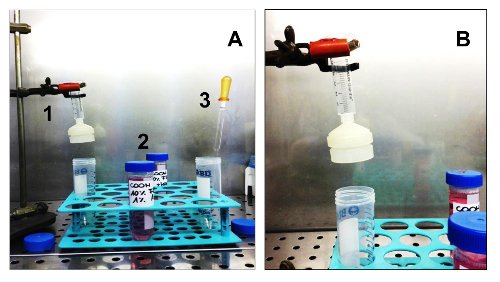
Sarcospheresを分離するために必要な図3.機器および消耗品。(A)。細胞単離のために必要なすべての機器。 1.滅菌膜フィルターホルダーとの無菌注射器。 2.二つの異なるメディア:GM AND SCGM; 3.滅菌ガラスパスツールピペット。 (B)メンブレンフィルターホルダーと、支持体上に組み立てられた注射器の詳細は、。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4濾過ユニット。濾過ユニット(A)の (ネットフィルタが矢印で示されている)を構築するために必要ないくつかの構成要素。ネットフィルタ(B)の40ミクロンメッシュの位相差観察(1つのメッシュを矢印で示しています)。オリジナル倍率:10X。濾過ユニット組み立て(C - D)。濾過ユニット滅菌(E)。 拡大表示はこちらをクリックしてくださいましこの図のrsion。
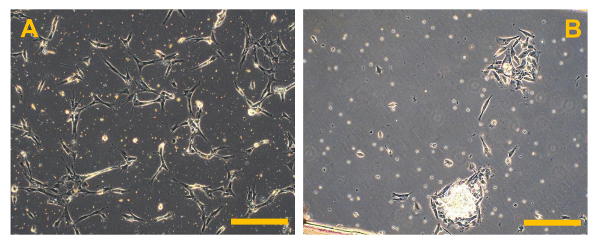
図従来のOSの5初代細胞培養物。ハイグレードOSの初代細胞培養物の位相差観察。 (B)において、いくつかの小さな丸い浮遊赤血球が存在している間(A)において、いくつかの明るい骨片は、表示されています。オリジナル倍率:10X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
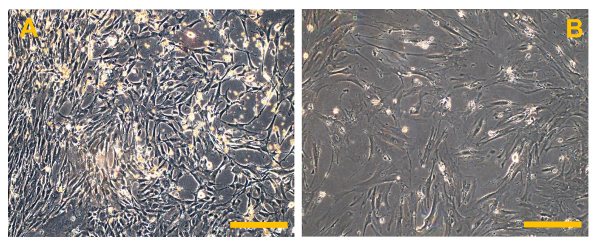
図6.従来の骨肉腫有限細胞株(OSA)。(A)OSA5及び(B)OSA6。位相コントラストで観察。オリジナル倍率:10X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
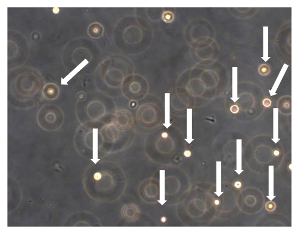
図OSA5とOSA6 7. Sarcosphereアッセイは、アッセイの開始から24時間後、細胞を浮遊させ、互いに分離(細胞を矢印で示しています)。位相コントラストで観察。オリジナル倍率:20X この図の拡大版をご覧になるにはこちらをクリックしてください。
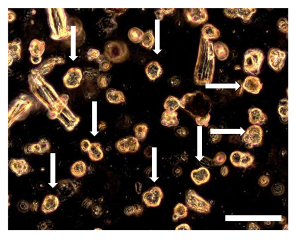
アッセイに7 D. 7 d における図8 OSA5のSarcosphereアッセイおよびOSA6、いくつかの小さなフェリカ単一細胞に囲まリットルのコロニーが観察されました。 sarcospheres(矢印で示されているこれらのsarcospheresの一部)を培地中に浮遊またはわずかにウェルの底に落ち着いて見えます。位相コントラストで観察。オリジナル倍率:20X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
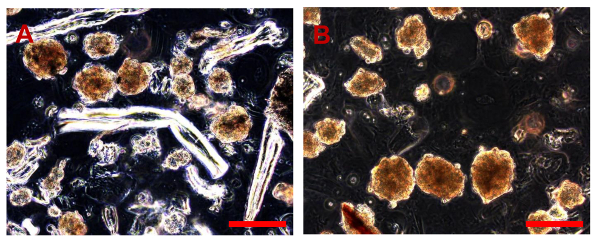
図9 Sarcosphere OSA5のアッセイおよびOSA6は28 D.で 28日後、いくつかの大規模な琥珀色のsarcospheresは、各ウェルOSA細胞株、OSA5(A)とOSA6(B)のためのプレートのそれぞれで観察されています。バーサイズ:100μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

Sarcospheresの単離のための図10通路 6ウェル超低接着プレートからsarcospheresを単離し、付着条件の下での再培養が示されている手順(A)単離するために必要なすべての機器。。: 1.各ウェルに、ネットフィルターホルダー2.シリンジ、3ピペット、4千μL滅菌ヒント、5 2滅菌ペリーピンセット、6 2つの異なる培養培地に形成されsarcospheresの一つの6ウェル超低プレート7.滅菌したパスツールピペット8ペトリ皿。 (B)sarcospheresのコレクション。各ウェルに含まれている媒体は、滅菌千μLチップでピペットを用いて収集されます。 (C)シリンジ中の懸濁液を収集します。回収した懸濁液を用いて、自然濾過プロセスを開始するために注射器に転送されます。メンブレンフィルターホルダー。 (D) 自然ろ過。 (E)をシリンジからメンブレンフィルターホルダーの分解。すべての懸濁液を濾過した後、ネットフィルタホルダは、離れて採取し、ペトリ皿に置かれます。 (F) メンブレンフィルターホルダーを分解。 Sarcospheresはネットフィルターホルダーの純フィルタの細孔に含まれているので、ペリーのピンセットを使用して解放する必要があります。 (G、H) メンブレンフィルターからsarcospheresの除去。 この図の拡大版をご覧になるにはこちらをクリックしてください。
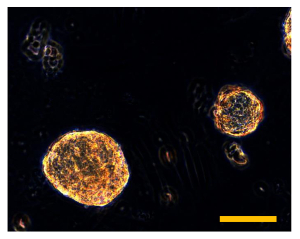
図11. Sarcosphere分離。孤立sarcospheresは60ミリメートルペトリ皿に培地中に浮遊します。位相コントラストで観察。オリジナル倍率:40X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
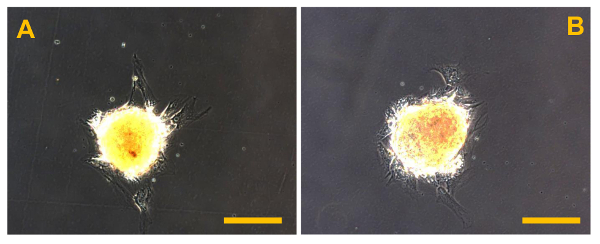
分離した後、図12 Sarcosphere OSA5から。Sarcospheres(A)と単離後48時間目に付着した条件で単層に再導入し、再培養を以下の付着性拡大の先頭にOSA6(B)細胞株。位相コントラストで観察。オリジナル倍率:20X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
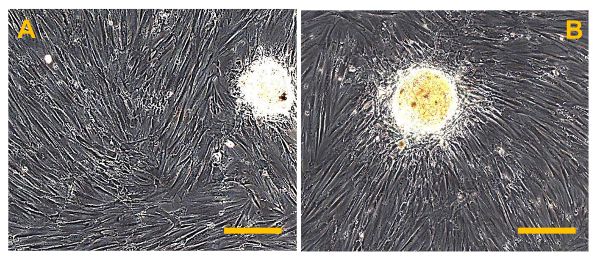
図 分離した後、7 Dで 13 Sarcospheres。 OSA5(A)からSarcospheresとOSA6(B)細胞株は、単離後7日で、付着条件で単層で再導入および再培養を以下の付着性に拡大しました。位相コントラストで観察。オリジナル倍率:20X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
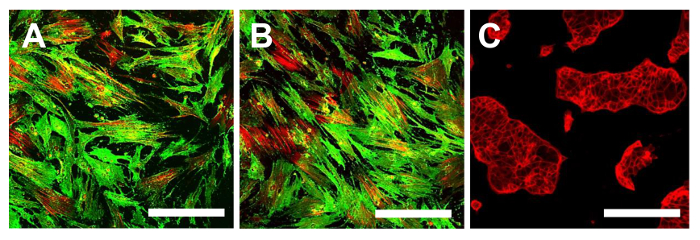
図14.免疫蛍光染色のためのCD105。OSA-CSC回線でのCD105のための免疫蛍光染色OSA5-のCSC(A)とOSA6-のCSC(B)および陰性対照として使用した連続的な細胞系HCT8(C)、インチ従来のカラーでLSCM:CD105のための緑と細胞骨格のための赤。オリジナル倍率:10X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
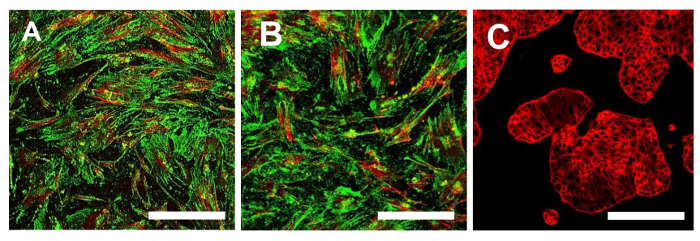
図15.免疫蛍光染色のためのCD44。OSA-CSC回線でのCD44のための免疫蛍光染色OSA5-のCSC(A)とOSA6-のCSC(B)および陰性対照として使用した連続的な細胞系HCT8(C)、インチ細胞骨格のためのCD44のための緑と赤:従来の色でLSCM。オリジナル倍率:10X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
Stro1の図16.免疫蛍光染色。OSA-CSCラインOSA5-のCSC(A)とOSA6-のCSC(B)及び負として使用した連続的な細胞系HCT8(C)において、STRO-1のための免疫蛍光染色コントロール。従来の色でLSCM:細胞骨格のためのSTRO-1のための緑と赤。オリジナル倍率:10X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
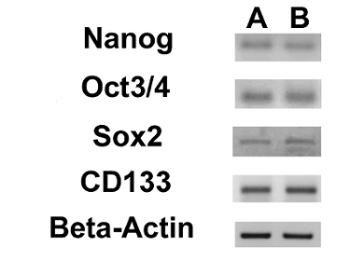
原子力ESCマーカーのとCD133遺伝子の図17発現。OSA5-のCSC(A)およびOSA6-のCSC(におけるNanog、10月3/4、Sox2のとCD133の発現を示すRT-PCR B)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
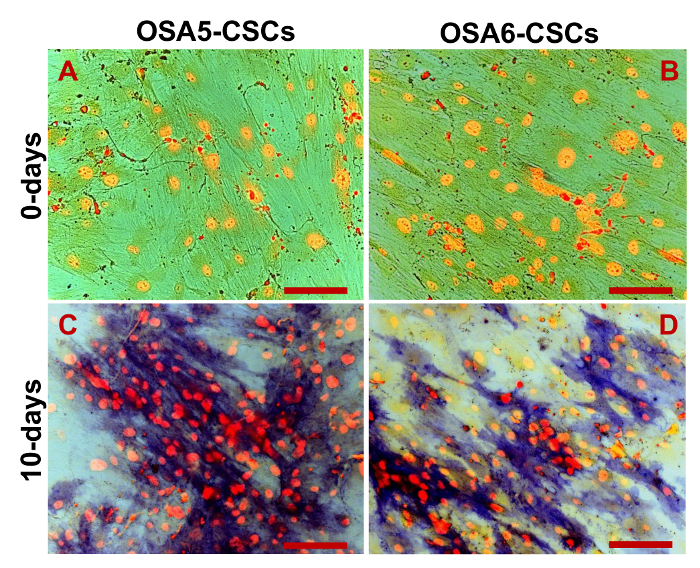
図18.骨形成分化アッセイ- 。ALP 0 D(A、B)でかつファーストブルーBBを使用して、ALPのために細胞化学染色によって決定されるよう誘導の10日間(C、D)後の骨形成分化。青、ALP +細胞では、赤で、核は、ヨウ化プロピジウムで対比しました。明視野および蛍光の複合観察。オリジナル倍率:20X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。

図19.骨形成分化アッセイ- HA 0、D(A、B)での骨形成分化およびアリザリンレッドSでヒドロキシアパタイトのために細胞化学染色によって決定されるように誘導の20 D(C、D)(HA)の後に、細胞を中で対比されています。 /ブルーグレー、およびHAの粒子の粗い堆積物が赤に染色されます。位相コントラストで観察。オリジナル倍率:40X。バーサイズ:100μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
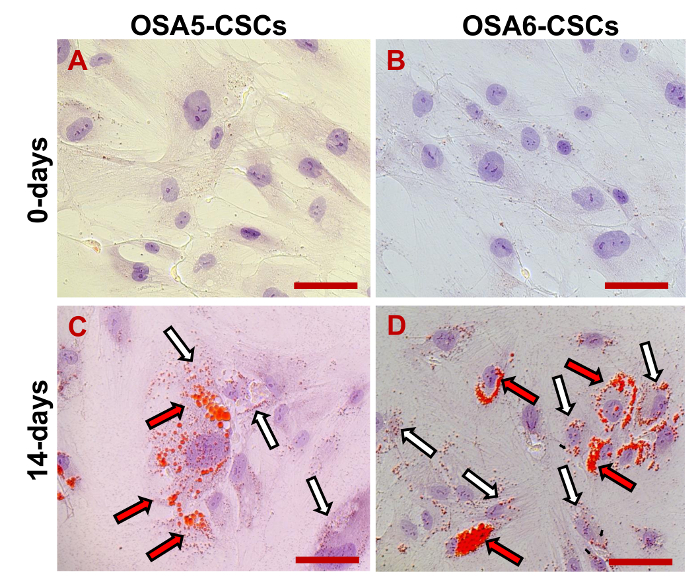
図20.脂肪細胞への分化アッセイ。cytochによって決定されるような誘導の0 D(A、B)に及び14日(C、D)後の脂肪細胞への分化赤でオイルレッドOでemical染色、脂質小胞(より大きな小胞は黒/赤の矢印で示されている。小さい小胞は白/黒の矢印で示されています)。青/紫で、核はヘマトキシリンにより対比します。明視野で観察。オリジナル倍率:40X。バーサイズ:100μM この図の拡大版をご覧になるにはこちらをクリックしてください。
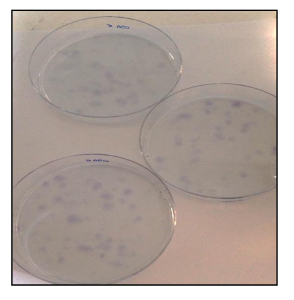
図21 CFUアッセイ。トルイジンブルーで染色したOSA-CSC回線のCFUアッセイ。 この図の拡大版をご覧になるにはこちらをクリックしてください。
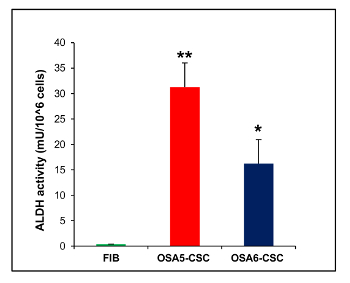 アッセイは、有限の分化した細胞株においてこの活動の不在を検出したのに対し、/> 図22. ALDH活性アッセイ。ALDH比色アッセイは、2 OS-CSC回線、OSA5-CSCおよびOSA6-のCSCにALDH活性の高いレベルを検出しました線維芽細胞の、FIB。エラーバー:SD。 **:FIB対のp <0.001; *:P <0.01 FIB対。 この図の拡大版をご覧になるにはこちらをクリックしてください。
アッセイは、有限の分化した細胞株においてこの活動の不在を検出したのに対し、/> 図22. ALDH活性アッセイ。ALDH比色アッセイは、2 OS-CSC回線、OSA5-CSCおよびOSA6-のCSCにALDH活性の高いレベルを検出しました線維芽細胞の、FIB。エラーバー:SD。 **:FIB対のp <0.001; *:P <0.01 FIB対。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 遺伝子 | オリゴヌクレオチド | シーケンス(5¹-3¹) | アンプリコンサイズ(bp)の | Tₐ(°C) | |
| Nanog | フォワードプライマーリバースプライマー | 87 | 60 | ||
| 10月3/2 | フォワードプライマーリバースプライマー | GGGAGGAGCTAGGGAAAGA TCCTTCCTTAGTGAATGAAGAACT | 77 | 60 | |
| Sox2の | フォワードプライマーリバースプライマー | TGCAGTACAACTCCATGACC GGACTTGACCACCGAACC | 125 | 55 | |
| CD133 | フォワードプライマーリバースプライマー | CCAGAAGCCGGGTCATAAAT ATTCACTCAAGGCACCATCC | 127 | 56 | |
| BP、アンプリコンサイズの塩基対;Tₐ、アニーリング温度 | |||||
アンプリコンサイズとアニール温度とのNanog、10月3/4、Sox2のとCD133のためのプライマー配列の表1の詳細なリスト
ディスカッション
CSCが腫瘍バルク中のこの特定の細胞サブセットの同定を可能にするいくつかのプロパティを持っています。そのようなATP結合カセットの多剤排出トランスポーターの過剰発現28細胞毒性化学療法剤に対する獲得耐性のようなこれらの特性に基づいて、32、33、またはそのような発現のためのALDH 32として解毒酵素の発現のアップレギュレーションのためにCSCを単離するためのこのようなCD133、CD44、CD34、CD90、および他の30、34、35、41、いくつかの異なる方法として、特定の表面マーカーの42-44が開発されてきました。これらの技術の一つは、非付着条件下で増殖するためのCSCの能力に基づいて球体形成アッセイです。
球体を形成するための組織幹細胞とのCSCの能力は、最初のレイノルズらによる神経幹細胞の同定の研究に記載された。37。その後、ギブスら38たちこれらの研究edは骨肉腫から、特に、固形腫瘍からのCSCを単離することを開始します。私たちは、ギブスらによって示されている球形成アッセイ法を使用することを決定した。従来のOSの生検から得られたOSA細胞株からのCSCを隔離します。我々は、このアッセイの結果を向上させ、他の癌細胞株のための再現性を容易にするための独自の方法を適合しました。球形成アッセイの確立を参照すると、我々は、40,000細胞/ウェルをプレーティングすることが確認され、アッセイの開始時に分離して細胞を維持するための良い方法です。このトリックは、球状コロニーが細胞凝集からではなく、非付着条件下で増殖し、球状のコロニーを形成するための単一のCSCの特定と排他的な能力に由来する可能性を回避するために非常に重要です。この能力は、このアッセイの特に重要な点です。
また、球形成の良好な速度を得るためにそれを認定します、元の方法に記載のように増殖因子のアリコートごとに3次元ではなく、毎日更新するのに十分です。本研究では、我々はまた、確立され、広範囲に非接着条件下で培養したときに形成される球状のコロニーを単離するための良い方法を説明しました。それらを損傷することなく、各ウェル内に形成されている可能な限り球のような多くを隔離しようとすることは非常に重要であるため、この手順は、このアッセイにおいて重要です。唯一の球ではなく、アッセイの期間中、懸濁液中に残っている可能性があり、単一の細胞を単離することも重要です。これらの重要な点を克服するために、我々は、CSCの単離のための良好な結果が得られ、上記のように、特定の分離法を開発しました。明らかに、そこに形成された全ての球を回収することができない可能性があるが、損失率は非常に低いです。実際に、我々はまた、(フォーム大きくなった後に球を単離するために40μmの孔を有するフィルターを使用する可能性を有していますEDは約100から200細胞)。
この分離は、球形成を停止しますが、単一細胞、メチルセルロース残基の一部、および最小の球をフィルタリングすることができます。プロトコールに記載されるように、この除去は、完全な濾過により行われます。
また、最小の球状コロニーの必然的な損失と40μmのメッシュを介して最大の球状コロニーの選択は1つが球状コロニーを形成する最大容量で、より大きな幹細胞性とのCSCを選択することができます。これらの修飾の全ては、アッセイを改善し、理解し、球体形成アッセイの元の方法の最も重要なステップを再現するためのCSCを研究する研究者を支援するために行きました。
CSCを単離するためのin vitro法に関する研究の中で、これは球形成アッセイを適応方法を示すことを目的としたこの研究からのCSCを単離するための良い方法かもしれませんOSAの細胞株。オリジナルの方法と詳細な分離技術への適応は、その有効性を改善します。短時間でのCSCのかなりの数を得ることができ、いくつかの実験のために使用されます。したがって、迅速にOS-のCSCを特徴付ける二幹様の表現型を研究するために、特に、幹様の表現型を確認し、することが可能です。したがって、この修正されたアッセイは、CSCをを単離し、それらの生物学を研究するための優れた手法である可能性があります。将来的には、この方法は、追加の適応でも希少な固形腫瘍の生検により得られた他の有限の癌細胞株からのCSCを単離するために使用されてもよいです。
OSなど希少な固形腫瘍からのCSCを単離する可能性は、この特定の癌に関する研究の改善を可能にするだけでなく、それらの単離のためのより良い方法を開発する異なるタイプの癌の研究にとの生物学の今後の研究にも及ぶだけでなく、この重要な細胞サブセット。したがって、我々として本研究で行っている、おそらくのために責任があるこの特定の細胞サブセットに対して向けの非常に特定の抗癌治療を、分子標的を発見し、開発の最終目標で、CSC生物学の研究を通じてCSC分離の方法を向上させることが重要です原発腫瘍の維持、再発の開発、およびいくつかの器官における転移の起源。 CSC生物学の研究でも、このようなネオアジュバント治療後の生存率は非常に貧しいままであるためにOS、などの癌の治療法に鋭いかもしれない治療法を見出すために重要です。
開示事項
The authors declare that they have no competing financial interest.
謝辞
This study was supported by ITT (Istituto Toscano Tumori) Grant Proposal 2010.
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco's Phosphate Buffered Saline with Ca2+ and Mg2+ (DPBS) | LONZA | BE17-513F | _ |
| Dulbecco's Phosphate Buffered Saline without Ca2+ and Mg2+ (DPBS) | LONZA | BE17-512F | _ |
| Porcine Trypsin 1:250 | BD Difco | 215310 | Solvent: DPBS. Stock concentration: Powder |
| Ethylenediamine tetraacetic acid disodium salt dihydrate(EDTA) | Sigma-Aldrich | E4884 | Solvent: DPBS. Stock concentration: Powder |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C0130 | Solvent: Buffer Solution, pH 7.4. Stock concentration: Powder |
| Dimethyl sulphoxide (DMSO) | BDH Chemicals-VWR | 10323 | _ |
| Nutrient Mixture F-12 Ham | Sigma-Aldrich | F6636 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| 2-Phospho-L-ascorbic acid trisodium salt | Sigma-Aldrich | 49752 | Solvent: DPBS. Stock concentration: 5 mg/mL |
| β-Glycerol phosphate disodium salt pentahydrate | Sigma-Aldrich | 50020 | Solvent: DPBS. Stock concentration: 1 M |
| Insulin. Human Recombinant | Sigma-Aldrich | 91077 | Solvent: NaOH 0.1 M. Stock concentration: 10 mM |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I5879 | Solvent: DMSO. Stock concentration: 500 mM |
| Indomethacin | Sigma-Aldrich | I7378 | Solvent: DMSO. Stock concentration: 200 mM |
| Dexamethasone | Sigma-Aldrich | D4902 | Solvent: DMSO. Stock concentration: 1 mM / 100 µM. Store in liquid nitrogen to maintain the biological activity |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | _ |
| Fetal Bovine Serum South America | EUROCLONE | ECS0180L | _ |
| Penicillin-Streptomycin (PEN-STREP) 10,000 U/mL | LONZA | DE17-602E | _ |
| Methyl cellulose | Sigma-Aldrich | 274429 | Solvent: Ultrapure dH2O. Stock concentration: 2% |
| Putresceine dihydrochloride | Sigma-Aldrich | P5780 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| apo-Transferrin | Sigma-Aldrich | T-1147 | Solvent: DPBS. Stock concentration: 25 mg/mL |
| Human Epidermal Growth Factor (EFGF) | Sigma-Aldrich | E5036 | Solvent: DPBS pH 7.4. Stock concentration: 10 µg/mL |
| Fibroblast Growth Factor-Basic Human | Sigma-Aldrich | F0291 | Solvent: DPBS + 0.2% BSA. Stock concentration: 25 µg/mL |
| Selenous Acid | Sigma-Aldrich | 211176 | Solvent: DPBS. Stock concentration: 30 mM |
| Progesterone | Sigma-Aldrich | P8783 | Solvent: ETOH. Stock concentration: 10 mM |
| Toluidine Blue O | Sigma-Aldrich | 198161 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Oil Red O | ICN Biochemicals | 155984 | Solvent: 2-Propanol. Stock concentration: Powder |
| Naphtol AS-MX Phosphate Disodium Salt | Sigma-Aldrich | N5000 | Solvent: DMSO. Stock concentration: Powder |
| Fast Blue BB Salt | Sigma-Aldrich | F3378 | Solvent: Tris HCL, pH 9.0. Stock concentration: Powder |
| Fast Red Violet LB Salt | Sigma-Aldrich | F3381 | Solvent: Tris HCL, pH 9.1. Stock concentration: Powder |
| Bovine Serum Albumin, Fraction V (BSA) | Sigma-Aldrich | A-4503 | Solvent: DPBS. Stock concentration: 2% |
| Alizarin Red S | ICN Biochemicals | 100375 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Formaldehyde solution | Sigma-Aldrich | 533998 | 4% |
| Triton-100X | MERCK | 11869 | Solvent: DPBS. Stock concentration: 0.2%. Danger - Use only under chemical hood |
| Calcein | MERCK | 2315 | Solvent: DPBS . Stock concentration: 200 µg/mL |
| 2-Propanol | MERCK | 109634 | Danger - Use only under chemical hood |
| Ab-CD105 (Mouse monoclonal [SN6] to CD105 (FITC) | Abcam | ab11415 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD44 (Mouse monoclonal [F10-44-2] to CD44 (PE/Cy7®) ) | Abcam | ab46793 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD45 (Mouse monoclonal [MEM-28] to CD45 (PerCP)) | Abcam | ab65952 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD105 (Human CD105 Purified Antibody) | Invitrogen | MHCD10500 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-CD44 (Anti-CD44 Antibody) | Abcam | EPR1013Y(ab51037) | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-Stro-1 (Mouse anti-STRO-1) | Invitrogen | 398401 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 488 (Anti-Rabbit IgG (Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L)) | Invitrogen | A-21206 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| FITC Anti-Mouse IG (FITC-Rabbit Anti Mouse IgG (H+L)) | Invitrogen | 61-6511 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 635 Phalloidin | Invitrogen | A34054 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| AutoMACS™Running Buffer MACS Separation Buffer | Miltenyi | 130,091,221 | Liquid. Store at 4 °C |
| QIAzol®Lysis Reagent | QIAGEN | 79306 | Danger - Use only under chemical hood |
| QUANTITECT® Reverse Transcription Kit | QIAGEN | 205314 | _ |
| Chlorophorm | Sigma-Aldrich | C2432 | Liquid. Danger - Use only under chemical hood |
| Laminar flow hood | GELAIRE | BSB6A | _ |
| Chemical hood | ARREDI TECNICI Villa | Modello DYNAMICA | _ |
| Centrifuge | EPPENDORF | 5415R | _ |
| Laser Scanning Confocal Microscopy LSM 5109 Meta | ZEISS | _ | _ |
| iCycler PCR Thermalcycler | BIORAD | _ | _ |
| CyFlow®SPACE | (PARTEC) | _ | _ |
| Inverted Micrposcope Axiovert 200M | ZEISS | _ | _ |
| Freezing container , | Nalgene | _ | _ |
| Original Pipet-Aid | pbiBrand | _ | _ |
| Micropipettes | EPPENDORF | _ | _ |
| Glass Pasteur Pipette | SIGMA | _ | _ |
| VICTOR3™ | PERKIN ELMER | _ | _ |
| Conical tubes (15 and 50 mL) | BD FALCON | 352096 (for 15 mL) 352070 (for 50 mL) | _ |
| 24-Well Clear Flat Bottom TC-Treated Multiwell-Cell-Culture-Plate | BD FALCON | 353047 | _ |
| 6-Well Clear Flat Bottom Ultra Low Attachment Multiple-Well-Plates | CORNING | 3471 | _ |
| Serological pipettes (5 and 10 mL) | BD FALCON | 357543 (for 5 mL) 357551 (for 10mL) | _ |
| Syringe (5mL) | B|BRAUN | 4617053V | _ |
| Petri dish 100X20 mm | BD FALCON | 353003 | _ |
| Röhren Tubes (3.5 mL, 55x12mm, PS) | SARSTEDT | 55,484 | _ |
| Petri dish 60X15 mm | BD FALCON | 353004 | _ |
| Cryovials 1.5 mL | NALGENE | 5000-1020 | _ |
| Cell-Culture Flasks 25 cm² | BD FALCON | 353014 | _ |
| Nylon Net Filter, Hydrophilic | MERCK | NY4104700 | _ |
| Swinnex Filter Holder | MERCK | SX0002500 | _ |
| Perry tweezer | _ | _ | _ |
| Lancet | _ | _ | _ |
| Dounce | _ | _ | _ |
参考文献
- Reddick, R. L., Michelitch, H. J., Levine, A. M., Triche, T. J. Osteogenic sarcoma: a study of the ultrastructure. Cancer. 45 (1), 64-71 (1980).
- Gatta, G., et al. Childhood cancer survival trends in Europe: a EUROCARE Working Group study. J. Clin. Oncol. 23 (16), 3742-3751 (2005).
- Olstad, O. K., et al. Molecular heterogeneity in human osteosarcoma demonstrated by enriched mRNAs isolated by directional tag PCR subtraction cloning. Anticancer. Res. 23 (3B), 2201-2216 (2003).
- Geller, D. S., Gorlick, R. Osteosarcoma: a review of diagnosis, management, and treatment strategies. Clin Adv Hematol Oncol. 8 (10), 705-718 (2010).
- Tang, N., Song, W. X., Luo, J., Haydon, R. C., He, T. C. Osteosarcoma development and stem cell differentiation. Clin. Orthop. Relat. Res. 466 (9), 2114-2130 (2008).
- Kempf-Bielack, B., et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J. Clin. Oncol. 23 (3), 559-568 (2005).
- Meyers, P. A., et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J. Clin. Oncol. 23 (9), 2004-2011 (2005).
- Gorlick, R., et al. Biology of childhood osteogenic sarcoma and potential targets for therapeutic development: meeting summary. Clin. Cancer Res. 9 (15), 5442-5453 (2003).
- Hayden, J. B., Hoang, B. H. Osteosarcoma: basic science and clinical implications. Orthop. Clin. North Am. 37 (1), 1-7 (2006).
- Thomas, D., Kansara, M. Epigenetic modifications in osteogenic differentiation and transformation. J. Cell. Biochem. 98 (4), 757-769 (2006).
- Araki, N., et al. Involvement of the retinoblastoma gene in primary osteosarcomas and other bone and soft-tissue tumors. Clin. Orthop. Relat. Res. 270 (270), 271-277 (1991).
- Chou, A. J., Gorlick, R. Chemotherapy resistance in osteosarcoma: current challenges and future directions. Expert. Rev. Anticancer Ther. 6 (7), 1075-1085 (2006).
- Arndt, C. A. S., Crist, W. M. Common musculoskeletal tumorsof childhood and adolescence. N. Engl. J. Med. 341 (5), 342-352 (1999).
- Longhi, A., Errani, C., De Paolis, M., Mercuri, M., Bacci, G. Primary bone osteosarcoma in the pediatric age: state of the art. Cancer. Treat. Rev. 32 (6), 423-436 (2006).
- Bacci, G., et al. Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at the istituto ortopedico rizzoli according to the istituto ortopedico rizzoli/osteosarcoma-2 protocol: an updated report. J. Clin. Oncol. 18 (24), 4016-4027 (2000).
- Clarke, M. F., et al. Cancer stem cells-perspectives on current status and future directions: AACR workshop on cancer stem cells. Cancer. Res. 66 (19), 9339-9344 (2006).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367 (6464), 645-648 (1994).
- Bonnet, D., Dick, J. E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med. 3 (7), 730-737 (1997).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumors: accumulating evidence and unresolved questions. Nat. Rev. Cancer. 8 (10), 755-768 (2008).
- Bapat, S. A. Evolution of cancer stem cells. Semin. Cancer Biol. 17 (3), 204-213 (2007).
- Rubio, D., et al. Spontaneous human adult stem cell transformation. Cancer. Res. 65 (8), 3035-3039 (2005).
- Burns, J. S., et al. Tumorigenic heterogeneity in cancer stem cells evolved from long-term cultures of telomerase-immortalized human mesenchymal stem cells. Cancer. Res. 65 (8), 3126-3135 (2005).
- Zhang, M., Rosen, J. M. Stem cells in the etiology and treatment of cancer. Curr. Opin. Genet. Dev. 16 (1), 60-64 (2006).
- Li, Y., et al. Evidence that transgenes encoding components of the Wnt signaling pathway preferentially induce mammary cancers from progenitor cells. Proc. Natl Acad. Sci. USA. 100 (26), 15853-15858 (2003).
- Sell, S. Cellular origin of cancer: dedifferentiation or stem cell maturation arrest?. Environ Health Perspect. 101 (Suppl 5), 15-26 (1993).
- Wernig, M., et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448 (7151), 318-324 (2007).
- Niwa, H., Miyazaki, J., Smith, A. G. Quantitative expression of oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat. Genet. 24 (4), 372-376 (2000).
- Hochedlinger, K., Jaenisch, R. Nuclear reprogramming and pluripotency. Nature. 441 (7097), 1061-1067 (2006).
- Dean, M., Fojo, T., Bates, S. Tumor stem cells and drug resistance. Nat. Rev. Cancer. 5 (4), 275-284 (2005).
- Ma, S., Lee, T. K., Zheng, B. J., Chan, K. W., Guan, X. Y. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway. Oncogene. 27 (12), 1749-1758 (2008).
- Wu, C., et al. Side population cells isolated from mesenchymal neoplasms have tumor initiating potential. Cancer. Res. 67 (17), 8216-8222 (2007).
- Ma, I., Allan, A. L. The role of human aldehyde dehydrogenase in normal and cancer stem cells. Stem. Cell. Rev. 7 (2), 292-306 (2011).
- Awad, O., et al. High ALDH activity identifies chemotherapy-resistant Ewing's sarcoma stem cells that retain sensitivity to EWS-FLI1 inhibition. PLoS One. 5 (11), e13943 (2010).
- Fujii, H., et al. Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines. Int. J. Oncol. 34 (5), 1381-1386 (2009).
- Di Fiore, R., et al. Genetic and molecular characterization of the human osteosarcoma 3AB-OS cancer stem cell line: a possible model for studying osteosarcoma origin and stemness. J. Cell. Physiol. 228 (6), 1189-1201 (2013).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonicprogenitor cell produces neurons and astrocytes. J. Neurosci. 12 (11), 4565-4574 (1992).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Gibbs, C. P., et al. Stem-like cells in bone sarcomas: implications for tumorigenesis. Neoplasia. 7 (11), 967-976 (2005).
- Beccari, N., Mazzi, V. . Manuale di tecnica microscopic. Casa Editrice Dr. Francesco Vallardi Società Editrice Libraria. , 99-100 (1966).
- Majumdar, M. K., Thiede, M. A., Mosca, J. D., Moorman, M., Gerson, S. L. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J. Cell. Physiol. 176 (1), 57-66 (1998).
- Tirino, V., et al. Human primary bone sarcomas contain CD133+ cancer stem cells displaying high tumorigenicity in vivo. FASEB J. 25 (6), 2022-2030 (2011).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. FASEB J. 27 (1), 13-24 (2013).
- Martins-Neves, S. R., et al. Therapeutic implications of an enriched cancer stem-like cell population in a human osteosarcoma cell line. BMC Cancer. 12 (1), 139 (2012).
- Tang, Q. L., et al. Enrichment of osteosarcoma stem cells by chemotherapy. Chin. J. Cancer. 30 (6), 426-432 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved