Method Article
Establecimiento de Cultivos Celulares del Cáncer Humano de osteosarcoma convencional Tallo
En este artículo
Resumen
La presencia de células madre del cáncer (CSC) en sarcomas óseos se ha vinculado recientemente a su patogénesis. En este artículo, presentamos el aislamiento de células madre cancerosas a partir de cultivos celulares primarios obtenidos de biopsias humanas de osteosarcoma convencional (OS) utilizando la capacidad de las células madre cancerosas de crecer bajo condiciones no adherentes.
Resumen
Las mejoras actuales en la terapia contra el osteosarcoma (OS) han prolongado la vida de los pacientes con cáncer, pero la tasa de supervivencia de cinco años sigue siendo pobre cuando se ha producido metástasis. La teoría de la célula madre del cáncer (CSC) sostiene que hay un subconjunto de células tumorales en el tumor que tiene características similares a madre, incluyendo la capacidad de mantener el tumor y para resistir la quimioterapia con múltiples fármacos. Por lo tanto, es necesaria una mejor comprensión de la biología y la patogénesis OS con el fin de avanzar en el desarrollo de terapias dirigidas a la erradicación de este subgrupo particular y para reducir la morbilidad y la mortalidad entre los pacientes. El aislamiento de células madre cancerosas, el establecimiento de cultivos celulares de células madre cancerosas, y el estudio de su biología son pasos importantes para mejorar nuestra comprensión de la biología del sistema operativo y la patogénesis. El establecimiento de derivado de ser humano-OS-CSC a partir de biopsias de OS se ha hecho posible el uso de varios métodos, incluyendo la capacidad de crear cultivos de células madre 3-dimensional bajo nonadherecondiciones NT. En estas condiciones, células madre cancerosas son capaces de crear colonias flotantes esféricos formados por células madre hija; estas colonias se denominan "esferas celulares". A continuación, se describe un método para establecer cultivos de CSC de cultivos celulares primarios de sistema operativo convencional obtenido a partir de biopsias del sistema operativo. Se describe claramente los varios pasajes necesarios para aislar y caracterizar células madre cancerosas.
Introducción
Los sarcomas son un grupo heterogéneo de tumores malignos del tejido conjuntivo poco frecuentes originados en su mayor parte a partir del mesodermo embrionario 1. Los diferentes tipos incluyen sarcomas óseos y sarcomas de tejidos blandos. sarcomas de hueso, un grupo de tumores primarios relativamente poco comunes, consisten en varios subtipos, incluyendo osteosarcoma (OS). OS, uno de los tumores primarios más comunes de los huesos, es una neoplasia mesenquimal que exhibe una amplia clínicos, histológicos y heterogeneidades moleculares 2, 3. Por desgracia, el sistema operativo se produce predominantemente en niños y en adultos jóvenes 4, 5 y representa el 60% de los subtipos histológicos comunes de sarcoma óseo en la infancia 6, 7. OS suele afectar a las áreas del esqueleto, que se caracterizan por el crecimiento rápido del hueso (por ejemplo, la metáfisis de los huesos largos). Entre los histológicamente diferentes subtipos de OS, el sistema operativo convencional, también llamado medular o el sistema operativo central, tiene un alto grado de malignidad y una cuota share del 80% 8. Este 80% se compone de 60% OS convencional osteoblástica, 10% OS condroblástico, y 10% OS fibroblástica 6, 8-10. Otros subtipos incluyen OS anaplásico, telangiectasias, rico en células gigantes y OS de células pequeñas. A pesar de los avances en la cirugía y la quimioterapia combinada en la gestión del sistema operativo, el resultado sigue siendo pobre, con una tasa de supervivencia a largo plazo del 65-70% en pacientes sin metástasis 11, 12. Recurrencias distantes con frecuencia se producen como metástasis pulmonares o, con menos frecuencia, como las metástasis a los huesos distantes y recurrencias locales 13. Las metástasis son a menudo resistente a los tratamientos convencionales. Esta resistencia es la razón por la supervivencia libre de enfermedad a 10 años es aproximadamente el 30% en los pacientes con enfermedad metastásica en el momento del diagnóstico 14, 15.
Al igual que con el tejido normal, el tejido de cáncer se compone de una colección heterogénea de tipos de células. Las células dentro del tumor parecen corresponder a diferentes etapas de desarrollo. Dentro de cualquier ntejido Ormal reside una subpoblación de células con la capacidad de selfrenew, proporcionando así progenitores y células maduras para la homeostasis del tejido. Del mismo modo, el cáncer se compone de una población heterogénea similar de células en diferentes etapas de desarrollo, con diferentes grados de proliferación y potencial tumorigénico. Un subconjunto de estas células de cáncer, denominada células madre del cáncer (CSC), constituye un depósito de autosostenible células con la capacidad exclusiva de selfrenew y mantener el potencial maligno de tumores, por lo tanto la generación de los diferentes linajes de células que constituyen la masa tumoral 16. En la década de 1990, los estudios sobre la leucemia mieloide aguda proporcionaron la primera evidencia convincente de la existencia de subpoblaciones CSC 17, 18. Los CCC ya se han aislado de un gran número de tumores sólidos 19, convirtiéndose así en uno de los temas más investigados en la investigación del cáncer. CSC de hecho puede surgir a partir de células madre normales por mutaciones en genes que hacen que la normal decélulas cancerosas 20-23 tallo. Las mutaciones múltiples de transformación y las interacciones con el microambiente también podrían contribuir a progenitores sanos y células maduras que adquieren la capacidad selfrenewal y la inmortalidad que tipifican los CAC. Hay varias hipótesis acerca de esta transformación. Progenitores sanos, las células maduras sanas y células cancerosas, pueden dedifferentiate a las células madre, la obtención de un fenotipo similar al tallo mediante la activación de los genes asociados selfrenewal-24-28. A pesar de varios estudios recientes, los orígenes de los CAC aún no se han descubierto.
Una característica particular de células madre cancerosas es que su capacidad de resistir el enfoque multi-terapia, que consiste en la cirugía y la quimioterapia combinada con diferentes fármacos. Estudios recientes han demostrado que los CAC también puede adquirir resistencia a los agentes de quimioterapia citotóxica. Las posibles explicaciones para esta resistencia incluyen la sobreexpresión de unión a ATP de cassette (ABC) transportador de múltiples fármacos (es decir,MDR1 y BCRP1), la sobreexpresión de enzimas metabolizadoras de quimioterapia tales como aldehído deshidrogenasa 1 (ALDH1), y / o cambios en la cinética del ciclo celular 30-33. La consecuencia directa de todos estos conceptos que se han descrito hasta ahora es que una terapia de cáncer sería eficaz sólo si la subpoblación CSC fueron eliminados por completo, mientras que la recurrencia local o metástasis a distancia podrían ocurrir si incluso una sola CSC sobrevivió.
El descubrimiento de células madre cancerosas en los sarcomas humanos 34, en particular OS 35, o en cualesquiera otros tipos de cáncer de hueso y tejidos blandos, tiene una gran importancia clínica, ya que ofrece una posible explicación de por qué muchos tratamientos parecen ser eficaces al principio, pero los pacientes recaída posterior. Por lo tanto, la esperanza para el futuro batalla contra el sistema operativo convencional es encontrar nuevas y específicas terapias dirigidas basado en el desarrollo de fármacos innovadores dirigidos a OS-CSC gracias a la caracterización molecular de este subla población y al estudio de la biología CSC.
En 1992, Reynolds y sus colegas, que estaban investigando si un subconjunto de células madre estaba presente en el cerebro adulto de mamíferos, desarrollaron un método para aislar células que se sospecha que ser células 36, 37 del vástago-similares. Este método se basa en la capacidad particular de estas células para formar colonias esféricas cuando se cultivan bajo condiciones no adherentes. Técnicas similares fueron empleados por Gibbs y sus colegas en 2005 para estudiar una subpoblación de células madre similares a los sarcomas de hueso 38. Para aislar y caracterizar OS-CSC a partir de cultivos celulares primarios de diferentes tipos de OS convencional, decidimos adaptar esta técnica para las líneas celulares del sistema operativo.
A continuación, describimos este método adaptado del ensayo de formación de esfera, denominado "ensayo sarcosphere", que se puede utilizar para aislar OS-CSC a partir de líneas de células primarias finitos derivados de biopsias humanas de OS convencional. También describimos todas las técnicas used para validar el CSC fenotipo de tallo como de las líneas celulares aisladas mediante este ensayo: 1) Evaluación de la expresión de genes que caracterizan a las células madre embrionarias pluripotentes (CES) y del gen CD133, que es un marcador de células madre cancerosas; 2) (CFU) ensayo de unidad formadora de colonias; 3) Evaluación de la capacidad de estas células para diferenciarse en osteoblastos y adipocitos bajo condiciones de diferenciación apropiadas; 4) el estudio de los marcadores de superficie de células madre mesenquimales (MSC) (por ejemplo, CD44, CD105 y Stro-1) por tinción de inmunofluorescencia y por análisis de citometría de flujo; 5) Evaluación de la actividad de ALDH de estas células.
Protocolo
Toda la experimentación utilizando tejidos humanos descritos en este documento fue aprobado por el comité de ética local (Rif. N. 141/12). El consentimiento informado para la recogida de muestras de tejidos y para el uso y almacenamiento de las muestras se obtuvo de los donantes en AOUC.
1. Preparación para la Cultura
- Preparar medio de cultivo de crecimiento (GM) mediante la adición de 10% suero bovino fetal (FBS), 100 UI / ml de penicilina y 100 mg / ml de estreptomicina y medio F12 de Ham modificado de Coon. Filtrar y esterilizar GM usando un filtro de 0,22 micras. Tienda de GM hasta 1 mes a 4 ° C.
- Preparar medio colagenasa (CM) mediante la adición de 20% de SFB, 100 UI / ml de penicilina, 100 mg / ml de estreptomicina y 3 mg / ml de colagenasa tipo II a medio F12 de Ham modificado de Coon. Filtrar y esterilizar CM usando un filtro de 0,22 micras. Tienda CM hasta 1 mes a -20 ° C.
- Preparar medio de congelación celular (FM) mediante la adición de 40% de SFB, 100 UI / ml de penicilina, 100 mg / ml de estreptomicina y 60,5% de dimetilsulfóxido (DMSO) a medio F12 de Ham modificado de Coon. Filtrar y esterilizar FM utilizando un filtro de 0,22 micras. Tienda de FM hasta 1 mes a 4 ° C.
- Preparar medio para el ensayo de CFU (CFUM) mediante la adición de 20% de SFB, 100 UI / ml de penicilina y 100 mg / ml de estreptomicina y medio F12 de Ham modificado de Coon. Filtrar y esterilizar CFUM utilizando un filtro de 0,22 micras. Tienda CFUM hasta 1 mes a 4 ° C.
- Preparar la tripsina mediante la disolución de 400 mg de tripsina, 200 mg de EDTA y 1,000 mg D (+) - glucosa anhidra en 1000 ml de Dulbecco tamponada con fosfato salino (DPBS) sin Ca2 + y Mg2 +.
NOTA: Se divide fresca tripsina-EDTA en 50 ml alícuotas en frascos de 25 cm2 utilizando un filtro de 0,22 micras y congelar a -20 ° C durante un máximo de 3 meses. Tienda descongeló alícuotas de filtro-esterilizado a 4 ° C sin pérdida de actividad. - Preparar medio de crecimiento de células madre (SCGM) mediante la adición de 10% de SFB, 100 UI / ml de penicilina, 100 mg / ml streptomycin, y 10 ng / ml de bFGF (25 mg / ml de stock) a medio F12 de Ham modificado de Coon. Filtro SCGM usando un filtro y almacenar SCGM 0,22 micras hasta 2 semanas a 4 ° C.
- Preparar% metilcelulosa 2 (MC) por disolución de MC en H2O ultrapura a 4 ° C durante 3 días. Cuando MC se disuelva por completo, autoclave y almacenar a 4 ° C.
NOTA: Después se esteriliza MC, se convierte en sólido. MC para llevar a un estado líquido, se almacena a 4 ° C. - Preparar medio de crecimiento sarcosphere (SGM). Preparar este medio fresco (no más de 2 semanas antes de usar) mediante la adición de 100 IU de penicilina / ml, 100 mg / ml de bFGF (25 g / Stock ml) humana, 20 nM de progesterona (10 mM de stock), 100 mM de putrescina, 30 nM selenita de sodio (30 mM de valores), 25 mg / ml de transferrina (25 mg / Stock ml), 20 mg / ml de insulina (20 mg / ml de solución madre), y 10 ng / EGF humano ml (10 mg / ml de solución madre) a 2X Coon de medio modificado F12 de Ham. Filtrar y esterilizar SGM usando un fil 0,22 micraster. Almacenar hasta por 2 semanas a 4 ° C.
- Preparar medio osteogénico (OM) mediante la adición de 10% de FBS (origen sudamericano), 100 UI / ml de penicilina, 100 mg / ml de estreptomicina, 10 nM de dexametasona (100 mM de stock), 0,2 mM de sodio L-ascorbil-2-fosfato (1 m stock), 10 mM de β-glicerofosfato (5 mg / ml de solución madre) y 1 mg / ml de calceína (200 mg / ml de stock) a medio F12 de Ham modificado de Coon. Filtrar y esterilizar OM utilizando un filtro de 0,22 micras. Almacenar a 4 ° C.
NOTA: Store Solutions dexametasona sobre acciones en virtud de nitrógeno líquido para mantener su actividad. Preparar OM fresco cada 2 semanas para mantener la actividad de la dexametasona con el fin de mantener el potencial de diferenciación del medio. - Preparar tampón de lisis de eritrocitos (ELB) disolviendo 1,66 mg de NH4Cl, 0,2 mg de K 2 HPO 4 y 0,007 mg de EDTA en 200 ml de agua destilada (dH2O). Filtrar y esterilizar ELB utilizando un filtro de 0,22 micras. Almacenar a 4 °DO.
- Preparar medio adipogénico (AM) mediante la adición de 10% de FBS (origen Sur América), 100 UI / ml de penicilina, 100 mg / ml de estreptomicina, 1 mM de dexametasona (mM stock 1), 1 mM de insulina bovina (mM Stock 10), 0,5 mM isobutilmetilxantina (IBMX) (mM Stock 500), y 100 indometacina mu M (200 mM) a medio F12 de Ham modificado de Coon. Filtrar y esterilizar AM utilizando un filtro de 0,22 micras. Almacenar a 4 ° C.
NOTA: Store Solutions dexametasona sobre acciones en virtud de nitrógeno líquido para mantener su actividad. Preparar AM fresco cada 2 semanas para mantener la actividad de la dexametasona con el fin de mantener el potencial de diferenciación del medio. - Preparar 2% albúmina de suero bovino (BSA) en DPBS (BSA / DPBS). Disolver 10 g de BSA en 500 ml de DPBS y preparar la solución stock de alícuotas de 50 ml de solución madre en 50 ml tubos cónicos. Almacenar a -20 ° C.
- Preparar una solución de 4% de paraformaldehído (PFA) en DPBS (PFA / DPBS). En un chcampana emical, diluido en DPBS paraformaldehído y preparar la solución stock de alícuotas de 50 ml de solución madre en 50 ml tubos cónicos. Almacenar a 4 ° C.
2. El establecimiento de cultivos celulares primarios OS y OS líneas celulares finitas (OSA)
NOTA: los cultivos de células del sistema operativo primario se prepararon a partir de muestras de biopsias frescas OS convencionales recogidos en la "Unità Ortopedia Oncológica e Ricostruttiva", AOUC Careggi, Florencia. Todas las biopsias, que se obtuvieron por aspiración con aguja o la resección quirúrgica de una pequeña porción del tumor (Figura 1A, B), se colocaron inmediatamente en un medio de cultivo suplementado con 100 UI / ml de penicilina y 100 mg / ml de estreptomicina (pH 7,4) y transportados al laboratorio en el que se procesaron. Todas las manipulaciones descritas se realizaron en condiciones asépticas utilizando una campana de flujo laminar.
- Aislamiento de células del sistema operativo
- Colocar la biopsia en una100 mm placa de Petri con un pequeño volumen de GM. Con una lanceta estéril y pinzas Perry, pelos en las muestras de tejido OS cortándolos en piezas tan pequeñas como sea posible (0,5 - 1 mm) (Figura 2A, B).
- Cubrir los fragmentos de tejido con CM 10 ml para la digestión enzimática (Figura 2B) y se incuba durante 3 h en un 37 ° C, 5% de CO 2 incubadora. eliminar suavemente la suspensión de fragmentos usando una pipeta y transferirlo a un tubo cónico de 15 ml para la centrifugación inmediata (400 xg durante 5 min) para sedimentar los fragmentos.
NOTA: Después de la centrifugación, si las biopsias son ricos en los eritrocitos, un depósito de color rojo compuesto de eritrocitos puede ser visto a través de los fragmentos. Por lo tanto, antes de proceder a la dispersión mecánica, el tratamiento de la muestra con tampón de lisis de eritrocitos. Eliminar el sobrenadante por aspiración y se añaden 5 ml ELB. - Suspender fragmentos de pellets de 1 min y se centrifuga la suspensión a 400 xg durante 2min. Eliminar el sobrenadante por aspiración. Añadir 5 ml de GM y mecánicamente dispersar los fragmentos usando una pipeta serológica de 10 ml (tamaño de la abertura, de 1,5 mm de diámetro interno) 10 - 20 veces.
- Centrifugar la suspensión a 400 xg durante 5 min. Eliminar el sobrenadante por aspiración, suspender el sedimento celular con 10 ml de GM, y luego transferir la suspensión celular resultante en una placa de Petri de 100 mm. Incubar la placa de Petri en un 37 ° C, 5% de CO2 y reemplazar el GM con total GM fresco cada 3 d.
NOTA: Muy a menudo, las muestras de tejido OS obtenidas por aspiración con aguja son muy pequeñas y contiene fragmentos de hueso, que no son digeridos por digestión enzimática con colagenasa. Por lo tanto, después de que el sobrenadante se ha eliminado, el intento de separar las células de tejido óseo por maceración fragmentos de pellets con una pipeta.
- Subcultura
NOTA: Para establecer un OSA, cuando las células alcanzan la confluencia aproximada, sacarlos de their recipiente de cultivo, diluir, y colocar en un plato fresco para permitir un mayor crecimiento. Este procedimiento de subcultivo se logra mediante el procedimiento enzimático denominado tripsinización.- Se elimina el medio por aspiración. Disociar la monocapa de células, añadir 2 - 3 ml de tripsina a TA (max 18 - 20 ° C), agitar suavemente una vez, y retire la tripsina inmediatamente por aspiración. Repetir dos veces. Se incuban las células a 37 ° C durante 3 - 4 minutos hasta que empiecen a separar.
NOTA: Bueno tripsinización puede ser visto por el usuario experimentado como pequeños agujeros que se forman en la monocapa ligeramente opaca cuando el plato se lleva a cabo a la luz. Esta disociación también se puede monitorizar usando un microscopio invertido; Se recomienda este enfoque para los principiantes. - Detener la reacción tripsina mediante la adición de 10 ml de GM y lavar el plato bien mediante una pipeta para separar todas las células. Se transfiere 1 ml de la suspensión a una nueva placa de Petri de 100 mm y añadir 9 ml de GM (1/10 de división de las células).
NOTA: La suspensión celular restante puede ser utilizado para la expansión de células (transferencia a otro plato de Petri de 100 mm), se pueden criopreservar (ver sección 2.3), o puede ser contado y se sembró en placas experimentales o pozos para ensayos de proliferación u otros fines (véase abajo).
- Se elimina el medio por aspiración. Disociar la monocapa de células, añadir 2 - 3 ml de tripsina a TA (max 18 - 20 ° C), agitar suavemente una vez, y retire la tripsina inmediatamente por aspiración. Repetir dos veces. Se incuban las células a 37 ° C durante 3 - 4 minutos hasta que empiecen a separar.
- Criopreservación de utilizar cultivos primarios y OSA
NOTA: Congelar una confluencia de 100 mm placa de Petri en crioviales 4-5. El proceso de criopreservación debe realizarse rápidamente porque DMSO, que protege las membranas celulares durante la congelación, es tóxico para las células a temperaturas de congelación no.- Disociar cultivos de células de la monocapa mediante tripsinización (véase la Sección 2.2), las células de pellets por centrifugación a 400 xg durante 5 min, eliminar el sobrenadante por aspiración, y luego suspender rápidamente el sedimento celular en FM.
- Alícuota de 1 ml de esta suspensión por vial criogénico. Inmediatamente colocar los viales llenos en una caja de congelador con una chaqueta de 2-propanol y almacenar immediatamente a -80 ° CO / N. Transferencia crioviales en nitrógeno líquido al día siguiente para el almacenamiento a largo plazo.
- Líneas celulares de descongelamiento del sistema operativo y cultivos primarios
- líneas celulares de descongelamiento del sistema operativo de almacenamiento de nitrógeno líquido, crioviales descongelar rápidamente colocándolos en un baño de agua de laboratorio a 37 ° C. Transferir el contenido de los crioviales en un tubo cónico de 15 ml y añadir aproximadamente 10 ml de GM (Ver Sección 2.3 para eliminar el DMSO). Eliminar el sobrenadante por aspiración y suspender el sedimento celular en 10 ml de GM. Placa de la suspensión de células en una placa de 100 mm Petri y se incuba en un 37 ° C, 5% de CO 2 incubadora.
3. Ensayo Sarcosphere para aislar células madre cancerosas-OS
NOTA: Este experimento se realiza en la AOS. La duración de este experimento se relaciona con la capacidad de las células para formar estas colonias esfera (sarcospheres), y el rango de tiempo es 7, 14, 21, y 28 d.
- Estabesta- de ensayo sarcosphere
- Preparar la cámara de hemocitómetro y todos los reactivos de antelación.
- Se elimina el medio por aspiración y disociar las células de la monocapa por tripsinización (ver sección 2.2). Mezclar la suspensión celular a fondo, pipeteado para dispersar los grumos, y recoger 10 l usando una punta de pipeta de 20 mL.
- Transferir la suspensión celular 10 l de inmediato al borde cámara de hemocitómetro, expulsar a la suspensión, y permitir que se dibuja bajo el cubreobjetos por acción capilar.
- Observar la cámara de hemocitómetro bajo contraste de fase. Seleccionar un objetivo de 10X y se centran en las líneas de la cuadrícula en la cámara. Contar las células que se encuentran en esta área de 1 mm 2 usando las subdivisiones (también vinculado por tres líneas paralelas) y líneas de malla individuales como una ayuda para el recuento.
- Medir la concentración y aplicar la siguiente ecuación: 1 ml = n * 10 4 / z (n: número total de células en todo el contadocuadrados de 1 mm 2; z: el número de cuadrados contados a 1 mm 2). Calcular el volumen de la suspensión de células necesaria a la placa una cantidad total de 240.000 células dividido en 40.000 células por cada pocillo de la placa de fijación de 6 pocillos ultra-bajo.
NOTA: Asegúrese de placa el número correcto de células en placas de células en un pocillo adicional. Por lo tanto, la cantidad total de células para ser plateado es 280.000 células. - Preparar 35 ml SGM mediante la adición de 50% de 2% MC (SGM-MC) en un matraz de 25 cm2. Preparar el volumen total de 5 ml SGM considerando adicional con el fin de placa de un pozo adicional.
- Añadir el volumen calculado de la suspensión celular a la SGM-MC preparado en el matraz y mezclar suavemente con una pipeta para dispersar los grumos. Placa de las células en una placa de fijación 6 pocillos ultra-bajo y el uso de un microscopio invertido para observar cómo aparecen las células después de haber sido chapado.
- Se incuban las células en un 37 ° C, 5% de CO 2 incubadora. Cada 3 d, añadir fralícuotas de ESH de bFGF y EGF a cada pocillo para refrescar la concentración de los factores de crecimiento. Añadir 2 l bFGF y EGF 5 l para mantener tanto a la concentración final de 10 ng / ml en cada pocillo.
- Aislamiento de sarcospheres
NOTA: Monitor de la buena marcha del ensayo sarcosphere a los 7, 14, 21 y 28 d para decidir cuando es necesario aislar los sarcospheres que se formaron.- Preparar todos los reactivos y el equipo en la campana de flujo laminar (Figura 3A, B). Montar la unidad de filtración mediante la colocación de un filtro de red de diámetro 25 mm y una malla de 40 micras en un soporte de filtro de membrana; esterilizar en autoclave (Figura 4A-E).
- Para cada pocillo, transferir el medio que contiene los sarcospheres a una jeringuilla con un soporte de filtro de membrana estéril usando una pipeta estéril con una punta de 1,000 l. Después de eliminar completamente el medio que contiene los sarcospheres, lavar el bien por añadiring 5 ml de GM para estar seguro de transferir todas las esferas a una jeringa. Utilizar el microscopio para confirmar si todos los sarcospheres han sido recuperados. Si no es así, continúe repitiendo este paso.
- Filtrar la suspensión con un soporte de filtro de membrana sólo por la gravedad sin presión con el fin de evitar daños en las esferas y para evitar que tienen sarcospheres que cruzan a través del filtro, evitando así la pérdida de esferas. Eliminar las burbujas de aire mediante el uso suavemente una pipeta Pasteur de vidrio estéril.
NOTA: A veces la filtración es bloqueado por la presencia de una burbuja de aire en el soporte de filtro de membrana. - Lavar la unidad de filtración mediante la adición de 10 ml de GM a la jeringa y dejar que se filtre y sin presión para asegurarse de eliminar las células individuales. Desmontar la unidad de filtro de la jeringa y ponerlo en una placa de Petri.
- Retire el filtro de red desde el soporte del filtro de membrana con unas pinzas Perry y lavarlo sacudiéndolo suavemente con las pinzas en un 60 mmplaca de Petri para liberar los sarcospheres de la maraña de la membrana. A continuación, colocar la membrana en un pozo y confirmar mediante observación microscópica que no hay más esferas enredados en la membrana. Si esferas todavía están enredados en la membrana, proceder con otro lavado como se describe en el paso 3.2.4.
- Tenga en cuenta las sarcospheres liberados utilizando un microscopio. Se incuban las sarcospheres liberados en un 37 ° C, 5% de CO2. Repita todos los pasos para cada pocillo de una placa de fijación de 6 pocillos ultra-bajo.
4. OS-CSC Líneas
NOTA: OS-CSC se obtienen de la sarcospheres que exhiben expansión adherente mediante la reintroducción y recultivo estas células en una monocapa después de que se colocaron en placas en pequeñas 60 mm placas de Petri ya no está bajo condiciones de ultra-bajas de fijación.
- Culturas OS-CSC
- Para habilitar un mayor crecimiento, las células de subcultivo cuando alcanzan aproximadamente el 90% de confluencia en un 60plato Petri mm. Repita el paso 2.2.1 para establecer cultivos OS-CSC.
- Deja de tripsina mediante la adición de 4 ml SCGM y lavar bien el plato, utilizando una pipeta para separar todas las células. Transferir la suspensión celular a una nueva placa de Petri de 100 mm y añadir 6 ml SCGM. Cuando llegan a las CSC-OS 90% de confluencia, subcultivo por la sección 2.2 de repetición.
NOTA: Para el análisis in vitro para caracterizar el fenotipo de células madre-como de aislados OS-células madre cancerosas, las células se pueden sembrar en diferentes tipos de placas. - Preservar las líneas OS-CSC establecidos por la crioconservación (repetir todos los pasos de la sección 2.3). Descongelar el criopreservados OS-células madre cancerosas mediante la repetición de todos los pasos de la sección 2.4.
5. In vitro Un nálisis para caracterizar las CSC-OS:
- Preparación de células para inmunofluorescencia
NOTA: Las células se fijaron en paraformaldehído cuando alcanzan el grado correcto de confluencia en cada pocillo de una pla 24 pocilloste. El grado de confluencia está relacionado con el tipo de experimentos.- Placa OS-células madre cancerosas en una placa de 24 pocillos para estudiar los marcadores mesenquimales superficie de las células madre (MSC) por inmunofluorescencia. Fijar las células en cada pocillo cuando alcanzan 50-60% de confluencia. Retire el SCGM por aspiración y se lava dos veces en una placa de 24 pocillos DPBS.
- Bajo una campana química, añadir 500 l 4% PFA / DPBS a cada pocillo. Incubar a TA durante 10 min. Retire la PFA / DPBS y se lava 3 veces con dH2O ultrapura Deje que la placa de 24 pocillos se seque en la campana de humos.
- Inmunofluorescencia para marcadores MSC
NOTA: La tinción de inmunofluorescencia de la OS-CSC fija en 4% PFA / DPBS se puede utilizar para investigar el fenotipo MSC-como de OS-CSC usando anticuerpos dirigidos contra CD44, Stro-1 y CD105. El siguiente método se utiliza de forma rutinaria por los autores.- En una campana química, permeabilizar las células que han sido fijados en el 4% PFA / DPBS mediante la adición de 500 l 0,2% De Triton X-100 / DPBS a cada pocillo. Se incuban las células a 37 ° C durante 30 min. Lave suavemente las células 3 veces con DPBS. Añadir 300 l de RNasa diluyó 1 / 1.000 con 2% BSA / DPBS a las células y se incuba a 37 ° C durante 30 min.
- Lave suavemente las células 3 veces con BSA al 2% / DPBS. Teñir las células para los marcadores de MSC. Añadir el anticuerpo primario solamente a los pocillos seleccionados como controles positivos para cada anticuerpo.
- Añadir 300 l anti-CD105 diluyeron 1/10 con un 2% de BSA / DPBS, 300 l anti-CD44 diluye 1/10 con un 2% de BSA / DPBS, 300 l anti-Stro-1 se diluye 1/10 con un 2% de BSA / DPBS y sólo 200 l 2% de BSA / DPBS a los pozos seleccionados como controles negativos para cada anticuerpo.
- Se incuban las células en un ambiente húmedo a 4 ° CO / N. Lavar los pocillos 3 veces con DPBS y luego dos veces con 2% BSA / DPBS.
- Revelar anticuerpos primarios mediante la adición de anticuerpos secundarios específicos.
- Añadir 300 l de IgG anti-conejo (de burro anti-IgG de conejo [H + L]) diluido 1/100con 2% de BSA / DPBS en cada pocillo elegido como control positivo y negativo para CD44 y CD105. Añadir 300 l FITC anti-Ig de ratón (FITC-conejo anti-IgG de ratón [H + L]) diluido 1/100 con 2% BSA / DPBS en cada pocillo elegido como control positivo y negativo para Stro-1. Se incuban las células en la oscuridad a temperatura ambiente durante 60 min. Lave los pocillos de 6x con DPBS.
- Mancha MSC células de marcador positivo para citoesqueleto de actina mediante la adición de 300 l faloidina diluida 1/100 con 2% de BSA / DPBS en cada pocillo manchado de inmunofluorescencia MSC marcador.
- Se incuban las células durante 40 min a TA. Lavar los pocillos 3 veces con DPBS y luego se lavan dos veces con dH2O ultrapura Proceder a la tinción de contraste de los núcleos después de la tinción de inmunofluorescencia se ha descrito anteriormente. Preparar la solución de yoduro de propidio 10 -5 M en DPBS (acción 1.5 x 10 -3 M) en una campana de humos.
- Añadir 200 solución de yoduro de propidio l a cada pocillo de color como se describe anteriormente. Incubar la células para 2 - 3 min a TA. Lavar los pocillos dos veces con dH2O ultrapura
NOTA: repetir todos los pasos de las secciones 5.1 - 5.2 en la HCT8 línea celular, una línea diferenciada continua primaria cáncer de colon de células que se utiliza como un control negativo.
- Añadir 200 solución de yoduro de propidio l a cada pocillo de color como se describe anteriormente. Incubar la células para 2 - 3 min a TA. Lavar los pocillos dos veces con dH2O ultrapura
- Ensayo de diferenciación osteogénica
NOTA: la diferenciación osteogénica tiene una duración de 20 d.- Plate OS-CSC en placas de 24 pocillos a una densidad celular de las células de 1 x 10 4 / cm 2 en SCCGM. Permitir que las células crezcan en SCGM hasta que alcanzan 80-90% de confluencia en cada pocillo.
- Iniciar la diferenciación osteogénica cambiando el SCGM a OM. Permiten que las células crezcan en OM y refrescar el medio cada 3 - 4 d. Detener el ensayo de diferenciación osteogénica a los 10 días para evaluar la presencia de fosfatasa alcalina (ALP).
- Fix células en PFA al 4% / DPBS (ver sección 5.1). Evaluar el fenotipo osteoblástico por tinción citoquímica para ALP y para HAutilizando rojo de alizarina S tinción.
- ALP tinción citoquímica
NOTA: Preparar la mezcla de colorantes en una campana química inmediatamente antes de iniciar la tinción.- Disolver 40 mg de Blue BB o sal Fast Red Violet LB en 50 ml de Tris-HCl, pH 9 (Solución A) Rápido. Disolver la sal de fosfato de sodio naftol-AS-MX 5 mg en 1 ml de DMSO (solución B). Añadir la solución B por completo a la solución A y mezclar bien, la obtención de células Solución C. Lavar dos veces con DPBS.
- Añadir 500 l - 1 ml de solución C a cada pocillo y se incuba a 37 ° C y 5% de CO 2. Vigilar el curso de la tinción cada 10 min mediante la observación de las células bajo el microscopio.
- Detener la tinción cuando las células ALP-positivos se vuelven intensamente coloreada (azul con la sal Fast Blue BB o rojo con sal LB Rojo Violeta Rápido), que generalmente se produce a los 30 minutos. Se lavan las células 3 veces con dH 2 O ultrapura para eliminar todos los residuos de la solución C. Si un precipitado de la manchos presente, se lavan las células rápidamente una vez con etanol absoluto.
- Proceder a la tinción de contraste de los núcleos después de la tinción de fosfatasa alcalina como se describe en los pasos 5.2.5 y 5.2.5.1.
- Rojo de alizarina S tinción citoquímica
NOTA: Preparar la mezcla de colorantes antes de comenzar el experimento.- Preparar el 2% rojo de alizarina S (2 g rojo de alizarina S en 100 ml de H2O ultrapura). Añadir 2,5% NH 3-2% rojo de alizarina S para llegar a pH 6,0. Tienda 2% de solución de rojo de alizarina S a 4 ° C. Se lavan las células una vez con DPBS.
- Añadir rojo de alizarina S a las células durante sólo unos pocos segundos.
- Lavar los pocillos con dH ultrapura 2 O para controlar el grado de tinción; Si los depósitos de HA no son intensamente coloreado, repita el paso 5.3.5.2. Detener la tinción cuando los depósitos de HA se vuelven de color rojo intenso color, que por lo general se produce dentro de unos minutos. Lavar los pocillos con ultrapura dH2O
- la diferenciación adipogénica
NOTA: Ensayo de duración depende de las líneas OS-CSC. El ensayo puede últimos 14 - 30 días.- Plate OS-CSC en placas de 24 pocillos a una densidad celular de las células de 1 x 10 4 / cm 2 en SCGM. Permitir que las células crezcan en SCGM hasta que alcanzan 80-90% de confluencia en cada pocillo. Iniciar la diferenciación adipogénica cambiando el SCGM a AM. Permiten que las células crezcan en AM y refrescar la mañana dos veces a la semana.
- Detener el ensayo de diferenciación adipogénica cuando las vesículas lipídicas son visibles. Evaluar el fenotipo adipogénico por Oil Red O tinción de hematoxilina y tinción de contraste para los núcleos.
- Contratinción de hematoxilina para los núcleos
NOTA: Preparar la mezcla de colorantes antes de comenzar el experimento.- Preparar la solución de hematoxilina 5%, llamado Emallume Carazzi 39. Almacenar la solución a 4 ° C. Añadir Emallume Carazzi por sólo 2 min. Lavar los pocillos con ULTrâpure dH2O
- ensayo de CFU
NOTA: Este experimento debe ser realizado por triplicado.- Plate OS-CSC en 100 mm placas de Petri a una densidad celular de 450 células / cm 2 en CFUM. Se incuban las células en un 37 ° C, 5% de CO2 durante 4 semanas. Refrescar CFUM dos veces a la semana.
- Manchar la UFC con azul de toluidina. Contar las colonias de color utilizando un microscopio invertido. Calcula la eficiencia CFU de acuerdo con la siguiente fórmula: (número de colonias formadas / número de células sembradas) * 100.
- Análisis de la actividad de ALDH
NOTA: ALDH actividad se ha evaluado usando un Ensayo Colorimétrico Kit ALDH Actividad en las dos líneas OS-CSC y en una línea de fibroblastos finito, que se utilizó como control negativo. Este kit cuantifica la actividad enzimática de ALDH por lectura de absorbancia a 450 nm. Todas las pruebas se han realizado por triplicado.- Disociar cultivos de células de la monocapa por tripsinización (ver sección 2.2). Precipitar las células por centrifugación a 400 xg durante 5 min. Siga el protocolo del fabricante.
- El análisis por citometría de:
NOTA: No se requieren suspensiones de células individuales para la tinción óptima de muestras de citometría de flujo. Una suspensión de células individuales deben estar preparados para cada anticuerpo a ensayar. Disociar cultivos de células de la monocapa por tripsinización (ver sección 2.2).- Coloque la suspensión de células en un tubo cónico, llevar a cabo un recuento de células usando el Bürker cámara de recuento, centrifugar las células a 400 xg y resuspender en un volumen apropiado de tampón de separación para obtener una suspensión celular a una concentración final de células de 1 x 10 5 células / ml.
- Centrifugar la suspensión celular durante 5 min a 4 ° C. Eliminar el sobrenadante y lavar el sedimento con tampón de separación. Repita este paso dos veces.
- Las células de la mancha para la EMMarcadores de C (es decir, CD44, CD105 y Stro-1) 40.
- Analizar las suspensiones de células teñidas positivamente en un citómetro de flujo. Analizar las muestras marcadas en el plazo de 1 d. Incubar las muestras a 4 ° C hasta su análisis.
- RT-PCR
- Extracción y aislamiento de ARN
- Añadir reactivo de lisis 1 ml de las muestras envasadas congelados celulares de OS-CSC y lisar las células directamente en el tubo con la pipeta el sedimento arriba y abajo varias veces.
- Centrifugar las muestras a 12.000 xg durante 1 min a 4 ° C. Retire con cuidado el sobrenadante. Transferir el sobrenadante a un nuevo tubo, añadir 200 l de cloroformo, y la tapa del tubo de forma segura. Agitar el tubo vigorosamente durante 15 segundos e incubar la muestra durante 5 min a TA.
- Centrifugar las muestras a 12.000 xg durante 15 min a 4 ° C. La mezcla se separa en tres fases diferentes. El ARN es exclusivamente en la fase acuosa superior incolora.
- siendo particularly cuidado, sólo eliminar la fase acuosa y la transferencia de esta fase en un nuevo tubo para proceder con el aislamiento de ARN. Añadir 500 l de isopropanol al tubo que contiene la fase acuosa. Agitar suavemente con la mano. Incubar la muestra a la temperatura ambiente durante 10 min. Centrifugar la muestra a 12.000 xg durante 10 min a 4 ° C.
NOTA: Después se centrifuga la muestra, es posible ver el ARN, que forma un gránulo similar a un gel en el lado y en la parte inferior del tubo. - Eliminar el sobrenadante del tubo, teniendo cuidado de dejar el pellet de ARN en la parte inferior. Añadir 1 ml de etanol 75% al tubo. Vortex el tubo con la mano durante unos pocos segundos y centrifugar el tubo a 7500 × g durante 5 min a 4 ° C.
- Desechar el etanol y secar al aire el precipitado de ARN. Cuando la pastilla es seco, resuspender el sedimento de ARN en RNasa libre de agua (10 - 50 l) pipeteando la solución hacia arriba y abajo varias veces.
- Determinar el rendimiento y la pureza del ARN por measurante la absorbancia a 260 nm y 280 nm usando un espectrofotómetro. Evaluar la integridad del ARN total sobre gel de agarosa estándar 1%. Almacenar el ARN a -80 ° C.
- Reacción en cadena de la polimerasa
- Sintetizar ADNc de primera cadena a partir de 500 ng muestras de ARN utilizando un kit de transcripción inversa. Descongelar las muestras de ARN en el hielo y el deshielo de las soluciones necesarias incluidas en el kit a temperatura ambiente. Proceder para sintetizar ADNc siguientes protocolo del fabricante.
- Semi-cuantitativa reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR)
- Llevar a cabo todas las PCR utilizando 1 l de ADNc para cada muestra como una plantilla en un volumen final de reacción de 24 l. Utilice las secuencias de los cebadores listados en la Tabla 1 para la amplificación de Nanog, Oct 3/4, SOX2 y CD133 genes.
- Separar los productos de RT-PCR mediante electroforesis en gel de agarosa al 1,8% y tinción con bromuro de etidio. Fotografía obtenida con Illum UVminación.
- Extracción y aislamiento de ARN
Resultados
Muestras OS obtenidas por aspiración con aguja o la resección quirúrgica de una pequeña porción del tumor (Figura 1A, B) permiten el aislamiento de una sola OSA si se trata precisamente, como se describe en la sección de Protocolo (Figura 2A, B). Desafortunadamente, el número de células aisladas a partir de las biopsias es baja, con un rango de salida de 30 a 50%. La salida depende del tipo y la dimensión de las biopsias (Figura 5A, B). Estas células tienen que ser tratados con precisión. Por consiguiente, aproximadamente un mes es necesario para los cultivos primarios para llegar a la confluencia en una placa de Petri de 100 mm. Después de este tiempo, OSA se obtienen a partir de dos muestras OS marcado OSA5 y OSA6 (Figura 6A, B). Entonces, es necesario subcultivar la línea celular primario para obtener un número suficiente de células para llevar a cabo el análisis de caracterización y criopreservar las células linES. En el paso 3 rd de subcultivo, cuando ambas líneas de células primarias OSA alcanzan la confluencia, se sembraron en placas de 6 pocillos de fijación ultra-bajas para el ensayo sarcosphere. Este tipo de placa se utiliza porque nos permite mantener las células en un estado de suspensión, para evitar que las células madre de la diferenciación de unión mediada, para evitar que las células dependientes de anclaje de dividir, y finalmente, para reducir de fijación al sustrato. Por lo tanto, su uso nos permite crear una condición estresante para las células cancerosas, que es necesaria para la selección de células madre cancerosas. A las 24 h después del inicio del ensayo, las células aparecen aislados uno de otro (Figura 7). Después de 7 d de control de la progresión del ensayo, pequeñas colonias esféricas han comenzado a formarse y son visibles (Figura 8). A los 28 días, varias colonias esféricas grandes que se han formado en cada pocillo se pueden observar (Figura 9A, B). Después de los sarcospheres por plae sido cultivados durante 28 d, estas grandes colonias esféricas se pueden aislar. La figura 10 muestra las etapas para aislar sarcospheres de 6 pocillos placas de fijación ultra-bajas y recultivo ellos en condiciones adherentes. La Figura 11 muestra las colonias esféricas flotantes después del aislamiento. Las grandes colonias esféricas sembraron en placas de fijación normales muestran expansión del adherente después de su aislamiento (Figura 12A, B). Las células que se expanden desde las sarcospheres individuales son probablemente las células cancerosas con un fenotipo de células madre similares. Por lo tanto, después del aislamiento, OS-células madre cancerosas probablemente fueron obtenidos. Estas células se denominan células madre cancerosas OSA5-y-OSA6 células madre cancerosas (Figura 13A, B).
En este punto, es necesario proceder a la caracterización del fenotipo de células madre similares para las dos líneas OS-CSC obtenidos, como se describe anteriormente. Los análisis para la caracterización del fenotipo de células madre wer-comoe realiza en el 4º paso del subcultivo después se aislaron los sarcospheres para cada línea OS-CSC. Las dos líneas celulares, células madre cancerosas OSA5-y-OSA6 células madre cancerosas, mostraron una fuerte positividad para los marcadores de superficie MSC (CD105 y CD44) (Figura 14A, B y Figura 15A, B), mientras que mostraron positividad moderada para el marcador de superficie MSC estroma 1 (Figura 16A, B). Nuestras observaciones han sido confirmadas por los resultados negativos obtenidos con la línea comercial y diferenciada de células de cáncer de colon HCT8 (Figura 14C, la Figura 15C, la Figura 16C). Se observó una total falta de tinción específica y no específica para estos marcadores de superficie en la línea celular HCT8.
Para evaluar el fenotipo MSC de los dos SO-células madre cancerosas, sino que también los análisis de citometría de flujo realizada. Tanto las líneas OS-CSC expresan altos niveles de CD44 y CD105. Sin embargo, de las células en las dos líneas celulares, sólo el 1,14%, expresado Stro-1. Por lo tanto, esta reSult confirmó la presencia moderada de Stro-1 como se demuestra por la tinción de inmunofluorescencia. Por el contrario, 99,62% de la OSA5-CSC expresó CD44 y 87,38% de estas células expresaban CD105; 99,88% de la OSA6-CSC expresa CD44 en y 95,79% de estas células expresaban CD105. Además, ambas líneas celulares son CD45-.
Se evaluó la expresión de marcadores de 3 ESC (Nanog, Oct 3/4, Sox2) y del gen CD133, otro marcador de células madre cancerosas, mediante RT-PCR. Hay que destacar que todos estos genes se expresaron en ambas líneas OS-CSC (Figura 17). Los ensayos de diferenciación osteogénica adipogénicos y mostraron la capacidad de las líneas aisladas OSA-CSC de diferenciarse en osteoblastos (Figura 18A - D y la Figura 19A - D) y en adipocitos (Figura 20A - D).
Además, la CFU una ssay (Figura 21) mostró una buena tasa de eficiencia clonogénico, con un 13% de los CAC-OSA5 y 14% para OSA6-CSC. Varios estudios recientes han demostrado que los altos niveles de actividad de ALDH son características de varios tipos de cáncer. Este parámetro puede ser utilizado como un marcador de células madre de cáncer y se correlaciona con un mal pronóstico. El ensayo de actividad de ALDH mostró que ambas líneas OS-CSC tienen altos niveles de actividad de ALDH (Figura 22), mientras que se observó actividad ALDH en el límite inferior cuantificable en la línea de fibroblastos que se utilizó como control negativo en este ensayo.

Figura 1. Ejemplos de muestras OS biopsia. (A). muestra de la biopsia obtenida por aspiración con aguja. (B). muestra de biopsia obtenido por la resección quirúrgica de una parte del tumor.884 / 53884fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. La desagregación mecánica de una muestra OS. (A) La fragmentación de una muestra con unas pinzas y una lanceta Perry. (B) Los fragmentos suspendidas en CM (indicada por la flecha). Haga clic aquí para ver una versión más grande de esta figura.
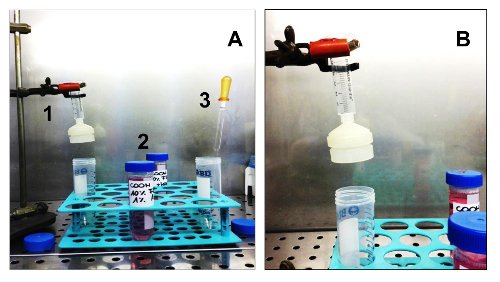
Figura 3. El equipo y consumibles necesarios para aislar Sarcospheres. (A). Todos los equipos necesarios para el aislamiento de células. 1. Una jeringa estéril con un soporte de filtro de membrana estéril; 2. Dos medios diferentes: un GMnd SCGM; 3. Una pipeta Pasteur de vidrio estéril. (B) Detalle de la jeringa montada sobre un soporte, con el soporte del filtro de membrana. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Unidad de filtración. Varios componentes necesarios para montar la unidad de filtración (A) (el filtro de red se indica por la flecha). De contraste de fase de observación de las 40 micras mallas (una malla está indicado por la flecha) del filtro neto (B). Aumento original: 10 veces. La unidad de filtración montado (C - D). Unidad de filtración esterilizada (E). Haga clic aquí para ver una mayor cincorsión de esta figura.
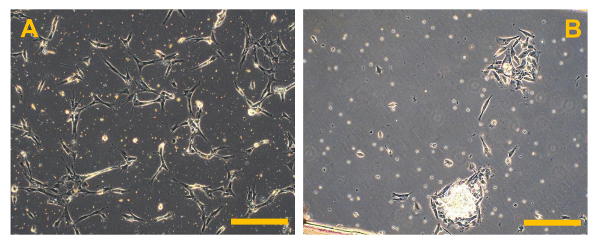
Figura 5. cultivos celulares primarios de sistema operativo convencional. Observación de contraste de fase de cultivos celulares primarios de sistema operativo de alto grado. En (A), varios fragmentos de hueso brillantes son visibles, mientras que en (B), varios pequeños eritrocitos redondeadas y flotantes están presentes. Aumento original: 10 veces. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
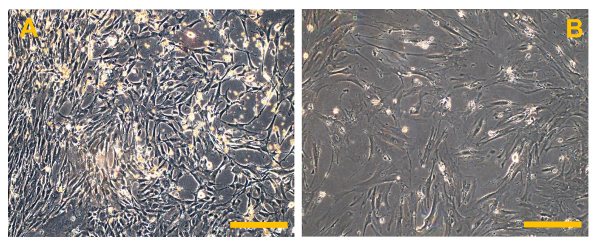
Figura 6. convencional Osteosarcoma líneas celulares finitas (OSA). (A) OSA5 y (B) OSA6. Observación de contraste de fase.Aumento original: 10 veces. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
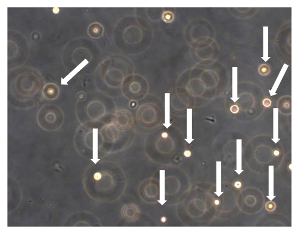
Figura 7. Sarcosphere Ensayo de OSA5 y OSA6. Después de 24 h desde el inicio del ensayo, las células fueron flotando y aisladas unas de otras (células se indican mediante flechas). Observación en contraste de fase. Aumento original:. 20X Haga clic aquí para ver una versión más grande de esta figura.
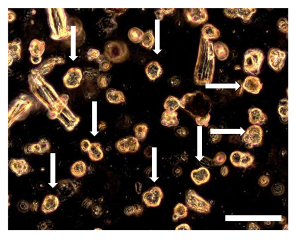
Figura 8. Ensayo de Sarcosphere OSA5 y OSA6 a las 7 D. 7 d en el ensayo, varios pequeños Sphericase pudieron observar l colonias rodeadas por células individuales. Los sarcospheres (algunos de estos sarcospheres se indican con flechas) aparecen flotando en el medio o ligeramente asentado en el fondo del pozo. Observación en contraste de fase. Aumento original: 20X. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
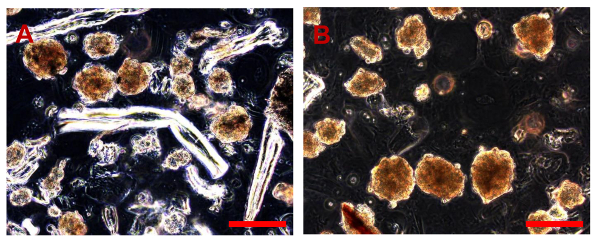
Figura 9. Ensayo de Sarcosphere OSA5 y OSA6 a 28 D. Después de 28 días, varias grandes sarcospheres ámbar se observan en cada pocillo de las placas de cada línea celular OSA, OSA5 (A) y OSA6 (B). Tamaño de la barra: 100 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10. Los pasajes para el aislamiento de Sarcospheres Los pasos para sarcospheres de aislamiento de 6 pocillos placas de fijación ultra-bajas y su recultivo en condiciones adherentes se muestran (A) Todo el equipo necesario para el aislamiento.:. 1. Uno de 6 pocillos ultra bajo placa con sarcospheres formados en cada pocillo, 2. jeringa con el soporte del filtro de red, 3. pipeta, 4. 1000 l puntas esterilizadas, 5. 2 pinzas estériles Perry, 6. 2 medios de cultivo diferentes , 7. pipeta Pasteur estéril 8. placas de Petri. (B) Recopilación de sarcospheres. El medio contenido en cada pocillo se recoge mediante una pipeta con una punta de 1.000 l estéril. (C) Recoger la suspensión en la jeringa. La suspensión recogida se transfiere a la jeringa para iniciar el proceso de filtración natural usando elsoporte de filtro de membrana. (D) filtración natural. (E) Desmontaje del soporte del filtro de membrana de la jeringa. Después se filtra toda la suspensión, el soporte del filtro neto se toma aparte y se puso en un plato de Petri; (F) Desmontaje del soporte del filtro de membrana. Sarcospheres están contenidas en los poros del filtro de red en el soporte del filtro de red, por lo que deben ser liberados con las pinzas Perry. (G, H) La eliminación de sarcospheres desde el filtro de membrana. Haga clic aquí para ver una versión más grande de esta figura.
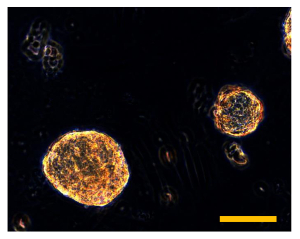
Figura 11. Aislamiento Sarcosphere. Sarcospheres Aislado flotar en el medio en la placa de Petri 60 mm. Observación de contraste de fase.Aumento original: 40X. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
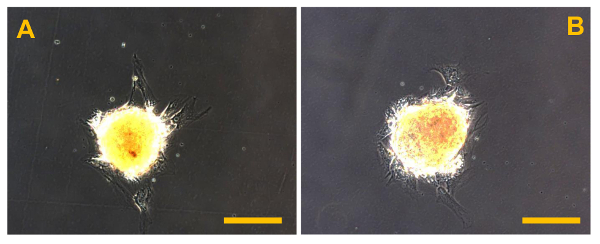
Figura 12. Sarcosphere después del aislamiento. Sarcospheres de OSA5 (A) y OSA6 (B) líneas celulares en el comienzo de la expansión adherente siguientes reintroducción y recultivo en una monocapa en condiciones adherentes a las 48 h después del aislamiento. Observación de contraste de fase. Aumento original: 20X. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
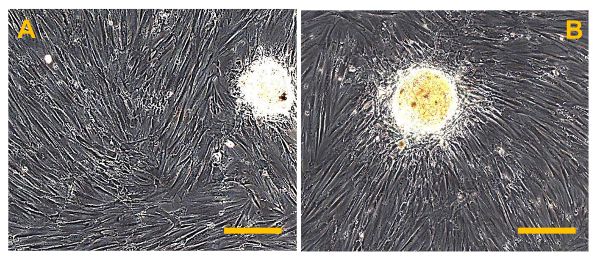
Figura 13. Sarcospheres A los 7 días después del aislamiento. Sarcospheres de OSA5 (A) y líneas celulares OSA6 (B) mostraron expansión adherente siguiente reintroducción y recultivo en una monocapa en condiciones adherentes a 7 d después del aislamiento. Observación de contraste de fase. Aumento original: 20X. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
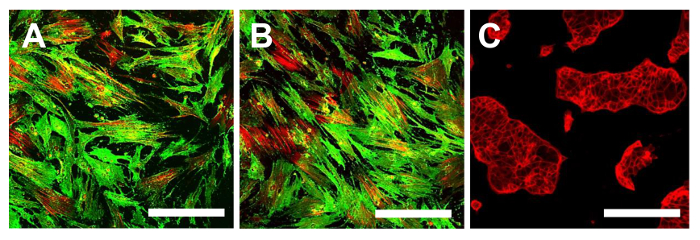
Figura 14. Inmunofluorescencia La tinción para CD105. La tinción de inmunofluorescencia para CD105 en las líneas de OSA-CSC OSA5-CSC (A) y OSA6-CSC (B) y en la línea celular continua HCT8 (C), que se utilizó como control negativo. LSCM de color convencional: Verde para CD105 y rojo para el citoesqueleto. Aumento original: 10 veces. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
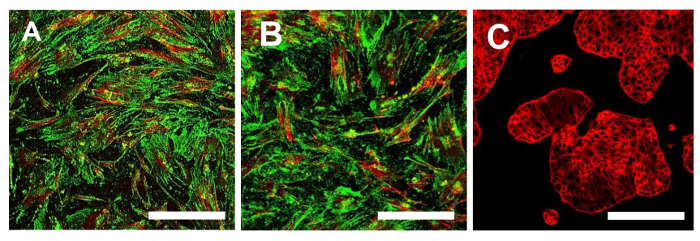
Figura 15. Inmunofluorescencia La tinción para CD44. La tinción de inmunofluorescencia para CD44 en las líneas de OSA-CSC OSA5-CSC (A) y OSA6-CSC (B) y en la línea celular continua HCT8 (C), que se utilizó como control negativo. LSCM en colores convencionales: verde y rojo para CD44 para citoesqueleto. Aumento original: 10 veces. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
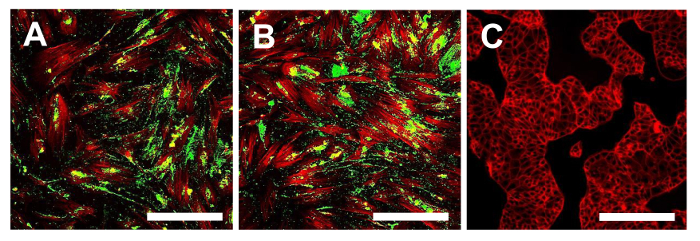
Figura 16. La inmunofluorescencia tinción de Stro-1. La tinción de inmunofluorescencia para Stro-1 en las líneas OSA-CSC-OSA5 células madre cancerosas (A) y OSA6-células madre cancerosas (B) y en la línea celular continua HCT8 (C), que fue utilizado como un negativo controlar. LSCM en colores convencionales: verde para Stro-1 y el rojo para citoesqueleto. Aumento original: 10 veces. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
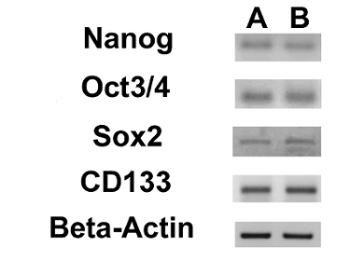
Figura 17. Expresión de marcadores nucleares del CES y del gen CD133. RT-PCR que muestra la expresión de Nanog, Oct 3/4, Sox2 y CD133 en células madre cancerosas OSA5-(A) y en los CAC-OSA6 ( B). Haga clic aquí para ver una versión más grande de esta figura.
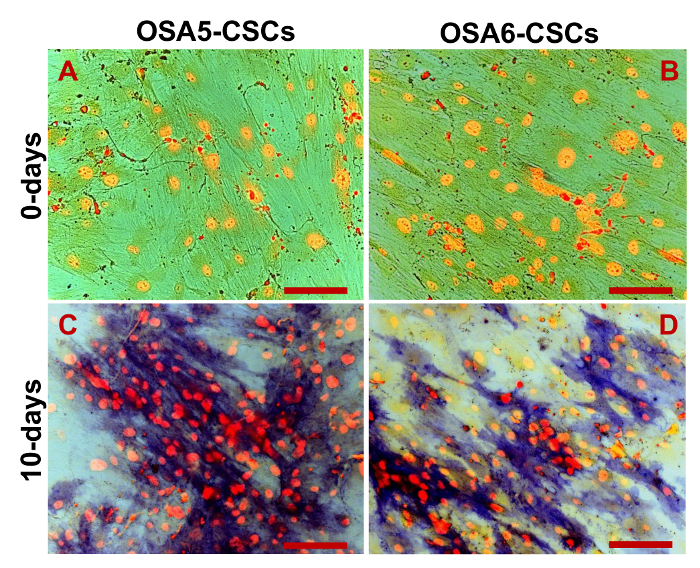
Figura 18. Ensayo de diferenciación osteogénica -. ALP diferenciación osteogénica en 0 d (A, B) y después de 10 d (C, D) de la inducción como se determina por tinción citoquímica para ALP usando Fast Blue BB. En azul, ALP + células; en rojo, el núcleo contratinción con yoduro de propidio. observación Composite en campo claro y en la fluorescencia. Aumento original: 20X. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.

Figura 19. Ensayo de diferenciación osteogénica -. HA diferenciación osteogénica en 0 d (A, B) y después de 20 d (C, D) de la inducción como se determina por tinción citoquímica para la hidroxiapatita (HA) con rojo de alizarina S. Las células se contrastan en depósitos de color azul / gris, y el granuladas de HA se tiñen de rojo. Observación en contraste de fase. Aumento original: 40X. Tamaño de la barra:. 100 micras Haga clic aquí para ver una versión más grande de esta figura.
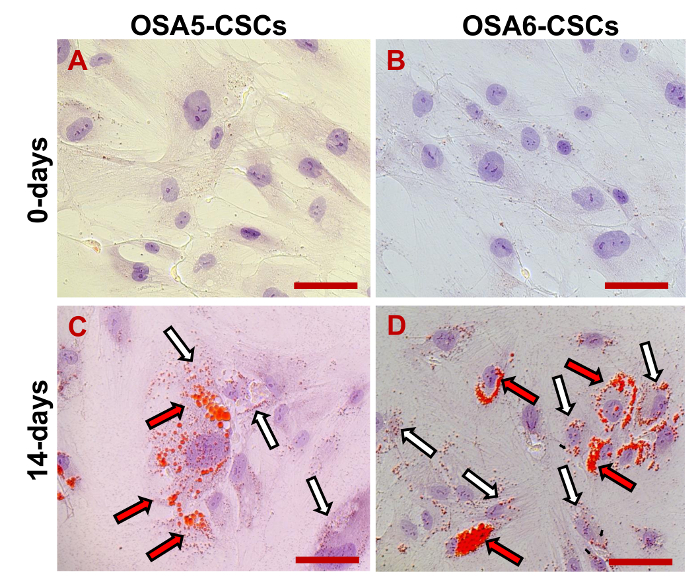
Figura 20. Adipogénico ensayo de diferenciación. Diferenciación adipogénica en 0 d (A, B) y después de 14 d (C, D) de la inducción como se determina por cytochtinción emical con Aceite Rojo O. En rojo, las vesículas lipídicas (las vesículas más grandes están indicadas por las flechas negras / rojo; las vesículas más pequeñas se indican mediante las flechas blancas / negras); en azul / violeta, los núcleos contrastados por hematoxilina. Observación de campo claro. Aumento original: 40X. Tamaño de la barra:. 100 M Haga clic aquí para ver una versión más grande de esta figura.
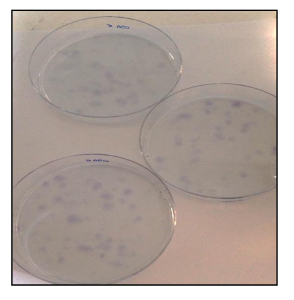
Figura 21. Ensayo de UFC. Ensayo de UFC de líneas OSA-CSC teñidas con azul de toluidina. Haga clic aquí para ver una versión más grande de esta figura.
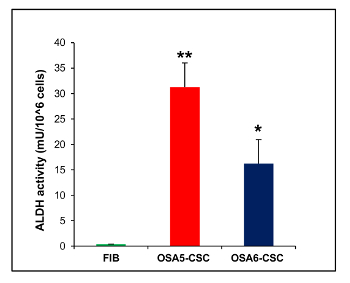 /> Figura 22. Ensayo de la actividad de ALDH. El ensayo colorimétrico ALDH detectado altos niveles de actividad de ALDH en las dos líneas OS-CSC, OSA5-células madre cancerosas y células madre cancerosas OSA6-, mientras que el ensayo detectó la ausencia de esta actividad en la línea de célula diferenciada finita de los fibroblastos, FIB. Las barras de error: SD. **: P <0,001 vs FIB; *:. P <0,01 vs FIB Haga clic aquí para ver una versión más grande de esta figura.
/> Figura 22. Ensayo de la actividad de ALDH. El ensayo colorimétrico ALDH detectado altos niveles de actividad de ALDH en las dos líneas OS-CSC, OSA5-células madre cancerosas y células madre cancerosas OSA6-, mientras que el ensayo detectó la ausencia de esta actividad en la línea de célula diferenciada finita de los fibroblastos, FIB. Las barras de error: SD. **: P <0,001 vs FIB; *:. P <0,01 vs FIB Haga clic aquí para ver una versión más grande de esta figura.
| Gene | Los oligonucleótidos | Secuencia (5¹-3¹) | El tamaño del amplicón (pb) | Tₐ (° C) | |
| Nanog | Cebador inverso cebador directo | 87 | 60 | ||
| octubre 3/2 | Cebador inverso cebador directo | GGGAGGAGCTAGGGAAAGA TCCTTCCTTAGTGAATGAAGAACT | 77 | 60 | |
| Sox2 | Cebador inverso cebador directo | TGCAGTACAACTCCATGACC GGACTTGACCACCGAACC | 125 | 55 | |
| CD133 | Cebador inverso cebador directo | CCAGAAGCCGGGTCATAAAT ATTCACTCAAGGCACCATCC | 127 | 56 | |
| pb, pares de bases de tamaño de amplificación; Tₐ, recocidotemperatura | |||||
Tabla 1. Lista detallada de Secuencias de los Cebadores para Nanog, Oct 3/4, Sox2 y CD133 con el tamaño de amplificación y la temperatura de recocido
Discusión
CSC tienen varias propiedades que permiten la identificación de este subconjunto celular particular en la masa del tumor. Sobre la base de estas características, tales como la resistencia adquirida a citotóxicos agentes de quimioterapia para la sobreexpresión de ATP de unión a transportadores de casete de eflujo multifármaco de 28, 32, 33, o para la regulación al alza de la expresión de enzimas de desintoxicación, tales como ALDH 32, para la expresión de un marcador de superficie en particular, como CD133, CD44, CD34, CD90, y otros 30, 34, 35, 41, varios métodos diferentes para aislar células madre cancerosas se han desarrollado 42-44. Una de estas técnicas es el ensayo de formación de esfera, que se basa en la capacidad de las células madre cancerosas para crecer en condiciones no adherentes.
La capacidad de las células madre de tejido y células madre cancerosas para formar esferas fue descrito primero en los estudios sobre la identificación de células madre neurales por Reynolds et al. 37. Posteriormente, Gibbs et al. 38 nosed estos estudios para iniciar el aislamiento de células madre cancerosas de los tumores sólidos, en particular, de sarcomas óseos. Hemos decidido utilizar el método de ensayo de formación de ámbito ilustrado por Gibbs et al. Para aislar células madre cancerosas de las líneas celulares obtenidas de biopsias OSA OS convencionales. Se adaptó el método original para mejorar los resultados de este ensayo y para facilitar su reproducibilidad para otras líneas celulares de cáncer. Con referencia a la creación de la ensayo de formación de esfera, se verificó que chapado 40.000 células / pocillo es una buena práctica para mantener las células en aislamiento en el comienzo del ensayo. Este truco es muy importante para evitar la posibilidad de que las colonias esféricas originan a partir de la agregación celular y no de la capacidad particular y exclusivo de un único CSC para crecer en condiciones no adherentes y formar una colonia esférica. Esta capacidad es un punto particularmente crítico de este ensayo.
También certificamos que para obtener una buena tasa de formación de esferas, Es suficiente para volver a cargar alícuotas de factores de crecimiento cada 3 d y no todos los días como se describe en el método original. En este estudio, también establecido y ampliamente descrito un buen método para el aislamiento de las colonias esféricas que se formaron cuando se cultiva en condiciones no adherentes. Este paso es crítico en este ensayo, ya que es muy importante para tratar de aislar como muchas de las esferas como sea posible que se forman en cada pocillo sin dañarlos. También es importante para aislar sólo las esferas y no las células individuales, que pueden permanecer en suspensión durante la duración del ensayo. Para superar estos puntos críticos, hemos desarrollado un método de aislamiento particular, el cual, como se muestra arriba, dio buenos resultados para el aislamiento CSC. Obviamente, hay la posibilidad de que no todas las esferas que se formaron se pueden recuperar, pero el porcentaje de pérdida es muy baja. De hecho, también tenemos la posibilidad de utilizar un filtro con poros 40 micras para aislar las esferas después de que se conviertan en grandes (formularioed aproximadamente 100 - 200 células).
Este aislamiento se detiene la formación de esfera pero permite que las células individuales, parte del residuo metilcelulosa, y las esferas más pequeñas para ser filtradas. Esta eliminación se lleva a cabo por filtración a fondo tal como se describe en el protocolo.
Por otra parte, la selección de las colonias más grandes esféricas a través de las 40 micras de malla, con la consiguiente pérdida de las colonias esféricas más pequeñas permite seleccionar las células madre cancerosas con la más alta capacidad de formar colonias esféricas y con mayor stemness. Todas estas modificaciones se llevaron a cabo para mejorar el ensayo y para ayudar a los investigadores que estudian los CAC de entender y reproducir el paso más crítico del método original del ensayo de formación de esfera.
Entre los estudios con respecto a los métodos in vitro de células madre cancerosas de aislamiento, este estudio tuvo como objetivo mostrar cómo este ensayo de formación de ámbito adaptada podría ser un buen método para aislar células madre cancerosas delíneas celulares de Osa. Las adaptaciones al método original y la técnica de aislamiento detallada describen mejorar su eficacia. En poco tiempo, buen número de los CAC se puede obtener y utilizar para varios experimentos. Por lo tanto, es posible confirmar rápidamente los fenotipos madre-como y, en particular, para estudiar el fenotipo doble vástago-como que caracteriza OS-CSC. Por lo tanto, este ensayo modificado podría ser una buena técnica para el aislamiento de células madre cancerosas y el estudio de su biología. En el futuro, este método, con adaptaciones adicionales, también se puede utilizar para aislar células madre cancerosas de otras líneas celulares de cáncer de finito obtenidos por biopsias de tumores sólidos raras.
La posibilidad de aislar células madre cancerosas de tumores sólidos raras, tales como OS, no sólo permite la mejora de los estudios sobre este tipo de cáncer particular, sino que se extiende también a estudios de diferentes tipos de cáncer para desarrollar mejores métodos para su aislamiento y para futuros estudios de la biología de este subconjunto celular importante. Por lo tanto, como hemoslo han hecho en este estudio, es importante para mejorar los métodos de aislamiento CSC a través del estudio de CSC biología, con el objetivo final de encontrar dianas moleculares y el desarrollo de una terapia contra el cáncer muy específico dirigido contra este subconjunto celular particular, que es probablemente responsable de el mantenimiento del tumor primario, el desarrollo de su repetición, y el origen de las metástasis en varios órganos. El estudio de la biología CSC también es importante para la búsqueda de terapias que podrían ser incisiva en la cura del cáncer, como el sistema operativo, para lo cual la tasa de supervivencia después del tratamiento neoadyuvante sigue siendo muy pobre.
Divulgaciones
The authors declare that they have no competing financial interest.
Agradecimientos
This study was supported by ITT (Istituto Toscano Tumori) Grant Proposal 2010.
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco's Phosphate Buffered Saline with Ca2+ and Mg2+ (DPBS) | LONZA | BE17-513F | _ |
| Dulbecco's Phosphate Buffered Saline without Ca2+ and Mg2+ (DPBS) | LONZA | BE17-512F | _ |
| Porcine Trypsin 1:250 | BD Difco | 215310 | Solvent: DPBS. Stock concentration: Powder |
| Ethylenediamine tetraacetic acid disodium salt dihydrate(EDTA) | Sigma-Aldrich | E4884 | Solvent: DPBS. Stock concentration: Powder |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C0130 | Solvent: Buffer Solution, pH 7.4. Stock concentration: Powder |
| Dimethyl sulphoxide (DMSO) | BDH Chemicals-VWR | 10323 | _ |
| Nutrient Mixture F-12 Ham | Sigma-Aldrich | F6636 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| 2-Phospho-L-ascorbic acid trisodium salt | Sigma-Aldrich | 49752 | Solvent: DPBS. Stock concentration: 5 mg/mL |
| β-Glycerol phosphate disodium salt pentahydrate | Sigma-Aldrich | 50020 | Solvent: DPBS. Stock concentration: 1 M |
| Insulin. Human Recombinant | Sigma-Aldrich | 91077 | Solvent: NaOH 0.1 M. Stock concentration: 10 mM |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I5879 | Solvent: DMSO. Stock concentration: 500 mM |
| Indomethacin | Sigma-Aldrich | I7378 | Solvent: DMSO. Stock concentration: 200 mM |
| Dexamethasone | Sigma-Aldrich | D4902 | Solvent: DMSO. Stock concentration: 1 mM / 100 µM. Store in liquid nitrogen to maintain the biological activity |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | _ |
| Fetal Bovine Serum South America | EUROCLONE | ECS0180L | _ |
| Penicillin-Streptomycin (PEN-STREP) 10,000 U/mL | LONZA | DE17-602E | _ |
| Methyl cellulose | Sigma-Aldrich | 274429 | Solvent: Ultrapure dH2O. Stock concentration: 2% |
| Putresceine dihydrochloride | Sigma-Aldrich | P5780 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| apo-Transferrin | Sigma-Aldrich | T-1147 | Solvent: DPBS. Stock concentration: 25 mg/mL |
| Human Epidermal Growth Factor (EFGF) | Sigma-Aldrich | E5036 | Solvent: DPBS pH 7.4. Stock concentration: 10 µg/mL |
| Fibroblast Growth Factor-Basic Human | Sigma-Aldrich | F0291 | Solvent: DPBS + 0.2% BSA. Stock concentration: 25 µg/mL |
| Selenous Acid | Sigma-Aldrich | 211176 | Solvent: DPBS. Stock concentration: 30 mM |
| Progesterone | Sigma-Aldrich | P8783 | Solvent: ETOH. Stock concentration: 10 mM |
| Toluidine Blue O | Sigma-Aldrich | 198161 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Oil Red O | ICN Biochemicals | 155984 | Solvent: 2-Propanol. Stock concentration: Powder |
| Naphtol AS-MX Phosphate Disodium Salt | Sigma-Aldrich | N5000 | Solvent: DMSO. Stock concentration: Powder |
| Fast Blue BB Salt | Sigma-Aldrich | F3378 | Solvent: Tris HCL, pH 9.0. Stock concentration: Powder |
| Fast Red Violet LB Salt | Sigma-Aldrich | F3381 | Solvent: Tris HCL, pH 9.1. Stock concentration: Powder |
| Bovine Serum Albumin, Fraction V (BSA) | Sigma-Aldrich | A-4503 | Solvent: DPBS. Stock concentration: 2% |
| Alizarin Red S | ICN Biochemicals | 100375 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Formaldehyde solution | Sigma-Aldrich | 533998 | 4% |
| Triton-100X | MERCK | 11869 | Solvent: DPBS. Stock concentration: 0.2%. Danger - Use only under chemical hood |
| Calcein | MERCK | 2315 | Solvent: DPBS . Stock concentration: 200 µg/mL |
| 2-Propanol | MERCK | 109634 | Danger - Use only under chemical hood |
| Ab-CD105 (Mouse monoclonal [SN6] to CD105 (FITC) | Abcam | ab11415 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD44 (Mouse monoclonal [F10-44-2] to CD44 (PE/Cy7®) ) | Abcam | ab46793 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD45 (Mouse monoclonal [MEM-28] to CD45 (PerCP)) | Abcam | ab65952 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD105 (Human CD105 Purified Antibody) | Invitrogen | MHCD10500 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-CD44 (Anti-CD44 Antibody) | Abcam | EPR1013Y(ab51037) | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-Stro-1 (Mouse anti-STRO-1) | Invitrogen | 398401 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 488 (Anti-Rabbit IgG (Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L)) | Invitrogen | A-21206 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| FITC Anti-Mouse IG (FITC-Rabbit Anti Mouse IgG (H+L)) | Invitrogen | 61-6511 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 635 Phalloidin | Invitrogen | A34054 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| AutoMACS™Running Buffer MACS Separation Buffer | Miltenyi | 130,091,221 | Liquid. Store at 4 °C |
| QIAzol®Lysis Reagent | QIAGEN | 79306 | Danger - Use only under chemical hood |
| QUANTITECT® Reverse Transcription Kit | QIAGEN | 205314 | _ |
| Chlorophorm | Sigma-Aldrich | C2432 | Liquid. Danger - Use only under chemical hood |
| Laminar flow hood | GELAIRE | BSB6A | _ |
| Chemical hood | ARREDI TECNICI Villa | Modello DYNAMICA | _ |
| Centrifuge | EPPENDORF | 5415R | _ |
| Laser Scanning Confocal Microscopy LSM 5109 Meta | ZEISS | _ | _ |
| iCycler PCR Thermalcycler | BIORAD | _ | _ |
| CyFlow®SPACE | (PARTEC) | _ | _ |
| Inverted Micrposcope Axiovert 200M | ZEISS | _ | _ |
| Freezing container , | Nalgene | _ | _ |
| Original Pipet-Aid | pbiBrand | _ | _ |
| Micropipettes | EPPENDORF | _ | _ |
| Glass Pasteur Pipette | SIGMA | _ | _ |
| VICTOR3™ | PERKIN ELMER | _ | _ |
| Conical tubes (15 and 50 mL) | BD FALCON | 352096 (for 15 mL) 352070 (for 50 mL) | _ |
| 24-Well Clear Flat Bottom TC-Treated Multiwell-Cell-Culture-Plate | BD FALCON | 353047 | _ |
| 6-Well Clear Flat Bottom Ultra Low Attachment Multiple-Well-Plates | CORNING | 3471 | _ |
| Serological pipettes (5 and 10 mL) | BD FALCON | 357543 (for 5 mL) 357551 (for 10mL) | _ |
| Syringe (5mL) | B|BRAUN | 4617053V | _ |
| Petri dish 100X20 mm | BD FALCON | 353003 | _ |
| Röhren Tubes (3.5 mL, 55x12mm, PS) | SARSTEDT | 55,484 | _ |
| Petri dish 60X15 mm | BD FALCON | 353004 | _ |
| Cryovials 1.5 mL | NALGENE | 5000-1020 | _ |
| Cell-Culture Flasks 25 cm² | BD FALCON | 353014 | _ |
| Nylon Net Filter, Hydrophilic | MERCK | NY4104700 | _ |
| Swinnex Filter Holder | MERCK | SX0002500 | _ |
| Perry tweezer | _ | _ | _ |
| Lancet | _ | _ | _ |
| Dounce | _ | _ | _ |
Referencias
- Reddick, R. L., Michelitch, H. J., Levine, A. M., Triche, T. J. Osteogenic sarcoma: a study of the ultrastructure. Cancer. 45 (1), 64-71 (1980).
- Gatta, G., et al. Childhood cancer survival trends in Europe: a EUROCARE Working Group study. J. Clin. Oncol. 23 (16), 3742-3751 (2005).
- Olstad, O. K., et al. Molecular heterogeneity in human osteosarcoma demonstrated by enriched mRNAs isolated by directional tag PCR subtraction cloning. Anticancer. Res. 23 (3B), 2201-2216 (2003).
- Geller, D. S., Gorlick, R. Osteosarcoma: a review of diagnosis, management, and treatment strategies. Clin Adv Hematol Oncol. 8 (10), 705-718 (2010).
- Tang, N., Song, W. X., Luo, J., Haydon, R. C., He, T. C. Osteosarcoma development and stem cell differentiation. Clin. Orthop. Relat. Res. 466 (9), 2114-2130 (2008).
- Kempf-Bielack, B., et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J. Clin. Oncol. 23 (3), 559-568 (2005).
- Meyers, P. A., et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J. Clin. Oncol. 23 (9), 2004-2011 (2005).
- Gorlick, R., et al. Biology of childhood osteogenic sarcoma and potential targets for therapeutic development: meeting summary. Clin. Cancer Res. 9 (15), 5442-5453 (2003).
- Hayden, J. B., Hoang, B. H. Osteosarcoma: basic science and clinical implications. Orthop. Clin. North Am. 37 (1), 1-7 (2006).
- Thomas, D., Kansara, M. Epigenetic modifications in osteogenic differentiation and transformation. J. Cell. Biochem. 98 (4), 757-769 (2006).
- Araki, N., et al. Involvement of the retinoblastoma gene in primary osteosarcomas and other bone and soft-tissue tumors. Clin. Orthop. Relat. Res. 270 (270), 271-277 (1991).
- Chou, A. J., Gorlick, R. Chemotherapy resistance in osteosarcoma: current challenges and future directions. Expert. Rev. Anticancer Ther. 6 (7), 1075-1085 (2006).
- Arndt, C. A. S., Crist, W. M. Common musculoskeletal tumorsof childhood and adolescence. N. Engl. J. Med. 341 (5), 342-352 (1999).
- Longhi, A., Errani, C., De Paolis, M., Mercuri, M., Bacci, G. Primary bone osteosarcoma in the pediatric age: state of the art. Cancer. Treat. Rev. 32 (6), 423-436 (2006).
- Bacci, G., et al. Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at the istituto ortopedico rizzoli according to the istituto ortopedico rizzoli/osteosarcoma-2 protocol: an updated report. J. Clin. Oncol. 18 (24), 4016-4027 (2000).
- Clarke, M. F., et al. Cancer stem cells-perspectives on current status and future directions: AACR workshop on cancer stem cells. Cancer. Res. 66 (19), 9339-9344 (2006).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367 (6464), 645-648 (1994).
- Bonnet, D., Dick, J. E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med. 3 (7), 730-737 (1997).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumors: accumulating evidence and unresolved questions. Nat. Rev. Cancer. 8 (10), 755-768 (2008).
- Bapat, S. A. Evolution of cancer stem cells. Semin. Cancer Biol. 17 (3), 204-213 (2007).
- Rubio, D., et al. Spontaneous human adult stem cell transformation. Cancer. Res. 65 (8), 3035-3039 (2005).
- Burns, J. S., et al. Tumorigenic heterogeneity in cancer stem cells evolved from long-term cultures of telomerase-immortalized human mesenchymal stem cells. Cancer. Res. 65 (8), 3126-3135 (2005).
- Zhang, M., Rosen, J. M. Stem cells in the etiology and treatment of cancer. Curr. Opin. Genet. Dev. 16 (1), 60-64 (2006).
- Li, Y., et al. Evidence that transgenes encoding components of the Wnt signaling pathway preferentially induce mammary cancers from progenitor cells. Proc. Natl Acad. Sci. USA. 100 (26), 15853-15858 (2003).
- Sell, S. Cellular origin of cancer: dedifferentiation or stem cell maturation arrest?. Environ Health Perspect. 101 (Suppl 5), 15-26 (1993).
- Wernig, M., et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448 (7151), 318-324 (2007).
- Niwa, H., Miyazaki, J., Smith, A. G. Quantitative expression of oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat. Genet. 24 (4), 372-376 (2000).
- Hochedlinger, K., Jaenisch, R. Nuclear reprogramming and pluripotency. Nature. 441 (7097), 1061-1067 (2006).
- Dean, M., Fojo, T., Bates, S. Tumor stem cells and drug resistance. Nat. Rev. Cancer. 5 (4), 275-284 (2005).
- Ma, S., Lee, T. K., Zheng, B. J., Chan, K. W., Guan, X. Y. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway. Oncogene. 27 (12), 1749-1758 (2008).
- Wu, C., et al. Side population cells isolated from mesenchymal neoplasms have tumor initiating potential. Cancer. Res. 67 (17), 8216-8222 (2007).
- Ma, I., Allan, A. L. The role of human aldehyde dehydrogenase in normal and cancer stem cells. Stem. Cell. Rev. 7 (2), 292-306 (2011).
- Awad, O., et al. High ALDH activity identifies chemotherapy-resistant Ewing's sarcoma stem cells that retain sensitivity to EWS-FLI1 inhibition. PLoS One. 5 (11), e13943 (2010).
- Fujii, H., et al. Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines. Int. J. Oncol. 34 (5), 1381-1386 (2009).
- Di Fiore, R., et al. Genetic and molecular characterization of the human osteosarcoma 3AB-OS cancer stem cell line: a possible model for studying osteosarcoma origin and stemness. J. Cell. Physiol. 228 (6), 1189-1201 (2013).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonicprogenitor cell produces neurons and astrocytes. J. Neurosci. 12 (11), 4565-4574 (1992).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Gibbs, C. P., et al. Stem-like cells in bone sarcomas: implications for tumorigenesis. Neoplasia. 7 (11), 967-976 (2005).
- Beccari, N., Mazzi, V. . Manuale di tecnica microscopic. Casa Editrice Dr. Francesco Vallardi Società Editrice Libraria. , 99-100 (1966).
- Majumdar, M. K., Thiede, M. A., Mosca, J. D., Moorman, M., Gerson, S. L. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J. Cell. Physiol. 176 (1), 57-66 (1998).
- Tirino, V., et al. Human primary bone sarcomas contain CD133+ cancer stem cells displaying high tumorigenicity in vivo. FASEB J. 25 (6), 2022-2030 (2011).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. FASEB J. 27 (1), 13-24 (2013).
- Martins-Neves, S. R., et al. Therapeutic implications of an enriched cancer stem-like cell population in a human osteosarcoma cell line. BMC Cancer. 12 (1), 139 (2012).
- Tang, Q. L., et al. Enrichment of osteosarcoma stem cells by chemotherapy. Chin. J. Cancer. 30 (6), 426-432 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados