Method Article
Création de souches du cancer de cultures de cellules de Human ostéosarcome conventionnel
Dans cet article
Résumé
La présence de cellules souches cancéreuses (CCF) dans sarcomes osseux a récemment été liée à leur pathogénie. Dans cet article, nous présentons l'isolement des cellules souches cancéreuses à partir de cultures de cellules primaires obtenues à partir de biopsies humaines d'ostéosarcome classique (OS) en utilisant la capacité de CSCs à croître dans des conditions non adhérentes.
Résumé
Les améliorations actuelles dans la thérapie contre l'ostéosarcome (OS) ont prolongé la vie des patients atteints de cancer, mais le taux de cinq ans de survie reste médiocre lorsque des métastases sont apparues. Le cellules souches du cancer (SCC) théorie soutient qu'il existe un sous-ensemble de cellules tumorales dans la tumeur qui ont des caractéristiques de souches de type, y compris la capacité de maintenir la tumeur et de résister à la chimiothérapie polychimiothérapie. Par conséquent, une meilleure compréhension de la biologie et de la pathogenèse OS est nécessaire pour faire avancer le développement de thérapies ciblées pour éradiquer ce sous-ensemble particulier et de réduire la morbidité et la mortalité chez les patients. Isoler CSCs, établir des cultures de cellules de CSCs, et l'étude de leur biologie sont des étapes importantes pour améliorer notre compréhension de la biologie et de la pathogenèse OS. La mise en place d'OS-CSCs d'origine humaine à partir de biopsies de l'OS a été rendu possible en utilisant plusieurs méthodes, y compris la capacité de créer des cultures de cellules souches en 3 dimensions sous nonadhereconditions nt. Dans ces conditions, les CSC sont en mesure de créer des colonies flottantes sphériques formées par les cellules souches filles; ces colonies sont appelées «sphères cellulaires». Ici, nous décrivons une méthode pour établir les cultures du SCC à partir de cultures de cellules primaires d'OS classique obtenu à partir de biopsies OS. Nous décrivons clairement les plusieurs passages nécessaires pour isoler et caractériser CSCs.
Introduction
Les sarcomes sont un groupe hétérogène de tumeurs rares du tissu conjonctif malignes provenant principalement du mésoderme embryonnaire 1. Les différents types comprennent les sarcomes osseux et des sarcomes des tissus mous. sarcomes osseux, un groupe de tumeurs primaires relativement rares, se composent de plusieurs sous-types, y compris l'ostéosarcome (OS). Système d' exploitation, l' un des tumeurs primaires les plus courantes de l'os, est une tumeur maligne mésenchymateuse qui présente une étendue cliniques, histologiques et hétérogénéités moléculaire 2, 3. Malheureusement, le système d' exploitation se produit principalement chez les enfants et les jeunes adultes 4, 5 et représente 60% les sous - types histologiques communs de sarcome des os dans l' enfance 6, 7. OS affecte habituellement les zones du squelette, qui se caractérisent par une croissance rapide des os (par exemple, la métaphyse des os longs). Parmi les différents sous-types histologiques d'OS, OS classique, également appelé médullaires ou OS central, a un haut degré de malignité et un sha de quotasre de 8 à 80%. Cette 80% est composé de 60% OS classique ostéoblastique, 10% chondroblastique OS, OS et 10% fibroblastique 6, 8-10. D'autres sous-types de systèmes d'exploitation comprennent anaplasique, télangiectasique, géant riche en cellules et un petit OS cellulaire. Malgré les progrès de la chirurgie combinée et de la chimiothérapie dans la gestion du système d'exploitation, le résultat reste faible, avec un taux de survie à long terme de 65-70% chez les patients sans métastases 11, 12. Récurrences Distant se produisent fréquemment comme des métastases pulmonaires ou, moins fréquemment, comme les métastases aux os lointains et récurrences locales 13. Les métastases sont souvent résistantes aux traitements conventionnels. Cette résistance est la raison pour laquelle la survie sans maladie à 10 ans est d' environ 30% chez les patients présentant une maladie métastatique au moment du diagnostic 14, 15.
Comme dans le cas des tissus normaux, les tissus cancéreux se compose d'un ensemble hétérogène de types de cellules. Cellules au sein de la tumeur semblent correspondre à différents stades de développement. Dans tout nOrmal tissu réside une sous-population de cellules ayant la capacité de selfrenew, fournissant ainsi des progéniteurs et des cellules matures de l'homéostasie tissulaire. De même, le cancer est composé d'une population hétérogène de cellules semblables à différents stades de développement, avec différents degrés de prolifération et le potentiel tumorigène. Un sous - ensemble de ces cellules cancéreuses, appelés cellules souches cancéreuses (CCM), constitue un réservoir de selfsustaining cellules ayant la capacité exclusive selfrenew et de maintenir le potentiel de malignité de tumeurs, générant ainsi les différentes lignées cellulaires qui constituent la majeure partie de la tumeur 16. Dans les années 1990, des études sur la leucémie myéloïde aiguë ont fourni la première preuve convaincante de l'existence de sous - populations du SCC 17, 18. CSCs ont depuis été isolé à partir d' un grand nombre de tumeurs solides 19, devenant ainsi l' un des sujets les plus étudiés dans la recherche sur le cancer. CSCs peut en effet provenir de cellules souches normales par des mutations dans les gènes qui rendent la normaleles cellules souches cancéreuses 20-23. mutations transformant multiples et les interactions avec le microenvironnement pourraient également contribuer à progéniteurs saines et les cellules matures acquièrent la capacité selfrenewal et de l'immortalité qui caractérisent CSCs. Il existe plusieurs hypothèses au sujet de cette transformation. Progéniteurs saines, les cellules matures saines, et les cellules cancéreuses, peuvent dédifférencier aux cellules souches, l' obtention d' un phénotype de tige en activant des gènes selfrenewal associée 24-28. Malgré plusieurs études récentes, les origines de CSCs ont encore à découvrir.
Une caractéristique particulière de CSCs est que leur capacité à résister à l'approche multi-thérapie, qui se compose de la chirurgie et de la chimiothérapie combinée avec différents médicaments. Des études récentes ont montré que CSCs peut également acquérir une résistance aux cytotoxiques des agents de chimiothérapie. Les explications possibles de cette résistance comprennent la surexpression de l' ATP-binding cassette (ABC) transporteur multidrogue (ie,MDR1 et BCRP1), la surexpression d'enzymes métabolisant chimiothérapeutiques tels que l' aldéhyde déshydrogénase 1 (ALDH1), et / ou des modifications dans la cinétique du cycle cellulaire , 30-33. La conséquence directe de tous ces concepts qui ont été décrits à ce jour est que le traitement du cancer serait efficace que si la sous-population du SCC ont été complètement éliminé, alors que la récidive locale ou de métastases à distance pourraient se produire si un seul SCC a survécu.
La découverte de CSCs dans les sarcomes humaine 34, en particulier OS 35, ou dans d'autres cancers des os et des tissus mous, a une grande importance clinique , car il offre une explication possible pour expliquer pourquoi de nombreux traitements semblent être efficaces au début, mais les patients plus tard rechute. Par conséquent, l'espoir pour la future bataille contre OS classique consiste à trouver de nouvelles et spécifiques thérapies ciblées sur la base du développement de médicaments innovants destinés aux OS-CCM grâce à la caractérisation moléculaire de ce sousla population et à l'étude de CSC biologie.
En 1992, Reynolds et collègues, qui cherche à déterminer si un sous - ensemble de cellules souches est présente dans le cerveau adulte de mammifère, ont développé une méthode pour isoler des cellules suspectées d'être des cellules 36, 37 souches analogues. Cette méthode est basée sur l'aptitude particulière de ces cellules pour former des colonies sphériques lorsqu'elles sont cultivées dans des conditions non adhérentes. Des techniques similaires ont été employés par Gibbs et ses collègues en 2005 pour étudier une sous - population de cellules souches comme dans l' os sarcomes 38. Pour isoler et caractériser OS-CSCs à partir de cultures de cellules primaires de différents types d'OS classique, nous avons décidé d'adapter cette technique pour les lignées cellulaires OS.
Ici, nous décrivons cette méthode adaptée de l'essai de formation de la sphère, appelée "test sarcosphere", qui peut être utilisé pour isoler les cellules souches cancéreuses OS à partir de lignées de cellules primaires dérivées finies à partir de biopsies humaines du système d'exploitation classique. Nous décrivons également toutes les techniques used pour valider la tige comme CSC phénotype des lignées de cellules isolées par ce test: 1) l'évaluation de l'expression des gènes qui caractérisent les cellules souches embryonnaires pluripotentes (CES) et du gène CD133, qui est un marqueur de CSCs; 2) (UFC) Essai de formation de colonies unité; 3) l'évaluation de la capacité de ces cellules à se différencier en ostéoblastes et les adipocytes dans des conditions de différenciation appropriées; 4) étude des marqueurs de surface de cellules souches mésenchymateuses (CSM) (c. -à- CD44, CD105 et Stro-1) par immunofluorescence et par analyse de cytométrie de flux; 5) l'évaluation de l'activité de ALDH de ces cellules.
Protocole
Toutes les expériences en utilisant des tissus humains décrits ici a été approuvé par le comité d'éthique local (Rif. N. 141/12). Le consentement éclairé pour la collecte des échantillons de tissus et pour l'utilisation et le stockage des échantillons a été obtenu à partir des donateurs à AOUC.
1. Préparation de la culture
- Préparer un milieu de culture de croissance (GM) par addition de 10% de sérum de veau fœtal (FBS), 100 UI / ml de pénicilline et 100 pg / ml de streptomycine à Ham F12 modifié du milieu de Coon. Filtrez et stériliser GM en utilisant un filtre de 0,22 um. Magasin GM jusqu'à 1 mois à 4 ° C.
- Préparer le milieu de la collagénase (CM) en ajoutant 20% de FBS, de 100 UI / ml de pénicilline, 100 pg / ml de streptomycine et de 3 mg de type II / ml de collagénase de Ham F12 modifié du milieu de Coon. Filtrez et stériliser CM en utilisant un filtre de 0,22 um. Magasin CM jusqu'à 1 mois à -20 ° C.
- Préparer le milieu pour la congélation (FM) cellulaire par addition de 40% de FBS, de 100 UI / ml de pénicilline, 100 pg / ml de streptomycine et 60,5% de diméthylsulfoxyde (DMSO) à Ham F12 modifié du milieu de Coon. Filtrer et stériliser FM en utilisant un filtre de 0,22 um. Magasin FM jusqu'à 1 mois à 4 ° C.
- Préparer le milieu pour essai CFU (CFUM) en ajoutant 20% de FBS, de 100 UI / ml de pénicilline et 100 pg / ml de streptomycine à Ham F12 modifié du milieu de Coon. Filtrer et stériliser CFUM en utilisant un filtre de 0,22 um. Magasin CFUM jusqu'à 1 mois à 4 ° C.
- Préparer trypsine en dissolvant 400 mg de trypsine, 200 mg d' EDTA et 1 000 mg de D (+) - glucose anhydre dans 1000 ml de tampon phosphate salin de Dulbecco (DPBS) sans Ca 2+ et Mg 2+.
REMARQUE: Divisez frais trypsine-EDTA dans 50 ml aliquotes en flacons de 25 cm2 en utilisant un filtre et le gel de 0,22 um à -20 ° C pendant jusqu'à 3 mois. Stocker des aliquotes décongelées stérilisées par filtration à 4 ° C sans perte d'activité. - Préparer un milieu de croissance des cellules souches (SCGM) en ajoutant 10% de FBS, de 100 UI / ml de pénicilline, 100 pg / ml streptomycin, et 10 ng / ml de bFGF (25 ng / stock ml) pour modifier Ham F12 du milieu de Coon. Filtre SCGM en utilisant un filtre de 0,22 um et stocker SCGM jusqu'à 2 semaines à 4 ° C.
- Préparer 2% de méthylcellulose (MC) , en dissolvant MC ultrapure dans H 2 O à 4 ° C pendant 3 jours. Lorsque MC est complètement dissous, autoclave et stocker à 4 ° C.
NOTE: Après MC est stérilisé, il devient solide. Pour amener MC à un état liquide, conserver à 4 ° C. - Préparer le milieu de croissance sarcosphere (SGM). Préparer ce milieu frais (pas plus de 2 semaines avant l'emploi) en ajoutant 100 UI / ml de pénicilline, 100 pg / ml de bFGF (25 ng / stock ml) humaine, 20 nM de progestérone (10 uM stock), 100 uM putrescine, 30 nM sélénite de sodium (30 uM de stock), 25 pg / ml de transferrine (25 mg / stock ml), 20 pg / ml d'insuline (20 mg / stock ml), et 10 ng / ml EGF humain (10 ug / mL stock) 2X Coon de modification du milieu F12 de Ham. Filtrer et stériliser SGM en utilisant un fil de 0,22 pmter. Stockez jusqu'à 2 semaines à 4 ° C.
- Préparer le milieu ostéogénique (OM) en ajoutant 10% de FBS (origine Amérique du Sud), 100 UI / ml de pénicilline, 100 pg / ml de streptomycine, 10 nM de dexaméthasone (100 uM stock), 0,2 mM de sodium L-ascorbyl-2-phosphate (1 M stock), 10 mM β-glycérophosphate (5 mg / ml de bouillon) et 1 pg / ml de calcéine (200 ug / stock ml) pour modifier Ham F12 du milieu de Coon. Filtrer et stériliser OM en utilisant un filtre de 0,22 um. Conserver à 4 ° C.
NOTE: Magasin dexaméthasone solutions mères sous azote liquide pour maintenir leur activité. Préparer OM frais toutes les 2 semaines pour maintenir l'activité de dexaméthasone dans le but de maintenir le potentiel de différenciation du milieu. - Préparer un tampon de lyse érythrocytaire (ELB) en dissolvant 1,66 mg de NH 4 Cl, 0,2 mg de K 2 HPO 4 et 0,007 mg d' EDTA dans 200 ml d' eau distillée (dH 2 O). Filtrez et stériliser ELB en utilisant un filtre de 0,22 um. Conserver à 4 °C.
- Préparer le milieu adipocytaire (AM) en ajoutant 10% de FBS (South Origine Amérique), 100 UI / ml de pénicilline, 100 pg / ml de streptomycine, 1 uM de dexaméthasone (1 mM), 1 pM d'insuline bovine (10 mM), 0,5 mM isobutylméthylxanthine (IBMX) (500 mM), et 100 uM indométacine (200 mM) pour modifier Ham F12 du milieu de Coon. Filtrez et stériliser AM en utilisant un filtre de 0,22 um. Conserver à 4 ° C.
NOTE: Magasin dexaméthasone solutions mères sous azote liquide pour maintenir leur activité. Préparer une solution fraîche AM toutes les 2 semaines pour maintenir l'activité de la dexaméthasone afin de maintenir le potentiel de différenciation du milieu. - Préparer 2% sérum-albumine bovine (BSA) dans du DPBS (BSA / DPBS). Dissoudre 10 g de BSA dans 500 ml DPBS et préparer la solution mère par aliquotage 50 ml de solution dans 50 ml tubes coniques. Conserver à -20 ° C.
- Préparer une solution de 4% de paraformaldehyde (PFA) dans du DPBS (PFA / DPBS). Dans un chhotte emical, diluer paraformaldehyde dans DPBS et de préparer la solution mère par aliquotage 50 ml de solution dans 50 ml tubes coniques. Conserver à 4 ° C.
2. Mise en place de cultures de cellules du système d'exploitation primaire et OS Finite lignées cellulaires (OSA)
NOTE: les cultures de cellules OS primaire ont été préparées à partir d' échantillons frais de biopsies OS classiques recueillies à la "Unità Ortopedia Oncologica e ricostruttiva", AOUC Careggi, Florence. Toutes les biopsies, qui ont été obtenus par ponction à l'aiguille ou d'une résection chirurgicale d'une petite partie de la tumeur (figure 1A, B) ont été immédiatement placés dans un milieu de culture supplémenté avec 100 UI / ml de pénicilline et 100 pg / ml de streptomycine (pH 7,4) et transportés au laboratoire où ils ont été traités. Toutes les manipulations décrites ont été effectuées dans des conditions aseptiques à l'aide d'une hotte à flux laminaire.
- Isolement des cellules SE
- Placer la biopsie dans un100 mm boîte de Pétri avec un petit volume de GM. Avec une lancette stérile et pinces Perry, émincer les échantillons de tissus du système d'exploitation en les coupant en morceaux aussi petits que possible (0,5 à 1 mm) (figure 2A, B).
- Recouvrir les fragments de tissu avec 10 ml CM pour la digestion enzymatique (figure 2B) et incuber pendant 3 h à 37 ° C, 5% de CO 2 incubateur. retirer doucement la suspension de fragments à l'aide d'une pipette et le transférer dans un tube conique de 15 ml pour centrifugation immédiate (400 g pendant 5 min) pour sédimenter les fragments.
NOTE: Après centrifugation, si les biopsies sont riches en érythrocytes, un dépôt rouge composé d'érythrocytes peut être vu sur les fragments. Par conséquent, avant de procéder à la dispersion mécanique, traiter l'échantillon avec un tampon de lyse érythrocytaire. Jeter le surnageant par aspiration et ajouter 5 ml ELB. - Suspendre fragments de granulés pendant 1 min et centrifuger la suspension à 400 g pour 2min. Retirer le surnageant par aspiration. Ajouter 5 ml de GM et mécaniquement disperser les fragments à l'aide d'une pipette 10 ml sérologique (taille d'ouverture, 1,5 mm Ø interne) 10 - 20 fois.
- Centrifuger la suspension à 400 g pendant 5 min. Enlever le surnageant par aspiration, suspension le culot cellulaire avec 10 ml de GM, et ensuite transférer la suspension cellulaire obtenue dans une boîte de Petri 100 mm. Incuber la boîte de Petri dans un 37 ° C, 5% de CO 2 incubateur et remplacer le GM avec des produits frais complète GM tous les 3 jours.
REMARQUE: Très souvent, les échantillons de tissus OS obtenus par aspiration à l' aiguille sont très petits et contiennent des fragments d'os, qui ne sont pas digérés par digestion enzymatique avec de la collagénase. Par conséquent, après le surnageant a été éliminé, on tente de séparer les cellules du tissu osseux par empâtage des fragments de granulés avec une pipette.
- Subculture
REMARQUE: Pour établir un OSA, lorsque les cellules atteignent la confluence approximative, les retirer de Their récipient de culture, diluer, et placer dans une nouvelle plaque pour permettre une nouvelle croissance. Cette procédure de sous-culture est réalisée en utilisant la procédure dite enzymatique trypsinisation.- Retirez le milieu par aspiration. Pour dissocier la monocouche cellulaire, ajouter 2 - 3 ml de trypsine à la température ambiante (max 18 - 20 ° C), agiter doucement une fois, et retirer immédiatement la trypsine par aspiration. Répéter deux fois. Incuber les cellules à 37 ° C pendant 3-4 minutes jusqu'à ce qu'ils commencent à se détacher.
NOTE: Good trypsinisation peut être vu par l'utilisateur expérimenté de petits trous qui se forment dans la monocouche légèrement opaque lorsque le plat est tenue à la lumière. Cette dissociation peut également être contrôlé à l'aide d'un microscope inversé; cette approche est recommandé pour les débutants. - Arrêter la réaction de la trypsine en ajoutant 10 ml de GM et laver le plat bien à l'aide d'une pipette de détacher toutes les cellules. Transfert 1 ml de la suspension à une nouvelle boîte de 100 mm de Pétri et ajouter 9 ml GM (1/10 scission de cellules).
REMARQUE: La suspension de cellules restant peut être utilisé pour l'expansion des cellules (transfert à un autre plat de 100 mm de Pétri), peuvent être cryoconservés (voir section 2.3), ou peut être compté et plaqué dans des boîtes ou des puits pour des essais de prolifération ou d'autres fins expérimentales (voir au dessous de).
- Retirez le milieu par aspiration. Pour dissocier la monocouche cellulaire, ajouter 2 - 3 ml de trypsine à la température ambiante (max 18 - 20 ° C), agiter doucement une fois, et retirer immédiatement la trypsine par aspiration. Répéter deux fois. Incuber les cellules à 37 ° C pendant 3-4 minutes jusqu'à ce qu'ils commencent à se détacher.
- Cryoconservation des OS cultures primaires et OSA
NOTE: Geler un confluentes 100 mm boîte de Pétri en 4-5 cryovials. Le processus de cryoconservation doit être effectuée rapidement parce que le DMSO, qui protège les membranes cellulaires lors de la congélation, est toxique pour les cellules à des températures non-congélation.- Dissociation des cultures de cellules de la monocouche par trypsinisation (voir section 2.2), un culot de cellules par centrifugation à 400 g pendant 5 min, retirer le surnageant par aspiration, puis suspendre rapidement le culot cellulaire dans FM.
- Aliquote de 1 ml de cette suspension par flacon cryogénique. Placer immédiatement les flacons remplis dans un congélateur avec une veste de 2-propanol et le magasin immédiadiatement à -80 ° CO / N. Transfert cryotubes à l'azote liquide le jour suivant pour le stockage à long terme.
- Lignées cellulaires Defrost OS et des cultures primaires
- Defrost OS lignées cellulaires de stockage d'azote liquide, cryovials décongélation rapidement en les plaçant dans un bain d'eau de laboratoire à 37 ° C. Transférer le contenu des cryotubes dans un tube conique de 15 ml et ajouter environ 10 ml de GM (Voir la section 2.3 pour éliminer le DMSO). Enlever le surnageant par aspiration et mettre en suspension le culot cellulaire dans 10 ml de GM. La plaque de la suspension cellulaire dans une boîte de Petri de 100 mm et incuber dans un 37 ° C, 5% de CO 2 incubateur.
3. Sarcosphere Assay à Isoler OS-CSCs
NOTE: Cette expérience est réalisée sur OSA. La durée de cette expérience est liée à la capacité des cellules à former des colonies de ces sphères (les sarcospheres) et l'intervalle de temps est de 7, 14, 21 et 28 d.
- Estabblissement de dosage sarcosphere
- Préparer la chambre de hémocytomètre et tous les réactifs à l'avance.
- Retirez le milieu par aspiration et dissocier les cellules de la monocouche par trypsinisation (voir section 2.2). Mélanger la suspension cellulaire à fond, pipetage pour disperser les grumeaux, et de recueillir 10 pi en utilisant une pointe de pipette 20 pi.
- Transférer la suspension cellulaire 10 ul immédiatement au bord de la chambre d'hémocytomètre, d'expulser la suspension, et lui permettre d'être tiré sous la lamelle couvre-objet par action capillaire.
- Observez la chambre de hémocytomètre en contraste de phase. Sélectionnez un objectif 10X et se concentrer sur les lignes de la grille dans la chambre. Compter les cellules se trouvant dans ce 1 mm 2 zone en utilisant les subdivisions (également lié par trois lignes parallèles) et les lignes de maillage individuelles comme une aide pour le comptage.
- Mesurer la concentration et à appliquer l'équation suivante: 1 ml = n * 10 4 / z (n: le nombre total de cellules comptées dans tous lesdes carrés de 1 mm 2; z: le nombre de carrés comptés 1 mm 2). Calculer le volume de la suspension nécessaire à l'assiette un montant total de 240.000 cellules divisé en 40.000 cellules pour chaque puits dans l'ultra-basse plaque de fixation 6 puits cellule.
REMARQUE: Assurez - vous de la plaque le nombre correct de cellules par étalement des cellules dans un puits supplémentaire. Par conséquent, la quantité totale de cellules à plaquer est de 280.000 cellules. - Préparer 35 ml SGM en ajoutant 50% de 2% MC (SGM-MC) dans un 2 flacon de 25 cm. Préparer le volume total de SGM considérant 5 ml supplémentaire afin de plaquer un puits supplémentaire.
- Ajouter le volume calculé de la suspension cellulaire à la SGM-MC préparé dans le flacon et mélanger doucement à l'aide d'une pipette pour disperser les grumeaux. Plaque les cellules dans un ultra-basse plaque de fixation 6 puits et utiliser un microscope inversé pour observer comment les cellules apparaissent après avoir été plaqué.
- Incuber les cellules dans un 37 ° C, 5% de CO 2 incubateur. Chaque 3 d, ajouter frESH des aliquotes de bFGF et EGF à chaque puits pour rafraîchir la concentration des facteurs de croissance. Ajouter 2 ul bFGF et EGF 5 ul de maintenir à la fois à la concentration finale de 10 ng / ml dans chaque puits.
- L' isolement de sarcospheres
REMARQUE: Surveiller le bon déroulement de l'essai de sarcosphere à 7, 14, 21, et 28 d de décider quand il est nécessaire d'isoler les sarcospheres qui formaient.- Préparer tous les réactifs et de l' équipement dans la hotte à flux laminaire (figure 3A, B). Assembler l'unité de filtration en plaçant un filet de filtre d'un diamètre de 25 mm et une maille de 40 um dans un porte-filtre à membrane; stériliser à l'autoclave (figure 4A-E).
- Pour chaque puits, transférer le milieu contenant les sarcospheres à une seringue avec un porte-filtre à membrane stérile à l'aide d'une pipette stérile avec une pointe de 1 000 pi. Après avoir retiré complètement le milieu contenant les sarcospheres, laver le puits par addtion 5 ml GM pour être sûr de transférer toutes les sphères à une seringue. Utilisez le microscope pour confirmer si tous les sarcospheres ont été récupérés. Sinon, passez en répétant cette étape.
- On filtre la suspension avec un porte-filtre à membrane uniquement par gravité, sans pression afin d'éviter d'endommager les sphères et d'éviter d'avoir sarcospheres traversant au travers du filtre, évitant ainsi la perte de sphères. Retirer les bulles d'air en utilisant doucement une pipette Pasteur en verre stérile.
REMARQUE: Parfois , la filtration est bloquée par la présence d'une bulle d'air dans le porte-filtre à membrane. - Laver l'unité de filtration par addition de 10 ml de GM à la seringue et laisser filtrer sans pression pour être sûr d'éliminer les cellules individuelles. Démonter l'unité de filtre de la seringue et le mettre dans une boîte de Pétri.
- Retirer le filtre net du porte-filtre à membrane en utilisant des pinces Perry et le laver en le secouant doucement avec la pince à épiler dans un 60 mmboîte de Pétri pour libérer les sarcospheres de l'enchevêtrement de la membrane. Ensuite, placez la membrane dans un puits et confirmer par l'observation microscopique qu'il n'y a pas plus de sphères enchevêtrées dans la membrane. Si les sphères sont toujours emmêlés dans la membrane, procéder à un autre lavage comme décrit à l'étape 3.2.4.
- Observer les sarcospheres libérés à l'aide d'un microscope. Incuber les sarcospheres libérés dans un 37 ° C, 5% de CO 2 incubateur. Répétez toutes les étapes pour chaque puits d'une ultra-basse plaque de fixation 6 puits.
4. OS-SCC Lines
REMARQUE: OS-CSCs sont obtenus à partir des sarcospheres qui présentent une dilatation adhérente en réintroduisant et re - culturation ces cellules en une monocouche après avoir été étalées dans de petites boîtes de Petri de 60 mm de plus dans des conditions de fixation ultra-basses.
- Cultures OS-SCC
- Pour permettre une nouvelle croissance, les cellules de sous-culture quand ils atteignent environ 90% de confluence dans un 60Antenne mm Petri. Répétez l'étape 2.2.1 pour établir des cultures OS-SCC.
- Arrêtez trypsinisation en ajoutant 4 ml SCGM et bien laver le plat, à l'aide d'une pipette de détacher toutes les cellules. Transférer la suspension cellulaire à un nouveau plat de 100 mm de Pétri et ajouter 6 ml SCGM. Lorsque OS-CSCs atteignent 90% de confluence, sous-culture par l'article 2.2 de répéter.
NOTE: Pour l' analyse in vitro pour caractériser le phénotype des cellules souches comme des isolés OS-CSCs, les cellules peuvent être étalées dans différents types de plaques. - Préserver les lignes OS-SCC établies par cryoconservation (répéter toutes les étapes de la section 2.3). Dégivrer le cryoconservés OS-CSCs en répétant toutes les étapes de la section 2.4.
5. In vitro A nalyse à Caractériser OS-CSCs:
- Préparation des cellules pour immunofluorescence
NOTE: Les cellules sont fixées dans le paraformaldehyde quand ils atteignent la bonne qualité de confluence dans chaque puits d'une pla 24 puitste. Le degré de confluence est liée au type d'expériences.- Plate-OS CSCs dans une plaque de 24 puits pour étudier les mésenchymateuses de surface des cellules souches (MSC) marqueurs par immunofluorescence. Fixer les cellules dans chaque puits quand ils atteignent 50 - 60% de confluence. Retirez la SCGM par aspiration et laver deux fois dans une plaque de 24 puits DPBS.
- Sous une hotte chimique, ajouter 500 pi 4% PFA / DPBS à chaque puits. Incubation à température ambiante pendant 10 min. Retirez le PFA / DPBS et laver 3x avec ultrapure dH 2 O. Laisser la plaque de 24 puits à sécher dans la hotte.
- Immunofluorescence pour les marqueurs de MSC
NOTE: Immunofluorescence de l'OS-CSCs fixé à 4% PFA / DPBS peut être utilisée pour étudier le phénotype MSC comme des OS-CSCs en utilisant des anticorps dirigés contre CD44, Stro-1 et CD105. La méthode suivante est utilisée régulièrement par les auteurs.- Dans une hotte chimique, perméabiliser les cellules qui ont été fixées dans 4% de PFA / DPBS par addition de 500 ul de 0,2% De Triton X-100 / DPBS à chaque puits. Incuber les cellules à 37 ° C pendant 30 min. laver délicatement les cellules 3x avec du DPBS. Ajouter 300 ul de RNase dilué à 1/1000 avec 2% de BSA / DPBS aux cellules et incuber à 37 ° C pendant 30 min.
- laver délicatement les cellules 3x avec 2% de BSA / DPBS. Colorer les cellules pour les marqueurs de MSC. Ajouter l'anticorps primaire que dans les puits choisis comme témoins positifs pour chaque anticorps.
- Ajouter 300 ul anti-CD105 dilués au 1/10 avec 2% de BSA / DPBS, 300 ul anti-CD44 dilué au 1/10 avec 2% de BSA / DPBS, 300 ul anti-Stro-1 dilué au 1/10 avec 2% de BSA / DPBS et seulement 200 pi 2% de BSA / DPBS dans les puits choisis comme témoins négatifs pour chaque anticorps.
- Incuber les cellules dans un environnement humide à 4 ° CO / N. Laver les puits 3x avec DPBS puis deux fois avec 2% de BSA / DPBS.
- Révéler des anticorps primaires en ajoutant des anticorps secondaires spécifiques.
- Ajouter 300 ul d'IgG anti-lapin (anticorps d'âne anti-IgG de lapin [H + L]) dilué au 1/100avec 2% de BSA / DPBS dans chaque puits choisi comme témoin positif et négatif pour CD44 et CD105. Ajouter 300 pi FITC anti-souris IG (FITC-lapin anti-souris IgG [H + L]) dilué à 1/100 avec 2% de BSA / DPBS dans chaque puits choisi comme témoin positif et négatif pour Stro-1. Incuber les cellules dans l'obscurité à température ambiante pendant 60 min. Laver les puits 6x avec DPBS.
- cellules marqueur-positives Stain MSC pour l'actine du cytosquelette en ajoutant 300 pi phalloidin dilué à 1/100 avec 2% de BSA / DPBS dans chaque puits colorées pour MSC marqueur immunofluorescence.
- Incuber les cellules pendant 40 min à température ambiante. Laver les puits 3x avec DPBS puis lavez - les deux fois avec ultrapure dH 2 O. Passez à la contre-coloration des noyaux après la coloration par immunofluorescence décrit ci-dessus. Préparer la solution d'iodure de propidium 10 -5 M dans DPBS (stocks de 1,5 x 10 -3 M) dans une hotte.
- Ajouter 200 ul d'iodure de propidium solution à chaque puits coloré tel que décrit ci-dessus. Incuber la cellules pour les 2 - 3 min à température ambiante. Laver les puits deux fois avec ultrapure dH 2 O.
REMARQUE: Répéter toutes les étapes des sections 5.1 - 5.2 sur la HCT8 de lignée cellulaire, une ligne continue primaire différenciée du cancer du côlon cellulaire qui est utilisé comme témoin négatif.
- Ajouter 200 ul d'iodure de propidium solution à chaque puits coloré tel que décrit ci-dessus. Incuber la cellules pour les 2 - 3 min à température ambiante. Laver les puits deux fois avec ultrapure dH 2 O.
- Test de différenciation ostéogénique
NOTE: ostéogénique différenciation dure 20 d.- OS-plaque CCM dans des plaques à 24 puits à une densité cellulaire de 1 x 10 4 cellules / cm 2 dans SCCGM. Permettre aux cellules de croître dans SCGM jusqu'à ce qu'ils atteignent 80-90% de confluence dans chaque puits.
- Lancer la différenciation ostéogénique en changeant la SCGM à l'OM. Permettre aux cellules de se développer dans l'OM et rafraîchissent moyenne tous les 3 - 4 d. Arrêter le test de différenciation osteogene à 10 j pour évaluer la présence de phosphatase alcaline (ALP).
- Fix cellules dans 4% PFA / DPBS (Voir la section 5.1). Évaluer le phénotype ostéoblastique par coloration cytochimique pour ALP et HAutilisant Alizarine Red S coloration.
- ALP coloration cytochimique
NOTE: Préparer le mélange de colorants dans une hotte chimique immédiatement avant de commencer la coloration.- Dissoudre 40 mg de Fast Blue BB ou sel Fast Red Violet LB dans 50 ml de Tris-HCl, pH 9 (solution A). Dissoudre le naphtol AS-MX phosphate de sodium à 5 mg dans 1 ml de DMSO (solution B). Ajouter la solution B entièrement à la solution A et bien mélanger, l'obtention de cellules Solution C. Laver deux fois avec DPBS.
- Ajouter 500 pi - 1 ml de la solution C à chaque puits et incuber à 37 ° C et 5% de CO 2. Surveiller l'évolution de la coloration toutes les 10 minutes, en observant les cellules au microscope.
- Arrêter la coloration lorsque les cellules ALP-positives deviennent intensément colorées (bleu avec le sel Fast Blue BB ou rouge avec Fast Red Violet LB sel), qui se produit habituellement dans les 30 minutes. Laver les cellules 3x avec ultrapure dH 2 O pour éliminer tous les résidus de la solution C. Si un précipité de la tache is présente, laver les cellules rapidement une fois avec de l'éthanol absolu.
- Passez à la contre-coloration des noyaux après la coloration ALP comme décrit dans les étapes 5.2.5 et 5.2.5.1.
- Alizarine Red S coloration cytochimique
NOTE: Préparer le mélange de colorants avant de commencer l'expérience.- Préparer la 2% alizarine rouge S (2 g de rouge d' alizarine S dans 100 ml de H 2 O ultrapure). Ajouter 2,5% NH 3 à 2% Alizarine Rouge S pour atteindre un pH de 6,0. Magasin 2% solution Alizarine Rouge S à 4 ° C. Laver les cellules une fois avec DPBS.
- Ajouter au rouge d'alizarine S aux cellules pendant seulement quelques secondes.
- Laver les puits avec dH2Û ultrapure pour contrôler le degré de coloration; si les dépôts HA ne sont pas intensément colorée, répéter l'étape 5.3.5.2. Arrêtez la coloration lorsque les dépôts HA deviennent intensément coloré en rouge, ce qui se produit généralement en quelques minutes. Laver les puits avec ultrapure dH 2 O.
- différenciation Adipogenic
NOTE: Assay durée dépend des lignes OS-SCC. L'essai peut durer 14-30 d.- OS-plaque CCM dans des plaques à 24 puits à une densité cellulaire de 1 x 10 4 cellules / cm 2 dans SCGM. Permettre aux cellules de croître dans SCGM jusqu'à ce qu'ils atteignent 80-90% de confluence dans chaque puits. Initier la différenciation adipocytaire en changeant la SCGM AM. Laisser les cellules à croître en AM et rafraîchissent l'AM deux fois par semaine.
- Arrêtez le test de différenciation adipocytaire lorsque des vésicules lipidiques sont visibles. Évaluer le phénotype adipocytaire par Oil Red O coloration et par hématoxyline pour les noyaux contre-coloration.
- Hématoxyline pour les noyaux contre - coloration
NOTE: Préparer le mélange de colorants avant de commencer l'expérience.- Préparer la solution hématoxyline 5%, appelée Emallume Carazzi 39. Conserver la solution à 4 ° C. Ajouter Emallume Carazzi pour seulement 2 min. Laver les puits avec ultRapure dH 2 O.
- dosage CFU
NOTE: Cette expérience doit être effectuée en triple.- OS-plaque CCM à 100 mm des boîtes de Pétri , à une densité cellulaire de 450 cellules / cm2 dans CFUM. Incuber les cellules à 37 ° C, 5% de CO 2 pendant 4 semaines. Actualisez CFUM deux fois par semaine.
- Colorer le CFU avec du bleu de toluidine. Compter les colonies colorées à l'aide d'un microscope inversé. Calcul de l'efficacité UFC selon la formule suivante: (nombre de colonies formées / nombre de cellules ensemencées) * 100.
- Analyse de l' activité de ALDH
NOTE: ALDH activité a été évaluée en utilisant un Colorimétrie Assay Kit ALDH activité sur les deux lignes OS-SCC et sur une ligne de fibroblaste finie, qui a été utilisé comme témoin négatif. Ce kit quantifie l'activité enzymatique ALDH par lecture d'absorbance à 450 nm. Tous les tests ont été effectués en triple.- Dissocier les cultures de cellules de la monocouche par trypsinisation (voir section 2.2). Sédimenter les cellules par centrifugation à 400 g pendant 5 min. Suivez le protocole du fabricant.
- Analyse des flux cytométrique:
REMARQUE: Des suspensions de cellules simples sont nécessaires pour une coloration optimale des échantillons pour la cytométrie de flux. Une suspension cellulaire unique doit être préparé pour chaque anticorps à tester. Dissocier les cultures de cellules de la monocouche par trypsinisation (voir section 2.2).- Placer la suspension cellulaire dans un tube conique, effectuer un comptage des cellules en utilisant la Bürker chambre de comptage, les cellules de centrifugation à 400 x g et remise en suspension dans un volume approprié de tampon de séparation pour obtenir une suspension cellulaire à une concentration cellulaire finale de 1 x 10 5 cellules / ml.
- Centrifuger la suspension cellulaire pendant 5 min à 4 ° C. Jeter le surnageant et laver le culot avec un tampon de séparation. Répéter deux fois cette étape.
- cellules Stain pour MSMarqueurs C (ie, CD44, CD105 et Stro-1) 40.
- Analyser les suspensions de cellules colorées positivement dans un cytomètre de flux. Analyser les échantillons marqués en 1 d. Incuber ces échantillons à 4 ° C jusqu'à l'analyse.
- RT-PCR
- L' extraction et l' isolement de l' ARN
- Ajouter 1 ml de réactif de lyse aux échantillons emballés congelés cellulaires OS-CSCs et lyser les cellules directement dans le tube par pipetage le culot de haut en bas plusieurs fois.
- Centrifuger les échantillons à 12000 xg pendant 1 min à 4 ° C. Retirez délicatement le surnageant. Transférer le surnageant dans un nouveau tube, ajouter 200 pi de chloroforme, et boucher le tube en toute sécurité. Agiter vigoureusement le tube pendant 15 secondes et incuber l'échantillon pendant 5 min à température ambiante.
- Centrifuger les échantillons à 12000 xg pendant 15 min à 4 ° C. Le mélange se sépare en trois phases différentes. L'ARN est exclusivement dans la phase aqueuse supérieure incolore.
- être particularly prudent, enlever seulement la phase aqueuse et de transférer cette phase dans un nouveau tube pour procéder à l'isolement de l'ARN. Ajouter 500 ul d'isopropanol dans le tube contenant la phase aqueuse. Agiter le tube doucement à la main. Incuber l'échantillon à température ambiante pendant 10 min. Centrifuger l'échantillon à 12.000 xg pendant 10 min à 4 ° C.
REMARQUE: Après que l'échantillon est centrifugé, on peut voir l'ARN qui forme une pastille analogue à un gel sur le côté et sur le fond du tube. - Retirer le surnageant du tube, en prenant soin de laisser le culot de l'ARN sur le fond. Ajouter 1 ml d'éthanol à 75% dans le tube. Vortex le tube à la main pendant quelques secondes, puis centrifuger le tube à 7500 xg pendant 5 min à 4 ° C.
- Jeter l'éthanol et sécher à l'air le culot d'ARN. Lorsque le culot est sec, remettre le culot d'ARN dans l'eau sans RNase (10-50 pi) par pipetage la solution de haut en bas plusieurs fois.
- Déterminer le rendement et la pureté de l'ARN par measendant l'absorbance à 260 nm et 280 nm en utilisant un spectrophotomètre. Évaluer l'intégrité de l'ARN total sur un gel d'agarose standard de 1%. Stocker l'ARN à -80 ° C.
- La réaction en chaîne par polymérase inverse
- Synthétiser cDNA premier brin de 500 échantillons d'ARN ng en utilisant un kit de transcription inverse. Les échantillons d'ARN Décongeler sur la glace et décongeler les solutions nécessaires inclus dans le kit à température ambiante. Passez à la synthèse des ADNc suivants le protocole du fabricant.
- Semi-quantitative de la réaction en chaîne de la polymérase transcriptase inverse (RT-PCR)
- Effectuer toutes les PCR en utilisant 1 pi d'ADNc de chaque échantillon en tant que matrice dans un volume réactionnel final de 24 ul. Utilisez les séquences d'amorces énumérées dans le tableau 1 pour l'amplification de Nanog, oct 3/4, les gènes SOX2 et CD133.
- Séparer les produits de RT-PCR de 1,8% d'agarose électrophorèse sur gel et coloration au bromure d'éthidium. Photo sous illum UVmination.
- L' extraction et l' isolement de l' ARN
Résultats
Des échantillons de systèmes d' exploitation obtenus par ponction à l'aiguille ou la résection chirurgicale d'une petite partie de la tumeur (figure 1A, B) permettent l'isolement d'un seul OSA si elle est traitée exactement comme décrit dans la section de protocole (figure 2A, B). Malheureusement, le nombre de cellules isolées à partir de biopsies est faible, avec une plage de sortie de 30 à 50%. La sortie dépend du type et de la dimension des biopsies (figure 5A, B). Ces cellules doivent être traitées de manière précise. Par conséquent, environ un mois est nécessaire pour les cultures primaires pour atteindre la confluence dans une boîte de Pétri de 100 mm. Après ce temps, OSA sont obtenus à partir de deux échantillons marqués de systèmes d'exploitation et OSA5 OSA6 (figure 6A, B). Ensuite, il est nécessaire de sous-culture de la lignée cellulaire primaire pour obtenir un nombre suffisant de cellules pour effectuer l'analyse de la caractérisation et à la cryoconservation de la cellule lines. Au 3 ème passage de sous - culture, lorsque les deux lignées de cellules primaires OSA atteignent la confluence, elles sont étalées dans 6 puits plaques ultra-faible fixation pour le dosage de sarcosphere. Ce type de plaque est utilisée, car elle nous permet de maintenir les cellules dans un état de suspension, afin d'empêcher les cellules souches provenant de la différenciation de fixation à médiation, afin d'empêcher les cellules dépendantes de l'ancrage de la division, et enfin, pour réduire la fixation sur le substrat. Par conséquent, leur utilisation nous permet de créer des conditions stressantes pour les cellules cancéreuses, ce qui est nécessaire pour la sélection des cellules souches cancéreuses. 24 h après le début de l'essai, les cellules apparaissent isolées les unes des autres (figure 7). Après 7 jours de surveillance de la progression de l'essai, de petites colonies sphériques ont commencé à se former et sont visibles (figure 8). À 28 jours, plusieurs grandes colonies sphériques qui sont formées dans chaque puits peuvent être observées (figure 9A, B). Après les sarcospheres VHAe été cultivé pendant 28 jours, ces grandes colonies sphériques peuvent être isolées. La figure 10 représente les étapes permettant d' isoler sarcospheres de 6 puits des plaques de fixation ultra-basses et en les re - culturation dans des conditions adhérentes. La figure 11 montre les colonies sphériques flottantes après isolement. Les grandes colonies sphériques plaquées dans des plaques de fixation normales montrent l' expansion adhérente après isolement (figure 12A, B). Les cellules qui se développent à partir des sarcospheres simples sont probablement les cellules cancéreuses avec un phénotype de cellules ressemblant à la tige. Par conséquent, après l'isolement, OS-CSCs ont probablement été obtenus. Ces cellules sont appelées OSA5-CSCs et OSA6-CSCs (Figure 13A, B).
A ce stade, il est nécessaire de procéder à la caractérisation du phénotype des cellules souches semblable pour les deux lignes OS-SCC obtenus, comme décrit ci-dessus. Les analyses pour la caractérisation du phénotype de cellules souches wer-likee effectuée sur le 4 ème passage de la sous - culture après les sarcospheres pour chaque ligne OS-CSC ont été isolés. Les deux lignées cellulaires, OSA5-CSCs et OSA6-CSCS, ont montré une forte positivité pour les marqueurs de MSC de surface (CD105 et CD44) (Figure 14A, B et Figure 15A, B), alors qu'ils ont montré la positivité modérée pour le marqueur de MSC de surface Stro- 1 (figure 16A, B). Nos observations ont été confirmées par des résultats négatifs obtenus avec la ligne commerciale et différenciée cellules du cancer du côlon HCT8 (Figure 14C, Figure 15C, Figure 16C). Une absence totale de coloration spécifique et non spécifique pour ces marqueurs de surface dans la lignée de cellules HCT8 a été observée.
Pour évaluer le phénotype MSC des deux OS-CSCs, nous avons également des analyses cytométrie de flux effectué. Les deux lignes OS-SCC ont exprimé des niveaux élevés de CD44 et CD105. Cependant, des cellules dans les deux lignées cellulaires, seules 1,14%, exprimé Stro-1. Par conséquent, cette réSult a confirmé la présence modérée de Stro-1 tel que démontré par immunofluorescence. En revanche, 99,62% de la OSA5-CSCs exprimé CD44 et 87,38% de ces cellules CD105 exprimé; 99,88% de la OSA6-CSCs exprimé CD44 et 95,79% de ces cellules CD105 exprimé. En outre, les deux lignées cellulaires sont CD45-.
Nous avons évalué l'expression de 3 marqueurs ESC (Nanog, oct 3/4, Sox2) et du gène CD133, un autre marqueur CSCs, par RT-PCR. Nous avons remarqué que tous ces gènes ont été exprimés dans les deux lignes OS-SCC (figure 17). Les dosages de différenciation ostéogénique et adipogènes ont démontré la capacité des deux lignes OSA SCC isolées de se différencier en ostéoblastes (Figure 18A - D et la Figure 19A - D) et en adipocytes (Figure 20A - D).
En outre, l'UFC un éssayé (Figure 21) a montré un bon taux d'efficacité clonogénique, avec 13% pour OSA5-CSCs et 14% pour OSA6-CSC. Plusieurs études récentes ont montré que les niveaux élevés d'activité de ALDH sont caractéristiques de différents types de cancer. Ce paramètre peut être utilisé comme un marqueur de cellules souches cancéreuses et est corrélée à un mauvais pronostic. Le dosage de l' activité de l' ALDH a montré que les deux lignées OS SCC ont des niveaux élevés d'activité de ALDH (figure 22), tandis que l' activité ALDH a été observée à la limite inférieure quantifiable dans la lignée de fibroblastes qui a été utilisé comme témoin négatif dans cet essai.

Figure 1. Exemples d'échantillons OS biopsie. (A). échantillon de biopsie obtenue par aspiration à l'aiguille. (B). prélèvement biopsique obtenu par résection chirurgicale d'une partie de la tumeur.884 / 53884fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Mechanical Ventilation d'un échantillon du système d'exploitation. (A) Fragmentation d'un échantillon en utilisant des pinces Perry et une lancette. (B) Les fragments en suspension dans CM (indiqué par la flèche). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Figure 3. L' équipement et consommables nécessaires à Isoler Sarcospheres. (A). Tout l'équipement nécessaire pour l'isolement cellulaire. 1. Une seringue stérile avec un porte-filtre à membrane stérile; 2. Deux différents médias: GM and SCGM; 3. Une pipette Pasteur en verre stérile. (B) Détail de la seringue monté sur un support, avec le support du filtre à membrane. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4. Unité de filtration. Plusieurs composants nécessaires pour assembler l'unité de filtration (A) (le filtre net est indiqué par la flèche). Contraste de phase d' observation des 40 um mailles (une maille est indiqué par la flèche) du filtre net (B). grossissement d'origine: 10X. L'unité de filtration assemblé (C - D). Unité de filtration stérilisé (E). S'il vous plaît cliquer ici pour voir une plus grande version de ce chiffre.
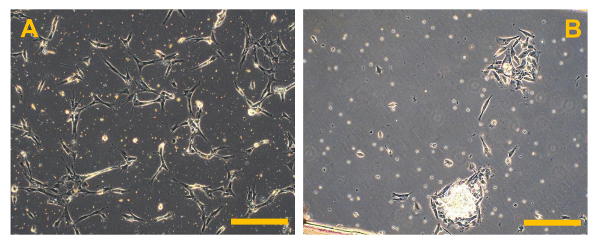
Figure 5. cultures de cellules primaires de OS conventionnel. D'observation en contraste de phase des cultures de cellules primaires d'OS de haute qualité. Dans (A), plusieurs fragments osseux brillants sont visibles, tandis que dans (B), plusieurs petits globules rouges arrondis et flottantes sont présents. grossissement d'origine: 10X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Figure 6. conventionnelle ostéosarcome Finite lignées cellulaires (OSA). (A) OSA5 et (B) OSA6. Observation en contraste de phase.grossissement d'origine: 10X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
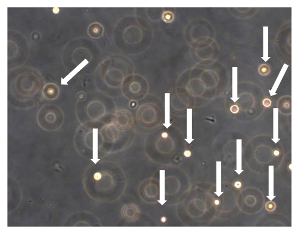
Figure 7 Dosage de Sarcosphere OSA5 et OSA6. Après 24 h à partir du début de l'essai, les cellules ont été isolées et flottent les uns des autres ( les cellules sont indiquées par des flèches). L'observation en contraste de phase. Grossissement d' origine:. 20X S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
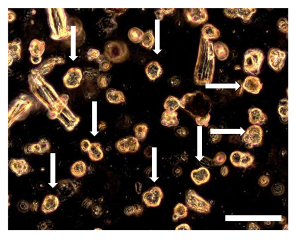
Figure 8. Sarcosphere Dosage de OSA5 et OSA6 à 7 D. 7 d dans l'essai, plusieurs petits spherical colonies entourées par des cellules isolées ont pu être observées. Les sarcospheres (certains de ces sarcospheres sont indiquées par des flèches) semblent flotter dans le milieu ou légèrement installés dans le fond du puits. L'observation en contraste de phase. grossissement d'origine: 20X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
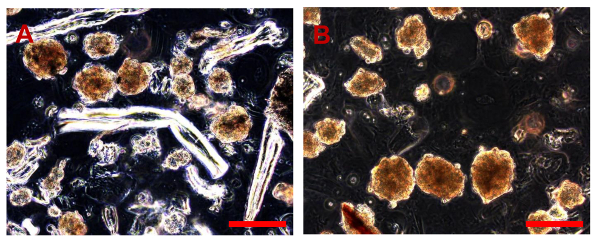
Figure 9. Sarcosphere Dosage de OSA5 et OSA6 à 28 D. Après 28 jours, plusieurs grandes sarcospheres d'ambre sont observés dans chaque puits des plaques pour chaque lignée cellulaire d'OSA, OSA5 (A) et OSA6 (B). Taille de la barre: 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 10. Passages pour l'isolement de Sarcospheres Les __gVirt_NP_NNS_NNPS<__ étapes pour sarcospheres isolement à partir de 6 puits plaques de fixation ultra-bas et leur re - culturation dans des conditions adhérentes sont indiquées (A) Tout l'équipement nécessaire pour l'isolement..: 1. Un 6 puits ultra-basse plaque avec sarcospheres formés dans chaque puits, 2. seringue avec le porte-filtre net, 3. pipette, 4. 1000 pi embouts stériles, 5. 2 pinces stériles Perry, 6. 2 différents milieux de culture , 7. stérile pipette Pasteur 8. boîtes de Pétri. (B) Collection de sarcospheres. Le milieu contenu dans chaque puits est recueillie à l'aide d'une pipette avec une pointe de 1000 ul stérile. (C) Recueillir la suspension dans la seringue. La suspension recueillie est transférée à la seringue pour démarrer le processus naturel de filtration à l'aide dula membrane porte-filtre. (D) filtration naturelle. (E) Le démontage du porte-filtre à membrane de la seringue. Après tout, la suspension est filtrée, le porte-filtre net est démonté et placé dans une boîte de Pétri; (F) Démonter le porte-filtre à membrane. Sarcospheres sont contenus dans les pores du filtre net dans le porte-filtre net, de sorte qu'ils doivent être libérés à l'aide des pinces Perry. (G, H) Enlèvement de sarcospheres du filtre à membrane. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
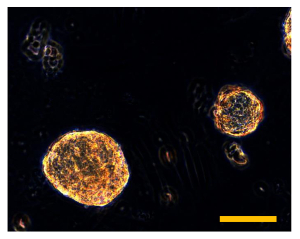
Figure 11. Sarcosphere Isolation. Sarcospheres isolés flottent dans le milieu dans le plat 60 mm Petri. Observation en contraste de phase.grossissement d'origine: 40X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
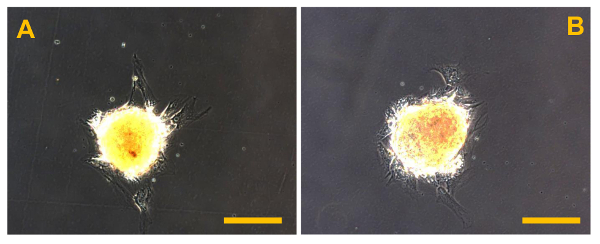
Figure 12. Après isolement Sarcosphere. Sarcospheres de OSA5 (A) et OSA6 (B) des lignées de cellules au début de l' expansion adhérente après la réintroduction et re - culturation en monocouche dans des conditions adhérentes à 48 heures après l' isolement. Observation en contraste de phase. grossissement d'origine: 20X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
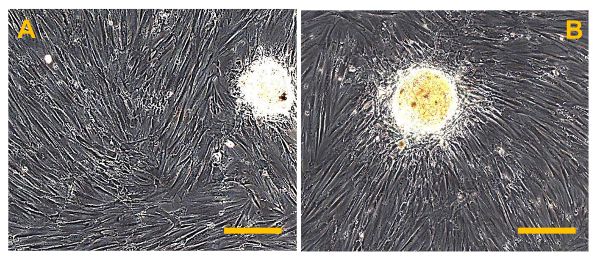
Figure 13. Sarcospheres à 7 D Après isolement. Sarcospheres de OSA5 (A) et OSA6 (B) , les lignées cellulaires adhérentes ont montré l' expansion suivant la réintroduction et re - culturation en monocouche dans des conditions adhérentes à 7 jours après l' isolement. Observation en contraste de phase. grossissement d'origine: 20X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
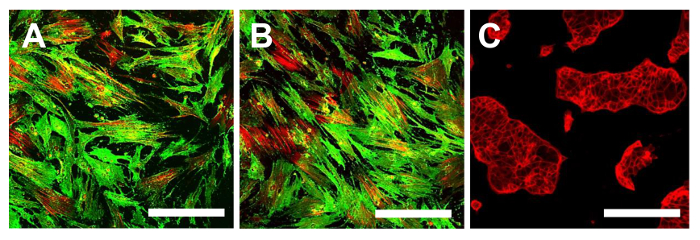
Figure 14. immunofluorescence pour CD105. Immunofluorescence pour CD105 dans les lignes OSA-SCC OSA5-CSCs (A) et OSA6-CSCs (B) et dans la lignée cellulaire continue HCT8 (C), qui a été utilisé comme témoin négatif. MCCL couleur classique: Vert pour CD105 et rouge pour cytosquelette. grossissement d'origine: 10X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
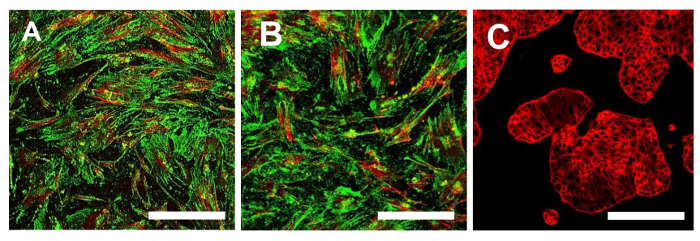
Figure 15. immunofluorescence pour CD44. Immunofluorescence coloration pour CD44 dans les lignes OSA-SCC OSA5-CSCs (A) et OSA6-CSCs (b) et dans la lignée cellulaire continue HCT8 ( en C), qui a été utilisé comme témoin négatif. MCCL dans des couleurs classiques: vert pour CD44 et rouge pour cytosquelette. grossissement d'origine: 10X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
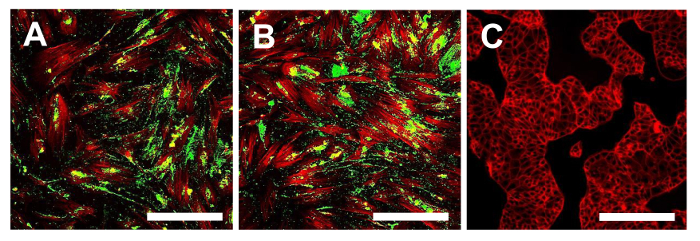
Figure 16. Immunofluorescence des Stro1. Immunofluorescence pour Stro-1 dans les lignes OSA-SCC OSA5-CSCs (A) et OSA6-CSCs (B) et dans la lignée cellulaire continue HCT8 (C), qui a été utilisé comme un négatif contrôle. MCCL dans des couleurs classiques: vert pour Stro-1 et rouge pour cytosquelette. grossissement d'origine: 10X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
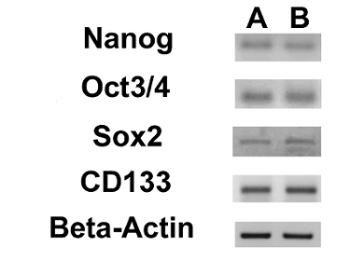
Figure 17. Expression de marqueurs nucléaires ESC et du CD133 Gene. RT-PCR montrant l'expression de Nanog, oct 3/4, Sox2 et CD133 dans OSA5-CSCs (A) et dans OSA6-CSCs ( B). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
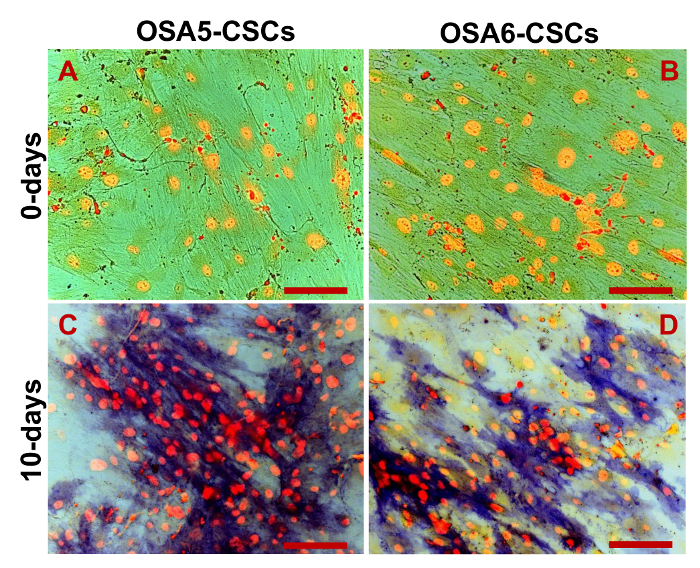
Figure 18. ostéogénique Différenciation Assay -. ALP différenciation ostéogénique à 0 d (A, B) et après 10 d (C, D) d'induction tel que déterminé par la coloration cytochimique pour ALP en utilisant Fast Blue BB. En bleu, ALP + cellules; en rouge, le noyau de contraste avec l'iodure de propidium. observation composite clair et en fluorescence. grossissement d'origine: 20X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 19. Essai de différenciation ostéogénique. - HA différenciation ostéogénique à 0 d (A, B) et après 20 j (C, D) de l' induction telle que déterminée par coloration cytochimique pour l' hydroxyapatite (HA) et rouge d' alizarine S. Les cellules sont mises en contraste dépôts bleu / gris, et granuleuses de HA sont colorés en rouge. L'observation en contraste de phase. grossissement d'origine: 40X. La taille de la barre:. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
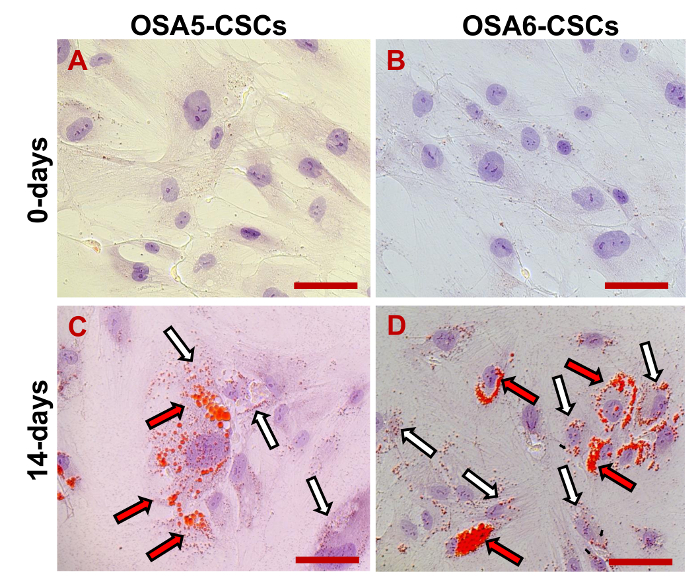
Figure 20. Essai de différenciation Adipogenic. Adipogenic de différenciation à 0 d (A, B) et après 14 jours (C, D) de l' induction telle que déterminée par cytochcoloration emical avec Oil Red O. En rouge, les vésicules lipidiques (les vésicules plus grandes sont indiquées par les flèches rouges / noires, les petites vésicules sont indiquées par les flèches blanches / noires); en bleu / violet, les noyaux contrecolorées par hématoxyline. Observation en fond clair. grossissement d'origine: 40X. Taille de la barre:. 100 uM S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
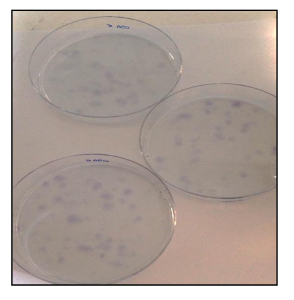
Figure 21. CFU Assay. CFU dosage de lignes OSA-SCC colorées avec du bleu de toluidine. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
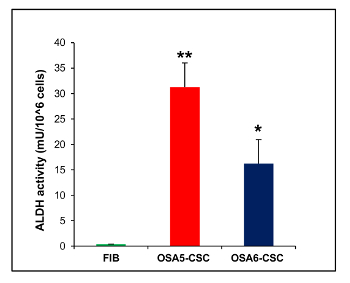 /> Figure 22. ALDH Dosage de l' activité. Le dosage colorimétrique ALDH détecté des niveaux élevés d'activité de ALDH dans les deux lignes OS-SCC, OSA5-CSCs et OSA6-CSCS, alors que le dosage a détecté l'absence de cette activité dans la lignée cellulaire différenciée finie des fibroblastes, FIB. Les barres d'erreur: SD. **: P <0,001 vs FIB; *:. P <0,01 vs FIB S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
/> Figure 22. ALDH Dosage de l' activité. Le dosage colorimétrique ALDH détecté des niveaux élevés d'activité de ALDH dans les deux lignes OS-SCC, OSA5-CSCs et OSA6-CSCS, alors que le dosage a détecté l'absence de cette activité dans la lignée cellulaire différenciée finie des fibroblastes, FIB. Les barres d'erreur: SD. **: P <0,001 vs FIB; *:. P <0,01 vs FIB S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Gène | oligonucleotides | Séquence (5¹-3¹) | Taille de l' amplicon (pb) | Tₐ (° C) | |
| Nanog | Amorce Amorce antisens | 87 | 60 | ||
| octobre 3/2 | Amorce Amorce antisens | GGGAGGAGCTAGGGAAAGA TCCTTCCTTAGTGAATGAAGAACT | 77 | 60 | |
| Sox2 | Amorce Amorce antisens | TGCAGTACAACTCCATGACC GGACTTGACCACCGAACC | 125 | 55 | |
| CD133 | Amorce Amorce antisens | CCAGAAGCCGGGTCATAAAT ATTCACTCAAGGCACCATCC | 127 | 56 | |
| pb, paires de base de la taille de l' amplicon; Tₐ, recuittempérature | |||||
Tableau 1. Liste détaillée des Séquences d' amorces pour Nanog, oct 3/4, Sox2 et CD133 avec la taille amplicon et de la température de recuit
Discussion
CSCs ont plusieurs propriétés qui permettent l'identification de ce sous-ensemble cellulaire particulier dans la masse de la tumeur. Sur la base de ces caractéristiques, telles que la résistance acquise cytotoxiques des agents chimiothérapeutiques pour la surexpression de l' ATP-binding cassette multirésistantes transporteurs d'efflux 28, 32, 33, ou pour la régulation positive de l'expression des enzymes de détoxication tels que ALDH 32, pour l'expression d'un marqueur de surface particulier, tel que le CD133, CD44, CD34, CD90, et les autres 30, 34, 35, 41, plusieurs méthodes différentes pour isoler des cellules souches cancéreuses ont été développés 42-44. Une de ces techniques est le test de formation sphère, qui est basée sur la capacité des cellules souches cancéreuses à se développer dans des conditions non-adhérentes.
La capacité des cellules souches des tissus et cellules souches cancéreuses pour former des sphères a été décrite dans les études sur l'identification des cellules souches neurales par Reynolds et al. , 37. Par la suite, Gibbs et al. Nous 38ed ces études pour commencer à isoler les cellules souches cancéreuses à partir de tumeurs solides, en particulier, de sarcomes des os. Nous avons décidé d'utiliser la méthode de test de formation de la sphère illustrée par Gibbs et al. Pour isoler CSCs partir de lignées cellulaires OSA obtenues à partir de biopsies OS classiques. Nous avons adapté la méthode originale pour améliorer les résultats de cet essai et de faciliter sa reproductibilité d'autres lignées de cellules cancéreuses. En ce qui concerne la mise en place de l'essai de formation de la sphère, nous avons vérifié que le placage de 40.000 cellules / est bien une bonne pratique pour le maintien des cellules dans l'isolement au début de l'essai. Cette astuce est très important d'éviter la possibilité que les colonies sphériques proviennent de l'agrégation cellulaire et non pas de la capacité particulière et exclusive d'un seul SCC à se développer dans des conditions non-adhérentes et former une colonie sphérique. Cette capacité est un point particulièrement critique de cet essai.
Nous avons également certifié que pour obtenir un bon taux de formation de la sphèreIl suffit pour rafraîchir des aliquotes de facteurs de croissance, tous les 3 jours et pas tous les jours, comme décrit dans la méthode originale. Dans cette étude, nous avons également établi et largement décrit une bonne méthode pour isoler les colonies sphériques qui se sont formées lorsqu'elles sont cultivées dans des conditions non-adhérentes. Cette étape est essentielle dans cet essai car il est très important d'essayer d'isoler le plus grand nombre de sphères possibles qui sont formées dans chaque puits sans les endommager. Il est également important d'isoler uniquement les sphères et non les cellules individuelles, ce qui pourrait rester en suspension pendant toute la durée de l'essai. Pour surmonter ces points critiques, nous avons mis au point une méthode d'isolement particulière, qui, comme indiqué ci-dessus, a donné de bons résultats pour l'isolement du SCC. De toute évidence, il existe la possibilité que toutes les sphères qui se sont formés peuvent être récupérés, mais le pourcentage de perte est très faible. En effet, nous avons aussi la possibilité d'utiliser un filtre de 40 um pores pour isoler les sphères après qu'ils deviennent grandes (formeed environ 100 - 200 cellules).
Cet isolement arrête la formation sphère mais permet aux cellules individuelles, une partie du résidu de méthylcellulose, et les plus petites sphères à filtrer. Cette élimination est effectuée par filtration complète comme décrit dans le protocole.
Par ailleurs, la sélection des colonies les plus grandes sphériques à travers les mailles de 40 um, avec la perte des plus petites colonies sphériques permet de sélectionner les cellules souches cancéreuses avec la plus grande capacité à former des colonies sphériques et avec une plus grande stemness. Toutes ces modifications ont été réalisées pour améliorer l'analyse et d'aider les chercheurs qui étudient CSCs à comprendre et à reproduire l'étape la plus critique de la méthode originale de l'essai de formation de la sphère.
Parmi les études portant sur des méthodes in vitro pour CSCs isolement, cette étude visait à montrer comment ce test de formation de la sphère adaptée pourrait être une bonne méthode pour isoler CSCs delignées cellulaires OSA. Les adaptations à la méthode originale et la technique d'isolation détaillée décrit l'amélioration de son efficacité. En peu de temps, un bon nombre de CSCs peut être obtenu et utilisé pour plusieurs expériences. Par conséquent, il est possible de confirmer rapidement les phénotypes de souches ressemblant et, en particulier, pour étudier la double phénotype de tige qui caractérise OS-CSCs. Ainsi, cet essai modifié pourrait être une bonne technique pour isoler CSCs et étudier leur biologie. Dans l'avenir, cette méthode, avec des adaptations supplémentaires, peuvent également être utilisés pour isoler les cellules souches cancéreuses provenant d'autres lignées de cellules cancéreuses fini obtenues par des biopsies de tumeurs solides rares.
La possibilité d'isoler CSCs de tumeurs solides rares, comme OS, permet non seulement l'amélioration des études sur ce cancer particulier, mais étend également à des études de différents types de cancer pour développer de meilleures méthodes pour leur isolement et à des études futures de la biologie de ce sous-ensemble cellulaire importante. Par conséquent, nousont fait dans cette étude, il est important d'améliorer les méthodes de CSC isolement par l'étude de CSC biologie, avec l'objectif final de trouver des cibles moléculaires et le développement d'un traitement anticancéreux très spécifique dirigé contre ce sous-ensemble cellulaire particulier, ce qui est probablement responsable de le maintien de la tumeur primaire, le développement de sa récurrence, et l'origine de métastases dans plusieurs organes. L'étude de la biologie du SCC est également important pour trouver des thérapies qui pourraient être incisive dans le traitement de cancers, tels que OS, pour lesquels le taux de survie après un traitement néoadjuvant reste très pauvre.
Déclarations de divulgation
The authors declare that they have no competing financial interest.
Remerciements
This study was supported by ITT (Istituto Toscano Tumori) Grant Proposal 2010.
matériels
| Name | Company | Catalog Number | Comments |
| Dulbecco's Phosphate Buffered Saline with Ca2+ and Mg2+ (DPBS) | LONZA | BE17-513F | _ |
| Dulbecco's Phosphate Buffered Saline without Ca2+ and Mg2+ (DPBS) | LONZA | BE17-512F | _ |
| Porcine Trypsin 1:250 | BD Difco | 215310 | Solvent: DPBS. Stock concentration: Powder |
| Ethylenediamine tetraacetic acid disodium salt dihydrate(EDTA) | Sigma-Aldrich | E4884 | Solvent: DPBS. Stock concentration: Powder |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C0130 | Solvent: Buffer Solution, pH 7.4. Stock concentration: Powder |
| Dimethyl sulphoxide (DMSO) | BDH Chemicals-VWR | 10323 | _ |
| Nutrient Mixture F-12 Ham | Sigma-Aldrich | F6636 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| 2-Phospho-L-ascorbic acid trisodium salt | Sigma-Aldrich | 49752 | Solvent: DPBS. Stock concentration: 5 mg/mL |
| β-Glycerol phosphate disodium salt pentahydrate | Sigma-Aldrich | 50020 | Solvent: DPBS. Stock concentration: 1 M |
| Insulin. Human Recombinant | Sigma-Aldrich | 91077 | Solvent: NaOH 0.1 M. Stock concentration: 10 mM |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I5879 | Solvent: DMSO. Stock concentration: 500 mM |
| Indomethacin | Sigma-Aldrich | I7378 | Solvent: DMSO. Stock concentration: 200 mM |
| Dexamethasone | Sigma-Aldrich | D4902 | Solvent: DMSO. Stock concentration: 1 mM / 100 µM. Store in liquid nitrogen to maintain the biological activity |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | _ |
| Fetal Bovine Serum South America | EUROCLONE | ECS0180L | _ |
| Penicillin-Streptomycin (PEN-STREP) 10,000 U/mL | LONZA | DE17-602E | _ |
| Methyl cellulose | Sigma-Aldrich | 274429 | Solvent: Ultrapure dH2O. Stock concentration: 2% |
| Putresceine dihydrochloride | Sigma-Aldrich | P5780 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| apo-Transferrin | Sigma-Aldrich | T-1147 | Solvent: DPBS. Stock concentration: 25 mg/mL |
| Human Epidermal Growth Factor (EFGF) | Sigma-Aldrich | E5036 | Solvent: DPBS pH 7.4. Stock concentration: 10 µg/mL |
| Fibroblast Growth Factor-Basic Human | Sigma-Aldrich | F0291 | Solvent: DPBS + 0.2% BSA. Stock concentration: 25 µg/mL |
| Selenous Acid | Sigma-Aldrich | 211176 | Solvent: DPBS. Stock concentration: 30 mM |
| Progesterone | Sigma-Aldrich | P8783 | Solvent: ETOH. Stock concentration: 10 mM |
| Toluidine Blue O | Sigma-Aldrich | 198161 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Oil Red O | ICN Biochemicals | 155984 | Solvent: 2-Propanol. Stock concentration: Powder |
| Naphtol AS-MX Phosphate Disodium Salt | Sigma-Aldrich | N5000 | Solvent: DMSO. Stock concentration: Powder |
| Fast Blue BB Salt | Sigma-Aldrich | F3378 | Solvent: Tris HCL, pH 9.0. Stock concentration: Powder |
| Fast Red Violet LB Salt | Sigma-Aldrich | F3381 | Solvent: Tris HCL, pH 9.1. Stock concentration: Powder |
| Bovine Serum Albumin, Fraction V (BSA) | Sigma-Aldrich | A-4503 | Solvent: DPBS. Stock concentration: 2% |
| Alizarin Red S | ICN Biochemicals | 100375 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Formaldehyde solution | Sigma-Aldrich | 533998 | 4% |
| Triton-100X | MERCK | 11869 | Solvent: DPBS. Stock concentration: 0.2%. Danger - Use only under chemical hood |
| Calcein | MERCK | 2315 | Solvent: DPBS . Stock concentration: 200 µg/mL |
| 2-Propanol | MERCK | 109634 | Danger - Use only under chemical hood |
| Ab-CD105 (Mouse monoclonal [SN6] to CD105 (FITC) | Abcam | ab11415 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD44 (Mouse monoclonal [F10-44-2] to CD44 (PE/Cy7®) ) | Abcam | ab46793 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD45 (Mouse monoclonal [MEM-28] to CD45 (PerCP)) | Abcam | ab65952 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD105 (Human CD105 Purified Antibody) | Invitrogen | MHCD10500 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-CD44 (Anti-CD44 Antibody) | Abcam | EPR1013Y(ab51037) | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-Stro-1 (Mouse anti-STRO-1) | Invitrogen | 398401 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 488 (Anti-Rabbit IgG (Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L)) | Invitrogen | A-21206 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| FITC Anti-Mouse IG (FITC-Rabbit Anti Mouse IgG (H+L)) | Invitrogen | 61-6511 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 635 Phalloidin | Invitrogen | A34054 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| AutoMACS™Running Buffer MACS Separation Buffer | Miltenyi | 130,091,221 | Liquid. Store at 4 °C |
| QIAzol®Lysis Reagent | QIAGEN | 79306 | Danger - Use only under chemical hood |
| QUANTITECT® Reverse Transcription Kit | QIAGEN | 205314 | _ |
| Chlorophorm | Sigma-Aldrich | C2432 | Liquid. Danger - Use only under chemical hood |
| Laminar flow hood | GELAIRE | BSB6A | _ |
| Chemical hood | ARREDI TECNICI Villa | Modello DYNAMICA | _ |
| Centrifuge | EPPENDORF | 5415R | _ |
| Laser Scanning Confocal Microscopy LSM 5109 Meta | ZEISS | _ | _ |
| iCycler PCR Thermalcycler | BIORAD | _ | _ |
| CyFlow®SPACE | (PARTEC) | _ | _ |
| Inverted Micrposcope Axiovert 200M | ZEISS | _ | _ |
| Freezing container , | Nalgene | _ | _ |
| Original Pipet-Aid | pbiBrand | _ | _ |
| Micropipettes | EPPENDORF | _ | _ |
| Glass Pasteur Pipette | SIGMA | _ | _ |
| VICTOR3™ | PERKIN ELMER | _ | _ |
| Conical tubes (15 and 50 mL) | BD FALCON | 352096 (for 15 mL) 352070 (for 50 mL) | _ |
| 24-Well Clear Flat Bottom TC-Treated Multiwell-Cell-Culture-Plate | BD FALCON | 353047 | _ |
| 6-Well Clear Flat Bottom Ultra Low Attachment Multiple-Well-Plates | CORNING | 3471 | _ |
| Serological pipettes (5 and 10 mL) | BD FALCON | 357543 (for 5 mL) 357551 (for 10mL) | _ |
| Syringe (5mL) | B|BRAUN | 4617053V | _ |
| Petri dish 100X20 mm | BD FALCON | 353003 | _ |
| Röhren Tubes (3.5 mL, 55x12mm, PS) | SARSTEDT | 55,484 | _ |
| Petri dish 60X15 mm | BD FALCON | 353004 | _ |
| Cryovials 1.5 mL | NALGENE | 5000-1020 | _ |
| Cell-Culture Flasks 25 cm² | BD FALCON | 353014 | _ |
| Nylon Net Filter, Hydrophilic | MERCK | NY4104700 | _ |
| Swinnex Filter Holder | MERCK | SX0002500 | _ |
| Perry tweezer | _ | _ | _ |
| Lancet | _ | _ | _ |
| Dounce | _ | _ | _ |
Références
- Reddick, R. L., Michelitch, H. J., Levine, A. M., Triche, T. J. Osteogenic sarcoma: a study of the ultrastructure. Cancer. 45 (1), 64-71 (1980).
- Gatta, G., et al. Childhood cancer survival trends in Europe: a EUROCARE Working Group study. J. Clin. Oncol. 23 (16), 3742-3751 (2005).
- Olstad, O. K., et al. Molecular heterogeneity in human osteosarcoma demonstrated by enriched mRNAs isolated by directional tag PCR subtraction cloning. Anticancer. Res. 23 (3B), 2201-2216 (2003).
- Geller, D. S., Gorlick, R. Osteosarcoma: a review of diagnosis, management, and treatment strategies. Clin Adv Hematol Oncol. 8 (10), 705-718 (2010).
- Tang, N., Song, W. X., Luo, J., Haydon, R. C., He, T. C. Osteosarcoma development and stem cell differentiation. Clin. Orthop. Relat. Res. 466 (9), 2114-2130 (2008).
- Kempf-Bielack, B., et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J. Clin. Oncol. 23 (3), 559-568 (2005).
- Meyers, P. A., et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J. Clin. Oncol. 23 (9), 2004-2011 (2005).
- Gorlick, R., et al. Biology of childhood osteogenic sarcoma and potential targets for therapeutic development: meeting summary. Clin. Cancer Res. 9 (15), 5442-5453 (2003).
- Hayden, J. B., Hoang, B. H. Osteosarcoma: basic science and clinical implications. Orthop. Clin. North Am. 37 (1), 1-7 (2006).
- Thomas, D., Kansara, M. Epigenetic modifications in osteogenic differentiation and transformation. J. Cell. Biochem. 98 (4), 757-769 (2006).
- Araki, N., et al. Involvement of the retinoblastoma gene in primary osteosarcomas and other bone and soft-tissue tumors. Clin. Orthop. Relat. Res. 270 (270), 271-277 (1991).
- Chou, A. J., Gorlick, R. Chemotherapy resistance in osteosarcoma: current challenges and future directions. Expert. Rev. Anticancer Ther. 6 (7), 1075-1085 (2006).
- Arndt, C. A. S., Crist, W. M. Common musculoskeletal tumorsof childhood and adolescence. N. Engl. J. Med. 341 (5), 342-352 (1999).
- Longhi, A., Errani, C., De Paolis, M., Mercuri, M., Bacci, G. Primary bone osteosarcoma in the pediatric age: state of the art. Cancer. Treat. Rev. 32 (6), 423-436 (2006).
- Bacci, G., et al. Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at the istituto ortopedico rizzoli according to the istituto ortopedico rizzoli/osteosarcoma-2 protocol: an updated report. J. Clin. Oncol. 18 (24), 4016-4027 (2000).
- Clarke, M. F., et al. Cancer stem cells-perspectives on current status and future directions: AACR workshop on cancer stem cells. Cancer. Res. 66 (19), 9339-9344 (2006).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367 (6464), 645-648 (1994).
- Bonnet, D., Dick, J. E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med. 3 (7), 730-737 (1997).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumors: accumulating evidence and unresolved questions. Nat. Rev. Cancer. 8 (10), 755-768 (2008).
- Bapat, S. A. Evolution of cancer stem cells. Semin. Cancer Biol. 17 (3), 204-213 (2007).
- Rubio, D., et al. Spontaneous human adult stem cell transformation. Cancer. Res. 65 (8), 3035-3039 (2005).
- Burns, J. S., et al. Tumorigenic heterogeneity in cancer stem cells evolved from long-term cultures of telomerase-immortalized human mesenchymal stem cells. Cancer. Res. 65 (8), 3126-3135 (2005).
- Zhang, M., Rosen, J. M. Stem cells in the etiology and treatment of cancer. Curr. Opin. Genet. Dev. 16 (1), 60-64 (2006).
- Li, Y., et al. Evidence that transgenes encoding components of the Wnt signaling pathway preferentially induce mammary cancers from progenitor cells. Proc. Natl Acad. Sci. USA. 100 (26), 15853-15858 (2003).
- Sell, S. Cellular origin of cancer: dedifferentiation or stem cell maturation arrest?. Environ Health Perspect. 101 (Suppl 5), 15-26 (1993).
- Wernig, M., et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448 (7151), 318-324 (2007).
- Niwa, H., Miyazaki, J., Smith, A. G. Quantitative expression of oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat. Genet. 24 (4), 372-376 (2000).
- Hochedlinger, K., Jaenisch, R. Nuclear reprogramming and pluripotency. Nature. 441 (7097), 1061-1067 (2006).
- Dean, M., Fojo, T., Bates, S. Tumor stem cells and drug resistance. Nat. Rev. Cancer. 5 (4), 275-284 (2005).
- Ma, S., Lee, T. K., Zheng, B. J., Chan, K. W., Guan, X. Y. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway. Oncogene. 27 (12), 1749-1758 (2008).
- Wu, C., et al. Side population cells isolated from mesenchymal neoplasms have tumor initiating potential. Cancer. Res. 67 (17), 8216-8222 (2007).
- Ma, I., Allan, A. L. The role of human aldehyde dehydrogenase in normal and cancer stem cells. Stem. Cell. Rev. 7 (2), 292-306 (2011).
- Awad, O., et al. High ALDH activity identifies chemotherapy-resistant Ewing's sarcoma stem cells that retain sensitivity to EWS-FLI1 inhibition. PLoS One. 5 (11), e13943 (2010).
- Fujii, H., et al. Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines. Int. J. Oncol. 34 (5), 1381-1386 (2009).
- Di Fiore, R., et al. Genetic and molecular characterization of the human osteosarcoma 3AB-OS cancer stem cell line: a possible model for studying osteosarcoma origin and stemness. J. Cell. Physiol. 228 (6), 1189-1201 (2013).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonicprogenitor cell produces neurons and astrocytes. J. Neurosci. 12 (11), 4565-4574 (1992).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Gibbs, C. P., et al. Stem-like cells in bone sarcomas: implications for tumorigenesis. Neoplasia. 7 (11), 967-976 (2005).
- Beccari, N., Mazzi, V. . Manuale di tecnica microscopic. Casa Editrice Dr. Francesco Vallardi Società Editrice Libraria. , 99-100 (1966).
- Majumdar, M. K., Thiede, M. A., Mosca, J. D., Moorman, M., Gerson, S. L. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J. Cell. Physiol. 176 (1), 57-66 (1998).
- Tirino, V., et al. Human primary bone sarcomas contain CD133+ cancer stem cells displaying high tumorigenicity in vivo. FASEB J. 25 (6), 2022-2030 (2011).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. FASEB J. 27 (1), 13-24 (2013).
- Martins-Neves, S. R., et al. Therapeutic implications of an enriched cancer stem-like cell population in a human osteosarcoma cell line. BMC Cancer. 12 (1), 139 (2012).
- Tang, Q. L., et al. Enrichment of osteosarcoma stem cells by chemotherapy. Chin. J. Cancer. 30 (6), 426-432 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon