Method Article
巨蟹座的建立源于人类传统的骨肉瘤细胞培养
摘要
癌症干细胞的骨肉瘤存在(的CSCs)最近被链接到他们的发病机理。在这篇文章中,我们目前使用的CSC不依条件下生长的能力从传统的骨肉瘤(OS)的人获得活检原代细胞培养肿瘤干细胞的分离。
摘要
在与骨肉瘤(OS)的治疗目前的改进延长癌症患者的生命,但已发生转移时的五年存活率仍然不佳。癌症干细胞(CSC)理论认为有肿瘤细胞具有干细胞样的特性,包括以维持肿瘤和抗多种药物化疗的能力的肿瘤内的一个子集。因此,需要以推进靶向治疗的发展,以消除这一特定子集,以减少患者的发病率和死亡率OS生物学和发病机制的更好的理解。隔离的社区体育,社区体育建立的细胞培养,并研究其生物学对提高我们的操作系统生物学和发病机制的认识的重要步骤。源于人的操作系统的CSCs的从操作系统的活检建立已成为可能使用几种方法,其中包括以下创建nonadhere 3维的干细胞培养物的能力NT的条件。在这些条件下,肿瘤干细胞是能够创建由子干细胞形成的球形浮菌落这些殖民地被称为"细胞球"。在这里,我们描述了建立从OS活检获得常规操作系统的原代细胞培养CSC培养的方法。我们清楚地描述了分离和鉴定肿瘤干细胞所需的几个段落。
引言
肉瘤是罕见的恶性结缔组织肿瘤从胚胎中胚层1主要源于一组异质性。不同类型的包括骨肉瘤和软组织肉瘤。骨肉瘤,一组比较少见的原发肿瘤,由若干亚型,包括骨肉瘤(OS)的。操作系统,骨中最常见的原发性肿瘤中的一个,是间充质恶性表现出广泛的临床,组织学和分子非均质2,3。不幸的是,操作系统主要是在儿童和年轻成人4时,5和代表60%的在儿童骨肉瘤的常见的组织学亚型6,7。操作系统通常影响骨骼区域,其通过快速骨生长特征( 例如 ,长骨的干骺端)。在OS,OS的常规,也称为延髓或中央OS的组织学不同的亚型,具有恶性肿瘤的高品位和配额SHA重的80%的8。这80%的由60%的常规的成骨细胞的OS,10%软骨细胞的OS,以及10%的成纤维细胞的OS 6,8-10。其他操作系统亚型包括间变性,毛细血管扩张,巨细胞丰富和小细胞操作系统。尽管联合手术,并在OS的管理化疗的进步,结果仍然较差,患者65-70%长期存活率无转移11,12。远处复发频繁发生作为肺转移或,较不频繁,如转移到遥远的骨骼和局部复发13。转移通常对常规治疗有抗性。这种阻力就是为什么10年无病生存率是转移性肿瘤患者约30%在诊断14,15的原因。
与正常组织,癌组织组成的细胞类型的异质集合。肿瘤内细胞似乎对应于不同的发展阶段。在任意normal组织驻留的细胞亚群与到selfrenew的能力,从而为组织稳态祖细胞和成熟细胞。同样地,癌症是在不同的发展阶段组成细胞的类似异质群体,具有不同程度的增殖和致瘤性的。这些癌细胞的子集,被称为癌症干细胞(CSCs的),构成自保持细胞到selfrenew和维持肿瘤的恶性潜能异能力,从而产生了构成肿瘤本体16上的不同的细胞谱系的一个储存器。在20世纪90年代,在急性髓细胞白血病的研究为CSC亚群17,18的存在提供了第一个令人信服的证据。社区体育会,因为从实体瘤19的大量的隔离,从而成为在癌症研究中研究最多的话题之一。肿瘤干细胞可能确实是从正常干细胞的突变的基因,使正常的出现癌干细胞20-23。多重转化突变和互动的微环境也可促进健康的祖细胞和成熟细胞获取自我更新能力和不朽的典型化CSCs的。大约有这一转型几种假说。健康祖细胞,健康成熟细胞和癌细胞,可以去分化干细胞,通过激活自我更新相关基因24-28获得干细胞样表型。尽管最近的几项研究,肿瘤干细胞的起源尚未被发现。
肿瘤干细胞的一个具体特点是,他们的能力抵御多的治疗方法,其中包括联合手术和化疗不同的药物。最近的研究表明,肿瘤干细胞也可能获得耐细胞毒性化疗药物。对于该电阻可能的解释包括ATP结合盒(ABC)多药转运的过表达(即MDR1和BCRP1),化疗代谢酶如醛脱氢酶1(ALDH1),和/或在细胞周期动力学30-33的变化的过表达。的已迄今描述的所有这些概念的直接后果是,癌症治疗将是有效的只有当CSC亚群被完全消除,而如果甚至单个CSC存活局部复发或远处转移可能发生。
的CSCs在人类肉瘤34,特别是操作系统35,或者在任何其他的骨和软组织癌症,发现具有重要的临床意义,因为它提供了一个可能的解释,为什么许多治疗似乎是有效的最初,但患者后来复发。因此,反对传统的OS未来战场的希望是基于对以下操作系统的CSCs由于定向到此子的分子特性的创新药物的发展寻找新的和具体的有针对性的治疗人口和CSC生物学研究。
在1992年,Reynolds和同事,谁正在调查的干细胞的一个子集是否存在于成年哺乳动物脑,研制分离怀疑是干细胞样细胞36,37的细胞的方法,该方法是基于对所述特定能力当非粘性的条件下生长,这些细胞以形成球形菌落。类似的技术被吉布斯和同事在2005年用于研究干细胞样细胞在骨肉瘤38亚群。分离并从不同类型的常规操作系统的原代细胞培养表征操作系统的CSCs,我们决定以适应该技术对于OS的细胞系。
这里,我们描述了球形成测定的这种适配方法,称为"sarcosphere测定法",它可用于操作系统的CSCs从常规操作系统的人类活检衍生有限原代细胞系分离。我们还描述了所有技术üsed将验证由该测定分离的细胞系的干细胞样的CSC型:1)表征多能胚胎干细胞(ESCs的基因的表达的评价)与CD133基因,这是肿瘤干细胞的标志物的; 2)集落形成单位(CFU)测定; 3)的这些细胞分化为适当的分化条件下的成骨细胞和脂肪细胞的能力评价; 4)通过免疫染色和流式细胞仪分析间质干细胞的表面标记(MSCS)( 即,CD44,CD105和STRO-1)的研究; 5)这些细胞的ALDH活性的评估。
研究方案
使用本文所述的人体组织的所有实验是经当地伦理委员会(RIF。N.12分之141)。从在AOUC捐赠者获得用于组织样本的收集和样品的使用和储存的知情同意。
1.准备文化
- 通过加入10%胎牛血清(FBS),100IU / ml青霉素和100μg/ ml链霉素的Coon到的改性的Ham的F12培养基制备生长培养基(GM)。过滤,并用0.22微米过滤器消毒通用。通用存储长达1个月在4℃。
- 通过添加20%FBS,100IU / ml青霉素,100微克/毫升链霉素和3毫克/毫升胶原酶II型到浣熊的改性的Ham的F12培养基制备胶原酶培养基(CM)。过滤,并用0.22微米过滤器消毒的CM。商店的CM长达1个月在-20℃。
- 通过添加40%FBS的制备用于细胞冷冻(FM)中,100国际单位/毫升青霉素,100微克/毫升链霉素和65.5%二甲基亚砜(DMSO)为浣熊的改良火腿的F12培养基。使用0.22微米的过滤器过滤和消毒FM。 FM存储长达1个月在4℃。
- 通过添加20%FBS,100IU / ml青霉素和100μg/ ml链霉素的Coon到的改性的Ham的F12培养基制备用于CFU试验(CFUM)培养基。使用0.22微米的过滤器过滤和消毒CFUM。商店CFUM长达1个月在4℃。
- 毫升Dulbecco氏磷酸盐缓冲盐水(DPBS)不含Ca 2+和Mg 2+无水葡萄糖在1000 - 400毫克胰蛋白酶,200毫克EDTA和1000毫克的D(+)溶解制备胰蛋白酶。
注意:使用0.22微米的过滤器并冷冻在-20℃下进行长达3个月除以新鲜胰蛋白酶-EDTA到50ml等分试样中为25cm 2烧瓶中。储存在4℃下解冻过滤灭菌等份而不丧失活性。 - 通过加入10%FBS,100IU / ml青霉素,100微克/毫升链霉菌制备的干细胞生长培养基(SCGM)霉素和10ng / ml的bFGF(25微克/毫升股票)到浣熊的改良火腿的F12培养基。在4℃下使用0.22微米的过滤器和储存SCGM最多2周筛选SCGM。
- 通过在4℃下3天在超纯H 2ö溶解MC制备2%甲基纤维素(MC)。当MC完全溶解,高压灭菌,并在4℃下保存。
注:MC消毒后,就变成固体。为了使MC为液态,储存在4℃。 - 准备sarcosphere生长培养基(SGM)。通过添加100IU / ml青霉素,100微克/毫升人bFGF(25微克/毫升的库存)制备该培养基新鲜(未使用前2周以上),为20nM孕酮(10μM股票),100μM的腐胺,为30nM亚硒酸钠(30μM的股票),25微克/毫升转铁蛋白(25mg / ml的股票),20微克/毫升胰岛素(20mg / ml的股票),和10ng / mL人表皮生长因子(10微克/毫升的库存)至2X浣熊的改良火腿的F12培养基。过滤,并用0.22微米的FIL消毒SGM之三。存储长达2周,在4℃。
- 通过加入10%FBS(南美原点),100国际单位/毫升青霉素,100微克/毫升链霉素,10nM的地塞米松(100μM股票),0.2mM的钠L-抗坏血酸-2-磷酸制备成骨培养基(OM)(1 1M贮存),10毫米β甘油(5毫克/毫升股票)和1微克/毫升钙黄绿素(200微克/毫升股票)到浣熊的改良火腿的F12培养基。使用0.22微米的过滤器过滤和消毒OM。保存在4℃。
注:在液氮下存储地塞米松原液保持它们的活性。制备新鲜的OM每2周,以保持以维持介质的分化潜能的地塞米松的活性。 - 通过将1.66毫克氯化铵制备红细胞裂解缓冲液(ELB),0.2毫克K 2 HPO 4和200毫升0.007毫克EDTA蒸馏水(DH 2 O)。过滤,并用0.22微米过滤器消毒ELB。保存在4°C。
- 通过加入制备成脂介质(AM)的10%FBS(南美洲原点),100国际单位/毫升青霉素,100微克/ ml链霉素,1μM地塞米松(1mM储备),1μM的牛胰岛素(10mM储备),0.5毫异丁基(IBMX)(500毫米股票),和100μM吲哚美辛(200毫米),浣熊的改良火腿的F12培养基。过滤,并用0.22微米过滤器消毒PM。保存在4℃。
注:在液氮下存储地塞米松原液保持它们的活性。制备新鲜调幅每2周,以保持以维持介质的分化潜能的地塞米松的活性。 - 制备2%牛血清白蛋白(BSA)在DPBS(BSA / DPBS)。溶解在500毫升DPBS10克BSA和通过在50ml锥形管中aliquotting 50ml料液制备原液。储存于-20℃。
- 制备4%低聚甲醛(PFA)的在DPBS(PFA / DPBS)中的溶液。在Chemical罩,稀释的多聚甲醛在DPBS和通过在50ml锥形管中aliquotting 50ml料液制备原液。保存在4℃。
2.建立主OS细胞培养和OS有限细胞系(OSA)
注:从在"盟Ortopedia OncologicaêRicostruttiva",AOUC Careggi酒店,佛罗伦萨收集传统OS活检的新鲜样品制备的主要操作系统细胞培养。所有活检,这是由针穿刺或手术切除肿瘤( 图1A,B)的一小部分而获得立即置于在补充有100IU / ml青霉素和100μg/ ml链霉素(pH7.4)和培养基运送到他们在那里处理的实验室。所有描述的操作都采用层流罩在无菌条件下进行的。
- OS细胞的分离
- 放置在一活检百毫米培养皿与通用的小体积。用无菌的刺血针和佩里镊子,通过切割其成碎片尽可能小剁碎操作系统组织样品(0.5 - 1毫米)( 图2A,B)。
- 覆盖用10ml的CM的酶促消化( 图2B)的组织片段,并在37℃,5%CO 2培养箱孵育3小时。轻轻取出用吸管片段的悬浮液,并将其转移到15毫升锥形管立即离心(400×g离心5分钟)以沉淀片段。
注:离心后,如果活检富含红细胞,红细胞组成的红色存款可以看出在片段。因此,在进行到机械分散前,治疗与红细胞裂解液的样品。吸弃上清加入5 ml ELB。 - 暂停沉淀碎片为1分钟,并在400×g离心2离心悬浮液分钟。通过抽吸除去上清液。加入5毫升通用汽车和机械用10毫升血清吸管(开口尺寸,1.5毫米的直径)10分散的碎片 - 的20倍。
- 离心在400 xg离心悬浮液5分钟。通过抽吸除去上清液,暂停用10毫升GM细胞沉淀,然后将所得的细胞悬浮液转移到100毫米的培养皿。孵育37℃,5% 二氧化碳培养箱的培养皿中,用新鲜完整的通用汽车每3天更换总经理。
注意:很多时候,通过针穿刺获得的OS组织样品是非常小的,并且包含骨头碎片,这是不通过用胶原酶酶解消化。因此,上清液被移除后,试图通过用移液管糖化粒料片段来分离从骨组织的细胞。
- 亚文化
注:要建立一个OSA,当细胞达到近似汇合,从兵卫删除ř培养容器,稀释,并在一个新的板放置,以使进一步的增长。此传代过程是使用称为胰蛋白酶消化酶过程来实现的。- 吸删除网上平台。以解离的细胞单层,加入2 - 3毫升胰蛋白酶在RT(最大18 - 20℃),轻轻摇动一次,并通过抽吸立即除去胰蛋白酶。重复两次。孵育细胞在37℃,3 - 4分钟,直到他们开始分离。
注:良好的胰蛋白酶可以通过有经验的用户如稍不透明的单层形成时,菜举行光小孔看到。这个离解,也可以使用倒置显微镜监测;建议初学者这种方法。 - 通过加入10ml通用停止胰蛋白酶反应和洗碟以及使用移液管分离的所有细胞。传输1毫升悬浮到了100毫米的培养皿,并添加9毫升GM(1/10分裂的细胞)。
注意: 剩余的细胞悬浮液可以用于细胞扩增(转移到另外100毫米的培养皿),可冻存(见2.3节),或者可在实验的菜肴或增殖测定或其他用途的孔(参见算和镀下面)。
- 吸删除网上平台。以解离的细胞单层,加入2 - 3毫升胰蛋白酶在RT(最大18 - 20℃),轻轻摇动一次,并通过抽吸立即除去胰蛋白酶。重复两次。孵育细胞在37℃,3 - 4分钟,直到他们开始分离。
- OS原代培养和OSA的冷冻保存
注:多冻结一汇合100毫米培养皿成4-5冷冻管。必须快速进行冷冻保存的过程中,因为-DMSO,其中冷冻过程中保护细胞膜,是有毒的在非冷冻温度下的细胞。- 从通过胰蛋白酶消化单层分离细胞培养物(见2.2节),离心沉淀细胞,在400×g离心5分钟,通过抽吸除去上清液,然后迅速中止在调频细胞沉淀。
- 分装1毫升每小瓶低温这个暂停。立即放置在冷冻箱的填充小瓶用2-丙醇和存储立即直接的夹套tely在-80°CO / N。转印冻存管以液氮为长期贮存次日。
- 除霜OS细胞系和原代培养物
- 从液氮储存除霜OS细胞系,解冻冷冻管迅速在37℃下将其放置在实验室水浴中。转移离心管的内容到一个15毫升的锥形管中,加入大约10mL,通用汽车(参见2.3节以去除DMSO)。吸去上清,并暂停在10毫升GM细胞沉淀。板细胞悬液在100毫米培养皿,并在37℃,5%CO 2培养箱孵育。
3. Sarcosphere检测,以隔离OS-的CSCs
注:此实验是在OSA执行。该实验的持续时间是相关的能力的细胞,以形成这些球落(sarcospheres),和时间的范围是7,14,21,和28天。
- ESTABsarcosphere测定lishment
- 准备血细胞计数室和提前全部试剂。
- 吸移除介质和用胰酶消化单层游离于细胞(参见2.2节)。彻底混合细胞悬液,移液驱散任何团块,并用20微升枪头,收集10微升。
- 立即转移10μL的细胞悬液至血细胞计数器室边缘,排出悬浮液,并允许它通过毛细管作用盖玻片下绘制。
- 观察下相衬的血细胞计数室。选择一个10X物镜和聚焦于腔室中的网格线。计数趴在使用这个细分1mm 2中区(也由三个平行线方向)细胞和单网格线作为计数的援助。
- 测量的浓度,并应用下列公式:1毫升= N * 10 4 / Z(正:细胞在所有的计数的全数字平方1mm 2中; Z:计数正方形1mm 2中)的数量。计算必要到板中的6孔超低附着板分成40,000个细胞每孔240000细胞的总量的细胞悬浮液的体积。
注意:一定要通过电镀细胞转化为一个额外的以及直接制版细胞的正确数目。因此,待镀的细胞的总量为28万细胞。 - 通过在的25cm 2烧瓶中加入2%的MC(SGM-MC)的50%制备35毫升SGM。准备SGM的考虑5毫升额外的总量,以镀一个额外的好。
- 添加细胞悬浮液在烧瓶中制备的SGM-MC的计算量,并用移液管以分散任何团块轻轻混匀。板的细胞在6孔超低附着板,并使用倒置显微镜观察被电镀后的细胞的显示方式。
- 孵育所述细胞在37℃,5%CO 2培养箱。每3天,加上FRbFGF和EGF的向每个孔ESH等份刷新的生长因子的浓度。添加2μL的bFGF和5μL的EGF在每个10纳克/毫升的终浓度,以保持这两个井。
- sarcospheres的分离
注:监视sarcosphere测定的良好的进展在7,14,21,和28天,以决定何时需要分离所形成的sarcospheres。- 准备在层流罩( 图3A,B)的所有的试剂和设备。通过将直径为25毫米的净过滤器和一个40微米网眼为膜过滤器保持器组装过滤装置;通过高压( 图4A-E)消毒。
- 对于每个孔,用无菌移液管有一个1000微升末端含有sarcospheres培养基转移到注射器用无菌膜过滤器保持器。完全删除含有sarcospheres介质后,洗好由addING5毫升通用,以确保所有的领域转移到注射器中。用显微镜确认所有sarcospheres是否已被追回。如果不是这样,通过重复这一步骤继续进行。
- 过滤与仅通过重力的膜过滤器保持器的悬浮液无压力,以防止损坏球体,并避免具有sarcospheres通过过滤器横过,从而避免球的损失。轻轻用无菌玻璃巴斯德吸管除去气泡。
注:有时过滤由气泡在膜过滤器保持器的存在阻止。 - 通过加入10ml通用注射器,让它过滤器没有压力,以确保消除单个细胞清洗过滤装置。从注射器拆开过滤装置,放入培养皿。
- 使用佩里镊子除去从膜过滤器保持器的净过滤并通过在60毫米与镊子轻轻摇动洗培养皿从膜的纠结释放sarcospheres。然后,将膜在一个井,并且没有更多的球在膜中纠结通过显微镜观察确认。如果球是在膜还在纠结,继续另一次清洗的步骤3.2.4所述。
- 观察用显微镜释放sarcospheres。孵育释放sarcospheres在37℃,5%CO 2培养箱。重复所有步骤6孔超低附着板的各孔中。
4. OS-CSC线
注:OS-的CSCs从表现通过重新引入和它们在小60毫米的培养皿超低附着条件下镀后不再在单层reculturing这些细胞贴壁扩张sarcospheres获得。
- OS-CSC文化
- 要启用进一步增长,传代细胞,当他们在60达到约90%汇合毫米的培养皿。重复步骤2.2.1建立OS-CSC文化。
- 停止胰蛋白酶消化通过加入4毫升SCGM和洗碟井,用移液管分离的所有细胞。细胞悬液转移到了100毫米的培养皿,并添加6毫升SCGM。当OS-CSCs的重复部分2.2达到90%融合,传代。
注: 对于体外分析来表征分离的操作系统的CSCs的干细胞样表型,细胞可在不同类型的板被镀。 - 保留通过冷冻保存建立的OS-CSC线(重复第2.3节中的所有步骤)。通过重复2.4节中的所有步骤解冻冻存OS-肿瘤干细胞。
5. 在体外 nalysis表征OS-CSCs的:
- 细胞免疫的制备
注:细胞固定在多聚甲醛,当他们在24孔解放军每孔达到汇合权等级德。合流的等级有关试验的类型。- 平板OS-肿瘤干细胞在24孔板通过免疫荧光研究表面间充质干细胞(MSC)标记。修复在每口井的细胞,当他们达到50 - 60%汇合。通过抽吸除去SCGM并在DPBS 24孔板洗涤两次。
- 下化学罩,加入500微升4%PFA / DPBS到每个孔中。孵育在室温10分钟。取出PFA / DPBS,并用超卫生署2 O.洗3倍允许在24孔板在通风柜干燥。
- 免疫荧光标记的MSC
注:在OS的CSCs的免疫荧光染色固定在4%PFA / DPBS可用于调查使用针对CD44,STRO-1和CD105抗体操作系统的CSCs的MSC样表型。下面的方法是由作者常规使用。- 在化学罩,通透已经被固定在4%PFA / DPBS细胞中加入500微升0.2%的Triton X-100 / DPBS到每个孔中。孵育所述细胞在37℃下30分钟。轻轻洗细胞用DPBS 3倍。添加300μL的RNA酶稀释1 / 1,000用2%BSA / DPBS到细胞中,并在37℃下孵育30分钟。
- 轻轻洗涤细胞用2%BSA / DPBS 3倍。染色细胞的MSC标记。第一抗体仅添加到选择作为各抗体阳性对照的孔中。
- 添加300μL的抗CD105稀释1/10用2%BSA / DPBS,300微升抗CD44稀释1/10用2%BSA / DPBS,300微升抗的Stro-1 1/10稀释用2%BSA / DPBS和仅200微升2%BSA / DPBS到选择作为各抗体阴性对照的孔中。
- 孵育在潮湿环境中的细胞在4℃CO / N。洗孔3倍用DPBS,然后两次用2%BSA / DPBS。
- 通过将特定的二抗揭示初级抗体。
- 添加300μL的抗兔IgG(驴抗兔IgG [H + L)]稀释1/100用2%BSA / DPBS到每个孔中选择作为CD44和CD105阳性和阴性对照。添加300μL的FITC标记抗小鼠Ig(FITC兔抗小鼠IgG [H + L)]用2%BSA中1/100稀释/ DPBS到每个孔中选择作为阳性和阴性对照为STRO-1。孵育在黑暗中的细胞在室温60分钟。洗井DPBS 6倍。
- 通过加入300微升鬼笔1/100稀释,用2%BSA的细胞骨架肌动蛋白染色的MSC标记阳性细胞/ DPBS到每个孔中染色的MSC标记免疫荧光。
- 孵育所述细胞在室温下40分钟。洗井DPBS 3倍,然后用超卫生署2 O.洗两次继续到核的上述免疫荧光染色后的复染。在通风橱中制备碘化溶液10 -5 M在DPBS(股票1.5×10 -3 M)。
- 添加200μL的碘化丙啶溶液如上所述每个孔着色。孵育细胞S表示2 - 在室温3分钟。用超卫生署2 O.洗孔两次
注:重复部分5.1的所有步骤- 5.2对细胞系HCT8,伯连续分化结肠癌细胞被用作阴性控制线。
- 添加200μL的碘化丙啶溶液如上所述每个孔着色。孵育细胞S表示2 - 在室温3分钟。用超卫生署2 O.洗孔两次
- 成骨分化分析
注意:成骨分化持续20天。- 板操作系统的CSCs在以1×10 4个细胞/ cm 2在SCCGM的细胞密度24孔板。允许,直到他们达到80细胞在SCGM增长 - 在每一个90%汇合好。
- 通过改变SCGM到OM启动成骨分化。让细胞在生长OM和刷新中,每3 - 4天。停止成骨分化测定法在10天以评价碱性磷酸酶(ALP)的存在。
- 修正了4%PFA / DPBS细胞(参见5.1节)。评估通过细胞化学染色成骨细胞表型碱性磷酸酶和HA用茜素红S染色。
- ALP细胞化学染色
注:立即开始染色前准备在化学罩染料混合物。- 解散40毫克固蓝BB或50毫升的Tris-HCl快速红紫LB盐,pH值9(溶液A)。溶解5毫克萘酚AS-MX磷酸钠盐在1ml DMSO中(溶液B)。加入溶液B完全解决方案A拌匀,获得溶液C.洗涤细胞用DPBS两次。
- 加入500微升-的溶液1ml℃至每个孔,并在37℃下孵育和5% 的 CO 2。监测在显微镜下观察细胞染色每10分钟的过程中。
- 停止染色时ALP阳性细胞变得强烈着色(蓝色与固蓝BB盐或红色固红紫色LB盐),通常30分钟内发生。清洗细胞3倍用超卫生署2 O去除溶液C.的所有残留物如果污渍我的沉淀物S出现,用无水乙醇洗细胞迅速一次。
- 继续到核中的步骤5.2.5和5.2.5.1中描述的ALP染色后的复染。
- 茜素红S细胞化学染色
注:在开始实验前准备染料混合物。- 准备2%茜素红S(2克茜素红S在100毫升超纯H 2的O)。添加2.5% 的 NH 3至2%茜素红S以达到pH 6.0。在4℃储存2%茜素红S溶液。用DPBS洗涤细胞一次。
- 添加茜素红S到细胞中只有几秒钟。
- 用超卫生署洗井2 O,以控制污染的程度;如果HA存款都没有强烈的有色,重复步骤5.3.5.2。停止染色时的HA沉积物变得强烈红色,这通常在几分钟之内发生。用超卫生署2 O.洗井
- 成脂分化
注意:试验持续时间取决于在OS-CSC线。该法可以持续14 - 30天。- 板操作系统的CSCs在以1×10 4个细胞/ cm 2在SCGM的细胞密度24孔板。允许,直到他们达到80细胞在SCGM增长 - 在每一个90%汇合好。通过改变SCGM到AM发起成脂分化。允许细胞在调幅生长并刷新调幅每周两次。
- 停止成脂分化检测时脂囊泡是可见的。通过评估油红O染色和苏木精复染原子核的脂肪形成的表型。
- 苏木复染原子核
注:在开始实验前准备染料混合物。- 准备5%的苏木解决方案称为Emallume Carazzi 39。储存在4℃的溶液中。添加Emallume Carazzi仅为2分钟。用洗井ULTrapure卫生署2 O.
- CFU试验
注:本实验必须以一式三份进行。- 板操作系统的CSCs 100 25mm培养皿以450细胞/ cm 2在CFUM的细胞密度。孵育在37℃,5%CO 2培养箱将细胞4周。每周刷新两次CFUM。
- 染色用甲苯胺蓝的CFU。计数使用倒置显微镜的有色菌落。根据下列公式计算CFU效率:(形成的菌落数/接种细胞数目)×100。
- ALDH活性分析
注:ALDH活性已在两个OS-CSC线和在有限成纤维细胞系,将其作为阴性对照使用的ALDH活性比色测定试剂盒进行评价。该试剂盒量化由吸光度读数450nm处的ALDH酶活性。所有的测试都在一式三份被执行。- 由胰酶消化分解单层细胞培养(参见2.2节)。在400 xg离心沉淀细胞离心5分钟。按照制造商的协议。
- 流式细胞分析:
注:单细胞悬浮液需要进行流式细胞术样品最优染色。单细胞悬浮液必须准备为每个要测试的抗体。由胰酶消化分解单层细胞培养(参见2.2节)。- 放置细胞悬液在一个锥形管,在分离缓冲液的适当体积执行使用Bürker重悬细胞计数计数室,离心细胞以400 xg离心并以1×10 5个细胞的最终菌体浓度,以获得一个细胞悬浮液/毫升。
- 离心细胞悬浮液在4℃5分钟。弃上清,洗涤与分离液沉淀。重复此步骤两次。
- 染色细胞MSÇ标记( 即 CD44,CD105和STRO-1)40。
- 在流式细胞仪分析染色阳性细胞悬浮液。 1天之内分析样品标记。在4℃直至分析孵育这些样品。
- RT-PCR法
- 提取和分离RNA
- 加入1ml裂解试剂到操作系统的CSCs的细胞冷冻包装的样品和吹打沉淀上下数次直接裂解细胞在管中。
- 离心样品以12,000 xg离心在4℃下1分钟。轻轻地取出上清。将上清转移到新的管中,加入200μL的氯仿,并牢固地盖住管。摇动该管剧烈持续15秒和孵育所述样品在RT 5分钟。
- 离心样品以12,000 xg离心在4℃下15分钟。该混合物分离成三个不同的阶段。 RNA是只在无色上层水相。
- 作为PArticularly小心,只取出水相,这相转移到新的管与RNA分离进行。加入500微升异丙醇,以含有水相的管。用手轻轻摇动管。孵育在RT样品10分钟。离心样品以12,000 xg离心在4℃下10分钟。
注:样品离心后,有可能看到的RNA,其形成在侧面和在管底部的凝胶状颗粒。 - 从管中取出上清液,小心留下底部的RNA的沉淀。 1毫升75%的乙醇添加到管中。涡流管用手几秒钟,然后离心管中,在7500 xg离心在4℃下5分钟。
- 丢弃乙醇和空气干燥RNA沉淀。吹打溶液上下数次 - (50μL10)当颗粒是干的,重悬在无RNA酶的水RNA沉淀。
- 确定RNA的由MEAS的产率和纯度uring在260nm用分光光度计280nm处的吸光度。评价标准的1%琼脂糖凝胶的总RNA的完整性。储存在-80℃的RNA。
- 反向聚合酶链反应
- 合成使用反转录试剂盒在500纳克RNA样品的第一链cDNA。在冰上解冻RNA样品和解冻包含在RT试剂盒中的必要的解决办法。继续进行,以合成下述制造商的协议的cDNA。
- 半定量逆转录聚合酶链反应(RT-PCR)技术
- 执行使用1μL的cDNA的各样品中的24微升的最终反应体积模板所有的PCR。使用表1中列出的引物序列为Nanog的10月3/4,SOX2和CD133的基因的扩增。
- 分离通过1.8%琼脂糖凝胶电泳和染色的RT-PCR产物用溴化乙锭。在紫外光下ILLUM照片萌发的。
- 提取和分离RNA
结果
通过针穿刺或手术切除肿瘤的一小部分的获得的OS样品( 图1A,B)准许只有一个OSA的隔离如果治疗精确地说,如( 图2A,B),在协议部分中描述。不幸的是,从活检分离的细胞的数量是低,与来自30的输出范围 - 50%。输出取决于类型和活检( 图5A,B)的尺寸。这些细胞必须精确处理。因此,约一个月是必要的原代培养,以100毫米的培养皿达到汇合。在此时间后,OSA从两个OS样品标记得到OSA5和OSA6( 图6A,B)。然后,有必要传代培养的初级细胞系,以获得细胞的足够数目来执行表征分析和冷冻保存的细胞林上课。在传代培养的第 3代,当两个OSA初级细胞系达到汇合,它们被镀在用于sarcosphere测定6孔超低附着板。使用这种类型的板,因为它可以使我们保持在悬浮状态的细胞,以防止附着介导的分化的干细胞,以防止锚定依赖性细胞分裂,最后,以减少附着于基板。因此,它们的使用使我们能够创建用于癌细胞紧张状况,这是必要的肿瘤干细胞的选择。在测定开始后24小时,细胞显得彼此( 图7)隔离。监测测定的进展的7天之后,小球状的菌落已开始形成并是可见的( 图8)。在28天,都形成在每个孔中的几个大球形菌落可以观察到( 图9A,B)。经过sarcospheres甲肝Ë被用于28天培养,这些大球形菌落可被分离。 图10示出了用于从6孔超低附着板分离sarcospheres和粘附条件下reculturing它们的步骤。 图11示出了分离后的浮动球形菌落。镀在正常安装板的大球形殖民地显示隔离后贴壁扩张( 图12A,B)。从单个sarcospheres扩大细胞是可能的癌细胞与干细胞样表型。因此,分离后,很可能获得OS-肿瘤干细胞。这些细胞被命名为OSA5-的CSCs和OSA6-的CSCs( 图13A,B)。
在这一点上,有必要与所获得的两个OS-CSC线干细胞样表型的表征来进行,如上所述。对于干细胞样表型WER的表征的分析E对于每个OS-CSC线sarcospheres分离后亚文化的第 4通道上执行。两个细胞系,OSA5-的CSCs和OSA6-的CSCs,显示出对表面的MSC标记强阳性(CD105和CD44)( 图14A,B和图15A,B),而它们显示出对表面的MSC标记中度阳性STRO- 1(图16A,B)。我们的观察已通过与商业和分化结肠癌细胞系HCT8( 图14C,图15C,图16C)中得到否定的结果证实。观察到完全没有在HCT8细胞系,这些表面标志物特异性和非特异性染色。
为了评估这两个操作系统的肿瘤干细胞的表型的MSC,我们还进行了流式细胞分析。无论是OS-CSC线表达高水平的CD44和CD105的。然而,在这两种细胞系的细胞中,只有1.14%表示的Stro-1。因此,该重新SULT证实的Stro-1的适度存在通过免疫荧光染色所证明。与此相反,OSA5-的CSCs的99.62%表达CD44和这些细胞的87.38%表达CD105;在OSA6-的CSCs的99.88%,在表达CD44和这些细胞的95.79%表示CD105。此外,这两种细胞系是CD45 - 。
我们评估了3 ESC标志物(Nanog的10月3/4,Sox2的)和CD133基因,另一个的CSCs标记,通过RT-PCR的表达。我们注意到,所有这些基因在两个OS-CSC线( 图17)表达。成脂和成骨分化的实验表明这两个孤立的OSA-CSC线分化为成骨细胞( 图18A - D和 图19A - D)的能力,并为脂肪细胞( 图20A - D)。
此外,CFU一个 SSAY( 图21)显示出的克隆效率良好的速率,与OSA5-的CSCs 13%,对于OSA6-CSC 14%。最近的几项研究表明,高水平的ALDH活性的是各种癌症的特征。此参数可作为癌症干细胞标记物,并与预后不良相关。所述ALDH活性测定表明,两个OS-CSC线具有高水平的ALDH活性( 图22)的,而在被用作该测定的阴性对照的成纤维细胞系的低量化限观察ALDH活性。

图1. OS活检样品的例子。(A)。通过针吸活检获得的样本。 (B)。通过手术切除肿瘤的一部分的获得活检样本。884 / 53884fig1large.jpg"目标="_空白">点击此处查看该图的放大版本。

图2.在OS样品的机械解体。(A)中使用佩里镊子和刺血针的样品的碎片。悬浮在CM(箭头所示),(B)片段。 请点击此处查看该图的放大版本。
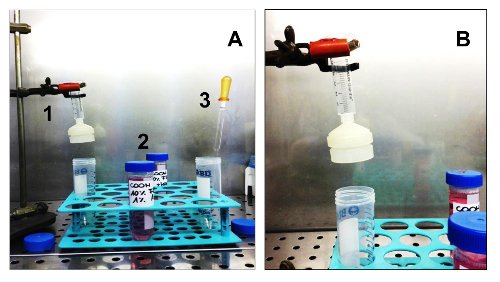
图3.设备及消耗品的所需来隔离Sarcospheres。(A)。所需的所有细胞分离的设备。 1.无菌注射器用无菌膜过滤持有人; 2.两个不同的媒体:通用汽车第二SCGM; 3.无菌玻璃巴斯德吸管。装配在支撑注射器,用膜过滤器架的(B)的细节。 请点击此处查看该图的放大版本。

图4.过滤股。装配过滤单元(A)所需的几个组件(净滤波器由箭头指示)。净器(B)的40微米的网眼(1个网眼由箭头指示)的相位差观察。原始放大倍数:10X。该过滤单元组装(C - D)。过滤装置灭菌(E)。 请点击此处查看大图已经这个数字rsion。
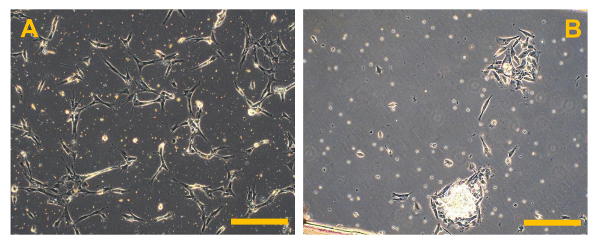
图5.传统的操作系统的原代细胞培养,高品位的操作系统原代细胞培养的相衬观察。在(A),几个明亮的碎骨是可见的,而在(B),几个小圆角和浮动红细胞都存在。原始放大倍数:10X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
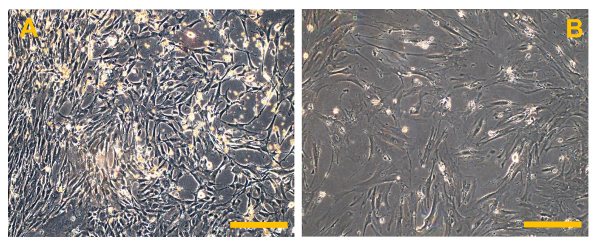
图6.传统的有限骨肉瘤细胞系(OSA)。(A)OSA5和(B)OSA6。观察相衬。原始放大倍数:10X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
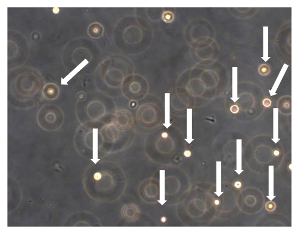
图7. OSA5和OSA6的Sarcosphere测定从测定开始24小时后,将细胞浮,并从彼此分离的(细胞通过箭头表示)。观察在相衬。原始放大倍数:20X 请点击此处查看该图的放大版本。
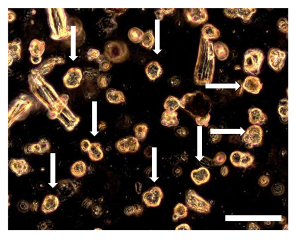
图8. OSA5的Sarcosphere分析和OSA6 7 D. 7天进入实验,几个小spherica由单个细胞包围升菌落可以观察到。该sarcospheres(一些sarcospheres由箭头表示)出现浮在中期或小幅回落落户到井的底部。观察在相衬。原始放大倍数:20X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
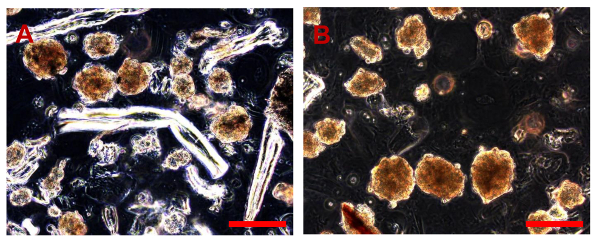
图9. OSA5的Sarcosphere测定和OSA6 28 D. 28天之后,几个大琥珀sarcospheres在每个孔中的每个OSA细胞系,OSA5(A)和OSA6(B)的板的观察。酒吧尺寸:100微米。 请点击此处查看该图的放大版本。

图10.经文为Sarcospheres的分离从6孔超低附着板用于分离sarcospheres的步骤和粘合条件下的reculturing示(A)中所需要的隔离的所有设备。: 1.一个6孔超低板在每口井,2注射器网过滤器支架,3吸管,4 1000μL无菌针头,5。2无菌镊子佩里,6 2种不同的培养基形成sarcospheres 7.无菌巴斯德吸管8培养皿。 sarcospheres( 二)集合。中所包含的每孔培养基用移液管,用无菌1000微升尖端收集。 (℃)收集在注射器中的悬浮液中。所收集的悬浮液转移到注射器使用开始自然过滤过程膜过滤器支架。 (D) 自然过滤。 (E)的拆卸从注射器的膜过滤器保持器。所有的悬浮液过滤后,净过滤器保持器被拆开并放在培养皿; (F) 拆卸膜过滤器支架。 Sarcospheres被包含在网过滤器保持器的净过滤器的孔,因此它们必须使用佩里镊子被释放。 (G,H) 从膜过滤sarcospheres的去除效果。 请点击此处查看该图的放大版本。
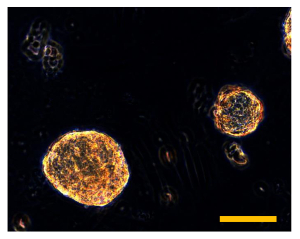
图11. Sarcosphere隔离。隔离sarcospheres漂浮在60毫米培养皿中。观察在相衬。原始放大倍数:40X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
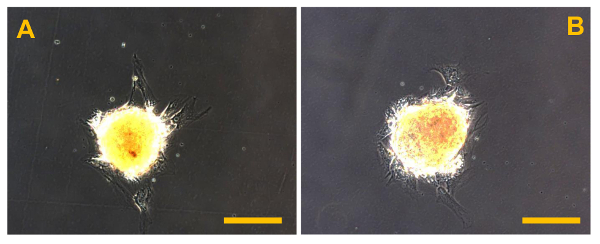
图12. Sarcosphere从OSA5(A)和OSA6(B)的下列再引入和在单层粘附的条件下,在48小时后隔离reculturing细胞系在贴壁膨胀的开始分离。Sarcospheres后 。观察在相衬。原始放大倍数:20X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
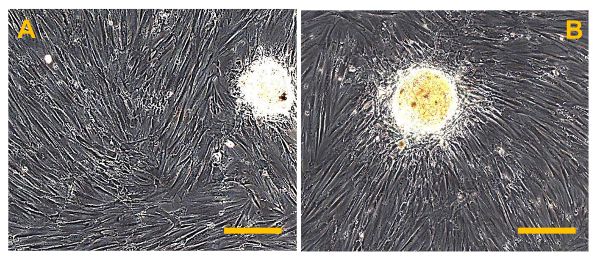
图13. 在Sarcospheres 7天隔离后 。从OSA5(A)和OSA6(B)的细胞系Sarcospheres表明粘附扩张以下再引入和在单层粘附的条件下,在7天的隔离后reculturing。观察在相衬。原始放大倍数:20X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
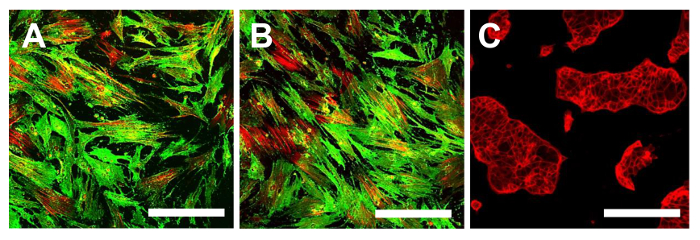
图14.免疫荧光染色为CD105。在OSA-CSC线免疫荧光染色为CD105 OSA5-的CSCs(A)和OSA6-的CSCs(B)和在连续细胞系HCT8(℃),将其用作阴性对照。激光共聚焦显微镜常规颜色:绿色CD105和红色的骨架。原始放大倍数:10X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
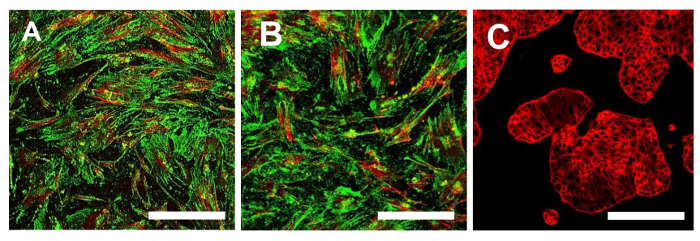
图15.免疫荧光染色为CD44。在OSA-CSC线免疫荧光染色为CD44 OSA5-的CSCs(A)和OSA6-的CSCs(B)和在连续细胞系HCT8(℃),将其用作阴性对照。 LSCM传统颜色:绿色,CD44和红色的骨架。原始放大倍数:10X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
- 页面内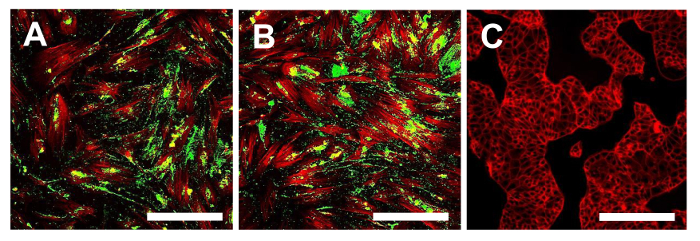
图16. Stro1。免疫荧光染色的免疫荧光染色为STRO-1在OSA-CSC线OSA5-的CSCs(A)和OSA6-的CSCs(B)和在连续细胞系HCT8(℃),将其用作负极控制。 LSCM传统颜色:绿色STRO-1和红色骨架。原始放大倍数:10X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
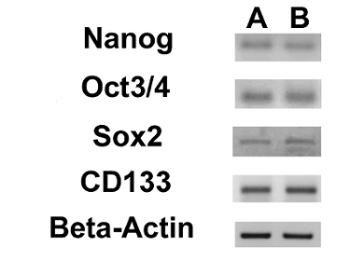
图17.核ESC标记和的CD133基因,RT-PCR检测显示Nanog的10月3/4,Sox2的和CD133在OSA5-CSCs的(A)和OSA6-的CSCs(表达表达 B)。 请点击此处查看该图的放大版本。
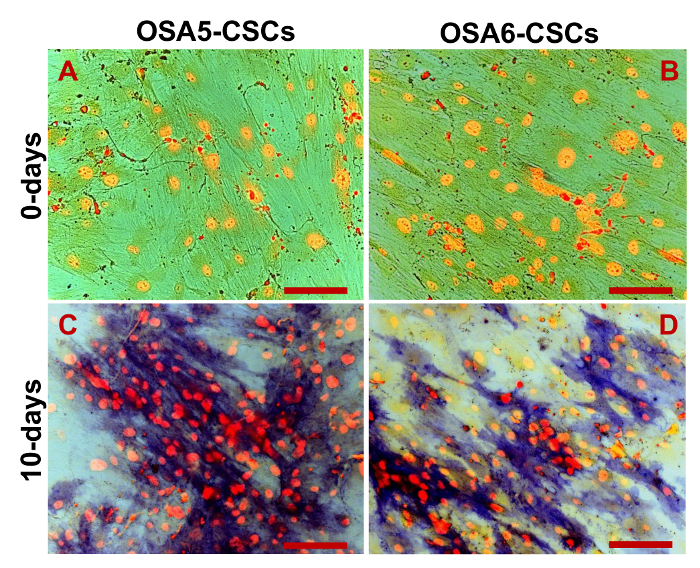
图18.成骨分化分析- ALP在0 D(A,B)和后使用固蓝BB的ALP通过细胞化学染色所确定的诱导10天(C,D),成骨分化。在蓝,ALP +细胞;在红色,细胞核复染色用碘化丙锭。综合观察在明和荧光。原始放大倍数:20X。酒吧尺寸:100微米请点击此处查看该图的放大版本。

图19.成骨分化分析- HA成骨在0天分化(A,B)和后通过细胞化学染色与茜素红S.确定羟基磷灰石(HA)诱导的20天(C,D),这些细胞在对比HA的蓝/灰色,颗粒感存款被染成红色。观察在相衬。原始放大倍数:40X。酒吧尺寸:100微米请点击此处查看该图的放大版本。
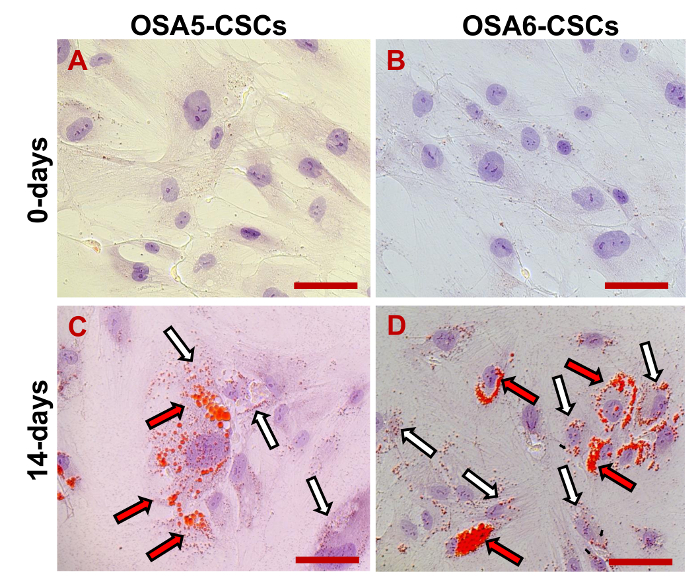
图20.成脂诱导分化含量在 0 D(A,B)和后14 D(C,D)成脂分化诱导由细胞色素决定emical染色油红O.在红,类脂囊泡(较大的囊泡是由黑/红箭头指示;小囊泡由白色/黑色箭头);蓝色/紫色,细胞核用苏木染。观察明。原始放大倍数:40X。酒吧尺寸:100μM 请点击此处查看该图的放大版本。
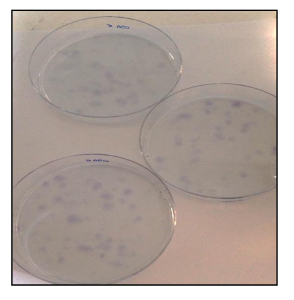
图21. CFU试验。用甲苯胺蓝染色OSA-CSC线CFU检测。 请点击此处查看该图的放大版本。
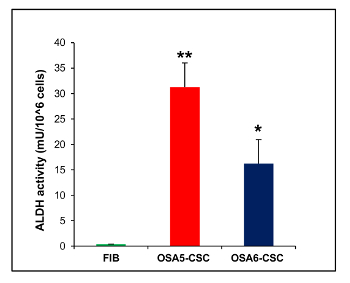 /> 图22. ALDH活性测定该 ALDH比色法检测高水平两个OS-CSC线,OSA5,肿瘤干细胞和OSA6-CSCs的ALDH活性,而法检测缺席本次活动在有限的分化细胞系成纤维细胞,纤维蛋白原。误差棒:SD。 **:P <0.001对FIB; *:P <0.01 VS FIB 请点击此处查看该图的放大版本。
/> 图22. ALDH活性测定该 ALDH比色法检测高水平两个OS-CSC线,OSA5,肿瘤干细胞和OSA6-CSCs的ALDH活性,而法检测缺席本次活动在有限的分化细胞系成纤维细胞,纤维蛋白原。误差棒:SD。 **:P <0.001对FIB; *:P <0.01 VS FIB 请点击此处查看该图的放大版本。
| 基因 | 寡核苷酸 | 序列(5¹-3¹) | 扩增子的大小(bp)的 | Tₐ(℃) | |
| NANOG | 正向引物反向引物 | 87 | 60 | ||
| 十月3/2 | 正向引物反向引物 | GGGAGGAGCTAGGGAAAGA TCCTTCCTTAGTGAATGAAGAACT | 77 | 60 | |
| SOX2 | 正向引物反向引物 | TGCAGTACAACTCCATGACC GGACTTGACCACCGAACC | 125 | 55 | |
| CD133 | 正向引物反向引物 | CCAGAAGCCGGGTCATAAAT ATTCACTCAAGGCACCATCC | 127 | 56 | |
| BP,碱基对扩增子的大小;Tₐ,退火温度 | |||||
表1详细引物序列对的Nanog,十月3/4,Sox2的和CD133与扩增子的大小和退火温度的列表
讨论
的CSCs具有几个特性,允许在肿瘤散装这个特定的蜂窝子集的标识。上的这些特征,例如获得性抗性细胞毒性化疗药物为ATP结合盒多药转运蛋白28,32,33,或用于解毒酶如ALDH 32的表达的上调的表达,为表达的基础特定表面标记,如CD133,CD44,CD34,CD90,和其他30,34,35,41,几种不同的方法来分离的CSCs已经开发了42-44。这些技术之一是球形成测定法,它是基于的CSCs的非贴壁条件下生长的能力。
组织干细胞和肿瘤干细胞的形成球体的能力中,第一次研究由Reynolds等37描述对神经干细胞的鉴定。随后,吉布斯等人。我们38编这些研究,开始从实体瘤中分离的CSCs,特别是从骨肉瘤。我们已经决定使用由吉布斯等人出的球形成测定方法。从常规活检OS OSA获得的细胞系的CSC隔离。我们适于原来的方法来改善该测定法的结果,并促进其用于其它癌细胞系的再现性。参照建立球体形成实验中,我们证实了电镀40,000个细胞/孔为在测定开始时保持在隔离细胞好的做法。这招是非常重要的,以避免球状菌落从蜂窝聚集和不能从一个单一的CSC的特定和独特的能力非粘附的条件下生长,并形成一个球面菌落发起的可能性。这种能力是该测定的一个特别关键点。
我们还证明,要获得的球形成一个良好率,这是足以作为在原始方法中描述每天刷新的生长因子等份每3天,不。在这项研究中,我们还建立并广泛描述的好方法分离时非粘附的条件下培养所形成的球形菌落。这一步骤是在该测定中非常重要,因为这是非常重要的,试图尽可能多的球体尽可能在每个中形成的的隔离良好而不损坏它们。同样重要的是隔离仅球体而不是单细胞,这可能留在悬浮液用于测定的持续时间。为了克服这些关键点,我们已经开发出一种特殊的分离方法,其中,如上图所示,给了CSC隔离了良好的效果。显然,是并非所有所形成的球体可以回收的可能性,但损失百分比非常低。事实上,我们也有可能使用过滤器40微米毛孔隔离球,他们会变大(表后编约100 - 200个细胞)。
这种隔离停止球体形成,但是允许待过滤的单细胞,甲基纤维素残基的一部分,并且最小球体。这消除由彻底过滤在协议中所述进行。
此外,通过40微米网状具有最小球面菌落随之损失最大球形菌落的选择允许一个带,以形成球形菌落最高容量并以更大的干性选择的CSCs。所有这些修改进行,以提高该测定,并帮助研究人员在研究的CSCs理解和重现球体形成测定的原始方法的最关键的步骤。
在体外方法对分离肿瘤干细胞研究,这项研究的目的是显示这个球改编形成实验如何是一个很好的方法,从分离肿瘤干细胞OSA细胞系。到原来的方法和详细隔离技术改编所述提高其疗效。在很短的时间,可以得到良好的数目的CSCs的并用于多种实验。因此,能够迅速地确认干细胞样表型,尤其是,要研究双茎样表型表征操作系统的CSCs。因此,这个修改后的分析可能是孤立肿瘤干细胞和研究其生物学一个很好的技术。在未来,该方法中,与另外的修改,也可用于分离从由稀有实体肿瘤的活组织检查获得的其他有限癌细胞系的CSCs。
隔离罕见实体瘤,如OS的CSCs的可能性,不仅允许左右这个特定癌症研究改善,但也延伸到不同类型的癌症,开发其隔离更好方法的研究和对生物学的未来研究这个重要的细胞子集。因此,在我们在这项研究中所做的那样,它通过CSC生物学的研究,以改善CSC隔离的方法中,以找到分子靶和显影针对这个特定的蜂窝子集的非常具体的抗癌疗法,这可能是负责的最终目标是非常重要的维持原发肿瘤,其复发的发展,和转移的若干器官的起源。 CSC生物学的研究也是寻找治疗方法,可能是癌症,如操作系统,为此,新辅助治疗后的存活率仍然非常差的固化精辟重要。
披露声明
The authors declare that they have no competing financial interest.
致谢
This study was supported by ITT (Istituto Toscano Tumori) Grant Proposal 2010.
材料
| Name | Company | Catalog Number | Comments |
| Dulbecco's Phosphate Buffered Saline with Ca2+ and Mg2+ (DPBS) | LONZA | BE17-513F | _ |
| Dulbecco's Phosphate Buffered Saline without Ca2+ and Mg2+ (DPBS) | LONZA | BE17-512F | _ |
| Porcine Trypsin 1:250 | BD Difco | 215310 | Solvent: DPBS. Stock concentration: Powder |
| Ethylenediamine tetraacetic acid disodium salt dihydrate(EDTA) | Sigma-Aldrich | E4884 | Solvent: DPBS. Stock concentration: Powder |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C0130 | Solvent: Buffer Solution, pH 7.4. Stock concentration: Powder |
| Dimethyl sulphoxide (DMSO) | BDH Chemicals-VWR | 10323 | _ |
| Nutrient Mixture F-12 Ham | Sigma-Aldrich | F6636 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| 2-Phospho-L-ascorbic acid trisodium salt | Sigma-Aldrich | 49752 | Solvent: DPBS. Stock concentration: 5 mg/mL |
| β-Glycerol phosphate disodium salt pentahydrate | Sigma-Aldrich | 50020 | Solvent: DPBS. Stock concentration: 1 M |
| Insulin. Human Recombinant | Sigma-Aldrich | 91077 | Solvent: NaOH 0.1 M. Stock concentration: 10 mM |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I5879 | Solvent: DMSO. Stock concentration: 500 mM |
| Indomethacin | Sigma-Aldrich | I7378 | Solvent: DMSO. Stock concentration: 200 mM |
| Dexamethasone | Sigma-Aldrich | D4902 | Solvent: DMSO. Stock concentration: 1 mM / 100 µM. Store in liquid nitrogen to maintain the biological activity |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | _ |
| Fetal Bovine Serum South America | EUROCLONE | ECS0180L | _ |
| Penicillin-Streptomycin (PEN-STREP) 10,000 U/mL | LONZA | DE17-602E | _ |
| Methyl cellulose | Sigma-Aldrich | 274429 | Solvent: Ultrapure dH2O. Stock concentration: 2% |
| Putresceine dihydrochloride | Sigma-Aldrich | P5780 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| apo-Transferrin | Sigma-Aldrich | T-1147 | Solvent: DPBS. Stock concentration: 25 mg/mL |
| Human Epidermal Growth Factor (EFGF) | Sigma-Aldrich | E5036 | Solvent: DPBS pH 7.4. Stock concentration: 10 µg/mL |
| Fibroblast Growth Factor-Basic Human | Sigma-Aldrich | F0291 | Solvent: DPBS + 0.2% BSA. Stock concentration: 25 µg/mL |
| Selenous Acid | Sigma-Aldrich | 211176 | Solvent: DPBS. Stock concentration: 30 mM |
| Progesterone | Sigma-Aldrich | P8783 | Solvent: ETOH. Stock concentration: 10 mM |
| Toluidine Blue O | Sigma-Aldrich | 198161 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Oil Red O | ICN Biochemicals | 155984 | Solvent: 2-Propanol. Stock concentration: Powder |
| Naphtol AS-MX Phosphate Disodium Salt | Sigma-Aldrich | N5000 | Solvent: DMSO. Stock concentration: Powder |
| Fast Blue BB Salt | Sigma-Aldrich | F3378 | Solvent: Tris HCL, pH 9.0. Stock concentration: Powder |
| Fast Red Violet LB Salt | Sigma-Aldrich | F3381 | Solvent: Tris HCL, pH 9.1. Stock concentration: Powder |
| Bovine Serum Albumin, Fraction V (BSA) | Sigma-Aldrich | A-4503 | Solvent: DPBS. Stock concentration: 2% |
| Alizarin Red S | ICN Biochemicals | 100375 | Solvent: Ultrapure dH2O. Stock concentration: Powder |
| Formaldehyde solution | Sigma-Aldrich | 533998 | 4% |
| Triton-100X | MERCK | 11869 | Solvent: DPBS. Stock concentration: 0.2%. Danger - Use only under chemical hood |
| Calcein | MERCK | 2315 | Solvent: DPBS . Stock concentration: 200 µg/mL |
| 2-Propanol | MERCK | 109634 | Danger - Use only under chemical hood |
| Ab-CD105 (Mouse monoclonal [SN6] to CD105 (FITC) | Abcam | ab11415 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD44 (Mouse monoclonal [F10-44-2] to CD44 (PE/Cy7®) ) | Abcam | ab46793 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD45 (Mouse monoclonal [MEM-28] to CD45 (PerCP)) | Abcam | ab65952 | Liquid. Application: Flow Cytometry (Flow Cyt) |
| Ab-CD105 (Human CD105 Purified Antibody) | Invitrogen | MHCD10500 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-CD44 (Anti-CD44 Antibody) | Abcam | EPR1013Y(ab51037) | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| Ab-Stro-1 (Mouse anti-STRO-1) | Invitrogen | 398401 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 488 (Anti-Rabbit IgG (Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L)) | Invitrogen | A-21206 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| FITC Anti-Mouse IG (FITC-Rabbit Anti Mouse IgG (H+L)) | Invitrogen | 61-6511 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Flow Cytometry (Flow Cyt) Immunofluorescence staining (IF) |
| Alexa Fluor 635 Phalloidin | Invitrogen | A34054 | Solvent: DPBS. Stock concentration: Lyophilized. Application: Immunofluorescence staining (IF) |
| AutoMACS™Running Buffer MACS Separation Buffer | Miltenyi | 130,091,221 | Liquid. Store at 4 °C |
| QIAzol®Lysis Reagent | QIAGEN | 79306 | Danger - Use only under chemical hood |
| QUANTITECT® Reverse Transcription Kit | QIAGEN | 205314 | _ |
| Chlorophorm | Sigma-Aldrich | C2432 | Liquid. Danger - Use only under chemical hood |
| Laminar flow hood | GELAIRE | BSB6A | _ |
| Chemical hood | ARREDI TECNICI Villa | Modello DYNAMICA | _ |
| Centrifuge | EPPENDORF | 5415R | _ |
| Laser Scanning Confocal Microscopy LSM 5109 Meta | ZEISS | _ | _ |
| iCycler PCR Thermalcycler | BIORAD | _ | _ |
| CyFlow®SPACE | (PARTEC) | _ | _ |
| Inverted Micrposcope Axiovert 200M | ZEISS | _ | _ |
| Freezing container , | Nalgene | _ | _ |
| Original Pipet-Aid | pbiBrand | _ | _ |
| Micropipettes | EPPENDORF | _ | _ |
| Glass Pasteur Pipette | SIGMA | _ | _ |
| VICTOR3™ | PERKIN ELMER | _ | _ |
| Conical tubes (15 and 50 mL) | BD FALCON | 352096 (for 15 mL) 352070 (for 50 mL) | _ |
| 24-Well Clear Flat Bottom TC-Treated Multiwell-Cell-Culture-Plate | BD FALCON | 353047 | _ |
| 6-Well Clear Flat Bottom Ultra Low Attachment Multiple-Well-Plates | CORNING | 3471 | _ |
| Serological pipettes (5 and 10 mL) | BD FALCON | 357543 (for 5 mL) 357551 (for 10mL) | _ |
| Syringe (5mL) | B|BRAUN | 4617053V | _ |
| Petri dish 100X20 mm | BD FALCON | 353003 | _ |
| Röhren Tubes (3.5 mL, 55x12mm, PS) | SARSTEDT | 55,484 | _ |
| Petri dish 60X15 mm | BD FALCON | 353004 | _ |
| Cryovials 1.5 mL | NALGENE | 5000-1020 | _ |
| Cell-Culture Flasks 25 cm² | BD FALCON | 353014 | _ |
| Nylon Net Filter, Hydrophilic | MERCK | NY4104700 | _ |
| Swinnex Filter Holder | MERCK | SX0002500 | _ |
| Perry tweezer | _ | _ | _ |
| Lancet | _ | _ | _ |
| Dounce | _ | _ | _ |
参考文献
- Reddick, R. L., Michelitch, H. J., Levine, A. M., Triche, T. J. Osteogenic sarcoma: a study of the ultrastructure. Cancer. 45 (1), 64-71 (1980).
- Gatta, G., et al. Childhood cancer survival trends in Europe: a EUROCARE Working Group study. J. Clin. Oncol. 23 (16), 3742-3751 (2005).
- Olstad, O. K., et al. Molecular heterogeneity in human osteosarcoma demonstrated by enriched mRNAs isolated by directional tag PCR subtraction cloning. Anticancer. Res. 23 (3B), 2201-2216 (2003).
- Geller, D. S., Gorlick, R. Osteosarcoma: a review of diagnosis, management, and treatment strategies. Clin Adv Hematol Oncol. 8 (10), 705-718 (2010).
- Tang, N., Song, W. X., Luo, J., Haydon, R. C., He, T. C. Osteosarcoma development and stem cell differentiation. Clin. Orthop. Relat. Res. 466 (9), 2114-2130 (2008).
- Kempf-Bielack, B., et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J. Clin. Oncol. 23 (3), 559-568 (2005).
- Meyers, P. A., et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J. Clin. Oncol. 23 (9), 2004-2011 (2005).
- Gorlick, R., et al. Biology of childhood osteogenic sarcoma and potential targets for therapeutic development: meeting summary. Clin. Cancer Res. 9 (15), 5442-5453 (2003).
- Hayden, J. B., Hoang, B. H. Osteosarcoma: basic science and clinical implications. Orthop. Clin. North Am. 37 (1), 1-7 (2006).
- Thomas, D., Kansara, M. Epigenetic modifications in osteogenic differentiation and transformation. J. Cell. Biochem. 98 (4), 757-769 (2006).
- Araki, N., et al. Involvement of the retinoblastoma gene in primary osteosarcomas and other bone and soft-tissue tumors. Clin. Orthop. Relat. Res. 270 (270), 271-277 (1991).
- Chou, A. J., Gorlick, R. Chemotherapy resistance in osteosarcoma: current challenges and future directions. Expert. Rev. Anticancer Ther. 6 (7), 1075-1085 (2006).
- Arndt, C. A. S., Crist, W. M. Common musculoskeletal tumorsof childhood and adolescence. N. Engl. J. Med. 341 (5), 342-352 (1999).
- Longhi, A., Errani, C., De Paolis, M., Mercuri, M., Bacci, G. Primary bone osteosarcoma in the pediatric age: state of the art. Cancer. Treat. Rev. 32 (6), 423-436 (2006).
- Bacci, G., et al. Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at the istituto ortopedico rizzoli according to the istituto ortopedico rizzoli/osteosarcoma-2 protocol: an updated report. J. Clin. Oncol. 18 (24), 4016-4027 (2000).
- Clarke, M. F., et al. Cancer stem cells-perspectives on current status and future directions: AACR workshop on cancer stem cells. Cancer. Res. 66 (19), 9339-9344 (2006).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367 (6464), 645-648 (1994).
- Bonnet, D., Dick, J. E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med. 3 (7), 730-737 (1997).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumors: accumulating evidence and unresolved questions. Nat. Rev. Cancer. 8 (10), 755-768 (2008).
- Bapat, S. A. Evolution of cancer stem cells. Semin. Cancer Biol. 17 (3), 204-213 (2007).
- Rubio, D., et al. Spontaneous human adult stem cell transformation. Cancer. Res. 65 (8), 3035-3039 (2005).
- Burns, J. S., et al. Tumorigenic heterogeneity in cancer stem cells evolved from long-term cultures of telomerase-immortalized human mesenchymal stem cells. Cancer. Res. 65 (8), 3126-3135 (2005).
- Zhang, M., Rosen, J. M. Stem cells in the etiology and treatment of cancer. Curr. Opin. Genet. Dev. 16 (1), 60-64 (2006).
- Li, Y., et al. Evidence that transgenes encoding components of the Wnt signaling pathway preferentially induce mammary cancers from progenitor cells. Proc. Natl Acad. Sci. USA. 100 (26), 15853-15858 (2003).
- Sell, S. Cellular origin of cancer: dedifferentiation or stem cell maturation arrest?. Environ Health Perspect. 101 (Suppl 5), 15-26 (1993).
- Wernig, M., et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448 (7151), 318-324 (2007).
- Niwa, H., Miyazaki, J., Smith, A. G. Quantitative expression of oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat. Genet. 24 (4), 372-376 (2000).
- Hochedlinger, K., Jaenisch, R. Nuclear reprogramming and pluripotency. Nature. 441 (7097), 1061-1067 (2006).
- Dean, M., Fojo, T., Bates, S. Tumor stem cells and drug resistance. Nat. Rev. Cancer. 5 (4), 275-284 (2005).
- Ma, S., Lee, T. K., Zheng, B. J., Chan, K. W., Guan, X. Y. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway. Oncogene. 27 (12), 1749-1758 (2008).
- Wu, C., et al. Side population cells isolated from mesenchymal neoplasms have tumor initiating potential. Cancer. Res. 67 (17), 8216-8222 (2007).
- Ma, I., Allan, A. L. The role of human aldehyde dehydrogenase in normal and cancer stem cells. Stem. Cell. Rev. 7 (2), 292-306 (2011).
- Awad, O., et al. High ALDH activity identifies chemotherapy-resistant Ewing's sarcoma stem cells that retain sensitivity to EWS-FLI1 inhibition. PLoS One. 5 (11), e13943 (2010).
- Fujii, H., et al. Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines. Int. J. Oncol. 34 (5), 1381-1386 (2009).
- Di Fiore, R., et al. Genetic and molecular characterization of the human osteosarcoma 3AB-OS cancer stem cell line: a possible model for studying osteosarcoma origin and stemness. J. Cell. Physiol. 228 (6), 1189-1201 (2013).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonicprogenitor cell produces neurons and astrocytes. J. Neurosci. 12 (11), 4565-4574 (1992).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Gibbs, C. P., et al. Stem-like cells in bone sarcomas: implications for tumorigenesis. Neoplasia. 7 (11), 967-976 (2005).
- Beccari, N., Mazzi, V. . Manuale di tecnica microscopic. Casa Editrice Dr. Francesco Vallardi Società Editrice Libraria. , 99-100 (1966).
- Majumdar, M. K., Thiede, M. A., Mosca, J. D., Moorman, M., Gerson, S. L. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J. Cell. Physiol. 176 (1), 57-66 (1998).
- Tirino, V., et al. Human primary bone sarcomas contain CD133+ cancer stem cells displaying high tumorigenicity in vivo. FASEB J. 25 (6), 2022-2030 (2011).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. FASEB J. 27 (1), 13-24 (2013).
- Martins-Neves, S. R., et al. Therapeutic implications of an enriched cancer stem-like cell population in a human osteosarcoma cell line. BMC Cancer. 12 (1), 139 (2012).
- Tang, Q. L., et al. Enrichment of osteosarcoma stem cells by chemotherapy. Chin. J. Cancer. 30 (6), 426-432 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。