Method Article
Строительство Клеточная нейромедиатор Флуоресцентные Engineered Репортеры (CNiFERs) для оптического детектирования нейротрансмиттеров
В этой статье
Резюме
Мы представляем протокол для создания на основе клеток нейромедиатором флуоресцентных сконструированные репортеров (CNiFERs) для оптического детектирования объемного высвобождения нейромедиаторов.
Аннотация
Клеточная нейромедиатор флуоресцентных сконструированные репортеры (CNiFERs) обеспечивают новый инструмент для нейробиологов , чтобы оптически обнаружить высвобождение нейротрансмиттеров в головном мозге в естественных условиях. Конкретный CNiFER создается из человеческой эмбриональной клетки почки , которые стабильно экспрессирует специфический G-белком рецептор, который соединен с G Q / 11 г белков и лобзиком на основе Ca 2+ -detector, TN-XXL. Активация рецептора приводит к увеличению сигнала разъедать. CNiFERs имеют чувствительность нм и временную характеристику секунды , потому что клон CNiFER использует нативный рецептор для определенного нейротрансмиттера, например, D2R для дофамина. CNiFERs непосредственно имплантировали в мозг, что позволяет им чувствовать высвобождение нейромедиаторов с пространственным разрешением менее ста мкм, что делает их идеальными для измерения объема передачи в естественных условиях. CNiFERs также могут быть использованы для скрининга других препаратов для потенциального перекрестной реактивности в VIVO. Недавно мы расширили семейство CNiFERs включить GPCRs , что пара к G I / O G белков. CNiFERs доступны для обнаружения ацетилхолин (АХ), допамин (DA) и норэпинефрина (NE). Принимая во внимание, что любой GPCR может быть использован для создания романа CNiFER и что есть примерно 800 GPCRs в геноме человека, мы опишем здесь общую процедуру разработки, реализовать и протестировать любой тип CNiFER.
Введение
Для того, чтобы полностью понять , как нейроны общаются в головном мозге, необходимо иметь метод измерения высвобождение нейротрансмиттеров в естественных условиях. Есть несколько хорошо зарекомендовавшие себя методы измерения нейротрансмиттеров в естественных условиях. Одно из наиболее часто используемым методом является микродиализ, в котором полая игла вставлена в мозг и небольшой объем цереброспинальной жидкости собирают и анализируют с помощью высокоэффективной жидкостной хроматографии с электрохимическим детектированием и 1. Микродиализ имеет пространственное разрешение порядка нескольких диаметров зонда, например, ~ 0,5 мм для зондового диаметром 200 мкм. Временное разрешение этого метода, однако, является медленным из - за интервалами между измерениями , которые обычно длятся ~ 5 минут или дольше 1. Кроме того, анализы не производятся в режиме реального времени. Другой метод является быстрое сканирование циклической вольтамперометрии (FSCV), которая использует углеродного волокна зонд, который вставляют в мозг. FSCV имеет отличную темпоральная разрешение (субсекундных), высокая чувствительность (нмоль) и пространственное разрешение с зондами диаметром от 5 до 30 мкм. Тем не менее, FSCV ограничивается передатчиками , которые производят характерное окисление и профиль снижения питание подано на потенциометрического датчика углерода 2.
Третий способ для измерения нейротрансмиттеры непосредственно через генетически закодированы нейромедиаторов (NT) биосенсоров 3. С помощью этого метода, слитый белок создается , который содержит лиганд-связывающий домен для передатчика , соединенного с флуоресцентного резонансного переноса энергии (FRET) основе пары флуорофоров 4 или перестановкой GFP 5. В отличие от предыдущих двух методов, эти биосенсоры генетически закодированы и экспрессируется на поверхности клетки-хозяина, такой как нейрон, через получения трансгенных животных или остро с использованием вирусных агентов, чтобы инфицировать клетки. На сегодняшний день генетически кодируемые биосенсоры были разработаны только для detectinг глутамата и ГАМК 3-5. Ограничения с помощью этих методик были низкая чувствительность, в диапазоне нМ, и невозможность расширить обнаружения для большого числа передатчиков, например, классических нейромедиаторов, нейропептидов и нейромодуляторов, которые передают сигналы посредством G-белками (GPCR , ). На самом деле, существует около 800 GPCRs в геноме человека.
Для устранения этих недостатков, мы разработали инновационный инструмент для оптического высвобождения мера любого нейротрансмиттера, который сигнализирует через GPCR. CNiFERs ( на основе клеток нейромедиатором флуоресцентных сконструированные репортеры) являются клоновых клетки НЕК293 , сконструированные для экспрессии конкретного GPCR , что при стимуляции, вызывает увеличение внутриклеточного [Са 2+] , который определяется генетически кодируемой FRET основе датчика Ca 2+, TN-XXL. Таким образом, преобразование CNiFERs нейромедиатора связывание рецептора в изменение флуоресценции, что обеспечивает оптическую р прямой и в режиме реального времениСвинец-из местной активности нейромедиаторов. Используя нативный рецептор для данного нейромедиатора, CNiFERs сохраняют химическую специфичность, сродство и временной динамики эндогенно выраженных рецепторов. На сегодняшний день мы создали три типа CNiFERs, один для обнаружения ацетилхолин с помощью рецептора M1, один для обнаружения допамина используя рецептор D2, и один для обнаружения норадреналина с использованием 6,7 - рецептора α1a. Технология CNiFER легко расширяемая и масштабируемая, что делает его доступным для любого типа GPCR. В этой статье Jove, мы опишем и проиллюстрировать методологию разработки, реализации и испытания в естественных условиях CNiFERs для любого применения.
протокол
Все процедуры на животных, проведенные в этом исследовании, в соответствии с институциональными уходу за животными и рекомендациями по использованию комитета (IACUC), и были одобрены IACUCs на Икан школы медицины на горе Синай и в Университете Калифорнии, Сан-Диего.
1. Сформировать GPCR-экспрессирующих Лентивирус для преобразования НЕК293
- Получение кДНК для конкретного GPCR из коммерческих источников, например, cdna.org. В качестве альтернативы, амплификации гена GPCR из библиотеки кДНК с помощью ПЦР. Получают лентивирусом экспрессирующих вектора, такие как PCDH-CMV-MCS-EF1-Puro (PCDH). Используйте этот вектор для размножения ДНК, а также для создания лентивирус.
- Клонирование кДНК GPCR в лентивирусов экспрессирующих вектора с помощью ПЦР. См Лоренц 8 Подробную информацию о ПЦР субклонирования.
- Расширить и очистить GPCR-PCDH ДНК с использованием '' макси комплект приготовительную эндотоксина в соответствии с инструкциями изготовителя. Убедитесь, что GPCR кДНК субклонировали в PCDH является mutation-бесплатно путем секвенирования ДНК.
Примечание: Перед подачей ДНК для производства вируса, переваривать аликвоты с соответствующим ферментом рестрикции, чтобы подтвердить размер вставки и чистоты ДНК. - Сформировать лентивирус с использованием основного объекта вируса, например один в Институте Солка, Университет Пенн., Или Университет Северной Каролины и т.д., или создавать в доме 9. Используйте приблизительно 25 мкг (> 1 мкг / мкл) эндотоксинов ДНК для трансфекции клеток НЕК в T75 колбу. Убедитесь , что ДНК имеет высокую чистоту, имеет поглощение соотношение (260/280) от ~ 1,8.
Примечание: Титры вируса ~ 10 11 -10 12 ГХ / мл являются оптимальными для трансдукции клеток НЕК293.
2. Выбор HEK293 / TN-XXL Тип Магистральная Cell культивированием In Vitro
Примечание: Определить G сочетания белков специфичность, например, G I / O, G д / 11, или л о р а G белки, о GPCR, так как это DICTates ли нужен белок химерой G для CNiFER. Для G д -coupled рецепторов, например М1 мускариновых рецепторов, выбирают HEK293 / TN-XXL (# 3G8) в качестве основы HEK293 типа клеток. Для G I / O -coupled рецепторов, химерный белок G G qi5 требуется 10. Для -coupled рецепторов G с, qs5 химерой G требуется 10. В этом протоколе построение D2R CNiFER используется в качестве примера. D2R сигналы через G I / O G белков и требует клеток НЕК293 , которые стабильно экспрессируют химерный белок G, G qi5, например, HEK293 / TN-XXL / G qi5 _ # qi5.6.
- Получите HEK293 / TN-XXL / G qi5 _ # qi5.6 клоновых клетки из исследовательской лаборатории. Примечание: Следующая клоновых клетки, НЕК293 / TN-XXL (# 3G8) для G д -coupled рецепторов, HEK293 / TN-XXL / G qi5 (# qi5.6) для G I / O -coupled рецепторов, и HEK293 / TN -XXL / G qs5 (# qs5.47) для -coupled ре л о р арецепторами, свободно доступны по запросу 6,7.
- Рост и расширение НЕК293 / TN-XXL / G qi5 _ # qi5.6 до ~ 90% слияния в Т25 колбы с 5 мл среды роста HEK293 (таблица 1). Grow клетки в увлажненном инкубаторе при температуре 37 ° С с 5% (об / об) CO 2.
Примечание: Все работы с культивированием клеток НЕК293 следует проводить с использованием стандартных методов стерильной культуры тканей. - Урожай HEK293 клетки сначала аспирационных носитель из Т25 колбы. Промывают клетки осторожно, добавляя по 5 мл PBS и качалки колбу.
- Удалите PBS и добавляют 1 мл 0,05% (вес / объем) трипсин / ЭДТА (таблица 2). Выдержите в течение от 1 до 2 мин при температуре 37 ° С с 5% (об / об) CO 2.
- Собирают клетки и переносят в стерильную 15 мл коническую трубку. Центрифуга в течение 5 мин при 1000 х г в клеточной культуре центрифуге. Аспирируйте супернатант.
- Ресуспендируют осадок клеток в 5 мл среды роста HEK293. Граф клеток в гемоцитометра с использованиемтрипанового синего. Вычислить плотность клеток и перейдите к шагу 3.
3. / Gqi5 Клетки Лентивирусов Трансдукция HEK293 / TN-XXL
- Семенной Т25 колбу с 0,7 × 10 6 qi5 клеток HEK293 / TN-XXL / G. Растут клетки в увлажненном инкубаторе при температуре 37 ° С с 5% (об / об) CO 2 до ~ 50% сплошности, после того, как приблизительно 1 день. Замораживание оставшиеся клетки (шаги 8.2-8.3). Эти клетки будут служить в качестве контроля CNiFER, т.е. CNiFER , который испытывает недостаток в GPCR.
- В день инфекции, разбавить , выражающую лентивирус GPCR (шаг 1,4) до конечной концентрации ~ 10 9 GC / мл в общем объеме 2 мл питательной среды HEK293 (таблица 1). Например, добавьте 20 мкл 10 11 GC вируса / мл 2 мл среды в колбе T25.
Примечание: Информация, титр вируса должна быть обеспечена основной вирус средства. Комбинат лентивирус и средств массовой информации в центрифужную пробирку и растирать осторожно. Высокие титры lentivирус являются биологической безопасности 2-го уровня (BSL-2). - Аспирируйте носитель из Т25 колбы. Добавьте 2 мл вируса / смеси носителя с шага 3.2. Выдержите Т25 колбу o / n при 37 ° С с 5% (об / об) CO 2.
- После того, как один день инфекции, аспирация вирус / смесь носителя и заменить его HEK293 роста среды , содержащей пуромицин (2 мкг / мл; Таблица 1). Пуромицин выбирает для трансдуцированных клеток. Инкубируйте колбы при 37 ° С с 5% (об / об) CO 2 до около 90% сплошности, после ~ 1-2 дня.
- Готовят 96-луночного планшета (черный с прозрачным дном), покрытые фибронектином, для генерации 10-балльной кривой агонистом / активации на этапе 4.1. В стерильных капот, добавить 50 мкл фибронектин (5 мкг / мл) на лунку в ряды А и В 96-луночный планшет. Инкубируйте планшет при комнатной температуре в течение 1 часа. Промыть два раза в течение 5 мин на промыванием PBS. Добавьте 50 мкл среды роста HEK293 и инкубировать O / N при температуре 37 ° С с 5% (об / об) CO 2.
Примечание: Fibronectin обработанные пластины являются коммерчески доступными. - Сбора клеток в Т25 колбы , как описано в пунктах 2,3-2,6 (таблица 2).
- Ресуспендируют осадок клеток в 5 мл среды роста HEK293. Семенной Т25 колбы с 1,5 мл клеток для анализа FACS. Кроме того, семена Т75 колбу с 1 мл клеток для замораживания и хранения (см шаги 8.2-8.3)
- Для кривой агонист 10-балльной, семян первые два ряда (А и В) с покрытой фибронектином 96-луночного планшета (с шагом 3.5) с 100 мкл суспензии клеток на лунку.
- Инкубируйте клеток НЕК293 , произрастающие в Т25 колбы Т75 колбы и 96-луночного планшета примерно до ~ 90% сплошности при 37 ° С с 5% (об / об) CO 2, после того, как ~ 1-2 дней.
4. FACS и изоляции одиночных CNiFER Клонов
- С помощью 96-луночный планшет для формирования 10-балльной кривой активирующим агониста.
Примечание: Перед тем как начать с активацией флуоресценции сортировки клеток (FACS-анализ), важно, чтобы подтвердитьвыражение GPCR путем тестирования трансдуцированных клеток для ответа агониста (10-точечная кривая агонист). Этот тест проводится с помощью флуорометрического для считывания планшетов.- Подготовьте тарелку лекарственного средства для 10-точечной кривой активации агонистом. Выберите 10 различных агонистов концентраций , которые кронштейну предсказанного EC 50, которые могут быть определены из литературы.
Примечание: Планшет Препарат содержит в 3 раза каждой концентрации (в двух экземплярах), чтобы приспособиться к 1: 3 разбавления в пластине CNiFER. Например, препарат пластина для тестирования D2 CNiFER содержит 10 различных концентраций дофамина при 3-кратной концентрации; 0,2, 0,5, 1, 3, 5, 10, 20, 30, 50, и 1000 нМ. В пластине CNiFER, следовательно, конечные концентрации дофамина являются 0,067, 0,167, 0,333, 1,00, 1,67, 3,33, 6,67, 10,0, 16,7, и 333 нМ. - Готовят Агонист решения с использованием искусственного спинномозговой жидкости (ACSF) (таблица 1). Используйте две скважины для 'ACSF', например, А1 и А2,и две скважины для «нет клеток», например, В1 и В2.
Примечание: Подготовка различных концентраций лекарственных средств с использованием методом серийных разведений. Создание шаблона для отслеживания CNiFER клонов и концентрации лекарственного средства (рисунок 3). - Используйте программное обеспечение для программирования 96-хорошо флуорометрического планшет-ридер для измерения FRET и выполнения переводов решений.
- Установите температуру пластины для чтения до 37 ° C.
- Для измерения FRET с TN-XXL, установите длину волны возбуждения до 436 ± 4,5 нм (центр ± HWHM). Установите фильтры выбросов до 485 ± 7,5 нм для ECFP и до 527 ± 7,5 нм для цитрин. Установите среза фильтра на 475 и 515 нм для ECFP и цитрин, соответственно.
- Запрограммируйте планшет-ридер для измерения излучения на длине волны 485 нм и 527 нм каждые 4 секунды в общей сложности на 180 сек. Выберите опцию, чтобы доставить 50 мкл из 3-кратном пластины лекарственного средства к 100 мкл в пластине CNiFER, после сбора 30 секундбазовый уровень флуоресценции.
- Аспирируйте носитель из рядов А и В и добавляют 100 мкл ACSF в 96-луночного CNiFER пластины, которая составляет ~ 90% сливающийся (шаг 3.9).
- Загрузите 96-луночного CNiFER пластину и "3-кратное" наркотиков планшет в планшет-ридере. Разрешить ~ 30 мин для уравновешивания пластин при 37 ° С. Затем запустите программу.
- Для анализа данных планшет-ридер, экспортировать значения флуоресценции в электронную таблицу. Создайте формулу вычитания фона измерений (принятые для каждого сигнала из скважин без клеток) из скважин с CNiFERs. Нормализуют интенсивности флуоресценции предварительного-стимула исходные условия, F цитрин (т) / F цитрин (базовый уровень), и вычислить соотношение FRET (ΔR / R;. Уравнение 1) , используя пик ответов на 527 нм и 485 выбросов нм (см шаг 11 ).
Примечание: Если имеется значительное изменение в ΔR / R с агонистом, то это указывает на экспрессию GPCR, и можно перейти к анализу FACS (шаг 4.2). Если йERE нет ответа ладу агониста, устранение неполадок с помощью Ca 2+ ионофор, например, A21387, чтобы проверить реакцию Ca 2+ и подтвердить , что датчик FRET на основе работает. Если ионофор работает, то не было, вероятно, выраженный рецептор.
- Подготовьте тарелку лекарственного средства для 10-точечной кривой активации агонистом. Выберите 10 различных агонистов концентраций , которые кронштейну предсказанного EC 50, которые могут быть определены из литературы.
- За день до FACS, подготовить четыре 96-луночные планшеты, покрытые фибронектином (см шаг 3.5) для сбора отсортированных клеток. Добавьте 50 мкл среды роста HEK293 и инкубировать O / N при температуре 37 ° С с 5% (об / об) CO 2.
- Готовят 5% (вес / объем) БСА в PBS (5 г / 100 мл) и фильтр (0,2 мкм) в стерильный флакон.
- Урожай клетки , выращенные в колбе Т25 (см шаги 2.3-2.5, таблица 2). Ресуспендируют осадок клеток в 4 мл 5% -ного (вес / объем) БСА в PBS. Центрифуга клеток при 1000 х г в течение 5 мин.
- Аспирата СМИ и ресуспендируют осадок клеток в ~ 5 мл 5% -ного (вес / объем) БСА в PBS с получением конечной концентрации ~ 5 · 10 6 клеток / мл.
Примечание: Проверьте с FAосновной комплекс CS для конкретных требований по плотности клеток и условий сортировки. - Фильтр ресуспензированной клетки с сетчатым фильтром 40 клеток мкм для удаления комков. Передача клеток в 5 мл полипропиленовые трубы с круглым дном. Поместите пробирку на льду для транспортировки на объект FACS.
- Сортировка трансдуцированных клеток НЕК293 на объекте FACS. Программа параметры на FACS проточном цитометре следующим образом: набор 4 ° C для держателя образца, 100 мкм для сопла и 20 фунтов на квадратный дюйм. На основе анализа предварительной сортировки, выделите ячейки, т.е. выбрать 'ворота', которые имеют большой ECFP флуоресценции (ECFP возбуждение, излучение ECFP) и большой FRET (ECFP возбуждения, эмиссии цитрин) флуоресценции (см ниже результаты, на рисунке 2 ).
- Депозит особь, отсортированных клеток в 96-луночный планшет, полученного на стадии 4.2, с одного клона на лунку, содержащую 50 мкл среды для выращивания HEK293 с пуромицин. Добавьте 50 мкл питательной среды HEK293 с пуромицин (TaBLE 1) в общей сложности на 100 мкл на лунку. Поддерживать клетки O / N при температуре 37 ° С с 5% (об / об) CO 2.
Примечание: HEK293 питательная среда содержит пуромицин для отбора трансдуцированных клеток.
5. Культивирование и расширение сортируют, Клональный CNiFERs
- Поддерживать CNiFERs в 96-луночные планшеты , путем удаления 50 мкл старой сред из каждой лунки и заменяя 50 мкл свежей среды для выращивания НЕК293 , содержащих пуромицин (таблица 1). Повторите это каждые 5 до 7 дней до ~ 90% сливающиеся, через 2-3 недели.
- Урожай CNiFER клетки осторожно аспирационных носитель и ополаскивания один раз осторожно PBS. Удалите PBS и добавляют 20 мкл 0,05% (вес / объем) трипсин / ЭДТА. Выдержите в течение от 1 до 2 мин при температуре 37 ° С с 5% (об / об) CO 2.
- Добавьте 100 мкл среды для выращивания HEK293 к трипсин обработанных клеток и ресуспендирования клеток. Содержание передачи в 24-луночный планшет, содержащий 400 мкл свежей HEK293 рост средств массовой остроумиеч пуромицин. В 24-луночный планшет, поддерживать клетки путем не замены 250 мкл питательной среды HEK293 каждые 5-7 дней до тех пор, скважины ~ 90% сплошности.
6. Определение кандидатских CNiFERs Основываясь на FRET Response Использование Флуорометрические планшет-ридер
Примечание: С четырьмя 96-луночные планшеты следующие FACS, должно быть> 100 тестируемые клоны, которые выживают и расшириться до 24-луночного этапе плиты, так как многие из оригинальных клонов не растут. Для выявления потенциальных CNiFERs кандидатов, использовать анализ 3-точечного для ответа FRET с родственным агониста, например, дофамин для D2R.
- Когда клетки ~ 90% сплошности в 24-луночный планшет, мягко аспирата средств массовой информации. Добавить ~ 100 мкл 0,05% (вес / объем) трипсин / ЭДТА и инкубировать в течение 1-2 мин при температуре 37 ° С с 5% (об / об) CO 2. Добавить 400 мкл среды для выращивания HEK293 к трипсин-клеток, обработанных и смешать клетки путем осторожного растирания.
- Настройка кривой агониста 3-точечного для первоначального скрининга ССНуказанные в другом месте. Для каждого клона CNiFER, т.е. одной из скважин с 24-луночного планшета, аликвоты по 100 мкл суспензии клеток (~ 4 · 10 3 клеток / лунку) в каждую из трех лунок, например, А1, А2, А3, из фибронектин покрытием 96-луночного планшета (черный с прозрачным дном) (см шаг 3.5).
- Передача оставшихся ~ 200 мкл клеточной суспензии в 12-луночный планшет, содержащий 1000 мкл среды для выращивания HEK293 (1,2 мл конечного объема). Инкубируйте обе пластины при температуре 37 ° С с 5% (об / об) CO 2, до ~ 90% сплошности. 96-луночный планшет предназначен для анализа флуориметрический и 12-луночный планшет для выращивания и расширения клонов.
- Для анализа 3-точечной, определяют три различные концентрации агониста , которые являются 0,1-, 1,0- и 10 раз EC 50 для конкретного GPCR. Подготовить агониста концентрации в пластине лекарственного средства, как описано в пунктах 4.1.1-4.1.2. Выполните флуорометрического анализа планшет-ридер, как описано в пунктах 4.1.3-4.1.5.
- Вычислить FRОтношение ET (ΔR / R), как описано в шаге 4.1.6. Выберите CNiFERs, которые имеют соответствующую чувствительность и большой отклик FRET для расширения, замораживание назад, и более полный анализ (этап 7).
- Для получения клонов, которые были выбраны на этапе 6.5 и растут в 12-луночного планшета, не удалить и заменить 600 мкл НЕК293 питательной среды каждые 5 до 7 дней, до ~ 90% сплошности.
- Постепенно расширять клонов из 12-луночного планшета на 6-луночный планшет, а затем в Т25 колбы (шаги 2,3 - 2,6 и таблица 2). Когда T25 колбу составляет ~ 90% сливающиеся, урожай клетки, как описано (шаги 2.3-2.5). Ресуспендируют осадок клеток в 5 мл среды роста HEK293.
- Добавляют 1 мл суспензии клеток в Т75 колбы с 9 мл среды роста HEK293. Используйте оставшиеся 4 мл суспензии клеток для криозащиты и хранения в жидком N 2 (шаги 8.2-8.3). Подготовьте восемь 1,5 криопробирок мл и помещают на лед.
- В T75 колбу, поддерживать клетки путем замены носителя шIth свежей питательной среды HEK293, например, 10 мл через каждые 3-5 дней до 70-80% сплошности, после ~ 1-2 недели.
7. Окончательный выбор CNiFER клонов Использование Флуорометрические планшет-ридер
- За день до анализа пластины читателя:
- Урожай клетки от ~ 90% сливающийся T75 колбу (см шаги 2,3-2,6, таблица 2). Seed 96-луночного покрытой фибронектином пластины (черный с прозрачным дном) при 5 х 10 4 / лунку с ~ 100 мкл клеточной суспензии. Примечание: Один клон распределен в одну пластину 96-луночного.
- Подготовьте тарелку наркотиков для комплексного скрининга CNiFER клонов, различая конкретные ответы от агонистов неспецифических реакций CNiFER.
- Для создания полной кривой доза-реакция, выбрать 10 различных концентраций агониста вокруг предсказанного EC 50. Используйте две скважины для «нет» клеток и двух скважин для 'ACSF'.
- Для определения неспецифических ответов, выберите ЧетЕ.Е. концентрации 12 различных медиаторов или модуляторов (72 скважин) (рисунок 3). Как и агониста, пластина содержит лекарственное средство в 3 раза концентрации в двух экземплярах. Например, в 100 мкл трех различных концентраций ацетилхолина, глутамата, орексина, VIP, аденозин, серотонин, норадреналин, ГАМК, вещество Р, мелатонин, соматостатин и гистамина, каждый в 3-кратной концентрацией 50, 1000, и 3000 нм загружаются в пластину наркотиков 96-луночного.
- Установите параметры на флуориметрический ридере для измерения FRET и выполнения переводов раствора, как описано в пунктах 4.1.3-4.1.5.
- Для анализа полной кривой дозового ответа, вычислить отношение пика FRET (ΔR / R) (этап 4.1.6), участок в зависимости от концентрации агониста журнала и согласуется с уравнением Хилла (шаг 11.4). Определить EC 50, коэффициент Хилла, и максимальное соотношение ладу. Для 12 других медиаторов / модуляторов, участок пика ΔR / R в качестве функции ое концентрация лекарственного средства.
- Выберите ~ 10 CNiFER клонов , которые имеют большое отношение FRET, соответствующее EC 50 для родственного агониста и мало или нет фоновых ответов на других агонистов нейромедиаторов (неспецифический ответ).
8. Замораживание-назад Выбранные CNiFER Клоны
- Используйте ~ 90% сливающийся T75 колбу индивидуального клона CNiFER. Урожай клетки , как описано (шаги 2.3-2.5, таблица 2). Для замораживания клеток, ресуспендируют осадок клеток в 5 мл среды для выращивания HEK293. Добавьте десять 1,5 криопробирок мл и установить на льду.
- Для криозащиты смешайте ячеек 1: 1 с 20% (об / об) ДМСО в среде для роста HEK293, например, в 5 мл 20% (об / об) ДМСО / носитель смесь осторожно смешивают с 5 мл суспензии клеток (конечная концентрация ДМСО составляет 10%).
- Аликвоты 1 мл в каждую из криопробирок. Закрепить трубки с клетками в -80 ° C морозильника O / N, в коробке пены изоляцией (см Материалы). Передача криопробирок для жидкого мылаID азот для длительного хранения.
9. CNiFER Имплантация в коре головного мозга мыши
- Стерилизовать всех хирургических инструментов в автоклаве до операции. Подготовить полу стерильностью поле для хирургии, протирая 70% этанолом и укладывание чистый лабораторный подгузник.
- Подготовьте инъекции пипетку CNiFER, потянув стеклянный капилляр (ID 0,53 мм) на вертикальной электрода съемник. Используйте пару нет. 5 тонкой кончик пинцетом, чтобы сломать кончик электрода диаметром ~ 40 мкм.
Примечание: Это лучше всего достигается при стерео зум микроскоп с сеткой. - Обезболить взрослого (постнатальный день 60-90) C57BL / 6 мыши с изофлуран: 4% (об / об) для индукции и от 1,5 до 2,0% (об / об) для технического обслуживания. Используйте хвост или носок щепотку, чтобы убедиться, что мышь полностью под наркозом.
Примечание: Re-пинч и периодически оценивать усов подергивания по всей хирургии переоценивать глубину анестезии. - Закройте глаза с глазной мази рРевент сушки. Установите мышь в стереотаксической рамы с уха баров. Поддерживают температуру тела мыши при 37 ° С с использованием тепла площадку регулируется с помощью ректального зонда.
- Бритье площадью около 5 мм на 12 мм с электробритвы животных. Нанести бетадин затем 70% (об / об) изопропанола. Используйте лезвие скальпеля, чтобы вырезать и удалить кожу по всей поверхности черепа. Используйте лезвие скальпеля для удаления надкостницы с поверхности черепа. Expose и очистить поверхность черепа, как описано для стереотаксической хирургии 11.
- Опустите пустую стеклянную пипетку, чтобы темени и записать переднезадней (A / P) и медио-латеральной (M / L) координаты. Ссылаясь на атласе мозга мыши, вычислить положение в месте инъекции. Сдвиг пипетку к нужному месту и отметьте череп для последующего формирования окна. См Четин и др. Подробную информацию о стереотаксической инъекции с грызунами 11.
Примечание: Место инъекции и окна зависят от регион изучаться и распределение нейромедиатора или пептидных высвобождая проекций в коре головного мозга. Например, в недавней публикации 7, стереотаксической координаты +1,0 до +2,0 мм A / P и +1,0 до +2,0 мм M / L были использованы для инъекции клеток CNiFER в лобной коре для получения изображения в естественных условиях высвобождения дофамина во время классического кондиционирования , - Форма 2 мм х 3 мм окно разреженных черепа , как описано выше 12,13.
Примечание: кость в окне должен быть толщиной 15-20 мкм. Маленькие белые пятна в кости не должны быть видны , когда поверхность черепа увлажняется, если кость достаточно разбавить 12,13. - Поместите ACSF смоченную губку на окно, чтобы держать его влажным при подготовке клетки к инъекционные.
- Урожай клон CNiFER, который был выращен в Т75 колбе до ~ 80% сплошности. Аспирация СМИ и промыть клетки стерильной PBS.
Примечание: Трипсин опущено для этих шагов. - Удалить PBS и использовать 10 мл OF ACSF, чтобы вытеснять клетки со дна колбы. Triturate клетки диссоциируют скопления клеток. Центрифуга и ресуспендируют осадок в 100 мкл ACSF. Центрифуга в течение 30 сек при 1400 XG и удалите супернатант, оставляя осадок покрытую ACSF. Этот шаг оставляет комок клеток в суспензии.
- Засыпка инъекционной пипеткой, полученного на стадии 9.2 с минеральным маслом, загрузите пипетку на более nanoinjector, и продвинуть поршень, чтобы извлечь небольшой шарик масла. Поместите по 5 мкл клеточной суспензии CNiFER на полосу пластиковой парафиновой пленки вблизи подготовки мыши. Оформи либо CNiFERs или контрольными клетками CNiFER в выдвинутом пипеткой.
- Переместите пипетку к целевой X и координаты Y, то есть, A / P и M / L , указанный в пункте 9.5. Опустите пипетку, прокалывая утонченную череп, и продолжают ~ 200-400 мкм ниже поверхности черепа, для осаждения клеток CNiFER в слоях 2/3 коры.
- Вводят ~ 4,6 нл клеток CNiFER на самом глубоком месте с nanoinjecтор, движение примечание в интерфейсе нефти и клеток, а затем ждать в течение 5 мин для клеток обойтись. Вывод пипетку ~ 100 мкм и вводят другой ~ 4,6 нл клеток CNiFER, подождите 5 мин. Затем извлеките пипеткой медленно и осторожно , чтобы предотвратить обратный поток из CNiFERs. Повторите инъекции на одном или нескольких соседних участков.
- Повторите инъекции шаги 9.8-9.12 с управлением НЕК293 (т.е. HEK293 / TN-XXL / G qi5 клон GPCR) не хватает. Отделить CNiFER и контролировать сайты инъекции клеток от ~ 200 мкм.
- После завершения клеточных имплантаций, ополоснуть окно разреженных черепа с ACSF и ждать, пока череп, чтобы высохнуть. Нанесите каплю клея цианакриловым (см Материалы) над окном и быстро разместить предварительно вырезанное стерильную покровного стекла поверх клея. Аккуратно надавите на крышку стекла против черепа в течение нескольких секунд. Пусть клей сухой в течение 2 мин 12,13.
- Печать края покровного стекла с зубным цементом и формы ашELL вокруг окна, чтобы держать воду для целей погружения.
- Для иммобилизации головы мыши во время формирования изображения, прикрепить изготовленный на заказ голова-бар с небольшой каплей клея цианакриловым за окном (см 14 для подробной информации о размерах и материалах). Пусть клей полностью высохнуть, а затем добавить дополнительные стоматологического цемента для дальнейшего усиления по индивидуальному заказу головной бар.
- Покрытия остальной части поверхности черепа, за исключением окна со слоем зубного цемента. Убедитесь, что края кожи покрыты цементом и дайте ему высохнуть в течение 20 мин.
- После операции, прекратить введение изофлуран и оставить мышь на грелку в клетке, пока она полностью не оправится от анестезии. Вводят 5% (вес / объем) глюкозы в солевом растворе (подкожно) для регидратации и от 0,05 до 0,1 мг / кг бупренорфина (IP, мгновенного высвобождения) для послеоперационного обезболивания.
Примечание: Для того, чтобы свести к минимуму потенциальную иммунологическую реакцию на человека CNiFERs, впрыснуть мышь ежедневно с 20 мкл / 100 г циклоsporine (ф) начиная день перед введением CNiFERs. - Вернуть мышь в родную клетку для еды и воды.
10. В Vivo Визуализация CNiFER Клонов
Примечание: Живая съемка проводится с использованием мышей двухфотонного микроскопа и аппарата с головы неподвижная. Анестезия не требуется во время сессий визуализации. При визуализации животных в бодрствующем состоянии, ограничить подголовника лишь несколько часов в то время, чтобы снизить уровень стресса. Вернуть животное к нему домой клетку между сеансами обработки изображений для производства продуктов питания и воды. Потенциал напряжения сводится к минимуму за счет затемнения освещение в комнате и окружающих часть мыши в корпусе.
- На следующий день после операции, установите курсор на платформе визуализации путем завинчивания металлической головки-бар, имплантированных на черепе к головной фиксации кадра.
Примечание: При визуализации без сна мышей, сеанс изображения не должна превышать несколько часов из-за потенциального стресса, вызванного лобовом удерживающего устройства. - Поместите платформу обработки изображений с головным сдержанной мыши в визуализации микроскопа двухфотонному, снабженном 10X (0,30 NA) и 40X (0,80 NA) целей погружения в воду.
- Вставьте фильтр куб для FRET изображений (ECFP и цитрин), который имеет дихроичное зеркало при 505 нм и полосовых фильтров, которые охватывают 460 нм до 500 нм для измерения ECFP и 520 нм до 560 нм для измерения цитрин.
- Добавить ACSF в лунку, содержащую окно разреженных черепа и опустите цель погружения в воду в ACSF. С помощью окуляра в сочетании с ртутной лампой и GFP, светофильтров, чтобы определить местонахождение поверхности коры и сосудистую систему под окном.
Примечание: Характер сосудистую помогает найти и изображение той же области в течение многократных дней визуализации. Переход к цели погружения в воду 40X, чтобы определить местонахождение CNiFERs вручную упором на поверхности коры над клетками с помощью GFP фильтра куб и ртутная лампа. - Настройка для работы с изображениями двух фотонов. Выберите арлегкий путь для получения изображения щих образовательных двухфотонному. Для типичной коммерческой системы, использовать программное обеспечение для переключения в режим визуализации двухфотонного и перенаправлять свет на ФЭУ (ФЭУ) в не-descanned детекторов. Включите ближней инфракрасной фемтосекундного импульсного лазера, выбрать длину волны 820 нм и установку мощности на 5-15%. Примечание: 5% мощности обычно обеспечивает ~ 25 мВт на образце.
- Установите напряжение PMt1 и PMt2 близко к максимальному значению, обычно 700-1000 V в зависимости от ФЭУ. Установите коэффициент усиления на 1 для каждого канала и нулевой позиции г для цели.
- Опустить цель ~ 100 до 200 мкм от поверхности коры и начать сканирование ху. Регулировка мощности лазера, коэффициента усиления и напряжения ФЭУ для каждого канала, т.е. ECFP и цитрин, чтобы оптимизировать соотношение сигнал-шум флуоресценции CNiFER.
- С помощью функции масштабирования в программном обеспечении, чтобы ограничить изображение в области, которая содержит клетки CNiFER, а также Background регион. Используйте скорость сканирования не медленнее, чем один кадр каждые 2 сек (0,5 Гц) при 4 мкс на пиксель. Отрегулируйте линию усреднения для подходящего отношения сигнала к шуму, например, Кальман 2 линии усреднения.
- Нарисуйте область представляющей интерес (ROI) вокруг клеток CNiFER, окружающих примерно от 3 до 4 клеток на плоскости. Настройка анализа в режиме реального времени ROI средней интенсивности. Начало сбора для мониторинга CNiFER флуоресценции с течением времени.
- Сбор флуоресценции от CNiFERs до и во время экспериментальных манипуляций, например, электростимуляция, ChR2 стимуляции, поведение, как определено пользователем.
- Когда эксперимент формирования изображения завершена, вернуть мышь к своей домашней клетки. Повторите томографию через дни, как хотелось бы. При повторной визуализации клетки относятся к ранее приобретенным низким увеличением изображения для сосудистой ориентации обратно в той же области обработки изображений (этап 10.4).
Примечание: имплантированные CNiFERs могут быть отображены в течение по крайней мере 7 дней.
Анализ 11. Данные
- Открыть файл изображения и выберите ROI для CNiFERs и один ROI для фона. Выберите '' анализ временных рядов для обоих каналов каждого ROI. Экспорт средней интенсивности флуоресценции для каждого ROI в качестве табуляцией файла.
- С помощью программы математического программного обеспечения (см Материалы) для анализа флуоресценции значения. Фильтр низких частот (0,3 Гц) каждый сигнал, а затем вычесть фоновой флуоресценции в каждом ROI от ECFP и цитрин интенсивности флуоресценции.
- Вычислить среднюю флуоресценции для базовой линии и рассчитать коэффициенты, как описано в уравнении 1 для измерения соотношения FRET ΔR (T) / R.
- Для того, чтобы определить чувствительность CNiFERs, участок соотношение FRET в зависимости от логарифму концентрации агониста. Установить с уравнением Хилла для определения коэффициента EC 50 и Hill (п), с помощью научного статистического программного обеспечения и уравнения Хилла (уравнение 2).

Результаты
CNiFER получают из эмбриональной почки человека (НЕК293) , клетки , который разработан для стабильной экспрессии по меньшей мере , двух белков: специфический G-белком рецептор (GPCR) , и генетически кодируемой [Са 2+] датчика, TN-XXL. TN-XXL подвергается флуоресцентного резонансного переноса энергии (FRET) между голубым и желтым флуоресцентными белками, ECFP и цитрин, соответственно, в ответ на Ca 2+ ионов 6,15. Активация GPCR , что пара к эндогенным G д G белки вызывают увеличение цитозольного [Ca 2+] через PLC / IP 3 пути, что приводит к увеличению FRET от TNXXL Ca 2+ детектора (рисунок 1).
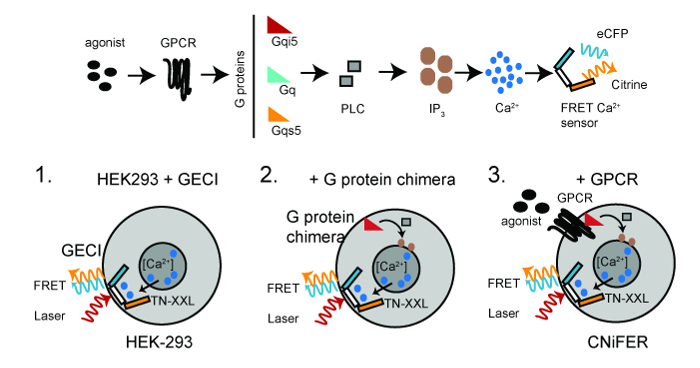
Рисунок 1:. Схема для развивающихся CNiFERs Top, GPCR-Ca 2+ сигнальный путь необходим для созданияCNiFER клеток. Внизу, основные шаги для построения CNiFERs с использованием клеток HEK293. Шаг 1. трансдукции с генетически закодированного FRET на основе Ca 2+ -detector (TN-XXL). Шаг 2. трансдукции Gα G-белок химеры, т.е. G qs5, G qi5, если это необходимо. Шаг 3. трансдукции уникальный GPCR для создания CNiFER. Двухфотонное возбуждающего света (красный) возбуждает ECFP, которая подвергается FRET, производя как эмиссию ECFP (голубого цвета) и испускания Цитрин (желтого цвета). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Увеличение FRET обеспечивает быстрое оптическим считыванием из изменения уровней нейромедиаторов. Для того, чтобы разработать CNiFER для конкретного типа медиатора, сначала необходимо определить тип G белка, который соединяется с GPCR. Для G д -coupled GPCRs, то GPCR использует G Q белки эндогенно , выраженные вНЕК293. Для G I / O -coupled GPCRs, клональной HEK293 линия сначала создается , что выражается химерный белок G , который перенаправляет GPCR к G д -PLC / IP 3 пути. Это достигается с помощью химерного белка G, G qi5, которая содержит в основном Gα последовательность Q и пять аминокислот карбоксильного конца G I. Эти пять аминокислот являются достаточными для G qi5 общаться с G I / O -coupled GPCRs, но сигнал через д пути G. Для -coupled GPCRs Г С, А qs5 химерой G используется 10. Общая стратегия получения CNiFER заключается в следующем : 1) создать клонального HEK293 клетки, которая стабильно экспрессирующие оптический детектор Ca 2+, т.е. TN-XXL, используя лентивирус трансдукции клеток НЕК, 2) стабильно экспрессируют белок химеры G , в случае необходимости, в клеточном клоне HEK293, выражающей TN-XXL, и 3) создать стабильно экспрессирующие GPCR клона в клетке HEK293клон, экспрессирующий TN-XXL и химерный белок G. Клональная HEK293 линия, которая испытывает недостаток в GPCR, но имеет TN-XXL и химерный белок G служит в качестве «управления CNiFER». Контроль CNiFER необходимо , чтобы подтвердить , что ответ CNiFER связано конкретно к активации сконструированных рецепторов, то есть, D2R, а не к активации других рецепторов эндогенно экспрессированным в клетках HEK293.
Для генерации лентивирус, используется система экспрессии lentivector, например, PCDH-ЦМВ-МКН-EF1-Пуро, которая содержит генетические элементы , ответственные за упаковку, трансдукции, стабильной интеграции вирусной экспрессии конструкции в геномной ДНК и экспрессии мишени последовательность гена. Для того, чтобы произвести высокий титр вирусных частиц, экспрессии и упаковочных векторов скоротечно совместно трансфицировали в клетки-продуценты млекопитающих и вирус собирают. Есть несколько основных вирусных объектов в США, которые могут генерировать высокую ти тер лентивирусов. После инфицирования клеток НЕК293, ген Puro обеспечивает устойчивость к антибиотикам для идентификации трансдуцированных клеток НЕК293.
Для того чтобы идентифицировать конкретные клональных линий, трансдуцированных НЕК293 сортируются с использованием клеток с возбуждением флуоресценции системы сортировки (FACS). Цель состоит в том, чтобы изолировать клон , который содержит высокий уровень экспрессии FRET-детектор на основе Са 2+ и способность совершать разъедать. В этом примере анализа FACS, флуоресценцию излучением ECFP представлен в зависимости от сигнала FRET (ECFP возбуждения и эмиссии цитрин). Коробки отметьте регионы (P2 и P3) , которые будут впоследствии выбраны ( "закрытого типа") для сортировки в 96-луночные планшеты (рисунок 2). Как правило, около четырех 96-луночные планшеты, достаточны для скрининга успешного создания CNiFERs. Из этих 4-х пластин, приблизительно 100 клонов подходят для флуориметрический анализа пластины читателя.
e_content "ВОК: Keep-together.within-странице =" 1 ">
Рисунок 2: Пример анализа FACS Образец выходе следующего анализа FACS.. На графике ECFP излучение ( "475/20-А") в зависимости от эмиссии Цитрин ( "FRET, V-530/30-А"), с использованием ECFP возбуждения для каждой ячейки. Регионы P2 и P3 показывают участки выбраны, т.е., закрытого типа, для сортировки на отдельные клетки. Цвета произвольны. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
После того, как отсортированные клетки выросли до достаточной плотности, ответ на FRET следующий агониста активации определяют с использованием 96-луночного флуорометрического систему планшет-ридер, оснащенный обработкой раствором. Для того, чтобы сузить количество клонов исследовании, «3-точка" кривой агонист используется для скрининга ~100 клонов и выберите CNiFERs с лучшими ответами. Приблизительно 10 клонов затем дополнительно проанализированы с определением полной доза-реакция с родственным агониста и неспецифические реакции, испытанные с 12 другими нейротрансмиттеров или модуляторов. Пластинчатый препарат 96-луночного готовят в виде трех-кратной концентрации (конечная концентрация разводят в соотношении 1: 3 в пластине) лекарственных средств (например, агонисты, антагонисты и т.д.) в ACSF. В этом примере пластина наркотиков устанавливается для тестирования D2 CNiFER с родственным агониста, дофамин и потенциальных неспецифических реакций с множеством других нейромедиаторов и пептидных агонистов (рисунок 3). Позвоночник CNiFER, в котором отсутствует GPCR, служит важным управления для вновь созданного CNiFER.
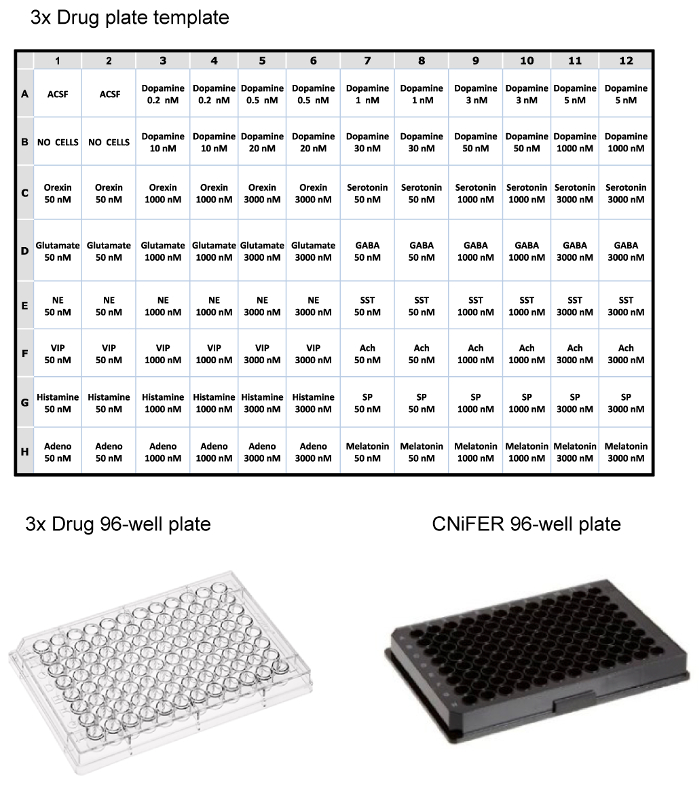
Рис . 3: Примеры компоновки для 96-луночные планшеты Top, таблица Лайут для загрузки пластины наркотиков 3x для флуориметрический ридере, используя троекратное концентрации различных нейромедиаторов и пептидов. Внизу, примеры прозрачного пластика 96-луночного планшета наркотиков и черного 96-луночного планшета для высева CNiFERs и измерения в ридере. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Стимулирование GPCR ожидается усиление ответа FRET, как следствие высоты внутриклеточным [Са 2+] и обнаружения с помощью TN-XXL. В этих условиях, лада производится ECFP и цитрин сближается, таким образом, что возбуждение ECFP производит меньший выброс ECFP и больший выброс Цитрин. В этом примере возбуждения устанавливается на 436 нм и эмиссии фильтров установлены до 485 ± 7,5 нм для ECFP и 527 ± 7,5 нм для Цитрина (рис 4). Тридцать сек баСелине измеряют флуоресценцию, а затем 50 мкл из "троекратным" агонист в ACSF пластины подается в каждую лунку, содержащую 100 мкл ACSF (1: 3) разбавления. ECFP и флуоресцентной эмиссии цитрин измеряются через каждые 3,8 секунды в течение 180 сек. Фоновые измерения проводятся из лунок без клеток и вычитают, если это необходимо. Интенсивность флуоресценции нормированные предварительно стимула исходных условий (F (T) / F (базовый уровень)), и пиковые ответы измеряются для расчета соотношения FRET (ΔR / R) с помощью F (T) / F (базовый) из 527 нм и 485 нм каналах (уравнение 1). Кривая доза - ответ затем строится путем построения графика соотношения FRET в зависимости от различных концентраций агониста и согласуется с уравнением Хилла для определения EC 50 и коэффициент Хилла (рисунок 5) (уравнение 2). Оптимальная CNiFER демонстрирует большое отношение FRET и соответствующий EC 50 для родственного агониста, и имеет мало или нет фона ответов на другой neurotransmitтер агонисты. В противоположность этому, контроль CNiFER должен показать мало ответ на родственный агониста.
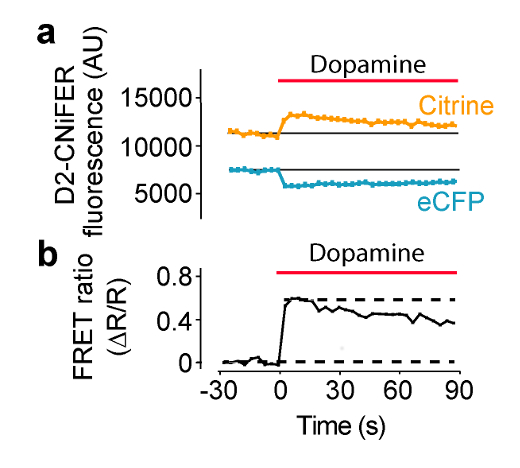
Рисунок 4: Пример агонист-индуцированной FRET Response D2R CNiFER FRET ответа , измеренного на ридере с системой подачи раствора.. (А) Участок ответа FRET, т.е. ECFP возбуждения с выбросами ECFP и цитрин, при применении допамина (красной полосой) к D2 CNiFERs. Следует отметить, что снижение выбросов ECFP в то время как цитрин выбросов возрастает с агонистом (дофамина). (В) График соотношения FRET (уравнение 1) для ответа на стадии (а) Рисунок модифицированного от Мюллера и др., 2014 7. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
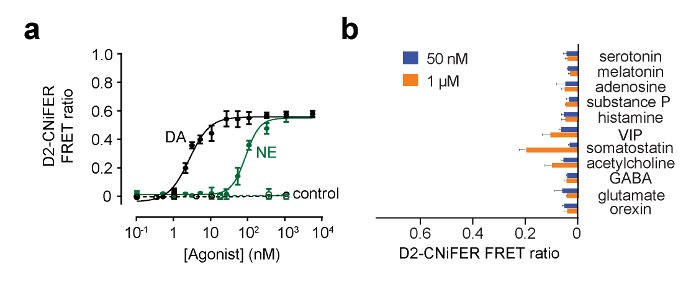
Рис . 5: Примеры кривых доза отклика для D2 CNiFER (А) Доза кривые отклика для ответа D2 CNiFERs к дофамина (DA, черный) и норэпинефрина (NE, зеленый). Кроме того, реакция "контрольных" CNiFERs которых отсутствует D2R показан. (В) Гистограмма показывает ответ соотношение FRET для других медиаторов и модуляторов при 50 нМ и 1 мкМ. Значения представляют собой среднее ± SEM. Рисунок редактировался Мюллера и др., 2014 г. 7. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
CNiFER клоны могут быть оценены в дальнейшем для возможной десенситизации рецепторов-зависимых и для их временного разрешения, дискриминации презентациюдвух различных импульсов агонистов (подробнее см Мюллер и др., 2014 7). Построив клон CNiFER, следующий шаг , чтобы проверить свою функцию в естественных условиях. Для мониторинга флуоресценции в естественных условиях, необходимо использовать двухфотонный микроскоп. После подготовки окно разреженных черепа, CNiFERs загружают в стеклянную пипетку и вводят в слои 2/3 коры. Затем мышь готовы к визуализации в естественных условиях путем прикрепления покровным стеклом к утонченной черепа, и насадить голову планку для фиксации головы во время съемки (рисунок 6).
Для того, чтобы определить , что имплантированные CNiFERs жизнеспособны в естественных условиях, известные концентрации агониста можно впрыскивать вблизи места имплантации и отношение FRET определяют 7. Для дальнейшей проверки активности имплантированных CNiFERs, стимулируя входные нейроны должны быть изучены. Например, с D2 CNiFER, эффектэлектрическая стимуляция нейронов среднего мозга допамина, что проект по коре головного мозга исследовали. 0,1 МОм вольфрам биполярный стимулирующий электрод с расстоянием между наконечником 500 мкм был имплантирован в черное вещество (-3,2 мм A / P, -1,3 мм М / л, -4,4 мм D / В). На рисунке 6 показан пример электрически стимулирование черной субстанции при различной интенсивности и наблюдать увеличение коэффициента FRET для D2 CNiFERs 7. Следует отметить, что системный внутрибрюшинную (IP) инъекцию антагониста рецептора D2, eticlopride (1 мг / кг), блокирует ответ D2 CNiFER. С другой стороны, инъекции кокаина (15 мг / кг), который блокирует обратный захват дофамина, повышающего электрически вызываемую D2 CNiFER ответ 7.

Рисунок 6: Пример D2 CNiFER Response I Онг> п Vivo После электрической стимуляции черной субстанции. (A) мультфильм показывает головной фиксированной мыши , уготованное двухфотонного визуализации в естественных условиях и электрической стимуляции. Двухфотонное свет (красный, 820 нм) для возбуждения и 475 нм для эмиссии ECFP (синий цвет) и 530 нм для эмиссии цитрин (зеленый). (Б) Линия участок показывает соотношение FRET для D2 CNiFER впрыскивается в коре головного мозга следующие электрической стимуляции черной субстанции, то есть 200 мкс импульсов от 50 до 300 мкА при 50 Гц в течение 500 мс, а после электрической стимуляции в присутствии D2R антагонист (eticlopride) или кокаина. Рисунок редактировался Мюллера и др., 2014 г. 7. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
ftp_upload / 53290 / 53290table1.jpg "/>
Таблица 1: Перечень химических веществ и реактивов для приготовления питательной среды HEK293 и ACSF.

Таблица 2: Объемы для сбора клеток из различных пластин Размер культуры или баллонах.
Обсуждение
Создание CNiFERs обеспечивает инновационный и уникальную стратегию для оптического измерения высвобождения нейромедиаторов в головном мозге в естественных условиях. CNiFERs идеально подходят для измерения внесинаптических высвобождения, т.е. объема проводимости, для нейротрансмиттеров. Важно отметить, что каждый из CNiFER обладает свойствами нативного GPCR, обеспечивая физиологическую оптическое измерение изменений в уровнях нейромедиаторов в головном мозге. На сегодняшний день CNiFERs созданы для обнаружения ацетилхолин (М1-CNiFER) 6, допамина (D2-CNiFER) 7 и норэпинефрина (α1a-CNiFER) 7.
В основной, CNiFER может быть создан для любого нейротрансмиттера, который сигнализирует через GPCR. Для случая , когда GPCR сигналы через ^ Q G белков, никакие дальнейшие модификации не требуется , чтобы клетки HEK293. GPCR , что сигнал через G I / O, однако, требуют коэкспрессия в G qi5 химерные G белкадля соединения GPCR с G Кв / PLC затрагивающего пути 7,10. Точно так же, GPCRs , что сигнал через G с потребует коэкспрессия химерного белка G qs5 G 10. После завершения, каждый клон CNiFER просеивают и только те клоны CNiFER , которые имеют сродство , сопоставимую с нативным рецептором, проявляют мало или вообще не десенсибилизации и обеспечивают отношение сигнал-шум , который является достаточным для измерения с в естественных условиях двухфотонного микроскопии, выбраны для исследований в естественных условиях.
Для исследований в естественных условиях, настоятельно рекомендуется для лечения мышей с циклоспорином свести к минимуму возможные иммунологической реакции. Существует возможность отказа или иммунологический ответ с имплантацией клеток CNiFER человека в мозге грызунов. Это было исследовано ранее, исследуя экспрессию GFAP и Mac1 7 после имплантации CNiFER. CNiFERs-видимому, не производить глиальные шрамы или генерировать любой СИГВВПficant МАС1 окрашивания 7.
Два основных вопроса, которые следует учитывать при построении CNiFERs являются чувствительность и десенсибилизации. Если ЕС 50 слишком велико, то есть с низкой аффинностью, по сравнению с нативными рецептором, то CNiFER не может иметь достаточную чувствительность для обнаружения высвобождения нейротрансмиттеров в естественных условиях. Одним из решений является rescreen клонов и выбрать другой клон CNiFER, который имеет более высокое сродство. Альтернативная стратегия будет заключаться в проверке других типов генетически кодируемых флуоресцентных Са 2+ -detectors , которые могут иметь более высокую чувствительность Ca 2+, который может сместить EC 50 для активации GPCR. Поскольку конструкция CNiFER имеет модульную структуру , легко приспособить к другим типам генетически кодируемых Са 2+ -detectors, таких как GCaMP 16. Разделительный CNiFER клоны с тем же рецептором , но разными ЕС50 с может быть выгодным для расширения динамического диапазона детектировать высвобождения эндогенного Neurotransmitters в естественных условиях.
Десенсибилизации CNiFER также ограничивает его применение в естественных условиях. Если пик реакции постепенно уменьшается с каждым импульсом агониста, то рецептор может быть десенсибилизирующее. В этом случае, рассмотрим другие клоны, и определить, есть ли они реагируют одинаково. Изменения в последовательности кислотного рецептора амино или использования другого подтипа рецептора может быть необходимо обратиться к агонист-зависимой десенсибилизации. Если известны сайты фосфорилирования или аминокислот определили, что связывают с рецепторных киназ протеина G (GRKs), было бы целесообразно построить не-десенсибилизирующее вариант GPCR путем мутирования одного или нескольких сайтов. Механизм десенсибилизации должен быть определен для каждого рецептора на индивидуальной основе случая.
До сих пор CNiFERs были только имплантируют в поверхностные слои коры 6,7, из - за ограничений , спектроскопических с флуорофоров изображений с двухфотонными мископии 17,18. В будущем, это может быть возможно приспособить технологию CNiFER с волокном на основе измерений флуоресценции 19 таким образом , что CNiFERs может быть имплантирован в подкорковых областях головного мозга.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим Б. Конклин (Калифорнийский университет, Сан - Франциско) за предоставление qi5 г и G qs5 А. кДНК Швейцера за помощь с электроникой, Н. Тэйлор за помощь скрининга клонов, Ян Glaaser и Роберт Рифкин для корректуры и Оливье Griesbeck для TN-XXL. Эта работа была поддержана исследовательских грантов через Национальный институт США по борьбе со злоупотреблением наркотическими средствами (NIDA) (DA029706; DA037170), Национального института биомедицинской визуализации и биоинженерии (NIBIB) (EB003832), Hoffman-La Roche (88610A) и "Neuroscience связанных с наркотиками гранта Злоупотребление "тренировочной через NIDA (DA007315).
Материалы
| Name | Company | Catalog Number | Comments |
| pCDH-CMV-MCS-EF1-Puro | System Biosciences | CD510B-1 | Cloning: for generating lentivirus |
| 12 x 75 *BD Falcon High Clarity Polypropylene Round Bottom Test Tube | BD Biosciences | 352063 | FACS |
| BD 40 um Falcon cell strainers | BD Biosciences | 352340 | FACS |
| 0.05% Trypsin EDTA | Invitrogen | 25200056 | FACS |
| 96 Well Plate, flat bottom, clear | Corning | 3596 | FACS |
| 96 well cell culture plates | Corning | CLS3997 | Flexstation |
| Optilux black clear bottom | Corning | 3603 | Flexstation |
| Flexstation pipet tips | Molecular Devices | 9000-0911 | Flexstation |
| Acetylcholine Chloride | Sigma-Aldrich | A2661 | Flexstation |
| Norepinephrine | Sigma-Aldrich | A7256 | Flexstation |
| Dopamine Hydrochloride | Sigma-Aldrich | PHR1090 | Flexstation |
| GABA | Sigma-Aldrich | A2129 | Flexstation |
| Histamine | Sigma-Aldrich | H7125 | Flexstation |
| Glutamate | Sigma-Aldrich | 49621 | Flexstation |
| Epinephrine | Sigma-Aldrich | E4642 | Flexstation |
| Somatostatin | Sigma-Aldrich | S1763 | Flexstation |
| 5HT | Sigma-Aldrich | H9523 | Flexstation |
| VIP | Alpha Diagnostics Inc. | SP-69627 | Flexstation |
| Orexin A | Alpha Diagnostics Inc. | 12-p-01 | Flexstation |
| Substance P | Sigma-Aldrich | S6883 | Flexstation |
| Adenosine | Sigma-Aldrich | A4036 | Flexstation |
| Melatonin | Sigma-Aldrich | M5250C | Flexstation |
| Fluorescence Plate Reader & software | Molecular Devices | Flexstation 3 | Flexstation |
| DMEM (high glucose) with Glutamax | Life Technologies | 10569-010 | Tissue culture |
| Fetal bovine serum | Life Technologies | 10082-139 | Tissue culture |
| Pen/Strep antibiotics | Life Technologies | 15140-122 | Tissue culture |
| Puromycin | InvivoGen | ant-pr-1 | Tissue culture |
| Fibronectin | Sigma-Aldrich | F0895 | Tissue culture |
| CoolCell LX Alcohol-free controlled-rate cell freezing box | Bioexpress | D-3508) | Tissue culture |
| cyanoacrylate glue | Loctite | Loctite no. 495 | surgery and stereotaxic injection |
| plastic paraffin film | VWR | Parafilm® | surgery and stereotaxic injection |
| Nanoinjector | Drummond | 3-000-204 | surgery and stereotaxic injection |
| Glass electrodes | Drummond | 3-000-203G | surgery and stereotaxic injection |
| hand held drill | OSADA | Exl-M40 | surgery and stereotaxic injection |
| Burrs for drill | Fine Scientific | 19007-05; 19007-07) | surgery and stereotaxic injection |
| Sterilizing bath | FST | 18000-45, Hot Bead Sterilizer | surgery and stereotaxic injection |
| isoflurane chamber/mask | Highland Medical Equipment | 564-0427, HME 109 Table Top Anesthetic Machine with Isoflurane Vaporizer, O2 Flowmeter, Gang Valve; 564-0852, Induction Chamber 16X7X7.5cm | surgery and stereotaxic injection |
| 3D scope with arm | Zeiss | surgery and stereotaxic injection | |
| fiber optic light | surgery and stereotaxic injection | ||
| Betadine | surgery and stereotaxic injection | ||
| 70 % (v/v) isopropyl alcohol | surgery and stereotaxic injection | ||
| Povidone-Iodine Prep Pads | dynarex | 1108 | surgery and stereotaxic injection |
| NaCl 0.9% (injection, USP, 918610) | surgery and stereotaxic injection | ||
| CYCLOSPORINE (INJECTION, USP) | surgery and stereotaxic injection | ||
| Buprenex (injection) buprenorphine (0.03 μg per g rodent) | Sigma-Aldrich | surgery and stereotaxic injection | |
| Ophthalmic ointment | Akorn | NDC 17478-235-35 | surgery and stereotaxic injection |
| Surgifoam | Ethicon | surgery and stereotaxic injection | |
| Grip dental cement | Dentsply | #675571, 675572 | surgery and stereotaxic injection |
| Instant SuperGlue | NDindustries | surgery and stereotaxic injection | |
| LOCTITE 4041 | surgery and stereotaxic injection | ||
| METABOND | C&B | surgery and stereotaxic injection | |
| no. 0 cover glass | Fisher | surgery and stereotaxic injection | |
| stereotaxic frame | Kopf | surgery and stereotaxic injection | |
| Rectal probe and heating pad | FHC | 40-90-8D, DC Temperature Controller,40-90-2-06, 6.5X9.5cm Heating Pad40-90-5D-02, Rectal Thermistor Probe | surgery and stereotaxic injection |
| optical breadboard for imaging | Thorlabs | surgery and stereotaxic injection | |
| Mineral oil | Fisher | S55667 | surgery and stereotaxic injection |
| Kwik-Cast (Silicone elastomer) | World Precision Instruments | surgery and stereotaxic injection | |
| Suture | Ethicon | 18’’, 1667, 4-0 | surgery and stereotaxic injection |
| Scissors | Fine Scientific Tools | 91500-09, 15018-10 | surgery and stereotaxic injection |
| Forcepts | Fine Scientific Tools | 11252-30; #55, 11295-51; Grafe, 11050-10 | surgery and stereotaxic injection |
| Student Halsted-Mosquito Hemostats | Fine Scientific Tools | 91308-12 | surgery and stereotaxic injection |
| Small Vessel Cauterizer Kit | Fine Scientific Tools | 18000-00 | surgery and stereotaxic injection |
| Hot Bead Sterilizers | Fine Scientific Tools | 18000-45 | surgery and stereotaxic injection |
| Instrument Case with Silicone Mat | Fine Scientific Tools | 20311-21 | surgery and stereotaxic injection |
| Plastic Sterilization Containers with Silicone Mat | Fine Scientific Tools | 20810-01 | surgery and stereotaxic injection |
| 2P fixed-stage fluorescence scope for in vivo imaging | Olympus | FV1200 MPE | in vivo imaging |
| Multiphoton laser | SpectraPhysics | Mai Tai DeepSee | in vivo imaging |
| Green Laser | Olympus | 473 nm Laser | in vivo imaging |
| xy translational base | Scientifica | MMBP | in vivo imaging |
| FRET filter cube for YFP and CFP | Olympus | in vivo imaging | |
| 10x and 40x water immersion objectives | Olympus | in vivo imaging | |
| air table | Newport | in vivo imaging | |
| custom built light-tight cage | Thorlab | in vivo imaging |
Ссылки
- Day, J. C., Kornecook, T. J., Quirion, R. Application of in vivo. microdialysis to the study of cholinergic systems. Methods. 23, 21-39 (2001).
- Robinson, D. L., Venton, B. J., Heien, M. L., Wightman, R. M. Detecting subsecond dopamine release with fast-scan cyclic voltammetry in vivo. Clin Chem. 49, 1763-1773 (2003).
- Liang, R., Broussard, G. J., Tian, L. Imaging Chemical Neurotransmission with Genetically Encoded Fluorescent Sensors. ACS Chem Neurosci. , (2015).
- Okubo, Y., et al. Imaging extrasynaptic glutamate dynamics in the brain. Proc. Natl. Acad. Sci. USA. 107, 6526-6531 (2010).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods. 10, 162-170 (2013).
- Nguyen, Q. T., et al. An in vivo biosensor for neurotransmitter release and in situ receptor activity. Nat Neurosci. 13, 127-132 (2010).
- Muller, A., Joseph, V., Slesinger, P. A., Kleinfeld, D. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods. 11, 1245-1252 (2014).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. , e3998 (2012).
- Wang, X., McManus, M. Lentivirus production. J Vis Exp. , (2009).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Gjα. Nature. 363, 274-276 (1993).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1, 3166-3173 (2006).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. , (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7, 981-984 (2010).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32, 1277-1309 (2012).
- Yamauchi, J. G., et al. Characterizing ligand-gated ion channel receptors with genetically encoded Ca2+ sensors. PLoS One. 6, e16519 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. 32, 13819-13840 (2012).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2, 932-940 (2005).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Cui, G., et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 494, 238-242 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены