Method Article
Construcción de base de células fluorescentes de neurotransmisores (Engineered Reporteros CNiFERs) para la detección óptica de los neurotransmisores
En este artículo
Resumen
Se presenta un protocolo para crear reporteros de ingeniería a base de células fluorescentes (neurotransmisor CNiFERs) para la detección óptica de la liberación de neurotransmisores volumétrica.
Resumen
Reporteros de ingeniería a base de células fluorescentes (neurotransmisor CNiFERs) proporcionan una nueva herramienta para los neurocientíficos para detectar ópticamente la liberación de neurotransmisores en el cerebro in vivo. Un CNiFER específica se crea a partir de una célula de riñón embrionario humano que expresa de forma estable una proteína G-receptor acoplado específica, que se acopla a G q / 11 proteínas G, y una basada en FRET Ca 2+ -detector, TN-XXL. La activación del receptor conduce a un aumento en la señal de FRET. CNiFERs tienen sensibilidad nM y una respuesta temporal de segundo porque un clon CNiFER utiliza el receptor nativo para un neurotransmisor particular, por ejemplo, D2R para la dopamina. CNiFERs se implantan directamente en el cerebro, lo que les permite detectar la liberación de neurotransmisores con una resolución espacial de menos de un centenar de micras, lo que es ideal para medir la transmisión de volumen in vivo. CNiFERs también se puede utilizar para detectar otros fármacos para el potencial de reactividad cruzada en vivo. Recientemente hemos ampliado la familia de CNiFERs para incluir los GPCR que se acoplan a G i / o proteínas G. CNiFERs están disponibles para la detección de la acetilcolina (ACh), dopamina (DA) y norepinefrina (NE). Teniendo en cuenta que cualquier GPCR puede ser utilizado para crear una novela CNiFER y que hay aproximadamente 800 GPCRs en el genoma humano, como se describe aquí el procedimiento general para diseñar, realizar, y probar cualquier tipo de CNiFER.
Introducción
Para comprender completamente cómo se comunican las neuronas en el cerebro, es necesario disponer de un método para medir la liberación de neurotransmisores en vivo. Existen varias técnicas bien establecidas para la medición de los neurotransmisores en vivo. Una técnica comúnmente usada es de microdiálisis, en el que se inserta una cánula en el cerebro y un pequeño volumen de líquido cefalorraquídeo se recoge y se analizó mediante cromatografía líquida de alto rendimiento y detección electroquímica 1. La microdiálisis tiene una resolución espacial del orden de unos pocos diámetros de la sonda, por ejemplo, ~ 0,5 mm para una microsonda de 200 m de diámetro. La resolución temporal de esta técnica, sin embargo, es lento debido a los intervalos de muestreo que típicamente duran ~ 5 min o más 1. Por otra parte, los análisis no se realizan en tiempo real. Otra técnica es escaneado rápido voltametría cíclica (FSCV), que utiliza una sonda de fibra de carbono que se inserta en el cerebro. FSCV tiene una excelente tempresolución por vía oral (por debajo del segundo), alta sensibilidad (nanomolar), y la resolución espacial con diámetro de la sonda de 5 a 30 micras. Sin embargo, FSCV está limitada a los transmisores que producen una oxidación característica y el perfil de reducción con el voltaje en una sonda potenciométrica de carbono 2.
Una tercera técnica para medir los neurotransmisores es directamente a través de neurotransmisores codificado genéticamente biosensores (NT) 3. Con este método, se crea una proteína de fusión que contiene un dominio de unión a ligando para un transmisor acoplado a una transferencia de energía por resonancia de fluorescencia (FRET) par de fluoróforos con base 4 o una GFP permutado 5. A diferencia de los dos métodos anteriores, estos biosensores están genéticamente codificados y expresados en la superficie de una célula huésped, tal como una neurona, a través de la producción de animales transgénicos o de forma aguda con el uso de agentes virales para infectar las células. Hasta la fecha, los biosensores codificados genéticamente sólo se han desarrollado para detecting glutamato y GABA 3-5. Limitaciones con estas técnicas han sido la baja sensibilidad, en el rango nM, y la incapacidad para ampliar la detección al gran número de transmisores, por ejemplo, neurotransmisores clásicos, neuropéptidos y neuromoduladores, que señalan a través de receptores acoplados a proteínas G (GPCRs). De hecho, hay cerca de 800 GPCRs en el genoma humano.
Para hacer frente a estas deficiencias, hemos desarrollado una herramienta innovadora para la liberación medida ópticamente de cualquier neurotransmisor que las señales a través de un GPCR. (Reporteros ingeniería neurotransmisor fluorescentes basado en células) CNiFERs son células HEK293 clonales ingeniería genética para expresar un GPCR específico que, cuando se estimula, provoca un aumento de intracelular [Ca 2 +] que es detectada por un sensor de Ca2 + a base de FRET codificado genéticamente, TN-XXL. Por lo tanto, CNiFERs transformada de unión en un cambio en la fluorescencia, proporcionando un r óptica en tiempo real directa y receptor neurotransmisoread de salida de la actividad del neurotransmisor local. Mediante la utilización del receptor nativo para un neurotransmisor determinado, CNiFERs retienen la especificidad química, la afinidad y la dinámica temporal de los receptores expresados de forma endógena. Hasta la fecha, hemos creado tres tipos de CNiFERs, una para la detección de la acetilcolina mediante el receptor M1, uno para la detección de la dopamina usando el receptor D2, y uno para la detección de norepinefrina mediante el 6,7 receptor a1a. La tecnología CNiFER es fácilmente ampliable y escalable, por lo que es susceptible de cualquier tipo de GPCR. En este artículo JoVe, describimos e ilustramos la metodología para diseñar, realizar, y la prueba en vivo CNiFERs para cualquier aplicación.
Protocolo
Todos los animales procedimientos realizados en este estudio están de acuerdo con el Cuidado de Animales institucional y el empleo directrices del Comité (IACUC), y han sido aprobados por el IACUC en la Escuela de Medicina de Icahn en el Monte Sinaí y la Universidad de California, San Diego.
1. Generar GPCR que expresan Lentivirus para transformar células HEK293
- Obtener el ADNc para un GPCR específico de una fuente comercial, por ejemplo, cdna.org. Alternativamente, amplificar el gen de GPCR de una biblioteca de cDNA utilizando PCR. Obtener un vector lentiviral que expresa, como Pcdh-CMV-MCS-EF1-Puro (Pcdh). Usar este vector para propagar el ADN, así como para generar lentivirus.
- Clonar el ADNc de GPCR en el vector de lentivirus que expresan por PCR. Ver Lorenz 8, para más detalles sobre la subclonación de PCR.
- Ampliar y purificar el ADN de GPCR-Pcdh utilizando un kit de preparación 'maxi' libre de endotoxinas de acuerdo con las instrucciones del fabricante. Confirmar que el ADNc de GPCR subclonó en Pcdh es mutation-libre por secuenciación del ADN.
Nota: Antes de enviar el ADN para la producción de virus, digerir una alícuota con la enzima de restricción apropiada para confirmar el tamaño del inserto y la pureza de ADN. - Generar lentivirus usando una instalación de núcleo del virus, tales como uno en el Instituto Salk, Universidad de Penn., O de la Universidad de Carolina del Norte, etc., o generar internamente 9. Utilice aproximadamente 25 g (> 1 mg / l) de ADN libre de endotoxina para la transfección de células HEK en un matraz T75. Asegúrese de que el ADN es de alta pureza, que tiene una relación de absorbancia (A 260 / A 280) de ~ 1,8.
Nota: Los títulos de virus de ~ 10 11 -10 12 GC / ml son óptimas para la transducción de células HEK293.
2. La elección de HEK293 / TN-XXL Tipo Backbone de la célula de cultivo in vitro
Nota: Determinar la proteína especificidad de acoplamiento G, por ejemplo, G i / o, G q / 11, o las proteínas G G s, del GPCR, ya que esto dicstados si es necesario hacerle una proteína quimera G para el CNiFER. Para receptores -junto G q, por ejemplo, los receptores muscarínicos M1, elija HEK293 / TN-XXL (# 3G8) como la columna vertebral HEK293 tipo de célula. Para G i receptores / o -junto, se necesita la quimérico proteína G G qi5 10. Para el receptor -junto G s, se necesita la QS5 quimera G 10. En este protocolo, la construcción de un D2R CNiFER se utiliza como un ejemplo. D2R señales a través de G i / o proteínas G y requiere células HEK293 que expresan de forma estable la proteína G quimérica, qi5 G, por ejemplo, HEK293 / TN-XXL / G qi5 _ # qi5.6.
- Obtener los qi5 HEK293 / TN-XXL / G _ # qi5.6 células clonales de un laboratorio de investigación. Nota: El siguiente células clonales, HEK293 / TN-XXL (# 3G8) para q -junto receptores G, HEK293 / TN-XXL / G qi5 (# qi5.6) de G i / o -junto receptores, y HEK293 / TN -XXL / G QS5 (# qs5.47) para la re -junto G sreceptores, están libremente disponibles a petición 6,7.
- Crecer y expandirse qi5 HEK293 / TN-XXL / G _ # qi5.6 a ~ 90% de confluencia en un matraz T25 con 5 ml de medio de crecimiento HEK293 (Tabla 1). Cultivar las células en un incubador humidificado a 37 ° C con CO 2 al 5% (v / v).
Nota: Todos los trabajos con el cultivo de células HEK293 debe llevarse a cabo utilizando técnicas de cultivo de tejidos estériles estándar. - Recoger las células HEK293 aspirando primer medio de T25 frasco. Se lavan las células con cuidado mediante la adición de 5 ml de PBS y el balanceo matraz.
- Retire el PBS y añadir 1 ml de 0,05% (w / v) de tripsina / EDTA (Tabla 2). Incubar durante 1 a 2 min a 37 ° C con CO 2 al 5% (v / v).
- Recoger las células y traslado al estéril de 15 ml tubo cónico. Centrifugar durante 5 minutos a 1000 xg en una centrífuga de cultivo de células. Aspirar el sobrenadante.
- Resuspender el sedimento celular en 5 ml de medio de crecimiento HEK293. Contar las células en un hemocitómetro utilizandoazul de tripano. Calcular la densidad celular y continúe con el paso 3.
3. Las células de Lentiviral Transducción de HEK293 / TN-XXL / Gqi5
- Sembrar un matraz T25 con 0,7 x 10 6 células HEK293 qi5 / TN-XXL / G. Cultivar las células en un incubador humidificado a 37 ° C con 5% (v / v) CO 2 hasta ~ 50% de confluencia, después de aproximadamente 1 día. Congelar las células restantes (pasos 8.2 a 8.3). Estas células servirán como el control CNiFER, es decir, un CNiFER que carece de la GPCR.
- En el día de la infección, se diluye la lentivirus que expresan GPCR (paso 1,4) a una concentración final de ~ 10 9 GC / ml en un volumen total de 2 ml de medio de crecimiento HEK293 (Tabla 1). Por ejemplo, añadir 20 l de virus / ml 10 11 GC de 2 ml de medio en un matraz T25.
Nota: La información de título de virus debe ser proporcionada por la instalación del núcleo del virus. Combinar lentivirus y los medios de comunicación en un tubo de centrífuga y se tritura con suavidad. Los títulos elevados de lentivirus son de nivel de bioseguridad 2 (BSL-2). - Aspirar los medios de comunicación del matraz T25. Añadir los 2 ml de mezcla de virus / medios de comunicación desde el paso 3.2. Incubar el matraz T25 O / N a 37 ° C con CO 2 al 5% (v / v).
- Después de un día de la infección, aspirar la mezcla de virus / media y reemplazarlo con medios de cultivo HEK293 que contiene puromicina (2 mg / ml; Tabla 1). Puromicina selecciona para que las células transducidas. Incubar el matraz a 37 ° C con 5% (v / v) CO 2 hasta alrededor de 90% de confluencia, después de ~ 1-2 días.
- Preparar una placa de 96 pocillos (de color negro con fondo transparente) recubiertas con fibronectina, para generar una curva de agonista / activación de 10 puntos en el paso 4.1. En una campana estéril, añadir 50 l de fibronectina (5 g / ml) por pocillo en las filas A y B de la placa de 96 pocillos. Se incuba la placa a temperatura ambiente durante 1 hora. Enjuague dos veces por 5 min por enjuague con PBS. Añadir 50 l de medio de crecimiento e incubar HEK293 O / N a 37 ° C con CO 2 al 5% (v / v).
Nota: Fibronplacas ectin tratados están disponibles comercialmente. - Recoger las células en el matraz T25 como se describe en los pasos 2,3-2,6 (Tabla 2).
- Resuspender el sedimento celular en 5 ml de medio de crecimiento HEK293. Sembrar un matraz T25 con 1,5 ml de células para el análisis FACS. Además, las semillas de un matraz T75 con 1 ml de células para la congelación y almacenamiento (consulte los pasos 8.2 a 8.3)
- Para la curva de agonista de 10 puntos, semilla de las dos primeras filas (A y B) de una placa de 96 pocillos recubiertos de fibronectina (del paso 3,5) con 100 l de la suspensión de células por pocillo.
- Se incuban las células HEK293 que crecen en un matraz T25, un matraz T75 y una placa de 96 pocillos hasta alrededor de ~ 90% de confluencia a 37 ° C con CO 2 al 5% (v / v), después de ~ 1-2 días.
4. FACS y aislamiento de clones individuales CNiFER
- Utilice la placa de 96 pocillos para la generación de una curva de activación agonista de 10 puntos.
Nota: Antes de comenzar celular activada por fluorescencia análisis (FACS), es importante para confirmar laexpresión del GPCR ensayando células transducidas para una respuesta agonista (curva agonista de 10 puntos). Esta prueba se lleva a cabo usando un lector de placas fluorométrico.- Preparar una placa de drogas para la curva de activación agonista de 10 puntos. Elija 10 concentraciones diferentes agonistas que enmarquen solamente el predijeron CE 50, que se pueden determinar a partir de la literatura.
Nota: La placa de fármaco contiene de 3 veces de cada concentración (por duplicado) para ajustar la dilución 1: 3 en la placa de CNiFER. Por ejemplo, la placa de drogas para probar un D2 CNiFER contiene 10 concentraciones diferentes de la dopamina a concentraciones de 3 veces; 0,2, 0,5, 1, 3, 5, 10, 20, 30, 50, y 1000 nM. En la placa de CNiFER, por lo tanto, las concentraciones finales de dopamina son 0,067, 0,167, 0,333, 1,00, 1,67, 3,33, 6,67, 10,0, 16,7, y 333 nM. - Preparar las soluciones de agonista utilizando un fluido artificial cerebral espinal (ACSF) (Tabla 1). Use dos pozos de 'ACSF', por ejemplo, A1 y A2,y dos pozos de 'no' células, por ejemplo, B1 y B2.
Nota: Preparar diferentes concentraciones de fármacos utilizando un método de dilución en serie. Crear una plantilla para realizar un seguimiento de los clones CNiFER y las concentraciones del fármaco (Figura 3). - Utilice el software para programar el lector de placas de 96 pocillos fluorométrico para la medición de FRET y la realización de transferencias de solución.
- Ajuste la temperatura lector de placas a 37 ° C.
- Para la medición de FRET con TN-XXL, ajuste la longitud de onda de excitación de 436 nm ± 4,5 (± HWHM centro). Establecer los filtros de emisión a 485 nm ± 7,5 para eCFP y a 527 ± 7,5 nm para citrino. Ajuste el filtro de corte a 475 y 515 nm para eCFP y citrino, respectivamente.
- Programar el lector de placas para medir la emisión a 485 nm y 527 nm cada 4 segundos para un total de 180 seg. Elija la opción de entregar 50 l de la placa de drogas 3 veces a los 100 l en la placa CNiFER, después de recoger 30 seg dede fluorescencia de línea de base.
- Aspirar los medios de comunicación de las filas A y B y añadir 100 l de ACSF a la placa de 96 pocillos CNiFER que es ~ 90% de confluencia (paso 3.9).
- Cargar la placa CNiFER de 96 pocillos y la placa de drogas '3 veces' en el lector de placas. Permitir ~ 30 min para equilibrar las placas a 37 ° C. A continuación, inicie el programa.
- Para analizar los datos de lector de placas, exportar los valores de fluorescencia a una hoja de cálculo. Crear una fórmula para restar las mediciones de fondo (tomadas para cada señal de pozos sin células) de pozos con CNiFERs. Normalizar las intensidades de fluorescencia para antes del estímulo líneas de base, M citrino (t) / M citrino (línea de base), y calcular la relación de FRET (? R / R;. Ecuación 1) usando las respuestas de los picos a 527 nm y 485 emisiones nm (véase la etapa 11 ).
Nota: Si no hay un cambio significativo en? R / R con el agonista, entonces esto indica la expresión del GPCR y se puede proceder al análisis FACS (paso 4.2). Si THERE hay respuesta FRET con agonista, solucionar mediante el uso de un ionóforo de Ca2 +, por ejemplo, A21387, para probar la respuesta de Ca2 + y confirmar que el sensor basado en FRET está funcionando. Si el ionóforo funciona, entonces el receptor se expresa no es probable.
- Preparar una placa de drogas para la curva de activación agonista de 10 puntos. Elija 10 concentraciones diferentes agonistas que enmarquen solamente el predijeron CE 50, que se pueden determinar a partir de la literatura.
- En el día antes de FACS, preparar cuatro placas de 96 pocillos recubiertas con fibronectina (véase el paso 3.5) para recoger las células clasificadas. Añadir 50 l de medio de crecimiento e incubar HEK293 O / N a 37 ° C con CO 2 al 5% (v / v).
- Preparar 5% (w / v) de BSA en PBS (5 g / 100 ml) y el filtro (0.2 m) en un frasco estéril.
- Recoger las células cultivadas en el matraz T25 (consulte los pasos 2.3-2.5, Cuadro 2). Resuspender el sedimento de células en 4 ml de 5% (w / v) de BSA en PBS. Centrifugar las células a 1000 xg durante 5 min.
- Aspirar los medios de comunicación y resuspender el sedimento celular en ~ 5 ml de 5% (w / v) de BSA en PBS para dar una concentración final de ~ 5 x 10 6 células / ml.
Nota: Consulte con la FAinstalación central de CS para los requisitos específicos sobre la densidad celular y las condiciones de clasificación. - Filtre las células resuspendidas con un filtro de células de 40 micras para eliminar los grumos. Transferir las células a un polipropileno 5 ml ronda tubo inferior. Se coloca el tubo en hielo durante el transporte a la instalación de FACS.
- Clasificar las células HEK293 transducidas en un centro de FACS. Programa de los parámetros en un citómetro de flujo FACS de la siguiente manera: Conjunto de 4 ° C para el soporte de la muestra, 100 micras para la boquilla y 20 psi. Con base en el análisis previo a la especie, seleccione las celdas, es decir, elegir una 'puerta', que tiene una gran fluorescencia eCFP (eCFP de excitación, emisión eCFP) y grandes FRET (excitación eCFP, emisión citrina) de fluorescencia (ver Resultados abajo, la Figura 2 ).
- Fuerte individual, células clasificadas en una placa de 96 pocillos preparada en la etapa 4.2, con un solo clon por pocillo que contiene 50 l de medio de crecimiento HEK293 con puromicina. Añadir 50 l de medio de crecimiento HEK293 con puromicina (Table 1) para un total de 100 l por pocillo. Mantener las células O / N a 37 ° C con CO 2 al 5% (v / v).
Nota: medios de cultivo HEK293 contiene puromicina para la selección de células transducidas.
5. El cultivo y la expansión de Ordenada, CNiFERs clonales
- Mantener los CNiFERs en las placas de 96 pocillos mediante la eliminación de 50 l de los viejos medios de cada pocillo y la sustitución con 50 l de medio de crecimiento fresco HEK293 que contienen puromicina (Tabla 1). Repita este cada 5 a 7 días hasta ~ 90% de confluencia, después de 2-3 semanas.
- Cosecha CNiFER células aspirando suavemente los medios de comunicación y enjuagar suavemente una vez con PBS. Retirar el PBS y añadir 20 l de 0,05% (w / v) de tripsina / EDTA. Incubar durante 1 a 2 min a 37 ° C con CO 2 al 5% (v / v).
- Añadir 100 l de medio de crecimiento a las células HEK293 tratados con tripsina y resuspender las células. contenidos de transferencia a una placa de 24 pocillos que contenía 400 l fresca HEK293 ingenio medios de cultivoh puromicina. En la placa de 24 pocillos, mantener las células mediante la sustitución de 250 l de medio de crecimiento HEK293 cada 5-7 días hasta que los pozos son ~ 90% de confluencia.
6. Identificar CNiFERs candidato en función de FRET de respuesta mediante lector de placas fluorométrico
Nota: Con cuatro placas de 96 pocillos después de FACS, no debería ser> 100 clones comprobables que sobreviven y se expanden a la etapa de placa de 24 pocillos, ya que muchos de los clones originales dejan de crecer. Para identificar potenciales candidatos CNiFERs, utilizar un análisis de 3 puntos para la respuesta de FRET con agonista afín, por ejemplo, la dopamina para D2R.
- Cuando las células son ~ 90% de confluencia en la placa de 24 pocillos, aspirar suavemente los medios de comunicación. Añadir ~ 100 l de 0,05% (w / v) de tripsina / EDTA y se incuba durante 1-2 min a 37 ° C con CO 2 al 5% (v / v). Añadir 400 l de medio de crecimiento a las células HEK293 tratados con tripsina y mezclar las células por trituración suave.
- Ajustar la curva agonista de 3 puntos para el cribado inicial de la clones. Para cada clon CNiFER, es decir, uno de los pozos de la placa de 24 pocillos, alícuota de 100 l de la suspensión de células (~ 4 x 10 3 células / pocillo) en cada uno de tres pozos, por ejemplo, A1, A2, A3, de una placa de 96 pocillos recubiertos de fibronectina (negro con fondo claro) (véase el paso 3.5).
- La transferencia de los restantes ~ 200 l de la suspensión celular a una placa de 12 pocillos que contenía 1.000 l de medio de crecimiento HEK293 (1,2 ml de volumen final). Incubar las dos placas a 37 ° C con CO 2 al 5% (v / v), hasta ~ 90% de confluencia. La placa de 96 pocillos es para el ensayo fluorométrico y la placa de 12 pocillos es para el cultivo y la expansión de los clones.
- Para el análisis de 3 puntos, determinar tres concentraciones diferentes de agonista que son 0,1-, 1,0-, y 10 veces la de la CE 50 para el GPCR específico. Preparar las concentraciones de agonista en una placa de drogas como se describe en los pasos 4.1.1-4.1.2. Realizar un ensayo de lector de placas fluorométrico tal como se describe en los pasos 4.1.3-4.1.5.
- Calcular la FRrelación de ET (? R / R) como se describe en el paso 4.1.6. Elija CNiFERs que tienen la sensibilidad adecuada y mayor respuesta de FRET para la expansión, la congelación de vuelta, y los análisis más completos (paso 7).
- Para los clones que fueron seleccionados en el paso 6.5 y están creciendo en la placa de 12 pocillos, remover y reemplazar 600 l de los medios de cultivo HEK293 cada 5 a 7 días, hasta ~ 90% de confluencia.
- Poco a poco ampliar los clones de una placa de 12 pocillos a una placa de 6 pocillos, y después a un matraz T25 (pasos 2.3 a 2.6 y en la Tabla 2). Cuando el matraz T25 es ~ 90% confluentes, las células de cosecha como se describe (pasos 2.3 a 2.5). Resuspender el sedimento celular en 5 ml de medio de crecimiento HEK293.
- Añadir 1 ml de suspensión celular a un matraz T75 con 9 ml de medio de crecimiento HEK293. Usa los restantes 4 ml de la suspensión celular para crioprotección y almacenamiento en N líquido 2 (pasos 8.2 a 8.3). Preparar ocho 1,5 ml criotubos y colocar en hielo.
- En el matraz T75, mantener las células mediante la sustitución de los medios de comunicación wITH medio de crecimiento fresco HEK293, por ejemplo, 10 ml cada 3-5 días hasta un 70-80% de confluencia, después de ~ 1-2 semanas.
7. Selección final de CNiFER clones usando lector de placas fluorométrico
- En el día antes del ensayo lector de placas:
- Cosecha de células confluentes un matraz T75 ~ 90% (consulte los pasos 2.3-2.6, Cuadro 2). Inicializar una placa recubiertos de fibronectina de 96 pocillos (de color negro con fondo claro) a 5 x 10 4 / pocillo con ~ 100 l de suspensión celular. Nota: Un clon se distribuye en una sola placa de 96 pocillos.
- Preparar una placa de drogas para la detección completa de clones CNiFER, distinguiendo respuestas agonista específico de respuestas CNiFER no específicos.
- Para generar una curva dosis-respuesta completa, seleccione 10 concentraciones diferentes agonistas de todo el CE pronosticado 50. Use dos pozos de 'no' células y dos pozos para 'ACSF'.
- Para la determinación de las respuestas no específicas, elija three concentraciones de 12 diferentes neurotransmisores o moduladores (72 pozos) (Figura 3). Al igual que el agonista, la placa de fármaco contiene concentraciones de 3 veces en duplicado. Por ejemplo, 100 l de tres concentraciones diferentes de la acetilcolina, glutamato, orexina, VIP, adenosina, serotonina, norepinefrina, GABA, sustancia P, la melatonina, la somatostatina y la histamina, cada uno a una concentración de 3 veces de 50, 1000, y 3000 nM se cargan en la placa de fármaco de 96 pocillos.
- Establecer los parámetros para el lector de placas fluorométrico para la medición de FRET y la realización de transferencias de solución como se describe en los pasos 4.1.3-4.1.5.
- Para el análisis de la curva de respuesta de dosis completa, calcular la relación de pico FRET (? R / R) (etapa 4.1.6), la trama como una función de la concentración de agonista de registro y encajar con la ecuación de Hill (paso 11.4). Determinar la CE 50, coeficiente de Hill, y de relación máxima FRET. Para los otros 12 neurotransmisores / moduladores, parcela pico? R / R en función of concentración del fármaco.
- Elija clones ~ 10 CNiFER que tienen una gran relación de FRET, una CE apropiado 50 para el agonista cognado, y poco o nada de las respuestas de fondo para otros agonistas de neurotransmisores (respuesta no específica).
Los clones CNiFER 8. Freeze-back seleccionados
- Utilice un matraz confluente T75 ~ 90% de un clon individual CNiFER. Las células de la cosecha como se describe (pasos 2.3 a 2.5, Tabla 2). Para las células de congelación, resuspender el sedimento celular en 5 ml de medio de crecimiento HEK293. Etiquetar diez 1,5 ml criotubos y establecer en hielo.
- Para cryoprotection, las células de la mezcla 1: 1 con 20% (v / v) de DMSO en medio de crecimiento HEK293, por ejemplo, 5 ml de la 20% (v / v) mezcla de DMSO / media se mezcla suavemente con 5 ml de suspensión celular (Final concentración de DMSO es 10%).
- Alícuota 1 ml en cada uno de los criotubos. Congelación de tubos con las células en un congelador a -80ºC O / N, en una caja de espuma de aislamiento (ver Materiales). Transferencia a criotubos Liqunitrógeno de identificación para almacenamiento a largo plazo.
9. CNiFER implantación en el ratón de la corteza
- Esterilizar todos los instrumentos quirúrgicos en un autoclave antes de la cirugía. Preparar un campo semi-estériles para cirugía frotando con un 70% de etanol y se fijan un pañal de laboratorio limpia.
- Prepare la pipeta de inyección CNiFER tirando de un capilar de vidrio (Identificación de 0,53 mm) en un extractor de electrodos vertical. Use un par de ninguna. 5 fórceps de punta fina para romper la punta del electrodo a un diámetro de ~ 40 m.
Nota: Esto se logra mejor con un microscopio estéreo con zoom con una retícula. - Anestesiar un adulto (día postnatal 60-90) C57BL / 6 de ratón con isoflurano: 4% (v / v) para la inducción y de 1,5 a 2,0% (v / v) para el mantenimiento. Utilice la cola o pellizco del dedo del pie para asegurarse de que el ratón está totalmente anestesiado.
Nota: Re-pinch periódicamente y evaluar los espasmos de la barba durante toda la operación de volver a evaluar la profundidad de la anestesia. - Cubrir los ojos con ungüento oftálmico aprevenir secado. Montar el ratón en un marco estereotáxico con barras de oído. Se mantiene la temperatura corporal del ratón a 37 ° C usando una almohadilla de calor regulada por una sonda rectal.
- Afeitarse un área de aproximadamente 5 mm por 12 mm con una máquina de afeitar eléctrica de los animales. Aplicar Betadine seguido por 70% (v / v) isopropanol. Utilice una hoja de bisturí para cortar y retirar la piel sobre la superficie del cráneo. Utilice una hoja de escalpelo para eliminar el periostio de la superficie del cráneo. Exponer y limpiar la superficie del cráneo, tal como se describe para la cirugía estereotáxica 11.
- Bajar una pipeta de vidrio vacía para bregma y registrar el antero-posterior (A / P) y medio-lateral (M / L) coordina. Haciendo referencia a los atlas de cerebro de ratón, calcular la posición del punto de inyección. Cambiar la pipeta al sitio de destino y marca el cráneo para la formación de la ventana posterior. Ver Cetin et al., Para más detalles sobre las inyecciones estereotáxica con roedores 11.
Nota: el sitio de la inyección y de la ventana depende de la regiones para ser estudiados y la distribución de neurotransmisores peptídicos o liberación de las proyecciones de la corteza. Por ejemplo, en una reciente publicación 7, el estereotáxica coordenadas +1.0 a +2,0 mm A / P y +1.0 a +2,0 mm M / L fueron utilizados para inyectar células CNiFER en la corteza frontal para obtener imágenes in vivo de la liberación de dopamina durante el condicionamiento clásico . - Formar una ventana de x-cráneo adelgazado 2 mm 3 mm, como se ha descrito previamente 12,13.
Nota: El hueso de la ventana debe ser de 15-20 micras de espesor. Los pequeños puntos blancos en la médula no deben ser visibles cuando se humedece la superficie del cráneo, si el hueso está suficientemente diluida 12,13. - Colocar un ACSF esponja empapada en la ventana para mantenerla húmeda mientras se prepara para inyectar células.
- Se recoge el clon CNiFER que se cultivó en un matraz T75 a ~ 80% de confluencia. Aspirar los medios de comunicación y se lavan las células con PBS estéril.
Nota: La tripsina se omite para estos pasos. - Retirar PBS y el uso de 10 ml of ACSF para desalojar las células de la parte inferior del matraz. células triturado en que se disocian grupos de células. Centrifugar y resuspender el precipitado en 100 l de ACSF. Centrifugar durante 30 segundos a 1400 xg y eliminar el sobrenadante, dejando un sedimento de cubierta en ACSF. Este paso deja un grupo de células en suspensión.
- Rellene la pipeta de inyección preparada en el paso 9.2 con aceite mineral, cargar la pipeta en un nanoinjector, y hacer avanzar el émbolo para expulsar una pequeña gota de aceite. Poner 5 l de suspensión de células CNiFER sobre una tira de lámina de parafina de plástico cerca de la preparación del ratón. Elaborar cualquiera de los CNiFERs o controlar las células CNiFER tirado en la pipeta.
- Mover la pipeta a la diana coordenadas X e Y, es decir, A / P y M / L anotado en el paso 9.5. Bajar la pipeta, perforando el cráneo adelgazada, y continúan ~ 200-400 micras por debajo de la superficie del cráneo, para depositar las células CNiFER en las capas de la corteza 2/3.
- Inyectar 4,6 ~ nl de células CNiFER en el lugar más profundo con el nanoinjector, el movimiento nota en la interfaz de petróleo y celular y luego esperar 5 minutos para que las células se dispensan. Retirar la pipeta ~ 100 micras e inyectar otra ~ 4,6 nl de células CNiFER, espere 5 minutos. A continuación, retirar la pipeta lentamente y con cuidado para evitar el reflujo de los CNiFERs. Repetir la inyección en uno o más sitios adyacentes.
- Repita los pasos 9.8 a 9.12 inyección con control de células HEK293 (es decir, HEK293 / TN-XXL / G qi5 clon carece GPCR). Separar la CNiFER y controlar los puntos de inyección de células de ~ 200 micras.
- Después de completar las implantaciones de células, enjuague la ventana-cráneo adelgazado con ACSF y esperar a que el cráneo se seque. Aplicar una gota de pegamento de cianoacrilato (ver Materiales) sobre la ventana y colocar rápidamente una cubierta de vidrio estéril pre-cortado en la parte superior de la cola. Empuje suavemente el cristal de la cubierta contra el cráneo durante unos segundos. Deje que el pegamento se seque durante 2 minutos 12,13.
- Sellar los bordes de la cubierta de vidrio con cemento dental y forma awell alrededor de la ventana para retener el agua para el objetivo de inmersión.
- Para inmovilizar la cabeza del ratón durante la formación de imágenes, adjunte una cabeza-barra hecha a la medida con una pequeña gota de pegamento de cianoacrilato detrás de la ventana (ver 14 para más detalles sobre dimensiones y materiales). Deje que el pegamento se seque completamente y luego añadir cemento dental adicional para reforzar aún más la cabeza de la barra hecha a la medida.
- Cubrir el resto de la superficie del cráneo, a excepción de la ventana, con una capa de cemento dental. Asegúrese de que los bordes de la piel están cubiertos por cemento y dejar secar durante 20 min.
- Después de la cirugía, deje de administración de isoflurano y dejar el ratón sobre una almohadilla térmica en una jaula hasta que se recupere completamente de la anestesia. Inyectar 5% (w / v) de glucosa en solución salina (sc) para la rehidratación y de 0,05 a 0,1 mg de buprenorfina / kg (ip, liberación instantánea) para la analgesia postoperatoria.
Nota: Para minimizar el potencial reacción inmunológica a los CNiFERs humanos, inyecte el ratón diario con 20 l / 100 g ciclosporine (ip) comenzando el día antes de la inyección de CNiFERs. - Vuelva a colocar el puntero del ratón a su jaula para la comida y el agua.
10. En vivo de imágenes de CNiFER Clones
Nota: Imágenes en vivo se lleva a cabo con ratones utilizando un microscopio de dos fotones y un aparato de cabeza fija. no se necesita anestesia durante las sesiones de formación de imágenes. Cuando la formación de imágenes de animales en el estado despierto, limitar reposacabezas a sólo unas pocas horas a la vez para reducir los niveles de estrés. Devolver el animal a ella jaula entre las sesiones de formación de imágenes de alimentos y agua. el estrés potencial se reduce al mínimo mediante el oscurecimiento de las luces de la sala y que rodea parte del ratón en un recinto.
- En el día después de la cirugía, montar el ratón sobre una plataforma de imágenes atornillando la cabeza barra de metal implantado en el cráneo al bastidor de cabeza de fijación.
Nota: Cuando la formación de imágenes ratones despiertos, la sesión de imágenes no debe exceder de unas pocas horas debido a la tensión potencial inducida por el dispositivo reposacabezas. - Coloque la plataforma de imágenes con el ratón de cabeza contenida en un microscopio de dos fotones equipado con un 10X (0,30 NA) y 40x (NA 0,80) objetivos de inmersión en agua.
- Inserte cubo de filtro para formación de imágenes FRET (eCFP y citrino) que tiene un espejo dicroico a 505 nm y filtros de paso de banda que se extienden a 460 nm a 500 nm para la medición de eCFP y 520 nm a 560 nm para la medición de citrino.
- Añadir ACSF a la ventana-cráneo adelgazado así contener y reducir el objetivo de inmersión en agua en el ACSF. Utilice el ocular en conjunción con lámpara de mercurio y el cubo filtro de GFP para localizar la superficie de la corteza y la vasculatura debajo de la ventana.
Nota: El patrón de la vasculatura ayuda a localizar y la imagen de la misma región en repetidas días de formación de imágenes. Cambie al objetivo de inmersión en agua 40X para localizar CNiFERs, centrándose de forma manual en la superficie de la corteza sobre las células utilizando el filtro de cubo GFP y una lámpara de mercurio. - La configuración de dos fotones de imágenes. Seleccione la apade- trayectoria de la luz para obtener imágenes de dos fotones. Para un sistema comercial típico, utilizar el software para cambiar al modo de dos fotones y redirigir la luz de los tubos fotomultiplicadores (PMT) en los detectores no descanned. Encienda el láser pulsado de femtosegundo cerca del infrarrojo, seleccionar una longitud de onda de 820 nm y una potencia de 5-15%. Nota: potencia 5% proporciona típicamente ~ 25 mW a la muestra.
- Ajuste la tensión PMT1 y PMT2 cerca del valor máximo, típicamente 700-1.000 V dependiendo de la PMT. Ajuste la ganancia de 1 para cada canal y poner a cero la posición z para el objetivo.
- Bajar el objetivo ~ 100 a 200 micras de la superficie cortical y comenzar la exploración XY. Ajustar la potencia del láser, la ganancia, y el voltaje de PMT para cada canal, es decir, eCFP y citrino, para optimizar la relación señal a ruido de la fluorescencia CNiFER.
- Utilice la función de zoom en el software para restringir la imagen de una región que contiene las células CNiFER, así como un backgrounla región d. Utilice una velocidad de barrido no más lento que un fotograma cada 2 s (0,5 Hz) a 4 mu s por píxel. Ajuste la línea promedio de la relación señal-ruido adecuado, por ejemplo, de Kalman 2 líneas de promedio.
- Dibuje una región de interés (ROI) en torno a las células CNiFER, que rodea alrededor de 3 a 4 células por avión. Configurar el análisis en tiempo real de la intensidad media de retorno de la inversión. Iniciar la adquisición de fluorescencia para monitorizar CNiFER lo largo del tiempo.
- Recoger fluorescencia de CNiFERs antes y durante las manipulaciones experimentales, por ejemplo, la estimulación eléctrica, la estimulación ChR2, comportamiento, según lo determinado por el usuario.
- Cuando se completa el experimento de formación de imágenes, devuelva el ratón a su jaula. Repetir la formación de imágenes a través de días, según se desee. Al volver a imágenes de las casillas se refieren a la imagen vasculatura de bajo aumento previamente adquiridos para orientar de nuevo al mismo campo de la imagen (paso 10.4).
Nota: CNiFERs implantados se pueden obtener imágenes durante al menos 7 días.
Análisis de datos 11.
- archivo de imagen y seleccione Abrir retorno de la inversión es para CNiFERs y uno retorno de la inversión para el fondo. Seleccione 'análisis de series' para los dos canales de cada ROI. la intensidad de fluorescencia promedio de exportación para cada ROI como un archivo delimitado por tabuladores.
- Use un software matemático (ver Materiales) programa para analizar los valores de fluorescencia. filtro de paso bajo (0,3 Hz) cada señal y luego restar la fluorescencia de fondo en cada ROI de ECFP y Citrino intensidades de fluorescencia.
- Calcular la fluorescencia media de la línea de base y calcular los coeficientes como se describe en la Ecuación 1 para medir la relación de? R FRET (t) / R.
- Para determinar la sensibilidad de CNiFERs, representar gráficamente la relación de FRET como una función de la concentración de agonista de registro. Encajar con la ecuación de Hill para determinar la CE 50 y coeficiente de Hill (n), utilizando el software estadístico científica y el Cerro La ecuación (ecuación 2).

Resultados
A CNiFER se deriva de una célula de riñón embrionario humano (HEK293) que está diseñado para expresar de forma estable al menos dos proteínas: una proteína G específica de receptores acoplados (GPCR) y un codificado genéticamente sensor [2 + Ca], TN-XXL. TN-XXL se somete a la transferencia de energía por resonancia de fluorescencia (FRET) entre las proteínas fluorescentes cian y amarillo, eCFP y citrino, respectivamente, en respuesta a los iones Ca2 + 6,15. La activación de GPCR que se acoplan a proteínas G endógena G q desencadenan un aumento de citosólico [Ca 2 +] través de la ruta PLC / IP 3, lo que lleva a un aumento de FRET desde el detector 2+ TNXXL Ca (Figura 1).
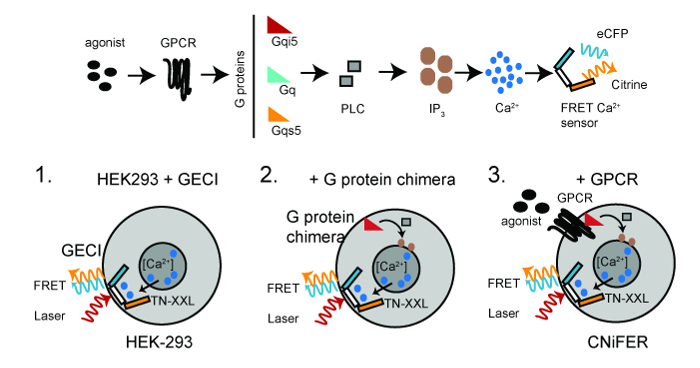
Figura 1:. Régimen para el desarrollo CNiFERs Top, GPCR-Ca 2+ vía de señalización requerida para la creación de unaCNiFER celular. En pocas palabras, los pasos básicos para la construcción de CNiFERs utilizando células HEK293. Paso 1. transducir con codificada genéticamente Ca 2+ -detector basados en FRET (TN-XXL). Paso 2. transducir Gα quimera G-proteína, es decir, QS5 g, qi5 g, si es necesario. Paso 3. GPCR única transducir para crear CNiFER. Dos fotones de luz de excitación (rojo) excita eCFP, que sufre FRET, produciendo tanto una emisión eCFP (cian) y la emisión citrino (amarillo). Por favor, haga clic aquí para ver una versión más grande de esta figura.
El aumento de FRET ofrece una lectura óptica rápida del cambio en los niveles de neurotransmisores. Para desarrollar un CNiFER para un tipo particular de neurotransmisor, determinar primero el tipo de proteína G que se acopla al GPCR. Para G q -junto GPCRs, el GPCR usa proteínas G q endógenamente expresadas encélulas HEK293. Para G i / o -junto GPCRs, una línea clonal HEK293 se crea en primer lugar que expresa una proteína G quimérica que redirige el GPCR al G q -PLC / IP 3 vía. Esto se logra con una proteína G quimérica, qi5 G, que contiene la secuencia q principalmente Gα y cinco aminoácidos del extremo carboxilo terminal de G i. Estos cinco aminoácidos son suficientes para G qi5 para comunicarse con G i / o -junto GPCRs, pero la señal a través de la vía q G. Para los GPCR -junto G s, un QS5 quimera G se utiliza 10. La estrategia general para la producción de un CNiFER es: 1) crear una célula clonal HEK293 que se expresan de forma estable un detector óptico de Ca2 +, es decir, TN-XXL, utilizando una transducción de lentivirus de células HEK, 2) expresar de forma estable una proteína quimera G si es necesario, en el clon de células HEK293 que expresan TN-XXL, y 3) crear un clon GPCR expresan de forma estable en la célula HEK293clon que expresa TN-XXL y la proteína G quimérica. La línea clonal HEK293 que carece de la GPCR, pero tiene el TN-XXL y la proteína G quimérica sirve como el "control CNiFER '. El control CNiFER es necesario para confirmar que la respuesta CNiFER se debe específicamente a la activación de los receptores de ingeniería, es decir, D2R, y no a la activación de otros receptores de forma endógena expresados en células HEK293.
Para generar lentivirus, se utiliza un sistema de expresión de lentivirus, por ejemplo, Pcdh-CMV-MCS-EF1-Puro, que contiene los elementos genéticos responsables de los envases, la transducción, la integración estable de la expresión viral construir en el ADN genómico, y la expresión de la diana secuencia génica. Para producir un alto título de partículas virales, vectores de expresión y de embalaje están transitoriamente cotransfectadas en células de mamíferos productores y se recoge el virus. Hay varias instalaciones del núcleo viral en los EE.UU. que pueden generar alta ti lentivirus ter. Después de la infección de las células HEK293, el gen Puro proporciona resistencia a los antibióticos para la identificación de células HEK293 transducidas.
Con el fin de identificar líneas clonales específicas, transducen las células HEK293 se clasifican utilizando una célula activada por fluorescencia sistema (FACS). El objetivo es aislar un clon que contiene un alto nivel de expresión de detector de Ca2 + a base de FRET y la capacidad de sufrir FRET. En este ejemplo de análisis de FACS, la fluorescencia de la emisión eCFP se representa frente a la señal de FRET (eCFP excitación y emisión citrino). Las cajas marcan regiones (P2 y P3) que serán seleccionados posteriormente ( "gated") para la clasificación en placas de 96 pocillos (Figura 2). Generalmente, cerca de cuatro placas de 96 pocillos son suficientes para la detección de la creación exitosa de CNiFERs. De estos 4 placas, aproximadamente 100 clones son adecuados para el análisis de lector de placas fluorométrico.
e_content "fo: keep-together.within-page =" 1 ">
Figura 2: Ejemplo de Análisis FACS Una muestra de la salida después de un análisis FACS.. El gráfico ECFP de emisión ( "475/20-A") como una función de citrino de emisión ( "FRET V-530/30-A"), utilizando eCFP de excitación para cada celda. Regiones P2 y P3 zonas seleccionados, es decir, cerrada, para la clasificación en las células individuales. Los colores son arbitrarios. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Una vez que las células clasificadas han crecido hasta una densidad suficiente, la respuesta de FRET después de la activación agonista se determina usando un sistema de lector de placas de 96 pocillos fluorométrico equipado con un manejo solución. Para reducir el número de clones para estudiar, una curva agonista "3 puntos" se utiliza para detectar ~100 clones selectos y CNiFERs con las mejores respuestas. Aproximadamente 10 clones son entonces analizados con la determinación de la dosis-respuesta completa con el agonista cognado, y las respuestas no específicas, sondadas con otros 12 neurotransmisores o moduladores. Una placa de fármaco de 96 pocillos se prepara como de tres veces la concentración (concentración final se diluye 1: 3 en placa) de medicamentos (por ejemplo, agonistas, antagonistas, etc.) en ACSF. En este ejemplo, una placa de medicamentos está configurado para probar una D2 CNiFER con su agonista afín, la dopamina, y posibles respuestas no específicas con una variedad de otros agonistas de neurotransmisores y de péptidos (Figura 3). La columna vertebral CNiFER, que carece de la GPCR, sirve como un control importante para el CNiFER recién creado.
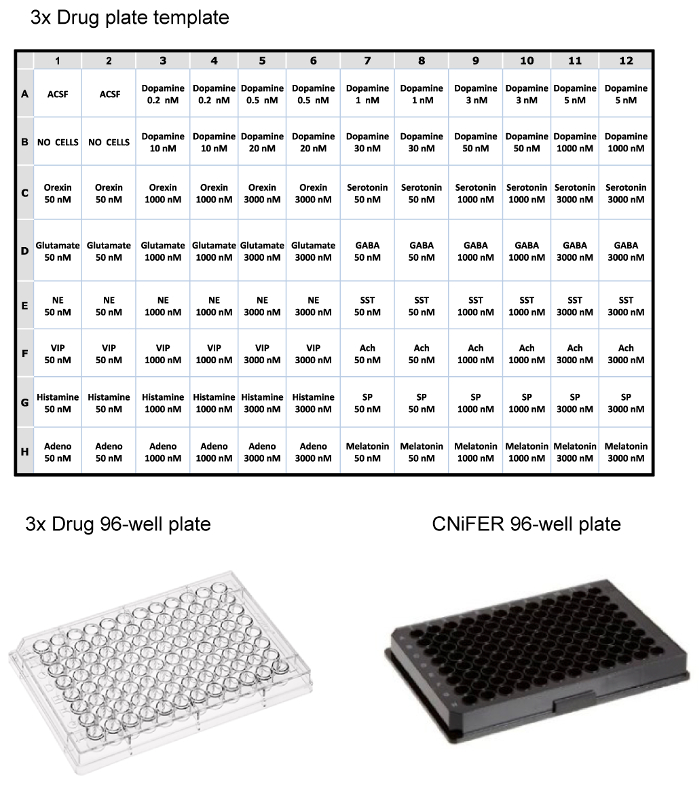
Figura 3:. Los ejemplos de diseño de placas de 96 pocillos superior, mesa de la layout para la carga de una placa de drogas 3x para lector de placas fluorométrico, utilizando concentraciones de tres veces de varios neurotransmisores y péptidos. En pocas palabras, ejemplos de plástico placa de 96 pocillos de drogas claro y negro placa de 96 pocillos para la siembra de CNiFERs y medir en un lector de placas. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Se espera que la estimulación del GPCR para aumentar la respuesta de FRET, como consecuencia de una elevación de intracelular [Ca 2 +] y detección por TN-XXL. En estas condiciones, FRET se produce por eCFP y citrino moviéndose más cerca, por lo que la excitación de eCFP produce una emisión eCFP más pequeño y emisión citrino más grande. En este ejemplo, la excitación se establece en 436 nm y emisión filtros están situados a 485 ± 7,5 nm para eCFP y 527 ± 7,5 nm para citrino (Figura 4). Treinta segundos de bafluorescencia seline se mide y después 50 l de agonista "triple" en la placa de ACSF se entrega a cada 100 l ACSF que contiene bien (dilución 1: 3). eCFP y emisión de fluorescencia citrino se miden cada 3,8 segundos durante 180 seg. mediciones de fondo se toman de los pozos sin células y se restan, si es necesario. intensidades de fluorescencia son normalizadas líneas de base para pre-estímulo (F (t) / F (línea de base)), y respuestas de los picos se miden para el cálculo de la relación de FRET (? R / R) con el F (t) / F (línea de base) de la 527 nm y 485 nm canales (Ecuación 1). Una curva de respuesta a la dosis a continuación, se construye representando gráficamente la relación de FRET como una función de diferentes concentraciones de agonista y encajar con la ecuación de Hill para determinar la CE 50 y el coeficiente de Hill (Figura 5) (Ecuación 2). Una óptima CNiFER exhibe una gran proporción de FRET y una EC 50 apropiada para el agonista afín, y exhibe poca o ninguna respuesta de fondo a otra neurotransmitagonistas del Ter. Por el contrario, el control CNiFER debe mostrar poca respuesta al agonista afín.
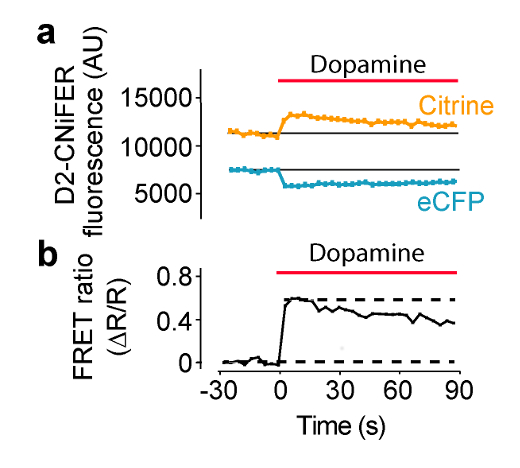
Figura 4: Ejemplo de la actividad agonista inducida por la respuesta de FRET Respuesta D2R CNiFER FRET se mide en un lector de placas con un sistema de entrega de la solución.. (A) Un diagrama de la respuesta de FRET, es decir, la excitación eCFP con ECFP y citrino emisiones, durante la aplicación de la dopamina (barra roja) a D2 CNiFERs. Tenga en cuenta que disminuye la emisión eCFP mientras que citrino de emisión aumenta con el agonista (dopamina). (B) Una representación gráfica de la relación de FRET (Ecuación 1) para la respuesta en la figura (A) modificado de Müller et al., 2014 7. Por favor, haga clic aquí para ver una versión más grande de esta figura.
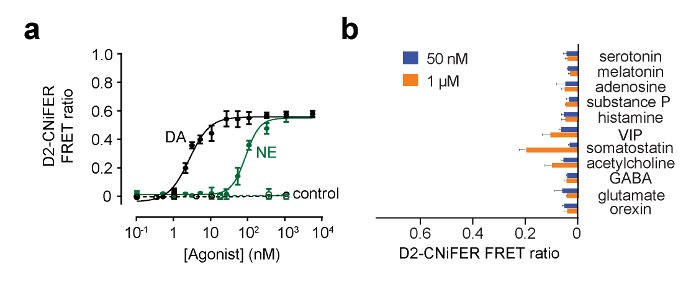
Figura 5:. Ejemplos de curvas de dosis respuesta para D2 CNiFER (A) Dosis curvas de respuesta para la respuesta de D2 CNiFERs a la dopamina (DA, negro) y de noradrenalina (NA, verde). Además, se muestra la respuesta de CNiFERs de "control" que carecen de la D2R. (B) El gráfico de barras muestra la respuesta de relación de FRET para otros neurotransmisores y moduladores a 50 nM y 1 mM. Los valores son medias ± SEM. La figura modificada de Müller et al., 2014 7. Haga clic aquí para ver una versión más grande de esta figura.
CNiFER clones pueden evaluarse posteriormente para una posible desensibilización dependiente del receptor y para su resolución temporal, discriminando la presentaciónde dos pulsos diferentes agonistas (para más detalles, véase Muller et al., 2014 7). Habiendo construido un clon CNiFER, el siguiente paso es poner a prueba su función in vivo. Para monitorizar la fluorescencia in vivo, es necesario el uso de un microscopio de dos fotones. Después de preparar una ventana de cráneo adelgazado, CNiFERs se cargan en una pipeta de vidrio y se inyectan en capas 2/3 de la corteza. A continuación se prepara el ratón para formación de imágenes in vivo mediante la fijación de una hoja de la cubierta de vidrio en el cráneo adelgazada, y la implantación de una barra de cabeza para la fijación de la cabeza durante la exploración (Figura 6).
Para determinar que el CNiFERs implantados son viables in vivo, concentraciones conocidas de agonista se pueden inyectar cerca del sitio de implantación y la relación de FRET determinaron 7. A fin de validar la actividad de CNiFERs implantados, la estimulación de las neuronas de entrada debe ser examinado. Por ejemplo, con el D2 CNiFER, el efecto deSe examinó la estimulación eléctrica de las neuronas de dopamina del cerebro medio que se proyectan hacia la corteza. A bipolar 0,1 mO tungsteno estimular electrodo con una separación punta de 500 micras se implantó en la sustancia negra (-3,2 mm A / P, -1,3 mm M / L, -4,4 mm D / V). La figura 6 muestra un ejemplo de eléctricamente la estimulación de la sustancia negra en diferentes intensidades y la observación de un aumento en la relación de FRET para D2 CNiFERs 7. Tenga en cuenta que la inyección sistémica intra-peritoneal (ip) de un antagonista del receptor D2, eticlopride (1 mg / kg), bloquea la respuesta D2 CNiFER. Por otra parte, la inyección de cocaína (15 mg / kg), que bloquea la recaptación de la dopamina, mejora la respuesta evocada eléctricamente D2 CNiFER 7.

Figura 6: Ejemplo de D2 CNiFER Respuesta I ong> n vivo después de la estimulación eléctrica de la Sustancia Negra. (A) Una caricatura muestra un ratón de cabeza fija preparado para dos fotones de imágenes in vivo y la estimulación eléctrica. la luz de dos fotones (roja, 820 nm) para la excitación y 475 nm de emisión para eCFP (azul) y 530 nm de emisión de citrino (verde). (B) El diagrama de puntos muestra la relación entre FRET para D2 CNiFER inyecta en la corteza después de la estimulación eléctrica de la sustancia negra, es decir, a 200 microsegundos pulsos de 50 a 300 mu a 50 Hz durante 500 mseg, y después de la estimulación eléctrica en presencia de un D2R antagonista (eticlopride) o la cocaína. La figura modificada de Müller et al., 2014 7. Haga clic aquí para ver una versión más grande de esta figura.
ftp_upload / 53290 / 53290table1.jpg "/>
Tabla 1: Lista de productos químicos y reactivos para la fabricación de un medio de crecimiento HEK293 y ACSF.

Tabla 2: Los volúmenes para recoger células de diferentes placas Tamaño Cultura o frascos.
Discusión
La creación de CNiFERs proporciona una estrategia novedosa y única para medir ópticamente liberación de neurotransmisores en el cerebro in vivo. CNiFERs son ideales para la medición de la liberación extrasináptico, es decir, la conducción volumen, por neurotransmisores. Es importante destacar que cada CNiFER posee las propiedades de la GPCR nativo, proporcionando una medición óptica fisiológica de los cambios en los niveles de neurotransmisores en el cerebro. Hasta la fecha, se han creado CNiFERs para la detección de la acetilcolina (M1-CNiFER) 6, la dopamina (D2-CNiFER) 7 y la norepinefrina (a1a-CNiFER) 7.
En principio, un CNiFER puede ser creado por cualquier neurotransmisor que las señales a través de un GPCR. Para el caso en que las señales de GPCR a través de las proteínas G G q, no se necesita ninguna modificación adicional a la célula HEK293. GPCRs que señalan a G i / o, sin embargo, requieren la co-expresión de un qi5 G proteína G quiméricapara acoplar el GPCR al G q / PLC 7,10 vía. Del mismo modo, los GPCR que señalan a G s requerirán co-expresión de una proteína G quimérica G QS5 10. Una vez completado, cada clon CNiFER se tamiza y sólo aquellos clones CNiFER que tienen una afinidad comparable al receptor nativo, exhiben poca o ninguna desensibilización y proporcionar una relación señal a ruido que es adecuado para medir con in vivo microscopía de dos fotones, son seleccionados para estudios in vivo.
Para los estudios in vivo, es muy recomendable para el tratamiento de los ratones con ciclosporina para minimizar cualquier respuesta inmunológica potencial. Hay una posibilidad de rechazo o una respuesta inmunológica con la implantación de células CNiFER humanos en el cerebro de roedores. Esto fue investigado previamente mediante el examen de la expresión de GFAP y MAC1 7, siguiendo CNiFER implantación. CNiFERs no parece producir cicatrices gliales o genera ningún signisignifica- CAM1 tinción 7.
Dos cuestiones importantes a tener en cuenta en la construcción de CNiFERs son la sensibilidad y la desensibilización. Si es demasiado alta, es decir, de baja afinidad, en relación con el receptor nativo de la CE 50, entonces el CNiFER puede no tener suficiente sensibilidad para detectar la liberación de neurotransmisor in vivo. Una solución es repetir el control de clones y selecciona un clon CNiFER diferente que tiene mayor afinidad. Una estrategia alternativa sería probar otros tipos de codificados genéticamente fluorescentes de Ca2 + -detectors que pueden tener sensibilidad a Ca 2+ mayor que puedan desplazarse la CE 50 para la activación de GPCR. Debido a que el diseño CNiFER es modular, se adapta fácilmente a otros tipos de codificados genéticamente Ca 2+ -detectors, como GCaMP 16. Aislamiento de clones CNiFER con el mismo receptor, pero diferentes CE 50 s podría ser ventajoso para extender el rango dinámico de detección de liberación de neu endógenorotransmitters in vivo.
La desensibilización de la CNiFER también limitará su uso in vivo. Si la respuesta del pico disminuye gradualmente con cada pulso de agonista, entonces el receptor puede ser desensibilizando. En este caso, examinar otros clones y determinar si responden de la misma manera. Las modificaciones de la secuencia de aminoácidos del receptor, o el uso de otro subtipo de receptor pueden ser necesarios para tratar la desensibilización dependiente de agonista. Si hay sitios de fosforilación de ácidos o amino conocidos identificados que se asocian con G receptores quinasas de proteínas (GRK), sería conveniente para construir una variante no desensibilizante del GPCR mediante la mutación de uno o más sitios. El mecanismo de desensibilización se debe determinar para cada receptor en una base de caso por caso.
Hasta el momento, sólo se han CNiFERs implantado en capas superficiales de la corteza 6,7, debido a las limitaciones espectroscópico con fluoróforos de imagen con el MI de dos fotonesmicroscopia 17,18. En el futuro, puede ser posible adaptar la tecnología CNiFER con las mediciones basadas en fibra de fluorescencia 19 de modo que CNiFERs puede ser implantado en regiones subcorticales del cerebro.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a B. Conklin (Universidad de California, San Francisco) para proporcionar los qi5 G y G QS5 ADNc, A. Schweitzer para obtener ayuda con la electrónica, N. Taylor para obtener ayuda con el análisis de clones, Ian y Robert Rifkin Glaaser para la corrección de pruebas y Olivier Griesbeck para TN-XXL. Este trabajo fue apoyado por becas de investigación a través del Instituto Nacional sobre Abuso de Drogas (NIDA) (DA029706; DA037170), el Instituto Nacional de Imágenes Biomédicas y Bioingeniería (NIBIB) (EB003832), Hoffman-La Roche (88610A) y el "Neurociencia relacionados con las drogas de abuso beca de formación "a través de NIDA (DA007315).
Materiales
| Name | Company | Catalog Number | Comments |
| pCDH-CMV-MCS-EF1-Puro | System Biosciences | CD510B-1 | Cloning: for generating lentivirus |
| 12 x 75 *BD Falcon High Clarity Polypropylene Round Bottom Test Tube | BD Biosciences | 352063 | FACS |
| BD 40 um Falcon cell strainers | BD Biosciences | 352340 | FACS |
| 0.05% Trypsin EDTA | Invitrogen | 25200056 | FACS |
| 96 Well Plate, flat bottom, clear | Corning | 3596 | FACS |
| 96 well cell culture plates | Corning | CLS3997 | Flexstation |
| Optilux black clear bottom | Corning | 3603 | Flexstation |
| Flexstation pipet tips | Molecular Devices | 9000-0911 | Flexstation |
| Acetylcholine Chloride | Sigma-Aldrich | A2661 | Flexstation |
| Norepinephrine | Sigma-Aldrich | A7256 | Flexstation |
| Dopamine Hydrochloride | Sigma-Aldrich | PHR1090 | Flexstation |
| GABA | Sigma-Aldrich | A2129 | Flexstation |
| Histamine | Sigma-Aldrich | H7125 | Flexstation |
| Glutamate | Sigma-Aldrich | 49621 | Flexstation |
| Epinephrine | Sigma-Aldrich | E4642 | Flexstation |
| Somatostatin | Sigma-Aldrich | S1763 | Flexstation |
| 5HT | Sigma-Aldrich | H9523 | Flexstation |
| VIP | Alpha Diagnostics Inc. | SP-69627 | Flexstation |
| Orexin A | Alpha Diagnostics Inc. | 12-p-01 | Flexstation |
| Substance P | Sigma-Aldrich | S6883 | Flexstation |
| Adenosine | Sigma-Aldrich | A4036 | Flexstation |
| Melatonin | Sigma-Aldrich | M5250C | Flexstation |
| Fluorescence Plate Reader & software | Molecular Devices | Flexstation 3 | Flexstation |
| DMEM (high glucose) with Glutamax | Life Technologies | 10569-010 | Tissue culture |
| Fetal bovine serum | Life Technologies | 10082-139 | Tissue culture |
| Pen/Strep antibiotics | Life Technologies | 15140-122 | Tissue culture |
| Puromycin | InvivoGen | ant-pr-1 | Tissue culture |
| Fibronectin | Sigma-Aldrich | F0895 | Tissue culture |
| CoolCell LX Alcohol-free controlled-rate cell freezing box | Bioexpress | D-3508) | Tissue culture |
| cyanoacrylate glue | Loctite | Loctite no. 495 | surgery and stereotaxic injection |
| plastic paraffin film | VWR | Parafilm® | surgery and stereotaxic injection |
| Nanoinjector | Drummond | 3-000-204 | surgery and stereotaxic injection |
| Glass electrodes | Drummond | 3-000-203G | surgery and stereotaxic injection |
| hand held drill | OSADA | Exl-M40 | surgery and stereotaxic injection |
| Burrs for drill | Fine Scientific | 19007-05; 19007-07) | surgery and stereotaxic injection |
| Sterilizing bath | FST | 18000-45, Hot Bead Sterilizer | surgery and stereotaxic injection |
| isoflurane chamber/mask | Highland Medical Equipment | 564-0427, HME 109 Table Top Anesthetic Machine with Isoflurane Vaporizer, O2 Flowmeter, Gang Valve; 564-0852, Induction Chamber 16X7X7.5cm | surgery and stereotaxic injection |
| 3D scope with arm | Zeiss | surgery and stereotaxic injection | |
| fiber optic light | surgery and stereotaxic injection | ||
| Betadine | surgery and stereotaxic injection | ||
| 70 % (v/v) isopropyl alcohol | surgery and stereotaxic injection | ||
| Povidone-Iodine Prep Pads | dynarex | 1108 | surgery and stereotaxic injection |
| NaCl 0.9% (injection, USP, 918610) | surgery and stereotaxic injection | ||
| CYCLOSPORINE (INJECTION, USP) | surgery and stereotaxic injection | ||
| Buprenex (injection) buprenorphine (0.03 μg per g rodent) | Sigma-Aldrich | surgery and stereotaxic injection | |
| Ophthalmic ointment | Akorn | NDC 17478-235-35 | surgery and stereotaxic injection |
| Surgifoam | Ethicon | surgery and stereotaxic injection | |
| Grip dental cement | Dentsply | #675571, 675572 | surgery and stereotaxic injection |
| Instant SuperGlue | NDindustries | surgery and stereotaxic injection | |
| LOCTITE 4041 | surgery and stereotaxic injection | ||
| METABOND | C&B | surgery and stereotaxic injection | |
| no. 0 cover glass | Fisher | surgery and stereotaxic injection | |
| stereotaxic frame | Kopf | surgery and stereotaxic injection | |
| Rectal probe and heating pad | FHC | 40-90-8D, DC Temperature Controller,40-90-2-06, 6.5X9.5cm Heating Pad40-90-5D-02, Rectal Thermistor Probe | surgery and stereotaxic injection |
| optical breadboard for imaging | Thorlabs | surgery and stereotaxic injection | |
| Mineral oil | Fisher | S55667 | surgery and stereotaxic injection |
| Kwik-Cast (Silicone elastomer) | World Precision Instruments | surgery and stereotaxic injection | |
| Suture | Ethicon | 18’’, 1667, 4-0 | surgery and stereotaxic injection |
| Scissors | Fine Scientific Tools | 91500-09, 15018-10 | surgery and stereotaxic injection |
| Forcepts | Fine Scientific Tools | 11252-30; #55, 11295-51; Grafe, 11050-10 | surgery and stereotaxic injection |
| Student Halsted-Mosquito Hemostats | Fine Scientific Tools | 91308-12 | surgery and stereotaxic injection |
| Small Vessel Cauterizer Kit | Fine Scientific Tools | 18000-00 | surgery and stereotaxic injection |
| Hot Bead Sterilizers | Fine Scientific Tools | 18000-45 | surgery and stereotaxic injection |
| Instrument Case with Silicone Mat | Fine Scientific Tools | 20311-21 | surgery and stereotaxic injection |
| Plastic Sterilization Containers with Silicone Mat | Fine Scientific Tools | 20810-01 | surgery and stereotaxic injection |
| 2P fixed-stage fluorescence scope for in vivo imaging | Olympus | FV1200 MPE | in vivo imaging |
| Multiphoton laser | SpectraPhysics | Mai Tai DeepSee | in vivo imaging |
| Green Laser | Olympus | 473 nm Laser | in vivo imaging |
| xy translational base | Scientifica | MMBP | in vivo imaging |
| FRET filter cube for YFP and CFP | Olympus | in vivo imaging | |
| 10x and 40x water immersion objectives | Olympus | in vivo imaging | |
| air table | Newport | in vivo imaging | |
| custom built light-tight cage | Thorlab | in vivo imaging |
Referencias
- Day, J. C., Kornecook, T. J., Quirion, R. Application of in vivo. microdialysis to the study of cholinergic systems. Methods. 23, 21-39 (2001).
- Robinson, D. L., Venton, B. J., Heien, M. L., Wightman, R. M. Detecting subsecond dopamine release with fast-scan cyclic voltammetry in vivo. Clin Chem. 49, 1763-1773 (2003).
- Liang, R., Broussard, G. J., Tian, L. Imaging Chemical Neurotransmission with Genetically Encoded Fluorescent Sensors. ACS Chem Neurosci. , (2015).
- Okubo, Y., et al. Imaging extrasynaptic glutamate dynamics in the brain. Proc. Natl. Acad. Sci. USA. 107, 6526-6531 (2010).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods. 10, 162-170 (2013).
- Nguyen, Q. T., et al. An in vivo biosensor for neurotransmitter release and in situ receptor activity. Nat Neurosci. 13, 127-132 (2010).
- Muller, A., Joseph, V., Slesinger, P. A., Kleinfeld, D. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods. 11, 1245-1252 (2014).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. , e3998 (2012).
- Wang, X., McManus, M. Lentivirus production. J Vis Exp. , (2009).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Gjα. Nature. 363, 274-276 (1993).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1, 3166-3173 (2006).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. , (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7, 981-984 (2010).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32, 1277-1309 (2012).
- Yamauchi, J. G., et al. Characterizing ligand-gated ion channel receptors with genetically encoded Ca2+ sensors. PLoS One. 6, e16519 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. 32, 13819-13840 (2012).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2, 932-940 (2005).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Cui, G., et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 494, 238-242 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados