Method Article
构建基于细胞的神经递质荧光工程记者(CNiFERs)神经递质的光学检测
摘要
我们提出了一个协议,用于容量神经递质释放的光学检测创建基于细胞的神经递质荧光工程记者(CNiFERs)。
摘要
基于细胞的神经递质荧光工程记者(CNiFERs)为神经科学家光学检测神经递质的释放在脑中体内的新工具。具体CNiFER是从稳定地表达特定的G蛋白偶联受体,其耦合至G Q / 11的G蛋白,以及一个基于FRET的钙 -detector,TN-XXL人胚肾细胞产生。该受体的活化导致的增加的FRET信号。 CNiFERs有纳米灵敏度和几秒钟的时间响应,因为一个CNiFER克隆利用天然受体对特定的神经递质, 例如 D2R为多巴胺。 CNiFERs被直接注入到大脑,使他们能够感神经递质释放与小于一百微米的空间分辨率,这使得它们理想来测量体内体积传输。 CNiFERs也可以用来筛选其它药物用于在vi潜在的交叉反应性VO。我们最近扩大CNiFERs的系列,包括G蛋白偶联受体的夫妇至G I / O的G蛋白。 CNiFERs可用于检测乙酰胆碱(ACh),多巴胺(DA)和去甲肾上腺素(NE)。鉴于任何GPCR可用于创建一个新颖CNiFER并有大约在人类基因组800的GPCR,我们在这里描述的一般方法来设计,实现和测试的任何类型的CNiFER的。
引言
为了全面了解神经元在大脑中的通信方式,它必须有用于测量神经递质在体内的释放的方法。有在体内神经递质检测几种行之有效的方法。一种常用的技术是微透析,其中套管被插入到脑和脑脊液中的一小体积被收集并用高效液相色谱法和电化学检测1进行分析。微透析有探针的几个直径的量级的空间分辨率, 例如 ,约0.5毫米的直径200微米的微探针。这种技术的时间分辨率,但是,是缓慢由于采样间隔,通常持续约5分钟以上1。此外,分析还没有实时进行。另一种技术是快速扫描循环伏安(FSCV),其使用插入到大脑的碳纤维探针。 FSCV具有优良的温度口服分辨率(亚秒),高灵敏度(毫微摩尔),并与探针直径的5至30微米的空间分辨率。然而,FSCV被限制为在碳势探头2产生的特性的氧化和与电压降低信息发射机。
测量神经递质第三种技术是直接通过基因编码的神经递质(NT)生物传感器3。用这种方法,融合蛋白创建包含用于耦合到荧光共振能量转移(FRET)系一对荧光团4或置换的GFP 5的发射机的配体结合域。不同于前两种方法,这些生物传感器遗传编码和表达的宿主细胞的表面上,如神经元,通过生产转基因动物的或急性与使用病毒试剂的感染细胞。迄今为止,遗传编码的生物传感器已被被仅用于detectin开发摹谷氨酸和GABA 3-5。这些技术的限制一直是低的灵敏度,在nM范围内,以及无法扩大检测到大量的发送器, 例如 ,经典的神经递质,神经肽和神经调质,其通过G蛋白偶联受体(GPCR)的信号。事实上,也有人类基因组近800 G蛋白偶联受体。
为了解决这些不足,我们已经开发了一种创新工具,通过一个GPCR信号的任何神经递质的光学测量释放。 CNiFERs(基于细胞的神经递质的荧光工程记者)的设计,以表达特定的GPCR是,在受到刺激时,会触发钙离子浓度由遗传编码的基于FRET的钙离子传感器检测到细胞内增加克隆HEK293细胞, TN-XXL。因此,CNiFERs变换神经递质受体结合到荧光变化,提供了一个直接和实时的光读EAD出局部神经递质的活动。通过利用天然受体对于给定的神经递质,CNiFERs保留化学特异性,亲和力和内源性表达的受体的时空动力 学。到目前为止,我们已经创建了三种CNiFERs,一个用于使用M1受体,一个用于检测多巴胺检测乙酰胆碱使用D2受体,和一个用于使用α1A受体6,7-检测去甲肾上腺素。该CNiFER技术很容易扩展和可扩展性,使得它适合于任何类型的GPCR的。在这个朱庇特的文章中,我们描述和示出了在体内 CNiFERs设计,实现的方法,及测试方法的任何应用。
研究方案
在这项研究中进行的所有动物的程序都是按照机构动物护理和使用委员会(IACUC)的指导方针,并已通过在医学学院伊坎在西奈山和加州大学圣地亚哥分校的IACUCs。
1.生成GPCR表达的慢病毒转化HEK293细胞
- 获得的cDNA为从商业来源, 例如 ,cdna.org特定GPCR。可替代地,扩增从使用PCR的cDNA文库的GPCR基因。获得慢病毒表达载体,如PCDH-CMV-MCS-EF1-迪普罗(PCDH)。使用该向量来传播该DNA以及生成慢病毒。
- 克隆GPCR的cDNA为通过PCR的慢病毒表达载体。见洛伦茨8,用于PCR的亚克隆的信息。
- 扩大和使用不含内毒素的"MAXI"prep试剂盒按照制造商的说明纯化GPCR-PCDH的DNA。确认GPCR的cDNA克隆到PCDH是mutation-通过DNA测序自由。
注意:在提交用于病毒生产的DNA,消化的等分试样用适当的限制性内切酶,以确认插入物与DNA的纯度的大小。 - 利用病毒核心设施,比如一个在索尔克研究所,宾夕法尼亚,大学和北卡罗莱纳大学等产生慢病毒,或者在内部生成9。使用约25 HEK细胞转染无内毒素的DNA微克(> 1微克/微升)在T75烧瓶中。确保DNA是高纯度的,具有1.8〜的吸收比(A 260 / A 280)。
注:病毒效价〜10 11 -10 12 GC /毫升是最适合HEK293细胞转导。
2.选择HEK293 / TN-XXL骨干细胞类型的体外培养
注:确定G蛋白偶联的特异性, 例如 ,G 的i / o,G Q / 11,或克S-的G蛋白的G蛋白偶联受体的,因为这DICtates是否需要为CNiFER G蛋白嵌合体。对于G q -偶联受体, 例如 ,M1毒蕈碱受体,选择HEK293 / TN-XXL(#3G8)为骨干的HEK293细胞类型。对于G I / O偶联的受体,该嵌合G G蛋白qi5需要10。对于克S-偶联的受体,对G QS5嵌合体需要10。在这个协议中,一个D2R CNiFER的结构被用作一个例子。通过G I / O的G蛋白和D2R信号需要HEK293细胞稳定表达嵌合G蛋白,G qi5, 例如 ,HEK293 / TN-XXL / G qi5 _#qi5.6。
- 获取HEK293 / TN-XXL / G qi5 _#qi5.6克隆细胞从研究实验室。注:以下克隆细胞,HEK293 / TN-XXL(#3G8)对于G q -偶联受体,HEK293 / TN-XXL / G qi5(#qi5.6)对于G 的i / o偶联的受体,和HEK293 / TN -XXL / G QS5(#qs5.47)为克S-偶联的重ceptors,可自由根据要求提供6,7。
- 发展和扩大HEK293 / TN-XXL / G qi5 _#qi5.6至〜90%汇合的T25烧瓶5毫升HEK293生长介质( 表1)。生长在潮湿的培养箱将细胞在37℃用5%(体积/体积) 的 CO 2。
注意:用培养HEK293细胞所有工作都应该使用标准的无菌组织培养技术进行。 - 首先从T25瓶中吸媒体收获HEK293细胞。轻轻加入5毫升的PBS并摇动烧瓶洗细胞。
- 移除PBS并加入0.05%(重量/体积)胰蛋白酶/ EDTA( 表2)1毫升用5%(体积/体积) 的 CO 2下孵育1至2分钟,在37℃。
- 收集细胞,并转移到无菌的15毫升锥形管中。在细胞培养离心机1000 xg离心离心5分钟。吸出上清液。
- 重悬在5ml HEK293生长培养基的细胞沉淀。计数使用血球细胞台盼蓝。计算细胞密度,并进行第3步。
3. HEK293的慢病毒转/ TN-XXL / Gqi5一起细胞
- 种子用0.7×10 6 HEK293 / TN-XXL / G qi5细胞T25烧瓶中。生长在潮湿的培养箱将细胞在37℃用5%(体积/体积)CO 2,直到〜50%汇合,在大约1天。冻结剩余的细胞(步骤8.2-8.3)。这些细胞将作为CNiFER控制, 即一个CNiFER缺乏的GPCR。
- 在感染当天,淡化GPCR表达慢病毒(步骤1.4),以10 9的GC /毫升〜终浓度在2毫升的HEK293生长培养基( 表1)的总体积。例如,在一个T25培养瓶中加入20微升10 11 GC / ml的病毒至2ml介质。
注意:病毒滴度信息应由病毒核心设施来提供。结合慢病毒和媒体在一个离心管中,轻轻磨碎。 lentiv高滴度病毒属的生物安全2级(BSL-2)。 - 吸从T25烧瓶中的介质。从步骤3.2加入2 mL萃取病毒/媒体的混合物。用5%(体积/体积) 的 CO 2孵育T25烧瓶O / N在37℃。
- 感染后一天,吸去病毒/媒体混合物并用含有嘌呤霉素的HEK293生长培养基更换(2微克/毫升; 表1)。嘌呤霉素选择用于转导的细胞。孵育烧瓶在37℃下用5%(体积/体积) 的 CO 2,直至约90%汇合,之后〜1-2天。
- 制备涂覆有纤连蛋白,对于在步骤4.1产生一个10点激动剂/激活曲线96孔板(黑色,透明底)。在无菌罩中,添加每孔50μl的纤连蛋白(5微克/毫升)在排A和B的96孔板的。孵育在室温下该板1小时。每冲洗5分钟,用PBS冲洗两次。加入50μl的HEK293生长培养基,用5%(体积/体积) 的 CO 2孵育O / N在37℃。
注:Fibronectin处理板是市售的。 - 收获在T25烧瓶中的细胞作为在步骤2.3-2.6( 见表2)中所述。
- 重悬在5ml HEK293生长培养基的细胞沉淀。种子T25培养瓶中用1.5ml细胞用于FACS分析的。此外,种子用1ml细胞的T75烧瓶中冷冻和存储(见步骤8.2-8.3)
- 为10点激动剂曲线,种子纤连蛋白包被的96孔板(来自步骤3.5)与每孔100μl的细胞悬浮液的前两行(A和B)。
- 孵育HEK293细胞在T25烧瓶中,一个T75烧瓶生长和一个96孔板直到大约〜90%汇合,在37℃用5%(体积/体积) 的 CO 2,后〜1-2天。
4,流式细胞仪及单CNiFER克隆的分离
- 使用96孔板,用于产生一个10点激动剂活化曲线。
注意:起始荧光激活细胞分选(FACS)分析前,以确认是非常重要的通过测试转导的细胞对激动剂响应(10点激动剂曲线)的GPCR的表达。这个试验进行使用荧光板读数器。- 准备的10点激动剂激活曲线的药物板。选择10种不同的促效剂浓度的支架上的预测的EC 50,这可以从文献中确定。
注意:药物板含有各浓度(一式两份)的3倍,调整为1:3稀释在CNiFER板。例如,用于测试D2 CNiFER药物板包含3倍浓度10不同浓度的多巴胺; 0.2,0.5,1,3,5,10,20,30,50和1000纳米。在CNiFER板,因此,多巴胺的最终浓度是0.067,0.167,0.333,1.00,1.67,3.33,6.67,10.0,16.7,和333纳米。 - 用人工脑脊髓液(ACSF)( 见表1)制备的激动剂的解决方案。使用两个井"学联", 例如 ,A1和A2,和两口井关于'无细胞的, 例如 ,B1和B2。
注意:使用连续稀释方法制备不同浓度的药物。创建模板跟踪CNiFER克隆和药物浓度( 图3)的。 - 使用该软件,用于测量FRET和表演溶液转移96-孔荧光平板读数器进行编程。
- 设置板器温度到37℃。
- 为了测量FRET与TN-XXL,将激发波长为436±4.5纳米(±中心HWHM)。设置ECFP并为黄水晶527±7.5纳米发射器485±7.5纳米。分别设定截止滤波器475和515纳米的ECFP和黄水晶。
- 编程板读数器在485纳米和每4秒,共180秒527纳米至测量发射。选择从3倍药物板提供50微升到100微升在CNiFER板的选项,收集30秒后基线荧光。
- 从行A和B吸媒体,并添加100μl的ACSF向96孔CNiFER板,其为〜90%汇合(步骤3.9)。
- 加载96- CNiFER板和'3倍"药物板进入板器。允许〜30分钟,在37℃下平衡板。然后,启动该程序。
- 分析酶标仪数据,荧光值导出到电子表格。创建一个公式中减去从与CNiFERs井背景测量(从孔中无细胞的对各信号)。正常化荧光强度进行预刺激的基线,女黄晶 (叔)/ F 黄晶 (基线),以及计算出的FRET比率(ΔR/ R;等式1),使用在527 nm和485 nm的发射峰响应(参见步骤11 )。
注意:如果在ΔR/ R与激动剂显著变化,那么这表明GPCR的表达,并可以进行FACS分析(步4.2)。如果日ERE是具有激动剂没有FRET响应,通过使用钙离子载体, 例如 ,A21387,以测试的 Ca 2+响应,并确认基于FRET的传感器工作排除故障。如果离子载体的工作原理,然后将受体不可能表达。
- 准备的10点激动剂激活曲线的药物板。选择10种不同的促效剂浓度的支架上的预测的EC 50,这可以从文献中确定。
- 上的FACS前一天,制备涂覆有纤连蛋白4个96孔板(见步骤3.5)用于收集分选的细胞。加入50μl的HEK293生长培养基,用5%(体积/体积) 的 CO 2孵育O / N在37℃。
- 制备5%(重量/体积)牛血清白蛋白的PBS(5克/ 100毫升),并过滤(0.2微米)到无菌瓶中。
- 收获在T25培养瓶中生长的细胞(参见步骤2.3-2.5, 表2)。重悬细胞沉淀在4毫升的5%在PBS(重量/体积)BSA中。离心细胞以1000 xg离心5分钟。
- 吸媒体和重悬在约5毫升的5%的细胞沉淀(重量/体积)牛血清白蛋白的PBS,得到的〜5×10 6个细胞/ ml的终浓度。
注:请与FACS核心设施对细胞密度和排序条件的具体要求。 - 过滤悬浮的细胞与一个40微米的细胞滤网以除去团块。转移细胞到5ml的聚丙烯圆底试管中。将管冰上运输到FACS设施。
- 排序在FACS工厂转导HEK293细胞。程序在FACS参数流式细胞仪如下:设置4℃样品架,100微米的喷嘴和20磅。根据排序前的分析,选择单元格, 即选择一个"门",那有一个大的ECFP荧光(ECFP激发,ECFP排放)和大FRET(ECFP激发,黄晶发射)的荧光(参见下面的结果, 图2 )。
- 存个人,分选的细胞成在步骤4.2每孔含有HEK293生长培养基50微升嘌呤制备,其中一个克隆的96孔板中。加入50μlHEK293生长介质的嘌呤( 钽竹叶提取1),共每孔100μl的。维持细胞O / N在37℃下用5%(体积/体积) 的 CO 2。
注:HEK293生长介质包含转导细胞嘌呤选择。
5.培养和分类的扩展,克隆CNiFERs
- 通过从各取出50微升旧媒体的井,并用50微升新鲜的HEK293生长培养基含有嘌呤( 表1)代替保持在96孔板的CNiFERs。此重复每5至7天,直到〜90%汇合时,2-3周后。
- 收获CNiFER细胞吸轻轻的媒体和PBS,一旦轻轻冲洗。除去PBS中并添加0.05%20微升(重量/体积)胰蛋白酶/ EDTA。用5%(体积/体积) 的 CO 2下孵育1至2分钟,在37℃。
- 加入100微升的HEK293生长培养基以胰蛋白酶处理细胞并悬浮细胞。传送内容含有400微升新鲜HEK293培养基机智24孔板^ h嘌呤霉素。在24孔板,通过更换250微升的HEK293生长培养基每5-7天,直到井〜90%汇合维持细胞。
6.确定基于FRET回答候选CNiFERs使用荧光微孔板检测仪
注意:使用以下的FACS 4个96孔板,应该有>存活下来并扩展到24孔平板平台100可检验的克隆,因为许多原始克隆失败增长。以确定潜在的候选者CNiFERs,使用3点分析与同源激动剂, 如多巴胺D2R为FRET的响应。
- 当细胞是〜于24孔板的90%汇合时,轻轻吸去介质。添加0.05%〜100微升(重量/体积)胰蛋白酶/ EDTA,在37℃,5%(体积/体积) 的 CO 2孵育1-2分钟。添加400微升的HEK293生长培养基以胰蛋白酶处理细胞,并通过温和研磨混合细胞。
- 设置了3点激动剂曲线为CLO的初步筛选网元。对于每个CNiFER克隆, 即 ,从24孔平板,等份加入100μl细胞悬浮液(〜4×10 3细胞/孔)的孔中到每个三个孔, 例如 ,A1,A2,A3的中的一个纤连蛋白包被的96孔板(黑色,透明底)(参见步骤3.5)。
- 传输剩余〜200微升的细胞悬液至含有HEK293生长培养基1000微升(1.2 ml终体积)的12孔板中。在37℃下用5%(体积/体积) 的 CO 2孵育两板,直到〜90%汇合。在96孔板是用于荧光分析和12孔板是用于生长和扩大的克隆。
- 为3点分析,确定三种不同浓度的激动剂是0.1-,1.0-和10倍的EC 50为特定的GPCR。如步骤4.1.1-4.1.2中所述的药物板制备激动剂的浓度。按照步骤4.1.3-4.1.5描述执行荧光酶标仪检测。
- 计算FR如在步骤4.1.6说明的ET比率(ΔR/ R)。选择具有适当的灵敏度和用于扩张最大FRET响应CNiFERs,冷冻背部,和更全面的分析(步骤7)。
- 在步骤6.5中选定,并在12孔板正在成长的克隆,删除和替换600微升每5〜7天HEK293生长培养基,直到〜90%汇合。
- 逐渐扩大,从一个12孔板克隆到6孔板,然后向一个T25培养瓶中(步骤2.3 - 2.6和表2)。当T25烧瓶是具有描述〜90%汇合,收获细胞(步骤2.3-2.5)。重悬在5ml HEK293生长培养基的细胞沉淀。
- 1毫升细胞悬浮液添加至T75烧瓶用9ml HEK293生长培养基。使用剩下的4毫升细胞悬浮液冷冻保护和储存在液体N 2(步骤8.2-8.3)。准备81.5毫升冻存管置于冰上。
- 在T75烧瓶中,保持细胞通过更换媒体瓦特第i个新鲜HEK293生长介质, 例如 ,每隔3-5天10毫升直到70-80%汇合,之后〜1-2周。
使用荧光板读CNiFER克隆人的最终7.选择
- 在板读数器测定的前一天:
- 从〜90%汇合的T75烧瓶收获细胞(参见步骤2.3-2.6, 表2)。以5×10 4个 /种子的96孔纤维连接蛋白包被的板(黑色透明底)以及与约100微升细胞悬浮液。注意:一个克隆被分配到一个单一的96孔板中。
- 制备药物板CNiFER克隆的全面筛选,区分非特异性CNiFER应答特异性激动剂响应。
- 以产生一个完整的剂量-响应曲线,选择围绕所述预测EC 50 10个不同的激动剂的浓度。使用两个井"无细胞"和两个井"学联"。
- 为了确定非特异性反应,选择THRee值浓度的12种不同的神经递质或调制器(72孔)( 图3)。像激动剂,所述药物板包含在重复3倍的浓度。例如,100微升的三种不同浓度的乙酰胆碱,谷氨酸盐,食欲素,VIP,腺苷,血清素,去甲肾上腺素,γ-氨基丁酸,P物质,褪黑激素,促生长素抑制素和组胺,每个在50 3倍浓度,1000,和3000纳米被加载到96孔药物板。
- 坐落在荧光酶标仪的参数,如步骤4.1.3-4.1.5描述测量FRET和执行解决方案转移。
- 用于分析所述全剂量反应曲线,计算峰值的FRET比率(ΔR/ R)(步骤4.1.6),情节日志激动剂浓度的函数,并且适合与希尔方程(步骤11.4)。确定EC 50,希尔系数和最大FRET比率。对于其他12递质/调制器,情节峰值ΔR/ R作为函数O˚F药物浓度。
- 选择具有大的FRET比率,适当的EC 50为同源激动剂,以及其它神经递质激动剂(非特异性反应)很少或没有背景应答〜10 CNiFER克隆。
8.冷冻回选择CNiFER克隆
- 使用单个CNiFER克隆的〜90%汇合的T75烧瓶中。收获细胞如所述(步骤2.3-2.5, 表2)。用于冷冻细胞,重悬在5ml HEK293生长培养基的细胞沉淀。标号101.5毫升冻存管并在冰上设置。
- 对于冷冻保护,混合细胞1:1用20%在HEK293生长培养基(体积/体积)的DMSO, 例如 ,将5ml的20%(体积/体积)的DMSO /介质混合物轻轻用5ml细胞悬液(最终混合的DMSO浓度为10%)。
- 分装1毫升到每个冻存管的。冻结与细胞管在-80°C冰箱O / N,在泡沫绝缘箱(见材料 )。转移到冷冻管理屈编号氮气长期贮存。
9. CNiFER植入小鼠皮层
- 手术前消毒在高压釜中所有的外科手术工具。通过用70%乙醇擦拭和放下一个干净的实验室尿布制备用于外科手术的半无菌区域。
- 通过在垂直电极拉马拉玻璃毛细管(0.53毫米)准备CNiFER注射吸管。使用一对没有。 5细尖镊子打破电极的尖端的直径为〜40微米。
注:这是一个刻度立体声变焦显微镜下很好地完成。 - 维修4%(V / V),用于感应和1.5%至2.0%(V / V):麻醉成年人(60-90日龄)C57BL / 6小鼠用异氟烷。使用尾巴或脚趾捏,以确保鼠标完全麻醉。
注:重新捏定期和评估整个手术晶须抽搐,重新评估麻醉深度。 - 捂在眼睛上用眼药膏为pr事件干燥。安装在鼠标耳酒吧立体框架。维持使用由直肠探头调节的热垫的鼠标体温在37℃。
- 剃的区域大约5mm通过用动物电动剃须刀12毫米,应用优碘随后70%(体积/体积)异丙醇。使用手术刀刀片切割并去除皮肤上的颅骨表面。使用手术刀刀片从颅骨表面去除骨膜。揭露和清理头骨表面,为立体定向手术11描述。
- 放下空杯子吸管前囟门和记录前 - 后(A / P)和内 - 外(M / L)坐标。参照小鼠脑图谱,计算注射部位的位置。移吸管到目标网站,标志着随后出现的窗口形成的头骨。见切廷等人的关于与鼠类11立体注射的信息。
注:注入和窗口的网站取决于章离子进行研究,并在皮质神经递质或肽释放凸起的分布。例如,在最近的一份出版物7,立体坐标+1.0 +2.0毫米的/ P和+1.0至2.0毫米M / L被用来CNiFER细胞注入额叶皮层古典调节过程中多巴胺释放的体内成像。 - 如前所述12,13形成2毫米x 3毫米变薄,骨窗。
注:在窗口中的骨骼应该是15-20微米厚。当颅骨表面润湿,如果骨被充分减薄12,13在骨中的小的白色斑点应该是不可见的。 - 将浸泡在窗口海绵的学联,以保持湿润,同时准备细胞注入。
- 收成是在T75烧瓶〜80%汇合生长的克隆CNiFER。吸媒体并用无菌PBS洗涤细胞。
注:胰蛋白酶省略了这些步骤。 - 删除PBS和使用10个毫升邻˚FACSF撞出从烧瓶底部的细胞。磨碎的细胞分离细胞团块。离心机和悬浮颗粒在100微升学联。离心30秒在1400 XG,去除上清,留下覆盖学联颗粒。这一步叶悬浮细胞的一丛。
- 回填在步骤9.2与矿物油制得的注射吸量管,装入吸管到nanoinjector,推进柱塞喷射的油的小珠。放5微升CNiFER细胞悬液到邻近的小鼠制备塑料石蜡膜的带材。制定任CNiFERs或控制CNiFER细胞进入拉出吸管。
- 移动吸移管到目标X和Y坐标, 即 A / P和M / L,在步骤9.5指出。放下吸管,刺穿颅骨变薄,继续〜200-400微米颅骨表面之下,存放CNiFER细胞层皮质的2/3。
- 注入〜4.6 NL CNiFER细胞在与nanoinjec最深部位器,中石油和细胞界面注意运动,然后等待5分钟,使细胞进行分配。拔出吸管〜100微米,并注入CNiFER细胞的另一个〜4.6 NL,等待5分钟,然后慢慢地,轻轻地抽出吸管,防止CNiFERs的回流。在一个或多个相邻站点重复注射。
- 重复注射步骤9.8-9.12与对照HEK293细胞( 即 HEK293 / TN-XXL / G qi5克隆缺乏GPCR)。分开CNiFER和控制由〜200微米的细胞注射部位。
- 在完成细胞植入后,冲洗变薄,骨窗与学联和等待头骨干燥。应用氰基丙烯酸酯胶一滴(见材料 )在窗口和快速地将一个预切的无菌护罩玻璃上胶的顶部。轻轻推压颅骨玻璃盖几秒钟。让胶水干2分钟12,13。
- 密封该玻璃盖的边缘与牙科水泥和形式AW在窗口ELL举办水浸渍目标。
- 对于成像时固定鼠标的头,附加一个定制的头酒吧窗户后面氰基丙烯酸酯胶的一小滴(见14在尺寸上和材料的细节)。让胶水彻底干燥,然后添加额外的牙科水泥,以进一步加强定制的头吧。
- 覆盖颅骨表面的其余部分,除窗口,用牙科水泥的层。确保皮肤的边缘由水泥覆盖并让它干燥20分钟。
- 继手术,异氟醚停止和管理上留下一个加热垫鼠标在一个笼子里,直到它完全从麻醉中恢复。手术后止痛注入补液5%(重量/体积)葡萄糖的生理盐水(SC)和0.05〜0.1毫克/公斤丁丙诺啡(IP,即时释放)。
注意:要尽量减少人类CNiFERs潜在的免疫反应,每天20微升/ 100g的环注入鼠标sporine(IP)开始CNiFERs的注射前一天。 - 返回鼠标其家笼食物和水。
10. 在 CNiFER克隆人的体内成像
注意:实时成像,使用双光子显微镜和一个头固定装置的小鼠进行的。在成像会议无需麻醉。如果在清醒状态下成像动物,限制头枕只有几个小时时间,以减少压力。返回动物吧成像会话之间的家庭笼食物和水。潜在应力被变暗房间的灯和包围该鼠标的一部分在外壳最小化。
- 手术后的当天,通过拧植入颅骨的头固定帧的金属头杆装入成像平台上的鼠标。
注意:当成像清醒小鼠,成像会话不应超过几个小时,由于由首约束装置引起的潜在压力。 - 放置成像平台与头部-抑制小鼠在装有10X(0.30 NA)和40X(0.80 NA)的水浸入目标的双光子成像的显微镜。
- 插入滤波器立方体FRET成像(ECFP和黄晶),其具有在505 nm和带通滤波器跨越460纳米至500纳米为测量ECFP和520纳米至560纳米为测量黄晶的分色镜。
- 加入学联到井含变薄,骨窗和降低水浸泡的目的进入学联。使用与汞灯和GFP滤波器立方体一起使用时的目镜定位皮质和脉管的窗口下方的表面上。
注:脉管系统的模式有助于在成像的重复定位日子和图像同一区域。 切换到40倍水浸泡的目的通过手动专注于皮质上使用GFP过滤立方体和汞灯细胞表面定位CNiFERs。 - 成立了双光子成像。选择AP对于双光子成像propriate光路。对于一个典型的商业系统中,使用软件切换到双光子成像模式和重定向光以在非退扫描检测器光电倍增管(PMT)。开启近红外飞秒脉冲激光,选择的820纳米波长和5-15%的功率设置。注:5%的功率通常提供〜25毫瓦的标本。
- 设置PMT1&PMT2电压接近最大值,通常700-1,000 V取决于PMT。将增益设置为1的每个信道 和零为目标的z位置。
- 降低目标从〜皮质表面100至200微米,并开始在xy扫描。调整激光功率,增益和每个通道的PMT电压, 即 ECFP和黄晶,以优化CNiFER荧光的信噪比。
- 使用缩放功能的软件的图像限制到包含CNiFER细胞以及一个背景和一个区域D区。使用的扫描速度不超过每像素4微秒的一帧,每2秒(0.5赫兹)慢。调整线平均为合适的信噪比, 例如 ,卡尔曼2行平均。
- 绘制区域周围的兴趣CNiFER细胞(ROI),周围的每架飞机约3〜4个细胞。投资回报率平均强度的建立实时分析。开始采集随时间监测CNiFER荧光。
- 之前和期间的实验操作, 例如 ,电刺激,的ChR2刺激,行为,如由用户确定收集CNiFERs荧光。
- 当完成成像实验中,小鼠返回其家笼。重复成像跨天,根据需要。当重新成像的细胞是指先前获得的低倍率脉管图像来定向回到同一摄像视野(步骤10.4)。
注:植入CNiFERs可以成像至少7天。
11.数据分析
- 打开图像文件,并选择投资回报率对CNiFERs和背景1的投资回报率。选择每个ROI的两个通道"系列分析"。出口平均荧光强度为每个投资回报为制表符分隔的文件。
- 使用数学软件(见材料 )程序来分析荧光值。低通滤波器(0.3赫兹),每个信号,然后减去背景荧光从ECFP和黄晶荧光强度每个ROI。
- 计算平均荧光基线和如公式1描述的测量FRET比率ΔR(t)的/ R计算比率。
- 为了确定CNiFERs的敏感性,绘制FRET比率日志激动剂浓度的函数。与希尔公式来确定EC 50和希尔系数(n)的配合,使用科学的统计软件和希尔方程(方程2)。

结果
特定G蛋白偶联受体(GPCR)和遗传编码的[Ca 2+]传感器,TN-XXL:一个CNiFER是从被设计为稳定地表达至少两种蛋白质人胚肾(HEK293)细胞衍生。 TN-XXL经受响应青色和黄色荧光蛋白,分别ECFP和黄晶,之间荧光共振能量转移(FRET)来的Ca 2+离子6,15。的GPCR即耦合到内源性ģq的G蛋白的激活触发胞质增加的[Ca 2+]通过PLC / IP 3通路,导致从TNXXL 的 Ca 2+检测器中的FRET的增加( 图1)。
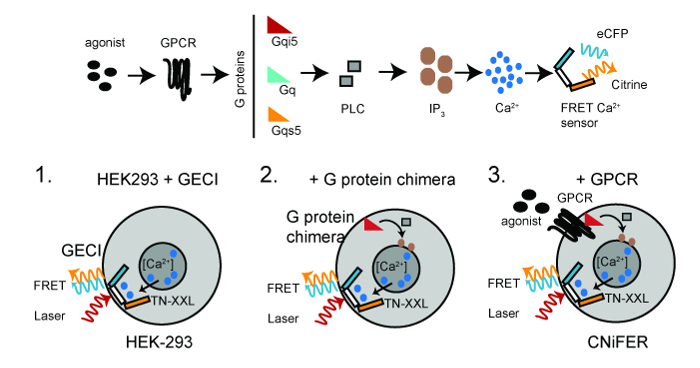
图1:方案发展CNiFERs顶,GPCR- 的 Ca 2+用于创建所需信号通路CNiFER细胞。底,用于构成使用HEK293细胞CNiFERs的基本步骤。第1步:用转导基因编码的基于FRET的钙 -detector(TN-XXL)。步骤2.转导GαG-蛋白嵌合体, 即 ,G QS5,G qi5,如果需要的话。第3步转导独特的GPCR创建CNiFER。双光子激发光(红色)激发ECFP,它经历FRET,同时生产的ECFP发射(青色)和黄水晶排放(黄色)。 请点击此处查看该图的放大版本。
在FRET的增加提供了快速的光学读出在神经递质水平的变化。开发一个CNiFER为特定类型的神经递质,首先确定G蛋白的类型耦合到GPCR。对于G q -偶联的GPCRs,无产阶级文化大革命中使用内源表达的G蛋白qHEK293细胞。对于G I / O偶联的G蛋白偶联受体,克隆HEK293一行首先创建表达了重定向GPCR与G q-PLC / IP 3通路嵌合G蛋白。这是通过嵌合G蛋白,G qi5,其中包含主要Gαq序列和G i的羧基末端的五个氨基酸来完成。这5个氨基酸足够对于G qi5到以G 的i / o -偶联的GPCR通信,而是通过对G q途径发出信号。对于克S-偶联的G蛋白偶联受体,G的QS5嵌合体使用10。用于生产CNiFER一般策略是:1)创建克隆HEK293细胞是稳定表达的光的 Ca 2+检测器, 即 ,TN-XXL,使用HEK细胞的慢病毒转导,2)稳定表达的G蛋白嵌合体如果需要,在HEK293细胞克隆表达的TN-XXL,以及3)在HEK293细胞建立稳定表达GPCR克隆克隆表达的TN-XXL和嵌合G蛋白。缺少了GPCR,但有TN-XXL和嵌合G蛋白的克隆HEK293线作为"控制CNiFER"。控制CNiFER是需要确认CNiFER响应是由于专门改造的受体, 即 D2R,而不是在HEK293细胞中内源表达的其他受体的活化的活化。
以产生慢病毒,慢病毒表达系统被使用, 例如 ,PCDH-CMV-MCS-EF1-迪普 罗,其中包含负责包装,转导,病毒表达的稳定整合构造成基因组DNA和表达靶的遗传元件基因序列。为了产生病毒颗粒,表达和包装载体的高滴度被瞬时共转染到生产者哺乳动物细胞和病毒被收集。有几种病毒核心设施,在美国,可以产生高缇之三慢。以下HEK293细胞的感染中,迪普罗基因提供了用于鉴定转染的HEK293细胞的抗生素抗性。
为了确定具体的无性系,转导HEK293细胞使用荧光激活细胞分选(FACS)系统排序。的目的是,在包含基于FRET的钙离子检测器的高表达水平和经历FRET的能力的克隆。在FACS分析的该例子中,ECFP发射的荧光作图对FRET信号(ECFP激发和黄晶发射)。的框标记将随后选择("选通"),用于分选入96孔板( 图2)的区域(P2和P3)。一般地,约4个96孔板足以筛选成功创建CNiFERs的。从这些4板,约100个克隆都适合荧光平板读数器分析。
e_content"FO: - together.within页保留="1">
图2:FACS分析示例跟随FACS分析输出的样本。的图形绘制ECFP发射("475/20-A"),为黄晶发射的一个功能("FRET V-器530/30-A"),使用ECFP激发每个小区。区域P2和P3显示区域中选择, 即 ,门控,分选成单个细胞。颜色是任意的。 请点击此处查看该图的放大版本。
一旦分选的细胞已经生长到足够密度,以下激动剂活化的FRET响应使用装有溶液处理96孔荧光平板读数器系统确定。缩小克隆研究的数量,一个"3点"激动剂曲线用来筛选〜100个克隆,选择CNiFERs最好的回应。约10个克隆是随后用测定同源激动剂完整的剂量 - 反应的进一步分析,和非特异性的反应,与其它12递质或调节探测。将96孔药物板被制备为三倍浓度(最终浓度稀释1:在板3)的药物( 如激动剂,拮抗剂等 )的ACSF中。在本实施例中,药物板被设置用于测试D2 CNiFER与其同源受体激动剂,多巴胺和潜在的非特异性的反应与多种其它神经递质和肽激动剂的( 图3)。骨干CNiFER,它缺乏GPCR,作为新创建CNiFER一个重要的控制。
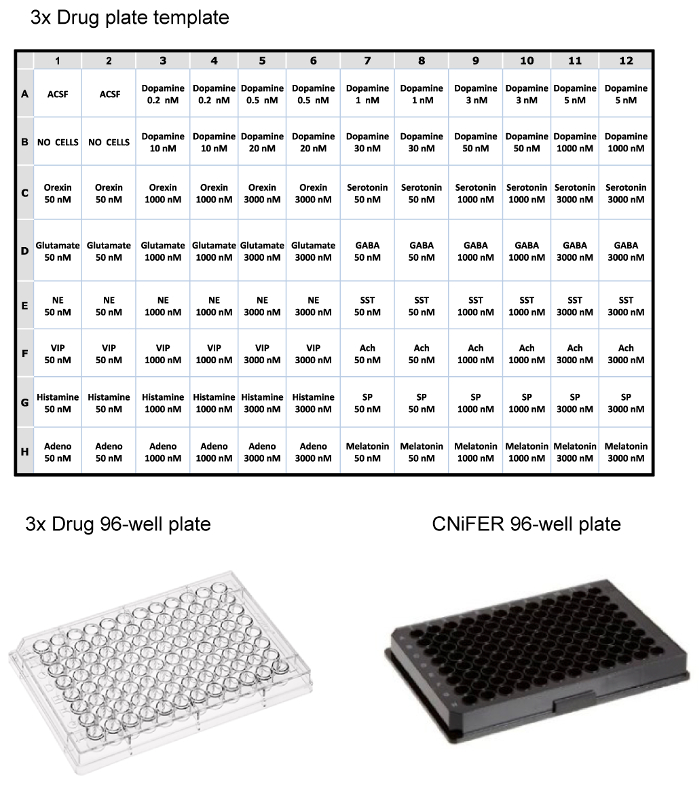
图3:96孔板布局的例子顶部的辣油表吨加载的3倍药物板荧光板读取器,使用各种神经递质和肽的三倍的浓度。底部的透明塑料96孔药物板播种CNiFERs和酶标仪测量黑色96孔板的例子。 请点击此处查看该图的放大版本。
所述GPCR刺激预期增加的FRET响应,如通过TN-XXL细胞内的[Ca 2+]和检测的标高的结果。在这些条件下,FRET是由ECFP和黄晶靠拢,所以ECFP的该激励产生较小ECFP发射,以及较大的水晶发射产生的。在这个例子中,激发被设置为436 nm,发射滤波器被设置为ECFP 485±7.5 nm和527为黄晶±7.5纳米( 图4)。巴三十秒seline荧光测定,然后50从ACSF中板的"三重"激动剂微升被输送到各孔含有100微升的ACSF(1:3稀释)。 ECFP和黄水晶发射荧光测量每3.8秒180秒。背景测量从孔中取无细胞和减去,如果需要的话。荧光强度标准化为预先刺激的基线(F(T)/ F(基线)),并且峰值响应测量来计算527的FRET比率(ΔR/ R)用F(T)/ F(基线)纳米和485纳米通道(等式1)。剂量响应曲线,然后由绘制的FRET比率不同激动剂浓度的函数,并且与希尔方程拟合,以确定EC 50和希尔系数( 图5)(式2)构成。最佳CNiFER表现出大的FRET比率和合适的EC 50为同源激动剂,并且显示出很少或没有背景响应其他neurotransmit之三激动剂。相比之下,控制CNiFER应该显示的同源激动剂小的反应。
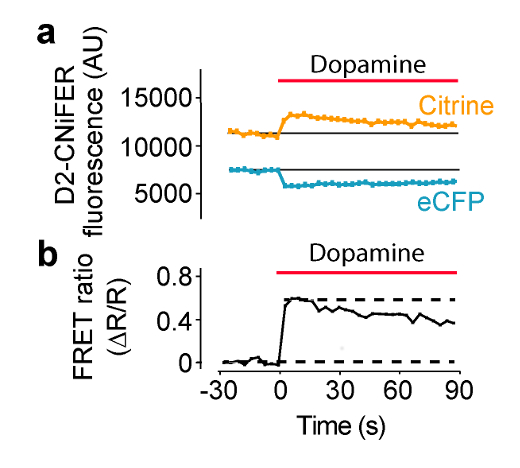
图4:在用溶液递送系统读板器测定激动剂诱导的FRET响应 D2R CNiFER FRET响应的实施例 。 ( 一 )FRET变化曲线, 即 ECFP激励与ECFP和黄水晶排放,多巴胺(红色条)的应用过程中,D2 CNiFERs。需要注意的是ECFP排放量减少,而与激动剂(多巴胺),黄水晶排放的增加。 (B) 在从穆勒等人修改(A)图的响应FRET比率(公式1)的情节在2014年7, 请点击这里查看该图的放大版本。
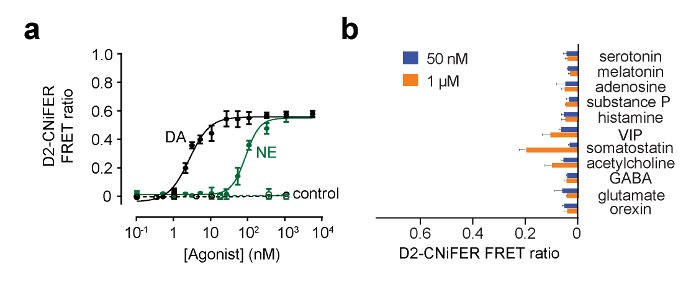
图 5:为D2 CNiFER 剂量响应曲线的实例 (A)的剂量为D2 CNiFERs的响应于多巴胺(DA,黑色)和去甲肾上腺素(NE,绿色)响应曲线。此外,缺乏D2R"控制"CNiFERs响应被示出。 (B)中的图形显示出,在50纳米和1微米为其它神经递质和调制器的FRET比率反应。值是平均值±SEM。图来自穆勒等人 ,2014年7修改。 请点击此处查看该图的放大版本。
CNiFER克隆可以进一步可能的受体依赖性脱敏和对它们的时间分辨率进行评估,判别演示两种不同的激动剂脉冲(详见穆勒等人 ,2014年7)。具有构成一个CNiFER克隆,下一个步骤是,以测试其功能在体内 。以监测体内荧光,有必要使用一个双光子显微镜。制备稀疏颅骨窗后,CNiFERs装入玻璃吸管并注入层皮质的2/3。鼠标然后通过玻璃盖玻片附着到减薄头骨,并植入头栏成像期间固定头( 图6) 用于体内成像制备。
以确定植入CNiFERs 在体内存活,激动剂已知浓度可植入部位附近注入和FRET的比率来确定7。为了进一步验证植入CNiFERs的活性,刺激神经元输入应检查。例如,用D 2 CNiFER,效果了检查投射到皮质中脑多巴胺神经元的电刺激。一个0.1兆欧钨双极刺激电极具有500微米的尖端分离植入黑质(-3.2毫米的A / P,-1.3毫米M / L,-4.4毫米D / V), 图6示出了电的一例刺激在不同强度的黑质和观察在FRET比率为D2 CNiFERs 7的增加。需要注意的是全身腹膜内(IP)一个D 2受体拮抗剂,依替必利(1毫克/千克),块D2 CNiFER响应的注入。另一方面,注射可卡因(15毫克/千克),其多巴胺块再摄取,提高电诱发D2 CNiFER响应7。

图6:D2 CNiFER响应我 的示例 翁>ñ体内继黑质的电刺激 (A)的一幅漫画描绘体内双光子成像和电刺激准备了头固定的鼠标。为激发双光子光(红,820纳米),475纳米发射为ECFP(蓝色)和530nm的发射为黄晶(绿色)。 (B)中的线图显示以下黑质电刺激,对D2 CNiFER FRET的比率注入皮质即在50赫兹为500毫秒,和50至300微安200微秒脉冲以下的D2R的存在下的电刺激拮抗剂(依替必利)或可卡因。图来自穆勒等人 ,2014年7修改。 请点击此处查看该图的放大版本。
ftp_upload / 53290 / 53290table1.jpg"/>
表1:用于制备HEK293生长培养基和人工脑脊液的化学品和试剂的列表 。

表2:卷的收获细胞从不同的尺寸培养板或瓶 。
讨论
CNiFERs的创建提供了用于体内光学测量大脑神经递质释放的创新和独特的策略。 CNiFERs非常适合用于测量突触外发布, 即音量传导,神经递质。重要的是,每CNiFER具有天然的GPCR的性质,提供了在大脑中的神经递质的水平的变化的生理光学测量。迄今,已被用于检测乙酰创建CNiFERs(M1-CNiFER)6,多巴胺(D2-CNiFER)7和去甲肾上腺素(α1A-CNiFER)7。
原则上,一个CNiFER可以为通过GPCR信号的任何神经递质创建。对于其中至G q的G蛋白的G蛋白偶联受体信号,没有进一步的修改是必要的HEK293细胞的情况。通过G信号GPCRs的I / O,但是,需要A G qi5嵌合G蛋白共表达以耦合GPCR与G Q / PLC途径7,10。同样,它们通过G S信号的GPCR将需要一个嵌合G QS5 G蛋白10的共表达。一旦完成,每个CNiFER克隆进行筛选,并仅具有相媲美的天然受体的亲和性的那些CNiFER克隆显示出很少或没有脱敏,并提供一个信噪比即足以在体内双光子显微镜测量,被选择用于体内研究。
对于体内研究,强烈建议用环孢素,以尽量减少任何潜在的免疫应答来治疗小鼠。有排斥的可能性或植入人CNiFER细胞进入啮齿动物脑的免疫应答。这是通过检查GFAP和MAC1 7的表达,下面CNiFER植入先前调查。 CNiFERs并未以产生神经胶质疤痕或产生任何显ficant MAC1染色7。
在构建CNiFERs要考虑两个主要问题是敏感性和脱敏。如果EC 50太高, 即低亲和力,相对于天然受体,则CNiFER可能不具有足够的灵敏度以检测体内的神经递质的释放。一种解决方案是rescreen克隆,并选择具有较高的亲合性的不同CNiFER克隆。另一种策略是测试其他类型的基因编码荧光钙 -detectors可能有较高的钙离子的敏感性,它可以转移EC 50 GPCR激活。因为CNiFER设计是模块化的,它很容易适应于其它类型的遗传编码的 Ca 2+ -detectors,如GCaMP 16。隔离CNiFER克隆具有相同的受体,但不同的EC 50号可以用于延长内源性神经检测释放的动态范围是有利rotransmitters 体内 。
所述CNiFER脱敏也将限制其在体内使用。如果峰值响应逐渐与激动剂的每个脉冲减小,则该受体可以被脱敏。在这种情况下,检查其它克隆和确定它们是否作出反应的方式相同。修改该受体的氨基酸序列,或使用受体的另一亚型可能是必要的,以解决激动剂依赖性脱敏。如果存在已知的磷酸化或氨基酸位点确定了与G蛋白受体激酶(GRKs)准,这将是可取通过突变一个或多个位点来构建GPCR的非脱敏变体。必须根据具体情况逐案各受体确定脱敏的机制。
迄今,CNiFERs已仅注入到皮质6,7-浅层,由于光谱与成像荧光局限性双光子英里croscopy 17,18。在将来,有可能适应CNiFER技术荧光19的基于光纤的测量,因此,CNiFERs可以在皮层下的大脑区域被植入。
披露声明
作者什么都没有透露。
致谢
我们感谢B.康克林(美国加州大学旧金山分校),用于提供对G qi5和G QS5的cDNA,A史怀哲寻求帮助,以电子,N.泰勒与克隆,伊恩Glaaser和罗伯特·里夫金的校对筛查援助,和Olivier Griesbeck为TN-XXL。 (; DA037170 DA029706),生物医学成像和生物工程研究所(NIBIB)(EB003832),霍夫曼 - 罗氏(88610A)和"神经科学这项工作是通过药物滥用美国国家研究所(NIDA)的研究资助项目通过NIDA(DA007315)关于滥用"培训资助的药物。
材料
| Name | Company | Catalog Number | Comments |
| pCDH-CMV-MCS-EF1-Puro | System Biosciences | CD510B-1 | Cloning: for generating lentivirus |
| 12 x 75 *BD Falcon High Clarity Polypropylene Round Bottom Test Tube | BD Biosciences | 352063 | FACS |
| BD 40 um Falcon cell strainers | BD Biosciences | 352340 | FACS |
| 0.05% Trypsin EDTA | Invitrogen | 25200056 | FACS |
| 96 Well Plate, flat bottom, clear | Corning | 3596 | FACS |
| 96 well cell culture plates | Corning | CLS3997 | Flexstation |
| Optilux black clear bottom | Corning | 3603 | Flexstation |
| Flexstation pipet tips | Molecular Devices | 9000-0911 | Flexstation |
| Acetylcholine Chloride | Sigma-Aldrich | A2661 | Flexstation |
| Norepinephrine | Sigma-Aldrich | A7256 | Flexstation |
| Dopamine Hydrochloride | Sigma-Aldrich | PHR1090 | Flexstation |
| GABA | Sigma-Aldrich | A2129 | Flexstation |
| Histamine | Sigma-Aldrich | H7125 | Flexstation |
| Glutamate | Sigma-Aldrich | 49621 | Flexstation |
| Epinephrine | Sigma-Aldrich | E4642 | Flexstation |
| Somatostatin | Sigma-Aldrich | S1763 | Flexstation |
| 5HT | Sigma-Aldrich | H9523 | Flexstation |
| VIP | Alpha Diagnostics Inc. | SP-69627 | Flexstation |
| Orexin A | Alpha Diagnostics Inc. | 12-p-01 | Flexstation |
| Substance P | Sigma-Aldrich | S6883 | Flexstation |
| Adenosine | Sigma-Aldrich | A4036 | Flexstation |
| Melatonin | Sigma-Aldrich | M5250C | Flexstation |
| Fluorescence Plate Reader & software | Molecular Devices | Flexstation 3 | Flexstation |
| DMEM (high glucose) with Glutamax | Life Technologies | 10569-010 | Tissue culture |
| Fetal bovine serum | Life Technologies | 10082-139 | Tissue culture |
| Pen/Strep antibiotics | Life Technologies | 15140-122 | Tissue culture |
| Puromycin | InvivoGen | ant-pr-1 | Tissue culture |
| Fibronectin | Sigma-Aldrich | F0895 | Tissue culture |
| CoolCell LX Alcohol-free controlled-rate cell freezing box | Bioexpress | D-3508) | Tissue culture |
| cyanoacrylate glue | Loctite | Loctite no. 495 | surgery and stereotaxic injection |
| plastic paraffin film | VWR | Parafilm® | surgery and stereotaxic injection |
| Nanoinjector | Drummond | 3-000-204 | surgery and stereotaxic injection |
| Glass electrodes | Drummond | 3-000-203G | surgery and stereotaxic injection |
| hand held drill | OSADA | Exl-M40 | surgery and stereotaxic injection |
| Burrs for drill | Fine Scientific | 19007-05; 19007-07) | surgery and stereotaxic injection |
| Sterilizing bath | FST | 18000-45, Hot Bead Sterilizer | surgery and stereotaxic injection |
| isoflurane chamber/mask | Highland Medical Equipment | 564-0427, HME 109 Table Top Anesthetic Machine with Isoflurane Vaporizer, O2 Flowmeter, Gang Valve; 564-0852, Induction Chamber 16X7X7.5cm | surgery and stereotaxic injection |
| 3D scope with arm | Zeiss | surgery and stereotaxic injection | |
| fiber optic light | surgery and stereotaxic injection | ||
| Betadine | surgery and stereotaxic injection | ||
| 70 % (v/v) isopropyl alcohol | surgery and stereotaxic injection | ||
| Povidone-Iodine Prep Pads | dynarex | 1108 | surgery and stereotaxic injection |
| NaCl 0.9% (injection, USP, 918610) | surgery and stereotaxic injection | ||
| CYCLOSPORINE (INJECTION, USP) | surgery and stereotaxic injection | ||
| Buprenex (injection) buprenorphine (0.03 μg per g rodent) | Sigma-Aldrich | surgery and stereotaxic injection | |
| Ophthalmic ointment | Akorn | NDC 17478-235-35 | surgery and stereotaxic injection |
| Surgifoam | Ethicon | surgery and stereotaxic injection | |
| Grip dental cement | Dentsply | #675571, 675572 | surgery and stereotaxic injection |
| Instant SuperGlue | NDindustries | surgery and stereotaxic injection | |
| LOCTITE 4041 | surgery and stereotaxic injection | ||
| METABOND | C&B | surgery and stereotaxic injection | |
| no. 0 cover glass | Fisher | surgery and stereotaxic injection | |
| stereotaxic frame | Kopf | surgery and stereotaxic injection | |
| Rectal probe and heating pad | FHC | 40-90-8D, DC Temperature Controller,40-90-2-06, 6.5X9.5cm Heating Pad40-90-5D-02, Rectal Thermistor Probe | surgery and stereotaxic injection |
| optical breadboard for imaging | Thorlabs | surgery and stereotaxic injection | |
| Mineral oil | Fisher | S55667 | surgery and stereotaxic injection |
| Kwik-Cast (Silicone elastomer) | World Precision Instruments | surgery and stereotaxic injection | |
| Suture | Ethicon | 18’’, 1667, 4-0 | surgery and stereotaxic injection |
| Scissors | Fine Scientific Tools | 91500-09, 15018-10 | surgery and stereotaxic injection |
| Forcepts | Fine Scientific Tools | 11252-30; #55, 11295-51; Grafe, 11050-10 | surgery and stereotaxic injection |
| Student Halsted-Mosquito Hemostats | Fine Scientific Tools | 91308-12 | surgery and stereotaxic injection |
| Small Vessel Cauterizer Kit | Fine Scientific Tools | 18000-00 | surgery and stereotaxic injection |
| Hot Bead Sterilizers | Fine Scientific Tools | 18000-45 | surgery and stereotaxic injection |
| Instrument Case with Silicone Mat | Fine Scientific Tools | 20311-21 | surgery and stereotaxic injection |
| Plastic Sterilization Containers with Silicone Mat | Fine Scientific Tools | 20810-01 | surgery and stereotaxic injection |
| 2P fixed-stage fluorescence scope for in vivo imaging | Olympus | FV1200 MPE | in vivo imaging |
| Multiphoton laser | SpectraPhysics | Mai Tai DeepSee | in vivo imaging |
| Green Laser | Olympus | 473 nm Laser | in vivo imaging |
| xy translational base | Scientifica | MMBP | in vivo imaging |
| FRET filter cube for YFP and CFP | Olympus | in vivo imaging | |
| 10x and 40x water immersion objectives | Olympus | in vivo imaging | |
| air table | Newport | in vivo imaging | |
| custom built light-tight cage | Thorlab | in vivo imaging |
参考文献
- Day, J. C., Kornecook, T. J., Quirion, R. Application of in vivo. microdialysis to the study of cholinergic systems. Methods. 23, 21-39 (2001).
- Robinson, D. L., Venton, B. J., Heien, M. L., Wightman, R. M. Detecting subsecond dopamine release with fast-scan cyclic voltammetry in vivo. Clin Chem. 49, 1763-1773 (2003).
- Liang, R., Broussard, G. J., Tian, L. Imaging Chemical Neurotransmission with Genetically Encoded Fluorescent Sensors. ACS Chem Neurosci. , (2015).
- Okubo, Y., et al. Imaging extrasynaptic glutamate dynamics in the brain. Proc. Natl. Acad. Sci. USA. 107, 6526-6531 (2010).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods. 10, 162-170 (2013).
- Nguyen, Q. T., et al. An in vivo biosensor for neurotransmitter release and in situ receptor activity. Nat Neurosci. 13, 127-132 (2010).
- Muller, A., Joseph, V., Slesinger, P. A., Kleinfeld, D. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods. 11, 1245-1252 (2014).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. , e3998 (2012).
- Wang, X., McManus, M. Lentivirus production. J Vis Exp. , (2009).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Gjα. Nature. 363, 274-276 (1993).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1, 3166-3173 (2006).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. , (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7, 981-984 (2010).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32, 1277-1309 (2012).
- Yamauchi, J. G., et al. Characterizing ligand-gated ion channel receptors with genetically encoded Ca2+ sensors. PLoS One. 6, e16519 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. 32, 13819-13840 (2012).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2, 932-940 (2005).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Cui, G., et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 494, 238-242 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。