Method Article
בנייה מבוססת תאים נוירוטרנסמיטר פלורסנט Engineered כתבים (CNiFERs) עבור זיהוי אופטי של נוירוטרנסמיטורים
In This Article
Summary
אנו מציגים פרוטוקול ליצור לכתבים מהונדסים פלורסנט הנוירוטרנסמיטר מבוססי תאים (CNiFERs) לצורך זיהוי אופטי של שחרור הנוירוטרנסמיטר נפח.
Abstract
כתבים מהונדסים פלורסנט הנוירוטרנסמיטר מבוסס תאים (CNiFERs) לספק כלי חדש עבור מדעני מוח כדי אופטי לזהות את השחרור של נוירוטרנסמיטורים במוח in vivo. ספציפית CNiFER נוצר מתא כליה עוברי אנושי ביציבות מבטא G- חלבון בשילוב ספציפי לקולטן, אשר זוגות q G / 11 חלבוני G, וכן סריג מבוסס Ca 2+ -detector, TN-XXL. הפעלת הקולטן מובילה לעליית אות הסריג. CNiFERs יש ננומטר רגיש תגובה זמנית של שניות, כי שיבוט CNiFER מנצל את הקולטן המקורי עבור נוירוטרנסמיטר מסוים, למשל, D2R עבור דופמין. CNiFERs מושתל ישירות לתוך המוח, מה שמאפשר להם לחוש שחרור הנוירוטרנסמיטר עם רזולוציה מרחבית של פחות ממאה מיקרומטר, מה שהופך אותם אידיאליים כדי למדוד הולכת נפח in vivo. CNiFERs יכול גם לשמש מסך תרופות אחרות עבור תגובתיות צולבת הפוטנציאל viVO. לאחרונה הרחיבה משפחת CNiFERs לכלול GPCRs כי בני הזוג G i / o G חלבונים. CNiFERs זמין לאיתור אצטילכולין (ACH), דופמין (DA) ונוראפינפרין (NE). בהתחשב בכך כל יכול לשמש GPCR ליצור רומן CNiFER וכי ישנם כ 800 GPCRs בגנום האנושי, אנו מתארים כאן את ההליך באופן כללי לתכנן, להבין, ולבדוק כל סוג של CNiFER.
Introduction
כדי להבין כיצד נוירונים לתקשר במוח, יש צורך להיות שיטה למדוד את שחרורו של נוירוטרנסמיטורים in vivo. ישנן מספר ומבוסס טכניקות למדידת נוירוטרנסמיטורים in vivo. טכניקה נפוצה אחת היא microdialysis, שבו צינורית מוכנס לתוך מוח נפח קטן של נוזל השדרתי נאסף ונותח באמצעות כרומטוגרפיה נוזלית בעל ביצועים גבוהים אלקטרוכימיים זיהוי 1. Microdialysis בעל רזולוציה מרחבית בסדר גודל של כמה בקטרים של החללית, למשל, ~ 0.5 מ"מ עבור microprobe בקוטר 200 מיקרומטר. ההחלטה הזמנית של טכניקה זו, לעומת זאת, הוא איטי בגלל מרווחי דגימה אשר בדרך הכלל האחרון ~ 5 דקות או יותר 1. יתר על כן, ניתוחים אינם עשויים בזמן אמת. טכניקה נוספת היא voltammetry המחזורית הסריקה מהירה (FSCV), אשר משתמשת במכשיר בדיקה סיבי פחמן מוכנס לתוך המוח. יש FSCV טמפ מעולהרזולוציה אוראלית (subsecond), רגישות גבוהה (nanomolar), ברזולוציה מרחבית בקטרי בדיקה של 5 עד 30 מיקרומטר. עם זאת, FSCV מוגבל משדרי המייצרים חמצון מאפיין ופרופיל הפחתה במתח על בדיקת פוטנציומטרית פחמן 2.
טכניקה שלישית למדוד נוירוטרנסמיטורים היא ישירות דרך הנוירוטרנסמיטר גנטי בקידוד (NT) biosensors 3. באמצעות שיטה זו, חלבון היתוך חדש שמכיל תחום מחייב ליגנד עבור משדר מצמיד את העברת אנרגית תהודת קרינה (סריג) זוג מבוסס של fluorophores 4 או permutated GFP 5. בניגוד לשתי השיטות הקודמות, חיישנים ביולוגיים אלה מקודדים גנטיים והביעו על פני השטח של תא מארח, כגון תא עצב, דרך הייצור של חיות טרנסגניות או בחריפות עם השימוש בחומרים ויראלי להדביק תאים. נכון להיום, biosensors גנטית בקידוד פותחו רק detectinגלוטמט g ו- GABA 3-5. מגבלות עם טכניקות אלה היו רגישים הנמוכים, בטווח ננומטר, וחוסר היכולת להרחיב את זיהוי המספר הגדול של משדרים, למשל, נוירוטרנסמיטורים קלסי, נוירופפטידים ו neuromodulators, אשר אות דרך החלבון בשילוב קולטנים G (GPCRs). למעשה, ישנם קרוב ל -800 GPCRs בגנום האנושי.
כדי לתת מענה הגירעונות הללו, פתחנו כלי חדשני לשחרורו מידה האופטי של כל נוירוטרנסמיטר סיגנלים דרך GPCR. CNiFERs (כתבים מהונדסים פלורסנט הנוירוטרנסמיטר מבוסס תאים) הם תאים משובטים HEK293 המהונדס להביע GPCR ספציפי, כאשר מגורה, מפעיל עלייה תאית [Ca 2 +] כי הוא זוהה על ידי חיישן סריג מבוסס מקודדים גנטיים Ca 2+, TN-XXL. לפיכך, CNiFERs להפוך קולטן הנוירוטרנסמיטר מחייב לכדי שינוי קרינה, מתן r האופטי ישירה בזמן האמתקצוב EAD של פעילות הנוירוטרנסמיטר מקומית. על ידי ניצול של קולטן המקורי עבור נוירוטרנסמיטר נתון, CNiFERs לשמר את וספציפיות כימיות, זיקה ודינמיקה זמנית של קולטנים הביע באופן אנדוגני. נכון להיום, יצרו לנו שלושה סוגים של CNiFERs, אחד לאיתור אצטילכולין באמצעות קולטן M1, אחד לאיתור דופמין באמצעות קולטן D2, ואחד לאיתור נוראפינפרין באמצעות 6,7 קולטן α1a. טכנולוגית CNiFER היא בקלות להרחבה, וניתן להרחבה, מה שהופך אותו מי שפתוח לכל סוג של GPCR. במאמר יופיטר זה נתאר ולהמחיש את המתודולוגיה לעצב, להבין, ובדקו CNiFERs vivo עבור כל יישום.
Protocol
הנהלים כל חיה שבוצעה במחקר זה הם בהתאם טיפול בבעלי חיים מוסדיים ועדת שימוש (IACUC) הנחיות, ואת אושרו על ידי IACUCs בבית הספר אייקן לרפואה הר סיני ואת אוניברסיטת קליפורניה, סן דייגו.
1. צור GPCR להביע Lentivirus להפיכת תאים HEK293
- השג את cDNA עבור GPCR ספציפי ממקור מסחרי, למשל, cdna.org. לחלופין, להגביר את הגן GPCR מספריה cDNA באמצעות PCR. השג וקטור להביע lentivirus, כגון pCDH-CMV-MCS-EF1-Puro (pCDH). השתמש וקטור זה כדי להפיץ את ה- DNA, כמו גם ליצור lentivirus.
- לשכפל את cDNA GPCR לתוך וקטור להביע lentivirus ידי PCR. ראה לורנץ 8, לקבלת פרטים על subcloning PCR.
- להרחיב ולטהר את ה- DNA GPCR-pCDH באמצעות ערכת הכנה רעלן פנימי ללא 'מקסי' על פי הנחיות היצרן. ודא GPCR cDNA subcloned לתוך pCDH הוא mutation-חינם על ידי רצפי DNA.
הערה: לפני הגשת DNA לייצור וירוס, לעכל דוגמא מתמיסה בסיסית עם אנזים הגבלה מתאים כדי לאשר גודל של כנס וטוהר של ה- DNA. - צור lentivirus באמצעות מתקן הגרעין וירוס, כגון אחד בבית סאלק המכון, אוניברסיטת פן., או אוניברסיטת צפון קרוליינה, וכו ', או ליצור בתוך הבית 9. השתמשו כ -25 מיקרוגרם (> 1 מיקרוגרם / μl) של ה- DNA חופשי-רעלן פנימי עבור transfection של תאים HEK בבקבוק T75. ודא כי ה- DNA הוא טוהר גבוה, בעל יחס ספיג (260/280) של ~ 1.8.
הערה: כותרות של וירוס ~ 10 11 -10 12 GC / מ"ל הם אופטימליים עבור התמרה של תאים HEK293.
2. בחירת HEK293 / סוג תא Backbone TN-XXL עבור Culturing במבחנה
הערה: בדוק את הספציפיות צימוד חלבון G, למשל, G i / o, G q / 11, או חלבוני G של G, של GPCR, כמו דסק"ש זהטאטעס אם כימרה חלבון G דרוש CNiFER. עבור קולטני G q -coupled, למשל, קולטן מוסקריניים M1, לבחור HEK293 / TN-XXL (# 3g8) כסוג תא HEK293 עמוד השדרה. עבור G i / o -coupled קולטנים, את qi5 G חלבון G כימרי נדרש 10. לקולטנים אלו -coupled של G, הכימרה qs5 G נדרשת 10. בפרוטוקול זה, בניית D2R CNiFER משמשת כדוגמא. אותות D2R עד G i / o G חלבונים דורש HEK293 תאים ביציבות להביע חלבון G כימרי, qi5 G, למשל, HEK293 / TN-XXL / G qi5 _ # qi5.6.
- השג את qi5 HEK293 / TN-XXL / G _ # התאים המשובטים qi5.6 מ מעבדת מחקר. הערה: להלן תאים משובטים, HEK293 / TN-XXL (# 3g8) עבור קולטני G q -coupled, HEK293 / TN-XXL / G qi5 (# qi5.6) עבור G i / o -coupled קולטנים, HEK293 / TN -XXL / G qs5 (# qs5.47) מחדש -coupled s Gceptors, זמינים באופן חופשי על פי דרישה 6,7.
- לגדול ולהתרחב HEK293 / TN-XXL / G qi5 _ # qi5.6 ל ~ 90% confluency בבקבוק T25 עם 5 מ"ל של התקשורת צמיחה HEK293 (טבלה 1). לגדל את התאים חממה humidified על 37 מעלות צלזיוס עם 5% (v / v) CO 2.
הערה: כל העבודה עם תאי culturing HEK293 צריכה להתבצע תוך שימוש בטכניקות רקמת סטרילית תרבות סטנדרטית. - קציר HEK293 התאים על ידי aspirating התקשורת הראשונה מן הבקבוק T25. שוטפים את התאים בעדינות על ידי הוספת 5 מ"ל של PBS ו נדנדה הבקבוק.
- הסר את PBS ולהוסיף 1 מ"ל של 0.05% (w / v) טריפסין / EDTA (טבלה 2). דגירה של 1 עד 2 דקות ב 37 מעלות צלזיוס עם 5% (v / v) CO 2.
- איסוף תאים ולהעביר סטרילית 15 מ"ל צינור חרוטי. צנטריפוגות במשך 5 דקות XG ב 1000 בצנטריפוגה תרבית תאים. לשאוב supernatant.
- Resuspend התא גלולה ב 5 מ"ל של התקשורת צמיחה HEK293. ספירת התאים בתוך hemocytometer באמצעותtrypan כחול. חשב את צפיפות התאים והמשך לשלב 3.
3. התמרה lentiviral של HEK293 / TN-XXL / תאים Gqi5
- זרעים בקבוקון T25 עם 0.7 x 10 6 HEK293 / TN-XXL / G תאים qi5. לגדל את התאים חממה humidified על 37 מעלות צלזיוס עם 5% (v / v) CO 2 עד ומחוברות ~ 50%, לאחר כ 1 יום. להקפיא תאים נותרים (שלבי 8.2-8.3). תאים אלה ישמשו את השליטה CNiFER, כלומר, CNiFER כי חסרה את GPCR.
- ביום הזיהום, לדלל את lentivirus להביע GPCR (שלב 1.4) לריכוז סופי של ~ 10 9 GC / מ"ל בנפח כולל של 2 מ"ל של התקשורת צמיחה HEK293 (טבלה 1). לדוגמה, להוסיף 20 μl של 10 11 וירוס GC / מ"ל 2 מ"ל התקשורת בבקבוק T25.
הערה: המידע כייל הנגיף צריך להינתן על ידי מתקן גרעין וירוס. שלב lentivirus ותקשורת צינור צנטריפוגות ו triturate בעדינות. טיטרים גבוהים של lentivirus הם biosafety ברמה 2 (BSL-2). - לשאוב התקשורת מהבקבוק T25. מוסיפים את 2 מ"ל של וירוס / מדיה תערובת משלב 3.2. דגירה O בקבוק T25 / N ב 37 מעלות צלזיוס עם 5% (v / v) CO 2.
- אחרי יום אחד של זיהום, לשאוב את התערובת וירוס / מדיה ולהחליפה puromycin המכילות מדיה צמיחה HEK293 (2 מיקרוגרם / מ"ל; טבלה 1). Puromycin בוחר עבור תאי transduced. דגירה את הבקבוק על 37 מעלות צלזיוס עם 5% (v / v) CO 2 עד 90% על ומחוברות, לאחר ~ 1-2 ימים.
- הכינו צלחת 96-היטב (שחור עם תחתית ברורה) מצופה פיברונקטין, להפקת עקומת 10 נקודות אגוניסט / הפעלה בשלב 4.1. במנדף סטרילי, להוסיף 50 פיברונקטין μl (5 מיקרוגרם / מ"ל) לכל היטב בשורות A ו- B של צלחת 96-היטב. דגירה את הצלחת על טמפ החדר למשך שעה 1. לשטוף פעמיים במשך 5 דקות לכל לשטוף עם PBS. הוסף 50 μl של תקשורת צמיחת HEK293 דגירת O / N ב 37 מעלות צלזיוס עם 5% (v / v) CO 2.
הערה: Fibronצלחות שטופל ectin זמינות מסחרי. - קציר התאים בבקבוק T25 כמתואר בשלבים 2.3-2.6 (טבלה 2).
- Resuspend התא גלולה ב 5 מ"ל של התקשורת צמיחה HEK293. זרעים בקבוקון T25 עם 1.5 מ"ל של תאים לניתוח FACS. כמו כן, זרע בבקבוק T75 עם 1 מ"ל של תאים להקפאה ואחסון (ראה צעדים 8.2-8.3)
- עבור עקומת אגוניסט של 10 נקודות, זרע בשתי השורות הראשונות (A ו- B) של צלחת 96-היטב פיברונקטין מצופה (משלב 3.5) עם 100 μl של ההשעיה תא לכל טוב.
- דגירה תאים HEK293 גדל בבקבוק T25, T75 בקבוקון וצלחת 96-היטב עד ומחוברות ~ 90% על 37 מעלות צלזיוס עם 5% (v / v) CO 2, לאחר ~ 1-2 ימים.
4. FACS ובידוד של משובטים יחידים CNiFER
- השתמש צלחת 96-היטב ליצירת עקומת ההפעלה אגוניסט של 10 נקודות.
הערה: לפני שמתחיל תא מופעל קרינת מיון (FACS) ניתוח, חשוב לאשר אתהביטוי של GPCR ידי בדיקת תאים transduced לתגובה אגוניסט (עקומת אגוניסט של 10 נקודות). בדיקה זו מתבצעת באמצעות קורא צלחת fluorometric.- הכינו צלחת התרופה עבור עקומת ההפעלה אגוניסט של 10 נקודות. בחר 10 ריכוזי אגוניסט שונים שעוטפים את ניבאו 50 EC, אשר ניתן לקבוע מן הספרות.
הערה: צלחת התרופה מכילה פי 3 של כל ריכוז (בשני עותקים) כדי להתאים עבור דילול 1: 3 בצלחת CNiFER. לדוגמא, צלחת תרופת בדיקת D2 CNiFER מכילה 10 ריכוזים שונים של דופמין בריכוזים פי 3; 0.2, 0.5, 1, 3, 5, 10, 20, 30, 50, ו -1,000 ננומטר. בצלחת CNiFER, ולכן, הריכוזים הסופיים של דופמין הם 0.067, 0.167, 0.333, 1.00, 1.67, 3.33, 6.67, 10.0, 16.7, ו 333 ננומטר. - הכן את הפתרונות אגוניסט באמצעות נוזל השדרה מוחין מלאכותית (ACSF) (טבלה 1). השתמש שתי בארות עבור 'ACSF', למשל, A1 ו- A2,ושתי בארות עבור 'לא התאים ", למשל, B1 ו- B2.
הערה: כן ריכוזים שונים של תרופות באמצעות שיטת דילול סדרתי. יצירת תבנית כדי לעקוב אחר שיבוטי CNiFER ואת ריכוזי התרופה (איור 3). - השתמש בתוכנה כדי לתכנת את קורא הצלחת 96-היטב fluorometric למדידת סריג וביצוע העברות פתרון.
- הגדר את הטמפרטורה קורא צלחת ל -37 מעלות צלזיוס.
- למדידת סריג עם TN-XXL, קבע את אורך הגל עירור על 436 ± 4.5 ננומטר (מרכז ± HWHM). הגדר את מסנני פליטה כדי 485 ± 7.5 ננומטר עבור ECFP וכדי 527 ± 7.5 ננומטר עבור סיטרין. הגדר את מסנן הפסקת 475 ו 515 ננומטר עבור ECFP סיטרין, בהתאמה.
- לתכנת את קורא הצלחת למדוד פליטה ב 485 ננומטר ו 527 ננומטר כל 4 שניות עבור סכום כולל של 180 שניות. בחר את האפשרות לספק 50 μl מהצלחת התרופה של פי 3 עד 100 μl בצלחת CNiFER, לאחר איסוף 30 שניות שלקרינת בסיס.
- לשאוב את התקשורת בין שורות A ו- B ולהוסיף 100 μl של ACSF לצלחת 96-היטב CNiFER כי הוא ~ 90% ומחוברות (שלב 3.9).
- טען את צלחת CNiFER 96-היטב את הצלחת 'פי 3' התרופה לתוך קורא הצלחת. אפשר ~ 30 דקות כדי לאזן את הצלחות על 37 מעלות צלזיוס. לאחר מכן, להפעיל את התוכנית.
- כדי לנתח נתונים קוראים צלחת, לייצא את ערכי קרינה לגיליון אלקטרוני. צור שנוסחא תפחית את מדידות הרקע (לקחו עבור כל אות מבארת ללא תאים) מבאר עם CNiFERs. לנרמל עוצמות קרינה מראש גירוי ערכי בסיס, F סיטרין (t) / F סיטרין (בסיס), ולחשב את יחס הסריג (ΔR / R;. Eqn 1) באמצעות תגובות השיא ב 527 ננומטר ו 485 פליטת ננומטר (ראה שלב 11 ).
הערה: אם יש שינוי משמעותי ΔR / R עם אגוניסט, אז זה מצביע על ביטוי של GPCR ואחד יכול להמשיך בניתוח FACS (שלב 4.2). אם ההוא פה שום תגובת סריג עם אגוניסט, לפתור באמצעות ionophore Ca 2+, למשל, A21387, על מנת לבחון את תגובת Ca 2+ ולאשר כי החיישן מבוסס סריג עובד. אם ionophore עובד, אז הקולטן לא בא לידי ביטוי סביר.
- הכינו צלחת התרופה עבור עקומת ההפעלה אגוניסט של 10 נקודות. בחר 10 ריכוזי אגוניסט שונים שעוטפים את ניבאו 50 EC, אשר ניתן לקבוע מן הספרות.
- ביום שלפני FACS, להכין ארבע צלחות 96-היטב מצופה פיברונקטין (ראה שלב 3.5) לאיסוף תאים ממוינים. הוסף 50 μl של תקשורת צמיחת HEK293 דגירת O / N ב 37 מעלות צלזיוס עם 5% (v / v) CO 2.
- הכן 5% (w / v) BSA ב PBS (5 גר '/ 100 מ"ל) ולסנן (0.2 מיקרומטר) לתוך בקבוק סטרילי.
- קציר תאי גדלי בקבוק T25 (ראה צעדים 2.3-2.5, טבלה 2). Resuspend התא גלולה ב 4 מ"ל של 5% (w / v) BSA ב PBS. צנטריפוגה התאים XG ב 1000 למשך 5 דקות.
- לשאוב התקשורת resuspend התא גלולה ב ~ 5 מ"ל של 5% (w / v) BSA ב PBS לתת הריכוז הסופי של ~ 5 x 10 6 תאים / מ"ל.
הערה: בדוק עם ההתאחדותמתקן ליבת CS עבור דרישות ספציפיות על צפיפות תאים ותנאי מיון. - סנן את התאים resuspended עם מסננת תא 40 מיקרומטר להסיר גושים. מעביר את תאי פוליפרופילן 5 מיליליטר עגול צינור תחתון. מניחים את הצינור על קרח למשך תחבורה למתקן FACS.
- מיינו את HEK293 תאים transduced במתקן FACS. תוכנית הפרמטרים על FACS לזרום cytometer כדלקמן: להגדיר 4 מעלות צלזיוס למשך בעל מדגם, 100 מיקרומטר עבור הפייה 20 psi. בהתבסס על הניתוח מראש למיין, בחרו את תאים, כלומר, לבחור 'שער', שיש להם קרינת ECFP גדולה (עירור ECFP, פליטת ECFP) ו סריג גדול (עירור ECFP, פליטת סיטרין) קרינה (ראה תוצאות להלן, איור 2 ).
- פרט, מיזוג אוויר, תאים ממוינים לתוך צלחת 96-היטב מוכנה בשלב 4.2, עם כפיל אחד לכל היטב המכיל 50 μl של תקשורת צמיחת HEK293 עם puromycin. הוסף 50 μl של תקשורת צמיחת HEK293 עם puromycin (Table 1) עבור סכום כולל של 100 μl לכל טוב. שמור על תאי O / N ב 37 מעלות צלזיוס עם 5% (v / v) CO 2.
הערה: תקשורת צמיחת HEK293 מכילה puromycin לבחירה של תאי transduced.
5. Culturing והרחבה של ממוין, CNiFERs המשובטים
- שמירה על CNiFERs ב 96-גם הצלחות על ידי הסרת 50 μl של המדיה הישנה מבאר כל והחלפת עם 50 μl של התקשורת צמיחה HEK293 טרי המכיל puromycin (טבלה 1). חזור על פעולה זו כל 5 עד 7 ימים עד ~ 90% ומחוברות, לאחר 2-3 שבועות.
- קציר CNiFER התאים על ידי aspirating התקשורת ושטיפה פעם בעדינות בעדינות עם PBS. הסר את PBS ולהוסיף 20 μl של 0.05% (w / v) טריפסין / EDTA. דגירה של 1 עד 2 דקות ב 37 מעלות צלזיוס עם 5% (v / v) CO 2.
- הוספת 100 μl של התקשורת צמיחה HEK293 לתאים שטופלו טריפסין ו resuspend התאים. תוכן מעביר לצלחת 24 גם המכילה 400 μl שנינות תקשורת צמיחת HEK293 טריh puromycin. בשנות ה 24 גם צלחת, לשמור על תאים על ידי החלפת 250 μl של התקשורת צמיחה HEK293 כל 5-7 ימים עד בארות הם ~ 90% ומחוברות.
6. זהה מועמד CNiFERs בהתבסס על תגובת סריג שימוש Reader פלייט Fluorometric
הערה: עם ארבע צלחות 96-היטב לאחר FACS, שם צריך להיות> 100 שיבוטים לבדיקה ששורדים ולהרחיב לשלב צלחת 24 גם, שכן רב של השיבוטים המקוריים מצליח לגדול. כדי לזהות CNiFERs מועמד פוטנציאלי, השתמש ניתוח 3 נקודות על התגובה סריג עם אגוניסט מאותו מקור, למשל, דופמין עבור D2R.
- כאשר התאים הם ~ 90% ומחוברות בצלחת 24 גם, בעדינות לשאוב התקשורת. הוסף את ~ 100 μl של 0.05% (w / v) טריפסין / EDTA דגירה במשך 1-2 דקות ב 37 מעלות צלזיוס עם 5% (v / v) CO 2. להוסיף 400 μl של התקשורת צמיחה HEK293 לתאים שטופלו טריפסין ומערבבים את התאים על ידי טחינה דקה ועדינה.
- הגדר את עקומת אגוניסט 3 נקודות עבור הסינון הראשוני של CLOנוס. עבור כל שיבוט CNiFER, כלומר, באחת הבארות מהצלחת 24-היטב, aliquot 100 μl של השעיה התא (~ 4 x 10 3 תאים / טוב) לתוך כל אחת משלוש הבארות, למשל, A1, A2, A3, של צלחת 96-היטב מצופה פיברונקטין (שחור עם תחתית ברורה) (ראה שלב 3.5).
- מעבירים את הנותרים ~ 200 μl של השעיה התא לצלחת 12-היטב המכיל 1,000 μl של התקשורת צמיחה HEK293 (נפח סופי 1.2 מ"ל). דגירה הן הצלחות ב 37 מעלות צלזיוס עם 5% (v / v) CO 2, עד ומחוברות ~ 90%. צלחת 96-גם היא עבור assay fluorometric ואת צלחת 12 גם היא לגידול והרחבת השיבוטים.
- לניתוח 3 נקודות, לקבוע בשלושה ריכוזים שונים של אגוניסט כי הם 0.1-, 1.0-, ו -10 פעמים את EC 50 עבור GPCR הספציפי. הכן ריכוזי אגוניסט בצלחת סמים כמתואר בשלבים 4.1.1-4.1.2. בצע assay קורא צלחת fluorometric כמתואר בשלבים 4.1.3-4.1.5.
- חשב את FRET יחס (ΔR / R) כמתואר בשלב 4.1.6. בחר CNiFERs שיש רגישות מתאימה ותגובת סריג גדולה להרחבה, הקפאה בחזרה, ניתוחים מקיפים יותר (שלב 7).
- עבור שיבוטים כי נבחרו בשלב 6.5 ו גדלים בצלחת 12-היטב, להסיר ולהחליף 600 μl של HEK293 התקשורת צמיחה כל 5 עד 7 ימים, עד ~ 90% ומחוברות.
- בהדרגה להרחיב את השיבוטים של צלחת 12-היטב צלחת 6-היטב, ולאחר מכן בבקבוק T25 (שלבים 2.3 - 2.6 ו טבלה 2). כאשר בקבוק T25 הוא ~ 90% ומחוברות, תאי קציר כמתואר (שלבי 2.3-2.5). Resuspend התא גלולה ב 5 מ"ל של התקשורת צמיחה HEK293.
- הוסף 1 מ"ל של השעיה תא בקבוק T75 עם 9 מ"ל של התקשורת צמיחה HEK293. השתמש 4 מיליליטר הנותר של השעית התא עבור cryoprotection ואחסון בנוזל N 2 (שלבי 8.2-8.3). כן שמונה cryotubes 1.5 מ"ל ומניח על קרח.
- בבקבוק T75, לשמור על תאים על ידי החלפת מדיה wה- i התקשורת צמיחה HEK293 טרי, למשל, 10 מ"ל כל 3-5 ימים עד 70-80% ומחוברות, לאחר ~ 1-2 שבועות.
בחירת 7. סופים של CNiFER משובט שימוש Reader פלייט Fluorometric
- ביום לפני assay קורא צלחת:
- קציר תאים מבקבוקון T75 ומחוברות ~ 90% (ראה צעדים 2.3-2.6, טבלה 2). זרעים בצלחת 96-היטב מצופה פיברונקטין (שחורה עם תחתית ברורה) ב 5 x 10 4 / טוב עם ~ 100 μl של השעית תא. הערה: שיבוט אחת מופץ לתוך צלחת 96-היטב יחידה.
- הכן צלחת סמים להקרנה המקיפה של שיבוטי CNiFER, תוך הבחנת תגובות אגוניסט ספציפיות מתגובות CNiFER הלא ספציפיות.
- כדי ליצור עקומת מנה-תגובה מלאה, לבחור 10 ריכוזי אגוניסט שונים ברחבי EC ניבא 50. השתמש שתי בארות עבור 'לא התאים "ושתי בארות עבור' ACSF '.
- לקביעת התגובות הלא ספציפית, לבחור thrריכוזי EE של 12 נוירוטרנסמיטורים או מאפננים שונים (72 בארות) (איור 3). כמו אגוניסט, צלחת התרופה מכילה ריכוזים של פי 3 בשני עותקים. לדוגמה, 100 μl של שלושה ריכוזים שונים של אצטילכולין, גלוטמט, orexin, VIP, אדנוזין, סרוטונין, נוראדרנלין, GABA, חומר P, מלטונין, סומטוסטטין ו היסטמין, כל בריכוז של פי 3 של 50, 1,000, ו -3,000 ננומטר נטענים לתוך צלחת תרופת 96-היטב.
- הגדר את הפרמטרים על קורא צלחת fluorometric למדידת סריג וביצוע העברות פתרון כמתואר בשלבי 4.1.3-4.1.5.
- לניתוח עקום מנת תגובה המלאה, לחשב את יחס סריג השיא (ΔR / R) (שלב 4.1.6), עלילה כפונקציה של ריכוז אגוניסט יומן ובכושר טוב עם המשוואה היל (שלב 11.4). קבע את EC 50, מקדם היל, ויחס סריג מקסימאלי. במשך 12 הנוירוטרנסמיטרים אחרים / מאפננים, העלילה השיא ΔR / R כפונקציה oריכוז התרופה f.
- בחר ~ 10 CNiFER שיבוטים כי יש יחס סריג גדול, EC מתאים 50 עבור אגוניסט מאותו המקור, ואת מעט או ללא תגובות רקע אגוניסטים הנוירוטרנסמיטר אחרים (תגובה הלא ספציפית).
8. נבחרים הקפאת גב המשובטים CNiFER
- השתמש בבקבוק T75 ומחוברות ~ 90% של שיבוט CNiFER הפרט. קציר תאים כמתואר (שלבים 2.3-2.5, טבלה 2). להקפאת תאים, resuspend התא הגלול ב 5 מיליליטר של תקשורת צמיחת HEK293. לייבל עשר 1.5 מ"ל cryotubes ולהגדיר על הקרח.
- לקבלת cryoprotection, לערבב תאים 1: 1 עם 20% (v / v) DMSO בתקשורת צמיחה HEK293, למשל, 5 מ"ל של 20% (v / v) DMSO / תערובת מדיה מעורבת בעדינות עם 5 מ"ל של תרחיף תאים (סופי ריכוז של DMSO הוא 10%).
- Aliquot 1 מ"ל לתוך כל אחת cryotubes. להקפיא צינורות עם תאים O במקפיא -80 ° C / N, בקופסא קצף בידוד (ראה חומרים). העברת cryotubes כדי liquid חנקן עבור אחסון לטווח ארוך.
9. השרשה CNiFER לעכבר Cortex
- לעקר את כל הכלים כירורגית ב חיטוי לפני הניתוח. כן בשדה חצי סטרילי לניתוחים ידי מנגב עם 70% אתנול ו בהנחת חיתול מעבדה נקיה.
- הכן את pipet הזרקת CNiFER ידי משיכת נימי זכוכית (id של 0.53 מ"מ) על חולץ אלקטרודה אנכי. השתמש זוג לא. 5 מלקחיים בסדר-קצה לשבור את קצה האלקטרודה אל בקוטר של ~ 40 מיקרומטר.
הערה: זו מושגת בצורה הטובה ביותר תחת מיקרוסקופ זום סטריאו עם graticule. - להרדים מבוגר (ביום הלידה 60-90) C57BL / 6 העכבר עם isoflurane: 4% (v / v) לזירוז ו -1.5 ל -2.0% (v / v) לצורך תחזוקה. השתמש זנב או קמצוץ בוהן לוודא כי העכבר הוא בהרדמה מלאה.
הערה: Re-קמצוץ מעת לעת להעריך זיף מתעוות ברחבי ניתוח להעריך מחדש עומק ההרדמה. - מכסים את העיניים עם משחת עיניים כדי pייבוש יימנע. הר העכבר בתוך מסגרת stereotaxic במוטות האוזן. לשמור על טמפרטורת גוף עכבר על 37 מעלות צלזיוס באמצעות כרית חום מוסדרת על ידי בדיקה רקטלית.
- לגלח שטח של כ 5 מ"מ על 12 מ"מ עם מכונת גילוח חשמלית חיה. בקש להצטרף בבטאדין ואחריו 70% (v / v) isopropanol. השתמש בלהב סכין מנתחים כדי לחתוך ולהסיר את העור מעל פני הגולגולת. השתמש בלהב סכין המנתחים להסיר את periosteum מפני השטח של הגולגולת. לחשוף ולנקות את פני השטח של הגולגולת, כמתואר לניתוח stereotaxic 11.
- להקטין באופן pipet כוס ריק כדי גבחת ולהקליט את אחורית אנטרו (A / P) ואת מדיו-צדדי (M / L) קואורדינטות. בהתייחסו אטלס מוח עכבר, לחשב את המיקום של הזריקה. העבר את pipet אל היעד ולסמן את הגולגולת להיווצרות חלון שלאחר מכן. ראה Cetin et al. לפרטים על זריקות stereotaxic עם מכרסמים 11.
הערה: באתר ההזרקה והחלון תלוי regיון להיחקר וחלוקת תחזיות שחרור הנוירוטרנסמיטר או הפפטיד בקליפה. למשל, בפרסום האחרונות 7, stereotaxic קואורדינטות +1,0 כדי +2,0 מ"מ A / P ו +1,0 כדי +2,0 מ"מ M / L שימשו להזריק תאים CNiFER לתוך קליפת המוח הקדמית בתחום ההדמיה vivo של שחרור דופמין במהלך התניה קלאסית . - טופס חלון 2 מ"מ x 3 מ"מ דליל-גולגולת כפי שתואר לעיל 12,13.
הערה: העצם בחלון צריך להיות 15-20 מיקרומטר עבה. כתמי לבנים הקטנים בתוך העצם לא צריכים להיות גלויים כאשר פני הגולגולת היא הרטיבו, אם העצם הוא דליל מספיק 12,13. - הוסף ACSF ספוג ספוג על החלון כדי לשמור אותו לח בעת הכנת תאים להזריק.
- קציר שיבוט CNiFER כי היה גדל בבקבוק T75 ל ~ 80% confluency. לשאוב את התקשורת לשטוף את התאים עם PBS סטרילית.
הערה: טריפסין מושמט עבור השלבים הבאים. - הסר PBS ולהשתמש 10 מ"ל of ACSF כדי לסלק תאים מהחלק התחתון של הבקבוק. תאי Triturate לנתק גושים תאים. צנטריפוגה ו resuspend גלולה ב 100 μl של ACSF. צנטריפוגה במשך 30 שניות 1,400 XG ולהסיר את supernatant, עוזב גלולה מכוסה ACSF. צעד זה משאיר סבך של התאים בתרחיף.
- למילוי הזריקה pipet מוכן בשלב 9.2 עם שמן מינרלי, לטעון את pipet גבי nanoinjector, ולהתקדם הבוכנה כדי להוציא חרוז קטן של שמן. שים 5 μl של השעיה תא CNiFER על רצועת הסרט פרפין פלסטיק ליד הכנה העכבר. צייר את גם את CNiFERs או לשלוט תאים CNiFER לתוך פיפטה ומשכה.
- הזז את פיפטה X היעד ו- y, כלומר, A / P ו- M / L בצעד 9.5. מנמיך את פיפטה, פירסינג הגולגולת הדלילה, ולהמשיך ~ 200-400 מיקרומטר מתחת לפני שטח הגולגולת, להפקיד תאי CNiFER בשכבות 2/3 קליפה.
- להזריק ~ 4.6 nl של תאי CNiFER באתר העמוק עם nanoinjecטור, תנועת הערה בממשק נפט תא ואז לחכות 5 דקות עבור התאים לוותר. למשוך את פיפטה ~ 100 מיקרומטר ו להזריק ~ 4.6 nl אחר של תאים CNiFER, לחכות 5 דקות. ואז למשוך את פיפטה לאט ובעדינות כדי למנוע זרימה חוזרת של CNiFERs. חזור על הזרקה באתרים אחד או יותר סמוכים.
- הזרקת חזור על שלבים 9.8-9.12 עם שליטה HEK293 תאים (כלומר, HEK293 / TN-XXL / G qi5 שיבוט חסר GPCR). הפרד את CNiFER ולשלוט המוזרקים התא על ידי ~ 200 מיקרומטר.
- לאחר השלים השתלות תאים, יש לשטוף את החלון-גולגולת הדלילה עם ACSF ולחכות הגולגולת להתייבש. החל ירידה של דבק cyanoacrylate (ראה חומרים) על החלון ובמהירות למקם כוס כיסוי סטרילי מראש לחתוך על גבי הדבק. דחף בעדינות את הזכוכית המכסה כנגד הגולגולת במשך כמה שניות. תן יבש הדבק למשך 2 דקות 12,13.
- חותם את הקצוות של זכוכית המכסה במלט שיניים וצורה awell סביב החלון כדי להחזיק מים עבור מטרת הטבילה.
- עבור משתק את ראשו של העכבר במהלך הדמיה, לצרף חזיתי בר שהותקן עם טיפה קטנה של דבק cyanoacrylate מאחורי החלון (ראה 14 לפרטים על ממד וחומרים). תן הדבק יבש ביסודיות ולאחר מכן להוסיף מלט שיניים נוסף כדי להמשיך לחזק את הראש-בר-פי מפרט.
- מכסים את שאר פני הגולגולת, למעט החלון, עם שכבה של דבק דנטלי. ודא את הקצוות של העור מכוסים על ידי מלט ולתת לו להתייבש במשך 20 דקות.
- בעקבות הניתוח, להפסיק ממשל isoflurane ולהשאיר את העכבר על כרית חימום בכלוב עד שהוא מתאושש לחלוטין מן ההרדמה. להזריק 5% (w / v) גלוקוז מלוחים (SC) עבור להחזרת נוזלים ו 0.05 כדי 0.1 מ"ג / ק"ג עצירות (IP, בשחרור מיידי) על כאבים שלאחר הניתוח.
הערה: כדי למזער תגובה אימונולוגית פוטנציאל CNiFERs האדם, להזריק את העכבר יומי עם 20 μl / 100 גרם סקלsporine (IP) החל ממועד לפני הזריקה של CNiFERs. - החזר את העכבר בכלוב בבית שלה עבור מזון ומים.
10. in vivo הדמיה של המשובטים CNiFER
הערה: הדמית חיה מתנהלת עם עכברים באמצעות מיקרוסקופ שני פוטונים ו מנגנון קבוע-ראש. אין הרדמה נדרשת במהלך פגישות ההדמיה. כאשר ההדמיה חייה במדינה הערה, להגביל איפוק הראש רק כמה שעות בכל פעם, כדי להפחית את רמות לחץ. מחזירים את החיה אליו לכלוב בבית בין המפגשים הדמיה עבור מזון ומים. מתח פוטנציאל ממוזער על ידי המחשיך את האורות בחדר סביב חלק של העכבר בחלל סגור.
- ביום לאחר ניתוח, הר העכבר על פלטפורמת הדמיה ידי הברגת הראש-בר המתכת מושתל על הגולגולת למסגרת חזיתית הקיבעון.
הערה: כאשר הדמית עכברים ערים, פגישת ההדמיה לא תעלה על כמה שעות בשל לחץ הפוטנציאל מושרה על ידי מכשיר ראש הריסון. - מניחים את פלטפורמת הדמיה עם העכבר-מרוסנת ראש מיקרוסקופ שני הפוטונים הדמיה מצויד 10X (0.30 NA) ו 40X (0.80 NA) מטרות טבילה במים.
- כנס מסנן קוביית הדמית סריג (ECFP סיטרין) כי יש מראה dichroic ב מסנן 505 ננומטר להקה עובר כי היקף 460 ננומטר ל -500 ננומטר למדידת ECFP ו 520 ננומטר עד 560 ננומטר למדידת סיטרין.
- להוסיף ACSF לחלון דליל-הגולגולת היטב המכיל ולהפחית את המטרה טבילה במים לתוך ACSF. השתמש העינית בשיתוף עם מנורת כספית קוביית מסנן GFP לאתר את פני השטח של קליפת המוח ואת כלי הדם מתחת לחלון.
הערה: התבנית של כלי הדם מסייעת לאתר ותמונה באותו האזור על פני ימים חוזרים ונשנים של הדמיה. Switch to מטרת הטבילה במי 40X לאתר CNiFERs ידי התמקדות באופן ידני על פני שטח של קליפת המוח על פני התאים באמצעות קוביית מסנן GFP ומנורת כספית. - הגדרת הדמיה שני פוטונים. בחר את APpropriate נתיב האור עבור שני הפוטונים הדמיה. עבור מערכת מסחרית טיפוסית, להשתמש בתוכנה כדי לעבור למצב הדמית שני פוטונים ולהפנות אור הצינורות המכפילים (PMTs) ב הגלאים הלא descanned. הפעל את הליזר פעם femtosecond האדום הקרוב, בחר אורך גל של 820 ננומטר הגדרת כוח של 5-15%. הערה: 5% כוח בדרך כלל מספק ~ 25 mW על הדגימה.
- הגדר את מתח PMT1 & PMT2 קרוב לערך המרבי, בדרך כלל 700-1,000 V תלוי PMT. קבע את הרווח עד 1 לכל ערוץ ואפס עמדת z עבור המטרה.
- מנמיכים את המטרה ~ 100 עד 200 מיקרומטר מפני השטח של קליפת המוח ואת להתחיל בסריקה XY. התאם את כוח לייזר, רווח, ואת מתח PMT לכל ערוץ, כלומר, ECFP סיטרין, כדי לייעל את יחס אות לרעש של הקרינה CNiFER.
- השתמש בתכונת הזום בתוכנה להגביל את התמונה באזור שמכיל את התאים CNiFER וכן backgrounאזור ד. השתמש קצב סריקה לא איטי יותר מאשר מסגרת אחת כל 2 שניות (0.5 הרץ) בשעה 4 מיקרו-שניות לפיקסל. התאם את הקו ממוצע עבור יחס אות לרעש מתאים, למשל, ממוצע קלמן 2 קו.
- צייר באזור של עניין (ROI) סביב תאי CNiFER, המקיף כ -3 עד 4 תאים לכל מטוס. הגדרת ניתוח בזמן אמת של עוצמות ממוצע ROI. התחל רכישת לפקח קרינת CNiFER לאורך זמן.
- אסוף קרינה מן CNiFERs לפני ובמהלך מניפולציות ניסיון, למשל, גירוי חשמלי, גירוי ChR2, התנהגות, כפי שנקבע על ידי המשתמש.
- כאשר ניסוי ההדמיה יושלם, להחזיר את העכבר בכלוב בבית שלה. חזור על הדמיה פני ימים, לפי הצורך. כאשר מחדש הדמיה התאים מתייחסים התמונה בכלי הדם נמוכה הגדלה רכשה בעבר כדי לכוון בחזרה לאותו תחום ההדמיה (שלב 10.4).
הערה: CNiFERs המושתל ניתן הדמיה למשך 7 ימים לפחות.
ניתוח 11. נתונים
- קובץ הדמיה להרחיב ובחר ROI של עבור CNiFERs ו- ROI אחד עבור רקע. בחירה 'ניתוח סדרת' עבור שני הערוצים של כל ROI. יצוא עוצם קרינה ממוצעת לכל ROI כקובץ מופרד באמצעות טאבים.
- השתמש בתוכנה מתמטית (ראה חומרים) תכנית לנתח ערכי קרינה. נמוך לעבור סינון (0.3 הרץ) כל אות ואחר כך להפחית את הקרינה רקע בכל ROI של עוצמות הקרינה ECFP סיטרין.
- חישוב הקרינה הממוצעת עבור המחקר ולאחר לחשב יחסים כמתואר משוואה 1 למדוד את ΔR יחס סריג (t) / R.
- כדי לקבוע את הרגישות של CNiFERs, עלילת יחס הסריג כפונקציה של ריכוז אגוניסט יומן. התאם עם משוואת היל כדי לקבוע את מקדם 50 והגבעה EC (n), באמצעות תוכנה סטטיסטית מדעית משוואת היל (משוואה 2).

תוצאות
CNiFER נגזר תא כליה עוברית אנושי (HEK293) כי הוא שהונדס ביציבות לפחות שני חלבונים: קולטן מסוים G- חלבון בשילוב (GPCR) ו מקודדים גנטיים [Ca 2 +] חיישן, TN-XXL. TN-XXL עובר תהודת העברת אנרגית פלואורסצנטי (סריג) בין חלבונים ציאן וצהוב ניאון, ECFP סיטרין, בהתאמה, בתגובת יוני Ca 2 + 6,15. הפעלת GPCRs כי בני הזוג חלבונים G q G אנדוגני לעורר עלייה cytosolic [Ca 2 +] דרך מסלול 3 PLC / IP, מה שמוביל לעלייה סריג ממגלה TNXXL Ca 2 + (איור 1).
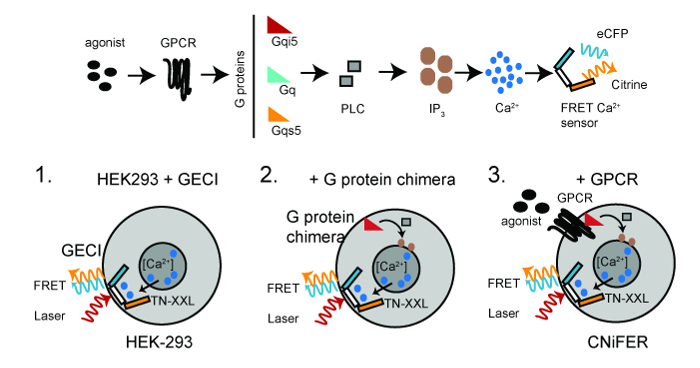
איור 1:. Scheme עבור CNiFERs פיתוח למעלה, GPCR-Ca 2 + מסלול איתות דרוש להפקהתא CNiFER. תחתון, הצעדים הבסיסיים לבניית CNiFERs באמצעות תאי HEK293. שלב 1. transduce עם מבוססי סריג מקודדים גנטית Ca 2+ -detector (TN-XXL). שלב 2. transduce Gα G- חלבון הכימרה, כלומר, qs5 G, G qi5, במידת הצורך. שלב 3. GPCR ייחודי transduce ליצור CNiFER. שני פוטוני אור העירור (אדום) שמרגש ECFP, אשר עובר סריג, מייצר גם פליטת ECFP (ציאן) ופליטת סיטרין (צהובה). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
גידול הסריג מספק לקריאה מתוך אופטית מהירה של שינוי הרמות הנוירוטרנסמיטר. כדי לפתח CNiFER עבור סוג מסוים של הנוירוטרנסמיטר, יש לקבוע תחילה את סוג חלבון G שזוגות אל GPCR. עבור G q -coupled GPCRs, את GPCR משתמשת חלבונים q G הביע באופן אנדוגני בHEK293 תאים. עבור G i / o -coupled GPCRs, קו HEK293 משובט נוצרת לראשונה מבטא חלבון G chimeric, אשר מפנה את GPCR להתפתח בהתאם למסלול G q -PLC / IP 3. מטרה זו מושגת באמצעות חלבון G כימרי, qi5 G, המכיל רצף q Gα בעיקר וחמישה חומצות אמינו של התחנה הסופית carboxyl של G i. חומצות אמינו אלה חמשת מספיקים qi5 G לתקשר עם G i / o -coupled GPCRs, אך מעידים על דרך מסלול q G. לקבלת GPCRs -coupled של G, כימרה qs5 G משמשת 10. האסטרטגיה הכללית לייצור CNiFER היא: 1) ליצור תא HEK293 המשובטים כי הוא מביע ביציבות גלאי אופטי Ca 2 +, כלומר, TN-XXL, באמצעות התמרה lentivirus של תאים HEK, 2) ביציבות להביע כימרה חלבון G , במידת הצורך, על שיבוט תאים HEK293 להביע TN-XXL, ו -3) ליצור שיבוט GPCR להביע ביציבות התא HEK293לשבט להביע TN-XXL ואת חלבון G chimeric. שורת HEK293 המשובטת כי חסרה את GPCR אבל יש TN-XXL וחלבון G כימרי משמשת שליטת CNiFER '. השליטה CNiFER נדרשת כדי לאשר את התגובה CNiFER נובע במיוחד כדי הפעלה של קולטנים מהונדסים, כלומר, D2R, ולא הפעלת קולטנים אחרים הביעו באופן אנדוגני בתאים HEK293.
כדי ליצור lentivirus, מערכת ביטוי lentivector משמשת, למשל, pCDH-CMV-MCS-EF1-Puro, אשר מכיל את הרכיבים הגנטיים אחראים אריזה, תמרה, שילוב יציב של ביטוי ויראלי לבנות לתוך הדנ"א הגנומי, וביטוי של היעד רצף גן. כדי לייצר כייל גבוה של חלקיקים נגיפיים, הביטוי וקטורים אריזה הם שיתוף transfected זמני לתאי יונקים המפיק וירוס נאסף. ישנן מספר מתקני גרעין ויראלי בארה"ב כי ניתן להפיק ti גבוהה lentivirus ter. בעקבות זיהום של תאי HEK293, גן Puro מספק עמידות לאנטיביוטיקה לזיהוי תאי HEK293 transduced.
על מנת לזהות קווי משובטים ספציפיים, transduced HEK293 תאים מסודרים באמצעות תא מופעל קרינת מיון (FACS) מערכת. המטרה היא לבודד שיבוט המכיל רמה גבוהה של ביטוי גלאי סריג מבוסס Ca 2+ ואת היכולת של עוברי סריג. בדוגמא זו של ניתוח FACS, הקרינה של פליטת ECFP זממה נגד אות הסריג (עירור ECFP ופליטת סיטרין). התיבות לסמן אזורים (P2 ו P3) שייבחר לאחר מכן ( "מגודר") למיון לתוך צלחות 96-היטב (איור 2). באופן כללי, על ארבע צלחות 96-היטב מספיקים למסך יצירה מוצלחת של CNiFERs. מתוך 4 צלחות אלה, כ 100 שיבוטים מתאימים לניתוח קורא צלחת fluorometric.
e_content "FO: keep-together.within-page =" 1 ">
איור 2: דוגמה של ניתוח FACS מדגם של הפלט הבא ניתוח FACS.. פליטת ECFP מגרשים גרף ( "475/20-א ') כפונקציה של פליטת סיטרין (" סריג V-530/30 א'), באמצעות עירור ECFP עבור כל תא. האזורים P2 ואזורים להראות P3 שנבחרו, כלומר, מגודרים, למיון לתוך תאים בודדים. צבעים הם שרירותיים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לאחר התאים הממוינים גדלו צפיפות מספיק, תגובת הסריג לאחר הפעלת אגוניסט נקבעת באמצעות מערכת קורא צלחת fluorometric 96-היטב עם טיפול פתרון. כדי לצמצם את מספר השיבוטים ללמוד, עקום אגוניסט "3 נקודות" אדם ומשמש כדי ~100 שיבוטים ובחר CNiFERs עם התגובות הטובות ביותר. כ 10 שיבוטים הם ניתחו עוד בנחישות של מנה-תגובה מלאה עם אגוניסט מאותו מקור, ואת התגובות הלא ספציפית, ומישש עם 12 נוירוטרנסמיטורים או מאפננים אחרים. צלחת תרופת 96, גם הוא מוכן כמו ריכוז של פי שלושה (ריכוז סופי הוא מדולל 1: 3 בצלחת) של תרופות (למשל, אגוניסטים, יריבים, וכו ') ב ACSF. בדוגמא זו, צלחת תרופה מוגדרת עבור בדיקת D2 CNiFER עם אגוניסט מאותו המקור שלה, דופמין, ותגובות שאינן ספציפיות פוטנציאל עם מגוון רחב של אגוניסטים הנוירוטרנסמיטר פפטיד אחרים (איור 3). עמוד השדרה CNiFER, אשר חסרה את GPCR, משמש פקד חשוב עבור CNiFER החדש שנוצר.
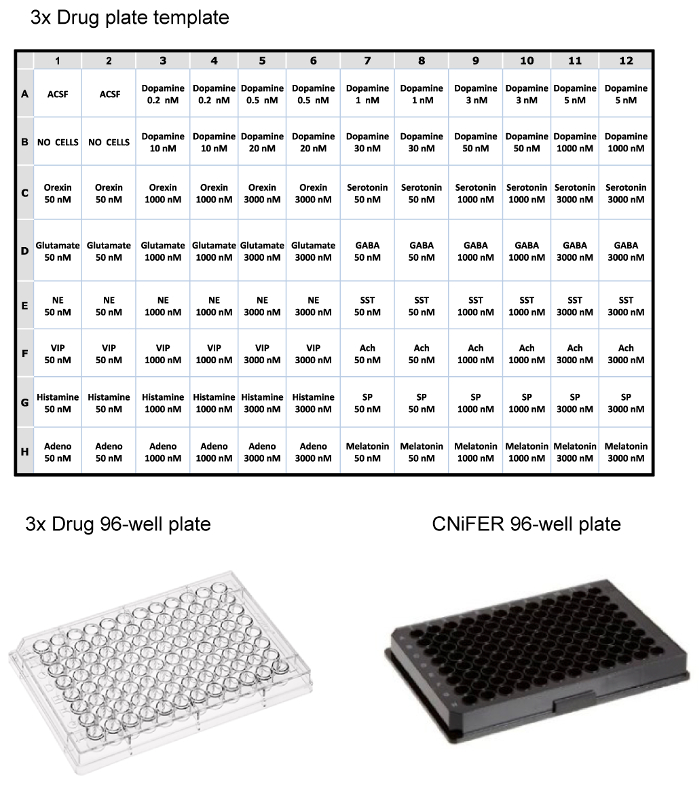
איור 3:. דוגמאות פריסה עבור 96-פלטות היטב למעלה, שולחן של layout לטעינת צלחת תרופת 3x עבור קורא צלחת fluorometric, באמצעות ריכוזים פי שלושה של נוירוטרנסמיטורים פפטידים שונים. תחתון, דוגמאות של צלחת תרופה 96-היטב בפלסטיק שקוף צלחת 96-היטב שחורה עבור זריעת CNiFERs ומדידה בקורא צלחת. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
גירוי של GPCR צפוי להגביר את תגובת הסריג, כתוצאה בגובה של תאיים [Ca 2 +] וזיהוי על ידי TN-XXL. בתנאים אלה, סריג מופק על ידי ECFP סיטרין מתקרבים, כך עירור של ECFP מייצר פליטת ECFP קטנה ופליטת סיטרין גדולה. בדוגמה זו, עירור מוגדר 436 מסננים ננומטר פליטה מוגדרים 485 ± 7.5 ננומטר עבור ECFP ו 527 ± 7.5 ננומטר עבור סיטרין (איור 4). שלושים שניות של baהקרינה סלין נמדדת ולאחר מכן 50 μl מן אגוניסט "פי שלושה" בצלחת ACSF מועבר לכל ACSF 100 μl היטב המכיל (1: 3 דילול). ECFP קרינת פליטת סיטרין נמדדים כל 3.8 שניות ל -180 שניות. מדידות רקע לקוחי בארות ללא תאים מופחתים, אם יהיה צורך בכך. עוצמות קרינה הם מנורמלים ערכי בסיס מראש גירוי (F (t) / F (בסיס)), ותגובות שיא נמדדים על מנת לחשב את יחס הסריג (ΔR / R) באמצעות F (t) / F (בסיס) של 527 ננומטר 485 ערוצי ננומטר (משוואה 1). עקומת מנת תגובה בנויה אז על ידי התוויית יחס הסריג כפונקציה של ריכוזי אגוניסט שונים ולהשתלב עם המשוואה היל כדי לקבוע את EC 50 מקדם היל (איור 5) (משוואה 2). אופטימלי CNiFER מפגין יחס סריג גדול ו EC מתאים 50 עבור אגוניסט מאותו המקור, ותערוכות מעט או ללא תגובות רקע neurotransmit האחר אגוניסטים ter. לעומת זאת, השליטה CNiFER צריך להראות קצת בתגובה אגוניסט מאותו מקור.
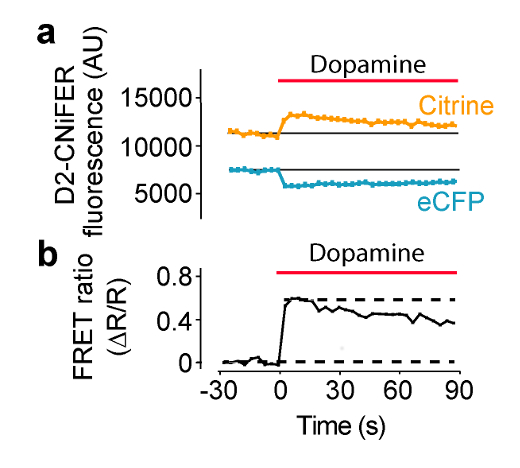
איור 4: דוגמא של תגובת הסריג מושרה אגוניסט בתגובת D2R CNiFER הסריג נמדדה על קורא צלחת עם מערכת מסירת פתרון.. (א) עלילה בתגובת הסריג, כלומר, עירור ECFP עם פליטת ECFP סיטרין, במהלך היישום של דופמין (פס אדום) כדי D2 CNiFERs. שים לב ירידות פליטת ECFP תוך עליות פליטת סיטרין עם אגוניסט (דופמין). (ב) העלילה של יחס סריג (משוואה 1) לתגובה (א) איור שונה מן מולר et al., 2014 7. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
er.within-page = "1"> 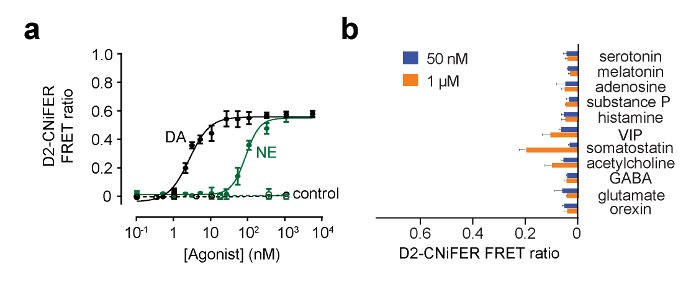
איור 5:. דוגמאות עקומות מינון תגובה עבור D2 CNiFER (א) מנת עקומות תגובה לתגובה של D2 CNiFERs דופאמין (DA, שחור) עבור נוראפינפרין (NE, ירוק). בנוסף, התגובה של CNiFERs "שליטה" חסר D2R מוצגת. (ב) גרף העמודות מציג את תגובת יחס הסריג עבור נוירוטרנסמיטורים מאפננים אחרים ב 50 ננומטר ו -1 מיקרומטר. ערכים הם ממוצעים ± SEM. איור שונה מן מולר et al., 2014 7. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
שיבוטי CNiFER ניתן להעריך נוסף הקהיה תלוית קולטן האפשר לפתרון הזמני שלהם, להפלות את המצגתשל שתי פעימות אגוניסט שונים (לפירוט ראה מולר et al., 2014 7). לאחר נבנה שיבוט CNiFER, הצעד הבא הוא לבדוק את תפקודו in vivo. כדי לפקח על קרינת in vivo, יש צורך להשתמש מיקרוסקופ שני פוטונים. לאחר הכנת חלון גולגולת דלילה, CNiFERs נטען לתוך פיפטה מזכוכית והזריק לתוך שכבות 2/3 קליפה. העכבר הוא מוכן אז הדמית in vivo על ידי הצמדת תלוש כיסוי זכוכית אל הגולגולת הדלילה, ולהשתיל בר ראש לתיקון בראשו במהלך ההדמיה (איור 6).
כדי לקבוע כי CNiFERs המושתל הוא קיימא in vivo, ריכוזים ידועים של אגוניסט ניתן להזריק בסמוך למקום ההשתלה ויחס הסריג נקבע 7. כדי להמשיך לאמת את הפעילות של CNiFERs המושתל, המרצת הנוירונים הקלט צריך להיבחן. לדוגמה, עם D2 CNiFER, השפעתגירוי חשמלי של נוירונים דופאמין במוח התיכון מקרין אל קליפת המוח נבדק. דו קוטבית טונגסטן 0.1 MΩ מגרה אלקטרודה עם הפרדה קצה 500 מיקרומטר היה מושתלים לתוך nigra substantia (-3.2 מ"מ A / P, -1.3 מ"מ M / L, -4.4 מ"מ D / V). איור 6 מציג דוגמה של חשמלית מגרה את nigra substantia בעוצמות שונות והתבוננות עלייה יחס סריג עבור D2 CNiFERs 7. שים לב תוך הצפק מערכתית (IP) הזרקה של אנטגוניסט לרצפטור D2, eticlopride (1 מ"ג / ק"ג), חוסם את התגובה D2 CNiFER. מצד שני, הזרקת קוקאין (15 מ"ג / ק"ג), אשר reuptake בלוקים של דופמין, משפר את התגובה D2 CNiFER עורר חשמלית 7.

איור 6: דוגמה של D2 CNiFER תגובה ואני אונג> n Vivo בעקבות גירוי חשמלי של חומר שחור. (א) קריקטורה מציגה עכבר קבוע ראש המוכן in vivo שני פוטוני הדמיה וגירוי חשמלי. שני הפוטונים אור (אדום, 820 ננומטר) עבור עירור 475 פליטה ננומטר עבור ECFP (כחול) ו 530 פליטה ננומטר עבור סיטרין (ירוק). (ב) העלילה שורה מציגה את יחס סריג עבור D2 CNiFER מוזרק לתוך קליפת בעקבות גירוי חשמלי של nigra substantia, כלומר, 200 μsec פולסים של 50 עד 300 מיקרו-אמפר מ בתדר 50 הרץ עבור 500 msec, ובעקבות גירוי חשמלי בנוכחות של D2R אנטגוניסט (eticlopride) או קוקאין. איור שונה מן מולר et al., 2014 7. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ftp_upload / 53,290 / 53290table1.jpg "/>
טבלה 1: רשימת כימיקלים ריאגנטים להכנת מדיום הגידול HEK293 ו ACSF.

טבלה 2: כרכים עבור תאי קציר מצלחות תרבות גודל שונות או צלוחיות.
Discussion
יצירת CNiFERs מספקת אסטרטגיה חדשנית וייחודית למדידה אופטית שחרור של נוירוטרנסמיטורים במוח in vivo. CNiFERs מותאם באופן אידיאלי למדידת שחרור extrasynaptic, כלומר, הולכת נפח, מסרים עצביים. חשוב לציין, כל CNiFER בעל המאפיינים של GPCR הילידים, מתן מדידה אופטית פיזיולוגית של השינויים ברמות של נוירוטרנסמיטורים במוח. נכון להיום, CNiFERs נוצרו לאיתור אצטילכולין (M1-CNiFER) 6, דופמין (D2-CNiFER) 7 ונוראפינפרין (α1a-CNiFER) 7.
בעיקרון, CNiFER ניתן ליצור עבור כל נוירוטרנסמיטר סיגנלים דרך GPCR. עבור המקרה שבו אותות GPCR באמצעות חלבוני G q G, אסור לשנות נוספים נדרשים לתא HEK293. GPCRs כי האות דרך G i / o, לעומת זאת, דורשים Coexpression של qi5 G חלבון כימרי Gכדי לשלב את GPCR אל 7,10 מסלול G q / PLC. באופן דומה, GPCRs כי האות דרך G s ידרוש Coexpression של חלבון כימרי G qs5 G 10. לאחר השלים, כל שיבוט CNiFER מוקרן ורק אלה שיבוטי CNiFER כי יש זיקה דומה לקולטן הילידים, להפגין מעט או ללא הקהיה ולספק יחס אות לרעש כי היא נאותה למדידה עם in vivo שני פוטונים מיקרוסקופיה, נבחרו מחקרי in vivo.
עבור מחקרי in vivo, מומלץ מאוד לטפל בעכברים עם ציקלוספורין למזער כל תגובה אימונולוגית פוטנציאלית. קיימת אפשרות של דחייה או תגובה אימונולוגית עם השתלת תאי CNiFER אדם לתוך המוח המכרסם. זה נחקר בעבר על ידי בחינת הביטוי של GFAP ו MAC1 7, לאחר ההשתלה CNiFER. CNiFERs לא נראה לייצר צלקות גליה או ליצור כל משמעותיficant MAC1 מכתים 7.
שני נושאים עיקריים לשקול בבניית CNiFERs הם רגישות הקהיה. אם EC 50 הוא גבוה מדי, כלומר, זיקה נמוכה, ביחס לקולטן הילידים, אז CNiFER לא יכול להיות מספיק רגיש כדי לזהות שחרור הנוירוטרנסמיטר in vivo. פתרון אחד הוא rescreen שיבוטים ולבחור שיבוט CNiFER שונה כי יש זיקה חזקה יותר. אסטרטגיה חלופית יהיה לבדוק סוגים אחרים של מקודד גנטית פלורסנט Ca 2 + מתכת ב שיש בהם כדי רגישות Ca 2 + גבוה, אשר יכול להעביר את EC 50 עבור הפעלת GPCR. מאחר שעיצוב CNiFER הוא מודולרית, הוא מותאם בקלות לסוגים אחרים של מקודדים גנטיים Ca 2 + מתכת ב, כגון GCaMP 16. בידוד שיבוטי CNiFER עם אותו קולטן אבל הים שונה 50 EC יכול להיות יתרון עבור הרחבת הטווח הדינמי של שחרור גילוי של neu אנדוגניrotransmitters in vivo.
הקהיה של CNiFER גם תגביל את השימוש שלה in vivo. אם תגובת השיא הולכת ופוחתת עם כל בזק אגוניסט, אז הקולטן ניתן ביטול רגישות. במקרה זה, לבחון שיבוטים אחרים ולקבוע אם הם מגיבים באותה צורה. עשיית שינויי רצף חומצות אמינו קולטן, או השימוש תת סוג אחר של קולטן עשויות להיות נחוצות כדי להתמודד עם הפחתת רגישות אגוניסט תלוי. אם יש ידועים אתרים של חומצות אמינו זרחון או זיהו כי לקשר עם קינאזות הקולטן חלבון G (GRKs), יהיה זה רצוי לבנות גרסה הלא ביטול הרגישות של GPCR ידי מוטציה אתר אחד או יותר. המנגנון של הפחתת רגישות צריך להיקבע לכל קולטן על בסיס כל מקרה לגופו.
עד כה, CNiFERs כבר מושתל רק לתוך בשכבות השטחיות של קליפת 6,7, בשל ספקטרוסקופיות מגבלות עם fluorophores הדמיה עם מיל שני הפוטוניםcroscopy 17,18. בעתיד, ייתכן שיהיה ניתן להתאים את הטכנולוגיה CNiFER עם מדידות מבוססות סיבים של הקרינה 19 כך CNiFERs אפשר להשתיל באזורי מוח קורטיקליים.
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
אנו מודים ב קונקלין (אוניברסיטת קליפורניה, סן פרנסיסקו) למתן qi5 G ו- G qs5 cDNAs, א שווייצר לסיוע עם אלקטרוניקה, נ טיילור לסיוע עם הקרנת שיבוטים, איאן Glaaser ורוברט ריפקין לקריאה הוכחה , ואוליבייה Griesbeck עבור TN-XXL. עבודה זו נתמכה על ידי מענקי מחקר באמצעות המוסד האמריקני הלאומי לשימוש בסמים (NIDA) (DA029706; DA037170), המכון הלאומי של הדמיה ביו Bioengineering (NIBIB) (EB003832), Hoffmann-La Roche (88610A) ו "Neuroscience הקשור לתרופות של מענק הכשרה לרעה "דרך NIDA (DA007315).
Materials
| Name | Company | Catalog Number | Comments |
| pCDH-CMV-MCS-EF1-Puro | System Biosciences | CD510B-1 | Cloning: for generating lentivirus |
| 12 x 75 *BD Falcon High Clarity Polypropylene Round Bottom Test Tube | BD Biosciences | 352063 | FACS |
| BD 40 um Falcon cell strainers | BD Biosciences | 352340 | FACS |
| 0.05% Trypsin EDTA | Invitrogen | 25200056 | FACS |
| 96 Well Plate, flat bottom, clear | Corning | 3596 | FACS |
| 96 well cell culture plates | Corning | CLS3997 | Flexstation |
| Optilux black clear bottom | Corning | 3603 | Flexstation |
| Flexstation pipet tips | Molecular Devices | 9000-0911 | Flexstation |
| Acetylcholine Chloride | Sigma-Aldrich | A2661 | Flexstation |
| Norepinephrine | Sigma-Aldrich | A7256 | Flexstation |
| Dopamine Hydrochloride | Sigma-Aldrich | PHR1090 | Flexstation |
| GABA | Sigma-Aldrich | A2129 | Flexstation |
| Histamine | Sigma-Aldrich | H7125 | Flexstation |
| Glutamate | Sigma-Aldrich | 49621 | Flexstation |
| Epinephrine | Sigma-Aldrich | E4642 | Flexstation |
| Somatostatin | Sigma-Aldrich | S1763 | Flexstation |
| 5HT | Sigma-Aldrich | H9523 | Flexstation |
| VIP | Alpha Diagnostics Inc. | SP-69627 | Flexstation |
| Orexin A | Alpha Diagnostics Inc. | 12-p-01 | Flexstation |
| Substance P | Sigma-Aldrich | S6883 | Flexstation |
| Adenosine | Sigma-Aldrich | A4036 | Flexstation |
| Melatonin | Sigma-Aldrich | M5250C | Flexstation |
| Fluorescence Plate Reader & software | Molecular Devices | Flexstation 3 | Flexstation |
| DMEM (high glucose) with Glutamax | Life Technologies | 10569-010 | Tissue culture |
| Fetal bovine serum | Life Technologies | 10082-139 | Tissue culture |
| Pen/Strep antibiotics | Life Technologies | 15140-122 | Tissue culture |
| Puromycin | InvivoGen | ant-pr-1 | Tissue culture |
| Fibronectin | Sigma-Aldrich | F0895 | Tissue culture |
| CoolCell LX Alcohol-free controlled-rate cell freezing box | Bioexpress | D-3508) | Tissue culture |
| cyanoacrylate glue | Loctite | Loctite no. 495 | surgery and stereotaxic injection |
| plastic paraffin film | VWR | Parafilm® | surgery and stereotaxic injection |
| Nanoinjector | Drummond | 3-000-204 | surgery and stereotaxic injection |
| Glass electrodes | Drummond | 3-000-203G | surgery and stereotaxic injection |
| hand held drill | OSADA | Exl-M40 | surgery and stereotaxic injection |
| Burrs for drill | Fine Scientific | 19007-05; 19007-07) | surgery and stereotaxic injection |
| Sterilizing bath | FST | 18000-45, Hot Bead Sterilizer | surgery and stereotaxic injection |
| isoflurane chamber/mask | Highland Medical Equipment | 564-0427, HME 109 Table Top Anesthetic Machine with Isoflurane Vaporizer, O2 Flowmeter, Gang Valve; 564-0852, Induction Chamber 16X7X7.5cm | surgery and stereotaxic injection |
| 3D scope with arm | Zeiss | surgery and stereotaxic injection | |
| fiber optic light | surgery and stereotaxic injection | ||
| Betadine | surgery and stereotaxic injection | ||
| 70 % (v/v) isopropyl alcohol | surgery and stereotaxic injection | ||
| Povidone-Iodine Prep Pads | dynarex | 1108 | surgery and stereotaxic injection |
| NaCl 0.9% (injection, USP, 918610) | surgery and stereotaxic injection | ||
| CYCLOSPORINE (INJECTION, USP) | surgery and stereotaxic injection | ||
| Buprenex (injection) buprenorphine (0.03 μg per g rodent) | Sigma-Aldrich | surgery and stereotaxic injection | |
| Ophthalmic ointment | Akorn | NDC 17478-235-35 | surgery and stereotaxic injection |
| Surgifoam | Ethicon | surgery and stereotaxic injection | |
| Grip dental cement | Dentsply | #675571, 675572 | surgery and stereotaxic injection |
| Instant SuperGlue | NDindustries | surgery and stereotaxic injection | |
| LOCTITE 4041 | surgery and stereotaxic injection | ||
| METABOND | C&B | surgery and stereotaxic injection | |
| no. 0 cover glass | Fisher | surgery and stereotaxic injection | |
| stereotaxic frame | Kopf | surgery and stereotaxic injection | |
| Rectal probe and heating pad | FHC | 40-90-8D, DC Temperature Controller,40-90-2-06, 6.5X9.5cm Heating Pad40-90-5D-02, Rectal Thermistor Probe | surgery and stereotaxic injection |
| optical breadboard for imaging | Thorlabs | surgery and stereotaxic injection | |
| Mineral oil | Fisher | S55667 | surgery and stereotaxic injection |
| Kwik-Cast (Silicone elastomer) | World Precision Instruments | surgery and stereotaxic injection | |
| Suture | Ethicon | 18’’, 1667, 4-0 | surgery and stereotaxic injection |
| Scissors | Fine Scientific Tools | 91500-09, 15018-10 | surgery and stereotaxic injection |
| Forcepts | Fine Scientific Tools | 11252-30; #55, 11295-51; Grafe, 11050-10 | surgery and stereotaxic injection |
| Student Halsted-Mosquito Hemostats | Fine Scientific Tools | 91308-12 | surgery and stereotaxic injection |
| Small Vessel Cauterizer Kit | Fine Scientific Tools | 18000-00 | surgery and stereotaxic injection |
| Hot Bead Sterilizers | Fine Scientific Tools | 18000-45 | surgery and stereotaxic injection |
| Instrument Case with Silicone Mat | Fine Scientific Tools | 20311-21 | surgery and stereotaxic injection |
| Plastic Sterilization Containers with Silicone Mat | Fine Scientific Tools | 20810-01 | surgery and stereotaxic injection |
| 2P fixed-stage fluorescence scope for in vivo imaging | Olympus | FV1200 MPE | in vivo imaging |
| Multiphoton laser | SpectraPhysics | Mai Tai DeepSee | in vivo imaging |
| Green Laser | Olympus | 473 nm Laser | in vivo imaging |
| xy translational base | Scientifica | MMBP | in vivo imaging |
| FRET filter cube for YFP and CFP | Olympus | in vivo imaging | |
| 10x and 40x water immersion objectives | Olympus | in vivo imaging | |
| air table | Newport | in vivo imaging | |
| custom built light-tight cage | Thorlab | in vivo imaging |
References
- Day, J. C., Kornecook, T. J., Quirion, R. Application of in vivo. microdialysis to the study of cholinergic systems. Methods. 23, 21-39 (2001).
- Robinson, D. L., Venton, B. J., Heien, M. L., Wightman, R. M. Detecting subsecond dopamine release with fast-scan cyclic voltammetry in vivo. Clin Chem. 49, 1763-1773 (2003).
- Liang, R., Broussard, G. J., Tian, L. Imaging Chemical Neurotransmission with Genetically Encoded Fluorescent Sensors. ACS Chem Neurosci. , (2015).
- Okubo, Y., et al. Imaging extrasynaptic glutamate dynamics in the brain. Proc. Natl. Acad. Sci. USA. 107, 6526-6531 (2010).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods. 10, 162-170 (2013).
- Nguyen, Q. T., et al. An in vivo biosensor for neurotransmitter release and in situ receptor activity. Nat Neurosci. 13, 127-132 (2010).
- Muller, A., Joseph, V., Slesinger, P. A., Kleinfeld, D. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods. 11, 1245-1252 (2014).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. , e3998 (2012).
- Wang, X., McManus, M. Lentivirus production. J Vis Exp. , (2009).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Gjα. Nature. 363, 274-276 (1993).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1, 3166-3173 (2006).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. , (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7, 981-984 (2010).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32, 1277-1309 (2012).
- Yamauchi, J. G., et al. Characterizing ligand-gated ion channel receptors with genetically encoded Ca2+ sensors. PLoS One. 6, e16519 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. 32, 13819-13840 (2012).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2, 932-940 (2005).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Cui, G., et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 494, 238-242 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved