Method Article
Construção de-base celular Neurotransmissores fluorescentes Engineered Repórteres (CNiFERs) para detecção óptica de neurotransmissores
Neste Artigo
Resumo
Nós apresentamos um protocolo para criar baseada em células neurotransmissor fluorescentes repórteres modificadas (CNiFERs) para a detecção óptica de liberação do neurotransmissor volumétrica.
Resumo
Com base nas células repórteres fluorescentes neurotransmissor modificadas (CNiFERs) fornecer uma nova ferramenta para neurocientistas para detectar opticamente a libertação de neurotransmissores no cérebro in vivo. A CNiFER específica é criada a partir de uma célula de rim embrionário humano que expressa estavelmente um receptor específico G acoplado a proteína, que os casais a G q / 11 proteínas G, e uma baseada em FRET Ca 2+ -detector, TN-XXL. A activação do receptor conduz a um aumento no sinal de FRET. CNiFERs tem sensibilidade nM e uma resposta temporal do segundo porque um clone CNiFER utiliza o receptor nativo para um neurotransmissor particular, por exemplo, para D2R dopamina. CNiFERs são directamente implantadas no cérebro, permitindo-lhes sentir a libertação de neurotransmissores, com uma resolução espacial de menos de cem um, tornando-as ideais para medir a transmissão de volume in vivo. CNiFERs também podem ser utilizados para pesquisar outros fármacos para o potencial reactividade cruzada em VIvo. Nós recentemente expandiu a família de CNiFERs para incluir GPCRs que o casal a G i / o G proteínas. CNiFERs estão disponíveis para a detecção de acetilcolina (ACh), dopamina (DA) e norepinefrina (NE). Dado que qualquer GPCR pode ser utilizado para criar um novo CNiFER e que há aproximadamente 800 GPCRs no genoma humano, descrevemos aqui o procedimento geral para conceber, realizar, e testar qualquer tipo de CNiFER.
Introdução
Para entender completamente como os neurônios se comunicam no cérebro, é necessário ter um método para medir a liberação de neurotransmissores in vivo. Existem várias técnicas bem estabelecidas para a medição in vivo neurotransmissores. Uma técnica utilizada é de microdiálise, em que uma cânula é inserida no cérebro e um pequeno volume de fluido cerebrospinal são recolhidas e analisadas por cromatografia líquida de elevado desempenho e detecção electroquímica 1. Microdiálise tem uma resolução espacial na ordem de alguns diâmetros da sonda, por exemplo, ~ 0,5 mm para uma microssonda de 200 um de diâmetro. A resolução temporal desta técnica, no entanto, é lento devido a intervalos de amostragem que duram tipicamente ~ 5 minutos ou mais 1. Além disso, as análises não são feitos em tempo real. Uma outra técnica é a pesquisa rápida voltametria cíclica (FSCV), que usa uma sonda de fibra de carbono que é introduzido no cérebro. FSCV tem excelente Tempresolução oral (subsecond), de alta sensibilidade (nanomolar), e resolução espacial com o diâmetro da sonda de 5 a 30 um. No entanto, está limitado a FSCV transmissores, que produzem uma característica de oxidação e redução perfil com tensão em uma sonda potenciométrica de carbono 2.
Uma terceira técnica para medir neurotransmissores é diretamente através de neurotransmissores geneticamente codificado (NT) biossensores 3. Com este método, uma proteína de fusão é criada que contém um domínio de ligação ao ligando para um transmissor acoplado a uma transferência de energia de ressonância de fluorescência (FRET) par com base na fluoróforos de 4 ou 5 permutado um GFP. Ao contrário dos dois métodos anteriores, estes biossensores são geneticamente codificado e expresso na superfície de uma célula hospedeira, tal como um neurónio, através da produção de animais transgénicos ou de forma aguda com a utilização de agentes virais para infectar as células. Até à data, biossensores geneticamente codificados só foram desenvolvidos para detecting glutamato e GABA 3-5. Limitações com estas técnicas têm sido a baixa sensibilidade, na gama nM, e a incapacidade para expandir a detecção de um grande número de emissores, por exemplo, neurotransmissores clássicos, neuropéptidos e neuromoduladores, que sinalizam através de receptores acoplados à proteína G (GPCRs). Na verdade, existem cerca de 800 GPCRs no genoma humano.
Para lidar com essas deficiências, desenvolvemos uma ferramenta inovadora para liberação medida opticamente de qualquer neurotransmissor que sinaliza através de um GPCR. CNiFERs (com base nas células repórteres fluorescentes modificadas neurotransmissor) são células HEK293 clonais manipuladas para expressar um GPCR específico que, quando estimulados, desencadeia um aumento na intracelular [Ca2 +] que é detectado por um sensor baseado em FRET de Ca 2+ geneticamente codificado, TN-XXL. Assim, obrigatório neurotransmissor CNiFERs transformar-se numa alteração na fluorescência, proporcionando uma óptica R em tempo real e directa do receptoread-out da actividade neurotransmissora local. Ao utilizar o receptor nativo para um determinado neurotransmissor, CNiFERs reter a especificidade química, afinidade e dinâmicas temporais dos receptores expresso endogenamente. Até à data, criámos três tipos de CNiFERs, um para detectar a acetilcolina utilizando o receptor M1, um para a detecção de dopamina utilizando o receptor D2, e um para detectar a norepinefrina usando o receptor de 6,7 α1a. A tecnologia CNiFER é facilmente expansível e escalável, tornando-se passível de qualquer tipo de GPCR. Neste artigo Jove, que descrevem e ilustram a metodologia para conceber, realizar, e teste em CNiFERs vivo para qualquer aplicação.
Protocolo
Todos os procedimentos com animais realizados neste estudo estão em conformidade com Institutional Animal Care e diretrizes Use Committee (IACUC), e tenham sido aprovados pelas IACUCs no Icahn Escola de Medicina Monte Sinai e da Universidade da Califórnia, San Diego.
1. Gerar GPCR-expressando Lentivírus para transformar células HEK293
- Obter o ADNc para um GPCR específico a partir de uma fonte comercial, por exemplo, cdna.org. Alternativamente, amplificar o gene GPCR a partir de uma biblioteca de ADNc utilizando PCR. Obter um vector expressando-lentivírus, tais como pCDH-CMV-MCS-EF1-Puro (pCDH). Use este vector para propagar o ADN, bem como para gerar lentivírus.
- Clonar o cDNA de GPCR para o vector que expressa lentivírus por PCR. Veja Lorenz 8, para obter detalhes sobre subclonagem PCR.
- Expandir e purificar o GPCR-pCDH DNA usando um 'maxi' kit de preparação livre de endotoxinas de acordo com as instruções do fabricante. Confirmar que o cDNA de GPCR subclonado pCDH é mutation-livre por sequenciação de ADN.
Nota: Antes de submeter a DNA para produção de vírus, digerir uma aliquota com a enzima de restrição apropriada para confirmar o tamanho de inserção e pureza de DNA. - Gerar lentivírus usando uma instalação do núcleo do vírus, como um no Instituto Salk, da Universidade de Penn., Ou Universidade da Carolina do Norte, etc., ou gerar in-house 9. Usar cerca de 25 ug (> 1 mg / mL) de ADN livre de endotoxina para a transfecção de células HEK em um frasco T75. Certifique-se de que o ADN seja de elevada pureza, com uma razão de absorvância (A260 / A280) de ~ 1,8.
Nota: Os títulos de vírus ~ 10 11 -10 12 GC / ml são ideais para a transdução de células HEK293.
2. Escolher HEK293 / TN-XXL Tipo Backbone celular para a cultura in vitro
Nota: determinar a especificidade de acoplamento à proteína G, por exemplo, G i / o, G q / 11, ou proteínas G G S, do GPCR, como esta dicstados se uma quimera da proteína G é necessária para a CNiFER. Para G q receptores -coupled, por exemplo, receptor muscarínico M1, escolha HEK293 / TN-XXL (# 3G8) como a espinha dorsal tipo de célula HEK293. Para G i / o -coupled receptores, o quimérico G proteína G qi5 é necessária 10. Para receptor -coupled G s, a quimera QS5 L 10 é necessária. Neste protocolo, a construção de um D2R CNiFER é utilizado como um exemplo. Sinais D2R através de G / S G proteínas e requer células HEK293 que expressam de forma estável a proteína G quimérica, qi5 G, por exemplo, qi5 HEK293 / TN-XXL / G _ # qi5.6.
- Obter os qi5 HEK293 / TN-XXL / G _ # qi5.6 células clonais de um laboratório de pesquisa. Nota: Os seguintes células clonais, HEK293 / TN-XXL (# 3G8) para os receptores q -coupled G, HEK293 / TN-XXL / G qi5 (# qi5.6) para G i / o -coupled receptores, e HEK293 / TN -XXL / G QS5 (# qs5.47) para G s re -coupledceptores, estão disponíveis gratuitamente, mediante solicitação 6,7.
- Crescer e expandir qi5 HEK293 / TN-XXL / G _ # qi5.6 para ~ 90% de confluência num frasco T25 com 5 ml de meio de crescimento de células HEK293 (Tabela 1). Crescer as células numa incubadora humidificada a 37 ° C com 5% (v / v) de CO2.
Nota: Todos os trabalhos com a cultura de células HEK293 que deve ser levada a cabo usando técnicas de cultura de tecidos estéreis padrão. - Colher as células HEK293 pela primeira aspiração de mídia a partir de frasco T25. Lavar as células com cuidado pela adição de 5 ml de PBS e de balanço balão.
- Remover o PBS e adicionar 1 ml de 0,05% (w / v) de tripsina / EDTA (Tabela 2). Incubar durante 1 a 2 minutos a 37 ° C com 5% (v / v) de CO2.
- Coletar células e transferir para estéril tubo de 15 ml. Centrifugar durante 5 minutos a 1.000 xg numa centrifugadora de cultura de células. Aspirar o sobrenadante.
- Ressuspender o sedimento de células em 5 ml de meio de crescimento de células HEK293. Contar as células num hemocitómetro utilizandoazul de tripano. Calcular a densidade celular e vá para a etapa 3.
3. Transdução Lentivirus de HEK293 / TN-XXL células / Gqi5
- Semear um frasco T25 com 0,7 x 10 6 células qi5 HEK293 / TN-XXL / g. Crescer as células numa incubadora humidificada a 37 ° C com 5% (v / v) de CO2 até ~ 50% confluentes, após cerca de 1 dia. Congelar as células restantes (passos 8,2-8,3). Estas células servirá como controlo CNiFER, isto é, um que não possui o CNiFER GPCR.
- No dia da infecção, diluir a lentivírus que expressa GPCR (passo 1.4) para uma concentração final de 10 ~ 9 GC / ml num volume total de 2 ml de meio de crescimento de células HEK293 (Tabela 1). Por exemplo, adicionar 20 ul de 10 11 GC vírus / ml a 2 ml de meio em um frasco T25.
Nota: A informação título do vírus devem ser fornecidos pela instalação do núcleo do vírus. Combine lentivírus e mídia em um tubo de centrífuga e triturar suavemente. Altos títulos de lentivIrus são de nível de biossegurança 2 (BSL-2). - Aspirar a mídia do frasco T25. Adicione as 2 ml de vírus / mistura de mídia a partir do passo 3.2. Incubar o balão T25 O / N a 37 ° C com 5% (v / v) de CO2.
- Depois de um dia da infecção, aspirar o / mistura meios de vírus e substitui-lo com HEK293 meio de crescimento contendo puromicina (2 pg / ml; Tabela 1). Puromicina selecciona para que as células transduzidas. Incubar o balão a 37 ° C com 5% (v / v) de CO2 até cerca de 90% confluentes, após o ~ 1-2 dias.
- Prepara-se uma placa de 96 poços (preto com fundo claro) revestidos com fibronectina, para gerar uma curva de agonista / activação 10-ponto no passo 4.1. Numa hote estéril, adicionar 50 ul de fibronectina (5 ug / ml) por poço nas linhas A e B da placa de 96 poços. Incubar a placa a temperatura ambiente durante 1 h. Lavar duas vezes durante 5 min por lavagem com PBS. Adicionar 50 ul de meio de crescimento e incubar HEK293 O / N a 37 ° C com 5% (v / v) de CO2.
Nota: Fibronplacas tratadas com ectin estão comercialmente disponíveis. - Colher as células no frasco T25, tal como descrito nos passos 2,3-2,6 (Tabela 2).
- Ressuspender o sedimento de células em 5 ml de meio de crescimento de células HEK293. Semente um frasco T25 com 1,5 ml de células para análise de FACS. Além disso, semear um frasco T75 com 1 ml de células para congelação e armazenamento (consulte os passos 8,2-8,3)
- Para a curva de agonista de 10-ponto, semear as primeiras duas filas (A e B) de uma placa de 96 poços revestidas com fibronectina (a partir do passo 3,5) com 100 ul da suspensão de células por poço.
- Incubar as células HEK293 que crescem em um frasco T25, um frasco T75 e uma placa de 96 poços até cerca de ~ 90% confluentes a 37 ° C com 5% (v / v) de CO 2, depois de ~ 1-2 dias.
4. FACS e isolamento de solteiro CNiFER Clones
- Utilizar a placa de 96 poços para gerar uma curva de activação agonista de 10 pontos.
Nota: antes de iniciar a triagem de células activadas por fluorescência (FACS), é importante para confirmar aexpressão do GPCR, testando células transduzidas para uma resposta agonista (10-ponto da curva agonista). Este ensaio é realizado utilizando um leitor de placas fluorométrico.- Prepara-se uma placa de fármaco para a curva de activação agonista de 10 pontos. Escolha 10 diferentes concentrações de agonista que encerrem o previsto EC 50, que podem ser determinados a partir da literatura.
Nota: A placa de droga contém de 3 vezes de cada concentração (em duplicado) para ajustar para a diluição de 1: 3 na placa CNiFER. Por exemplo, a placa de droga para testar um D2 CNiFER contém 10 diferentes concentrações de dopamina a concentrações 3 vezes; 0,2, 0,5, 1, 3, 5, 10, 20, 30, 50 e 1000 nM. Na placa CNiFER, por conseguinte, as concentrações finais de dopamina são de 0,067, 0,167, 0,333, 1,00, 1,67, 3,33, 6,67, 10,0, 16,7, e 333 nM. - Preparar as soluções usando agonistas de fluido espinal cerebral artificial (ACSF) (Tabela 1). Usar dois poços para 'ACSF', por exemplo, A1 e A2,e dois poços para 'nenhuma célula', por exemplo, B1 e B2.
Nota: Preparar diferentes concentrações de medicamentos utilizando um método de diluição em série. Criar um modelo para manter o controle de clones CNiFER e as concentrações da droga (Figura 3). - Usar o software para programar o leitor de placas de 96 poços fluorométrico para a medição de FRET e executar as transferências de solução.
- Ajustar a temperatura leitor de placas a 37 ° C.
- Para a medição de FRET com TN-XXL, definir o comprimento de onda de excitação a 436 ± 4,5 nm (centro ± HWHM). Defina os filtros de emissão para 485 ± 7,5 nm para eCFP e para 527 ± 7,5 nm para Citrino. Definir o filtro de corte a 475 e 515 nm para eCFP e citrino, respectivamente.
- Programar o leitor de placas para medir a emissão a 485 nm e 527 nm a cada 4 segundos para um total de 180 seg. Escolha a opção de administrar 50 uL da placa de fármaco de 3 vezes para os 100 ul na placa CNiFER, após a recolha de 30 segfluorescência basal.
- Aspirar a mídia de linhas A e B e adicione 100 ml de ACSF à placa de 96 poços CNiFER que é ~ 90% confluentes (passo 3.9).
- Carregar a placa de 96 poços e a CNiFER '3-dobra "placa de droga no leitor de placas. Permitir ~ 30 min para equilibrar as placas a 37 ° C. Em seguida, iniciar o programa.
- Para analisar os dados leitor de placas, exportar os valores de fluorescência para uma planilha. Criar uma fórmula para subtrair as medições de fundo (tomadas para cada sinal de poços sem células) de poços com CNiFERs. Normalizar intensidades de fluorescência para as linhas de base de estímulo pré, F Citrino (t) / F Citrino (baseline), e calcular a relação FRET (ΔR / R;. Eqn 1) com as respostas de pico em 527 nm e 485 emissões nm (veja o passo 11 ).
Nota: Se houver uma alteração significativa na ΔR / R com o agonista, então isso indica expressão do GPCR e pode-se proceder à análise por SCAF (passo 4.2). Se there há resposta de FRET com agonista, solucionar usando um ionóforo de Ca2 +, por exemplo, A21387, para testar a resposta de Ca 2+ e confirmar que o sensor baseado em FRET está a trabalhar. Se o ionóforo funciona, então, o receptor foi expresso não é provável.
- Prepara-se uma placa de fármaco para a curva de activação agonista de 10 pontos. Escolha 10 diferentes concentrações de agonista que encerrem o previsto EC 50, que podem ser determinados a partir da literatura.
- No dia antes de FACS, preparar a quatro placas de 96 poços revestidas com fibronectina (ver passo 3.5) para recolher as células separadas. Adicionar 50 ul de meio de crescimento e incubar HEK293 O / N a 37 ° C com 5% (v / v) de CO2.
- Prepare a 5% (w / v) de BSA em PBS (5 g / 100 ml) e filtra-se (0,2 um) para um frasco estéril.
- Colher as células cultivadas no frasco T25 (ver passos 2,3-2,5, Tabela 2). Ressuspender o sedimento de células em 4 ml de 5% (w / v) de BSA em PBS. Centrifugar as células a 1000 xg durante 5 min.
- Aspirar os meios de comunicação e ressuspender o sedimento de células em ~ 5 ml de 5% (w / v) de BSA em PBS para dar uma concentração final de 5 x 10 ~ 6 células / ml.
Nota: Verifique com a FACS instalação do núcleo de requisitos específicos sobre a densidade de células e condições de classificação. - Filtrar as células ressuspensas com um filtro celular de 40 um para eliminar os aglomerados. Transferir as células para um polipropileno de 5 ml de tubo redondo de fundo. Colocar o tubo em gelo durante o transporte para a instalação de FACS.
- Organizar os HEK293 células transduzidas em uma instalação FACS. Programa os parâmetros com um citómetro de fluxo FACS como se segue: definir 4 ° C para o suporte de amostras, de 100 um para o bocal e 20 psi. Com base na análise pré-tipo, selecione as células, isto é, escolher um 'gate', que tem uma grande fluorescência eCFP (eCFP de excitação, emissão eCFP) e grandes FRET (excitação eCFP, emissão Citrino) de fluorescência (ver resultado abaixo, Figura 2 ).
- Depósito indivíduo, as células classificadas em uma placa de 96 poços preparado na etapa 4.2, com um clone por poços contendo 50 uL de meio de crescimento HEK293 com puromicina. Adicionar 50 ul de meio de crescimento HEK293 com puromicina (Table 1) para um total de 100 ul por poço. Manter as células O / N a 37 ° C com 5% (v / v) de CO2.
Nota: o meio de crescimento HEK293 contém puromicina para selecção de células transduzidas.
5. Cultivar e expansão do Ordenado, CNiFERs clonais
- Manter as CNiFERs nas placas de 96 poços, removendo 50 ul de meios de idade de cada poço e substitui com 50 ul de meio de crescimento fresco contendo puromicina HEK293 (Tabela 1). Repetir este a cada 5 a 7 dias até ~ 90% confluentes, após 2-3 semanas.
- células colheita CNiFER aspirando delicadamente os meios de comunicação e enxaguar uma vez suavemente com PBS. Remover o PBS e adicionar 20 ul de 0,05% (w / v) de tripsina / EDTA. Incubar durante 1 a 2 minutos a 37 ° C com 5% (v / v) de CO2.
- Adicionar 100 ul de meio de crescimento para células HEK293 tratadas com tripsina e ressuspender as células. conteúdos de transferência para uma placa de 24 poços contendo 400 ul fresco HEK293 meios de crescimento da sagacidadeh puromicina. Na placa de 24 poços, a manter as células através da substituição de 250 ul de meio de crescimento HEK293 cada 5-7 dias até os poços são ~ 90% confluentes.
6. Identificar CNiFERs candidato com base em FRET Response Usando Plate Reader Fluorométrica
Nota: Com quatro placas de 96 poços seguindo FACS, não devem ser> 100 clones testáveis que sobrevivem e se expandem para a etapa de placas de 24 poços, uma vez que muitos dos clones originais não conseguem crescer. Para identificar CNiFERs candidatos potenciais, use uma análise de 3 pontos para a resposta traste com agonista cognato, por exemplo, a dopamina para D2R.
- Quando as células estão 90% confluentes ~ na placa de 24 poços, aspirar cuidadosamente os meios de comunicação. Adicionar 100 uL de ~ 0,05% (w / v) de tripsina / EDTA e incubar durante 1-2 min a 37 ° C com 5% (v / v) de CO2. Adicionar 400 ul de meio de crescimento para células HEK293 tratados com tripsina e misturar as células por trituração suave.
- Configurar a curva de agonista de 3 pontos para a triagem inicial do clones. Para cada clone CNiFER, ou seja, um dos poços da placa de 24 poços, alíquota de 100 ul da suspensão de células (~ 4 x 10 3 células / poço) em cada um de três poços, por exemplo, A1, A2, A3, de uma placa de 96 poços revestidos com fibronectina (preto com fundo transparente) (veja o passo 3.5).
- Transferir os restantes ~ 200 uL da suspensão de células para uma placa de 12 poços contendo 1000 mL de meio de crescimento de células HEK293 (1,2 ml de volume final). Incubar ambas as placas a 37 ° C com 5% (v / v) de CO2, até ~ 90% confluentes. A placa de 96 poços é para o ensaio fluorimétrico e a placa de 12 poços é para o crescimento e expansão dos clones.
- Para a análise de 3 pontos, determinar três diferentes concentrações de agonista que são 0,1-, 1.0-, e 10 vezes a EC 50 para o GPCR específico. Preparar as concentrações agonistas em uma placa de fármaco, tal como descrito nos passos 4.1.1-4.1.2. Realizar um ensaio de leitor de placas fluorométrico como descrito nos passos 4.1.3-4.1.5.
- Calcule o FRproporção ET (ΔR / R), tal como descrito no passo 4.1.6. Escolha CNiFERs que têm sensibilidade adequada e maior resposta FRET para a expansão, o congelamento de volta, e análises mais abrangentes (Passo 7).
- Para os clones que foram seleccionados na etapa 6.5 e estão crescendo na placa de 12 poços, remover e substituir os 600 ul de meio de crescimento HEK293 a cada 5 a 7 dias, até que ~ 90% confluentes.
- Gradualmente expandir os clones a partir de uma placa de 12 poços para uma placa de 6 poços, e, em seguida, para um frasco T25 (passos 2,3-2,6 e Tabela 2). Quando o frasco T25 é ~ 90% confluentes, as células de colheita, tal como descrito (passos 2,3-2,5). Ressuspender o sedimento de células em 5 ml de meio de crescimento de células HEK293.
- Adicionar 1 ml de suspensão de células para um frasco T75 com 9 ml de meio de crescimento de células HEK293. Usar os restantes 4 ml da suspensão de células para crioprotecção e armazenamento em N2 líquido (passos 8,2-8,3). Prepare oito 1,5 ml criotubos e colocar no gelo.
- No frasco T75, manter as células, substituindo a W meiosom meios de crescimento HEK293 fresco, por exemplo, 10 ml a cada 3-5 dias até 70-80% confluentes, após ~ 1-2 semanas.
7. A selecção final do CNiFER Clones Usando Plate Reader Fluorométrica
- No dia antes do ensaio leitor de placas:
- Células colheita de um frasco confluente T75 ~ 90% (ver passos 2,3-2,6, Tabela 2). Propagar uma placa revestida com fibronectina de 96 poços (preto com fundo claro) a 5 x 10 4 / cavidade com ~ 100 ul de suspensão de células. Nota: Um clone é distribuído numa única placa de 96 poços.
- Prepara-se uma placa de fármaco para o rastreio abrangente de clones CNiFER, distinguindo respostas agonistas específicos de respostas CNiFER não-específicos.
- Para gerar uma curva de dose-resposta completa, 10 escolher diferentes concentrações de agonista em torno da CE 50 previsto. Use dois poços para 'nenhuma célula' e dois poços para 'ACSF'.
- Para determinar as respostas não específicas, escolha thrAs concentrações de ee de 12 neurotransmissores diferentes ou moduladores (72 poços) (Figura 3). Como o agonista, a placa de fármaco contém concentrações de 3 vezes em duplicado. Por exemplo, a 100 ul de três diferentes concentrações de acetilcolina, o glutamato, orexina, VIP, adenosina, serotonina, norepinefrina, o GABA, a substância P, a melatonina, a somatostatina e histamina, cada um a uma concentração de 3 vezes de 50, 1000, e 3000 nM são carregados para a placa de 96 poços de drogas.
- Defina os parâmetros no leitor de placas fluorom�rica para medir FRET e realizando transferências de solução como descrito nos passos 4.1.3-4.1.5.
- Para análise da curva de resposta à dose completa, o cálculo da relação de pico de FRET (ΔR / R) (passo 4.1.6), lote como uma função da concentração do agonista de registo e se encaixam com a equação de Hill (passo 11.4). Determinar a EC 50, o coeficiente de Hill, e relação de FRET máxima. Para o 12 outros neurotransmissores / moduladores, pico trama ΔR / R como função oconcentração da droga f.
- Escolha clones de ~ 10 CNiFER que têm uma grande proporção de FRET, uma CE 50 apropriado para o agonista de cognato, e respostas pouca ou nenhuma experiência para outros agonistas de neurotransmissores (resposta não específica).
Clones CNiFER 8. Freeze-volta seleccionados
- Usar um frasco confluente T75 ~ 90% de um clone CNiFER indivíduo. Células colheita como descrito (passos 2,3-2,5, Tabela 2). Para as células congelação, ressuspender o sedimento de células em 5 ml de meio de crescimento de células HEK293. Rotular dez 1,5 ml criotubos e definir em gelo.
- Para crioprotecção, misturar células de 1: 1 com 20% (v / v) de DMSO em meio de crescimento de HEK293, por exemplo, 5 ml de 20% (v / v) de mistura de DMSO / meio é suavemente misturada com 5 ml de suspensão de células (Final concentração de DMSO é de 10%).
- Aliquota de 1 ml em cada um dos tubos criogénicos. Congelar tubos com células em uma -80 ° C congelador O / N, em uma caixa com isolamento de espuma (veja Materiais). Transferência criotubos para LIQUID de azoto para armazenamento a longo prazo.
9. CNiFER implantação no rato Cortex
- Esterilizar todos os instrumentos cirúrgicos em uma autoclave antes da cirurgia. Prepare um campo semi-estéril para a cirurgia, limpando com 70% de etanol e estabelece uma fralda laboratório limpo.
- Prepare a pipeta de injeção CNiFER puxando um capilar de vidro (id de 0,53 mm) em um extrator eletrodo vertical. Use um par de nenhum. 5 uma pinça de ponta fina para quebrar a ponta do eléctrodo para um diâmetro de ~ 40? M.
Nota: Este é melhor realizado sob um microscópio estéreo zoom com uma retícula. - Anestesiar um adulto (dia pós-natal 60-90) C57BL / 6 mouse com isoflurano: 4% (v / v) para a indução e 1,5 a 2,0% (v / v) para manutenção. Use cauda ou pitada dedo do pé para se certificar de que o rato está totalmente anestesiado.
Nota: Re-pitada e avaliar periodicamente suiça contrair-se durante toda a cirurgia para reavaliar profundidade da anestesia. - Cobrir os olhos com pomada oftálmica para psecagem revent. Monte o mouse em um quadro estereotáxico com barras de ouvido. Manter a temperatura do corpo do rato a 37 ° C utilizando uma almofada de aquecimento regulada por uma sonda rectal.
- Raspar uma área de aproximadamente 5 mm por 12 mm com um barbeador elétrico animal. Aplicar Betadine seguido por 70% (v / v) de isopropanol. Usar uma lâmina de bisturi para cortar e remover a pele sobre a superfície do crânio. Usar uma lâmina de bisturi para remover o periósteo da superfície do crânio. Expor e limpar a superfície do crânio, como descrito para a cirurgia estereotáxica 11.
- Abaixe uma pipeta de vidro vazio para bregma e registrar o antero-posterior (A / P) e médio-lateral (M / L) coordena. Referindo-se o atlas do cérebro do rato, calcular a posição do local de injecção. Deslocar a pipeta para o site de destino e marcar o crânio para a formação janela subsequente. Veja Cetin et al. Para obter detalhes sobre as injecções estereotáxicas com roedores 11.
Nota: O local da injecção e janela dependem do Região a ser estudado e a distribuição das projecções de neurotransmissores ou péptido libertando no córtex. Por exemplo, em uma recente publicação 7, coordena o estereotáxico 1,0-2,0 mm A / P e +1,0 a 2,0 milímetro M / L foram usadas para injetar células CNiFER no córtex frontal para imagiologia in vivo da libertação de dopamina durante o condicionamento clássico . - Formar um 2 milímetros janela do crânio diluído x 3 mm, como descrito anteriormente 12,13.
Nota: O osso na janela deve ser de 15-20 mm de espessura. Os pontos brancos pequenos no osso não deve ser visível quando a superfície do crânio é humedecido, se o osso for suficientemente diluído 12,13. - Coloque um ACSF embebido esponja sobre a janela para mantê-la úmida enquanto prepara as células para injetar.
- Colheita do clone CNiFER que foi cultivado num balão T75 com ~ 80% de confluência. Aspirar a mídia e lavar as células com PBS estéril.
Nota: A tripsina é omitido para estes passos. - Remover PBS e usar 10 ml de of ACSF para desalojar as células a partir do fundo do balão. Triturar células para dissociar aglomerados de células. Centrífuga e ressuspender o sedimento em 100 ul de ACSF. Centrifugar durante 30 segundos a 1400 x g e eliminar o sobrenadante, deixando um pelete coberto em ACSF. Esta etapa deixa um amontoado de células em suspensão.
- Aterrar a pipeta de injeção preparada no passo 9.2 com óleo mineral, carregar a pipeta em um nanoinjector, e fazer avançar o êmbolo para ejetar uma pequena gota de óleo. Coloque 5 ul de suspensão de células CNiFER em uma tira de filme de parafina plástico perto a preparação mouse. Elaborar tanto os CNiFERs ou controlar células CNiFER para a pipeta puxado.
- Mover a pipeta para o alvo coordenadas X e Y, ou seja, A / P e M / L anotou na etapa 9.5. Diminuir a pipeta, perfurando o crânio diluído, e continuar a 200-400 ~ ^ M abaixo da superfície do crânio, para depositar camadas de células CNiFER em 2/3 do córtex.
- Injectar ~ 4,6 nl de células CNiFER no local mais profundo com o nanoinjector, movimento nota na interface do petróleo e celular e depois esperar por 5 min para as células para dispensar. Retirar a pipeta ~ 100 mm e injetar outra ~ 4,6 nl de células CNiFER, espere 5 minutos. Em seguida, retirar a pipeta devagar e com cuidado para evitar o refluxo dos CNiFERs. Repetir injecção em um ou mais sítios adjacentes.
- Repita os passos de injecção 9,8-9,12 com controle HEK293 células (ou seja, qi5 HEK293 / TN-XXL / G clone falta GPCR). Separa-se a CNiFER e controlar locais de injecção de células de ~ 200 pM.
- Depois de concluir implantações de células, lavar a janela de caveira diluído com ACSF e esperar que o crânio para secar. Aplicar uma gota de cola de cianoacrilato (ver Materiais) ao longo da janela e rapidamente colocar uma tampa de vidro pré-cortado estéril em cima da cola. Com cuidado, empurre a tampa de vidro contra o crânio por alguns segundos. Deixe a cola secar por 2 min 12,13.
- Selar as bordas da tampa de vidro com cimento dental e forma awell em torno da janela de reter a água para que o objectivo de imersão.
- Para imobilizar a cabeça do rato durante o exame, anexar uma custom-built cabeça-bar com uma pequena gota de cola de cianoacrilato por trás da janela (veja a 14 para obter detalhes sobre a dimensão e materiais). Deixe a cola secar completamente e depois adicionar cimento dental adicional para reforçar ainda mais a custom-built cabeça-bar.
- Cobrir o resto da superfície do crânio, excepto para a janela, com uma camada de cimento dental. Verifique se as bordas da pele são cobertas por cimento e deixe secar por 20 min.
- Após a cirurgia, pare administração de isoflurano e deixar o mouse sobre uma almofada de aquecimento em uma gaiola até que se recupere totalmente da anestesia. Injectar 5% (w / v) de glucose em solução salina (SC) para a reidratação e 0,05 a 0,1 mg / kg de buprenorfina (ip, de libertação instantânea) para analgesia pós-operatória.
Nota: Para minimizar a potencial reação imunológica aos CNiFERs humanos, injetar o mouse diariamente com 20 l / 100 g de ciclosporine (ip), a partir do dia antes da injeção de CNiFERs. - Devolver o mouse para sua gaiola para comida e água.
10. In vivo de imagens de CNiFER Clones
Nota: Imagens ao vivo é realizado com camundongos, usando um microscópio de dois fotões e um aparelho de cabeça fixa. Sem anestesia é necessário durante as sessões de imagem. Quando imagiologia animais no estado desperto, limitar apoio de cabeça a apenas algumas horas de cada vez para reduzir os níveis de estresse. Devolver o animal para que gaiola entre as sessões de imagem para comida e água. potencial estresse é minimizado por escurecendo as luzes da sala e ao redor parte do mouse em um gabinete.
- No dia após a cirurgia, montar o mouse sobre uma plataforma de imagem, enroscando o metal cabeça-bar implantados no crânio ao quadro cabeça-fixação.
Nota: Quando imagiologia ratos acordados, a sessão de imagem não deve exceder algumas horas devido ao potencial de estresse induzido pelo dispositivo cabeça-contenção. - Coloque a plataforma de imagem com o mouse conteve-cabeça em um microscópio de imagem de dois fótons equipado com um 10X (0,30 NA) e 40X (0,80 NA) Objectivos de imersão em água.
- Insira cubo de filtro para FRET imagem (eCFP e citrino) que tem um espelho dicróico de 505 nm e filtros passa-banda que se estendem por 460 nm a 500 nm para medir eCFP e 520 nm a 560 nm para medir a citrina.
- Adicionar ACSF para a janela-crânio diluído bem conter e diminuir a objectiva de imersão em água na ACSF. Utilize a ocular em conjunto com a lâmpada de mercúrio e cubo de filtro GFP para localizar a superfície do córtex e da vasculatura abaixo da janela.
Nota: O padrão da vasculatura e ajuda a localizar a imagem da mesma região ao longo de dias repetidos de imagiologia. Alterne para a objectiva de imersão em água 40X para localizar CNiFERs, concentrando-se manualmente na superfície do córtex sobre as células usando o cubo de filtro GFP e uma lâmpada de mercúrio. - Configurar para geração de imagens de dois fótons. Seleccione a apcaminho da luz propriate para geração de imagens de dois fótons. Para um sistema comercial típica, usar o software para mudar para o modo de imagem de dois fótons e redirecionar luz aos tubos fotomultiplicadores (PMTs) nos detectores não descanned. Ligue o próximo laser pulsado femtosecond infravermelho, selecione um comprimento de onda de 820 nm e uma potência de 5-15%. Nota: A potência de 5% normalmente fornece ~ 25 mW no espécime.
- Definir a tensão PMT1 & PMT2 perto do valor máximo, tipicamente 700-1,000 V dependendo da PMT. Definir o ganho de 1 para cada canal e zero a posição z para o objectivo.
- Abaixe o objetivo ~ 100 a 200 mm a partir da superfície cortical e começar a varredura xy. Ajustar a potência do laser, ganho e de voltagem PMT para cada canal, isto é, eCFP e citrino, para optimizar a relação sinal-ruído de fluorescência CNiFER.
- Utilizar a função de zoom no software para restringir a imagem de uma região que contém as células CNiFER, bem como um backgrounregião d. Use uma taxa de varredura não mais lento do que um quadro a cada 2 segundos (0,5 Hz) em 4 mS por pixel. Ajuste da linha média para a proporção adequada de sinal-ruído, por exemplo, de Kalman 2 linha média.
- Desenhe uma região de interesse (ROI) em torno de células CNiFER, em torno de cerca de 3 a 4 células por avião. Configurar análise em tempo real de ROI intensidades médias. Comece aquisição para monitorar CNiFER fluorescência ao longo do tempo.
- Recolha de fluorescência a partir de CNiFERs antes e durante as manipulações experimentais, por exemplo, estimulação eléctrica, a estimulação ChR2, de comportamento, tal como determinado pelo utilizador.
- Quando o experimento de imagem está completado, o rato retornar à sua gaiola. Repetir a imagiologia através dia, como desejado. Quando re-imagem das células consulte a imagem vasculatura de baixa ampliação previamente adquirido para orientar volta para o mesmo campo de imagem (passo 10.4).
Nota: CNiFERs implantados podem ser visualizados por pelo menos 7 dias.
Análise 11. Dados
- ficheiro de imagem Abrir e selecione ROI é para CNiFERs e um ROI para o fundo. Selecione 'análise de séries' para ambos os canais de cada ROI. Exportação intensidade de fluorescência média para cada ROI como um arquivo delimitado por tabulação.
- Use um software de matemática (veja Materiais) programa para analisar valores de fluorescência. filtro passa-baixa (0,3 Hz) cada sinal e, em seguida, subtrair a fluorescência de fundo em cada ROI de ECFP e citrino intensidades de fluorescência.
- Calcular a fluorescência média de linha de base e calcular rácios, como descrito na Equação 1 para medir o rácio de FRET ΔR (t) / R.
- Para determinar a sensibilidade de CNiFERs, traçar a proporção de FRET como uma função da concentração do agonista de log. Se encaixam com a equação de Hill para determinar o coeficiente de CE 50 e Hill (n), usando um software de estatística científica e da Colina Equation (Equação 2).

Resultados
Um CNiFER é derivada de uma célula de rim embrionário humano (HEK293) que é manipulada para expressar de forma estável pelo menos duas proteínas: uma proteína G específica acoplada do receptor (GPCR) e uma [Ca 2+] Sensor geneticamente codificado, TN-XL. TN-XXL sofre de ressonância de fluorescência de transferência de energia (FRET) entre proteínas ciano e amarelo fluorescente, eCFP e citrino, respectivamente, em resposta ao Ca 2+ 6,15. A activação de GPCRs que par a proteínas G endógena Gq, provocaria um aumento no citosólica [Ca 2+] através da via PLC / IP 3, levando a um aumento da TERF do TNXXL detector de Ca2 + (Figura 1).
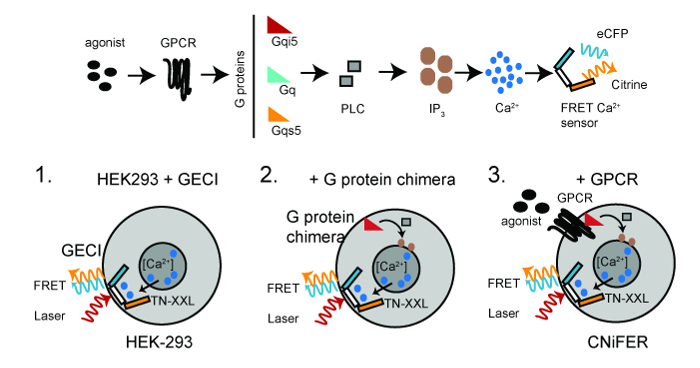
Figura 1:. Esquema para CNiFERs Desenvolvimento Top, GPCR-Ca 2+ via de sinalização necessária para a criação de umcelular CNiFER. Bottom, os passos básicos para a construção de CNiFERs utilizando células HEK293. Passo 1. transduzir com geneticamente codificado baseado em FRET de Ca 2+ -detector (TN-XXL). Passo 2. transduzir Gu quimera da proteína G, ou seja, QS5 G, G qi5, se necessário. Passo 3. transdução GPCR única para criar CNiFER. Luz de excitação de dois fótons (vermelho) excita eCFP, que sofre FRET, produzindo tanto uma emissão eCFP (ciano) e emissão Citrino (amarelo). Por favor clique aqui para ver uma versão maior desta figura.
O aumento de FRET fornece uma rápida óptica de leitura a partir da alteração nos níveis de neurotransmissores. Para desenvolver uma CNiFER para um determinado tipo de neurotransmissor, em primeiro lugar determinar o tipo de proteína G que acopla ao GPCR. Para G Q -coupled GPCRs, o GPCR utiliza proteínas G q endogenamente expressos emcélulas HEK293. Para G i / o -coupled GPCRs, uma linha HEK293 clonal é criado pela primeira vez que expressa uma proteína G quimérica que redireciona o GPCR ao G q -PLC / IP 3 percurso. Isto é conseguido com uma proteína G quimérica, qi5 g, o qual contém uma sequência de q principalmente Gu e cinco aminoácidos do terminal carboxilo de L i. Estes cinco aminoácidos são suficientes para G qi5 para comunicar com G i / o -coupled GPCRs, mas sinalizar através da via da G q. Para GPCRs -coupled G s, um G QS5 quimera é usado 10. A estratégia geral para a produção de um CNiFER é: 1) criar uma célula HEK293 clonal que expressa de forma estável um detector óptico de Ca2 +, isto é, TN-XL, utilizando um lentivírus transdução de células HEK, 2) expressar de forma estável uma quimera da proteína G , se necessário, no clone de células HEK293 que expressam TN-XL, e 3) criar um clone de GPCR que expressam estavelmente na célula HEK293clone expressando TN-XL e a proteína G quimérica. A linha de HEK293 clonal que não tem o GPCR, mas tem o TN-XXL e proteína G quimérica serve como o "controle CNiFER '. O controlo CNiFER é necessária para confirmar que a resposta CNiFER é devido especificamente a activação dos receptores de engenharia, isto é, D2R, e não para a activação de outros receptores endogenamente expressos em células HEK293.
Para gerar lentivírus, um sistema de expressão lentivector é usado, por exemplo, pCDH-CMV-MCS-EF1-puro, que contém os elementos genéticos responsáveis pela embalagem, transdução, a integração estável da expressão virai construir no ADN genómico, e a expressão do alvo sequência do gene. Para produzir um título elevado de partículas virais, vectores de expressão e de embalagem são transientemente co-transfectadas em células de mamífero produtoras de vírus e é recolhido. Existem várias instalações nucleares virais em que os EUA podem gerar alta ti Ter lentivírus. Após a infecção de células HEK293, o gene Puro proporciona resistência aos antibióticos para a identificação de células HEK293 transduzidas.
A fim de identificar linhas clonais específicos, transduzidas células HEK293 são classificados utilizando um sistema (FACS) de células activadas por fluorescência triagem. O objectivo é isolar um clone que contém um nível de expressão elevado de base-FRET detector de Ca2 + e a capacidade de sofrer de FRET. Neste exemplo de análise de FACS, a fluorescência de emissão eCFP é representada em função do sinal de FRET (eCFP excitação e emissão Citrino). As caixas marcam regiões (P2 e P3) que irá ser subsequentemente seleccionados ( "gate") para separação em placas de 96 poços (Figura 2). Geralmente, cerca de quatro placas de 96 poços são suficientes para o rastreio de êxito da criação de CNiFERs. A partir destas placas 4, aproximadamente 100 clones são adequados para análise leitor de placas fluorométrico.
e_content "fo: manter-together.within-page =" 1 ">
Figura 2: Exemplo de análise de FACS Um exemplo do resultado na sequência de uma análise por FACS.. O gráfico parcelas ECFP emissão ( "475/20-A") em função da emissão de citrino ( "TERF V-530/30-A"), utilizando eCFP excitação para cada célula. Regiões P2 e P3 áreas mostram selecionado, ou seja, fechado, para a classificação em células individuais. As cores são arbitrário. Por favor clique aqui para ver uma versão maior desta figura.
Uma vez que as células separadas foram crescidas até uma densidade suficiente, a resposta de FRET após activação agonista é determinada usando um sistema de leitor de placa de 96 poços equipada com fluorométrico o manuseamento da solução. Para diminuir o número de clones para estudar, um "3-point" curva agonista é utilizado para rastrear ~100 clones e selecione CNiFERs com as melhores respostas. Aproximadamente 10 clones são então analisados mais com a determinação de dose-resposta completa com o agonista de cognato, e as respostas não específicas, sondadas com 12 outros neurotransmissores ou moduladores. Uma placa de 96 poços de droga é preparada como se três vezes a concentração (concentração final é diluído 1: 3 em placa) de drogas (por exemplo, agonistas, antagonistas, etc.) em ACSF. Neste exemplo, uma placa de fármaco está configurado para testar um D2 CNiFER com o seu agonista cognato, dopamina, e potenciais respostas não específicas com uma variedade de outros agonistas de neurotransmissores e de péptidos (Figura 3). A espinha dorsal CNiFER, ao qual falta o GPCR, serve como um controlo importante para a CNiFER recém-criada.
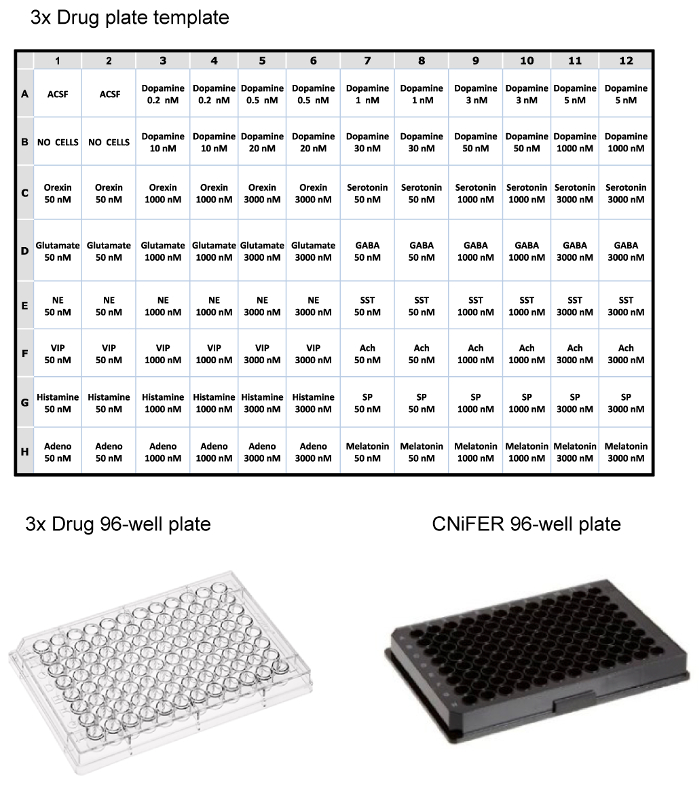
Figura 3:. Exemplos de layout para placas de 96 poços Top, mesa do Layout para carregar uma placa de drogas 3x para leitor de placas fluorom�rica, usando concentrações de três vezes de vários neurotransmissores e peptídeos. Bottom, exemplos de plástico placa de 96 poços de drogas clara e placa de 96 poços preta para semear CNiFERs e medir no leitor de placas. Por favor clique aqui para ver uma versão maior desta figura.
Estimulação do GPCR é esperado um aumento da resposta de FRET, como uma consequência de uma elevação de intracelular [Ca2 +] e a detecção por TN-XL. Sob estas condições, a FRET é produzido por eCFP e citrino aproximando-se, de modo que a excitação de eCFP produz uma emissão eCFP menor e maior emissão citrina. Neste exemplo, a excitação é definida como 436 nm e emissão filtros são ajustados para 485 ± 7,5 nm para eCFP e 527 ± 7,5 nm para citrina (Figura 4). Trinta segundos de baSeline fluorescência é medida e, em seguida, 50 uL do agonista "três vezes" na placa ACSF é entregue a cada cavidade contendo 100 ul ACSF (diluição 1: 3). eCFP e emissão de fluorescência Citrino são medidos a cada 3,8 segundos para 180 segundos. medições de fundo foram tomadas a partir de poços sem células e subtraído, se necessário. intensidades de fluorescência são normalizados linhas de base pré-estímulo (F (t) / F (linha de base)), e respostas dos picos são medidos para calcular a relação de FRET (ΔR / R), utilizando o F (t) / F (linha de base) do 527 nm e 485 nm canais (Equação 1). Uma curva de resposta à dose é então construído através da representação gráfica da proporção de FRET como uma função de diferentes concentrações de agonista e se encaixam com a equação de Hill para determinar a CE 50 e o coeficiente de Hill (Figura 5) (equação 2). Uma óptima CNiFER exibe uma grande proporção de FRET e um EC apropriado 50 para o agonista cognato, e exibe pouca ou nenhuma experiência respostas a outra neurotransmitagonistas TER. Em contraste, o controle CNiFER deverá apresentar uma resposta ao agonista cognato.
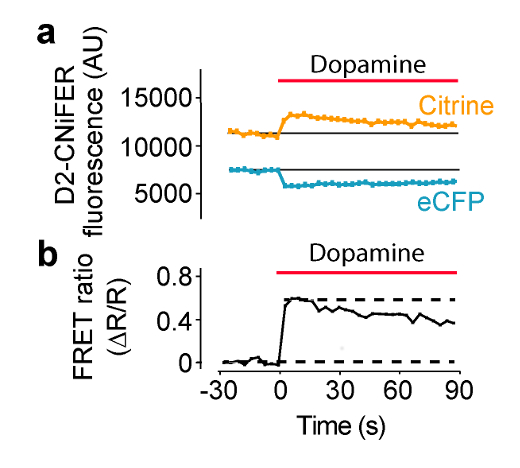
Figura 4: Exemplo de resposta induzida por agonista da resposta de FRET FRET D2R CNiFER medida num leitor de placa com um sistema de fornecimento de solução.. (A) Um gráfico da resposta de FRET, ou seja, a excitação eCFP com emissões ECFP e citrino, durante a aplicação da dopamina (barra vermelha) para D2 CNiFERs. Note-se que diminui emissão eCFP enquanto Citrino aumento das emissões com agonista (dopamina). (B) Um gráfico da relação de FRET (Equação 1) para a resposta em (A) Figura modificado a partir de Muller et al., 2014 7. Por favor clique aqui para ver uma versão maior desta figura.
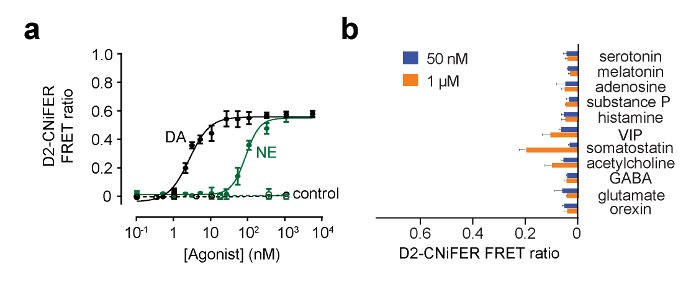
Figura 5:. Exemplos de curvas de dose resposta para D2 CNiFER (A) Dose curvas de resposta para a resposta de D2 CNiFERs à dopamina (DA, preto) e para a norepinefrina (NE, verde). Além disso, a resposta de CNiFERs "controlo" sem o D2R é mostrado. (B) O gráfico de barras que mostra a resposta de FRET rácio de outros neurotransmissores e moduladores a 50 nM e 1 uM. Os valores são média ± SEM. Figura modificado a partir de Muller et al., 2014 7. Por favor clique aqui para ver uma versão maior desta figura.
clones CNiFER pode ser analisado em maior profundidade para possível dessensibilização dependente do receptor e para a sua resolução temporal, discriminando a apresentaçãode dois pulsos agonistas diferentes (para detalhes, ver Muller et al., 2014 7). Tendo construído um clone CNiFER, o próximo passo é o de testar a sua função in vivo. Para monitorizar a fluorescência in vivo, é necessário o uso de um microscópio de dois fotões. Depois de preparar uma janela crânio-diluídos, CNiFERs são carregados para uma pipeta de vidro e injectado em camadas 2/3 do córtex. O rato é em seguida preparado para imagiologia in vivo, anexando uma lamela de vidro para o crânio diluído, e a implantação de uma barra de cabeça para a fixação da cabeça durante a imagiologia (Figura 6).
Para determinar que os CNiFERs implantados são viáveis, in vivo, concentrações conhecidas de agonista pode ser injectado perto do local de implantação e a taxa de FRET determinado 7. Para validar ainda mais a actividade de CNiFERs implantados, estimulando os neurónios de entrada deve ser examinado. Por exemplo, com o D2 CNiFER, o efeito defoi examinada a estimulação elétrica dos neurônios de dopamina do mesencéfalo que se projetam para o córtex. Um bipolar de tungsténio 0,1 mohms estimular eléctrodo com uma separação de ponta de 500 um foi implantado na substantia nigra (-3,2 mm A / P, -1,3 mm M / L, -4,4 mm D / V). A Figura 6 mostra um exemplo de electricamente estimulando a substantia nigra em diferentes intensidades e observando-se um aumento do rácio de FRET para D2 CNiFERs 7. Note-se que (IP) injecção intra-peritoneal sistémica de um antagonista do receptor D2, eticlopride (1 mg / kg) bloqueia a resposta CNiFER D2. Por outro lado, a injecção de cocaína (15 mg / kg), que bloqueia a recaptação de dopamina, melhora a resposta evocada electricamente D2 CNiFER 7.

Figura 6: Exemplo de D2 CNiFER resposta I ong> n Vivo após a estimulação elétrica da substância negra. (A) Uma charge mostra um mouse fixo-cabeça preparada para in vivo de imagens de dois fótons e estimulação elétrica. luz de dois fótons (vermelho, 820 nm) para excitação e 475 nm de emissão para eCFP (azul) e 530 nm de emissão para Citrino (verde). (B) O gráfico de linha mostra a razão de FRET para D2 CNiFER injectado no córtex após a estimulação eléctrica de substantia nigra, ou seja, 200 ms pulsos de 50 a 300 mA a 50 Hz durante 500 ms, e após estimulação eléctrica na presença de um D2R antagonista (eticlopride) ou cocaína. Figura modificado a partir de Muller et al., 2014 7. Por favor clique aqui para ver uma versão maior desta figura.
ftp_upload / 53290 / 53290table1.jpg "/>
Tabela 1: Lista de produtos químicos e reagentes para fabricar o meio de crescimento e HEK293 ACSF.

Tabela 2: Volumes para colheita de células de diferentes placas de cultura de Tamanho ou frascos.
Discussão
A criação de CNiFERs proporciona uma estratégia inovadora e original para opticamente medição da libertação de neurotransmissores no cérebro in vivo. CNiFERs são idealmente adequados para a medição da libertação de extrasynaptic, ou seja, o volume de condução, para neurotransmissores. Importante, cada CNiFER possui as propriedades do GPCR nativo, proporcionando uma medição óptica fisiológica das alterações nos níveis de neurotransmissores no cérebro. Até à data, CNiFERs foram criados para a detecção de acetilcolina (M1-CNiFER) 6, dopamina (D2-CNiFER) 7 e norepinefrina (α1a-CNiFER) 7.
Em princípio, um CNiFER pode ser criada por qualquer neurotransmissor que sinaliza através de um GPCR. Para o caso em que os sinais de GPCR através de proteínas G Gq, nenhuma outra modificação é necessária para a célula HEK293. GPCRs que sinalizam a G i / o, no entanto, exigem co-expressão de um qi5 G proteína G quiméricapara acoplar o GPCR para o G q / PLC via 7,10. Da mesma forma, os GPCRs que sinalizam a G s requer a co-expressão de uma proteína G quimérica QS5 G 10. Uma vez concluída, cada clone CNiFER é peneirado e só aqueles clones CNiFER que têm uma afinidade comparável para o receptor nativo, exibem pouca ou nenhuma dessensibilização e proporcionar uma relação de sinal-para-ruído que é adequado para medir com in vivo microscopia de dois fotões, são selecionados para estudos in vivo.
Para os estudos in vivo, é altamente recomendável para tratar os ratos com ciclosporina para minimizar qualquer resposta imunológica potencial. Existe a possibilidade de rejeição ou de uma resposta imunológica com implantação de células CNiFER humanas no cérebro de roedores. Isto foi investigado anteriormente por análise de expressão de GFAP e MAC1 7, a seguir à implantação CNiFER. CNiFERs não pareceu produzir cicatrizes gliais ou gerar qualquer signisigni- MAC1 coloração 7.
Duas questões importantes a considerar na construção CNiFERs são a sensibilidade e dessensibilização. Se a CE 50 é demasiado alta, isto é, baixa afinidade, em relação ao receptor nativo, então o CNiFER pode não tem sensibilidade suficiente para detectar a libertação de neurotransmissor in vivo. Uma solução é rastrear de novo os clones e escolher um clone diferente CNiFER que tem maior afinidade. Uma estratégia alternativa seria testar outros tipos de codificados geneticamente fluorescentes Ca 2+ -detectors que podem ter um Ca 2+ maior sensibilidade, que pode deslocar a EC 50 para a ativação GPCR. Dado que a concepção CNiFER é modular, é facilmente adaptado a outros tipos de geneticamente codificados de Ca2 +, tais como -detectors GCaMP 16. Isolamento de clones de CNiFER com o mesmo receptor, mas diferentes de EC 50 s poderia ser vantajoso para prolongar o intervalo dinâmico da detecção de libertação de neu endógenarotransmitters in vivo.
Dessensibilização do CNiFER também vai limitar o seu uso in vivo. Se o pico de resposta diminui gradualmente com cada impulso de agonista, então o receptor pode ser dessensibilizante. Neste caso, examinar outros clones e determinar se eles respondem da mesma forma. Modificações na sequência de aminoácidos do receptor, ou a utilização de um outro subtipo de receptor pode ser necessário para tratar a dessensibilização agonista-dependente. Se não são conhecidos locais de ácidos aminados ou de fosforilação identificados que associado com o G-cinases do receptor de proteína (GRKs), que seria conveniente para a construção de uma variante não dessensibilizante do GPCR por mutação num ou mais locais. O mecanismo de dessensibilização deve ser determinado para cada receptor, numa base caso-a-caso.
Até agora, CNiFERs só foram implantadas em camadas superficiais do córtex 6,7, devido à espectroscópicas limitações com fluoróforos de imagem com mi de dois fótonscroscopy 17,18. No futuro, pode ser possível adaptar a tecnologia CNiFER com medições à base de fibras de fluorescência 19 de modo que CNiFERs pode ser implantado em regiões cerebrais subcorticais.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Agradecemos B. Conklin (Universidade da Califórnia, San Francisco) por fornecer os qi5 G e G QS5 cDNAs, A. Schweitzer para assistência com a eletrônica, N. Taylor para a assistência com a seleção de clones, Ian Glaaser e Robert Rifkin para leitura de prova e Olivier Griesbeck para TN-XXL. Este trabalho foi apoiado por bolsas de investigação, através do Instituto Nacional sobre Abuso de Drogas (NIDA) (DA029706; DA037170), o Instituto Nacional de Imagem Biomédica e Bioengenharia (NIBIB) (EB003832), Hoffman-La Roche (88610A) eo "Neuroscience relacionados com a droga de bolsa de formação abuso "por meio de NIDA (DA007315).
Materiais
| Name | Company | Catalog Number | Comments |
| pCDH-CMV-MCS-EF1-Puro | System Biosciences | CD510B-1 | Cloning: for generating lentivirus |
| 12 x 75 *BD Falcon High Clarity Polypropylene Round Bottom Test Tube | BD Biosciences | 352063 | FACS |
| BD 40 um Falcon cell strainers | BD Biosciences | 352340 | FACS |
| 0.05% Trypsin EDTA | Invitrogen | 25200056 | FACS |
| 96 Well Plate, flat bottom, clear | Corning | 3596 | FACS |
| 96 well cell culture plates | Corning | CLS3997 | Flexstation |
| Optilux black clear bottom | Corning | 3603 | Flexstation |
| Flexstation pipet tips | Molecular Devices | 9000-0911 | Flexstation |
| Acetylcholine Chloride | Sigma-Aldrich | A2661 | Flexstation |
| Norepinephrine | Sigma-Aldrich | A7256 | Flexstation |
| Dopamine Hydrochloride | Sigma-Aldrich | PHR1090 | Flexstation |
| GABA | Sigma-Aldrich | A2129 | Flexstation |
| Histamine | Sigma-Aldrich | H7125 | Flexstation |
| Glutamate | Sigma-Aldrich | 49621 | Flexstation |
| Epinephrine | Sigma-Aldrich | E4642 | Flexstation |
| Somatostatin | Sigma-Aldrich | S1763 | Flexstation |
| 5HT | Sigma-Aldrich | H9523 | Flexstation |
| VIP | Alpha Diagnostics Inc. | SP-69627 | Flexstation |
| Orexin A | Alpha Diagnostics Inc. | 12-p-01 | Flexstation |
| Substance P | Sigma-Aldrich | S6883 | Flexstation |
| Adenosine | Sigma-Aldrich | A4036 | Flexstation |
| Melatonin | Sigma-Aldrich | M5250C | Flexstation |
| Fluorescence Plate Reader & software | Molecular Devices | Flexstation 3 | Flexstation |
| DMEM (high glucose) with Glutamax | Life Technologies | 10569-010 | Tissue culture |
| Fetal bovine serum | Life Technologies | 10082-139 | Tissue culture |
| Pen/Strep antibiotics | Life Technologies | 15140-122 | Tissue culture |
| Puromycin | InvivoGen | ant-pr-1 | Tissue culture |
| Fibronectin | Sigma-Aldrich | F0895 | Tissue culture |
| CoolCell LX Alcohol-free controlled-rate cell freezing box | Bioexpress | D-3508) | Tissue culture |
| cyanoacrylate glue | Loctite | Loctite no. 495 | surgery and stereotaxic injection |
| plastic paraffin film | VWR | Parafilm® | surgery and stereotaxic injection |
| Nanoinjector | Drummond | 3-000-204 | surgery and stereotaxic injection |
| Glass electrodes | Drummond | 3-000-203G | surgery and stereotaxic injection |
| hand held drill | OSADA | Exl-M40 | surgery and stereotaxic injection |
| Burrs for drill | Fine Scientific | 19007-05; 19007-07) | surgery and stereotaxic injection |
| Sterilizing bath | FST | 18000-45, Hot Bead Sterilizer | surgery and stereotaxic injection |
| isoflurane chamber/mask | Highland Medical Equipment | 564-0427, HME 109 Table Top Anesthetic Machine with Isoflurane Vaporizer, O2 Flowmeter, Gang Valve; 564-0852, Induction Chamber 16X7X7.5cm | surgery and stereotaxic injection |
| 3D scope with arm | Zeiss | surgery and stereotaxic injection | |
| fiber optic light | surgery and stereotaxic injection | ||
| Betadine | surgery and stereotaxic injection | ||
| 70 % (v/v) isopropyl alcohol | surgery and stereotaxic injection | ||
| Povidone-Iodine Prep Pads | dynarex | 1108 | surgery and stereotaxic injection |
| NaCl 0.9% (injection, USP, 918610) | surgery and stereotaxic injection | ||
| CYCLOSPORINE (INJECTION, USP) | surgery and stereotaxic injection | ||
| Buprenex (injection) buprenorphine (0.03 μg per g rodent) | Sigma-Aldrich | surgery and stereotaxic injection | |
| Ophthalmic ointment | Akorn | NDC 17478-235-35 | surgery and stereotaxic injection |
| Surgifoam | Ethicon | surgery and stereotaxic injection | |
| Grip dental cement | Dentsply | #675571, 675572 | surgery and stereotaxic injection |
| Instant SuperGlue | NDindustries | surgery and stereotaxic injection | |
| LOCTITE 4041 | surgery and stereotaxic injection | ||
| METABOND | C&B | surgery and stereotaxic injection | |
| no. 0 cover glass | Fisher | surgery and stereotaxic injection | |
| stereotaxic frame | Kopf | surgery and stereotaxic injection | |
| Rectal probe and heating pad | FHC | 40-90-8D, DC Temperature Controller,40-90-2-06, 6.5X9.5cm Heating Pad40-90-5D-02, Rectal Thermistor Probe | surgery and stereotaxic injection |
| optical breadboard for imaging | Thorlabs | surgery and stereotaxic injection | |
| Mineral oil | Fisher | S55667 | surgery and stereotaxic injection |
| Kwik-Cast (Silicone elastomer) | World Precision Instruments | surgery and stereotaxic injection | |
| Suture | Ethicon | 18’’, 1667, 4-0 | surgery and stereotaxic injection |
| Scissors | Fine Scientific Tools | 91500-09, 15018-10 | surgery and stereotaxic injection |
| Forcepts | Fine Scientific Tools | 11252-30; #55, 11295-51; Grafe, 11050-10 | surgery and stereotaxic injection |
| Student Halsted-Mosquito Hemostats | Fine Scientific Tools | 91308-12 | surgery and stereotaxic injection |
| Small Vessel Cauterizer Kit | Fine Scientific Tools | 18000-00 | surgery and stereotaxic injection |
| Hot Bead Sterilizers | Fine Scientific Tools | 18000-45 | surgery and stereotaxic injection |
| Instrument Case with Silicone Mat | Fine Scientific Tools | 20311-21 | surgery and stereotaxic injection |
| Plastic Sterilization Containers with Silicone Mat | Fine Scientific Tools | 20810-01 | surgery and stereotaxic injection |
| 2P fixed-stage fluorescence scope for in vivo imaging | Olympus | FV1200 MPE | in vivo imaging |
| Multiphoton laser | SpectraPhysics | Mai Tai DeepSee | in vivo imaging |
| Green Laser | Olympus | 473 nm Laser | in vivo imaging |
| xy translational base | Scientifica | MMBP | in vivo imaging |
| FRET filter cube for YFP and CFP | Olympus | in vivo imaging | |
| 10x and 40x water immersion objectives | Olympus | in vivo imaging | |
| air table | Newport | in vivo imaging | |
| custom built light-tight cage | Thorlab | in vivo imaging |
Referências
- Day, J. C., Kornecook, T. J., Quirion, R. Application of in vivo. microdialysis to the study of cholinergic systems. Methods. 23, 21-39 (2001).
- Robinson, D. L., Venton, B. J., Heien, M. L., Wightman, R. M. Detecting subsecond dopamine release with fast-scan cyclic voltammetry in vivo. Clin Chem. 49, 1763-1773 (2003).
- Liang, R., Broussard, G. J., Tian, L. Imaging Chemical Neurotransmission with Genetically Encoded Fluorescent Sensors. ACS Chem Neurosci. , (2015).
- Okubo, Y., et al. Imaging extrasynaptic glutamate dynamics in the brain. Proc. Natl. Acad. Sci. USA. 107, 6526-6531 (2010).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods. 10, 162-170 (2013).
- Nguyen, Q. T., et al. An in vivo biosensor for neurotransmitter release and in situ receptor activity. Nat Neurosci. 13, 127-132 (2010).
- Muller, A., Joseph, V., Slesinger, P. A., Kleinfeld, D. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods. 11, 1245-1252 (2014).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. , e3998(2012).
- Wang, X., McManus, M. Lentivirus production. J Vis Exp. , (2009).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Gjα. Nature. 363, 274-276 (1993).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1, 3166-3173 (2006).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. , (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7, 981-984 (2010).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32, 1277-1309 (2012).
- Yamauchi, J. G., et al. Characterizing ligand-gated ion channel receptors with genetically encoded Ca2+ sensors. PLoS One. 6, e16519(2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. 32, 13819-13840 (2012).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2, 932-940 (2005).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Cui, G., et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 494, 238-242 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados