Method Article
Costruzione di Cell-based neurotrasmettitore fluorescenti Engineered Reporters (CNiFERs) per il rilevamento ottico dei neurotrasmettitori
In questo articolo
Riepilogo
Vi presentiamo un protocollo per creare celle a base di neurotrasmettitore fluorescenti reporter ingegnerizzati (CNiFERs) per la rilevazione ottica del rilascio di neurotrasmettitore volumetrico.
Abstract
Basate sulle cellule neurotrasmettitore fluorescenti reporter ingegnerizzati (CNiFERs) fornire un nuovo strumento per i neuroscienziati di rilevare visivamente il rilascio di neurotrasmettitori nel cervello in vivo. Una specifica CNiFER è creata da una cellula embrionali renali umane che esprime stabilmente uno specifico recettore accoppiato alla proteina G, che le coppie di G q / 11 proteine G, e un FRET-based Ca 2+ -detector, TN-XXL. L'attivazione del recettore porta ad un aumento nel segnale FRET. CNiFERs hanno una sensibilità nm e una risposta temporale di secondi perché un clone CNiFER utilizza il recettore nativo per un particolare neurotrasmettitore, ad esempio, D2R per la dopamina. CNiFERs sono direttamente impiantati nel cervello, consentendo loro di percepire il rilascio di neurotrasmettitore con una risoluzione spaziale di meno di cento micron, che li rende ideali per misurare il volume di trasmissione in vivo. CNiFERs può anche essere usata per selezionare altri farmaci per il potenziale reattività incrociata in vivo. Recentemente abbiamo ampliato la famiglia di CNiFERs per includere GPCR quella coppia a G I / O G proteine. CNiFERs sono disponibili per rilevare acetilcolina (ACh), dopamina (DA) e noradrenalina (NE). Dato che ogni GPCR può essere utilizzato per creare un romanzo CNiFER e che ci sono circa 800 GPCR nel genoma umano, che descriviamo qui la procedura generale per progettare, realizzare e testare qualsiasi tipo di CNiFER.
Introduzione
Per comprendere appieno come i neuroni comunicano nel cervello, è necessario disporre di un metodo per misurare il rilascio di neurotrasmettitori in vivo. Ci sono diverse tecniche consolidate per la misurazione neurotrasmettitori in vivo. Una tecnica comunemente usata è microdialisi, in cui una cannula viene inserita nel cervello e un piccolo volume di liquido cerebrospinale viene raccolto ed analizzato mediante cromatografia liquida ad alte prestazioni e rilevazione elettrochimica 1. Microdialisi ha una risoluzione spaziale dell'ordine di pochi diametri della sonda, ad esempio, ~ 0,5 mm per una microsonda 200 micron di diametro. La risoluzione temporale di questa tecnica, tuttavia, è lento a causa di intervalli di campionamento che tipicamente durano ~ 5 minuti o più 1. Inoltre, le analisi non sono fatti in tempo reale. Un'altra tecnica è scansione veloce voltammetria ciclica (FSCV), che utilizza una sonda in fibra di carbonio che viene inserito nel cervello. FSCV ha eccellenti temperaturaRisoluzione orale (in frazioni), alta sensibilità (nanomolari), e la risoluzione spaziale con diametri della sonda da 5 a 30 micron. Tuttavia, FSCV è limitato ai trasmettitori che producono ossidazione caratteristico profilo riduzione con tensione su una sonda potenziometrica carbonio 2.
Una terza tecnica per misurare neurotrasmettitori è direttamente attraverso neurotrasmettitori geneticamente codificato biosensori (NT) 3. Con questo metodo, una proteina di fusione viene creato che contiene un dominio ligando vincolante per un trasmettitore accoppiato ad un trasferimento di energia di risonanza di fluorescenza (FRET) accoppiamento sede di fluorofori 4 o un GFP permutati 5. A differenza delle precedenti due metodi, questi biosensori sono geneticamente codificati ed espressi sulla superficie di una cellula ospite, come un neurone, attraverso la produzione di animali transgenici o acutamente con l'uso di agenti virali per infettare le cellule. Fino ad oggi, biosensori geneticamente codificati sono stati sviluppati solo per detecting glutammato e GABA 3-5. Limitazioni con queste tecniche sono la bassa sensibilità, nell'intervallo nM, e l'incapacità di espandere il rilevamento del gran numero di trasmettitori, ad esempio, neurotrasmettitori classici, neuropeptidi e neuromodulatori, che segnalano attraverso recettori accoppiati alla proteina G (GPCR). In realtà, ci sono quasi 800 GPCR nel genoma umano.
Per far fronte a queste carenze, abbiamo sviluppato uno strumento innovativo per misura rilascio otticamente di qualsiasi neurotrasmettitore che segnala attraverso un GPCR. CNiFERs (neurotrasmettitore fluorescenti a base di cellule reporter ingegnerizzati) sono cellule HEK293 clonali ingegnerizzate per esprimere un GPCR specifico che, quando stimolato, provoca un aumento intracellulare [Ca 2+] che viene rilevata da un sensore geneticamente codificato FRET-based Ca 2+, TN-XXL. Così, CNiFERs trasformare recettore neurotrasmettitore vincolante in un cambiamento della fluorescenza, fornendo un r ottica tempo reale diretta eead-out di attività neurotrasmettitore locale. Utilizzando il recettore nativo per un determinato neurotrasmettitore, CNiFERs conservano la specificità chimica, affinità e dinamiche temporali dei recettori endogenamente espressi. Ad oggi, abbiamo creato tre tipi di CNiFERs, uno per rilevare acetilcolina usando il recettore M1, uno per rilevare dopamina utilizzando il recettore D2, e uno per rilevare noradrenalina usando l'6,7 recettore tipo a1A. La tecnologia CNiFER è facilmente espandibile e scalabile, rendendolo suscettibile a qualsiasi tipo di GPCR. In questo articolo Giove, descriviamo e illustrare la metodologia per la progettazione, la realizzazione, e la prova CNiFERs vivo per qualsiasi applicazione.
Protocollo
Tutte le procedure sugli animali eseguiti in questo studio sono conformi Istituzionale cura degli animali e le linee guida Comitato Usa (IACUC), e sono stati approvati dai IACUCs presso la Scuola di Medicina Icahn al Monte Sinai e la University of California, San Diego.
1. Generare GPCR che esprimono Lentivirus per trasformare cellule HEK293
- Ottenere il cDNA per un GPCR specifico da una fonte commerciale, ad esempio, cdna.org. In alternativa, amplificano il gene GPCR da una libreria di cDNA mediante PCR. Ottenere un vettore lentivirus che esprimono, come ad esempio pCDH-CMV-MCS-EF1-Puro (pCDH). Utilizzare questo vettore per propagare il DNA così come per generare lentivirus.
- Clonare il GPCR cDNA nel vettore lentivirus che esprimono mediante PCR. Vedere Lorenz 8, per i dettagli sulla PCR subcloning.
- Espandere e purificare il GPCR-pCDH DNA utilizzando un 'maxi' kit di preparazione privo di endotossine secondo le istruzioni del produttore. Verificare che il GPCR cDNA clonato in pCDH è mutation-libera dal sequenziamento del DNA.
Nota: Prima di inviare il DNA per la produzione di virus, digerire un'aliquota con adeguata enzima di restrizione di confermare la dimensione di inserimento e la purezza del DNA. - Generare lentivirus usando una struttura di base di virus, come ad esempio uno al Salk Institute, Università di Penn., O University of North Carolina, ecc, o generare in-house 9. Utilizzare circa 25 mg (> 1 mg / mL) di DNA privo di endotossine per trasfezione di cellule HEK in un pallone T75. Assicurarsi che il DNA è di elevata purezza, avente un rapporto di assorbanza (A 260 / A 280) di ~ 1,8.
Nota: I titoli di virus ~ 10 11 -10 12 GC / ml sono ottimali per la trasduzione di cellule HEK293.
2. Scegliere HEK293 / TN-XXL Tipo Backbone cellulare per la coltura in vitro
Nota: Determinare la proteina di accoppiamento specificità G, ad esempio, G I / O, G q / 11, o proteine G G s, della GPCR, in quanto questo dictati sia una chimera proteina G è necessario per la CNiFER. Per i recettori -coupled G q, ad esempio, M1 recettori muscarinici, scegliere HEK293 / TN-XXL (# 3G8) come il tipo di cellule HEK293 spina dorsale. Per G I / O -coupled recettori, la chimerica G proteina G qi5 è necessario 10. Per recettore -coupled G s, il QS5 chimera G è necessario 10. In questo protocollo, la costruzione di un D2R CNiFER viene utilizzato come esempio. Segnali D2R attraverso G I / O G proteine e richiede HEK293 cellule che stabilmente esprimono la proteina chimerica G, qi5 G, ad esempio, HEK293 / TN-XXL / G qi5 _ # qi5.6.
- Ottenere i qi5 HEK293 / TN-XXL / G _ # qi5.6 cellule clonali da un laboratorio di ricerca. Nota: Le seguenti cellule clonali, HEK293 / TN-XXL (# 3G8) per G q -coupled recettori, HEK293 / TN-XXL / G qi5 (# qi5.6) per G I / O -coupled recettori, e HEK293 / TN -XXL / G QS5 (# qs5.47) per G s re -coupledrecettori, sono liberamente disponibili su richiesta 6,7.
- Crescere ed espandersi qi5 HEK293 / TN-XXL / G _ # qi5.6 al ~ 90% di confluenza in un pallone T25 con 5 ml di terreni di crescita HEK293 (Tabella 1). Crescere le cellule in un incubatore umidificato a 37 ° C con 5% (v / v) di CO 2.
Nota: Tutti i lavori con la coltura di cellule HEK293 deve essere effettuata utilizzando tecniche di coltura dei tessuti sterili standard. - Raccogliere le cellule HEK293 dal primo aspirando mezzi dalla boccetta T25. Lavare le cellule delicatamente con l'aggiunta di 5 ml di PBS e dondolo pallone.
- Rimuovere il PBS e aggiungere 1 ml di 0,05% (w / v) tripsina / EDTA (Tabella 2). Incubare per 1 a 2 minuti a 37 ° C con 5% (v / v) di CO 2.
- Raccogliere le cellule e trasferimento sterile tubo da 15 ml. Centrifugare per 5 min a 1000 xg in una centrifuga coltura cellulare. Aspirare il surnatante.
- Risospendere il pellet di cellule in 5 ml di terreni di crescita HEK293. Contare le cellule in un emocitometro utilizzandotrypan blu. Calcolare la densità cellulare e passare al punto 3.
3. Cellule / Gqi5 lentivirali trasduzione del HEK293 / TN-XXL
- Seed un pallone T25 con 0,7 x 10 6 cellule HEK293 qi5 / TN-XXL / G. Crescere le cellule in un incubatore umidificato a 37 ° C con 5% (v / v) di CO 2 fino ~ 50% confluenti, dopo circa 1 giorno. Congelare cellule rimanenti (passi 8,2-8,3). Queste cellule serviranno come il controllo CNiFER, vale a dire, un CNiFER che manca il GPCR.
- Il giorno dell'infezione, diluire il lentivirus esprimere GPCR (passo 1,4) ad una concentrazione finale di 10 ~ 9 GC / ml in un volume totale di 2 ml di terreni di crescita HEK293 (Tabella 1). Ad esempio, aggiungere 20 ml di 10 11 GC virus / ml a 2 ml media in un pallone T25.
Nota: le informazioni titolo del virus dovrebbero essere fornite dalla struttura di base dei virus. Combinare lentivirus e media in una provetta da centrifuga e triturare delicatamente. Alti titoli di lentivIRU sono livello di biosicurezza 2 (BSL-2). - Aspirare il supporto dal fiasco T25. Aggiungere i 2 ml di miscela di virus / media dal punto 3.2. Incubare la beuta T25 O / N a 37 ° C con 5% (v / v) di CO 2.
- Dopo un giorno di infezione, aspirare la miscela di virus / media e sostituirla con HEK293 terreni di coltura contenente puromicina (2 mg / ml; Tabella 1). Puromicina seleziona per le cellule trasdotte. Incubare la beuta a 37 ° C con 5% (v / v) di CO 2 fino a circa 90% confluenti, dopo ~ 1-2 giorni.
- Preparare una piastra a 96 pozzetti (nera con fondo trasparente) rivestito con fibronectina, per la generazione di una curva agonista / attivazione di 10 punti nella fase 4.1. In una cappa sterile, aggiungere 50 ml di fibronectina (5 mg / ml) per pozzetto per righe A e B della piastra a 96 pozzetti. Incubare la piastra a temperatura ambiente per 1 ora. Lavare due volte per 5 min per risciacquo con PBS. Aggiungere 50 ml di terreni di crescita HEK293 e incubare O / N a 37 ° C con 5% (v / v) di CO 2.
Nota: FibronPiastre ectin trattati sono disponibili in commercio. - Raccogliere le cellule nel pallone T25 come descritto nei passaggi 2,3-2,6 (Tabella 2).
- Risospendere il pellet di cellule in 5 ml di terreni di crescita HEK293. Seed un pallone T25 con 1,5 ml di cellule per l'analisi FACS. Inoltre, seme un pallone T75 con 1 ml di cellule per il congelamento e la conservazione (vedere i passaggi 8,2-8,3)
- Per la curva agonista 10 punti, seminare le prime due righe (A e B) di una piastra a 96 pozzetti fibronectina rivestite (dal punto 3.5) con 100 ml di sospensione cellulare per pozzetto.
- Incubare le cellule HEK293 che crescono in un pallone T25, T75 un pallone e una piastra a 96 pozzetti fino a circa ~ 90% confluenti a 37 ° C con 5% (v / v) di CO 2, dopo ~ 1-2 giorni.
4. FACS e l'isolamento di singole CNiFER cloni
- Utilizzare la piastra a 96 pozzetti per la generazione di una curva di attivazione agonista di 10 punti.
Nota: Prima di iniziare la fluorescenza delle cellule attivate (FACS) analisi, è importante confermare laespressione del GPCR testando cellule trasdotte una risposta agonista (curva agonista 10 punti). Questa prova viene effettuata utilizzando un lettore di piastre fluorimetrico.- Preparare un piatto di droga per la curva di attivazione agonista di 10 punti. Scegliere 10 diverse concentrazioni di agonista che delimitano il predetto CE 50, che possono essere determinate dalla letteratura.
Nota: La piastra farmaco contiene 3 volte di ciascuna concentrazione (in duplice copia) per regolare per la diluizione 1: 3 nella piastra CNiFER. Ad esempio, la piastra farmaco per testare un D2 CNiFER contiene 10 differenti concentrazioni di dopamina a concentrazioni di 3 volte; 0,2, 0,5, 1, 3, 5, 10, 20, 30, 50, e 1000 nM. Nella piastra di CNiFER, quindi, le concentrazioni finali di dopamina sono 0.067, 0.167, 0.333, 1.00, 1.67, 3.33, 6.67, 10.0, 16.7, e 333 nM. - Preparare soluzioni agonista utilizzando artificiale fluido cerebrale spinale (ACSF) (Tabella 1). Utilizzare due pozzetti per 'ACSF', ad esempio, A1 e A2,e due pozzi per "no cellule ', ad esempio, B1 e B2.
Nota: Preparare differenti concentrazioni di farmaci utilizzando un metodo di diluizione seriale. Creare un modello per tenere traccia dei cloni CNiFER e le concentrazioni di farmaco (Figura 3). - Utilizzare il software per programmare il lettore di piastre a 96 pozzetti per la misurazione fluorimetrica tasto e l'esecuzione di trasferimenti di soluzione.
- Impostare la temperatura lettore di piastre a 37 ° C.
- Per la misurazione FRET con TN-XXL, impostare la lunghezza d'onda di eccitazione di 436 ± 4,5 nm (centro ± HWHM). Impostare i filtri di emissione a 485 ± 7.5 nm per ECFP e di 527 ± 7.5 nm per citrino. Impostare il filtro di taglio di 475 e 515 nm per ECFP e citrino, rispettivamente.
- Programmare il lettore di piastre per misurare emissione a 485 nm e 527 nm ogni 4 secondi per un totale di 180 sec. Scegliere l'opzione di consegnare 50 ml dalla piastra di droga 3 volte ai 100 l nella piastra CNiFER, dopo aver raccolto 30 sec difluorescenza basale.
- Aspirare il supporto dal righe A e B e aggiungere 100 ml di ACSF al 96 pozzetti CNiFER piatto che è ~ 90% confluenti (passo 3,9).
- Caricare il 96 pozzetti CNiFER e 'di 3 volte' piastra di farmaco nel lettore di piastre. Consentire ~ 30 min per equilibrare le piastre a 37 ° C. Quindi, avviare il programma.
- Per analizzare i dati lettore di piastre, esportare i valori di fluorescenza a un foglio di calcolo. Creare una formula per sottrarre le misurazioni del fondo (adottate per ogni segnale da pozzi senza cellule) da pozzi con CNiFERs. Normalizzare intensità di fluorescenza di pre-stimolo linee di base, F citrino (t) / F citrino (basale), e calcolare il rapporto FRET (ΔR / R;. Eqn 1) con le risposte di picco a 527 nm e 485 emissioni nm (vedi punto 11 ).
Nota: Se vi è un cambiamento significativo nella ΔR / R con l'agonista, allora questo indica espressione del GPCR e si può procedere all'analisi FACS (fase 4.2). Se esimoere c'è risposta FRET con agonisti, risolvere i problemi utilizzando un Ca 2+ ionoforo, ad esempio, A21387, per testare la risposta di Ca 2+ e confermare che il sensore FRET-based sta lavorando. Se l'ionoforo funziona, quindi il recettore non era probabile espresso.
- Preparare un piatto di droga per la curva di attivazione agonista di 10 punti. Scegliere 10 diverse concentrazioni di agonista che delimitano il predetto CE 50, che possono essere determinate dalla letteratura.
- Il giorno prima FACS, preparare quattro piastre a 96 pozzetti rivestiti con fibronectina (vedi punto 3.5) per la raccolta delle cellule ordinati. Aggiungere 50 ml di terreni di crescita HEK293 e incubare O / N a 37 ° C con 5% (v / v) di CO 2.
- Preparare 5% (w / v) BSA in PBS (5 g / 100 ml) e il filtro (0,2 micron) in una bottiglia sterile.
- Raccogliere le cellule coltivate in pallone di T25 (vedere i passaggi 2,3-2,5, Tabella 2). Risospendere il pellet cellulare in 4 ml di 5% (w / v) BSA in PBS. Centrifugare le cellule a 1000 xg per 5 min.
- Aspirare media e risospendere il pellet cellulare in ~ 5 ml di 5% (w / v) BSA in PBS per dare una concentrazione finale di ~ 5 x 10 6 cellule / ml.
Nota: verificare con la FAimpianto di base CS per i requisiti specifici sulla densità cellulare e le condizioni di ordinamento. - Filtrare le cellule risospese con un colino cella di 40 micron per rimuovere i grumi. Trasferire le cellule ad un 5 ml in polipropilene tubo tondo in basso. Posizionare la provetta in ghiaccio per il trasporto alla struttura FACS.
- Ordinare le cellule HEK293 trasdotte in un impianto FACS. Programmare i parametri su un citofluorimetro FACS come segue: impostato 4 ° C per il supporto del campione, 100 micron per l'ugello e 20 psi. Sulla base delle analisi di pre-ordinare, selezionare le celle, cioè, scegliere una 'porta', che hanno una grande fluorescenza ECFP (ECFP di eccitazione, emissione ECFP) e grande FRET (ECFP di eccitazione, emissione di citrino) di fluorescenza (vedi risultati qui sotto, figura 2 ).
- Deposito individuale, cellule ordinati in una piastra da 96 pozzetti preparato al passo 4.2, con un clone per pozzetto contenente 50 ml di HEK293 terreni di crescita con puromicina. Aggiungere 50 ml di HEK293 terreni di crescita con puromicina (Table 1) per un totale di 100 microlitri per pozzetto. Mantenere cellule O / N a 37 ° C con 5% (v / v) di CO 2.
Nota: HEK293 mezzi di crescita contiene puromicina per la selezione delle cellule trasdotte.
5. la coltura e l'espansione di Ordinati, CNiFERs clonali
- Mantenere le CNiFERs nelle piastre a 96 pozzetti, eliminando 50 ml di vecchi media da ogni pozzetto e la sua sostituzione con 50 ml di terreni di crescita HEK293 fresco contenente puromicina (Tabella 1). Ripetere questo ogni 5 a 7 giorni fino a ~ 90% confluenti, dopo 2-3 settimane.
- Harvest CNiFER cellule aspirando delicatamente i media e il risciacquo una volta delicatamente con PBS. Rimuovere il PBS e aggiungere 20 ml di 0,05% (w / v) tripsina / EDTA. Incubare per 1 a 2 minuti a 37 ° C con 5% (v / v) di CO 2.
- Aggiungere 100 ml di HEK293 terreni di crescita per le cellule tripsina-trattati e risospendere le cellule. contenuti Trasferire in una piastra da 24 pozzetti contenenti 400 ml HEK293 fresco terreni di crescita with puromicina. Nel 24-pozzetti, mantenere le cellule sostituendo 250 ml di mezzi di crescita HEK293 ogni 5-7 giorni fino a quando i pozzi sono ~ 90% confluenti.
6. Identificare CNiFERs candidati Sulla base di FRET risposta utilizzando Plate Reader fluorimetrico
Nota: Con quattro piastre a 96 pozzetti seguente FACS, ci dovrebbe essere> 100 cloni verificabili che sopravvivono e si espandono per lo stadio 24-pozzetti, dal momento che molti dei cloni originali non riescono a crescere. Per identificare i potenziali candidati CNiFERs, utilizzare un analisi a 3 punti per la risposta FRET con agonisti cognate, ad esempio, la dopamina per D2R.
- Quando le cellule sono ~ 90% confluenti nella piastra 24 pozzetti, aspirare delicatamente il supporto. Aggiungere ~ 100 ml di 0,05% (w / v) tripsina / EDTA e incubare per 1-2 minuti a 37 ° C con 5% (v / v) di CO 2. Aggiungere 400 ml di HEK293 terreni di crescita per le cellule tripsina-trattati e mescolare le cellule delicatamente triturazione.
- Impostare la curva agonista a 3 punti per lo screening iniziale del clones. Per ogni clone CNiFER, cioè, uno dei pozzetti della piastra da 24 pozzetti, un'aliquota di 100 microlitri della sospensione cellulare (~ 4 x 10 3 cellule / pozzetto) in ciascuno dei tre pozzi, ad esempio, A1, A2, A3, di un 96-pozzetti fibronectina rivestite (nera con fondo trasparente) (vedi punto 3.5).
- Trasferire le restanti ~ 200 microlitri della sospensione cellulare a 12-pozzetti contenente 1,000 ml di terreni di crescita HEK293 (1,2 ml di volume finale). Incubare entrambe le piastre a 37 ° C con 5% (v / v) di CO 2, fino ~ 90% confluenti. La piastra a 96 pozzetti è per il saggio fluorimetrico e la piastra 12 pozzetti è crescita e completamento cloni.
- Per l'analisi 3 punti, determinare tre diverse concentrazioni di agonista che sono 0,1-, 1,0- e 10 volte la CE 50 per l'GPCR specifico. Preparate le concentrazioni di agonista in un piatto di droga, come descritto nei punti 4.1.1-4.1.2. Eseguire un test lettore di piastre fluorimetrico come descritto nei passaggi 4.1.3-4.1.5.
- Calcolare il FRRapporto di ET (ΔR / R) come descritto al punto 4.1.6. Scegli CNiFERs che hanno sensibilità adeguata e la più grande risposta FRET per l'espansione, congelamento indietro, e le analisi più complete (passo 7).
- Per i cloni che sono stati selezionati nella fase 6.5 e stanno crescendo in 12-pozzetti, rimuovere e sostituire 600 l di HEK293 mezzi di crescita ogni 5 a 7 giorni, fino a quando ~ 90% confluenti.
- Gradualmente espandere i cloni da una piastra 12 pozzetti ad una piastra da 6 pozzetti, e poi in un pallone T25 (punti 2.3 - 2.6 e Tabella 2). Quando il pallone T25 è ~ 90% confluenti, Celle di raccolta come descritto (punti 2.3-2.5). Risospendere il pellet di cellule in 5 ml di terreni di crescita HEK293.
- Aggiungere 1 ml di sospensione cellulare in un pallone T75 con 9 ml di terreni di crescita HEK293. Utilizza i restanti 4 ml di sospensione cellulare per crioprotezione e stoccaggio in N 2 liquido (passi 8,2-8,3). Preparare otto 1,5 ml CryoTubes e disporli sul ghiaccio.
- Nella beuta T75, mantenere le cellule sostituendo il materiale wesimo fresco mezzi di crescita HEK293, ad esempio, 10 ml ogni 3-5 giorni fino a 70-80% confluenti, dopo ~ 1-2 settimane.
7. selezione finale dei CNiFER cloni Utilizzando Plate Reader fluorimetrico
- Il giorno prima del test lettore di piastre:
- Celle di raccolta da un pallone confluenti T75 ~ 90% (vedere i passi 2,3-2,6, tabella 2). Seeding di una piastra di fibronectina rivestite 96 pozzetti (nera con fondo trasparente) a 5 x 10 4 / bene con ~ 100 ml di sospensione cellulare. Nota: Un clone è distribuito in un'unica piastra da 96 pozzetti.
- Preparare un piatto di droga per lo screening completo di cloni CNiFER, distinguendo le risposte agonisti specifici da non specifiche risposte CNiFER.
- Per generare una curva piena dose-risposta, scegliere 10 diverse concentrazioni di agonista in tutto il predetto CE 50. Utilizzare due pozzetti per "no cellule e due pozzi per 'ACSF'.
- Per determinare le risposte non specifiche, scegliere thrconcentrazioni ee di 12 diversi neurotrasmettitori o modulatori (72 pozzetti) (Figura 3). Come l'agonista, la piastra farmaco contiene concentrazioni di 3 volte in duplicato. Ad esempio, 100 ml di tre diverse concentrazioni di acetilcolina, glutammato, orexina, VIP, l'adenosina, la serotonina, noradrenalina, GABA, sostanza P, la melatonina, somatostatina e l'istamina, ciascuno in concentrazione di 3 volte di 50, 1.000, e 3.000 nm vengono caricati nella piastra droga 96 pozzetti.
- Impostare i parametri sulla lettore di piastre fluorimetrico per la misurazione tasto e l'esecuzione di trasferimenti di soluzione, come descritto nei punti 4.1.3-4.1.5.
- Per analizzare la curva dose-risposta completa, calcolare il rapporto di picco FRET (ΔR / R) (fase 4.1.6), la trama in funzione della concentrazione agonista log e in forma con l'equazione Hill (passo 11.4). Determinare la CE 50, coefficiente di Hill, e il rapporto di FRET massima. Per il 12 altri neurotrasmettitori / modulatori, la trama di picco ΔR / R in funzione oconcentrazione di farmaco f.
- Scegli cloni ~ 10 CNiFER che hanno un grande rapporto di FRET, un EC appropriata 50 per l'agonista cognate, e poca o nessuna risposta per altri agonisti neurotrasmettitori (risposta non specifica).
Cloni CNiFER 8. Fermo-back selezionati
- Utilizzare un pallone confluenti T75 ~ 90% di un individuo clone di CNiFER. Celle di raccolta come descritto (passi 2,3-2,5, Tabella 2). Per le cellule congelamento, risospendere il pellet di cellule in 5 ml di terreni di crescita HEK293. Etichetta dieci 1,5 ml CryoTubes e impostare su ghiaccio.
- Per crioprotezione, mescolare celle 1: 1 con il 20% (v / v) DMSO in HEK293 terreni di crescita, ad esempio, 5 ml di 20% (v / v) della miscela DMSO / media viene delicatamente miscelati con 5 ml di sospensione cellulare (finale concentrazione di DMSO è 10%).
- Aliquotare 1 ml in ciascuna delle cryotubes. Congelare tubi con celle di una -80 ° C freezer O / N, in una scatola di schiuma isolante (vedi Materiali). Trasferimento CryoTubes di sapone liquidazoto id per la conservazione a lungo termine.
9. CNiFER impianto in mouse Cortex
- Sterilizzare tutti gli strumenti chirurgici in autoclave prima dell'intervento chirurgico. Preparare un campo semi-sterili per la chirurgia strofinando con etanolo al 70% e che stabilisce un pannolino pulito laboratorio.
- Preparare l'iniezione pipetta CNiFER tirando un capillare di vetro (id dello 0,53 mm) su un estrattore elettrodo verticale. Utilizzare un paio di no. 5 pinze fine-tip per rompere la punta dell'elettrodo ad un diametro di ~ 40 micron.
Nota: Questo si realizza meglio al microscopio zoom stereo con un reticolo. - Anestetizzare un adulto (giorno postnatale 60-90) C57BL / 6 mouse con isoflurano: 4% (v / v) per l'induzione e l'1,5 al 2,0% (v / v) per la manutenzione. Utilizzare la coda o pizzico punta a fare in modo che il mouse è completamente anestetizzato.
Nota: Re-pinch e valutano periodicamente baffo contrazioni durante un intervento chirurgico per rivalutare profondità dell'anestesia. - Coprire gli occhi con pomata oftalmica di pessiccazione revent. Montare il mouse in un telaio stereotassico con barre per le orecchie. Mantenere la temperatura corporea del mouse a 37 ° C usando un tampone di calore regolata da una sonda rettale.
- Radere una superficie di circa 5 mm di 12 mm con un rasoio elettrico degli animali. Applicare Betadine seguita da 70% (v / v) isopropanolo. Utilizzare una lama di bisturi per tagliare e rimuovere la pelle sopra la superficie del cranio. Utilizzare una lama di bisturi per rimuovere il periostio dalla superficie del cranio. Esporre e pulire la superficie del cranio, come descritto per la chirurgia stereotassica 11.
- Abbassare una pipetta di vetro vuota bregma e registrare antero-posteriore (A / P) e medio-laterale (M / L) coordinate. Riferendosi alle atlas cervello di topo, calcolare la posizione del sito di iniezione. Spostare la pipetta al sito di destinazione e segnare il cranio per la successiva formazione della finestra. Vedere Cetin et al. Per i dettagli su iniezioni stereotassica con roditori 11.
Nota: Il sito di iniezione e finestra dipendono dal regione da studiare e la distribuzione di neurotrasmettitori peptidici o rilasciando proiezioni nella corteccia. Per esempio, in una recente pubblicazione 7, coordinate stereotassica +1.0 a 2,0 millimetri A / P e +1.0 a 2,0 millimetri M / L sono stati utilizzati per iniettare cellule CNiFER nella corteccia frontale per l'imaging in vivo del rilascio di dopamina durante condizionamento classico . - Formare a 2 mm x finestra assottigliato-teschio 3 millimetri come descritto in precedenza 12,13.
Nota: L'osso nella finestra dovrebbe avere uno spessore di 15-20 micron. Le piccole macchie bianche nel midollo non devono essere visibili quando la superficie del cranio è inumidito, se l'osso è sufficientemente diluito 12,13. - Inserire un ACSF imbevuta spugna sulla finestra per mantenerlo umido durante la preparazione delle cellule da iniettare.
- Raccolto il clone CNiFER che è stato coltivato in un pallone T75 al ~ 80% di confluenza. Aspirare i media e lavare le cellule con PBS sterile.
Nota: tripsina è omesso per questi passaggi. - Rimuovere PBS e utilizzare 10 ml of ACSF per staccare le cellule dal fondo del pallone. cellule Triturare a dissociarsi grumi di cellule. Centrifuga e risospendere il pellet in 100 ml di ACSF. Centrifugare per 30 sec a 1.400 xg e rimuovere il surnatante, lasciando una pallina ricoperta di ACSF. Questa fase lascia un grumo di cellule in sospensione.
- Backfill la pipetta di iniezione preparato al punto 9.2 con olio minerale, caricare la pipetta su un nanoinjector, e far avanzare lo stantuffo per espellere una piccola goccia di olio. Mettere 5 ml di sospensione cellulare CNiFER su una striscia di pellicola di paraffina plastica vicino la preparazione del mouse. Elaborare sia i CNiFERs o controllare le cellule CNiFER nella pipetta tirato.
- Spostare la pipetta al bersaglio coordinate X e Y, cioè, A / P e M / L ha osservato al punto 9.5. Abbassare la pipetta, perforando il cranio assottigliata, e continuano a ~ 200-400 micron al di sotto della superficie del cranio, di depositare le cellule CNiFER a strati 2/3 della corteccia.
- Iniettare ~ 4.6 nl delle cellule CNiFER presso il sito più profondo con il nanoinjector, il movimento nota nell'interfaccia del petrolio e delle cellule e quindi attendere per 5 minuti per le celle a dispensare. Ritirare la pipetta ~ 100 micron e iniettare un altro ~ 4.6 nl delle cellule CNiFER, attendere 5 minuti. Poi ritirare la pipetta lentamente e delicatamente per impedire il riflusso delle CNiFERs. Ripetere iniezione in uno o più siti adiacenti.
- Iniezione Ripetere i passaggi 9,8-9,12 con il controllo HEK293 cellule (ad esempio, HEK293 / TN-XXL / G qi5 clone manca GPCR). Separare il CNiFER e controllare i siti di iniezione delle cellule di ~ 200 micron.
- Dopo aver completato implantologia cellulari, sciacquare la finestra assottigliato-teschio con ACSF e attendere che il cranio si asciughi. Applicare una goccia di colla di cianoacrilato (vedi Materiali) sopra la finestra e inserire rapidamente un vetro di copertura pre-taglio sterile in cima alla colla. Spingere delicatamente il vetro di copertura contro il cranio per alcuni secondi. Lasciate asciugare la colla per 2 min 12,13.
- Sigillare i bordi del vetro di copertura con cemento dentale e la forma awell intorno alla finestra per contenere l'acqua per l'obiettivo immersione.
- Per immobilizzare la testa del mouse durante l'imaging, allegare un testa-bar su misura con una piccola goccia di colla cianoacrilato dietro la finestra (vedi 14 per i dettagli sulle dimensioni e materiali). Lasciate asciugare la colla a fondo e quindi aggiungere cemento dentale supplementare per rafforzare ulteriormente la testa-bar su misura.
- Coprire il resto della superficie del cranio, tranne per la finestra, con uno strato di cemento dentale. Assicurarsi che i bordi della pelle sono coperti da cemento e lasciare asciugare per 20 min.
- Dopo l'intervento chirurgico, smettere di amministrazione isoflurano e lasciare il mouse su una piastra elettrica in una gabbia fino a quando non recupera completamente dall'anestesia. Iniettare 5% (w / v) di glucosio in soluzione salina (sc) per la reidratazione e 0,05 a 0,1 mg / kg buprenorfina (ip, rilascio immediato) per analgesia post-operatoria.
Nota: Per ridurre al minimo il potenziale reazione immunologica alle CNiFERs umani, iniettare il mouse al giorno con 20 l / 100 g Cyclosporine (ip) a partire dal giorno prima iniezione di CNiFERs. - Ritorna il mouse per sua gabbia casa per cibo e acqua.
10. imaging in vivo di CNiFER cloni
Nota: immagini dal vivo è condotto con i topi utilizzando un microscopio a due fotoni e un apparato di testa fissa. Nessuna anestesia è necessaria durante le sessioni di imaging. Quando l'imaging animali in stato di veglia, limitare poggiatesta a solo poche ore alla volta per ridurre i livelli di stress. Rispedire l'animale ad esso gabbia a casa tra le sessioni di imaging per il cibo e l'acqua. lo stress potenziale è ridotto al minimo scurendo le luci della stanza e che circonda parte del mouse in un recinto.
- Il giorno dopo l'intervento chirurgico, montare il mouse su una piattaforma di imaging avvitando la testa barra di metallo impiantato sul cranio al telaio testa-fissazione.
Nota: Quando l'imaging topi svegli, la sessione di imaging non deve superare un paio d'ore a causa del potenziale stress indotto dal dispositivo poggiatesta. - Posizionare la piattaforma di imaging con il mouse testa trattenuto in un microscopio a due fotoni di imaging dotato di 10 volte (0,30 NA) e 40x (0.80 NA) obiettivi immersione acqua.
- Inserire cubo di filtro per l'imaging FRET (ECFP e citrino) che ha uno specchio dicroico a 505 nm e filtri passa-banda che si estendono su 460 nm a 500 nm per misurare ECFP e 520 nm a 560 nm per misurare citrino.
- Aggiungere ACSF alla finestra assottigliato-teschio pozzetto contenente e abbassare l'obiettivo ad immersione acqua nel ACSF. Utilizzare l'oculare in combinazione con lampada al mercurio e il cubo filtro GFP per localizzare la superficie della corteccia e vascolare sotto la finestra.
Nota: Il modello del sistema vascolare aiuta a localizzare e l'immagine stessa regione nel corso del giorno ripetute di imaging. Passare l'obiettivo immersione in acqua 40X per individuare CNiFERs dalla messa a fuoco manuale sulla superficie della corteccia sulle celle che utilizzano il cubo filtro di GFP e una lampada al mercurio. - Impostare per l'imaging a due fotoni. Selezionare l'appercorso della luce le anche in due fotoni di imaging. Per un sistema commerciale tipico, utilizzare il software per passare alla modalità di imaging a due fotoni e reindirizzare la luce per i tubi fotomoltiplicatori (PMT) nei rivelatori non descanned. Accendere il prossimo laser pulsato a femtosecondi a infrarossi, selezionare una lunghezza d'onda di 820 nm e un livello di potenza di 5-15%. Nota: Potenza 5% fornisce tipicamente ~ 25 mW a campione.
- Impostare la tensione PMT1 & PMT2 vicino al valore massimo, tipicamente 700-1.000 V seconda PMT. Impostare il guadagno di 1 per ogni canale e azzerare la posizione z per l'obiettivo.
- Abbassare l'obiettivo ~ 100 a 200 micron dalla superficie corticale e avviare la scansione xy. Regolare la potenza del laser, il guadagno e la tensione PMT per ciascun canale, cioè, ECFP e citrino, per ottimizzare il rapporto segnale-rumore della fluorescenza CNiFER.
- Utilizzare la funzione di zoom nel software per limitare l'immagine di una regione che contiene le cellule CNiFER così come un backgrounregione d. Utilizzare una velocità di scansione non più lento di un fotogramma ogni 2 secondi (0,5 Hz) a 4 ms per pixel. Regolare la linea media per adatto rapporto segnale-rumore, ad esempio, la linea di Kalman 2 media.
- Disegnare una regione-di-interesse (ROI) intorno cellule CNiFER, circostante circa 3 a 4 celle per piano. Impostare analisi in tempo reale di ROI dell'intensità media. Inizia acquisizione di monitorare CNiFER fluorescenza nel tempo.
- Raccogliere la fluorescenza da CNiFERs prima e durante le manipolazioni sperimentali, ad esempio, la stimolazione elettrica, di stimolazione ChR2, di comportamento, come determinato da parte dell'utente.
- Quando l'esperimento di imaging è stata completata, riportare il mouse per sua gabbia casa. Ripetere la immagini attraverso giorni, se lo desideri. Quando re-imaging delle cellule fare riferimento all'immagine vascolarizzazione basso ingrandimento precedentemente acquisito per orientare di nuovo allo stesso campo di imaging (passo 10.4).
Nota: CNiFERs impiantati possono essere esposte per almeno 7 giorni.
Analisi 11. Dati
- i file di immagini e selezionare Apri ROI per CNiFERs e un ROI per lo sfondo. Seleziona 'analisi delle serie' per entrambi i canali di ogni ROI. Export intensità media di fluorescenza per ogni ROI come file delimitato da tabulazioni.
- Utilizzare un software matematico (vedi Materiali) programma per analizzare i valori di fluorescenza. Filtro passa-basso (0,3 Hz) ogni segnale e quindi sottrarre la fluorescenza di fondo in ogni ROI da ECFP e citrino intensità di fluorescenza.
- Calcolare la fluorescenza media basale e calcolare coefficienti come descritto nell'equazione 1 per misurare il rapporto di ΔR FRET (t) / R.
- Per determinare la sensibilità di CNiFERs, tracciare il rapporto FRET in funzione della concentrazione log agonisti. Montare con l'equazione Hill per determinare la EC50 e Hill coefficiente (n), usando un software statistico scientifica e Hill Equation (Equazione 2).

Risultati
Un CNiFER è derivato da una cellula umana embrionali renali (HEK293) che è progettato per esprimere stabilmente almeno due proteine: una specifica proteina G recettori accoppiati (GPCR) e geneticamente codificato sensore [Ca 2+], TN-XXL. TN-XXL subisce Fluorescence Resonance Energy Transfer (FRET) tra il ciano e giallo fluorescenti proteine, rispettivamente ECFP e citrino,, in risposta a Ca 2+ ioni 6,15. Attivazione GPCRs che coppia a endogeno G q proteine G innescare un aumento citosolico [Ca 2+] attraverso il PLC / IP 3 pathway, portando ad un aumento FRET dalla 2+ rivelatore TNXXL Ca (Figura 1).
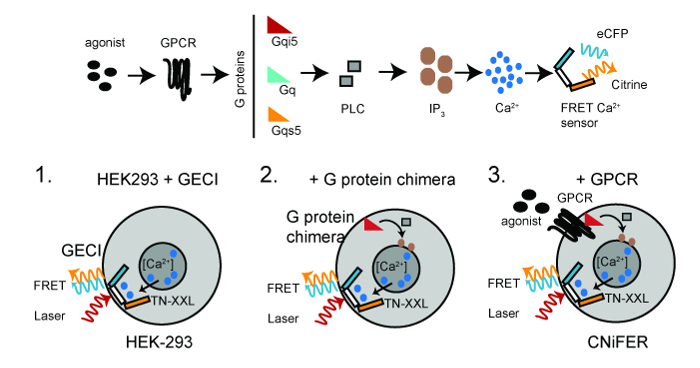
Figura 1:. Schema per CNiFERs in via di sviluppo superiore, GPCR-Ca 2+ via di segnalazione necessaria per la creazione di uncell CNiFER. In basso, i passaggi fondamentali per la costruzione di CNiFERs utilizzando cellule HEK293. Fase 1. trasdurre con geneticamente codificato FRET-based Ca 2+ -detector (TN-XXL). Fase 2. trasdurre Gα chimera G-proteine, cioè, QS5 G, qi5 G, se necessario. Fase 3. trasdurre GPCR unica per creare CNiFER. A due fotoni luce di eccitazione (rossa) eccita ECFP, che subisce FRET, producendo sia un'emissione ECFP (ciano) ed emissione citrino (giallo). Si prega di cliccare qui per vedere una versione più grande di questa figura.
L'aumento FRET fornisce una rapida lettura ottica dalla variazione dei livelli di neurotrasmettitori. Per sviluppare un CNiFER per un particolare tipo di neurotrasmettitore, prima di determinare il tipo di proteina G che accoppia alla GPCR. Per G q GPCR -coupled, il GPCR utilizza proteine G q endogeno espressi inHEK293 cellule. Per G I / O -coupled GPCR, una linea HEK293 clonale viene creato che esprime una proteina G chimerica che reindirizza il GPCR al G q -PLC / IP 3 percorso. Ciò si ottiene con una proteina G chimerica, qi5 G, che contiene principalmente Gα sequenza q e cinque aminoacidi della carbossile terminale G i. Questi cinque aminoacidi sono sufficienti per G qi5 di comunicare con G I / O -coupled GPCR, ma il segnale attraverso la q via G. Per G s GPCR -coupled, una chimera QS5 G viene utilizzato 10. La strategia generale per produrre un CNiFER è di: 1) creare una cellula clonale HEK293 che è stabilmente esprimendo un rilevatore ottico Ca 2+, cioè, TN-XXL, utilizzando una trasduzione lentivirus di cellule HEK, 2) esprimono stabilmente una chimera proteina G , se necessario, nel clone cellulare HEK293 che esprimono TN-XXL, e 3) creare un GPCR clone che esprime stabilmente nella cellula HEK293clonare esprimendo TN-XXL e la proteina G chimerica. La linea HEK293 clonale che manca la GPCR, ma ha la TN-XXL e proteine G chimerica serve come il 'controllo CNiFER'. Il controllo CNiFER è necessario per confermare che la risposta CNiFER è dovuto specificamente all'attivazione dei recettori ingegnerizzati, cioè, D2R, e non a attivazione di altri recettori endogenamente espressi in cellule HEK293.
Per generare lentivirus, un sistema di espressione lentivector viene utilizzato, ad esempio, pCDH-CMV-MCS-EF1-Puro, che contiene gli elementi genetici responsabili di imballaggi, trasduzione, stabile integrazione dell'espressione virale costruire nel DNA genomico, e l'espressione del bersaglio sequenza genica. Per produrre un alto titolo di particelle virali, espressione e vettori di imballaggio sono transitoriamente co-trasfettato in cellule di mammifero produttori e il virus viene raccolto. Ci sono diverse strutture di base virali negli Stati Uniti che possono generare alta TI ter lentivirus. A seguito di infezione di cellule HEK293, il gene Puro offre resistenza agli antibiotici per l'identificazione di cellule HEK293 trasdotte.
Per identificare linee clonali specifici, trasdotte cellule HEK293 sono ordinati utilizzando una fluorescenza attivato cell sorting system (FACS). L'obiettivo è quello di isolare un clone che contiene un alto livello di espressione di Ca 2+ rivelatore FRET-based e la capacità di subire FRET. In questo esempio di analisi FACS, la fluorescenza dell'emissione ECFP è tracciata contro il segnale FRET (ECFP eccitazione ed emissione Citrine). Le scatole segnano regioni (P2 e P3) che verranno successivamente selezionati ( "gated") per l'ordinamento in piastre da 96 pozzetti (Figura 2). In generale, circa quattro piastre a 96 pozzetti sono sufficienti per lo screening per la creazione di successo di CNiFERs. Da questi 4 piastre, circa 100 cloni sono adatti per fluorimetrica analisi lettore di piastre.
e_content "fo: keep-together.within-page =" 1 ">
Figura 2: Esempio di analisi FACS Un esempio dell'output seguente analisi FACS.. Le trame grafico ECFP emissione ( "475/20-A") in funzione delle emissioni citrino ( "FRET V-530/30-A"), utilizzando ECFP di eccitazione per ogni cella. Regioni P2 e P3 aree spettacolo selezionati, vale a dire, gated, per l'ordinamento in singole cellule. I colori sono arbitrarie. Cliccate qui per vedere una versione più grande di questa figura.
Una volta che le cellule ordinati sono cresciuti a densità sufficiente, la risposta FRET dopo l'attivazione agonista viene determinato utilizzando un sistema di lettore di piastre a 96 pozzetti fluorimetrica dotato di movimentazione soluzione. Per restringere il numero di cloni per studiare, una curva di agonisti "3 punti" viene utilizzato per lo screening ~100 cloni e selezionare CNiFERs con le migliori risposte. Circa 10 cloni sono poi analizzati ulteriormente con determinazione del completo dose-risposta con l'agonista cognate, e le risposte non specifiche, sondato con 12 altri neurotrasmettitori o modulatori. Una piastra di droga 96 pozzetti viene preparato come triplice concentrazione (concentrazione finale viene diluito 1: 3 in lamiera) di farmaci (ad esempio, agonisti, antagonisti, etc.) in ACSF. In questo esempio, una piastra farmaco è impostato per testare un D2 CNiFER con il suo agonista cognate, dopamina, e potenziali risposte non specifiche con una varietà di altri agonisti neurotrasmettitori e peptidi (Figura 3). La spina dorsale CNiFER, che manca il GPCR, serve come un controllo importante per il CNiFER appena creato.
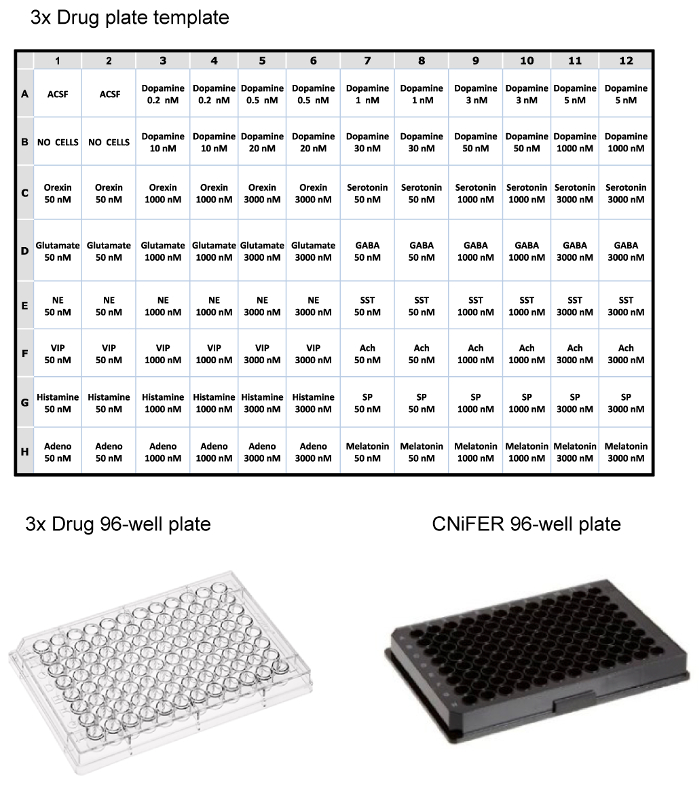
Figura 3:. Esempi di layout per 96 pozzetti superiore, mensa del Layout per il caricamento di un piatto di droga 3x per lettore di piastre fluorimetrica, usando concentrazioni triplice vari neurotrasmettitori e peptidi. In basso, esempi di plastica trasparente 96 pozzetti di droga e nero piastra a 96 pozzetti per la semina CNiFERs e misurando in lettore di piastre. Cliccate qui per vedere una versione più grande di questa figura.
La stimolazione del GPCR dovrebbe aumentare la risposta FRET, come conseguenza di una elevazione di intracellulare [Ca 2+] e il rilevamento da TN-XXL. In queste condizioni, FRET è prodotto da ECFP e citrino avvicinarsi, in modo che l'eccitazione di ECFP produce una minore emissione di ECFP e più grandi emissioni citrino. In questo esempio, l'eccitazione viene impostato a 436 nm e filtri di emissione sono impostati a 485 ± 7,5 nm per ECFP e 527 ± 7,5 nm per citrino (Figura 4). Trenta secondi di Baseline fluorescenza viene misurata e poi 50 microlitri dal agonisti "triplice" in lamiera ACSF è consegnato a ciascun pozzetto contenente 100 microlitri ACSF (diluizione 1: 3). ECFP e fluorescenza emissione citrino sono misurati ogni 3,8 secondi per 180 sec. misure di sfondo vengono prelevati da pozzi senza cellule e sottratti, se necessario. intensità di fluorescenza sono normalizzati linee di base pre-stimolo (F (t) / F (basale)), e le risposte di picco sono misurati per calcolare il rapporto FRET (ΔR / R) usando l'F (t) / F (basale) del 527 nm e 485 nm canali (Equazione 1). Una curva dose-risposta viene costruita tracciando il rapporto FRET in funzione di diverse concentrazioni di agonista e forma con l'equazione Hill per determinare la EC50 e coefficiente di Hill (Figura 5) (Equazione 2). Un ottimale CNiFER presenta un grande rapporto di tasto e un EC appropriata 50 per l'agonista cognate, e mostra poca o nessuna risposta ad altri neurotransmitagonisti ter. Al contrario, il controllo CNiFER dovrebbe mostrare poca risposta alla agonisti cognate.
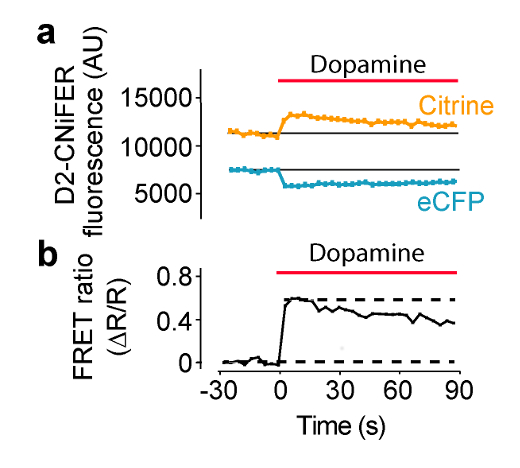
Figura 4: Esempio di risposta FRET risposta D2R CNiFER FRET agonista-indotta misurata su un lettore di piastre con un sistema di soluzione di consegna.. (A) Un diagramma della risposta FRET, vale a dire, ECFP eccitazione con ECFP e citrino emissioni, durante l'applicazione di dopamina (barra rossa) a D2 CNiFERs. Si noti che diminuisce le emissioni ECFP mentre citrino aumenti delle emissioni con agonisti (dopamina). (B) Una trama del rapporto FRET (Equazione 1) per la risposta in (A) Figura modificata da Muller et al., 2014 7. Clicca qui per vedere una versione più grande di questa figura.
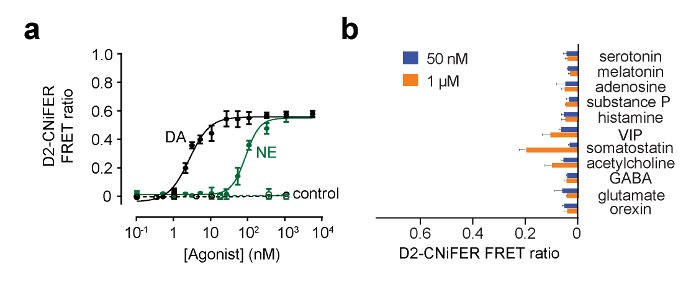
Figura 5:. Esempi di curve dose risposta per D2 CNiFER (A) Dose curve di risposta per la risposta di D2 CNiFERs di dopamina (DA, nero) e per la noradrenalina (NE, verde). Inoltre, viene mostrata la risposta del CNiFERs "controllo" manca il D2R. (B) Il grafico a barre mostra la risposta rapporto di FRET per altri neurotrasmettitori e modulatori a 50 nm e 1 micron. I valori sono media ± SEM. Figura modificata da Muller et al., 2014 7. Clicca qui per vedere una versione più grande di questa figura.
cloni CNiFER possono essere valutate ulteriormente per un possibile desensibilizzazione del recettore-dipendente e per la loro risoluzione temporale, discriminando la presentazionedi due diversi impulsi agonisti (per i dettagli, vedere Muller et al., 2014 7). Dopo aver costruito un clone CNiFER, il passo successivo è quello di testare la sua funzione in vivo. Per monitorare la fluorescenza in vivo, è necessario utilizzare un microscopio a due fotoni. Dopo aver preparato una finestra assottigliato-teschio, CNiFERs vengono caricati in una pipetta di vetro e iniettato in strati 2/3 della corteccia. Il mouse viene poi preparato per l'imaging in vivo collegando un vetrino di vetro al cranio assottigliata, e impiantare un bar testa per il fissaggio alla testa durante l'imaging (Figura 6).
Per determinare che i CNiFERs impiantati sono vitali in vivo, concentrazioni note di agonisti possono essere iniettati nei pressi del sito di impianto e il rapporto FRET determinate 7. Per convalidare ulteriormente l'attività di CNiFERs impiantati, stimolando i neuroni di ingresso dovrebbe essere esaminato. Ad esempio, con il D2 CNiFER, l'effetto dila stimolazione elettrica dei neuroni dopaminergici mesencefalo che proiettano alla corteccia è stata esaminata. Un bipolare 0,1 MW tungsteno stimolante elettrodo con una separazione punta di 500 micron è stato impiantato nella substantia nigra (-3,2 mm A / P, -1.3 mm M / L, -4.4 mm D / V). La Figura 6 mostra un esempio di elettricamente stimolando substantia nigra a diverse intensità e osservando l'aumento del rapporto FRET per D2 CNiFERs 7. Si noti che (ip) iniezione sistemica intra-peritoneale di un antagonista del recettore D2, eticlopride (1 mg / kg), blocca la risposta D2 CNiFER. D'altra parte, l'iniezione di cocaina (15 mg / kg), che blocca la ricaptazione della dopamina, migliora la evocata elettricamente risposta D2 CNiFER 7.

Figura 6: Esempio di D2 CNiFER risposta che ho ong> n Vivo in seguito a stimolazione elettrica di sostanza nera. (A) Una vignetta mostra un mouse testa fissa preparato per l'imaging in vivo due fotoni e la stimolazione elettrica. A due fotoni di luce (rossa, 820 nm) per l'eccitazione e 475 nm di emissione per ECFP (blu) e 530 nm di emissione per citrino (verde). (B) Il grafico lineare mostra la proporzione FRET per D2 CNiFER iniettato nella corteccia dopo stimolazione elettrica della substantia nigra, cioè, 200 msec impulsi di 50 a 300 iA a 50 Hz per 500 msec e seguenti stimolazione elettrica in presenza di un D2R antagonista (eticlopride) o cocaina. Figura modificata da Muller et al., 2014 7. Clicca qui per vedere una versione più grande di questa figura.
ftp_upload / 53290 / 53290table1.jpg "/>
Tabella 1: Elenco dei prodotti chimici e reagenti per rendere il terreno di coltura HEK293 e ACSF.

Tabella 2: Volumi per le celle di raccolta di diverse piastre Dimensioni la cultura o fiaschi.
Discussione
La creazione di CNiFERs fornisce una strategia innovativa e unica per misurare otticamente rilascio di neurotrasmettitori nel cervello in vivo. CNiFERs sono ideali per misurare il rilascio extrasinaptica, vale a dire, il volume di conduzione, per neurotrasmettitori. È importante sottolineare che ogni CNiFER possiede le proprietà del GPCR nativa, fornendo una misurazione ottica fisiologica dei cambiamenti nei livelli di neurotrasmettitori nel cervello. Fino ad oggi, sono stati creati per la rilevazione CNiFERs acetilcolina (M1-CNiFER) 6, la dopamina (D2-CNiFER) 7 e noradrenalina (tipo a1A-CNiFER) 7.
In linea di principio, un CNiFER può essere creato per ogni neurotrasmettitore che segnala attraverso un GPCR. Per il caso in cui i segnali GPCR attraverso G q proteine G, è necessaria alcuna ulteriore modifica al cellulare HEK293. GPCRs che segnalano attraverso G di I / O, tuttavia, richiedono coexpression di un qi5 G proteina G chimericaper accoppiare il GPCR al G q / PLC pathway 7,10. Allo stesso modo, GPCR che segnalano attraverso G s richiederanno coexpression di una chimerica proteine G QS5 G 10. Una volta completato, ogni clone CNiFER è schermato e solo quei cloni CNiFER che hanno un'affinità paragonabile al recettore nativo, presentano poco o nessun desensibilizzazione e fornire un rapporto segnale-rumore che è adeguata per misurare con in vivo microscopia a due fotoni, vengono selezionati per gli studi in vivo.
Per gli studi in vivo, si raccomanda di trattare i topi con ciclosporina per ridurre al minimo qualsiasi potenziale risposta immunologica. C'è la possibilità di rigetto o una risposta immunologica con impiantando cellule CNiFER umane nel cervello dei roditori. Questo è stato studiato in precedenza esaminando l'espressione di GFAP e MAC1 7, dopo CNiFER impianto. CNiFERs non sembra produrre cicatrici gliali o genera alcun signisignifi- MAC1 colorazione 7.
Due questioni importanti da considerare nella costruzione CNiFERs sono la sensibilità e la desensibilizzazione. Se la CE 50 è troppo elevata, cioè, bassa affinità, rispetto al recettore nativo, allora il CNiFER non può avere sensibilità sufficiente per rilevare rilascio di neurotrasmettitori in vivo. Una soluzione è quella di sottoporre a nuovi controlli cloni e scegliere un diverso clone di CNiFER che ha maggiore affinità. Una strategia alternativa potrebbe essere quella di provare altri tipi di geneticamente codificati fluorescenti Ca 2+ -detectors che possono avere un più alto Ca 2+ sensibilità che possono spostarsi l'EC 50 per l'attivazione GPCR. Poiché il disegno CNiFER è modulare, è facilmente adattato ad altri tipi di geneticamente codificati Ca 2+ -detectors, come GCaMP 16. Isolando cloni CNiFER con lo stesso recettore ma differenti CE 50 s potrebbe essere vantaggioso per estendere la gamma dinamica di rilevare rilascio di neu endogenarotransmitters in vivo.
Desensibilizzazione del CNiFER anche limitarne l'uso in vivo. Se la risposta di picco diminuisce gradualmente con ogni impulso di agonisti, allora il recettore può essere desensibilizzazione. In questo caso, esaminare altri cloni e determinare se essi rispondono allo stesso modo. Modifiche alla sequenza di acido recettore amino, o l'uso di un altro sottotipo di recettore può essere necessario per affrontare la desensibilizzazione agonista-dipendente. Se vi sono siti di fosforilazione acidi o amminoacidi noti identificati che associano G recettori proteina chinasi (GRKs), sarebbe opportuno costruire una variante non-desensibilizzazione del GPCR mutando uno o più siti. Il meccanismo di desensibilizzazione deve essere determinato per ciascun recettore caso per caso.
Finora, CNiFERs sono stati impiantati solo in strati superficiali della corteccia 6,7, a causa di limitazioni spettroscopiche con fluorofori di imaging con mi a due fotonimicroscopia 17,18. In futuro, potrebbe essere possibile adattare la tecnologia CNiFER con le misurazioni a base di fibre di fluorescenza 19 in modo che CNiFERs può essere impiantato nelle regioni cerebrali sottocorticali.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo B. Conklin (University of California, San Francisco) per fornire i qi5 G e G QS5 cDNA, A. Schweitzer per l'assistenza con l'elettronica, N. Taylor per l'assistenza con lo screening di cloni, Ian Glaaser e Robert Rifkin per correzione di bozze , e Olivier Griesbeck per TN-XXL. Questo lavoro è stato sostenuto da borse di ricerca attraverso l'Istituto nazionale degli Stati Uniti on Drug Abuse (NIDA) (DA029706; DA037170), l'Istituto Nazionale di Biomedical Imaging e Bioingegneria (NIBIB) (EB003832), Hoffman-La Roche (88610A) e il "Neuroscience correlati alla droga di concessione di abuso "formazione attraverso NIDA (DA007315).
Materiali
| Name | Company | Catalog Number | Comments |
| pCDH-CMV-MCS-EF1-Puro | System Biosciences | CD510B-1 | Cloning: for generating lentivirus |
| 12 x 75 *BD Falcon High Clarity Polypropylene Round Bottom Test Tube | BD Biosciences | 352063 | FACS |
| BD 40 um Falcon cell strainers | BD Biosciences | 352340 | FACS |
| 0.05% Trypsin EDTA | Invitrogen | 25200056 | FACS |
| 96 Well Plate, flat bottom, clear | Corning | 3596 | FACS |
| 96 well cell culture plates | Corning | CLS3997 | Flexstation |
| Optilux black clear bottom | Corning | 3603 | Flexstation |
| Flexstation pipet tips | Molecular Devices | 9000-0911 | Flexstation |
| Acetylcholine Chloride | Sigma-Aldrich | A2661 | Flexstation |
| Norepinephrine | Sigma-Aldrich | A7256 | Flexstation |
| Dopamine Hydrochloride | Sigma-Aldrich | PHR1090 | Flexstation |
| GABA | Sigma-Aldrich | A2129 | Flexstation |
| Histamine | Sigma-Aldrich | H7125 | Flexstation |
| Glutamate | Sigma-Aldrich | 49621 | Flexstation |
| Epinephrine | Sigma-Aldrich | E4642 | Flexstation |
| Somatostatin | Sigma-Aldrich | S1763 | Flexstation |
| 5HT | Sigma-Aldrich | H9523 | Flexstation |
| VIP | Alpha Diagnostics Inc. | SP-69627 | Flexstation |
| Orexin A | Alpha Diagnostics Inc. | 12-p-01 | Flexstation |
| Substance P | Sigma-Aldrich | S6883 | Flexstation |
| Adenosine | Sigma-Aldrich | A4036 | Flexstation |
| Melatonin | Sigma-Aldrich | M5250C | Flexstation |
| Fluorescence Plate Reader & software | Molecular Devices | Flexstation 3 | Flexstation |
| DMEM (high glucose) with Glutamax | Life Technologies | 10569-010 | Tissue culture |
| Fetal bovine serum | Life Technologies | 10082-139 | Tissue culture |
| Pen/Strep antibiotics | Life Technologies | 15140-122 | Tissue culture |
| Puromycin | InvivoGen | ant-pr-1 | Tissue culture |
| Fibronectin | Sigma-Aldrich | F0895 | Tissue culture |
| CoolCell LX Alcohol-free controlled-rate cell freezing box | Bioexpress | D-3508) | Tissue culture |
| cyanoacrylate glue | Loctite | Loctite no. 495 | surgery and stereotaxic injection |
| plastic paraffin film | VWR | Parafilm® | surgery and stereotaxic injection |
| Nanoinjector | Drummond | 3-000-204 | surgery and stereotaxic injection |
| Glass electrodes | Drummond | 3-000-203G | surgery and stereotaxic injection |
| hand held drill | OSADA | Exl-M40 | surgery and stereotaxic injection |
| Burrs for drill | Fine Scientific | 19007-05; 19007-07) | surgery and stereotaxic injection |
| Sterilizing bath | FST | 18000-45, Hot Bead Sterilizer | surgery and stereotaxic injection |
| isoflurane chamber/mask | Highland Medical Equipment | 564-0427, HME 109 Table Top Anesthetic Machine with Isoflurane Vaporizer, O2 Flowmeter, Gang Valve; 564-0852, Induction Chamber 16X7X7.5cm | surgery and stereotaxic injection |
| 3D scope with arm | Zeiss | surgery and stereotaxic injection | |
| fiber optic light | surgery and stereotaxic injection | ||
| Betadine | surgery and stereotaxic injection | ||
| 70 % (v/v) isopropyl alcohol | surgery and stereotaxic injection | ||
| Povidone-Iodine Prep Pads | dynarex | 1108 | surgery and stereotaxic injection |
| NaCl 0.9% (injection, USP, 918610) | surgery and stereotaxic injection | ||
| CYCLOSPORINE (INJECTION, USP) | surgery and stereotaxic injection | ||
| Buprenex (injection) buprenorphine (0.03 μg per g rodent) | Sigma-Aldrich | surgery and stereotaxic injection | |
| Ophthalmic ointment | Akorn | NDC 17478-235-35 | surgery and stereotaxic injection |
| Surgifoam | Ethicon | surgery and stereotaxic injection | |
| Grip dental cement | Dentsply | #675571, 675572 | surgery and stereotaxic injection |
| Instant SuperGlue | NDindustries | surgery and stereotaxic injection | |
| LOCTITE 4041 | surgery and stereotaxic injection | ||
| METABOND | C&B | surgery and stereotaxic injection | |
| no. 0 cover glass | Fisher | surgery and stereotaxic injection | |
| stereotaxic frame | Kopf | surgery and stereotaxic injection | |
| Rectal probe and heating pad | FHC | 40-90-8D, DC Temperature Controller,40-90-2-06, 6.5X9.5cm Heating Pad40-90-5D-02, Rectal Thermistor Probe | surgery and stereotaxic injection |
| optical breadboard for imaging | Thorlabs | surgery and stereotaxic injection | |
| Mineral oil | Fisher | S55667 | surgery and stereotaxic injection |
| Kwik-Cast (Silicone elastomer) | World Precision Instruments | surgery and stereotaxic injection | |
| Suture | Ethicon | 18’’, 1667, 4-0 | surgery and stereotaxic injection |
| Scissors | Fine Scientific Tools | 91500-09, 15018-10 | surgery and stereotaxic injection |
| Forcepts | Fine Scientific Tools | 11252-30; #55, 11295-51; Grafe, 11050-10 | surgery and stereotaxic injection |
| Student Halsted-Mosquito Hemostats | Fine Scientific Tools | 91308-12 | surgery and stereotaxic injection |
| Small Vessel Cauterizer Kit | Fine Scientific Tools | 18000-00 | surgery and stereotaxic injection |
| Hot Bead Sterilizers | Fine Scientific Tools | 18000-45 | surgery and stereotaxic injection |
| Instrument Case with Silicone Mat | Fine Scientific Tools | 20311-21 | surgery and stereotaxic injection |
| Plastic Sterilization Containers with Silicone Mat | Fine Scientific Tools | 20810-01 | surgery and stereotaxic injection |
| 2P fixed-stage fluorescence scope for in vivo imaging | Olympus | FV1200 MPE | in vivo imaging |
| Multiphoton laser | SpectraPhysics | Mai Tai DeepSee | in vivo imaging |
| Green Laser | Olympus | 473 nm Laser | in vivo imaging |
| xy translational base | Scientifica | MMBP | in vivo imaging |
| FRET filter cube for YFP and CFP | Olympus | in vivo imaging | |
| 10x and 40x water immersion objectives | Olympus | in vivo imaging | |
| air table | Newport | in vivo imaging | |
| custom built light-tight cage | Thorlab | in vivo imaging |
Riferimenti
- Day, J. C., Kornecook, T. J., Quirion, R. Application of in vivo. microdialysis to the study of cholinergic systems. Methods. 23, 21-39 (2001).
- Robinson, D. L., Venton, B. J., Heien, M. L., Wightman, R. M. Detecting subsecond dopamine release with fast-scan cyclic voltammetry in vivo. Clin Chem. 49, 1763-1773 (2003).
- Liang, R., Broussard, G. J., Tian, L. Imaging Chemical Neurotransmission with Genetically Encoded Fluorescent Sensors. ACS Chem Neurosci. , (2015).
- Okubo, Y., et al. Imaging extrasynaptic glutamate dynamics in the brain. Proc. Natl. Acad. Sci. USA. 107, 6526-6531 (2010).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods. 10, 162-170 (2013).
- Nguyen, Q. T., et al. An in vivo biosensor for neurotransmitter release and in situ receptor activity. Nat Neurosci. 13, 127-132 (2010).
- Muller, A., Joseph, V., Slesinger, P. A., Kleinfeld, D. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods. 11, 1245-1252 (2014).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. , e3998(2012).
- Wang, X., McManus, M. Lentivirus production. J Vis Exp. , (2009).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Gjα. Nature. 363, 274-276 (1993).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1, 3166-3173 (2006).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. , (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7, 981-984 (2010).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32, 1277-1309 (2012).
- Yamauchi, J. G., et al. Characterizing ligand-gated ion channel receptors with genetically encoded Ca2+ sensors. PLoS One. 6, e16519(2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. 32, 13819-13840 (2012).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2, 932-940 (2005).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Cui, G., et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 494, 238-242 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon