Method Article
La construction de base de cellules fluorescentes neurotransmetteur Engineered Reporters (CNiFERs) pour la détection optique des neurotransmetteurs
Dans cet article
Résumé
Nous présentons un protocole pour créer journalistes neurotransmetteur fluorescents à base de cellules modifiées (CNiFERs) pour la détection optique de la libération de neurotransmetteurs volumétrique.
Résumé
Reporters base de cellules fluorescentes neurotransmetteur d' ingénierie (CNiFERs) fournissent un nouvel outil pour les neuroscientifiques pour détecter optiquement la libération de neurotransmetteurs dans le cerveau in vivo. Un CNiFER spécifique est créé à partir d' une cellule de rein embryonnaire humain qui exprime de manière stable un récepteur spécifique G couplé à la protéine, qui couple à G q / 11 protéines G, et un Ca 2+ -detector à base de FRET, TN-XXL. L'activation du récepteur conduit à une augmentation du signal FRET. CNiFERs ont une sensibilité nM et une réponse temporelle de secondes parce qu'un clone CNiFER utilise le récepteur natif pour un neurotransmetteur particulier, par exemple, D2R pour la dopamine. CNiFERs sont directement implantés dans le cerveau, ce qui leur permet de détecter la libération des neurotransmetteurs avec une résolution spatiale inférieure à cent um, ce qui les rend idéales pour mesurer la transmission de volume in vivo. CNiFERs peut également être utilisé pour dépister d' autres médicaments pour la réactivité croisée potentielle dans vivo. Nous avons récemment élargi la famille de CNiFERs pour inclure GPCR ce couple à G i / o protéines G. CNiFERs sont disponibles pour la détection de l'acétylcholine (Ach), la dopamine (DA) et la norepinephrine (NE). Étant donné que toute GPCR peut être utilisé pour créer un roman CNiFER et qu'il ya environ 800 GPCR dans le génome humain, nous décrivons ici la procédure générale pour concevoir, réaliser et tester tout type de CNiFER.
Introduction
Pour bien comprendre comment les neurones communiquent dans le cerveau, il est nécessaire d'avoir une méthode pour mesurer la libération de neurotransmetteurs in vivo. Il existe plusieurs techniques bien établies pour la mesure in vivo des neurotransmetteurs. Une technique couramment utilisée est microdialyse, dans laquelle une canule est insérée dans le cerveau et un faible volume de liquide céphalorachidien est recueillie et analysée par chromatographie en phase liquide à haute performance et détection électrochimique 1. Microdialyse a une résolution spatiale de l'ordre de quelques diamètres de la sonde, par exemple environ 0,5 mm pour un diamètre microsonde 200 um. La résolution temporelle de cette technique, cependant, est lente en raison des intervalles d' échantillonnage qui durent généralement environ 5 minutes ou plus 1. En outre, les analyses ne sont pas faites en temps réel. Une autre technique consiste à balayage rapide voltamétrie cyclique (FSCV), qui utilise une sonde en fibre de carbone qui est insérée dans le cerveau. FSCV a une excellente températurerésolution orale (subsecond), haute sensibilité (nanomolaire), et la résolution spatiale avec des diamètres de sonde de 5 à 30 um. Cependant, FSCV est limitée aux émetteurs qui produisent une oxydation caractéristique et le profil de réduction avec la tension sur une sonde potentiométrique de carbone 2.
Une troisième technique pour mesurer les neurotransmetteurs est directement à travers neurotransmetteurs génétiquement codés (NT) biocapteurs 3. Avec cette méthode, une protéine de fusion est créée qui contient un domaine de liaison de ligand pour un émetteur couplé à un transfert d'énergie de résonance de fluorescence (FRET) paire à base de fluorophores 4 ou 5 permuté une GFP. Contrairement aux deux procédés précédents, ces biocapteurs sont génétiquement codées et exprimées sur la surface d'une cellule hôte, telle qu'un neurone, grâce à la production d'animaux transgéniques ou aiguë avec l'utilisation d'agents viraux pour infecter des cellules. À ce jour, les biocapteurs génétiquement codés ont été seulement développé pour detecting de glutamate et de GABA 05/03. Limitations avec ces techniques ont été la faible sensibilité, dans la gamme nM, et l'incapacité à élargir la détection du grand nombre d'émetteurs, par exemple, les neurotransmetteurs classiques, neuropeptides et neuromodulateurs, qui signalent par G récepteurs couplés aux protéines (RCPG). En fait, il y a près de 800 GPCR dans le génome humain.
Pour combler ces lacunes, nous avons développé un outil innovant pour mesurer optiquement la libération de tout neurotransmetteur qui signale par un GPCR. CNiFERs (fluorescente neurotransmetteur à base de cellules rapporteurs modifiés) sont des cellules HEK293 clonales modifiées pour exprimer un GPCR spécifique qui, lorsqu'il est stimulé, provoque une augmentation intracellulaire [Ca 2+] , qui est détecté par un capteur à base de Ca 2+ FRET codé génétiquement, TN-XXL. Ainsi, CNiFERs transformer la liaison en un changement de fluorescence, en fournissant un r optique en temps réel directe et récepteur neurotransmetteuread-out de l'activité des neurotransmetteurs local. En utilisant le récepteur natif pour un neurotransmetteur donné, CNiFERs conserver la spécificité chimique, l' affinité et la dynamique temporelle des récepteurs endogènes exprimés. À ce jour, nous avons créé trois types de CNiFERs, un pour la détection de l' acétylcholine en utilisant le récepteur M1, un pour la détection de la dopamine en utilisant le récepteur D2 et une pour la détection de la norépinéphrine à l' aide du 6,7 récepteur α1a. La technologie CNiFER est facilement extensible et évolutive, ce qui rend prête à tout type de GPCR. Dans cet article JoVE, nous décrivons et illustrons la méthodologie pour concevoir, réaliser et test CNiFERs in vivo pour toute application.
Protocole
Toutes les procédures animales effectuées dans cette étude sont conformes à Institutional Animal Care et utilisation Commission (IACUC) des lignes directrices, et ont été approuvés par les IACUC à l'École Icahn de médecine Mount Sinai et l'Université de Californie, San Diego.
1. Générer GPCR exprimant lentivirus pour transformer des cellules HEK293
- Obtenir l'ADNc pour un GPCR spécifique à partir d' une source commerciale, par exemple cdna.org. En variante, amplifier le gène de GPCR à partir d'une banque d'ADNc en utilisant une PCR. Obtenir un vecteur lentivirus exprimant, comme pCDH-CMV-MCS-EF1-Puro (pCDH). Utiliser ce vecteur pour propager l'ADN ainsi que pour générer des lentivirus.
- Cloner l'ADNc de GPCR dans le vecteur de lentivirus exprimant par PCR. Voir Lorenz 8, pour plus de détails sur le sous - clonage PCR.
- Développer et purifier le pCDH-GPCR l'ADN en utilisant un 'maxi' kit de préparation sans endotoxine selon les instructions du fabricant. Vérifiez que le GPCR ADNc sous-cloné dans pCDH est mutation-libre par séquençage d'ADN.
Note: Avant de soumettre l'ADN pour la production de virus, digérer une aliquote avec une enzyme de restriction appropriée pour confirmer la taille de l'insert et de la pureté de l'ADN. - Générer lentivirus en utilisant une installation de base de virus, comme celui au Salk Institute, Université de Penn., Ou à l' Université de Caroline du Nord, etc., ou générer en interne 9. Utiliser environ 25 ug (> 1 ug / ul) d'ADN exempt d'endotoxine pour la transfection de cellules HEK dans un flacon T75. Faire en sorte que l'ADN soit d' une grande pureté, ayant un rapport d' absorbance (A 260 / A 280) de ~ 1,8.
Note: Les titres de virus ~ 10 11 -10 12 GC / ml sont optimales pour la transduction des cellules HEK293.
2. Choisir HEK293 / TN-XXL type Backbone cellulaire pour la culture in vitro
Note: Déterminer la protéine G spécificité de couplage, par exemple, G i / o, G q / 11, ou G protéines Gs, du GPCR, que ce dicTates si une protéine G chimère est nécessaire pour la CNiFER. Pour G q récepteurs -coupled, par exemple M1 récepteurs muscariniques, choisissez HEK293 / TN-XXL (# 3G8) comme l'épine dorsale HEK293 type de cellule. Pour G i / o -coupled récepteurs, la protéine G chimère G qi5 est nécessaire 10. Pour le récepteur -coupled de G, le G QS5 chimère est nécessaire 10. Dans ce protocole, la construction d'un D2R CNiFER est utilisé à titre d'exemple. Signaux D2R par G i / o protéines G et nécessite des cellules HEK293 qui expriment de manière stable la protéine chimère G, G qi5, par exemple, HEK293 / TN-XXL / G qi5 _ # qi5.6.
- Obtenir les HEK293 / TN-XXL / G qi5 _ # qi5.6 cellules clonales à partir d' un laboratoire de recherche. Note: Ce qui suit les cellules clonales, HEK293 / TN-XXL (# 3G8) pour G q -coupled récepteurs, HEK293 / TN-XXL / G qi5 (# qi5.6) G i / o -coupled récepteurs et HEK293 / TN -XXL / G QS5 (# qs5.47) pour re -coupled Gprécepteurs, sont disponibles gratuitement sur demande 6,7.
- Croître et se développer HEK293 / TN-TTG / G qi5 _ # qi5.6 à ~ 90% de confluence dans une fiole T25 avec 5 ml de milieu de croissance HEK293 (tableau 1). Cultiver les cellules dans un incubateur humidifié à 37 ° C avec 5% (v / v) de CO 2.
Remarque: Tous les travaux avec la culture de cellules HEK293 doit être effectuée en utilisant des techniques de culture de tissus stériles standard. - Récolter les cellules HEK293 d'abord par aspiration médias de T25 flacon. Laver les cellules en douceur en ajoutant 5 ml de PBS et on bascule ballon.
- Retirer le PBS et on ajoute 1 ml de 0,05% (p / v) de trypsine / EDTA (tableau 2). Incuber pendant 1 à 2 min à 37 ° C avec 5% (v / v) de CO 2.
- Recueillir les cellules et transfert à stériles 15 ml tube conique. Centrifuger pendant 5 min à 1000 x g dans une centrifugeuse de culture cellulaire. Aspirer le surnageant.
- Remettre en suspension le culot cellulaire dans 5 ml de milieu de croissance HEK293. Compter les cellules à l'aide d'un hémocytomètrebleu trypan. Calculer la densité cellulaire et passez à l'étape 3.
3. Lentiviral transduction de HEK293 / TN-XXL Cellules / Gqi5
- Graine d' un flacon T25 avec 0,7 x 10 6 cellules qi5 HEK293 / TN-XXL / G. Cultiver les cellules dans un incubateur humidifié à 37 ° C avec 5% (v / v) de CO 2 jusqu'à ~ 50% de confluence, après environ 1 jour. Geler les cellules restantes (étapes 8.2-8.3). Ces cellules serviront de contrôle CNiFER, à savoir, un CNiFER qui manque le GPCR.
- Le jour de l'infection, on dilue le lentivirus exprimant le GPCR (étape 1.4) à une concentration finale de 10 ~ 9 GC / ml dans un volume total de 2 ml de milieu de croissance HEK293 (tableau 1). Par exemple, ajouter 20 ul de virus 10 11 GC / ml à 2 ml de milieu dans un flacon T25.
Remarque: Les informations de titre de virus devrait être fourni par l'installation de base de virus. Combinez lentivirus et les médias dans un tube de centrifugeuse et triturer doucement. Des titres élevés de lentivirus sont du niveau de biosécurité 2 (BSL-2). - Aspirer le support du flacon T25. Ajouter 2 ml de virus / mélange des médias de l'étape 3.2. Incuber le flacon T25 O / N à 37 ° C avec 5% (v / v) de CO 2.
- Après une journée d'infection, aspirez le virus / mélange des médias et le remplacer par un milieu de croissance HEK293 contenant la puromycine (2 pg / ml; tableau 1). Puromycin sélectionne les cellules transduites. Incuber le ballon à 37 ° C avec 5% (v / v) de CO 2 jusqu'à environ 90% de confluence, après ~ 1-2 jours.
- Préparer une plaque à 96 puits (noir avec fond transparent) revêtu de fibronectine, pour générer une courbe agoniste / activation de 10 points à l'étape 4.1. Dans une hotte stérile, ajouter 50 ul de fibronectine (5 ug / ml) par puits dans les lignes A et B de la plaque de 96 puits. Incuber la plaque à température ambiante pendant 1 h. Rincer deux fois pendant 5 min par rinçage avec du PBS. Ajouter 50 ul de milieu de croissance et laisser incuber HEK293 O / N à 37 ° C avec 5% (v / v) de CO 2.
Remarque: Fibronplaques ectin traitées sont disponibles dans le commerce. - Récolter les cellules dans le flacon T25 , comme décrit dans les étapes 2,3-2,6 (tableau 2).
- Remettre en suspension le culot cellulaire dans 5 ml de milieu de croissance HEK293. Ensemencer un flacon T25 avec 1,5 ml de cellules pour une analyse FACS. En outre, les graines d'un flacon T75 avec 1 ml de cellules pour la congélation et de stockage (voir les étapes 8.2-8.3)
- Pour la courbe de l'agoniste de 10 points, ensemencer les deux premières lignes (A et B) d'une plaque à 96 puits revêtues de fibronectine (étape 3.5) avec 100 ul de la suspension cellulaire par puits.
- Incuber les cellules HEK293 qui poussent dans un flacon T25, d' un flacon T75 et d' une plaque à 96 puits jusqu'à environ ~ 90% de confluence à 37 ° C avec 5% (v / v) de CO 2, après ~ 1-2 jours.
4. FACS et Isolement de simples CNiFER Clones
- Utilisez la plaque de 96 puits pour générer une courbe d'activation agoniste de 10 points.
Remarque: Avant de commencer le tri cellulaire activé par fluorescence (FACS), il est important de confirmer lal'expression du GPCR en testant les cellules transduites d'une réponse agoniste (courbe agoniste 10 points). Ce test est effectué en utilisant un lecteur de plaque fluorométrique.- Préparer une plaque de médicament pour la courbe d'activation agoniste de 10 points. Choisissez 10 concentrations différentes agonistes qui encadrent la prédits CE 50, qui peuvent être déterminées à partir de la littérature.
Remarque: La plaque de médicament contient 3 fois de chaque concentration (en double) pour ajuster la dilution 1: 3 dans la plaque CNiFER. Par exemple, la plaque d'essai d'un médicament pour CNiFER D2 contient 10 concentrations différentes de la dopamine, à des concentrations de 3 fois; 0,2, 0,5, 1, 3, 5, 10, 20, 30, 50 et 1000 nM. Dans la plaque CNiFER, par conséquent, les concentrations finales de la dopamine sont 0,067, 0,167, 0,333, 1,00, 1,67, 3,33, 6,67, 10,0, 16,7 et 333 nm. - Préparer les solutions d' agoniste en utilisant un fluide céphalorachidien artificiel (ACSF) (tableau 1). Utiliser deux puits pour "ACSF", par exemple A1 et A2,et deux puits pour les cellules «non», par exemple, B1 et B2.
Note: Préparer les différentes concentrations de médicaments en utilisant une méthode de dilution en série. Créer un modèle pour garder la trace des clones CNiFER et les concentrations de médicament (figure 3). - Utiliser le logiciel pour programmer le lecteur de plaque à 96 puits pour la mesure fluorométrique FRET et effectuer des transferts de solution.
- Réglez la température de lecteur de plaque à 37 ° C.
- Pour la mesure de FRET avec TN-XXL, régler la longueur d'onde d'excitation à 436 ± 4,5 nm (centre ± HWHM). Définissez les filtres d'émission à 485 ± 7,5 nm pour ECFP et à 527 ± 7,5 nm pour Citrine. Réglez le filtre de coupure à 475 et 515 nm pour ECFP et Citrine, respectivement.
- Programmer le lecteur de plaque pour mesurer l'émission à 485 nm et 527 nm toutes les 4 secondes pour un total de 180 sec. Choisir l'option pour délivrer 50 ul de la plaque de médicament trois fois à 100 pl de la plaque CNiFER, après avoir recueilli 30 secondes d'la fluorescence de base.
- Aspirer les médias de lignes A et B et ajouter 100 ul de ACSF à la plaque de 96 puits CNiFER qui est ~ 90% confluentes (étape 3.9).
- Chargez le plaque à 96 puits CNiFER et le «3 fois» plaque de médicament dans le lecteur de plaque. Autoriser ~ 30 min pour équilibrer les plaques à 37 ° C. Ensuite, démarrez le programme.
- Pour analyser les données de lecteur de plaque, exporter les valeurs de fluorescence à une feuille de calcul. Créer une formule pour soustraire les mesures de fond (prises pour chaque signal à partir de puits sans cellules) de puits avec CNiFERs. Normaliser intensités de fluorescence à des lignes de base-relance pré, F Citrine (t) / F Citrine (ligne de base), et calculer le ratio de FRET (AR / R;. L' équation 1) en utilisant les réponses de pointe à 527 nm et 485 émissions nm (voir l' étape 11 ).
Remarque: S'il y a un changement significatif dans AR / R avec l'agoniste, cela indique l'expression du GPCR et on peut procéder à l'analyse FACS (étape 4.2). Si eavant l'absence de réponse de FRET avec agoniste, résoudre en utilisant un ionophore Ca2 +, par exemple, A21387, pour tester la réponse Ca 2+ et confirmer que le capteur à base de FRET fonctionne. Si le ionophore fonctionne, le récepteur n'a pas été probablement exprimé.
- Préparer une plaque de médicament pour la courbe d'activation agoniste de 10 points. Choisissez 10 concentrations différentes agonistes qui encadrent la prédits CE 50, qui peuvent être déterminées à partir de la littérature.
- A la veille de FACS, préparer quatre plaques à 96 puits revêtues de fibronectine (voir étape 3.5) pour collecter les cellules triées. Ajouter 50 ul de milieu de croissance et laisser incuber HEK293 O / N à 37 ° C avec 5% (v / v) de CO 2.
- Préparer 5% (p / v) de BSA dans du PBS (5 g / 100 ml) et on filtre (0,2 pm) dans un flacon stérile.
- Récolter les cellules cultivées dans le flacon T25 (voir les étapes 2.3-2.5, tableau 2). Remettre en suspension le culot cellulaire dans 4 ml de 5% (p / v) de BSA dans du PBS. Centrifuger les cellules à 1000 g pendant 5 min.
- Aspirer les médias et remettre en suspension le culot cellulaire dans environ 5 ml de 5% (p / v) de BSA dans du PBS pour obtenir une concentration finale de 5 x 10 ~ 6 cellules / ml.
Remarque: Vérifiez auprès de la FAinstallation de base CS pour des besoins spécifiques sur la densité cellulaire et les conditions de tri. - Filtrer les cellules remises en suspension avec un tamis cellulaire de 40 um pour éliminer les grumeaux. Transférer les cellules à un 5 ml polypropylène tube rond en bas. Placer le tube sur la glace pour le transport vers l'installation FACS.
- Trier les cellules HEK293 transduites dans une installation FACS. Programmer les paramètres sur un cytomètre de flux FACS comme suit: set 4 ° C pour le porte-échantillon, 100 um pour la buse et 20 psi. Sur la base de l'analyse pré-tri, sélectionnez les cellules, soit choisir une «porte», qui ont une grande fluorescence ECFP (ECFP d'excitation, ECFP émission) et un grand FRET (ECFP excitation, Citrine émission) fluorescence (voir les résultats ci - dessous, la figure 2 ).
- Fort individuel, cellules triées dans une plaque à 96 puits préparé à l'étape 4.2, avec un clone par puits contenant 50 ul de milieu de croissance HEK293 avec puromycine. Ajouter 50 ul de milieu de croissance HEK293 avec la puromycine (Table 1) pour un total de 100 pi par puits. Maintenir les cellules O / N à 37 ° C avec 5% (v / v) de CO 2.
Remarque: les milieux de croissance de HEK293 contient puromycine pour la sélection de cellules transduites.
5. la mise en culture et l'expansion de classement, CNiFERs clonales
- Maintenir les CNiFERs dans les plaques à 96 puits en supprimant 50 ul de vieux support de chaque puits et les remplacer par 50 ul de milieu de croissance frais contenant HEK293 puromycine (tableau 1). Répétez ce tous les 5 à 7 jours jusqu'à ~ 90% de confluence, après 2-3 semaines.
- Récolte des cellules CNiFER par aspiration doucement les médias et le rinçage une fois doucement avec du PBS. Retirer le PBS et on ajoute 20 pl de 0,05% (p / v) de trypsine / EDTA. Incuber pendant 1 à 2 min à 37 ° C avec 5% (v / v) de CO 2.
- Ajouter 100 ul de milieu de croissance des cellules HEK293 aux traités à la trypsine et remettre en suspension les cellules. Transférer le contenu dans une plaque de 24 puits contenant 400 ul HEK293 frais wit de milieux de croissanceh puromycine. Dans la plaque à 24 puits, maintenir les cellules en remplaçant 250 ul de milieu de croissance HEK293 tous les 5-7 jours jusqu'à ce que les puits sont ~ 90% de confluence.
6. Identifier CNiFERs candidats basée sur la réponse FRET utilisant fluorométrique lecteur de plaque
Note: Avec quatre plaques à 96 puits suivant FACS, il devrait y avoir> 100 clones testables qui survivent et se dilatent à l'étape de plaque de 24 puits, puisque la plupart des clones originaux ne parviennent pas à se développer. Pour identifier CNiFERs candidats potentiels, utiliser une analyse de 3 points pour la réponse de FRET avec agoniste apparenté, par exemple, la dopamine pour D2R.
- Lorsque les cellules sont confluentes à environ 90% dans la plaque à 24 puits, aspirer avec douceur le support. Ajouter ~ 100 ul de 0,05% (p / v) de trypsine / EDTA et on incube pendant 1-2 min à 37 ° C avec 5% (v / v) de CO 2. Ajouter 400 ul de milieu de croissance des cellules HEK293 aux traités à la trypsine et mélanger les cellules par trituration douce.
- Mettre en place la courbe agoniste 3 points pour le dépistage initial du clonda. Pour chaque clone CNiFER, soit l' un des puits de la plaque à 24 puits, aliquoter 100 pi de la suspension cellulaire (~ 4 x 10 3 cellules / puits) dans chacun des trois puits, par exemple, A1, A2, A3, de une plaque de 96 puits fibronectine (noir avec fond clair) (voir l'étape 3.5).
- Transférer les 200 ul restants ~ de la suspension cellulaire à une plaque de 12 puits contenant 1000 ul de milieu de croissance HEK293 (1,2 ml de volume final). Incuber les plaques à 37 ° C avec 5% (v / v) de CO 2, jusqu'à environ 90% confluentes. La plaque à 96 puits est pour le dosage fluorométrique et la plaque de 12 puits est pour la croissance et l'expansion des clones.
- Pour l'analyse de 3 points, déterminer trois concentrations différentes d'agoniste qui sont 0.1-, 1.0- et 10 fois la CE 50 pour le GPCR spécifique. Préparer des concentrations agonistes dans une plaque de médicament comme décrit dans les étapes 4.1.1-4.1.2. Effectuer un test de lecteur de plaque fluorométrique comme décrit dans les étapes 4.1.3-4.1.5.
- Calculer la FRrapport ET (AR / R) tel que décrit dans l'étape 4.1.6. Choisissez CNiFERs qui ont une sensibilité appropriée et la plus grande réponse de FRET pour l'expansion, le gel de retour, et des analyses plus complètes (étape 7).
- Pour les clones qui ont été sélectionnés dans l'étape 6.5 et sont en croissance dans la plaque de 12 puits, enlever et remplacer 600 pi des HEK293 milieux de croissance tous les 5 à 7 jours, jusqu'à ce que ~ 90% de confluence.
- Peu à peu étendre les clones à partir d' une plaque de 12 puits à une plaque de 6 puits, puis à un flacon T25 (étapes 02.03 à 02.06 et le tableau 2). Lorsque le flacon T25 est ~ 90% confluentes, les cellules de récolte comme décrit (étapes 2,3-2,5). Remettre en suspension le culot cellulaire dans 5 ml de milieu de croissance HEK293.
- Ajouter 1 ml de suspension cellulaire dans un flacon T75 avec 9 ml de milieu de croissance HEK293. Utiliser les 4 ml restants de la suspension de cellules pour la cryoconservation et le stockage dans l' azote liquide 2 (étapes 8.2 à 8.3). Préparer huit 1,5 ml cryotubes et placer sur la glace.
- Dans le flacon T75, maintenir les cellules en remplaçant les milieux with milieux de croissance de HEK293 frais, par exemple, 10 ml tous les 3-5 jours jusqu'à 70-80% confluentes, après ~ 1-2 semaines.
7. Sélection finale de CNiFER Clones Utilisation fluorométrique lecteur de plaque
- Le jour avant l'essai de lecteur de microplaques:
- Cellules de récolte à partir d' un flacon T75 confluentes ~ 90% (voir les étapes 2.3-2.6, tableau 2). Seed une plaque de fibronectine 96 puits (noir avec fond clair) à 5 x 10 4 / puits avec environ 100 pi de suspension cellulaire. Remarque: Un clone est distribué dans une plaque à 96 puits unique.
- Préparer une plaque de médicament pour le dépistage complet des clones CNiFER, en distinguant les réponses agonistes spécifiques des réponses non spécifiques CNiFER.
- Pour générer une courbe dose-réponse complète, choisissez 10 concentrations d'agonistes différents autour de la CE prédit 50. Utilisez deux puits pour 'pas de cellules »et deux puits pour' ACSF '.
- Pour la détermination des réponses non spécifiques, choisissez thrconcentrations ee de 12 différents neurotransmetteurs ou modulateurs (72 puits) (figure 3). Comme l'agoniste, la plaque de médicament contient des concentrations de 3 fois en double. Par exemple, 100 ul de trois concentrations différentes de l'acétylcholine, le glutamate, l'orexine, le VIP, l'adénosine, la sérotonine, la norépinéphrine, le GABA, la substance P, la mélatonine, la somatostatine et de l'histamine, chacun à une concentration de 3 fois de 50, 1000 et 3000 nM sont chargés dans la plaque de médicament à 96 puits.
- Réglez les paramètres du lecteur de plaque fluorométrique pour mesurer FRET et effectuer des transferts de solution comme décrit dans les étapes 4.1.3-4.1.5.
- Pour l'analyse de la courbe de pleine dose-réponse, calculer le ratio pic de FRET (AR / R) (étape 4.1.6), tracé en fonction de la concentration d'agoniste du journal et correspondre à l'équation de Hill (étape 11.4). Déterminer la CE 50, coefficient de Hill, et le ratio maximal de FRET. Pour les 12 autres neurotransmetteurs / modulateurs, terrain de pointe AR / R en fonction of concentration du médicament.
- Choisissez clones ~ 10 CNiFER qui ont un grand ratio de FRET, un CE approprié 50 pour l'agoniste apparenté, et peu ou pas de réponses de fond à d' autres agonistes de neurotransmetteurs (réponse non spécifique).
Clones CNiFER 8. Gel-back sélectionnés
- Utilisez un confluentes T75 flacon d'un clone CNiFER individuel ~ 90%. Récolte des cellules telles que décrites (étapes 2.3-2.5, tableau 2). Pour la congélation de cellules, remettre en suspension le culot cellulaire dans 5 ml de milieu de croissance HEK293. Etiqueter dix 1,5 ml cryotubes et mis sur la glace.
- Pour la cryoconservation, les cellules mélange 1: 1 avec 20% (v / v) de DMSO dans le milieu de croissance HEK293, par exemple, 5 ml de 20% (v / v) de DMSO / support est doucement mélangé avec 5 ml de suspension cellulaire (définitif concentration de DMSO est de 10%).
- Aliquote de 1 ml dans chacune des cryotubes. Congeler tubes avec des cellules dans un -80 ° C congélateur O / N, dans une boîte à isolation de mousse (voir Matériaux). Transfert CryoTubes à LIQUid azote pour le stockage à long terme.
9. CNiFER Implantation dans Souris Cortex
- Stériliser tous les instruments chirurgicaux dans un autoclave avant la chirurgie. Préparer un champ de semi-stérile pour la chirurgie en essuyant avec 70% d'éthanol et fixant une couche de laboratoire propre.
- Préparer la pipette d'injection CNiFER en tirant sur un tube capillaire en verre (id de 0,53 mm) sur une électrode de traction verticale. Utilisez une paire de pas. 5 pince à pointe fine pour briser la pointe de l'électrode à un diamètre de ~ 40 um.
Note: Ceci est mieux accompli sous un microscope à zoom stéréo avec un réticule. - Anesthésier un adulte (60-90 jours après la naissance) souris C57BL / 6 avec de l'isoflurane: 4% (v / v) pour l'induction et de 1,5 à 2,0% (v / v) pour l'entretien. Utilisez la queue ou pincement de l'orteil pour vous assurer que la souris est complètement anesthésié.
Remarque: Re-pincement et évaluer périodiquement whisker secousses pendant toute la chirurgie pour réévaluer la profondeur de l'anesthésie. - Couvrir les yeux avec pommade ophtalmique à pséchage revent. Monter la souris dans un cadre stéréotaxique avec des barres d'oreille. Maintenir la température du corps de la souris à 37 ° C en utilisant un tampon de chaleur régulée par une sonde rectale.
- Rasez une superficie d'environ 5 mm par 12 mm avec un rasoir électrique des animaux. Appliquer la Bétadine suivie par 70% (v / v) d'isopropanol. Utilisez une lame de scalpel pour couper et enlever la peau sur la surface du crâne. Utiliser une lame de scalpel pour enlever le périoste de la surface du crâne. Exposer et de nettoyer la surface du crâne, comme décrit pour la chirurgie stéréotaxique 11.
- Abaisser un verre vide à la pipette bregma et enregistrer le antéro-postérieur (A / P) et médio-latérale (M / L) coordonne. En se référant à l'atlas de cerveau de souris, calculer la position du point d'injection. Déplacer la pipette vers le site cible et marquer le crâne pour la formation de fenêtre subséquente. Voir Cetin et al. Pour plus de détails sur les injections stéréotaxiques avec les rongeurs 11.
Note: Le site d'injection et dépendent de la fenêtre du siègeion à étudier et la répartition des neurotransmetteurs ou de peptides libérant des projections dans le cortex. Par exemple, dans une publication récente 7, l'stéréotaxique coordonne à +2.0 mm +1.0 A / P et de 1,0 à 2,0 mm M / L ont été utilisées pour injecter des cellules CNiFER dans le cortex frontal pour l' imagerie in vivo de la libération de dopamine pendant le conditionnement classique . - Former un 2 mm x 3 mm fenêtre crâne amincie comme décrit précédemment 12,13.
Remarque: L'os dans la fenêtre devrait être 15-20 um d'épaisseur. Les petites taches blanches dans l'os ne doivent pas être visibles lorsque la surface du crâne est humidifié, si l'os est suffisamment amincie 12,13. - Placer une éponge imbibée ACSF sur la fenêtre pour le garder humide pendant la préparation de cellules à injecter.
- Récolter le clone CNiFER qui a été cultivée dans un flacon T75 à ~ 80% de confluence. Aspirer les médias et laver les cellules avec du PBS stérile.
Note: La trypsine est omise pour ces étapes. - Retirer du PBS et utiliser 10 ml of ACSF pour déloger les cellules du fond du flacon. Broyez les cellules à se dissocient amas de cellules. Centrifugeuse et resuspendre le culot dans 100 ul de ACSF. Centrifuger pendant 30 secondes à 1400 xg et retirer le surnageant, en laissant une pastille recouverte de ACSF. Cette étape laisse un amas de cellules en suspension.
- Remblayer la pipette d'injection préparé à l'étape 9.2 avec de l'huile minérale, de charger la pipette sur un nanoinjector, et de faire avancer le piston pour éjecter une petite perle d'huile. Mettre 5 ul de CNiFER suspension cellulaire sur une bande de film de paraffine en plastique près de la préparation de la souris. Dresser soit les CNiFERs ou contrôler les cellules CNiFER dans la pipette tiré.
- Déplacer la pipette à la cible des coordonnées X et Y, à savoir, A / P et M / L noté à l' étape 9.5. Abaisser la pipette, perçant le crâne amincie, et continuer à ~ 200-400 um en dessous de la surface du crâne, pour déposer les cellules CNiFER en couches 2/3 du cortex.
- Injecter ~ 4,6 nl de cellules CNiFER sur le site le plus profond avec le nanoinjecteur, le mouvement de la note dans l'interface de l'huile et de la cellule, puis attendre pendant 5 min pour les cellules de se passer. Retirer la pipette ~ 100 um et injecter un autre ~ 4,6 nl de cellules CNiFER, attendez 5 min. Ensuite , retirer la pipette doucement et lentement pour empêcher le reflux des CNiFERs. Répéter l'injection à un ou plusieurs sites adjacents.
- Étapes injection Répéter 09/08 à 09/12 avec le contrôle des cellules HEK293 (ie, HEK293 / TN-XXL / G qi5 clone manque GPCR). Séparez le CNiFER et le contrôle des sites d'injection de cellules de ~ 200 um.
- Après avoir terminé les implantations de cellules, rincer la fenêtre-crâne amincie avec ACSF et attendez que le crâne pour sécher. Appliquer une goutte de colle cyanoacrylate (voir Matériaux) sur la fenêtre et placez rapidement un verre de couverture stérile prédécoupée sur le dessus de la colle. Poussez doucement le verre de protection contre le crâne pendant quelques secondes. Laisser sécher la colle pendant 2 min 12,13.
- Sceller les bords du verre de couverture avec du ciment dentaire et forme awell autour de la fenêtre pour retenir l'eau pour l'objectif d'immersion.
- Pour immobiliser la tête de la souris lors de l' imagerie, fixez une tête-bar intégré personnalisé avec une petite goutte de colle cyanoacrylate derrière la fenêtre (voir 14 pour plus de détails sur les dimensions et les matériaux). Laissez la colle sécher complètement puis ajouter du ciment dentaire supplémentaire pour renforcer encore la tête-bar construit sur mesure.
- Couvrir le reste de la surface du crâne à l'exception de la fenêtre, avec une couche de ciment dentaire. Assurez-vous que les bords de la peau sont couverts par le ciment et le laisser sécher pendant 20 min.
- Après la chirurgie, arrêter l'administration de l'isoflurane et de laisser la souris sur un coussin chauffant dans une cage jusqu'à ce qu'il récupère complètement de l'anesthésie. Injecter 5% (p / v) de glucose dans une solution saline (sc) pour la réhydratation et de 0,05 à 0,1 mg / kg de buprénorphine (ip, libération instantanée) pour l'analgésie post-opératoire.
Remarque: Pour minimiser la réaction immunologique potentielle aux CNiFERs humains, injecter la souris par jour avec 20 pl / 100 g cyclosporine (ip) à partir du jour avant l'injection de CNiFERs. - Retour de la souris dans sa cage à la maison pour la nourriture et l'eau.
10. imagerie in vivo de CNiFER Clones
Remarque: l'imagerie en direct est réalisée avec des souris en utilisant un microscope à deux photons et un appareil de tête fixe. Aucune anesthésie est nécessaire pendant les séances d'imagerie. Lorsque l'imagerie des animaux à l'état éveillé, limiter l'appuie-tête à seulement quelques heures à la fois pour réduire les niveaux de stress. Retour à l'animal de la maison cage entre les séances d'imagerie pour la nourriture et l'eau. le stress potentiel est réduit au minimum en assombrissant les lumières de la pièce et entourant une partie de la souris dans une enceinte.
- Le jour après la chirurgie, monter la souris sur une plate-forme d'imagerie par vissage de la tête-barre métallique implantée sur le crâne à la trame de tête de fixation.
Remarque: Lors de l'imagerie souris éveillés, la session d'imagerie ne doit pas dépasser quelques heures en raison du stress potentiel induit par le dispositif appuie-tête. - Placez la plate-forme d'imagerie avec la souris de tête retenu dans une imagerie microscope à deux photons équipé d'un 10X (0,30 NA) et 40X (0,80 NA) objectifs d'immersion de l'eau.
- Insérer le cube de filtre pour l'imagerie FRET (ECFP et Citrine) qui comporte un miroir dichroïque à 505 nm et passe-bande des filtres qui enjambent 460 nm à 500 nm pour la mesure et ECFP 520 nm à 560 nm pour la mesure de citrine.
- Ajouter ACSF à la fenêtre du crâne amincie puits contenant et abaisser l'objectif d'immersion dans l'eau dans le ACSF. Utiliser l'oculaire en association avec une lampe au mercure et un filtre GFP cube pour localiser la surface du cortex et le système vasculaire au-dessous de la fenêtre.
Remarque: Le motif de la vascularisation aide à localiser et à l'image de la même région au cours des jours répétées de l'imagerie. Basculer vers l'objectif d'immersion dans l'eau 40X pour localiser CNiFERs en se concentrant manuellement sur la surface du cortex au cours des cellules en utilisant le GFP filtre cube et une lampe à mercure. - Mettre en place pour l'imagerie à deux photons. Sélectionnez l'apchemin de lumière appro- pour l'imagerie à deux photons. Pour un système commercial typique, utiliser le logiciel pour passer en mode d'imagerie à deux photons et rediriger la lumière vers les tubes photomultiplicateurs (PMT) dans les détecteurs non-descanned. Allumez le laser à impulsions femtoseconde dans le proche infrarouge, sélectionnez une longueur d'onde de 820 nm et un réglage de puissance de 5-15%. Note: 5% de la puissance fournit typiquement ~ 25 mW à l'échantillon.
- Régler la tension PMT1 & PMT2 proche de la valeur maximale, typiquement 700-1000 V en fonction de la PMT. Réglez le gain à 1 pour chaque canal et zéro la position z pour l'objectif.
- Abaisser l'objectif ~ 100 à 200 um de la surface corticale et commencer le balayage xy. Régler la puissance du laser, le gain et la tension de PMT pour chaque canal, soit ECFP et citrine, afin d' optimiser le rapport signal-bruit de la fluorescence CNiFER.
- Utilisez la fonction de zoom dans le logiciel pour restreindre l'image à une région qui contient les cellules CNiFER ainsi qu'un background région. Utilisez une vitesse de balayage pas plus lent que d'une image toutes les 2 secondes (0,5 Hz) à 4 ms par pixel. Ajuster la ligne moyenne pour rapport approprié signal-bruit, par exemple, Kalman 2 ligne moyenne.
- Dessinez une région d'intérêt (ROI) autour des cellules CNiFER, entourant environ 3 à 4 cellules par avion. Mettre en place une analyse en temps réel de ROI intensités moyennes. Lancer acquisition pour surveiller CNiFER fluorescence au fil du temps.
- Recueillir la fluorescence provenant CNiFERs avant et pendant les manipulations expérimentales, par exemple, la stimulation électrique, CHR2 stimulation, un comportement, tel que déterminé par l'utilisateur.
- Lorsque l'expérience d'imagerie est terminée, retournez la souris à sa cage. Répétez l'imagerie à travers jours, comme vous le souhaitez. Lorsque re-imager les cellules se réfèrent à l'image précédemment acquise à faible grossissement vasculature pour orienter vers le même champ d'imagerie (étape 10.4).
Note: CNiFERs implantables peuvent être visualisés pendant au moins 7 jours.
11. Analyse des données
- Ouvrir le fichier d'image et sélectionnez ROI pour CNiFERs et un retour sur investissement pour le fond. Sélectionnez 'analyse des séries »pour les deux canaux de chaque ROI. Export intensité de fluorescence moyenne pour chaque ROI comme un fichier délimité par des tabulations.
- Utilisez un logiciel mathématique (voir Matériaux) de programme pour analyser les valeurs de fluorescence. filtre passe-bas (0,3 Hz) chaque signal, puis soustraire la fluorescence de fond dans chaque ROI de ECFP et Citrine intensités de fluorescence.
- Calculer la fluorescence moyenne de référence et de calculer des rapports tels que décrits dans l'équation 1 pour mesurer le rapport de FRET AR (t) / R.
- Pour déterminer la sensibilité de CNiFERs, tracer le ratio FRET en fonction de la concentration log agoniste. Monter avec l'équation de Hill pour déterminer la CE 50 et Hill coefficient (n), en utilisant un logiciel statistique scientifique et la Colline Equation (Equation 2).

Résultats
Un CNiFER est dérivé d'un rein embryonnaire (HEK293) cellule humaine qui est modifiée pour exprimer de façon stable au moins deux protéines: une protéine G spécifique des récepteurs couplés (GPCR) et une [Ca2 +] capteur codé génétiquement, TN-TTG. TN-XXL subit un transfert de résonance de fluorescence d'énergie (FRET) entre cyan et jaune fluorescent protéines, ECFP et Citrine, respectivement, en réponse à des ions Ca 2+ 6,15. L' activation de GPCR endogène qui couplent à des protéines G Gq déclencher une augmentation cytosolique [Ca 2+] par la voie PLC / IP 3, ce qui conduit à une augmentation du FRET 2+ détecteur TNXXL Ca (figure 1).
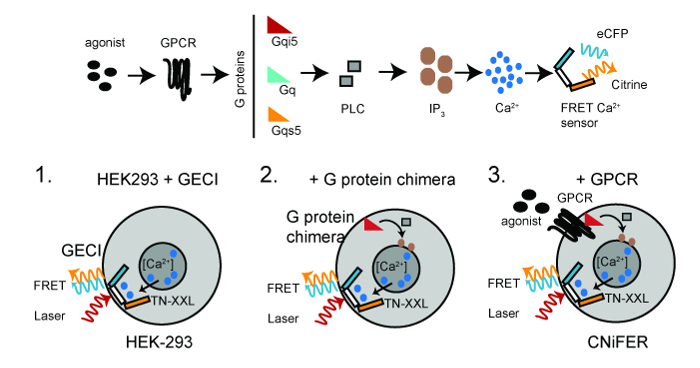
Figure 1:. Schéma de développement CNiFERs Top, GPCR-Ca 2+ voie de signalisation pour créer unecellule CNiFER. Bas, les étapes de base pour la construction de CNiFERs utilisant des cellules HEK293. Étape 1. transduction avec génétiquement codé sur la base FRET Ca 2+ -detector (TN-XXL). Etape 2. transduire Ga protéine G chimère, à savoir G QS5, G qi5, le cas échéant. Etape 3. transduction GPCR unique de créer CNiFER. Excitation lumineuse à deux photons (rouge) excite ECFP, qui subit FRET, produisant à la fois une émission de ECFP (cyan) et émission de Citrine (jaune). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
L'augmentation de FRET fournit une lecture optique rapide du changement dans les niveaux de neurotransmetteurs. Pour développer un CNiFER pour un type particulier de neurotransmetteur, d'abord déterminer le type de protéine G que les couples au GPCR. Pour G q -coupled GPCR, le GPCR utilise G q protéines endogènes exprimées dansles cellules HEK293. Pour G i / o -coupled GPCR, une ligne de HEK293 clonale est créée qui exprime une protéine G chimérique qui redirige le GPCR du G q -PLC / IP 3 voie. Ceci est réalisé avec une protéine G chimère, G qi5, qui contient la séquence q principalement Ga et cinq acides aminés de l'extrémité carboxy - terminale de Gi. Ces cinq acides aminés sont suffisants pour G qi5 pour communiquer avec G i / o -coupled GPCR, mais le signal par la voie G q. Pour GPCR -coupled de G, G QS5 chimère est utilisé 10. La stratégie générale pour la production d' un CNiFER consiste à: 1) créer une cellule clonale HEK293 qui expriment de façon stable un détecteur optique Ca2 +, à savoir, TN-TTG, en utilisant un lentivirus transduction des cellules HEK, 2) expriment de façon stable une protéine G chimère , si nécessaire, dans le clone de cellule HEK293 exprimant TN-TTG et 3) créer un GPCR clone exprimant de manière stable dans la cellule HEK293clone exprimant TN-XXL et la protéine G chimère. La ligne de HEK293 clonale qui manque le GPCR mais a le TN-XXL et chimère protéine G sert de «contrôle CNiFER». Le contrôle CNiFER est nécessaire pour confirmer que la réponse CNiFER est due spécifiquement à l' activation des récepteurs modifiés, c. -à- D2R et non pas à l' activation d'autres récepteurs exprimés de manière endogène dans les cellules HEK293.
Pour générer un lentivirus, d' un système d'expression de lentivirus est utilisé, par exemple pCDH-CMV-MCS-EF1-Puro, qui contient les éléments génétiques responsables de l' emballage, la transduction, l' intégration stable de l'expression virale construction dans l' ADN génomique et l' expression de la cible la séquence du gène. Pour produire un titre élevé de particules virales, vecteurs d'expression et d'emballage sont transitoirement co-transfecté dans des cellules de mammifères de producteurs et le virus est collecté. Il existe plusieurs installations de base virale aux États-Unis qui peuvent générer haute ti ter lentivirus. Après l'infection des cellules HEK293, le gène de résistance à un antibiotique fournit Puro pour identifier des cellules HEK293 transduites.
Afin d'identifier les lignées clonales spécifiques transduit les cellules HEK293 sont triées en utilisant une cellule de tri activé par fluorescence du système (FACS). L'objectif est d'isoler un clone qui contient un niveau élevé d'expression à base de FRET Ca2 + détecteur et la capacité de subir FRET. Dans cet exemple, l'analyse FACS, la fluorescence de l'émission ECFP est tracée en fonction du signal de FRET (ECFP d'excitation et d'émission Citrine). Les boîtes marquent les régions (P2 et P3) qui seront sélectionnés par la suite ( "gated") pour le tri dans des plaques à 96 puits (Figure 2). En général, environ quatre plaques à 96 puits sont suffisantes pour cribler pour la création réussie de CNiFERs. A partir de ces 4 plaques, environ 100 clones sont appropriés pour fluorométrique analyse de lecteur de plaque.
e_content "fo: keep-together.within-page =" 1 ">
Figure 2: Exemple d'analyse FACS Un échantillon de la sortie suite à une analyse FACS.. Les émissions de Les parcelles de graphique ( "475/20-A") en fonction de Citrine émission ( "FRET V-530/30-A"), en utilisant ECFP excitation pour chaque cellule. Régions P2 et P3 montrent les zones sélectionnées, soit fermée, pour le tri dans des cellules individuelles. Les couleurs sont arbitraires. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Une fois que les cellules triées sont cultivées à une densité suffisante, la réponse de FRET après l'activation agoniste est déterminée à l'aide d'un système de lecteur de plaque à 96 puits fluorométrique équipé d'une manipulation de la solution. Pour réduire le nombre de clones pour étudier, une courbe d'agoniste "3 points" est utilisé pour dépister ~100 clones et sélectionnez CNiFERs avec les meilleures réponses. Environ 10 clones sont ensuite analysés en outre par la détermination de la relation dose-réponse complète avec l'agoniste idoine, et les réponses non spécifiques, sondées avec 12 d'autres neurotransmetteurs ou modulateurs. Une plaque de drogue de 96 puits est préparé comme trois fois la concentration (concentration finale est diluée à 1: 3 dans la plaque) des médicaments (par exemple, des agonistes, antagonistes, etc.) ACSF. Dans cet exemple, une plaque de médicament est configuré pour tester une D2 CNiFER avec son agoniste apparenté, la dopamine et des réponses non spécifiques potentiels avec une variété d'autres agonistes des récepteurs de neurotransmetteurs et de peptides (figure 3). L'épine dorsale CNiFER, qui manque le GPCR, sert de contrôle important pour le CNiFER nouvellement créé.
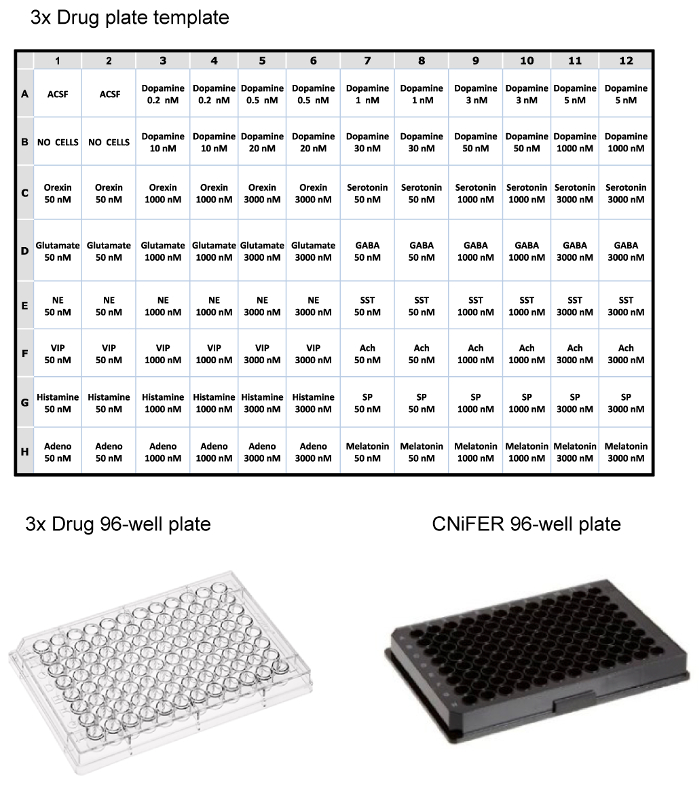
Figure 3:. Des exemples de mise en page pour plaques à 96 puits Top, table de l'layout pour charger une plaque de drogue 3x pour lecteur de plaque fluorométrique, en utilisant des concentrations de trois plis de divers neurotransmetteurs et des peptides. Bottom, des exemples de plastique de 96 puits plaque de drogue claire et plaque à 96 puits noir pour l' ensemencement CNiFERs et de mesure dans le lecteur de plaque. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
On prévoit la stimulation de GPCR pour augmenter la réponse du FRET, à la suite d'une élévation de intracellulaire [Ca 2+] , et la détection par TN-TTG. Dans ces conditions, le FRET est produit par la ECFP et citrine se rapprocher, de sorte que l'excitation de la ECFP produit une émission ECFP petites et grandes Citrine émission. Dans cet exemple, l' excitation est réglée à 436 nm et de filtres d' émission sont réglés à 485 ± 7,5 nm pour ECFP et 527 ± 7,5 nm pour citrine (figure 4). Trente secondes de bafluorescence Seline est mesurée et ensuite 50 ul de la "triple" agoniste de la plaque de ACSF est livré à chaque puits contenant 100 ul ACSF (dilution 1: 3). ECFP et d'émission de fluorescence Citrine sont mesurées toutes les 3,8 secondes pour 180 sec. Les mesures de fond sont prises à partir des puits sans cellules et soustraites, si nécessaire. intensités de fluorescence sont normalisées des lignes de base de pré-stimulation (F (t) / F (référence)), et les réponses maximales sont mesurées pour calculer le ratio de FRET (AR / R) en utilisant le F (t) / F (référence) de la 527 nm et 485 nm canaux (équation 1). Une courbe dose - réponse est alors construite en traçant le rapport de FRET en fonction de différentes concentrations d'agoniste et s'adapter avec l'équation de Hill afin de déterminer les CE 50 et le coefficient de Hill (Figure 5) (équation 2). Une CNiFER optimale présente un grand rapport de FRET et une EC appropriée 50 pour l'agoniste apparenté, et présente peu ou pas de fond réponses à d' autres neurotransmitagonistes ter. En revanche, le contrôle CNiFER devrait montrer peu de réponse à l'agoniste apparenté.
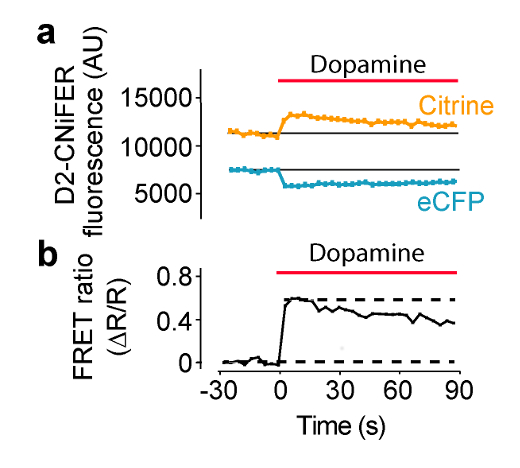
Figure 4: Exemple de réponse de FRET FRET Réponse D2R CNiFER induite par l' agoniste mesurée sur un lecteur de plaque avec un système de distribution de solution.. (A) Un tracé de la réponse de FRET, soit ECFP excitation avec des émissions ECFP et Citrine, lors de l' application de la dopamine (barre rouge) à D2 CNiFERs. Notez que les diminutions d'émissions ECFP alors l'augmentation des émissions Citrine avec agoniste (dopamine). (B) Un tracé du rapport de FRET (équation 1) pour la réponse en (A) Figure modifiée de Muller et al., 2014 7. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
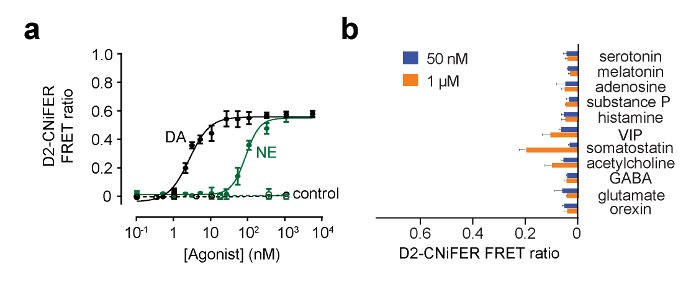
Figure 5:. Exemples de courbes de réponse de dose pour D2 CNiFER (A) Dose courbes de réponse pour une réponse de D2 CNiFERs à la dopamine (DA, noir) et pour la norépinéphrine (NE, vert). En outre, la réponse de CNiFERs «contrôle» dépourvues du D2R est représenté. (B) Le graphique à barres montre la réponse du rapport FRET pour d' autres neurotransmetteurs et des modulateurs à 50 nM et 1 uM. Les valeurs sont la moyenne ± SEM. Figure modifiée de Muller et al., 2014 7. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Les clones CNiFER peuvent être évalués en outre possible pour la désensibilisation du récepteur-dépendants et de leur résolution temporelle, la présentation de discriminationde deux impulsions agonistes différents (pour plus de détails, voir Muller et al., 2014 7). Après avoir construit un clone CNiFER, l'étape suivante consiste à tester la fonction in vivo. Pour surveiller la fluorescence in vivo, il est nécessaire d'utiliser un microscope à deux photons. Après avoir préparé une fenêtre crâne amincie CNiFERs sont chargés dans une pipette de verre et injecté dans les couches du cortex 2/3. La souris est ensuite préparé pour l' imagerie in vivo en attachant une lamelle de verre sur le crâne amincie, et l' implantation d' une barre de tête pour la fixation de la tête lors de l' imagerie (figure 6).
Déterminer que les CNiFERs implantés sont viables in vivo, des concentrations connues d' un agoniste peut être injecté à proximité du site d'implantation et le rapport de FRET 7 déterminés. Afin de valider l'activité de CNiFERs implantés, stimulant les neurones d'entrée doit être examinée. Par exemple, avec la norme D2 CNiFER, l'effet dela stimulation électrique des neurones dopaminergiques du mésencéphale qui se projettent vers le cortex a été examiné. A bipolaire 0,1 MQ de tungstène électrode de stimulation avec une séparation de 500 um de pointe a été implanté dans la substantia nigra (-3,2 mm A / P, -1.3 mm M / L, -4.4 mm D / V). La figure 6 montre un exemple de l' électricité la stimulation de la substantia nigra à des intensités différentes et en observant une augmentation du ratio FRET pour D2 CNiFERs 7. On notera que intrapéritonéale (ip) par injection systémique d'un antagoniste des récepteurs D2, éticlopride (1 mg / kg), bloque la réponse D2 CNiFER. D'autre part, l' injection de cocaïne (15 mg / kg), qui bloque la recapture de la dopamine, améliore la réponse D2 CNiFER 7 évoqué électriquement.

Figure 6: Exemple de D2 CNiFER Réponse I ong> n vivo après stimulation électrique du locus niger. (A) Un dessin animé montre une souris de tête fixe préparé pour l'imagerie in vivo à deux photons et la stimulation électrique. la lumière à deux photons (rouge, 820 nm) pour l'excitation et 475 nm émission pour ECFP (bleu) et 530 nm émission pour Citrine (vert). (B) Le tracé de la ligne montre le ratio de FRET pour D2 CNiFER injecté dans le cortex après stimulation électrique du substantia nigra, soit 200 microsecondes impulsions de 50 à 300 uA à 50 Hz pour 500 msec, et après stimulation électrique en présence d'un D2R antagoniste (éticlopride) ou de la cocaïne. Figure modifiée de Muller et al., 2014 7. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
ftp_upload / 53290 / 53290table1.jpg "/>
Tableau 1: Liste des produits chimiques et des réactifs pour rendre un milieu de croissance et HEK293 ACSF.

Tableau 2: Les volumes pour les cellules de récolte de différentes plaques Taille de culture ou Flacons.
Discussion
La création de CNiFERs offre une stratégie innovante et unique pour mesurer optiquement la libération de neurotransmetteurs dans le cerveau in vivo. CNiFERs sont parfaitement adaptés pour la mesure de libération extrasynaptique, à savoir, le volume de conduction, pour les neurotransmetteurs. Surtout, chacun CNiFER possède les propriétés du RCPG natif, fournissant une mesure optique physiologique des changements dans les niveaux de neurotransmetteurs dans le cerveau. À ce jour, CNiFERs ont été créés pour détecter l' acétylcholine (M1-CNiFER) 6, la dopamine (D2-CNiFER) 7 et de la noradrénaline (α1a-CNiFER) 7.
En principe, un CNiFER peut être créé pour tout neurotransmetteur qui signale par un GPCR. Dans le cas où les signaux de GPCR à G q protéines G, aucune modification supplémentaire est nécessaire pour la cellule HEK293. GPCR que le signal à G i / o nécessitent toutefois une co - expression d'un G qi5 chimère protéine Gpour coupler le GPCR du G q / PLC voie 7,10. De même, les GPCR qui signalent à G s , il faudra coexpression d'une chimère G QS5 protéine G 10. Une fois terminée, chaque clone CNiFER est tamisé et seuls les clones CNiFER ayant une affinité comparable au récepteur natif, présentent peu ou pas de désensibilisation et de fournir un rapport signal-bruit qui est suffisant pour mesurer avec in vivo , la microscopie biphotonique, sont sélectionnés pour des études in vivo.
Pour les études in vivo, il est fortement recommandé de traiter les souris avec de la cyclosporine pour minimiser toute réponse immunologique potentiel. Il existe une possibilité de rejet ou d'une réaction immunologique avec l'implantation de cellules humaines CNiFER dans le cerveau des rongeurs. Cela a été étudié précédemment en examinant l' expression de la GFAP et MAC1 7, suivant CNiFER implantation. CNiFERs ne semble pas produire des cicatrices gliales ou de générer toute signisigni- MAC1 coloration 7.
Deux grandes questions à prendre en compte dans la construction de CNiFERs sont la sensibilité et la désensibilisation. Si les CE 50 est trop élevée, soit une faible affinité, par rapport au récepteur natif, alors le CNiFER ne peut pas avoir une sensibilité suffisante pour détecter la libération de neurotransmetteurs in vivo. Une solution est de clones et choisissez Refaire le dépistage d'un clone CNiFER différent qui a une affinité plus élevée. Une stratégie alternative serait de tester d' autres types de codées génétiquement fluorescentes Ca 2+ objets métalliques qui peuvent avoir la sensibilité d'un Ca supérieur, qui peut décaler la CE 50 pour l' activation GPCR. Parce que la conception CNiFER est modulaire, il est facilement adapté à d' autres types de génétiquement codés Ca 2+, d' objets métalliques tels que GCaMP 16. Isoler clones CNiFER avec le même récepteur , mais différents CE 50 pourrait être avantageux pour étendre la gamme dynamique de détection de la libération de neu endogènerotransmitters in vivo.
Désensibilisation du CNiFER limite également son utilisation in vivo. Si la réponse de crête diminue progressivement à chaque impulsion de l'agoniste, le récepteur peut être désensibilisant. Dans ce cas, examiner d'autres clones et de déterminer si elles répondent de la même façon. Les modifications apportées à la séquence d'acides aminés du récepteur ou de l'utilisation d'un autre sous-type de récepteur peuvent être nécessaires pour répondre à la désensibilisation agoniste-dépendante. S'il y a des sites de phosphorylation ou des acides aminés connus identifiés qui associent G kinases des récepteurs de protéines (GRK), il serait souhaitable de construire une variante non-désensibilisation du GPCR par mutation d'un ou plusieurs sites. Le mécanisme de la désensibilisation doit être déterminée pour chaque récepteur sur une base au cas par cas.
Jusqu'à présent, CNiFERs ont été seulement implantés dans les couches superficielles du cortex 6,7, en raison de limitations spectroscopiques avec fluorophores d'imagerie à mi deux photonscroscopy 17,18. À l'avenir, il peut être possible d'adapter la technologie CNiFER avec des mesures à base de fibres de fluorescence 19 de sorte que CNiFERs peut être implanté dans des régions cérébrales sous - corticales.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Nous remercions B. Conklin (Université de Californie, San Francisco) pour fournir les qi5 G et G QS5 cDNA, A. Schweitzer pour l' assistance à l'électronique, N. Taylor pour l' aide au dépistage des clones, Ian Glaaser et Robert Rifkin pour la relecture et Olivier Griesbeck pour TN-XXL. Ce travail a été soutenu par des subventions de recherche par le biais de l'Institut national américain sur l'abus des drogues (NIDA) (DA029706; DA037170), l'Institut national d'imagerie biomédicale et Bioengineering (NIBIB) (EB003832), Hoffman-La Roche (88610A) et le "Neuroscience liés à la drogue de subvention de formation des abus »par NIDA (DA007315).
matériels
| Name | Company | Catalog Number | Comments |
| pCDH-CMV-MCS-EF1-Puro | System Biosciences | CD510B-1 | Cloning: for generating lentivirus |
| 12 x 75 *BD Falcon High Clarity Polypropylene Round Bottom Test Tube | BD Biosciences | 352063 | FACS |
| BD 40 um Falcon cell strainers | BD Biosciences | 352340 | FACS |
| 0.05% Trypsin EDTA | Invitrogen | 25200056 | FACS |
| 96 Well Plate, flat bottom, clear | Corning | 3596 | FACS |
| 96 well cell culture plates | Corning | CLS3997 | Flexstation |
| Optilux black clear bottom | Corning | 3603 | Flexstation |
| Flexstation pipet tips | Molecular Devices | 9000-0911 | Flexstation |
| Acetylcholine Chloride | Sigma-Aldrich | A2661 | Flexstation |
| Norepinephrine | Sigma-Aldrich | A7256 | Flexstation |
| Dopamine Hydrochloride | Sigma-Aldrich | PHR1090 | Flexstation |
| GABA | Sigma-Aldrich | A2129 | Flexstation |
| Histamine | Sigma-Aldrich | H7125 | Flexstation |
| Glutamate | Sigma-Aldrich | 49621 | Flexstation |
| Epinephrine | Sigma-Aldrich | E4642 | Flexstation |
| Somatostatin | Sigma-Aldrich | S1763 | Flexstation |
| 5HT | Sigma-Aldrich | H9523 | Flexstation |
| VIP | Alpha Diagnostics Inc. | SP-69627 | Flexstation |
| Orexin A | Alpha Diagnostics Inc. | 12-p-01 | Flexstation |
| Substance P | Sigma-Aldrich | S6883 | Flexstation |
| Adenosine | Sigma-Aldrich | A4036 | Flexstation |
| Melatonin | Sigma-Aldrich | M5250C | Flexstation |
| Fluorescence Plate Reader & software | Molecular Devices | Flexstation 3 | Flexstation |
| DMEM (high glucose) with Glutamax | Life Technologies | 10569-010 | Tissue culture |
| Fetal bovine serum | Life Technologies | 10082-139 | Tissue culture |
| Pen/Strep antibiotics | Life Technologies | 15140-122 | Tissue culture |
| Puromycin | InvivoGen | ant-pr-1 | Tissue culture |
| Fibronectin | Sigma-Aldrich | F0895 | Tissue culture |
| CoolCell LX Alcohol-free controlled-rate cell freezing box | Bioexpress | D-3508) | Tissue culture |
| cyanoacrylate glue | Loctite | Loctite no. 495 | surgery and stereotaxic injection |
| plastic paraffin film | VWR | Parafilm® | surgery and stereotaxic injection |
| Nanoinjector | Drummond | 3-000-204 | surgery and stereotaxic injection |
| Glass electrodes | Drummond | 3-000-203G | surgery and stereotaxic injection |
| hand held drill | OSADA | Exl-M40 | surgery and stereotaxic injection |
| Burrs for drill | Fine Scientific | 19007-05; 19007-07) | surgery and stereotaxic injection |
| Sterilizing bath | FST | 18000-45, Hot Bead Sterilizer | surgery and stereotaxic injection |
| isoflurane chamber/mask | Highland Medical Equipment | 564-0427, HME 109 Table Top Anesthetic Machine with Isoflurane Vaporizer, O2 Flowmeter, Gang Valve; 564-0852, Induction Chamber 16X7X7.5cm | surgery and stereotaxic injection |
| 3D scope with arm | Zeiss | surgery and stereotaxic injection | |
| fiber optic light | surgery and stereotaxic injection | ||
| Betadine | surgery and stereotaxic injection | ||
| 70 % (v/v) isopropyl alcohol | surgery and stereotaxic injection | ||
| Povidone-Iodine Prep Pads | dynarex | 1108 | surgery and stereotaxic injection |
| NaCl 0.9% (injection, USP, 918610) | surgery and stereotaxic injection | ||
| CYCLOSPORINE (INJECTION, USP) | surgery and stereotaxic injection | ||
| Buprenex (injection) buprenorphine (0.03 μg per g rodent) | Sigma-Aldrich | surgery and stereotaxic injection | |
| Ophthalmic ointment | Akorn | NDC 17478-235-35 | surgery and stereotaxic injection |
| Surgifoam | Ethicon | surgery and stereotaxic injection | |
| Grip dental cement | Dentsply | #675571, 675572 | surgery and stereotaxic injection |
| Instant SuperGlue | NDindustries | surgery and stereotaxic injection | |
| LOCTITE 4041 | surgery and stereotaxic injection | ||
| METABOND | C&B | surgery and stereotaxic injection | |
| no. 0 cover glass | Fisher | surgery and stereotaxic injection | |
| stereotaxic frame | Kopf | surgery and stereotaxic injection | |
| Rectal probe and heating pad | FHC | 40-90-8D, DC Temperature Controller,40-90-2-06, 6.5X9.5cm Heating Pad40-90-5D-02, Rectal Thermistor Probe | surgery and stereotaxic injection |
| optical breadboard for imaging | Thorlabs | surgery and stereotaxic injection | |
| Mineral oil | Fisher | S55667 | surgery and stereotaxic injection |
| Kwik-Cast (Silicone elastomer) | World Precision Instruments | surgery and stereotaxic injection | |
| Suture | Ethicon | 18’’, 1667, 4-0 | surgery and stereotaxic injection |
| Scissors | Fine Scientific Tools | 91500-09, 15018-10 | surgery and stereotaxic injection |
| Forcepts | Fine Scientific Tools | 11252-30; #55, 11295-51; Grafe, 11050-10 | surgery and stereotaxic injection |
| Student Halsted-Mosquito Hemostats | Fine Scientific Tools | 91308-12 | surgery and stereotaxic injection |
| Small Vessel Cauterizer Kit | Fine Scientific Tools | 18000-00 | surgery and stereotaxic injection |
| Hot Bead Sterilizers | Fine Scientific Tools | 18000-45 | surgery and stereotaxic injection |
| Instrument Case with Silicone Mat | Fine Scientific Tools | 20311-21 | surgery and stereotaxic injection |
| Plastic Sterilization Containers with Silicone Mat | Fine Scientific Tools | 20810-01 | surgery and stereotaxic injection |
| 2P fixed-stage fluorescence scope for in vivo imaging | Olympus | FV1200 MPE | in vivo imaging |
| Multiphoton laser | SpectraPhysics | Mai Tai DeepSee | in vivo imaging |
| Green Laser | Olympus | 473 nm Laser | in vivo imaging |
| xy translational base | Scientifica | MMBP | in vivo imaging |
| FRET filter cube for YFP and CFP | Olympus | in vivo imaging | |
| 10x and 40x water immersion objectives | Olympus | in vivo imaging | |
| air table | Newport | in vivo imaging | |
| custom built light-tight cage | Thorlab | in vivo imaging |
Références
- Day, J. C., Kornecook, T. J., Quirion, R. Application of in vivo. microdialysis to the study of cholinergic systems. Methods. 23, 21-39 (2001).
- Robinson, D. L., Venton, B. J., Heien, M. L., Wightman, R. M. Detecting subsecond dopamine release with fast-scan cyclic voltammetry in vivo. Clin Chem. 49, 1763-1773 (2003).
- Liang, R., Broussard, G. J., Tian, L. Imaging Chemical Neurotransmission with Genetically Encoded Fluorescent Sensors. ACS Chem Neurosci. , (2015).
- Okubo, Y., et al. Imaging extrasynaptic glutamate dynamics in the brain. Proc. Natl. Acad. Sci. USA. 107, 6526-6531 (2010).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods. 10, 162-170 (2013).
- Nguyen, Q. T., et al. An in vivo biosensor for neurotransmitter release and in situ receptor activity. Nat Neurosci. 13, 127-132 (2010).
- Muller, A., Joseph, V., Slesinger, P. A., Kleinfeld, D. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods. 11, 1245-1252 (2014).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. , e3998 (2012).
- Wang, X., McManus, M. Lentivirus production. J Vis Exp. , (2009).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Gjα. Nature. 363, 274-276 (1993).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1, 3166-3173 (2006).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. , (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7, 981-984 (2010).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32, 1277-1309 (2012).
- Yamauchi, J. G., et al. Characterizing ligand-gated ion channel receptors with genetically encoded Ca2+ sensors. PLoS One. 6, e16519 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. 32, 13819-13840 (2012).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2, 932-940 (2005).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Cui, G., et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 494, 238-242 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon