Method Article
Фототромбоза-индуцированной ишемии как модель с повреждением спинного мозга у мышей
В этой статье
Резюме
Photothrombosis is a minimally invasive and highly reproducible procedure to induce focal ischemia in the spinal cord and serves as a model of spinal cord injury in mice.
Аннотация
Spinal cord injury (SCI) is a devastating clinical condition causing permanent changes in sensorimotor and autonomic functions of the spinal cord (SC) below the site of injury. The secondary ischemia that develops following the initial mechanical insult is a serious complication of the SCI and severely impairs the function and viability of surviving neuronal and non-neuronal cells in the SC. In addition, ischemia is also responsible for the growth of lesion during chronic phase of injury and interferes with the cellular repair and healing processes. Thus there is a need to develop a spinal cord ischemia model for studying the mechanisms of ischemia-induced pathology. Focal ischemia induced by photothrombosis (PT) is a minimally invasive and very well established procedure used to investigate the pathology of ischemia-induced cell death in the brain. Here, we describe the use of PT to induce an ischemic lesion in the spinal cord of mice. Following retro-orbital sinus injection of Rose Bengal, the posterior spinal vein and other capillaries on the dorsal surface of SC were irradiated with a green light resulting in the formation of a thrombus and thus ischemia in the affected region. Results from histology and immunochemistry studies show that PT-induced ischemia caused spinal cord infarction, loss of neurons and reactive gliosis. Using this technique a highly reproducible and relatively easy model of SCI in mice can be achieved that would serve the purpose of scientific investigations into the mechanisms of ischemia induced cell death as well as the efficacy of neuroprotective drugs. This model will also allow exploration of the pathological changes that occur following SCI in live mice like axonal degeneration and regeneration, neuronal and astrocytic Ca2+ signaling using two-photon microscopy.
Введение
Травматический травмы спинного мозга (SCI) является разрушительным клиническое состояние влияет сенсомоторной и вегетативной функции СК. Пациенты выжившие SCI часто остаются с изнурительной параплегия, что значительно влияет на их повседневную деятельность и качество жизни 1. Модели экспериментальной SCI были незаменимым инструментом в научных исследованиях, чтобы понять патофизиологию ТСМ и сопутствующих процессов нервной ремонт. Эти модели были также использованы для проверки доклинические эффективности различных экспериментальных нейропротективных вмешательств, направленных на восстановление функций. В настоящее время, большинство моделей ТСМ на практике используют использования физической силы тупым, чтобы механически разрушить и травмировать SC. Эти методы включают в себя ушиб, вывих, сжатие и рассечение КА 2. Было высказано предположение, что после первичной механической инсульта вторичного повреждения в виде ишемии множеств в в поврежденной SC 3,4. Этиология вторичной ишемии включает в себя обширный дегенерации тканей, кровоизлияния паренхимы и иногда обструкции кровеносных сосудов тканей отек 5-7. В результате вторичного повреждения целостности СК далее пострадавших, нейроны и глиальные клетки сильно поражены в функции и жизнеспособности и апоптоз, что приводит к инфаркта рост в хронической стадии травмы, аналогичный рост ишемического инсульта полутени следующей 8,9. Некоторые механизмы, такие как эксайтотоксичности, свободных радикалов и воспаление, как сообщалось, будет отвечать за ишемической гибели клеток следующим ТСМ 10,11. Кроме того, СК ишемия серьезным осложнением торако-аневризмы брюшной аорты ремонт кабинетов, которые часто приводят к параплегии у пациентов 12,13. Несмотря на столь высокую клиническую воздействия очень мало моделей ишемии спинного мозга с высокой воспроизводимости в настоящее время.
нт "> фототромбоза (СТ) является широко используемым методом индукции очаговой ишемии головного мозга 14-20. Методика довольно неинвазивным, высокой воспроизводимостью и дает точное фокусное ишемического поражения в пораженном участке мозга 17 -21. Это достигается путем системного введения светочувствительных красителей, таких как бенгалроза (RB) 16-20,22 или Эритрозин В 23 с последующим облучением локализованного кровеносных сосудов с надлежащего источника света. Фотоактивация красителя приводит к генерации свободных радикалов, которые нарушить целостность сосудистого эндотелия гладкой, и вызвать накопление тромбоцитов, который впоследствии образует тромб. обструкции кровотока по результатам тромба в инфаркта в области, предоставленной емкости 24. Из-за легкости управления на Интенсивность и длительность облучения эта процедура дает очень равномерное и воспроизводимое инфаркт. Кроме того, этот способ может быть использован для индукции infarcт при различных анатомических местах позволяет пространственное (например, серое вещество против белого вещества) понимание влияния ишемии.Цель данного исследования заключается в разработке простого и хорошо воспроизводимый модель SC ишемии у мышей. Мы описали процедуру в РТ модели SC ишемии у мышей. Результаты гистологии и иммунным показали, что СТ может эффективно индуцировать SC миокарда, потерю нейронов и реактивный глиоза.
протокол
Примечание: Мыши (C57BL / 6J, мужчина) в возрасте 10 - 12 недель были использованы в этом исследовании. Все процедуры были выполнены в соответствии с Руководством по NIH по уходу и использованию лабораторных животных и были одобрены Университета Миссури Институциональные животных уходу и использованию комитета (IACUC).
1. Предварительная хирургия
- Накануне автоклаве хирургии и стерилизации всех хирургических инструментов. Оберните инструменты и автоклаве при 121 ° С на 15 фунтов на квадратный дюйм в течение 30 мин с последующим 30 мин сушки (121 о С, 15 фунтов на квадратный дюйм, 30/30 цикл). Поместите инструменты в чистом и стерильной среде до дальнейшего использования.
- Приготовьте свежий бенгальский розовый (РБ) раствор (20 мг / мл в стерильном физиологическом растворе) каждый раз перед операцией. Для полного растворения RB вихревые трубки, то затем ультразвуком в течение 5 мин при 50/60 Гц с мощностью от 19 Вт Wrap труб в алюминиевую фольгу и защитить его от света до дальнейшего используется во время сюрГери.
- Приготовить смесь кетамина / ксилазина в стерильном физиологическом растворе. Добавить 125 мкл (концентрация ксилазина складе: 20 мг / мл) и 325 мкл (концентрация ketmaine складе: 100 мг / мл) и 550 мкл стерильного физиологического раствора, чтобы конечный объем 1 мл анестетика смеси.
- Предварительно нагреть теплокровного грелку.
- Предварительно нагреть металл лампа (источник света для FN1 эпи-флуоресцентного микроскопа) в течение 30 мин для стабилизации мощности лампы.
- Отрегулируйте размер освещенной области диаметром 1 мм с использованием 10X цель и сетки, регулируя полевую диафрагму в вертикальном положении FN1 эпи-флуоресцентного микроскопа.
2. Хирургические процедуры
- Обезболить мышь с дозой кетамина (130 мг / кг B. мас.) И ксилазина (10 мг / кг В. мас.). На основе коктейля в 1.3, 4 мкл на мышь г Б. мас. нужны. Стерилизовать сайт инъекции спиртовым тампоном и управлять анестетиков через Intra-peritoneal (IP), маршрут. Позаботьтесь, чтобы не вводить анестетиков в кровеносные сосуды или мышцы, как это было задержать индукции и восстановление животного.
- Применить искусственной слезы мазь в оба глаза мыши, чтобы предотвратить высыхание и поместите животное на грелку, чтобы предотвратить переохлаждение.
- Подготовка животного
- Проверьте животное для надлежащего уровня хирургической анестезии с помощью пальца щепоткой ответ.
- После того, как животное достигло уровня хирургической анестезии, зажимают волосы на дорсальной поверхности вокруг средней линии животного с помощью электрического триммера волос. Скраб хирургического сайт с 70% этанола с последующим бетадином решения в три раза. Накройте сайт стерильной хирургической драпировка до следующего шага.
- Хирургическая процедура, чтобы тонкой кости, чтобы разоблачить спинного мозга
- Наведите в положении лежа за теплокровного грелку на платформе хирургической (рис 1А). Правильно закрепите мышьпоза с помощью морды зажим для поддержания удлиненную область шеи (фиг.1А, Б).
- Сделайте надрез (длиной около 1 см), используя хирургические ножницы вдоль спинной средней линии, проходящей от грудного позвонков Т9 Т12. Отодвинуть кожу подвергать хирургическому область.
- Использование скальпеля, тщательно очистить мышцы, чтобы разоблачить спинной колючки в T9 - T12 позвонков. Остановка кровотечения в каждом шаге, слегка надавливая стерильной ватным тампоном. Отдельные Т10 - Т12 позвонков от окружающей мышцы и закрепить их с помощью позвоночный зажим, чтобы стабилизировать и предотвратить любое движение (1А, Б).
- Использование высокой скорости дрель с костной полировки сверла, тщательно и аккуратно тонкой спинной поверхности T10 T11 или позвонка визуализировать заднюю спинного вены и другие мелкие сосуды на спинной поверхности КА (рис 1в).
- Для предотвращения термического повреждения из-за тепла, генерируемого во время процедуры прореживания,применить нежный и постоянный поток физиологического раствора вместе с постоянным всасыванием, чтобы удалить мусор.
- Используя скальпель тщательно гладкой поверхности кости до тех пор, пока в основном резервуаре четко виден. Позаботьтесь, чтобы не повредить спинной мозг в этом процессе.
- После того, как кровеносный сосуд визуализировать, управлять RB в дозе 30 мг / кг (веса тела) через ретро-орбитального синуса маршруту с использованием инсулиновый шприц.
- Измерение кровотока с использованием лазерного доплеровского расходомера через 3 мин следующие RB инъекции, если необходимо (2А, В). Поддерживать асептики во время всей процедуры.
3. Индукция PT
- Поместите животное на позиции XY регулируемой ступени над Lab-Джек, который может регулировать высоту. Отрегулируйте положение мыши так подвержены область T11 спинного мозга непосредственно под 10-кратным цели FN1 эпи-флуоресцентного микроскопа (рис 3А).
- Установите мощность LiИсточник GHT на 12% и облучить область T11 с диаметром 0,75 мм в середине разбавленной спинного мозга (Примечание: эта область включает в себя заднюю вену спинного и другие капилляры) с зеленым светом (длина волны 540 - 580 нм, что достигается куба фильтра в микроскоп) через объектив 10X в течение 2 мин. Возьмем изображения в начале и в конце облучения (рис 3б, в) и записывать время эксперимента в этой точке.
- Измерение кровотока снова в течение 10 мин, при необходимости путем размещения лазерного доплеровского зонда на ту же позицию выше спинного мозга, как в 2.4.8 (рисунок 2А, В).
- После проверки облучения для любого кровотечения, и если ни один нашел не приступить к ушивание животное. Шовный поверхностной фасции вместе с мышц на каждой стороне спинного мозга с использованием рассасывающийся шовный или 4-0 шелковой нити размера. Позаботьтесь, чтобы не повредить подвергается SC. Шовный кожу 4-0 шелковой нити. Применить Бетадин или йодк краям кожи после наложения швов.
4. Послеоперационный уход
- После наложения швов, поместите животное на грелку для восстановления. После выздоровления проверить животных на наличие признаков неврологического дефицита, наблюдая движение обеих задних конечностей-. Не оставляйте животное без присмотра, пока он не пришел в сознание достаточно, чтобы поддерживать грудины лежачее положение.
- Передача животных в клетку. Не вернуть животное, претерпела операцию на компании других животных до полного восстановления.
- Проверьте животных на регулярной основе. В случае серьезных неврологических дефицитов, обеспечить надлежащий уход, как эвакуации мочевого пузыря, введения анальгетиков (бупренорфин, 0,05 - 0,1 мг / кг). Проверьте обезвоживания и управлять нормальный физиологический подкожно в тяжелых случаях. Как правило, бупренорфин (0,1 мг / кг) будет введен после наложения швов для облегчения боли в месте операции.
- Если животные не сразуэвтаназии после операции, мы поставим контента диету с высоким воды на полу клетки, таким образом, животные могут добраться до пищи легко.
5. Transcardial перфузии, Нисслю окрашивание и Иммуноокрашивание
- Транскардиальную заливать животное, как описано выше 17-20.
- Обезболить животное, как описано ранее в протоколе и транскардиально заливать фосфатным буферным раствором (PBS, рН 7,4), с последующим ледяной 4% параформальдегида (PFA) в PBS.
- После перфузии, удалить спинной мозг (SC) и пост-это исправить в 4% PFA в PBS при 4 ° CO / N. Передача фиксированного SC в PBS с 30% сахарозы и держать его в течение 2 - 3 дней, пока он не опускается на дно пробирки.
- Использованием криостата сократить спинной мозг в 30 мкм толстых секций и поместить их последовательно на покрытые желатином предметные стекла или в 48-луночный планшет с 0,01 М PBS.
- Нисслю окрашивание: Для проверки вред, причиненный PT выполнить Ниссля stainiнг на участках спинного мозга, как описано выше 17-20.
- Вкратце, собирать каждый пятый спинной кусок шнура на стеклах и пятно 0,25% крезиловым фиолетового. Возьмите образы окрашенных участков (рисунок 4).
- Иммуноокрашивание: Как описано ранее, используя метод плавающей секции 17,18,20.
- Вкратце, окрасить секции спинного мозга путем инкубации O / N при 4 ° С с кроличьей анти-глии фибриллярного кислого белка (GFAP) поликлональные антитела (1: 300), кроличьими анти-NeuN антитела (1: 300), и кролика анти- Iba1 антитела (1: 500), а затем осел анти кролика Alexa 568-конъюгированного IgG (1: 400) вторичными антителами в течение 4 часов при комнатной температуре. Возьмите изображения с флуоресцентным микроскопом (рис 5).
Результаты
Целью данного исследования было получение спинного мозга к ишемии у мышей с использованием модели PT. После требуемой области кости выше спинного мозга (T10 - T12) был тоньше, бенгальский розовый вводили через ретро-орбитального синуса маршрута, и ишемию вызывают путем PT 1А, В показывает мышь, расположенную в заказ хирургическое. Платформа во время операции. Мышь была проведена на месте с помощью зажима морды и два регулируемых зажимов позвоночных стабилизировать спинной мозг Рис 1С показывают утонченную окно выше спинного мозга Т10 -. T12. Основной кровеносный сосуд и его ветви могут быть четко визуализируется. Чтобы подтвердить индукции ишемии, изменения кровотока измеряли с использованием лазерного доплеровского расходомера до и после Pt (фиг.2А, В). Для анализа, снижение% кровотока была рассчитана с использованием базового кровотока до фототромбоза. Кровоток упал до ~ 20% сразу же после светового облучения по сравнению шIth базального уровня до освещения. 3В, С показывает флуоресцентные изображения спинного мозга кровеносных сосудов в начале и в конце PT. Освещение в течение 2 мин индуцированного тромба в кровеносных сосудах (рис 3C), что свидетельствует о индукции ишемии, в соответствии с измерениями лазерного доплеровского расходомера. Для осмотра вред, причиненный PT, мышей умерщвляли через 3 дня после проводили СТ и окрашивание Нисслю. Изображения, полученные с последующим окрашиванием Нисслю показал регион инфаркта, которые могут быть четко разграничены от окружающей области, что свидетельствует спинного мозга повреждение тканей и гибель клеток после PT (рисунок 4). Иммуноокрашивание выполняется для NeuN, GFAP и Iba1. Neun + нейроны погибли в сером веществе в ишемическая основной (рис 5А), в то время как выражение GFAP был увеличен на границе ишемическая основной (рис 5B, также см в штучной упаковке регион). Микроглия Iba1 + выставлены глобоидных морморфологией (т.е.., увеличенный тело клетки с более короткими и меньше процессов, увидеть коробку область) наряду с увеличением Iba1 выражения (5С). Хотя было потери ткани в ишемической области сердцевины из-за окрашивания плавающей разделе, увеличение GFAP и выражения Iba1 во всей пригородных инфаркта регионе можно ясно наблюдать. Эти результаты показывают, гибель нейронов и реактивный глиоза в полутени после ишемии SC. С другой стороны, существенные функциональные дефициты наблюдались в мышей с повреждением, то есть, отключен движение задних конечностей один день после PT, указывающий паралич задних конечностей (-видеть кино).

Рисунок 1. ПТ-индуцированной модели ишемии в спинном мозге. () Фотографии хирургии платформы для спинного мозга PT. Врезка: увеличена позвонков зажимы.(Б) мышь была проведена в морду зажима и двух заказных позвонков зажимов на сцене. Обратите внимание, что кости тоньше на Т10 -. T12 регионе и два зажима позвоночника металлические были использованы для стабилизации спинного мозга (С) увеличение в изображение, показывающее область с тоньше кости выше спинного мозга на T10-11 для индукция PT. Обратите внимание на основные кровеносные сосуды и его филиалов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2. Спинной мозг измерения кровотока. (А) Установка спинного мозга поверхности измерения кровотока с использованием лазерного доплеровского расходомера и стереотаксической устройства для позиционирования зонда. (В)Спинной мозг кровотока до и после PT измерялась. В этом эксперименте, ПТ индуцировали путем освещения с источником света в течение 2 мин с 12% мощности. Диаметр облучаемой поверхности 0,75 мм, был в центре спинного мозга. Кровоток был записан в течение 5 мин, чтобы получить стабилизированный сигнал перед PT и до 10 минут после ПТ. Данные каждой мыши нормированы к значению до светового облучения. График показывает усредненное значение данных из 3 мышей. Стрелка указывает на начало ФП. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3. PT-индуцированной ишемии спинного мозга. () Фотографиямыши помещается на микроскопе для индукции ФП в спинном мозге. Положение мыши можно регулировать в трех измерениях, используя этап XY скольжения и Lab-Джек. Свет от цели 10X была сосредоточена на поверхности спинного мозга. (До н.э.) Флуоресцентные изображения кровеносных сосудов в спинном мозге до (Б) и после (C) освещения после инъекции бенгалроза. Обратите внимание на сгусток крови после 2 мин облучения (C) (см стрелки). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
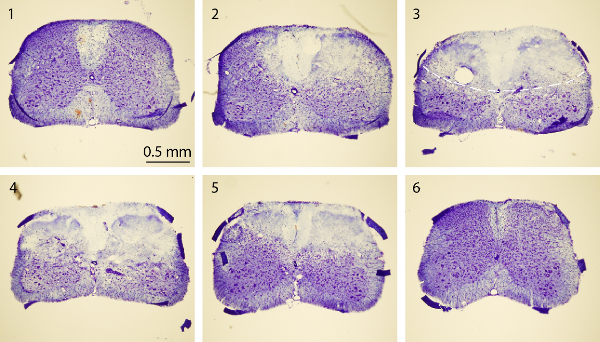
Рисунок 4. Нисслю окрашивание спинного мозга. Ниссля окрашивания изображения из серии ростральных к хвостовой секции спинного мозга поперечных, которые включают нормальные (разделы1 и 6), и СТ-индуцированной Epicenter (разделы 2 - 5). Мышей умерщвляли через 3 дня после PT. Каждая секция спинного мозга толщиной 30 мкм. Интервал между двумя секциями 750 мкм. Пунктирная линия на 3-й изображение очерчивает область инфаркта. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
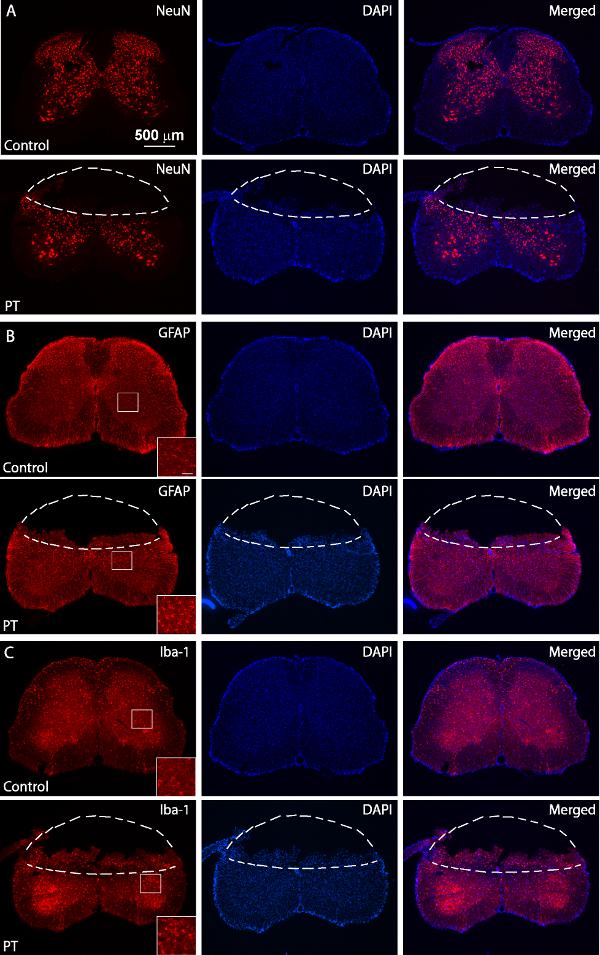
Рисунок 5. Иммуноокрашивание NeuN, GFAP и Iba1. Флуоресцентные изображения NeuN (A), GFAP (Б) и Iba1 (С) Окрашивание от нормальных (верхние панели) и ПТ-ранения (нижние панели) разделы спинного мозга. Ранения мыши были принесены в жертву через 3 дня после PT. Пунктирные линии разделения миокарда областей из нормальных тканей. В коробке регионы показать изображений с высоким разрешением GFAP и выражения Iba1 с масштабной линейки 50мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Кино . PT в спинном мозге индуцируется поведенческие дефициты. Фильм показывает движение нормальной и мыши PT-ранения в клетке. Обратите внимание, перетаскивание обеих задних конечностей-мыши с вступившее в законную силу спинного мозга, с указанием паралич задних конечностей (-параплегия). Фильм был взят 24 ч после ПТ в поврежденной мыши.
Обсуждение
В этом исследовании мы описали фототромботической модель SC ишемии. Благодаря достижениям в области генной инженерии имело всплеск в коммерчески доступных трансгенных мышей, которые сделало возможным изучить влияние конкретных генов, участвующих в патофизиологии ишемического в СК. Цель исследования заключалась в разработке воспроизводимый модель мыши спинного мозга ишемии. Здесь мы адаптировали корковой модели PT индуцировать SCI мышей. После операции задний спинной вены и капилляры на спинной части мышей на уровне T11 грудного позвонка были подвержены. Затем РБ, коммерчески доступный фотоактивное краситель, вводили через ретро-орбитального синуса маршруту, чтобы достичь требуемого распределения сосудов. Подвергаются кровеносных сосудов затем облучают зеленым светом, чтобы вызвать образование тромбов, а затем на инфаркт. Наши результаты гистологических и Иммуноокрашивание методов показали, что СТ индуцированной инфаркт в спинном мозге и Reactiве глиоза в области пригородных инфаркта. Наблюдались также неврологические нарушения, такие как паралич задних конечностей. Эти данные показывают, что СТ находится подходящая модель для изучения патофизиологии и механизмы клеточной смерти после ТСМ. Важным шагом в протоколе является использование высокоскоростного сверла для тонкой поверхности позвонка для визуализации кровеносных сосудов на дорсальной поверхности SC. Этот шаг должен быть тщательно выполнены как применение избыточного давления может вызвать дрель, чтобы войти спинного полости и повредить SC. С другой стороны, неравномерное истончение может привести к неправильной освещенности и может привести к неправильной инфаркты. Чтобы решить эту проблему, часто осмотр поверхности кости под микроскопом после каждого короткого этапа бурения рекомендуется оценить толщину кости и дополнительно оценить применение сверла. Использование стерильного физиологического раствора рекомендуется вымывания мусора, а также для лучшей визуализации открытой поверхности. Поддержание минусыTant асептики в течение всего хирургического вмешательства, собственно послеоперационный уход за животным может улучшить выживаемость животных и увеличить вероятность успеха экспериментов.
Наша текущая модель PT не требует покупки каких-либо дорогих инструментов, как любой лаборатории, оборудованной с эпи-флуоресцентного микроскопа с источником света (например, ртутной лампы, металлогалогенные лампы, или лазера длины волны 488 нм) может Для выполнения этой процедуры. Кроме того, этот метод обеспечивает контроль над размером инфаркта при помощи регулировки размера апертуры по сравнению с другими моделями СК ишемии, как в сочетании окклюзии аорты, левой подключичной и внутренней грудной артерии 25 и модифицированного метода аорты поперечного зажимного 26, которые сложны и чрезвычайно агрессивным. В нашей модели высокая скорость сверла для тонких спинной поверхности позвонка для визуализации был выбран в качестве альтернативы Ламинэктомия, методом выбора многих лабораториях, чтобы побудить SCI.Ламинэктомия включает резку позвонков, которые могут вызвать чрезмерное кровотечение в связи с перерезки позвонков кровеносных сосудов, и это может затруднять поле для визуализации. Даже если некоторые протоколы советуем использовать ватные тампоны, чтобы убрать чрезмерное кровотечение во время ламинэктомией это может привести к сжатию, которые могут привести к дополнительной травме СК. Кроме того подвергается поверхность спинного мозга может прийти в непосредственном контакте с кровью и ее компонентов, а также острыми краями разреза костей, которые можно добавить ненужных изменчивость эксперимента. Использование текущей модели PT, миокарда с различным размером и глубиной могут быть получены путем простого манипулирования интенсивности источника света, продолжительности воздействия и площади открытой поверхности. Хотя данное исследование генерируется ишемии на центральном участке T11 в СК, этот метод может также генерировать инфаркты в различных местах вдоль ростральной к каудальной, а также в поперечном направлении спинного мозга, который миаHT пользу понимания региональной специфики влияния ишемии на параплегии. С другой стороны, хотя освещение на поверхности спинного мозга, свет может проникнуть в определенной глубине в ткани и травма также может быть вызван в сером веществе. Как бенгальский розовый распределяется во всей системе циркуляции, если видов животных одни и те же, и возраст, и вес схожи, мы ожидаем, что соответствует поражения будет генерироваться, как в кортикальной ишемии, вызванной PT.
Другим важным преимуществом PT-индуцированной ишемии очень низкая смертность животных. Низкая смертность означает долгосрочные исследования выживаемости может осуществляться, которые могут быть полезны в разгадке временной эффект ишемического повреждения на восстановление выживания и моторной функции. Эта модель также может помочь в понимании клеточных механизмов ремонт, которые обычно встречаются в конце хронической фазе травмы 14,19,27-29. Эта модель также производит значительные дефициты двигательной функции, которые могут бе используется для оценки эффективности нейропротекторы на функциональное восстановление. Кроме того, эта модель также позволит изучение патологических изменений после ТСМ, таких как дегенерации аксонов и нейронов, регенерации и астроцитов Ca 2+ сигналов и перегрузки в живых мышей с использованием двух-фотонной микроскопии.
Как и все другие модели SCI, PT не лишена недостатков. К недостаткам этого метода аналогичны тем, которые наблюдаются в корковом PT. Мало кто из недостатков относятся отсутствие четкой анатомически ишемической полутени, которая мишенью многих ноотропных препаратов, и отсутствие реперфузии. Известно, что вследствие ишемии реперфузии характеризуется изменениями как повышенной продукции активных форм кислорода, инфильтрации воспалительных клеток и повышенной продукции цитокинов 30-32. Отсутствие реперфузии в PT означает изменения, связанные с реперфузионного повреждения в СК будет по-прежнему трудно изучать с использованием этой модели.Тем не менее, преимущества использования PT индуцированной ишемией перевешивают недостатки, и этот метод обеспечивает исследователей с легко выполнить и высокой воспроизводимостью модели генерации SCI мышей.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа была поддержана Национальным институтом здравоохранения [Грант не. R01NS069726] и Американской кардиологической ассоциации Грант в помощи Грант [Грант нет. 13GRNT17020004] СД.
Материалы
| Name | Company | Catalog Number | Comments |
| Rose Bengal | Sigma-Aldrich | 330000 | 20 mg/ml in sterile saline |
| C57BL/6J | Jackson lab | 664 | 22 - 25 g |
| Ketamine | VEDCO | NDC-50989-996-06 | 100 mg/ml |
| Xylazine | VEDCO | NDC-50989-234-11 | 100 mg/ml |
| Betadine solution | Purdue | NDC-67618-150-01 | 10% povidone iodine topical solution |
| Normal saline | Abott Laboratories | 04930-04-10 | For diluting RB, anaesthesia and for preventing tissue from drying |
| Artificial tears ointment | Rugby | NDC-0536-6550-91 | 83% white petrolatum |
| Ethanol | Decon labs.Inc | 2716 | 70% ethanol for disinfection |
| Metal halide lamp | EXFO, Canada | X-Cite 120 PC | Set power at 12% |
| Spring scissors | Fine Science Tool | 15000-10 | for minor dissection |
| Scissors (angled to side) | Fine Science Tool | 14063-011 | No. 3 handle |
| Standard scalpel | Fine Science Tool | 10003-12 | for removing muscle |
| Scalpel blade | Feather | 2976 | No. 10 |
| Forceps (curved) | Fine Science Tool | 11150-10 | for holding tissue |
| Forceps (straight) | Fine Science Tool | 11151-10 | for holding tissue |
| Needle holder | Fine Science Tool | 12002-12 | for suturing |
| Tissue adhesive glue | 3M Vetbond | 1469SB | to adhere to edges of the cut skin |
| Monofilament polypropylene | USSC Sutures | VP-521 | Size = 4-0 (for fascia) |
| Perma-hand silk | Ethicon | 683G | Size = 4-0 (for skin) |
| Micro drill | Roboz Surgical Instrument Co. Inc. | RS-6300 | with bone polishing drill bit |
| Laser doppler flowmeter | Moor Instruments | moorVMS-LDF1 | for monitoring change in blood flow |
| Heating pad | Fine Science Tool | 21052-00 | to prevent hypothermia |
| Lab-Jack | Fisher scientific | 14-673-50 | 4 x 4 in plate to adjust the height of the animal |
| X-Y gliding stage | Amscope | GT100 | for positioning the animal under microscope |
Ссылки
- Cadotte, D. W., Fehlings, M. G. Spinal cord injury: a systematic review of current treatment options. Clin Orthop Relat Res. 469 (3), 732-741 (2011).
- Cheriyan, T., et al. Spinal cord injury models: a review. Spinal Cord. 52 (8), 588-595 (2014).
- Young, W. Secondary injury mechanisms in acute spinal cord injury. J Emerg Med. 11, Suppl 1. 13-22 (1993).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Soubeyrand, M., et al. Effect of norepinephrine on spinal cord blood flow and parenchymal hemorrhage size in acute-phase experimental spinal cord injury. Eur Spine J. 23 (3), 658-665 (2014).
- Soubeyrand, M., et al. Real-time and spatial quantification using contrast-enhanced ultrasonography of spinal cord perfusion during experimental spinal cord injury. Spine (Phila Pa 1976). 37 (22), E1376-E1382 (2012).
- Mautes, A. E., Weinzierl, M. R., Donovan, F., Noble, L. J. Vascular events after spinal cord injury: contribution to secondary pathogenesis). Phys Ther. 80 (7), 673-687 (2000).
- Liu, X. Z., et al. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci. 17 (14), 5395-5406 (1997).
- Liu, L., et al. An experimental study of cell apoptosis and correlative gene expression after tractive spinal cord injury in rats. Zhonghua Wai Ke Za Zhi. 42 (23), 1434-1437 (2004).
- Hirose, K., et al. Activated protein C reduces the ischemia/reperfusion-induced spinal cord injury in rats by inhibiting neutrophil activation. Ann Surg. 232 (2), 272-280 (2000).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guerit, J. M., Dion, R. A. State-of-the-art of neuromonitoring for prevention of immediate and delayed paraplegia in thoracic and thoracoabdominal aorta surgery). Ann Thorac Surg. 74 (5), S1867-S1869 (2002).
- Schepens, M. A., Heijmen, R. H., Ranschaert, W., Sonker, U., Morshuis, W. J. Thoracoabdominal aortic aneurysm repair: results of conventional open surgery. Eur J Vasc Endovasc Surg. 37 (6), 640-645 (2009).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Exp Transl Stroke Med. 1, 8(2009).
- Carmichael, S. T. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dietrich, W. D., Ginsberg, M. D., Busto, R., Watson, B. D. Photochemically induced cortical infarction in the rat. 1. Time course of hemodynamic consequences. J Cereb Blood Flow Metab. 6 (2), 184-194 (1986).
- Zhang, W., et al. Neuronal protective role of PBEF in a mouse model of cerebral ischemia. J Cereb Blood Flow Metab. 30 (12), 1962-1971 (2010).
- Li, H., Zhang, N., Sun, G., Ding, S. Inhibition of the group I mGluRs reduces acute brain damage and improves long-term histological outcomes after photothrombosis-induced ischaemia. ASN Neuro. 5 (3), 195-207 (2013).
- Li, H., et al. Histological, cellular and behavioral assessments of stroke outcomes after photothrombosis-induced ischemia in adult mice. BMC Neurosci. 15, 58(2014).
- Wang, T., Cui, W., Xie, Y., Zhang, W., Ding, S. Controlling the Volume of the Focal Cerebral Ischemic Lesion through Photothrombosis. American Journal of Biomedical Sciences. 2 (1), 33-42 (2010).
- Schroeter, M., Jander, S., Stoll, G. Non-invasive induction of focal cerebral ischemia in mice by photothrombosis of cortical microvessels: characterization of inflammatory responses. J Neurosci Methods. 117 (1), 43-49 (2002).
- Boquillon, M., Boquillon, J. P., Bralet, J. Photochemically induced, graded cerebral infarction in the mouse by laser irradiation evolution of brain edema. J Pharmacol Toxicol Methods. 27 (1), 1-6 (1992).
- Kim, G. W., Lewen, A., Copin, J., Watson, B. D., Chan, P. H. The cytosolic antioxidant, copper/zinc superoxide dismutase, attenuates blood-brain barrier disruption and oxidative cellular injury after photothrombotic cortical ischemia in mice. Neuroscience. 105 (4), 1007-1018 (2001).
- Schmidt, A., et al. Photochemically induced ischemic stroke in rats. Exp Transl Stroke Med. 4 (1), 13(2012).
- Lang-Lazdunski, L., et al. Spinal cord ischemia. Development of a model in the mouse. Stroke. 31 (1), 208-213 (2000).
- Wang, Z., et al. Development of a simplified spinal cord ischemia model in mice. J Neurosci Methods. 189 (2), 246-251 (2010).
- Labat-gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. J Vis Exp. (76), (2013).
- Lu, H., et al. Induction and imaging of photothrombotic stroke in conscious and freely moving rats. J Biomed Opt. 19 (9), 96013(2014).
- Seto, A., et al. Induction of ischemic stroke in awake freely moving mice reveals that isoflurane anesthesia can mask the benefits of a neuroprotection therapy. Front Neuroenergetics. 6 (1), (2014).
- Bell, M. T., et al. Toll-like receptor 4-dependent microglial activation mediates spinal cord ischemia-reperfusion injury. Circulation. 128 (11 Suppl 1), S152-S156 (2013).
- Smith, P. D., et al. The evolution of chemokine release supports a bimodal mechanism of spinal cord ischemia and reperfusion injury. Circulation. 126 (11 Suppl 1), S110-S117 (2012).
- Jia, Z., et al. Oxidative stress in spinal cord injury and antioxidant-based intervention. Spinal Cord. 50 (4), 264-274 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены