Method Article
Photothrombosis-induced איסכמיה מיקוד כדגם של חוט השדרה פגיעה בעכברים
In This Article
Summary
Photothrombosis is a minimally invasive and highly reproducible procedure to induce focal ischemia in the spinal cord and serves as a model of spinal cord injury in mice.
Abstract
Spinal cord injury (SCI) is a devastating clinical condition causing permanent changes in sensorimotor and autonomic functions of the spinal cord (SC) below the site of injury. The secondary ischemia that develops following the initial mechanical insult is a serious complication of the SCI and severely impairs the function and viability of surviving neuronal and non-neuronal cells in the SC. In addition, ischemia is also responsible for the growth of lesion during chronic phase of injury and interferes with the cellular repair and healing processes. Thus there is a need to develop a spinal cord ischemia model for studying the mechanisms of ischemia-induced pathology. Focal ischemia induced by photothrombosis (PT) is a minimally invasive and very well established procedure used to investigate the pathology of ischemia-induced cell death in the brain. Here, we describe the use of PT to induce an ischemic lesion in the spinal cord of mice. Following retro-orbital sinus injection of Rose Bengal, the posterior spinal vein and other capillaries on the dorsal surface of SC were irradiated with a green light resulting in the formation of a thrombus and thus ischemia in the affected region. Results from histology and immunochemistry studies show that PT-induced ischemia caused spinal cord infarction, loss of neurons and reactive gliosis. Using this technique a highly reproducible and relatively easy model of SCI in mice can be achieved that would serve the purpose of scientific investigations into the mechanisms of ischemia induced cell death as well as the efficacy of neuroprotective drugs. This model will also allow exploration of the pathological changes that occur following SCI in live mice like axonal degeneration and regeneration, neuronal and astrocytic Ca2+ signaling using two-photon microscopy.
Introduction
פגיעה בחוט השדרה טראומטית (SCI) היא מצב קליני הרסני המשפיע על הפונקציות הסנסורית והאוטונומיות של SC. חולים ששרדו SCI לעתים קרובות נשארים עם מתיש paraplegia שמשפיע באופן משמעותי את הפעילות היומית שלהם ואיכות חייהם 1. מודלים הניסיוניים SCI היו כלי הכרחי בחקירה המדעית להבין את הפתופיזיולוגיה של SCI ותהליכי תיקון עצבי קשורים. מודלים אלה יש גם שימשו לבדיקת היעילות פרה-קלינית של התערבויות נוירו ניסיוניות שונות שמטרתם החלמה תפקודית. נכון לעכשיו, רוב דגמי SCI בפועל להעסיק את השימוש בכח פיזי בוטה לשבש מכאני ולפגוע בSC. שיטות אלה כוללות חבלה, דחיסה, נקע וחיתוך רוחב של SC 2. זה כבר הציע כי לאחר העלבון המכני העיקרי פגיעה משנית בצורה של סטי איסכמיה בSC הפצוע 3,4. אטיולוגיה של איסכמיה המשנית כוללת ניוון נרחב רקמות, דימום parenchymal ולפעמים על ידי חסימה של כלי דם על ידי בצקת רקמת 5-7. כתוצאה מהפגיעה המשנית שלמות SC מושפעת נוספת, תאי עצב ותאי גליה הם נפגעים קשים בתפקוד וביכולת קיום ועוברים אפופטוזיס שמוביל לאוטם צמיחה בשלב הכרוני של פציעה, מקביל לצמיחה של השבץ איסכמי הבא פנומברה 8,9. מספר מנגנונים כמו הפעלת יתר רעילה, ייצור של רדיקלים חופשיים, ודלקת כבר דיווחו להיות אחראי למותם של תאי איסכמי הבאים SCI 10,11. בנוסף, איסכמיה SC הוא סיבוך חמור של ניתוחי תיקון מפרצת אב העורקים thoraco-בטן אשר לעתים קרובות להוביל לparaplegia בחולי 12,13. למרות השפעה קלינית כה גבוהה מעט מאוד מודלים של איסכמיה חוט השדרה עם שחזור גבוה זמינים כרגע.
NT "> Photothrombosis (PT) הוא שיטה נפוץ לאינדוקציה של איסכמיה מוקדי במוח 14-20. הטכניקה היא די בלתי פולשני, שחזור מאוד ומייצר נגע איסכמי מוקד מדויק באזור החשוף של המוח 17 -21. זו מושגת על ידי ממשל מערכתי של צבעי photoactive כמו רוז בנגל (RB) 16-20,22 או erythrosine B 23 ואחריו הקרנה מקומית של כלי דם עם מקור אור נכון. Photoactivation של הצבע גורם לייצור של רדיקלים חופשיים ש לשבש את שלמותו של האנדותל כלי הדם החלק, ולגרום לטסיות הדם לצבור, אשר לאחר מכן יוצר קריש דם. החסימה של זרימת דם על ידי קריש הדם בתוצאות אוטם באזור המסופק על ידי כלי השיט 24. בשל להקל שליטה על עוצמת ומשך הקרנת הליך זה מניב אוטם אחיד ושחזור מאוד. יתר על כן, בשיטה זו יכולה להיות מועסק על מנת לגרום לinfarcלא במקומות אנטומיים שונים מאפשר הבנה מרחבית (למשל, חומר אפור לעומת חומר לבן) של ההשפעה של איסכמיה.מטרת המחקר הנוכחי היא לפתח מודל קל מאוד לשחזור של איסכמיה SC בעכברים. אנחנו תיארנו את ההליך של מודל PT של איסכמיה SC בעכברים. תוצאות מהיסטולוגיה וimmunostaining הוכיחו כי PT יכול למעשה לגרום לאוטם SC, אובדן עצבי ודבק תגובתי.
Protocol
הערה: עכברים (C57BL / 6J, זכר) בגילים 10 - 12 שבועות שמשו במחקר זה. כל הנהלים בוצעו בהתאם למדריך NIH לטיפול והשימוש בחי מעבדה ואושרו על ידי אוניברסיטת מיזורי המוסדית הטיפול בבעלי חי ועדת שימוש (IACUC).
1. טרום ניתוח
- היום לפני ניתוח החיטוי ולעקר את כל מכשירי הניתוח. לעטוף את המכשירים וחיטוי ב 121 מעלות צלסיוס ב 15 psi במשך 30 דקות ואחרי 30 דקות של ייבוש (C 121 o, 15 psi, 30/30 מחזור). הנח את המכשירים בסביבה נקייה וסטרילי עד לשימוש נוסף.
- הכן פתרון טרי רוז בנגל (RB) (20 מ"ג / מיליליטר בתמיסת מלח סטרילית) בכל פעם שלפני הניתוח. לפזר לגמרי RB, מערבולת הצינור לאחר מכן על ידי sonication 5 דקות בהרץ 50/60 תפוקת חשמל של 19 W. לעטוף את הצינור בנייר אלומיניום ולהגן עליו מפני אור עם עד בשימוש עוד במהלך surגרי.
- הכן תערובת של קטמין / xylazine בתמיסת מלח סטרילית. להוסיף 125 μl של xylazine (ריכוז מניות: 20 מ"ג / מיליליטר) וμl 325 של ketmaine (ריכוז מניות: 100 מ"ג / מיליליטר) ו -550 μl של תמיסת מלח סטרילית לעשות נפח סופי של 1 מיליליטר של תערובת הרדמה.
- טרום חם כרית חימום homeothermic.
- טרום חם מנורת מטל הלייד (מקור אור למיקרוסקופ פלואורסצנטי עלית FN1) למשך 30 דקות כדי לייצב את כוח המנורה.
- להתאים את גודל האזור המואר לקוטר של 1 מ"מ באמצעות אובייקטיבי 10X וreticle ידי התאמת סרעפת השדה במיקרוסקופ פלואורסצנטי עלית FN1 הזקוף.
2. נוהל כירורגי
- להרדים את העכבר עם מנה של קטמין (130 מ"ג / קילוגרם ב WT.) ו xylazine (WT ב / קילוגרם 10 מ"ג.). בהתבסס על הקוקטייל ב1.3, 4 μl לגרם של WT ב עכבר. יש צורך. לעקר את האתר של הזרקה עם ספוגית אלכוהול ולנהל את ההרדמה דרך הפניםמסלול -peritoneal (IP). יש להיזהר שלא להזריק ההרדמה לתוך כלי דם או השריר כמו זה יעכב את האינדוקציה והתאוששות של בעלי החיים.
- החל משחה דמעה מלאכותית לשתי העיניים של העכבר כדי למנוע התייבשות ומניח את החיה על כרית החימום כדי למנוע היפותרמיה.
- הכנת בעלי החיים
- בדקו את בעלי החיים להרדמה כירורגית רמה נאותה על ידי שימוש בתגובת קמצוץ הבוהן.
- ברגע שהגיעו לבעלי חי רמה כירורגית של הרדמה, קליפ השיער על פני השטח הגבי סביב קו האמצע של בעלי החיים באמצעות גוזם שיער חשמלי. לשפשף את האתר כירורגית עם 70% אתנול ואחריו פתרון בטאדין שלוש פעמים. מכסה את האתר עם וילון ניתוח סטרילי עד השלב הבא.
- הליך כירורגי לדק העצם לחשוף את חוט השדרה
- מניחים את העכבר בעמדה נוטה על כרית חימום homeothermic על הפלטפורמה כירורגית (איור 1 א). כראוי לאבטח את העכבריציבה באמצעות מהדק חוטם לשמור אזור צוואר מוארך (איור 1 א ', ב').
- עושה חתך (כ 1 סנטימטר) באמצעות מספריים כירורגיות לאורך קו אמצע הגב המשתרע מT9 חוליות החזה לT12. הזז הצידה את העור לחשוף אזור ניתוח.
- באמצעות אזמל, בזהירות לנקות את השרירים כדי לחשוף את עמוד השדרה הגבי בT9 - T12 חוליות. לעצור את הדימום בכל שלב על ידי הפעלת לחץ עדין עם מקלון צמר גפן סטרילי. T10 הנפרד - T12 חוליות מהשרירים המקיפים ולאבטח אותם באמצעות מהדק השדרה כדי לייצב ולמנוע כל תנועה (איור 1 א ', ב').
- באמצעות מקדח במהירות גבוה עם מקדח עצם ליטוש, בזהירות ובעדינות דקה לפני שטח הגב של T10 או T11 חוליה לדמיין את הווריד האחורי של עמוד השדרה וספינות קטנות אחרות על פני השטח הגב של SC (איור 1 ג).
- כדי למנוע נזק תרמי עקב חום שנוצר במהלך הליך הדילול,תחול זרם עדין וקבוע של מלח רגיל יחד עם שאיבה קבועה כדי להסיר את הפסולת.
- באמצעות אזמל להחליק בזהירות את משטח העצם עד הספינה העיקרית היא ברור לעין. יש להיזהר שלא לפגוע בחוט השדרה במהלך תהליך זה.
- ברגע שכלי הדם דמיינו, לנהל RB במינון של 30 מ"ג / קילוגרם (משקל גוף) דרך מסלול סינוס רטרו מסלולית באמצעות מזרק אינסולין.
- למדוד את זרימת דם באמצעות מד זרימת הלייזר דופלר לאחר 3 דקות לאחר הזרקת RB אם (איור 2 א, ב) צורך. לשמור asepsis במהלך ההליך כולו.
3. אינדוקציה של PT
- מניחים את החיה על במה מתכווננת עמדת XY על מעבדה-ג'ק שיכול להתאים את הגובה. להתאים את המיקום של העכבר כך האזור החשוף של חוט השדרה T11 הוא ישירות תחת מטרת 10x של מיקרוסקופ פלואורסצנטי עלית FN1 (איור 3 א).
- הגדר את הכח שלימקור להילחם על 12% ומקרינים את אזור T11 בקוטר של 0.75 מ"מ באמצע חוט השדרה דליל (הערה: אזור זה כולל את הווריד האחורי של עמוד השדרה ונימים אחרות) עם אור ירוק (אורך גל 540-580 ננומטר, שהוא מושגת על ידי קוביית המסנן במיקרוסקופ) באמצעות אובייקטיבי 10X למשך 2 דקות. קח תמונות בתחילת וסוף ההקרנה (איור 3, C) ולהקליט את הזמן של הניסוי בשלב זה.
- למדוד את זרימת דם שוב במשך 10 דקות במידת צורך על ידי הצבת חללית דופלר לייזר לאותה התנוחה מעל חוט השדרה כמו ב2.4.8 (איור 2 א, ב).
- לאחר הקרנת סימון עבור כל דימום ואם אף מצא להמשיך לתפירת בעלי החיים. לתפור את fascia השטחי יחד עם השרירים בכל הצד של חוט השדרה באמצעות תפר נספג או תפר משי 4-0 גודל. יש להיזהר שלא לפגוע בSC החשוף. לתפור את העור עם תפר 4-0 משי. החל פולידין או יודאת הקצוות של העור לאחר תפירה.
ניתוח-הודעה טיפוח 4.
- לאחר תפירה, הנח את החיה על כרית החימום להתאוששות. לאחר ההתאוששות לבדוק את החיות לסימנים של גירעונות נוירולוגיות על ידי התבוננות התנועה של שני האחורי-הגפיים. אל תשאירו את בעלי החיים ללא השגחה עד שהוא חזר להכרה מספיק כדי לשמור על כיבה sternal.
- העבר את החיות לכלוב בבית. אל תחזיר את בעלי החיים שעברו ניתוח לחברה של בעלי חיים אחרים, עד שהתאושש באופן מלא.
- בדקו את בעלי החיים במרווחים זמן קבועים. במקרה של גירעונות נוירולוגים חמורים, לספק טיפול הולם כמו פינוי שלפוחית השתן, ממשל של משככי כאבים (עצירות, 0.05-0.1 מ"ג / קילוגרם). בדקו התייבשות ותת עורי לנהל מלח רגיל במקרה חמור. בדרך כלל, עצירות (0.1 מ"ג / קילוגרם) תנוהל לאחר תפירת כדי להקל על כאב באזור הניתוח.
- אם בעלי חיים הם לא באופן מיידימורדמים לאחר ניתוח, נוכל לשים את דיאטת תכולת מים גבוהים על רצפת הכלוב, כך החיות יכולות להגיע למזון בקלות.
5. Transcardial זלוף, מכתים Nissl וImmunostaining
- Transcardially ינקב את החיה כפי שתואר לעיל 17-20.
- להרדים את החיה כפי שתואר קודם לכן בפרוטוקול וtranscardially perfuse עם פוספט החיץ (PBS, pH 7.4), ואחריו paraformaldehyde 4% קרים כקרח (PFA) ב- PBS.
- לאחר זלוף, להסיר את חוט השדרה (SC) ופוסט-לתקן את זה PFA 4% PBS ב 4 ° CO / N. העבר את SC הקבוע לPBS עם סוכרוז 30% ולשמור אותו ל2-3 ימים עד שהיא שוקעת לתחתית של התחתית.
- באמצעות cryostat לחתוך את חוט השדרה ל -30 מיקרומטר חלקים עבים ומניח אותם באופן סדרתי בשקופיות זכוכית מצופה ג'לטין או בצלחת 48-היטב עם 0.01 M PBS.
- צביעת Nissl: כדי לבדוק את הניזק שנגרם על ידי PT לבצע staini Nisslng על חלקי חוט השדרה כפי שתואר בעבר 17-20.
- בקצרה, לאסוף כל פרוסה חוט השדרה החמישית בשקופיות הזכוכית וכתם עם 0.25% סגולים cresyl. קח תמונות של החלקים המוכתמים (איור 4).
- Immunostaining: כפי שתואר באמצעות 17,18,20 שיטת הסעיף צף בעבר.
- בקצרה, להכתים את חלקי חוט השדרה על ידי דוגרים O / N ב 4 ° C עם חלבון ארנב נגד גליה fibrillary חומצי (GFAP) נוגדן polyclonal (1: 300), נוגדן ארנב נגד NeuN (1: 300), ונגד ארנב נוגדן Iba1 (1: 500) ואחרי ארנב נגד חמור IgG Alexa 568 מצומדות- (1: 400) נוגדנים משני עבור 4 שעות ב RT. קח תמונות עם מיקרוסקופ פלואורסצנטי (איור 5).
תוצאות
מטרת מחקר זה הייתה לייצר איסכמיה חוט השדרה בעכברים באמצעות מודל PT. אחרי האזור הרצוי של עצם מעל חוט השדרה (T10 - T12) היה דליל, רוז בנגל הוזרק דרך מסלול סינוס רטרו מסלולית, ואיסכמיה הייתה מושרה על ידי PT איור 1 א ', ב' יציג את העכבר ממוקם בכירורגית מחוייט. פלטפורמה במהלך ניתוח. העכבר נערך במקום על ידי מהדק חוטם ושתי חוליות מתכוונן מלחציים לייצב את עמוד השדרה תרשים 1C להראות חלון דליל מעל חוט השדרה של T10 -. T12. כלי הדם הראשיים והסתעפויותיה ניתן בבירור דמיינו. כדי לאשר את הגיוס של איסכמיה, שינויים בזרימת דם נמדדו באמצעות מד זרימת דופלר לייזר לפני ואחרי PT (איור 2 א, ב). לניתוח, הירידה ב% מזרימת הדם חושב באמצעות זרימת דם בתחילת המחקר לפני photothrombosis. זרימת דם ירד ל ~ 20% מייד לאחר הארת אור לעומת wה- i הרמה הבסיסית לפני ההארה. איור 3, C מראה תמונות ניאון של כלי דם בעמוד השדרה בתחילת וסוף PT. תאורה למשך 2 דקות קריש דם מושרה בכלי הדם (איור 3 ג), המצביע על האינדוקציה של איסכמיה, עולה בקנה אחד עם המדידות של מד זרימת דופלר הלייזר. כדי לבדוק את הניזק שנגרם על ידי PT, עכברים הוקרבו 3 ימים לאחר PT וצביעת Nissl בוצעו. תמונות שצולמו לאחר צביעת Nissl הראו אזור האוטם שניתן מסומן בבירור מהאזור שמסביב, המצביע על נזק בעמוד השדרה ורקמות מוות של תאים לאחר PT (איור 4). Immunostaining בוצע עבור NeuN, GFAP וIba1. נוירונים NeuN + אבדו בחומר האפור בליבת איסכמי (איור 5 א), ואילו ביטוי GFAP הוגדל בגבול של ליבת איסכמי (איור 5, גם לראות את האזור התאגרף). מיקרוגלי Iba1 + הציגו מור globoidphology (כלומר., גוף תא מוגדל עם תהליכים קצרים יותר ופחות, לראות את האזור התאגרף) יחד עם ביטוי Iba1 המוגבר (איור 5 ג). למרות שלא היה אובדן רקמות באזור הליבה איסכמי בשל הכתמת סעיף צף, עלייה בGFAP וביטוי Iba1 באזור פרי-האוטם השלם יכולה להיות נצפתה בבירור. תוצאות אלו מצביעות על מוות עצבי ודבקי תגובתי בצללים לאחר איסכמיה SC. מצד השני, ליקויים תפקודיים משמעותיים נצפו בעכברים שנפגעו, כלומר יום אחד תנועה אחורית-איבר נכים, לאחר PT, המצביעים על שיתוק של גפיים אחוריות-(ראה הסרט).

איור 1. מודל מושרה-PT איסכמיה בחוט השדרה. () תמונות של פלטפורמת הניתוח לחוט השדרה PT. הבלעה: הורחבה מלחציים השדרה.(ב) העכבר נערך על ידי מהדק חוטם ועל ידי שני מלחציים השדרה מחוייט על הבמה. שים לב שהעצם היה דליל בT10 -. אזור T12 ושני מלחציים חוליות מתכת שמשו לייצב את עמוד השדרה (C) זום-בתמונה המראה את האזור עם דלל-העצם מעל חוט השדרה בT10-11 ל אינדוקציה של PT. שים לב כלי הדם הראשיים והסתעפויותיה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. זרימת דם מדידת חוט השדרה. (א) ההתקנה של מדידת זרימת דם בעמוד השדרה משטח כבל באמצעות מד זרימת דופלר לייזר ומכשיר stereotaxic כדי למקם את החללית. (ב)זרימת דם בעמוד השדרה לפני ואחרי PT נמדדה. בניסוי זה, PT היה מושרה על ידי מאיר עם מקור אור למשך 2 דקות עם 12% תפוקת חשמל. הקוטר של פני השטח המוקרנים היה 0.75 מ"מ והיה באמצע חוט השדרה. זרימת דם נרשמה לעד 5 דקות לקבלת אות התייצבה לפני PT ועד 10 דקות הבאות PT. נתונים מכל עכבר היה מנורמל לערך לפני תאורת אור. הגרף מראה את הערך הממוצע של הנתונים מ3 עכברים. החץ מציין את תחילתו של PT. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

צילום איור 3. PT-induced איסכמיה חוט השדרה. (א) לעכבר ממוקם על המיקרוסקופ לזירוז PT בחוט השדרה. העמדה של העכבר יכולה להיות מותאמת בשלושה ממדים באמצעות שלב גלישת XY ומעבדה-ג'ק. אור ממטרת 10X היה ממוקד על פני השטח של חוט השדרה. (BC) תמונות פלורסנט של כלי הדם בעמוד השדרה לפני (B) ואחרי ההארה (ג) לאחר ההזרקה של רוז בנגל. שים לב לקריש הדם לאחר 2 דקות של הקרינה (C) (ראה חיצים). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
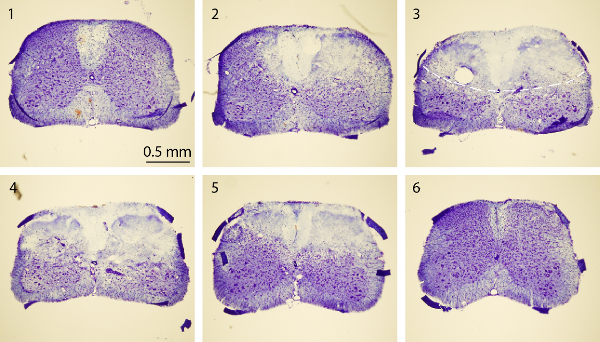
איור 4. מכתים Nissl של חוט השדרה. תמונות מכתים Nissl של סדרה של חלקים רוחביים חוט השדרה מקורי לזנב שכוללות (סעיפים רגילים1 ו -6) ומוקד מושרה PT (סעיפים 2-5). העכברים הוקרבו 3 ימים לאחר PT. כל קטע חוט השדרה הוא 30 מיקרומטר עבה. המרווח בין שני חלקים הוא 750 מיקרומטר. הקו המקווקו בתמונת 3 rd מתאר את אזור האוטם. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
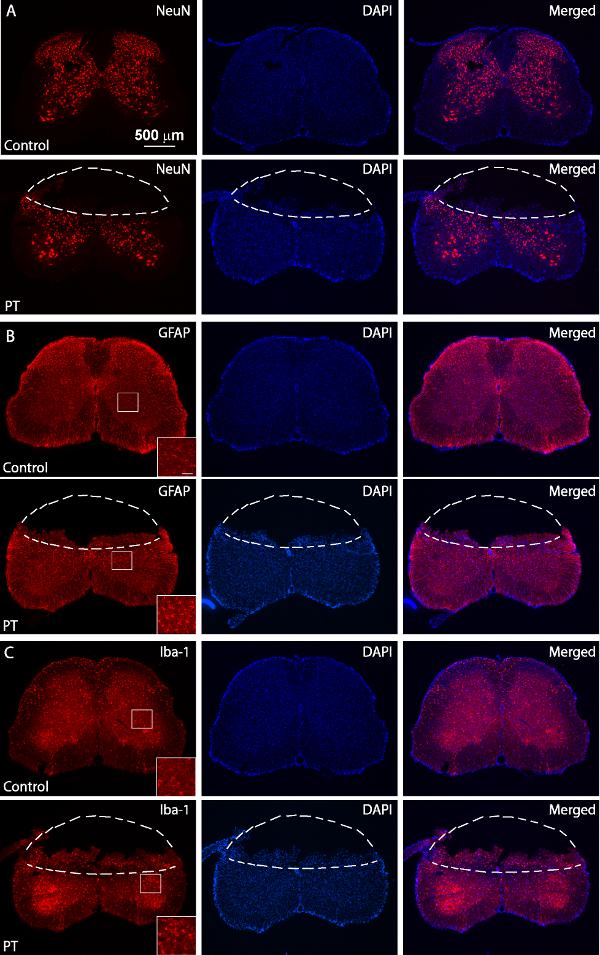
איור 5. Immunostaining של NeuN, GFAP וIba1. תמונות ניאון של NeuN (), GFAP (B) וIba1 צביעה (C) מ( לוחות העליונים) רגילים וPT-נפצעו (לוחות נמוכים יותר) חלקי חוט השדרה. העכבר נפצע הוקרב 3 ימים לאחר PT. קווים מקווקווים להפריד את אזורי האוטם מרקמות נורמליות. האזורים התאגרפו להראות תמונות ברזולוציה גבוהות של GFAP וביטוי Iba1 עם בר סולם של 50מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

סרט. PT בחוט השדרה נגרם גירעונות התנהגותיות. הסרט מציג את התנועה של נורמלי ועכבר נפצע PT בכלוב. שים לב לגרירה של שני האחורי-הגפיים של העכבר עם חוט השדרה מחוסן, המצביע על שיתוק של גפיים אחוריות-(paraplegia). הסרט צולם 24 שעות לאחר PT בעכבר הפצוע.
Discussion
במחקר זה, שתארנו מודל photothrombotic של איסכמיה SC. בשל התקדמות בהנדסה גנטית חל זינוק בעכברים מהונדסים זמינים מסחרי שהפך אותו ניתן ללמוד את ההשפעה של גנים ספציפיים המעורבים בפתופיזיולוגיה איסכמי בSC. מטרת המחקר הייתה לפתח מודל עכבר לשחזור של איסכמיה חוט השדרה. כאן אנו מותאמים מודל PT קליפת המוח כדי לגרום לפגיעה בחוט שדרה בעכברים. לאחר ניתוח הווריד האחורי של עמוד השדרה ונימים בהיבט הגב של עכברים ברמה של החוליה T11 חזה נחשפו. אז RB, צבע photoactive זמין מסחרי, הוזרק דרך מסלול סינוס רטרו מסלולית להשיג הפצת כלי דם רצויה. כלי הדם חשוף אז מוקרן על ידי אור ירוק ללגרום להיווצרות קרישי דם, ומאוחר יותר באוטם. התוצאות שלנו משיטות היסטולוגית וimmunostaining הראו כי PT מושרה אוטם בחוט השדרה וReactiיש דבק באזור פרי-האוטם. גירעונות נוירולוגיות כמו שיתוק גפיים האחורי גם נצפו. נתונים אלה מראים כי PT הוא מודל מתאים ללימוד הפתופיזיולוגיה ומנגנונים של מוות של תאים לאחר SCI. השלב הקריטי בפרוטוקול הוא השימוש בתרגיל במהירות גבוהה לדק על פני השטח של חוליה להדמיה של כלי דם על פני השטח הגב של SC. צעד זה צריך להתבצע בזהירות כהפעלת לחץ עודף עלולים לגרום לתרגיל להיכנס חלל עמוד השדרה ולגרום הנזק לSC. מצד השני, דילול אחיד עלול לגרום לתאורה לא תקינה ועלול לייצר אוטמים לא סדירים. כדי לטפל בבעיה זו, בדיקה תכופה של פני השטח של העצם תחת מיקרוסקופ לאחר כל שלב קצר של קידוח מומלץ להעריך את העובי של העצם ולהעריך את השימוש בתרגיל נוסף. השימוש בתמיסת מלח סטרילית מומלץ שטיפת הפסולת, כמו גם להדמיה טובה יותר של פני השטח החשופים. שמירה על חסרונותasepsis tant במהלך ההליך הכירורגי כל, טיפול לאחר ניתוח נכון של בעלי החיים יכול לשפר את השרידות של בעלי חיים ולהגדיל את שיעור הצלחה של הניסויים.
המודל הנוכחי שלנו של PT אינו דורש הרכישה של כל מכשירים יקרים, כמו כל מעבדה המצוידת במיקרוסקופ פלואורסצנטי עלית עם מקור אור (כגון מנורה כספית, מנורת הליד מתכת, או לייזר באורך גל 488 ננומטר) יכול לבצע הליך זה. בנוסף, טכניקה זו מספקת שליטה על הגודל של האוטם על ידי התאמת גודל הצמצם, בהשוואה לדגמי איסכמיה SC אחרים כמו חסימה משולבת של אב העורקים, עורק subclavian שמאל וחלב פנימי 25 ושיטת הידוק צלב אב העורקים שונה 26 שהם מסובכים ו פולשנית מאוד. במודל שלנו תרגיל במהירות גבוהה לדקים על פני השטח הגב של חוליה להדמיה נבחר כחלופה לlaminectomy, שיטה של בחירה על ידי מעבדות רבות כדי לגרום לפגיעה בחוט שדרה.Laminectomy כרוך חיתוך של החוליות שעלולות לגרום לדימום מוגזם עקב חיתוך רוחב של כלי דם בעמוד השדרה וזה עלול לטשטש את השדה להדמיה. למרות כמה פרוטוקולים לייעץ שימוש בצמר גפן כדי לנקות את הדימום מוגזם במהלך laminectomy זה עלול לגרום לדחיסה שעלול לגרום לפגיעה נוספת לSC. נוסף על פני השטח החשופים של חוט השדרה יכול לבוא במגע ישיר עם דם ומרכיביו, כמו גם קצוות חדים של העצמות לחתוך אשר יכולה להוסיף השתנות מיותרות לניסוי. שימוש במודל PT הנוכחי, אוטם עם גודל שונה ועומק יכול להיות שנוצר על ידי מניפולציה פשוטה של עוצמת מקור האור, משך חשיפה והאזור של פני השטח החשופים. למרות שהמחקר הנוכחי נוצר איסכמיה באזור של T11 המרכזי בSC, שיטה זו יכולה גם ליצור אוטמים במקומות שונים לאורך מקורי לזנב כמו גם כיוון לרוחב של חוט השדרה, שמיגHT ליהנות הבנת ההשפעה ספציפית לאזור של איסכמיה על paraplegia. מצד השני, אם כי התאורה היא על פני השטח של חוט השדרה, האור יכול לחדור לעומק מסוים ברקמות ולפציעתם גם יכולה להיגרם בחומר האפור. כרוז בנגל מופץ במערכת מחזור כולו, אם בעלי החיים הם אותו הדבר, והגיל והמשקל דומים, אנו מצפים נגע עקבי יופק כבאיסכמיה בקליפת המוח הנגרמת על ידי PT.
היתרון הגדול הנוספים של איסכמיה נגרם PT הוא תמותה נמוכה מאוד של בעלי חיים. תמותה נמוכה פירוש יכולים להתבצע מחקרי הישרדות לטווח ארוך שעשוי להיות שימושי בהתרת האפקט הזמני של פגיעת איסכמית על התאוששות הישרדות ותפקוד מוטורי. מודל זה יכול גם לסייע בהבנת מנגנוני התיקון הסלולריים אשר מתרחשים בדרך כלל בשלב מאוחר בשלב הכרוני של פציעה 14,19,27-29. מודל זה גם מייצר גירעונות תפקוד מוטורי ניכרים שיכולים בהדואר משמש כדי להעריך את היעילות של סוכני neuroprotective בהחלמה תפקודית. בנוסף, מודל זה יאפשר גם המחקר של שינויים פתולוגיים לאחר SCI כגון ניוון axonal והתחדשות, עצבי ואיתות Ca 2 + astrocytic ועומס יתר בעכברים חיים באמצעות מיקרוסקופ שני פוטונים.
כמו כל דגמי SCI האחרים, PT אינו חף מחסרונות. החסרונות של שיטה זו דומים לאלה ראו בPT קליפת המוח. כמה מהחסרונות כוללים חוסר פנומברה איסכמית אנטומית ברורה, המהווה את היעד של תרופות רבות neuroprotective, והעדר reperfusion. זה ידוע היטב כי איסכמיה הבאה reperfusion מאופיינת בשינויים כמו ייצור מוגבר של מיני חמצן מגיבים, חדירה של תאים דלקתיים וייצור ציטוקינים מוגבר 30-32. חוסר reperfusion בPT משמעות השינויים הקשורים לפגיעת reperfusion בSC יישארו קשים ללמוד באמצעות מודל זה.עם זאת, היתרונות של שימוש באיסכמיה PT מושרה עולים על החסרונות וטכניקה זו מספקת לחוקרים עם קל לביצוע ומודל לשחזור מאוד של יצירת SCI בעכברים.
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לבריאות [גרנט לא. R01NS069726] ואגודת הלב האמריקאי גרנט בסיוע גרנט [גרנט לא. 13GRNT17020004] לSD.
Materials
| Name | Company | Catalog Number | Comments |
| Rose Bengal | Sigma-Aldrich | 330000 | 20 mg/ml in sterile saline |
| C57BL/6J | Jackson lab | 664 | 22 - 25 g |
| Ketamine | VEDCO | NDC-50989-996-06 | 100 mg/ml |
| Xylazine | VEDCO | NDC-50989-234-11 | 100 mg/ml |
| Betadine solution | Purdue | NDC-67618-150-01 | 10% povidone iodine topical solution |
| Normal saline | Abott Laboratories | 04930-04-10 | For diluting RB, anaesthesia and for preventing tissue from drying |
| Artificial tears ointment | Rugby | NDC-0536-6550-91 | 83% white petrolatum |
| Ethanol | Decon labs.Inc | 2716 | 70% ethanol for disinfection |
| Metal halide lamp | EXFO, Canada | X-Cite 120 PC | Set power at 12% |
| Spring scissors | Fine Science Tool | 15000-10 | for minor dissection |
| Scissors (angled to side) | Fine Science Tool | 14063-011 | No. 3 handle |
| Standard scalpel | Fine Science Tool | 10003-12 | for removing muscle |
| Scalpel blade | Feather | 2976 | No. 10 |
| Forceps (curved) | Fine Science Tool | 11150-10 | for holding tissue |
| Forceps (straight) | Fine Science Tool | 11151-10 | for holding tissue |
| Needle holder | Fine Science Tool | 12002-12 | for suturing |
| Tissue adhesive glue | 3M Vetbond | 1469SB | to adhere to edges of the cut skin |
| Monofilament polypropylene | USSC Sutures | VP-521 | Size = 4-0 (for fascia) |
| Perma-hand silk | Ethicon | 683G | Size = 4-0 (for skin) |
| Micro drill | Roboz Surgical Instrument Co. Inc. | RS-6300 | with bone polishing drill bit |
| Laser doppler flowmeter | Moor Instruments | moorVMS-LDF1 | for monitoring change in blood flow |
| Heating pad | Fine Science Tool | 21052-00 | to prevent hypothermia |
| Lab-Jack | Fisher scientific | 14-673-50 | 4 x 4 in plate to adjust the height of the animal |
| X-Y gliding stage | Amscope | GT100 | for positioning the animal under microscope |
References
- Cadotte, D. W., Fehlings, M. G. Spinal cord injury: a systematic review of current treatment options. Clin Orthop Relat Res. 469 (3), 732-741 (2011).
- Cheriyan, T., et al. Spinal cord injury models: a review. Spinal Cord. 52 (8), 588-595 (2014).
- Young, W. Secondary injury mechanisms in acute spinal cord injury. J Emerg Med. 11, Suppl 1. 13-22 (1993).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Soubeyrand, M., et al. Effect of norepinephrine on spinal cord blood flow and parenchymal hemorrhage size in acute-phase experimental spinal cord injury. Eur Spine J. 23 (3), 658-665 (2014).
- Soubeyrand, M., et al. Real-time and spatial quantification using contrast-enhanced ultrasonography of spinal cord perfusion during experimental spinal cord injury. Spine (Phila Pa 1976). 37 (22), E1376-E1382 (2012).
- Mautes, A. E., Weinzierl, M. R., Donovan, F., Noble, L. J. Vascular events after spinal cord injury: contribution to secondary pathogenesis). Phys Ther. 80 (7), 673-687 (2000).
- Liu, X. Z., et al. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci. 17 (14), 5395-5406 (1997).
- Liu, L., et al. An experimental study of cell apoptosis and correlative gene expression after tractive spinal cord injury in rats. Zhonghua Wai Ke Za Zhi. 42 (23), 1434-1437 (2004).
- Hirose, K., et al. Activated protein C reduces the ischemia/reperfusion-induced spinal cord injury in rats by inhibiting neutrophil activation. Ann Surg. 232 (2), 272-280 (2000).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guerit, J. M., Dion, R. A. State-of-the-art of neuromonitoring for prevention of immediate and delayed paraplegia in thoracic and thoracoabdominal aorta surgery). Ann Thorac Surg. 74 (5), S1867-S1869 (2002).
- Schepens, M. A., Heijmen, R. H., Ranschaert, W., Sonker, U., Morshuis, W. J. Thoracoabdominal aortic aneurysm repair: results of conventional open surgery. Eur J Vasc Endovasc Surg. 37 (6), 640-645 (2009).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Exp Transl Stroke Med. 1, 8(2009).
- Carmichael, S. T. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dietrich, W. D., Ginsberg, M. D., Busto, R., Watson, B. D. Photochemically induced cortical infarction in the rat. 1. Time course of hemodynamic consequences. J Cereb Blood Flow Metab. 6 (2), 184-194 (1986).
- Zhang, W., et al. Neuronal protective role of PBEF in a mouse model of cerebral ischemia. J Cereb Blood Flow Metab. 30 (12), 1962-1971 (2010).
- Li, H., Zhang, N., Sun, G., Ding, S. Inhibition of the group I mGluRs reduces acute brain damage and improves long-term histological outcomes after photothrombosis-induced ischaemia. ASN Neuro. 5 (3), 195-207 (2013).
- Li, H., et al. Histological, cellular and behavioral assessments of stroke outcomes after photothrombosis-induced ischemia in adult mice. BMC Neurosci. 15, 58(2014).
- Wang, T., Cui, W., Xie, Y., Zhang, W., Ding, S. Controlling the Volume of the Focal Cerebral Ischemic Lesion through Photothrombosis. American Journal of Biomedical Sciences. 2 (1), 33-42 (2010).
- Schroeter, M., Jander, S., Stoll, G. Non-invasive induction of focal cerebral ischemia in mice by photothrombosis of cortical microvessels: characterization of inflammatory responses. J Neurosci Methods. 117 (1), 43-49 (2002).
- Boquillon, M., Boquillon, J. P., Bralet, J. Photochemically induced, graded cerebral infarction in the mouse by laser irradiation evolution of brain edema. J Pharmacol Toxicol Methods. 27 (1), 1-6 (1992).
- Kim, G. W., Lewen, A., Copin, J., Watson, B. D., Chan, P. H. The cytosolic antioxidant, copper/zinc superoxide dismutase, attenuates blood-brain barrier disruption and oxidative cellular injury after photothrombotic cortical ischemia in mice. Neuroscience. 105 (4), 1007-1018 (2001).
- Schmidt, A., et al. Photochemically induced ischemic stroke in rats. Exp Transl Stroke Med. 4 (1), 13(2012).
- Lang-Lazdunski, L., et al. Spinal cord ischemia. Development of a model in the mouse. Stroke. 31 (1), 208-213 (2000).
- Wang, Z., et al. Development of a simplified spinal cord ischemia model in mice. J Neurosci Methods. 189 (2), 246-251 (2010).
- Labat-gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. J Vis Exp. (76), (2013).
- Lu, H., et al. Induction and imaging of photothrombotic stroke in conscious and freely moving rats. J Biomed Opt. 19 (9), 96013(2014).
- Seto, A., et al. Induction of ischemic stroke in awake freely moving mice reveals that isoflurane anesthesia can mask the benefits of a neuroprotection therapy. Front Neuroenergetics. 6 (1), (2014).
- Bell, M. T., et al. Toll-like receptor 4-dependent microglial activation mediates spinal cord ischemia-reperfusion injury. Circulation. 128 (11 Suppl 1), S152-S156 (2013).
- Smith, P. D., et al. The evolution of chemokine release supports a bimodal mechanism of spinal cord ischemia and reperfusion injury. Circulation. 126 (11 Suppl 1), S110-S117 (2012).
- Jia, Z., et al. Oxidative stress in spinal cord injury and antioxidant-based intervention. Spinal Cord. 50 (4), 264-274 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved