Method Article
Photothrombosis induite par ischémie focale comme un modèle de lésion médullaire chez la souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Photothrombosis is a minimally invasive and highly reproducible procedure to induce focal ischemia in the spinal cord and serves as a model of spinal cord injury in mice.
Résumé
Spinal cord injury (SCI) is a devastating clinical condition causing permanent changes in sensorimotor and autonomic functions of the spinal cord (SC) below the site of injury. The secondary ischemia that develops following the initial mechanical insult is a serious complication of the SCI and severely impairs the function and viability of surviving neuronal and non-neuronal cells in the SC. In addition, ischemia is also responsible for the growth of lesion during chronic phase of injury and interferes with the cellular repair and healing processes. Thus there is a need to develop a spinal cord ischemia model for studying the mechanisms of ischemia-induced pathology. Focal ischemia induced by photothrombosis (PT) is a minimally invasive and very well established procedure used to investigate the pathology of ischemia-induced cell death in the brain. Here, we describe the use of PT to induce an ischemic lesion in the spinal cord of mice. Following retro-orbital sinus injection of Rose Bengal, the posterior spinal vein and other capillaries on the dorsal surface of SC were irradiated with a green light resulting in the formation of a thrombus and thus ischemia in the affected region. Results from histology and immunochemistry studies show that PT-induced ischemia caused spinal cord infarction, loss of neurons and reactive gliosis. Using this technique a highly reproducible and relatively easy model of SCI in mice can be achieved that would serve the purpose of scientific investigations into the mechanisms of ischemia induced cell death as well as the efficacy of neuroprotective drugs. This model will also allow exploration of the pathological changes that occur following SCI in live mice like axonal degeneration and regeneration, neuronal and astrocytic Ca2+ signaling using two-photon microscopy.
Introduction
Traumatisme de la moelle épinière (SCI) est un état clinique dévastatrice qui affecte les fonctions sensori-motrices et autonomes de la SC. SCI patients survivants se retrouvent souvent avec une paraplégie débilitante qui affecte considérablement leurs activités et de la qualité de la vie quotidienne 1. SCI modèles expérimentaux ont été un outil indispensable dans la recherche scientifique pour comprendre la physiopathologie de la SCI et les processus de réparation de neurones associés. Ces modèles ont également été utilisés pour tester l'efficacité préclinique de diverses interventions neuroprotectrices expérimentales qui visent à la récupération fonctionnelle. Actuellement, la majorité des modèles SCI dans la pratique emploient l'utilisation de la force physique brutale de perturber mécaniquement et blesser le SC. Ces méthodes comprennent contusion, compression, la dislocation et transection du SC 2. Il a été suggéré que, après l'insulte mécanique primaire une lésion secondaire sous la forme d'ensembles d'ischémie dans la SC blessé 3,4. L'étiologie de l'ischémie secondaire comprend une vaste dégénérescence des tissus, l'hémorragie parenchymateuse et parfois par l'obstruction des vaisseaux sanguins par un œdème des tissus 5-7. À la suite de la lésion secondaire l'intégrité de SC est en outre affectée, les neurones et les cellules gliales sont gravement altérées dans la fonction et la viabilité et l'apoptose qui conduit à l'infarctus croissance au cours de la phase chronique de la blessure, analogue à la croissance de pénombre ischémique suite d'un AVC 8,9. Plusieurs mécanismes comme excitotoxicité, production de radicaux libres, et l'inflammation ont été signalés à être responsable de la mort cellulaire ischémique suivant SCI 10,11. En outre, SC ischémie est une complication grave de l'anévrisme aortique thoraco-abdominaux chirurgies de réparation qui conduisent souvent à la paraplégie chez les patients 12,13. En dépit de cet impact clinique haute très peu de modèles de ischémie de la moelle épinière avec une reproductibilité élevée sont actuellement disponibles.
nt "> Photothrombosis (PT) est une méthode couramment utilisée pour l'induction d'une ischémie focale dans le cerveau 14-20. La technique est assez non-invasif, hautement reproductible et produit une lésion ischémique focal précis dans la zone exposée du cerveau 17 -21. Ceci est réalisé par administration systémique de colorants photoactifs tels que le rose Bengale (RB) 16-20,22 érythrosine B ou 23 suivie par une irradiation localisée de vaisseaux sanguins avec une source de lumière appropriée. photoactivation du colorant provoque la génération de radicaux libres qui perturber l'intégrité de l'endothélium vasculaire lisse, et provoquent les plaquettes d'accumuler, qui forme ensuite un thrombus. L'obstruction de la circulation sanguine par les résultats de thrombus dans un infarctus dans la région fournies par le navire 24. En raison de la facilité de contrôle de la l'intensité et la durée de l'irradiation de cette procédure donne un infarctus très uniforme et reproductible. En outre, ce procédé peut être utilisé pour induire un infarctust à divers emplacements anatomiques permettant spatiale (par exemple, la matière grise vs. matière blanche) compréhension de l'effet de l'ischémie.L'objectif de la présente étude est de développer un modèle facile et hautement reproductible de SC ischémie chez les souris. Nous avons décrit la procédure d'un modèle d'ischémie PT de SC chez des souris. Les résultats de l'histologie et immunomarquage ont démontré que PT peut induire efficacement SC du myocarde, une perte neuronale et une gliose réactive.
Protocole
Note: Des souris (C57BL / 6J, mâle) ans 10-12 semaines fussent utilisés dans cette étude. Toutes les procédures ont été effectuées en conformité avec le Guide NIH pour le soin et l'utilisation des animaux de laboratoire et ont été approuvés par l'Université du Missouri institutionnel de protection des animaux et l'utilisation Comité (IACUC).
1. Pré-chirurgie
- La veille de l'intervention autoclave et stériliser tous les instruments chirurgicaux. Enveloppez les instruments et l'autoclave à 121 o C à 15 psi pendant 30 min suivie par 30 minutes de séchage (121 o C, 15 psi, 30/30 cycle). Placez les instruments dans un environnement propre et stérile jusqu'à l'utilisation.
- Préparer une solution fraîche Rose Bengale (RB) solution (20 mg / ml dans une solution saline stérile) à chaque fois avant la chirurgie. Pour dissoudre complètement RB, vortex le tube puis suivi par ultrasons pendant 5 min à 50/60 Hz avec une puissance de sortie de 19 W. Enrouler le tube dans une feuille d'aluminium et de la protéger de la lumière jusqu'à nouvel utilisé pendant surGery.
- Préparer un mélange de kétamine / xylazine dans une solution saline stérile. Ajouter 125 pi de xylazine (concentration du stock: 20 mg / ml) et 325 pi de ketmaine (concentration du stock: 100 mg / ml) et 550 pi de solution saline stérile pour obtenir un volume final de 1 ml de mélange anesthésique.
- Préchauffer le coussin chauffant homéothermes.
- Préchauffer la lampe à halogénure métallique (de source de lumière pour FN1 épi-microscope à fluorescence) pendant 30 minutes pour stabiliser la puissance de la lampe.
- Ajuster la taille de la région éclairée à un diamètre de 1 mm en utilisant objectif 10X et un réticule en ajustant le diaphragme de champ dans le FN1 debout epi-microscope à fluorescence.
2. Procédure chirurgicale
- Anesthésier les souris avec une dose de kétamine (130 mg / kg B. poids.) Et de xylazine (10 mg / kg B. poids.). Basé sur le cocktail dans 1.3, 4 pi par g de souris B. poids. sont nécessaires. Stériliser le site d'injection avec un tampon imbibé d'alcool et d'administrer les anesthésiques par voie intra-peritoneal (IP) itinéraire. Prenez soin de ne pas injecter les anesthésiques dans les vaisseaux sanguins ou le muscle car cela retarderait l'induction et la récupération de l'animal.
- Appliquer une pommade artificielle déchirure aux deux yeux de la souris pour éviter le dessèchement et placez l'animal sur le coussin chauffant pour prévenir l'hypothermie.
- Préparation des animaux
- Vérifiez l'animal pour le bon niveau de l'anesthésie chirurgicale en utilisant la réponse orteil de pincement.
- Une fois que l'animal a atteint le niveau de l'anesthésie chirurgicale, couper les poils sur la face dorsale autour de la ligne médiane de l'animal à l'aide d'une tondeuse électrique. Frotter le site chirurgical avec de l'éthanol à 70% puis avec une solution de bétadine trois fois. Couvrir le site avec un champ opératoire stérile jusqu'à la prochaine étape.
- Intervention chirurgicale pour fluidifier l'os pour exposer la moelle épinière
- Placez la souris dans une position couchée sur le coussin chauffant homéothermes sur la plate-forme chirurgicale (figure 1A). Fixer correctement la sourisposture aide d'une pince de museau à maintenir une région du cou allongé (figure 1A, B).
- Faire une incision (environ 1 cm de long) à l'aide des ciseaux chirurgicaux le long de la ligne médiane dorsale étendant des vertèbres thoraciques T9 à T12. Écarter la peau pour exposer zone chirurgicale.
- Avec un scalpel, effacer soigneusement le muscle pour exposer les épines dorsales au T9 - T12 vertèbres. Arrêter le saignement dans chaque étape en appliquant une légère pression avec un coton-tige stérile. T10 séparé - T12 vertèbres du muscle environnant et les fixer à l'aide d'une pince vertébrale à stabiliser et empêcher tout déplacement (figure 1A, B).
- Utiliser un foret à grande vitesse avec l'os de polissage foret, soigneusement et délicatement mince la surface dorsale de T10 ou T11 vertèbre de visualiser la veine postérieure de la moelle et d'autres petits vaisseaux à la surface dorsale de la SC (figure 1C).
- Pour éviter un endommagement thermique du fait de la chaleur générée durant la procédure d'amincissement,appliquer un courant doux et constant de solution saline normale avec aspiration constante pour enlever les débris.
- En utilisant un scalpel soigneusement lisser la surface de l'os jusqu'à ce que la cuve principale est clairement visible. Prenez soin de ne pas endommager la moelle épinière au cours de ce processus.
- Une fois que le vaisseau sanguin est visualisée, RB administrer à une dose de 30 mg / kg (poids corporel) par le sinus rétro-orbital itinéraire à l'aide d'une seringue à insuline.
- Mesurer le débit sanguin à l'aide d'un débitmètre Laser Doppler après 3 min après injection RB si nécessaire (figure 2A, B). Maintenir l'asepsie pendant toute la procédure.
3. Induction de PT
- Placez l'animal sur une scène réglable en position XY sur un Lab-Jack qui peut ajuster la hauteur. Ajustez la position de la souris pour la région exposée de T11 moelle épinière est directement sous l'objectif du microscope 10x FN1 épifluorescence (figure 3A).
- Régler la puissance de la lisource de lutte à 12% et irradier la région T11 avec un diamètre de 0,75 mm au milieu de la moelle épinière amincie (Note: cette région contient la partie postérieure veine vertébrale et d'autres capillaires) avec une lumière verte (longueur d'onde 540-580 nm, ce qui est obtenu par le cube de filtre dans le microscope) à travers l'objectif 10X pendant 2 min. Prendre des images au début et à la fin de l'irradiation (figure 3B, C) et enregistrer le temps de l'expérience à ce stade.
- Mesurer de nouveau le débit sanguin pendant 10 min si nécessaire en plaçant la sonde laser Doppler dans la même position au-dessus de la moelle épinière que dans 2.4.8 (figure 2A, B).
- Après vérification de l'irradiation de toute hémorragie et si aucun trouvé procéder à suturer l'animal. Suturer l'aponévrose superficielle avec les muscles sur le côté soit de la moelle épinière en utilisant une suture absorbable ou 4-0 taille soie suture. Prenez soin de ne pas endommager le SC exposée. Suturer la peau avec une suture de soie 4-0. Appliquer Bétadine ou de l'iodesur les bords de la peau après la suture.
4. Post-chirurgie soins
- Après suture, placez l'animal sur le coussin chauffant pour la récupération. Après la récupération examiner les animaux pour des signes de déficits neurologiques en observant le mouvement des deux membres postérieurs. Ne pas laisser l'animal sans surveillance tant qu'il a repris conscience suffisante pour maintenir décubitus sternal.
- Transférer les animaux dans la cage de la maison. Ne retournez pas l'animal qui a subi une intervention chirurgicale à la compagnie d'autres animaux jusqu'à guérison complète.
- Vérifiez les animaux à intervalles réguliers. En cas de déficits neurologiques graves, fournir des soins appropriés, comme l'évacuation de la vessie, de l'administration d'analgésiques (buprénorphine, de 0,05 à 0,1 mg / kg). Vérifier la déshydratation et à administrer par voie sous cutanée de solution saline normale en cas sévère. Habituellement, la buprénorphine (0,1 mg / kg) est administrée après la suture pour soulager la douleur dans le site chirurgical.
- Si les animaux ne sont pas immédiatementeuthanasiés après la chirurgie, nous allons mettre l'alimentation à haute teneur en eau sur le sol de la cage, de sorte que les animaux peuvent atteindre la nourriture facilement.
5. Transcardial perfusion, la coloration de Nissl et immunocoloration
- Transcardiaque perfuser l'animal de 17 à 20 comme décrit précédemment.
- Anesthésier l'animal, comme décrit plus haut dans le protocole et perfuser transcardiaque avec une solution saline tamponnée phosphate (PBS, pH 7,4), suivie par de la glace froide 4% de paraformaldehyde (PFA) dans du PBS.
- Après la perfusion, retirer la moelle épinière (SC) et post-fixer dans 4% PFA dans du PBS à 4 ° CO / N. Transférer le SC fixe dans PBS avec 30% de saccharose et le garder pour 2 - 3 jours jusqu'à ce qu'il coule au fond du tube.
- L'utilisation d'un cryostat coupé la moelle épinière en 30 sections um d'épaisseur et les placer en série sur des lamelles de verre recouvertes de gélatine ou dans une plaque de 48 puits avec 0,01 M de PBS.
- Coloration Nissl: Pour inspecter le dommage causé par PT effectuer une Nissl staining sur des sections de la moelle épinière comme décrit précédemment 17-20.
- En bref, de recueillir chaque cinquième tranche de la moelle épinière sur les lames de verre et des taches avec 0,25% violet de crésyl. Prenez des photos de coupes colorées (figure 4).
- L'immunocoloration: Comme il est décrit précédemment en utilisant un procédé de coupe flottant 17,18,20.
- En bref, colorer les sections de la moelle épinière par incubation O / N à 4 ° C avec de lapin anti-glie protéine acide fibrillaire (GFAP) d'anticorps polyclonaux (1: 300), anticorps de lapin-NeuN contre (1: 300), et de lapin anti- Iba1 anticorps (1: 500) suivi d'âne anti-lapin Alexa 568-conjugué IgG (1: 400) les anticorps secondaires pendant 4 h à température ambiante. Prenez des photos avec un microscope à fluorescence (figure 5).
Résultats
Le but de cette étude était de produire ischémie de la moelle épinière chez des souris en utilisant un modèle de PT. Après la région désirée de l'os au-dessus de la moelle épinière (T10 - T12) a été amincie, Rose Bengale a été injecté à travers le sinus rétro-orbital itinéraire, et l'ischémie a été induite par PT Figure 1A, B correspond à la souris placée dans un instrument chirurgical sur mesure. plate-forme au cours de la chirurgie. La souris a été maintenu en place par une pince de museau et deux vertébrés réglable serre pour stabiliser la moelle épinière figure 1C montre une fenêtre amincie dessus de la moelle épinière des T10 -. T12. Le vaisseau sanguin principal et de ses branches peuvent être clairement visualisées. Pour confirmer l'induction d'une ischémie, des changements dans la circulation sanguine a été mesurée en utilisant un débitmètre Doppler laser avant et après PT (Figure 2A, B). Pour l'analyse, la diminution en% de la circulation sanguine a été calculée en utilisant le flux sanguin de base avant photothrombosis. La circulation du sang est tombé à environ 20% immédiatement après l'illumination de lumière par rapport wla i-ième niveau de base avant l'illumination. La figure 3B, C montre des images de fluorescence de la colonne vertébrale vaisseaux de sang de cordon au début et à la fin de PT. Éclairage pendant 2 min induite caillot de sang dans les vaisseaux sanguins (figure 3C), ce qui suggère l'induction de l'ischémie, en accord avec les mesures du débitmètre à laser Doppler. Pour inspecter le dommage causé par PT, les souris ont été sacrifiées 3 jours après PT et coloration de Nissl a été effectuée. Images prises à la suite coloration de Nissl montré la région de l'infarctus qui peut être clairement délimitée de la région environnante, indiquant des dommages aux tissus de la moelle épinière et la mort cellulaire après PT (Figure 4). Immunocoloration a été réalisée pour NeuN, GFAP et Iba1. Neurones NeuN + ont été perdus dans la matière grise dans le noyau ischémique (figure 5A), tandis que l'expression de la GFAP a été augmentée dans la frontière de coeur ischémique (figure 5B, voir aussi la région encadrée). Les microglies Iba1 + présentaient une mor globoïdephology (ie., un organisme cellulaire élargie avec des processus plus courts et moins, voir la région encadré) avec une expression accrue Iba1 (Figure 5C). Bien qu'il y ait une perte de tissu dans la région du coeur ischémique due à flottante section coloration, une augmentation de la GFAP et d'expression Iba1 dans toute la région péri-infarctus peut être clairement observé. Ces résultats témoignent de la mort neuronale et gliose réactive dans la pénombre après SC ischémie. D'autre part, les déficits fonctionnels importants ont été observés chez les souris blessés, à savoir, les personnes handicapées mouvement membre postérieur un jour après PT, indiquant une paralysie des membres postérieurs (voir le film).

Figure 1. modèle induit PT-ischémie dans la moelle épinière. (A) Photographies de la plate-forme de chirurgie pour la moelle épinière PT. En médaillon: agrandie pinces vertébrales.(B) La souris a été tenu par une pince de museau et par deux pinces vertébrales sur mesure sur la scène. Notez que l'os a été éclaircie au T10 -. Zone de T12 et deux pinces vertébrales métalliques ont été utilisés pour stabiliser la moelle épinière (C) Un zoom sur l'image montrant la région avec l'os amincie dessus de la moelle épinière au T10-11 pour le induction de PT. Remarquez les principaux vaisseaux sanguins et de ses branches. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 2. de mesure du débit de sang de la moelle épinière. (A) La mise en place de la mesure du débit de sang de la surface de la moelle épinière à l'aide d'un débitmètre Doppler à laser et un dispositif de stéréotaxie pour positionner la sonde (B).Moelle épinière flux sanguin avant et après PT a été mesurée. Dans cette expérience, PT a été induit en éclairant avec une source lumineuse pour 2 minutes avec une puissance de 12%. Le diamètre de la surface irradiée était de 0,75 mm et était au milieu de la moelle épinière. Le flux sanguin a été enregistré pour un maximum de 5 min pour obtenir le signal stabilisé avant PT et jusqu'à 10 minutes après PT. Les données de chaque souris a été normalisée à la valeur avant la lumière d'éclairage. Le graphique montre la valeur moyenne des données à partir de 3 souris. La flèche indique le début de PT. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 3. PT-induite ischémie de la moelle épinière. (A) Photographie d'unla souris placée sur le microscope pour l'induction PT dans la moelle épinière. La position de la souris peut être réglé en trois dimensions en utilisant la platine XY de glisse et un Lab-Jack. La lumière provenant de l'objectif 10X a été focalisé sur la surface de la moelle épinière. (BC) images fluorescentes des vaisseaux sanguins dans la moelle épinière avant (B) et après (C) l'éclairage suivant l'injection de Rose Bengale. Remarquez le caillot de sang après 2 min de l'irradiation (C) (voir les flèches). S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
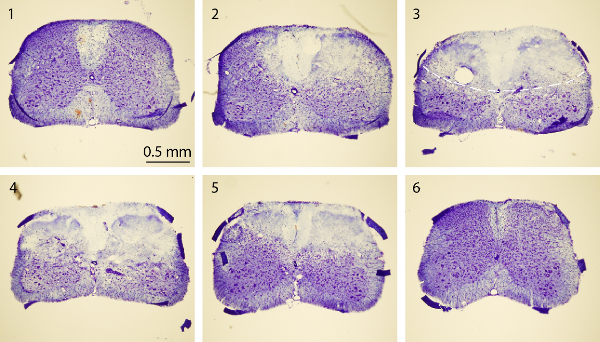
Figure 4. coloration de Nissl de la moelle épinière. Nissl images de coloration d'une série de sections transversales cordon épinière rostrale-à-caudale qui comprennent des sections normales (1 et 6) et PT-épicentre induite sections (2-5). Les souris ont été sacrifiées 3 jours après PT. Chaque section de la moelle épinière est de 30 um d'épaisseur. L'intervalle entre deux sections est de 750 um. La ligne en pointillés 3 ème contours de l'image de la région de l'infarctus. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
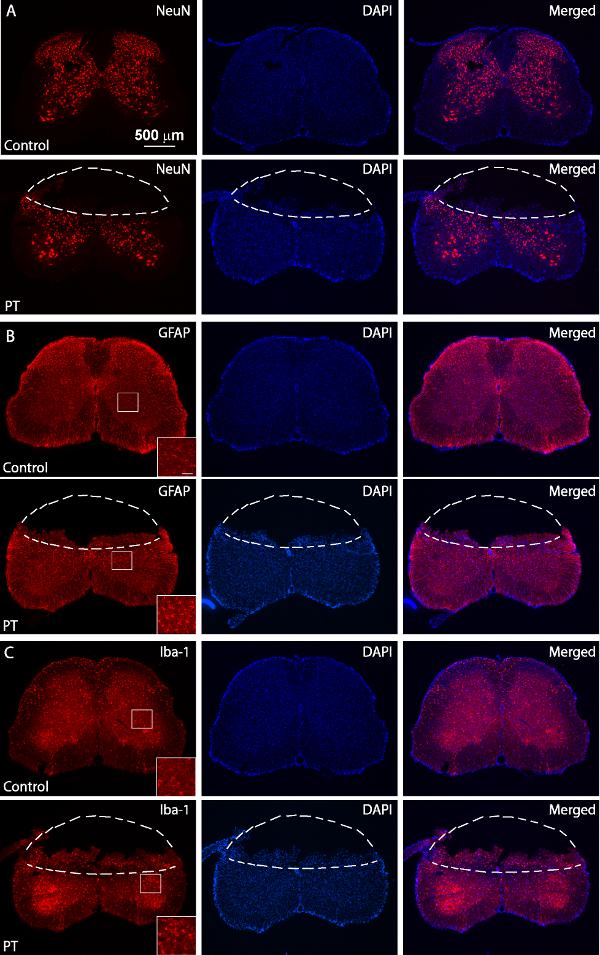
Figure 5. Immunocoloration de NeuN, GFAP et Iba1. NeuN images fluorescentes de (A), GFAP (B) et Iba1 (C) de coloration (panneaux supérieurs) et normales (PT-blessées panneaux inférieurs) sections de la moelle épinière. La souris blessés a été sacrifié 3 jours après PT. Les lignes en pointillés séparent les régions du myocarde à partir de tissus normaux. Les régions encadrées montrent des images de haute résolution de la GFAP et d'expression Iba1 avec une barre d'échelle de 50um. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Film . PT dans la moelle épinière induite déficits comportementaux. Le film montre le mouvement d'une normale et une souris PT-blessé dans une cage. Notez le glissement des deux membres postérieurs de la souris avec la moelle épinière endurcis, indiquant une paralysie des membres postérieurs (paraplégie). Le film a été prise 24 heures après PT chez la souris blessée.
Discussion
Dans cette étude, nous avons décrit un modèle de photothrombotique SC ischémie. Grâce aux progrès en génie génétique, il ya eu une forte augmentation des souris transgéniques disponible dans le commerce qui a permis d'étudier l'impact des gènes spécifiques impliqués dans la physiopathologie ischémique dans la SC. Le but de l'étude était de développer un modèle de souris reproductible de ischémie de la moelle épinière. Ici nous avons adapté un modèle PT corticale pour induire SCI chez la souris. Après la chirurgie et la veine postérieure de la colonne vertébrale capillaires sur la face dorsale de souris au niveau de la vertèbre thoracique T11 ont été exposés. Ensuite, RB, d'un colorant photo-actif disponible dans le commerce, a été injecté à travers le sinus rétro-orbital itinéraire pour atteindre la distribution souhaitée vasculaire. Le vaisseau sanguin exposé a été ensuite irradiée par une lumière verte pour induire la formation de thrombus et plus tard un infarctus. Nos résultats de méthodes histologiques et immunocoloration ont montré que PT induit un infarctus dans la moelle épinière et Reactive gliose dans la région péri-infarctus. Les déficits neurologiques comme la paralysie des membres postérieurs ont également été observées. Ces données suggèrent que PT est un modèle approprié pour l'étude de la physiopathologie et les mécanismes de la mort cellulaire après un traumatisme médullaire. L'étape critique dans le protocole est l'utilisation d'un foret à haute vitesse pour fluidifier la surface de vertèbre de visualisation du vaisseau sanguin sur la surface dorsale de la SC. Cette étape doit être soigneusement effectuée que l'application d'une pression excessive pourrait provoquer la perceuse pour entrer cavité vertébrale et endommager le SC. D'autre part, l'amincissement inégale pourrait entraîner l'éclairage est adéquat et peut produire infarctus irréguliers. Pour résoudre ce problème, l'inspection fréquente de la surface de l'os sous microscope après chaque étape courte de forage est recommandé d'évaluer l'épaisseur de l'os et d'évaluer davantage l'utilisation de la perceuse. L'utilisation d'une solution saline stérile est recommandé au lavage les débris ainsi que pour la meilleure visualisation de la surface exposée. Maintenir les inconvénientsTant l'asepsie pendant toute la procédure chirurgicale, soins post-chirurgicaux adéquat de l'animal peut améliorer la survie des animaux et augmenter le taux des expériences de succès.
Notre modèle actuel de PT ne nécessite pas l'achat d'instruments coûteux, comme tout laboratoire qui est équipé d'un microscope épi-fluorescence avec une source de lumière (comme une lampe à mercure, lampe aux halogénures de métal, ou le laser de 488 nm de longueur d'onde) peuvent effectuer cette procédure. En outre, cette technique permet de contrôler la taille de l'infarctus par ajustement de la taille de l'ouverture par rapport à d'autres modèles SC ischémie comme occlusion combinée de l'aorte, sous-clavière gauche et de l'artère mammaire interne 25 et un procédé de serrage transversale de l'aorte modifié 26 qui sont compliquées et sont extrêmement invasive. Dans notre modèle d'une perceuse à grande vitesse pour fluidifier la surface dorsale de la vertèbre pour la visualisation a été choisi comme une alternative à la laminectomie, méthode de choix par de nombreux laboratoires pour induire SCI.Laminectomie consiste à couper des vertèbres qui peut provoquer une hémorragie excessive due à transection des vaisseaux sanguins vertébraux, ce qui pourrait occulter le champ de formation d'image. Même si certains protocoles conseillent l'utilisation de cotons-tiges pour effacer le saignement excessif pendant laminectomie il peut en résulter une compression qui peut causer des blessures supplémentaires à la SC. En outre, la surface exposée de la moelle épinière peut entrer en contact direct avec du sang et de ses composants, ainsi que des bords tranchants des os coupe qui peut ajouter la variabilité nécessaire à l'expérience. En utilisant le modèle de courant PT, l'infarctus avec la taille et la profondeur différente peut être généré par une simple manipulation de l'intensité de la source de lumière, la durée d'exposition et la zone de la surface exposée. Bien que la présente étude ischémie généré sur la région centrale de T11 dans les CP, ce procédé peut également générer des infarctus, à différents endroits le long de rostrale à caudale, ainsi que la direction latérale de la moelle épinière, qui might bénéficier comprendre l'effet spécifique à la région de l'ischémie sur la paraplégie. D'autre part, même si l'éclairement est sur la surface de la moelle épinière, la lumière peut pénétrer à certaine profondeur dans le tissu et la lésion peut également être induite dans la matière grise. Comme Rose Bengale est distribué dans tout le système de circulation, si l'espèce animale sont les mêmes, et l'âge et le poids sont les mêmes, nous nous attendons lésion uniforme est généré comme dans l'ischémie induite par PT cortical.
L'autre avantage majeur de l'ischémie induite par PT-est très faible mortalité des animaux. Signifie une faible mortalité études de survie à long terme peuvent être réalisées qui pourraient être utiles à démêler l'effet temporel de lésion ischémique sur la survie et la fonction motrice récupération. Ce modèle peut également aider à comprendre les mécanismes de réparation cellulaire qui se produisent habituellement à la fin de la phase chronique de la blessure 14,19,27-29. Ce modèle produit aussi des déficits de la fonction motrice considérables qui peuvent be utilisée pour évaluer l'efficacité des agents neuroprotecteurs sur la récupération fonctionnelle. En outre, ce modèle permettra également à l'étude des changements pathologiques après SCI telles que la dégénérescence axonale et la régénération, la signalisation neuronale et astrocytaire Ca 2+ et la surcharge dans des souris vivantes en utilisant la microscopie à deux photons.
Comme tous les autres modèles SCI, PT est pas dépourvue d'inconvénients. Les inconvénients de cette technique sont similaires à ceux observés dans PT cortical. Peu de lacunes notamment le manque d'une pénombre ischémique anatomiquement claire, qui est la cible de nombreux médicaments neuroprotecteurs, et l'absence de reperfusion. Il est bien connu que l'ischémie reperfusion suivant est caractérisée par des modifications telles que la production accrue d'espèces réactives de l'oxygène, l'infiltration de cellules inflammatoires et la production accrue de cytokines 30-32. Manque de reperfusion dans PT signifie que les changements associés à des lésions de reperfusion dans SC resteront difficiles à étudier en utilisant ce modèle.Cependant, les avantages de l'utilisation de l'ischémie PT induits emportent sur les inconvénients et cette technique fournit les chercheurs avec une facile à réaliser et le modèle hautement reproductible de générer SCI chez la souris.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Ce travail a été soutenu par le National Institutes of Health [Grant pas. R01NS069726] et l'Association Grant American Heart in Aid Grant [Grant pas. 13GRNT17020004] pour SD.
matériels
| Name | Company | Catalog Number | Comments |
| Rose Bengal | Sigma-Aldrich | 330000 | 20 mg/ml in sterile saline |
| C57BL/6J | Jackson lab | 664 | 22 - 25 g |
| Ketamine | VEDCO | NDC-50989-996-06 | 100 mg/ml |
| Xylazine | VEDCO | NDC-50989-234-11 | 100 mg/ml |
| Betadine solution | Purdue | NDC-67618-150-01 | 10% povidone iodine topical solution |
| Normal saline | Abott Laboratories | 04930-04-10 | For diluting RB, anaesthesia and for preventing tissue from drying |
| Artificial tears ointment | Rugby | NDC-0536-6550-91 | 83% white petrolatum |
| Ethanol | Decon labs.Inc | 2716 | 70% ethanol for disinfection |
| Metal halide lamp | EXFO, Canada | X-Cite 120 PC | Set power at 12% |
| Spring scissors | Fine Science Tool | 15000-10 | for minor dissection |
| Scissors (angled to side) | Fine Science Tool | 14063-011 | No. 3 handle |
| Standard scalpel | Fine Science Tool | 10003-12 | for removing muscle |
| Scalpel blade | Feather | 2976 | No. 10 |
| Forceps (curved) | Fine Science Tool | 11150-10 | for holding tissue |
| Forceps (straight) | Fine Science Tool | 11151-10 | for holding tissue |
| Needle holder | Fine Science Tool | 12002-12 | for suturing |
| Tissue adhesive glue | 3M Vetbond | 1469SB | to adhere to edges of the cut skin |
| Monofilament polypropylene | USSC Sutures | VP-521 | Size = 4-0 (for fascia) |
| Perma-hand silk | Ethicon | 683G | Size = 4-0 (for skin) |
| Micro drill | Roboz Surgical Instrument Co. Inc. | RS-6300 | with bone polishing drill bit |
| Laser doppler flowmeter | Moor Instruments | moorVMS-LDF1 | for monitoring change in blood flow |
| Heating pad | Fine Science Tool | 21052-00 | to prevent hypothermia |
| Lab-Jack | Fisher scientific | 14-673-50 | 4 x 4 in plate to adjust the height of the animal |
| X-Y gliding stage | Amscope | GT100 | for positioning the animal under microscope |
Références
- Cadotte, D. W., Fehlings, M. G. Spinal cord injury: a systematic review of current treatment options. Clin Orthop Relat Res. 469 (3), 732-741 (2011).
- Cheriyan, T., et al. Spinal cord injury models: a review. Spinal Cord. 52 (8), 588-595 (2014).
- Young, W. Secondary injury mechanisms in acute spinal cord injury. J Emerg Med. 11, Suppl 1. 13-22 (1993).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Soubeyrand, M., et al. Effect of norepinephrine on spinal cord blood flow and parenchymal hemorrhage size in acute-phase experimental spinal cord injury. Eur Spine J. 23 (3), 658-665 (2014).
- Soubeyrand, M., et al. Real-time and spatial quantification using contrast-enhanced ultrasonography of spinal cord perfusion during experimental spinal cord injury. Spine (Phila Pa 1976). 37 (22), E1376-E1382 (2012).
- Mautes, A. E., Weinzierl, M. R., Donovan, F., Noble, L. J. Vascular events after spinal cord injury: contribution to secondary pathogenesis). Phys Ther. 80 (7), 673-687 (2000).
- Liu, X. Z., et al. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci. 17 (14), 5395-5406 (1997).
- Liu, L., et al. An experimental study of cell apoptosis and correlative gene expression after tractive spinal cord injury in rats. Zhonghua Wai Ke Za Zhi. 42 (23), 1434-1437 (2004).
- Hirose, K., et al. Activated protein C reduces the ischemia/reperfusion-induced spinal cord injury in rats by inhibiting neutrophil activation. Ann Surg. 232 (2), 272-280 (2000).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guerit, J. M., Dion, R. A. State-of-the-art of neuromonitoring for prevention of immediate and delayed paraplegia in thoracic and thoracoabdominal aorta surgery). Ann Thorac Surg. 74 (5), S1867-S1869 (2002).
- Schepens, M. A., Heijmen, R. H., Ranschaert, W., Sonker, U., Morshuis, W. J. Thoracoabdominal aortic aneurysm repair: results of conventional open surgery. Eur J Vasc Endovasc Surg. 37 (6), 640-645 (2009).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Exp Transl Stroke Med. 1, 8(2009).
- Carmichael, S. T. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dietrich, W. D., Ginsberg, M. D., Busto, R., Watson, B. D. Photochemically induced cortical infarction in the rat. 1. Time course of hemodynamic consequences. J Cereb Blood Flow Metab. 6 (2), 184-194 (1986).
- Zhang, W., et al. Neuronal protective role of PBEF in a mouse model of cerebral ischemia. J Cereb Blood Flow Metab. 30 (12), 1962-1971 (2010).
- Li, H., Zhang, N., Sun, G., Ding, S. Inhibition of the group I mGluRs reduces acute brain damage and improves long-term histological outcomes after photothrombosis-induced ischaemia. ASN Neuro. 5 (3), 195-207 (2013).
- Li, H., et al. Histological, cellular and behavioral assessments of stroke outcomes after photothrombosis-induced ischemia in adult mice. BMC Neurosci. 15, 58(2014).
- Wang, T., Cui, W., Xie, Y., Zhang, W., Ding, S. Controlling the Volume of the Focal Cerebral Ischemic Lesion through Photothrombosis. American Journal of Biomedical Sciences. 2 (1), 33-42 (2010).
- Schroeter, M., Jander, S., Stoll, G. Non-invasive induction of focal cerebral ischemia in mice by photothrombosis of cortical microvessels: characterization of inflammatory responses. J Neurosci Methods. 117 (1), 43-49 (2002).
- Boquillon, M., Boquillon, J. P., Bralet, J. Photochemically induced, graded cerebral infarction in the mouse by laser irradiation evolution of brain edema. J Pharmacol Toxicol Methods. 27 (1), 1-6 (1992).
- Kim, G. W., Lewen, A., Copin, J., Watson, B. D., Chan, P. H. The cytosolic antioxidant, copper/zinc superoxide dismutase, attenuates blood-brain barrier disruption and oxidative cellular injury after photothrombotic cortical ischemia in mice. Neuroscience. 105 (4), 1007-1018 (2001).
- Schmidt, A., et al. Photochemically induced ischemic stroke in rats. Exp Transl Stroke Med. 4 (1), 13(2012).
- Lang-Lazdunski, L., et al. Spinal cord ischemia. Development of a model in the mouse. Stroke. 31 (1), 208-213 (2000).
- Wang, Z., et al. Development of a simplified spinal cord ischemia model in mice. J Neurosci Methods. 189 (2), 246-251 (2010).
- Labat-gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. J Vis Exp. (76), (2013).
- Lu, H., et al. Induction and imaging of photothrombotic stroke in conscious and freely moving rats. J Biomed Opt. 19 (9), 96013(2014).
- Seto, A., et al. Induction of ischemic stroke in awake freely moving mice reveals that isoflurane anesthesia can mask the benefits of a neuroprotection therapy. Front Neuroenergetics. 6 (1), (2014).
- Bell, M. T., et al. Toll-like receptor 4-dependent microglial activation mediates spinal cord ischemia-reperfusion injury. Circulation. 128 (11 Suppl 1), S152-S156 (2013).
- Smith, P. D., et al. The evolution of chemokine release supports a bimodal mechanism of spinal cord ischemia and reperfusion injury. Circulation. 126 (11 Suppl 1), S110-S117 (2012).
- Jia, Z., et al. Oxidative stress in spinal cord injury and antioxidant-based intervention. Spinal Cord. 50 (4), 264-274 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon