Method Article
Photothrombosis induzierte fokale Ischämie als ein Modell der Rückenmarksverletzungen in Mäusen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Photothrombosis is a minimally invasive and highly reproducible procedure to induce focal ischemia in the spinal cord and serves as a model of spinal cord injury in mice.
Zusammenfassung
Spinal cord injury (SCI) is a devastating clinical condition causing permanent changes in sensorimotor and autonomic functions of the spinal cord (SC) below the site of injury. The secondary ischemia that develops following the initial mechanical insult is a serious complication of the SCI and severely impairs the function and viability of surviving neuronal and non-neuronal cells in the SC. In addition, ischemia is also responsible for the growth of lesion during chronic phase of injury and interferes with the cellular repair and healing processes. Thus there is a need to develop a spinal cord ischemia model for studying the mechanisms of ischemia-induced pathology. Focal ischemia induced by photothrombosis (PT) is a minimally invasive and very well established procedure used to investigate the pathology of ischemia-induced cell death in the brain. Here, we describe the use of PT to induce an ischemic lesion in the spinal cord of mice. Following retro-orbital sinus injection of Rose Bengal, the posterior spinal vein and other capillaries on the dorsal surface of SC were irradiated with a green light resulting in the formation of a thrombus and thus ischemia in the affected region. Results from histology and immunochemistry studies show that PT-induced ischemia caused spinal cord infarction, loss of neurons and reactive gliosis. Using this technique a highly reproducible and relatively easy model of SCI in mice can be achieved that would serve the purpose of scientific investigations into the mechanisms of ischemia induced cell death as well as the efficacy of neuroprotective drugs. This model will also allow exploration of the pathological changes that occur following SCI in live mice like axonal degeneration and regeneration, neuronal and astrocytic Ca2+ signaling using two-photon microscopy.
Einleitung
Traumatische Rückenmarksverletzungen (SCI) ist eine verheerende klinischen Zustand, die die sensomotorische und autonome Funktionen des SC. Patienten überleben SCI sind oft mit schwächenden Querschnittslähmung, die ihre täglichen Aktivitäten und die Lebensqualität erheblich beeinträchtigt 1 verlassen. Experimental SCI Modelle wurden zu einem unverzichtbaren Werkzeug in der wissenschaftlichen Forschung, um die Pathophysiologie der SCI und die damit verbundenen neuronalen Reparaturprozesse zu verstehen. Diese Modelle wurden auch verwendet, um die Wirksamkeit von verschiedenen präklinischen experimentellen neuroprotektive Eingriffe, bei funktionellen Erholung abzielen testen. Derzeit Mehrheit der SCI-Modelle in der Praxis beschäftigen die Verwendung von physikalischen stumpfe Gewalt mechanisch stören und schädigen die SC. Diese Methoden umfassen Quetschung, Kompression, Dislokation und Durchtrennung des SC 2. Es wurde vorgeschlagen, dass nach der primären mechanischen Insult eine sekundäre Verletzungen in Form von Sätzen in Ischämie im verletzten SC 3,4. Die Ätiologie der sekundären Ischämie beinhaltet umfangreiche Gewebedegeneration, parenchymale Blutungen und manchmal durch Verstopfung von Gefäßen durch Gewebsödeme 5-7. Als Folge der Sekundärverletzung die Integrität SC ist weiter beeinflusst werden Neuronen und Gliazellen stark in Funktion und Lebensfähigkeit beeinträchtigen und Apoptose die an das Wachstum in der chronischen Phase der Schädigung Infarkt führt analog zu unterziehen, um das Wachstum von ischämischen Penumbra nach Schlaganfall 8,9. Mehrere Mechanismen wie Exzitotoxizität, Produktion von freien Radikalen und Entzündungen berichtet worden, für die ischämischen Zelltod nach SCI 10,11 verantwortlich. Darüber hinaus ist SC Ischämie eine ernste Komplikation der thorakoabdominale Aortenaneurysma Reparatur Operationen, die oft zu Querschnittslähmung bei den Patienten, 12,13. Trotz dieser hohen klinischen Auswirkungen gibt sehr wenige Modelle von Rückenmark-Ischämie mit hoher Reproduzierbarkeit verfügbar.
nt "> Photothrombosis (PT) ist ein allgemein verwendetes Verfahren für die Induktion einer fokalen Ischämie im Gehirn 14-20. Die Technik ist ziemlich nicht-invasiven, hoch reproduzierbar und ergibt eine genaue fokalen ischämischen Läsion in dem belichteten Bereich des Gehirns 17 -21. Dies wird durch die systemische Verabreichung von photoaktiven Farbstoffen wie Rose Bengal (RB) 16-20,22 oder Erythrosin B erzielt 23, gefolgt von lokalisierten Bestrahlung der Blutgefäße mit der richtigen Lichtquelle. Die Photoaktivierung des Farbstoffs bewirkt die Erzeugung von freien Radikalen, stören die Integrität des glatten vaskulären Endothel, und bewirken, daß die Plättchen zu sammeln, die anschließend bildet einen Thrombus. die Behinderung der Blutströmung durch den Thrombus führt zu einem Infarkt in der von dem Behälter 24 zugeführt Bereich. Aufgrund der Kontrolle über die Leichtigkeit Intensität und Dauer der Bestrahlung dieses Verfahren ergibt sich eine sehr gleichmäßige und reproduzierbare Infarkt. Darüber hinaus kann dieses Verfahren verwendet, um eine infarc induzierent an verschiedenen anatomischen Stellen ermöglicht räumliche (zB graue Substanz vs. weißen Substanz) Verständnis der Wirkung der Ischämie.Das Ziel der vorliegenden Studie ist es, eine einfache und hoch reproduzierbare Modell SC-Ischämie bei Mäusen zu entwickeln. Beschrieben wir die Prozedur eines PT-Modell SC Ischämie in Mäusen. Ergebnisse aus Histologie und Immunfärbung nachgewiesen, dass PT effektiv induzieren SC Infarkt, Neuronenverlust und reaktive Gliose.
Protokoll
Hinweis: Die Mäuse (C57BL / 6J, männlich) im Alter 10 bis 12 Wochen um waren in dieser Studie verwendet. Alle Verfahren wurden in Übereinstimmung mit der NIH Leitfaden für die Pflege und Verwendung von Labortieren durchgeführt und wurden von der University of Missouri Institutional Animal Care und Verwenden Committee (IACUC) zugelassen.
1. Pre-Chirurgie
- Der Tag vor der Operation Autoklaven sterilisieren und alle chirurgischen Instrumenten. Wickeln Sie die Instrumente und Autoklav bei 121 ° C bei 15 psi für 30 Minuten, gefolgt von 30 min zum Trocknen (121 o C, 15 psi, 30/30 Zyklus). Legen Sie die Instrumente in einem sauberen und sterilen Umgebung bis zur weiteren Verwendung.
- Bereiten Sie frische Rose Bengal (RB) Lösung (20 mg / ml in steriler Kochsalzlösung), jedes Mal vor der Operation. Um sich vollständig aufzulösen RB, Wirbel die dann durch Ultraschallbehandlung für 5 min bei 50/60 Hz mit einer Ausgangsleistung von 19 W. Wickeln Sie das Rohr in Aluminiumfolie und vor Lichtröhre bis auf weiteres während sur verwendetgery.
- Bereiten Sie eine Mischung von Ketamin / Xylazin in steriler Kochsalzlösung. Fügen Sie 125 ul von Xylazin (Stammkonzentration: 20 mg / ml) und 325 & mgr; l ketmaine (Stammkonzentration: 100 mg / ml) und 550 & mgr; l steriler Kochsalzlösung, um ein Gesamtvolumen von 1 ml des Anästhetikums Mischung zu machen.
- Pre-warm die homeothermic Heizkissen.
- Pre-warm die Metallhalogenlampe (Lichtquelle für FN1 Epi-Fluoreszenzmikroskop) für 30 Minuten, um die Lampenleistung zu stabilisieren.
- Anpassen der Größe des beleuchteten Bereichs auf einen Durchmesser von 1 mm unter Verwendung von 10X-Objektiv und einer Strichplatte durch Einstellung der Feldblende in der aufrechten FN1 Epi-Fluoreszenzmikroskop.
2. Chirurgisches Verfahren
- Betäuben die Maus mit einer Dosis von Ketamin (130 mg / kg B. Gew.) Und Xylazin (10 mg / kg B. Gew.). Auf der Grundlage der Cocktail in 1.3, 4 & mgr; l pro g Maus B. Gew. werden gebraucht. Sterilisieren Sie die Injektionsstelle mit einem Alkoholtupfer und Verwaltung der Anästhesie durch den inner-peritoneal (IP) Route. Achten Sie darauf, die Betäubungsmittel in die Blutgefäße oder Muskel injizieren, da dies würde die Ein- und Ausleitung des Tieres zu verzögern.
- Künstliche Tränen Salbe auf beiden Augen von der Maus, um ein Austrocknen zu verhindern und legen Sie das Tier auf dem Heizkissen, um Unterkühlung zu verhindern.
- Aufbereiten von tierischen
- Überprüfen Sie das Tier für die ordnungsgemäße chirurgische Ebene der Anästhesie durch Verwendung des toe Prise Antwort.
- Sobald das Tier chirurgischen Narkosetiefe erreicht hat, und klemmen die Haare auf der Rückenoberfläche um Mittellinie des Tieres mit einem elektrischen Haarschneider. Scheuern die Operationsstelle mit 70% Ethanol, gefolgt von Betadin-Lösung dreimal. Decken Sie die Website mit einem sterilen Operationstuch bis zum nächsten Schritt.
- Chirurgisches Verfahren, um dünne Knochen um das Rückenmark freizulegen
- Platzieren Sie die Maus in Bauchlage über die homeothermic Heizkissen auf der chirurgischen Plattform (Abbildung 1A). Die Maus richtig zu sichernHaltung mit einem Schnauzen Klemme einen länglichen Halsbereich (1A, B) zu halten.
- Einen Einschnitt (etwa 1 cm Länge) unter Verwendung von chirurgischen Scheren entlang der dorsalen Mittellinie, die sich von der Brustwirbel T9 bis T12. Abnehmen der Haut, OP-Bereich freizulegen.
- Mit einem Skalpell vorsichtig deaktivieren Sie das Muskel, um die Rückenstacheln bei T9 aussetzen - T12 Wirbel. Blutungen stoppen in jedem Schritt durch leichten Druck mit sterilen Wattestäbchen. Separate T10 - T12 Wirbel von der umgebenden Muskeln und sichern Sie diese mit Hilfe eines Wirbelklemme zu stabilisieren und jede Bewegung verhindert wird (Abbildung 1A, B).
- Verwendung eines Hochgeschwindigkeitsbohrer mit Knochen Polieren Bohrer, vorsichtig und sanft dünne der dorsalen Oberfläche des T10 oder T11 Wirbels der hinteren Rückenader und andere kleine Schiffe auf der dorsalen Oberfläche des SC (1C) zu visualisieren.
- Zu thermischen Schäden aufgrund von Wärme während der Ausdünnung Prozedur erzeugt verhindern,eine milde und konstanten Strom von normaler Kochsalzlösung mit konstanter Saugleistung, um die Trümmer zu entfernen.
- Mit einem Skalpell vorsichtig glatt die Knochenoberfläche, bis der Hauptbehälter ist deutlich sichtbar. Darauf achten, dass das Rückenmark bei diesem Vorgang beschädigt werden.
- Sobald das Blutgefäß visualisiert verabreichen RB bei einer Dosis von 30 mg / kg (Körpergewicht) durch retro-orbitalen Sinus Route unter Verwendung einer Insulinspritze.
- Messen Sie den Blutfluss mit Hilfe eines Laser-Doppler-Durchflussmesser nach 3 min folgenden RB Injektion bei Bedarf (2A, B). Pflegen Asepsis während gesamte Verfahren.
3. Induktion von PT
- Legen Sie das Tier auf einem XY-Position einstellbar Stufe über einen Lab-Jack, der die Höhe justieren kann. Einstellen der Position der Maus, so dass die freigelegten Bereich T11 Rückenmark ist direkt unter dem 10X-Objektiv des FN1 Epi-Fluoreszenzmikroskop (3A).
- Stellen Sie die Macht des liGHT Quelle bei 12% und bestrahlen die Region T11 mit einem Durchmesser von 0,75 mm in der Mitte des ausgedünnten Rückenmark (Anmerkung: Diese Region umfasst die hintere Rücken Vene und anderen Kapillaren) mit grünem Licht (Wellenlänge 540-580 nm, das ist durch den Filterwürfel in dem Mikroskop) durch die 10X-Objektiv für 2 min erreicht wird. Bilder aufnehmen, am Anfang und Ende des Bestrahlungs (3B, C) und Aufzeichnen der Zeit des Experiments an dieser Stelle.
- Messung der Blutfluss wieder für 10 min bei Bedarf, indem der Laser-Doppler-Sonde an der gleichen Position über dem Rückenmark, wie in 2.4.8 (2A, B).
- Nach der Bestrahlung Prüfung für jede Blutung und wenn keiner gefunden, Annähen des Tieres gehen. Naht der oberflächliche Faszie zusammen mit den Muskeln auf der jeder Seite des Rückenmarks mit einem resorbierbaren Naht oder 4-0 Größe Seidenfaden. Achten Sie darauf, um die freiliegende SC beschädigen. Naht der Haut mit 4-0 Seidennaht. Bewerben Betadine oder Jodzu den Rändern der Haut nach dem Vernähen.
4. Post-Chirurgie Pflege
- Nach dem Nähen, legen Sie das Tier auf dem Heizkissen für die Wiederherstellung. Nach der Wiederherstellung überprüfen Sie die Tiere auf Anzeichen von neurologischen Defiziten durch die Beobachtung der Bewegung der beiden hinteren Extremitäten. Stellen Sie das Tier nicht unbeaufsichtigt lassen, bis er wieder zu sich kam, um ausreichende Brustlage zu halten.
- Übertragen Sie die Tiere auf den Käfig. Stellen Sie das Tier, das der Operation an die Firma von anderen Tieren unterzogen wurde, bis vollständig erholt nicht zurück.
- Überprüfen Sie die Tiere in regelmäßigen Abständen. Im Falle von schweren neurologischen Defiziten, bieten die richtige Pflege wie Evakuierung von Blase, Verabreichung von Analgetika (Buprenorphin, 0,05 bis 0,1 mg / kg). Überprüfen Sie für die Dehydratisierung und verwalten normaler Kochsalzlösung subkutan in schweren Fall. Üblicherweise wird Buprenorphin (0,1 mg / kg) nach dem Vernähen zu Schmerzen im Operationsstelle zu lindern, verabreicht werden.
- Wenn Tiere nicht sofortnach der Operation getötet, werden wir mit hohem Wassergehalt Ernährung auf dem Käfigboden setzen, damit die Tiere die Nahrung leicht zu erreichen.
5. transkardialer Perfusion, Nissl-Färbung und Immunfärbung
- Transkardial perfundieren das Tier wie zuvor 17-20 beschrieben.
- Das Tier zu betäuben, wie zuvor in dem Protokoll beschrieben und transkardial mit Phosphatpuffer-Salzlösung (PBS, pH 7,4), gefolgt von eiskaltem 4% Paraformaldehyd (PFA) in PBS perfundiert.
- Nach Durchblutung, entfernen Sie das Rückenmark (SC) und post-fix it in 4% PFA in PBS bei 4 ° CO / N. Übertragen Sie die Fest SC in PBS mit 30% Saccharose und halten Sie sie für 2 - 3 Tage, bis es auf den Boden der Röhre sinkt.
- Verwendung eines Kryostaten geschnitten das Rückenmark in 30 & mgr; m dicke Abschnitte und sie seriell auf eine Gelatine-beschichtete Glasobjektträger oder in einem 48-Well-Platte mit 0,01 M PBS.
- Nissl-Färbung: Um die Verletzungsgefahr durch PT verursacht inspizieren führen eine Nissl staining auf Rückenmarksabschnitte wie zuvor beschrieben, 17-20.
- Kurz gesagt, sammeln jeden fünften Rückenmark Scheibe auf den Glasobjektträger und Färbung mit 0,25% Kresylviolett. Nehmen Sie Bilder von den gefärbten Schnitten (Abbildung 4).
- Immunfärbung: Wie vorher mit einem schwimmenden Abschnitt Verfahren 17,18,20 beschrieben.
- Kurz gesagt, färben die Rückenmarkschnitte durch Inkubieren O / N bei 4 ° C mit Kaninchen-anti-Glia fibrilläres saures Protein (GFAP) polyklonalem Antikörper (1: 300), Kaninchen-anti-NeuN Antikörper (1: 300), und Kaninchen-anti- Iba1 Antikörper (1: 500), gefolgt von Esel-Anti-Kaninchen Alexa 568-konjugierten IgG (1: 400) Sekundärantikörper für 4 h bei RT. Bilder aufnehmen, mit einem Fluoreszenzmikroskop (Abbildung 5).
Ergebnisse
Das Ziel dieser Studie war es, das Rückenmark Ischämie bei Mäusen mit einem PT-Modell zu erzeugen. Nach der gewünschten Knochenbereich über dem Rückenmark (T10 - T12) wurde verdünnt wurde Rose Bengal durch retro-orbitalen Sinus Weg injiziert, und Ischämie wurde von PT induziert 1A, B zeigen die Maus positioniert eine maßgeschneiderte chirurgisch. Plattform während der Operation. Die Maus wurde anstelle von einer Schnauze Klammer gehalten und zwei verstellbare wirbelKlemmen zur Stabilisierung der Wirbelsäule 1C zeigen einen verdünnten Fenster über dem Rückenmark von T10. - T12. Der Hauptblutgefäß und deren Filialen deutlich sichtbar gemacht werden. (B 2A), die Induktion von Ischämie zu bestätigen, wurde Veränderungen im Blutfluss unter Verwendung eines Laser-Doppler-Durchflussmesser vor und nach PT gemessen. Zur Analyse wurde der Rückgang in% des Blutflusses mit der Grundlinie Blutfluss vor photothrombosis berechnet. Blutfluss fiel auf ~ 20% unmittelbar nach Lichtbeleuchtung im Vergleich wit dem basalen Niveau vor Beleuchtung. 3B, C zeigt Fluoreszenzbilder von Rückenmarks Blutgefße am Anfang und Ende des PT. Beleuchtung für 2 min unter Blutgerinnsel in den Blutgefäßen (3C), was die Induktion von Ischämie, die mit den Messungen des Laser-Doppler-Durchflussmesser. Der Schädigung des PT verursacht inspizieren wurden die Mäuse 3 Tage opferte nach PT und Nissl-Färbung durchgeführt wurde. Bilder im Anschluss Nissl-Färbung zeigte die Infarktregion, die sich deutlich von dem umgebenden Bereich begrenzt werden kann, was anzeigt, Rückenmarkgewebeschäden und Zelltod nach PT (Abbildung 4). Die Immunfärbung wurde für NeuN, GFAP und Iba1 durchgeführt. NeuN + Neuronen in der grauen Substanz in der ischämischen Kerns (5A) verloren, während GFAP-Expression wurde in der Grenze von ischämischen Kerns erhöht (5B, auch den boxed Region). Die Iba1 + Mikroglia zeigte eine globoid morphologie (dh., eine vergrößerte Zellkörper mit kürzeren und weniger Prozesse finden Sie in der boxed Region) zusammen mit erhöhter Iba1 Ausdruck (5C). Zwar gab es eine Gewebeverlust in der ischämischen Kernbereich durch schwimmende Abschnitt Färbung kann eine Erhöhung in GFAP und Iba1 Ausdruck im gesamten peri-Infarktbereich deutlich beobachtet werden. Diese Ergebnisse zeigen, neuronalen Tod und reaktive Gliose in der Penumbra nach SC Ischämie. Auf der anderen Seite, erhebliche Funktionsdefizite wurden in den verletzten Mäusen dh deaktiviert Hintergliedbewegung einen Tag nach PT beobachtet, was anzeigt, Lähmung der hinteren Extremitäten (siehe Video).

Abbildung 1. PT-induzierten Ischämie-Modell in Rückenmark. (A) Fotografien des Chirurgie-Plattform für das Rückenmark PT. Einschub: vergrößert Wirbelschellen.(B) Die Maus wurde durch eine Schnauze Klemme und durch zwei maßgeschneiderte Wirbelklemmen auf der Bühne gehalten wird. Beachten Sie, dass der Knochen bei T10 dünnt. - T12 Bereich und zwei Metallwirbelklemmen wurden zur Stabilisierung der Wirbelsäule (C) Eine Zoom-in-Bild, das die Region mit der ausgedünnten Knochen über dem Rückenmark auf T10-11 für die Induktion von PT. Beachten Sie die Hauptblutgefäße und deren Filialen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Die Rückenmarkblutflussmessung. (A) Das Setup des Rückenmarks Oberfläche Blutflussmessung mit Hilfe eines Laser-Doppler-Durchflussmesser und stereotaktischen Gerät, um die Sonde zu positionieren. (B)Rückenmarksblutung vor und nach der PT gemessen. In diesem Experiment wurde die PT durch Beleuchten mit einer Lichtquelle für 2 min mit einer 12% Leistung induziert. Der Durchmesser der bestrahlten Oberfläche war 0,75 mm und wurde in der Mitte des Rückenmarks. Blutfluß wurde für bis zu 5 min zu stabilisierenden Signals vor PT zu erhalten, und bis zu 10 min nach PT aufgezeichnet. Daten von jeder Maus wurde auf den Wert vor der Lichtbestrahlung normalisiert. Die Grafik zeigt den gemittelten Wert der Daten von 3 Mäusen. Der Pfeil zeigt den Beginn der PT. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. PT-induzierte Rückenmarks Ischämie. (A) Fotografie einerMaus platziert unter dem Mikroskop auf Induktions PT im Rückenmark. Die Position der Maus kann in dreidimensional mit Hilfe der XY Gleittisch und ein Lab-Jack eingestellt werden. Licht aus dem 10X-Objektiv wurde auf der Oberfläche des Rückenmarks konzentriert. (BC) Fluoreszenzbilder der Blutgefäße in das Rückenmark vor (B) und nach (C) Beleuchtung nach der Injektion von Rose Bengal. Beachten Sie die Blutgerinnsel nach 2 min Bestrahlung (C) (siehe Pfeile). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
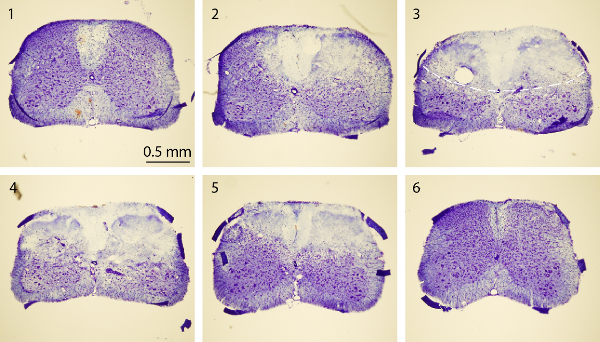
Abbildung 4. Nissl-Färbung von Rückenmark. Nissl-Färbung von Bildern einer Reihe von rostral-zu-Schwanzrückenmarksquerschnitte, die normal (Abschnitte enthalten1 und 6) und PT-induzierte Epizentrum (Abschnitte 2-5). Die Mäuse wurden 3 Tage nach der PT geopfert. Jeder Abschnitt des Rückenmarks ist 30 um dick. Das Intervall zwischen zwei Abschnitten 750 um. Die gestrichelte Linie in 3 rd Bild skizziert die Infarktbereich. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
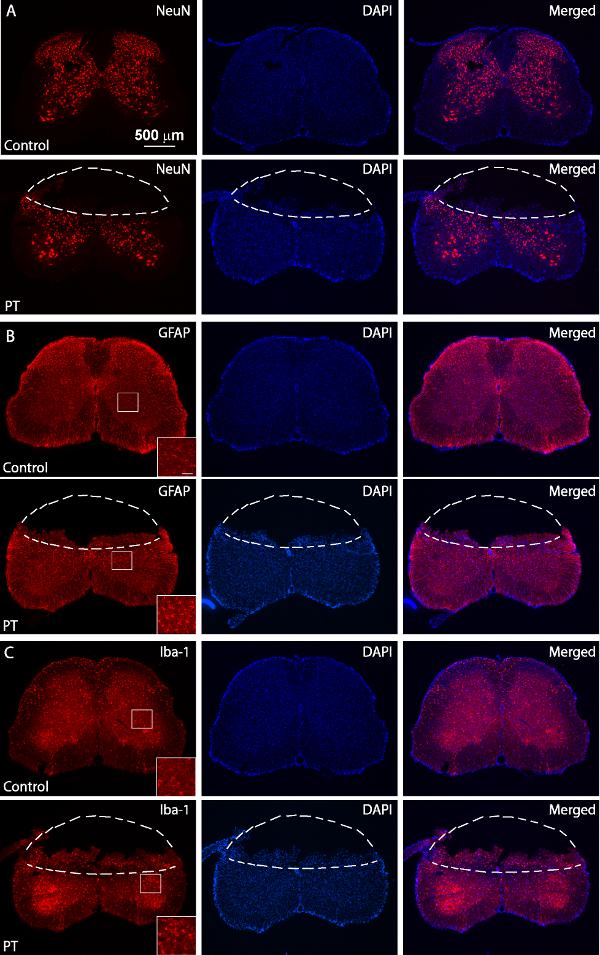
Abbildung 5: Immunfärbung von NeuN, GFAP und Iba1. Fluoreszenzbilder von NeuN (A), GFAP (B) und Iba1 (C) Färbung von normalen (obere Felder) und PT-verletzt (untere Felder) Rückenmarksschnitte. Der verletzte Maus wurde 3 Tage nach der PT geopfert. Die gestrichelten Linien trennen die Infarktregionen von normalen Geweben. Die eingerahmten Bereiche zeigen, hochauflösende Bilder von GFAP und Iba1 Ausdruck mit einem Maßstab von 50mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Film . PT in Rückenmark induzierte Verhaltensdefiziten. Der Film zeigt die Bewegung eines normalen und eines PT-verletzten Maus in einen Käfig. Bemerken das Ziehen beider Hintergliedmaßen der Maus mit inured Rückenmark, was anzeigt Lähmung hinteren Extremitäten (Paraplegie). Der Film wurde 24 Stunden nach der PT in die verletzte Maus gemacht.
Diskussion
In dieser Studie haben wir beschrieben, eine photothrombotic Modell SC Ischämie. Aufgrund der Fortschritte in der Gentechnik hat es eine Schwankung in der im Handel erhältlichen transgenen Mäuse, die es möglich gemacht hat, um die Auswirkungen von spezifischen Genen in das ischämische Pathophysiologie im SC beteiligt studieren. Das Ziel der Studie war es, eine reproduzierbare Mausmodell der Ischämie des Rückenmarks zu entwickeln. Hier angepasst wir eine kortikale PT Modell SCI in Mäusen zu induzieren. Nach der Operation die hintere Rücken Vene und Kapillaren auf der Dorsalseite von Mäusen auf der Ebene der Brustwirbel T11 wurden belichtet. Dann RB, ein kommerziell erhältliches fotoaktiven Farbstoff wurde durch retro-orbitalen Sinus Weg injiziert, um die gewünschte Gefäßverteilung zu finden. Die freiliegende Blutgefäß wurde dann durch ein grünes Licht bestrahlt, um die Bildung von Thromben und später einem Infarkt induzieren. Unsere Ergebnisse von histologischen und Immunofärbung Methoden zeigten, dass PT induzierten Infarkt im Rückenmark und Reactive Gliose in der peri-Infarktbereich. Auch wurden neurologische Defizite wie Lähmung der hinteren Gliedmaßen beobachtet. Diese Daten legen nahe, dass PT ist ein geeignetes Modell für die Untersuchung der Pathophysiologie und Mechanismen des Zelltods nach SCI. Der kritische Schritt im Protokoll ist die Verwendung eines Hochgeschwindigkeits-Bohrmaschine dünnen der Oberfläche des Wirbels zur Sichtbarmachung des Blutgefäßes an der dorsalen Oberfläche des SC. Dieser Schritt sollte sorgfältig, wie Anwendung von Überdruck kann dazu führen, den Bohrer, um Rücken Hohlraum geben und den SC beschädigen durchgeführt werden. Auf der anderen Seite, könnte ungleichmäßige Verdünnung zu fehlerhafter Beleuchtung führen und unregelmäßige Infarkte zu produzieren. Zur Lösung dieses Problems ist eine häufige Inspektion der Oberfläche des Knochens unter Mikroskop nach jedem kurzen Schritt des Bohrens empfohlen, die Dicke des Knochens zu bewerten und um die Verwendung des Bohrers weiter bewerten. Die Verwendung von steriler Kochsalzlösung wird empfohlen, den Schmutz sowie zur besseren Visualisierung der exponierten Oberfläche auszuwaschen. Die Aufrechterhaltung constant Asepsis während gesamte chirurgische Verfahren, angemessene postoperative Pflege des Tieres Tierüberlebensfähigkeit zu verbessern und die Erfolgsquote der Experimente.
Unsere aktuellen Modell der PT nicht den Kauf einer teuren Instrumente, wie jedes Labor, das mit einer Auflicht-Fluoreszenz-Mikroskop mit einer Lichtquelle ausgestattet ist erforderlich (wie Quecksilberlampe, Halogen-Metalldampflampe oder Laser von 488 nm Wellenlänge) kann führen Sie dieses Verfahren. Darüber hinaus bietet diese Technik Kontrolle über die Größe des Infarkts durch Einstellen der Öffnungsgröße im Vergleich zu anderen SC Ischämiemodellen dergleichen kombiniert Okklusion Aorten-, subclavia und innere Brustwandarterie 25 und modifiziert Aortenquerschnitts Klemmverfahren 26, die kompliziert sind und extrem invasiv. In unserem Modell wurde ein Hochgeschwindigkeits-Bohrer, um dünn der dorsalen Oberfläche des Wirbels zur Visualisierung als Alternative zur Laminektomie, Methode der Wahl von vielen Labors entschieden, SCI induzieren.Laminektomie beinhaltet Schneid der Wirbel, die übermäßige Blutungen durch Durchtrennung der Wirbelblutgefäße führen kann und dies könnte das Feld für die Bildgebung zu verschleiern. Auch wenn einige Protokolle beraten die Verwendung von Wattestäbchen während Laminektomie kann es in Kompression führen klar aus dem starke Blutungen, welche zusätzlichen Verletzungen des SC verursachen können. Weiterhin ist die freiliegende Oberfläche des Rückenmarks kann in direktem Kontakt mit Blut und seine Bestandteile sowie scharfen Kanten der geschnittenen Knochen, die unnötige Schwankungen dem Experiment hinzuzufügen kommen kann. Unter Verwendung der aktuellen PT Modell können Infarkt mit unterschiedlicher Größe und Tiefe durch einfache Manipulation der Intensität der Lichtquelle, die Dauer der Belichtung und die Fläche der freiliegenden Oberfläche erzeugt werden. Obwohl die aktuelle Studie erzeugten Ischämie auf den zentralen Bereich von T11 in der SC kann dieses Verfahren auch Infarkte an unterschiedlichen Orten entlang rostral-zu-Schwanz sowie seitlichen Richtung des Rückenmarks, welche mig erzeugenht profitieren Verständnis der regionsspezifische Wirkung der Ischämie auf Querschnittslähmung. Auf der anderen Seite, auch wenn die Beleuchtung auf der Oberfläche des Rückenmarks, das Licht kann zu bestimmten Tiefe in das Gewebe eindringen und die Schädigung kann auch in der grauen Substanz induziert werden. Wie Rose Bengal in gesamten Umlaufsystem verteilt, wenn die Tierarten gleich sind, und dem Alter und Gewicht ähnlich sind, erwarten wir, dass konsistente Läsion wie in kortikale Ischämie durch PT induziert erzeugt werden.
Der andere große Vorteil des PT-induzierten Ischämie ist sehr niedrige Sterblichkeit der Tiere. Niedrige Sterblichkeit bedeutet langfristige Überlebensstudien können durchgeführt, die nützlich in der Entschlüsselung der zeitlichen Wirkungen des ischämischen Verletzung auf das Überleben und die motorische Funktion Erholung sein könnte. Dieses Modell kann auch für das Verständnis der zellulären Reparaturmechanismen, die in der Regel in der chronischen Phase der Verletzung 14,19,27-29 auftreten spät zu unterstützen. Dieses Modell produziert auch erhebliche motorische Defizite, die Be verwendet, um die Wirksamkeit von Neuroprotektiva auf funktionelle Erholung beurteilen. Darüber hinaus wird auch dieses Modell ermöglicht die Untersuchung der pathologischen Veränderungen nach der SCI wie axonale Degeneration und Regeneration, neuronale und astrocytic Ca 2+ Signalisierung und Überlastung in lebenden Mäusen mit Zwei-Photonen-Mikroskopie.
Wie alle anderen Modelle SCI ist PT nicht frei von Nachteilen. Die Nachteile dieser Technik sind ähnlich denen in kortikalen PT gesehen. Einige der Mängel gehören der Mangel an einer anatomisch klar ischämischen Penumbra, die das Ziel vieler neuroprotektive Medikamente ist, und das Fehlen von Reperfusion. Es ist gut bekannt, dass der Reperfusion nach Ischämie wird durch Veränderungen wie erhöhte Produktion von reaktiven Sauerstoffspezies, Infiltration von Entzündungszellen und eine erhöhte Produktion von Zytokinen 30-32 gekennzeichnet. Mangelnde Reperfusion in PT bedeutet die Änderungen mit Reperfusionsschaden in SC zugeordnet wird schwierig bleiben, um zu studieren mit diesem Modell.Die Vorteile der Verwendung von PT Ischämie Allerdings überwiegen die Nachteile, und diese Technik erlaubt jetzt, die mit einer leicht durchzuführen und sehr reproduzierbares Modell des Erzeugens SCI bei Mäusen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health [Gabe nicht unterstützt. R01NS069726] und der American Heart Association in Grants Beihilfen [Zuschuss Nr. 13GRNT17020004] auf SD.
Materialien
| Name | Company | Catalog Number | Comments |
| Rose Bengal | Sigma-Aldrich | 330000 | 20 mg/ml in sterile saline |
| C57BL/6J | Jackson lab | 664 | 22 - 25 g |
| Ketamine | VEDCO | NDC-50989-996-06 | 100 mg/ml |
| Xylazine | VEDCO | NDC-50989-234-11 | 100 mg/ml |
| Betadine solution | Purdue | NDC-67618-150-01 | 10% povidone iodine topical solution |
| Normal saline | Abott Laboratories | 04930-04-10 | For diluting RB, anaesthesia and for preventing tissue from drying |
| Artificial tears ointment | Rugby | NDC-0536-6550-91 | 83% white petrolatum |
| Ethanol | Decon labs.Inc | 2716 | 70% ethanol for disinfection |
| Metal halide lamp | EXFO, Canada | X-Cite 120 PC | Set power at 12% |
| Spring scissors | Fine Science Tool | 15000-10 | for minor dissection |
| Scissors (angled to side) | Fine Science Tool | 14063-011 | No. 3 handle |
| Standard scalpel | Fine Science Tool | 10003-12 | for removing muscle |
| Scalpel blade | Feather | 2976 | No. 10 |
| Forceps (curved) | Fine Science Tool | 11150-10 | for holding tissue |
| Forceps (straight) | Fine Science Tool | 11151-10 | for holding tissue |
| Needle holder | Fine Science Tool | 12002-12 | for suturing |
| Tissue adhesive glue | 3M Vetbond | 1469SB | to adhere to edges of the cut skin |
| Monofilament polypropylene | USSC Sutures | VP-521 | Size = 4-0 (for fascia) |
| Perma-hand silk | Ethicon | 683G | Size = 4-0 (for skin) |
| Micro drill | Roboz Surgical Instrument Co. Inc. | RS-6300 | with bone polishing drill bit |
| Laser doppler flowmeter | Moor Instruments | moorVMS-LDF1 | for monitoring change in blood flow |
| Heating pad | Fine Science Tool | 21052-00 | to prevent hypothermia |
| Lab-Jack | Fisher scientific | 14-673-50 | 4 x 4 in plate to adjust the height of the animal |
| X-Y gliding stage | Amscope | GT100 | for positioning the animal under microscope |
Referenzen
- Cadotte, D. W., Fehlings, M. G. Spinal cord injury: a systematic review of current treatment options. Clin Orthop Relat Res. 469 (3), 732-741 (2011).
- Cheriyan, T., et al. Spinal cord injury models: a review. Spinal Cord. 52 (8), 588-595 (2014).
- Young, W. Secondary injury mechanisms in acute spinal cord injury. J Emerg Med. 11, Suppl 1. 13-22 (1993).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Soubeyrand, M., et al. Effect of norepinephrine on spinal cord blood flow and parenchymal hemorrhage size in acute-phase experimental spinal cord injury. Eur Spine J. 23 (3), 658-665 (2014).
- Soubeyrand, M., et al. Real-time and spatial quantification using contrast-enhanced ultrasonography of spinal cord perfusion during experimental spinal cord injury. Spine (Phila Pa 1976). 37 (22), E1376-E1382 (2012).
- Mautes, A. E., Weinzierl, M. R., Donovan, F., Noble, L. J. Vascular events after spinal cord injury: contribution to secondary pathogenesis). Phys Ther. 80 (7), 673-687 (2000).
- Liu, X. Z., et al. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci. 17 (14), 5395-5406 (1997).
- Liu, L., et al. An experimental study of cell apoptosis and correlative gene expression after tractive spinal cord injury in rats. Zhonghua Wai Ke Za Zhi. 42 (23), 1434-1437 (2004).
- Hirose, K., et al. Activated protein C reduces the ischemia/reperfusion-induced spinal cord injury in rats by inhibiting neutrophil activation. Ann Surg. 232 (2), 272-280 (2000).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guerit, J. M., Dion, R. A. State-of-the-art of neuromonitoring for prevention of immediate and delayed paraplegia in thoracic and thoracoabdominal aorta surgery). Ann Thorac Surg. 74 (5), S1867-S1869 (2002).
- Schepens, M. A., Heijmen, R. H., Ranschaert, W., Sonker, U., Morshuis, W. J. Thoracoabdominal aortic aneurysm repair: results of conventional open surgery. Eur J Vasc Endovasc Surg. 37 (6), 640-645 (2009).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Exp Transl Stroke Med. 1, 8(2009).
- Carmichael, S. T. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dietrich, W. D., Ginsberg, M. D., Busto, R., Watson, B. D. Photochemically induced cortical infarction in the rat. 1. Time course of hemodynamic consequences. J Cereb Blood Flow Metab. 6 (2), 184-194 (1986).
- Zhang, W., et al. Neuronal protective role of PBEF in a mouse model of cerebral ischemia. J Cereb Blood Flow Metab. 30 (12), 1962-1971 (2010).
- Li, H., Zhang, N., Sun, G., Ding, S. Inhibition of the group I mGluRs reduces acute brain damage and improves long-term histological outcomes after photothrombosis-induced ischaemia. ASN Neuro. 5 (3), 195-207 (2013).
- Li, H., et al. Histological, cellular and behavioral assessments of stroke outcomes after photothrombosis-induced ischemia in adult mice. BMC Neurosci. 15, 58(2014).
- Wang, T., Cui, W., Xie, Y., Zhang, W., Ding, S. Controlling the Volume of the Focal Cerebral Ischemic Lesion through Photothrombosis. American Journal of Biomedical Sciences. 2 (1), 33-42 (2010).
- Schroeter, M., Jander, S., Stoll, G. Non-invasive induction of focal cerebral ischemia in mice by photothrombosis of cortical microvessels: characterization of inflammatory responses. J Neurosci Methods. 117 (1), 43-49 (2002).
- Boquillon, M., Boquillon, J. P., Bralet, J. Photochemically induced, graded cerebral infarction in the mouse by laser irradiation evolution of brain edema. J Pharmacol Toxicol Methods. 27 (1), 1-6 (1992).
- Kim, G. W., Lewen, A., Copin, J., Watson, B. D., Chan, P. H. The cytosolic antioxidant, copper/zinc superoxide dismutase, attenuates blood-brain barrier disruption and oxidative cellular injury after photothrombotic cortical ischemia in mice. Neuroscience. 105 (4), 1007-1018 (2001).
- Schmidt, A., et al. Photochemically induced ischemic stroke in rats. Exp Transl Stroke Med. 4 (1), 13(2012).
- Lang-Lazdunski, L., et al. Spinal cord ischemia. Development of a model in the mouse. Stroke. 31 (1), 208-213 (2000).
- Wang, Z., et al. Development of a simplified spinal cord ischemia model in mice. J Neurosci Methods. 189 (2), 246-251 (2010).
- Labat-gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. J Vis Exp. (76), (2013).
- Lu, H., et al. Induction and imaging of photothrombotic stroke in conscious and freely moving rats. J Biomed Opt. 19 (9), 96013(2014).
- Seto, A., et al. Induction of ischemic stroke in awake freely moving mice reveals that isoflurane anesthesia can mask the benefits of a neuroprotection therapy. Front Neuroenergetics. 6 (1), (2014).
- Bell, M. T., et al. Toll-like receptor 4-dependent microglial activation mediates spinal cord ischemia-reperfusion injury. Circulation. 128 (11 Suppl 1), S152-S156 (2013).
- Smith, P. D., et al. The evolution of chemokine release supports a bimodal mechanism of spinal cord ischemia and reperfusion injury. Circulation. 126 (11 Suppl 1), S110-S117 (2012).
- Jia, Z., et al. Oxidative stress in spinal cord injury and antioxidant-based intervention. Spinal Cord. 50 (4), 264-274 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten