Method Article
Photothrombosis inducida por isquemia focal como un modelo de lesión de médula espinal en ratones
* Estos autores han contribuido por igual
En este artículo
Resumen
Photothrombosis is a minimally invasive and highly reproducible procedure to induce focal ischemia in the spinal cord and serves as a model of spinal cord injury in mice.
Resumen
Spinal cord injury (SCI) is a devastating clinical condition causing permanent changes in sensorimotor and autonomic functions of the spinal cord (SC) below the site of injury. The secondary ischemia that develops following the initial mechanical insult is a serious complication of the SCI and severely impairs the function and viability of surviving neuronal and non-neuronal cells in the SC. In addition, ischemia is also responsible for the growth of lesion during chronic phase of injury and interferes with the cellular repair and healing processes. Thus there is a need to develop a spinal cord ischemia model for studying the mechanisms of ischemia-induced pathology. Focal ischemia induced by photothrombosis (PT) is a minimally invasive and very well established procedure used to investigate the pathology of ischemia-induced cell death in the brain. Here, we describe the use of PT to induce an ischemic lesion in the spinal cord of mice. Following retro-orbital sinus injection of Rose Bengal, the posterior spinal vein and other capillaries on the dorsal surface of SC were irradiated with a green light resulting in the formation of a thrombus and thus ischemia in the affected region. Results from histology and immunochemistry studies show that PT-induced ischemia caused spinal cord infarction, loss of neurons and reactive gliosis. Using this technique a highly reproducible and relatively easy model of SCI in mice can be achieved that would serve the purpose of scientific investigations into the mechanisms of ischemia induced cell death as well as the efficacy of neuroprotective drugs. This model will also allow exploration of the pathological changes that occur following SCI in live mice like axonal degeneration and regeneration, neuronal and astrocytic Ca2+ signaling using two-photon microscopy.
Introducción
Lesión medular traumática (SCI) es una condición clínica devastadora que afecta a las funciones sensoriomotoras y autonómicas de la SC. Los pacientes que sobreviven SCI a menudo se dejan con paraplejia que afecta significativamente sus actividades y la calidad de vida 1 diarias debilitante. Modelos experimentales SCI han sido una herramienta indispensable en la investigación científica para comprender la fisiopatología de la lesión medular y los procesos de reparación neuronal asociados. Estos modelos también se han utilizado para probar la eficacia preclínica de varias intervenciones neuroprotectoras experimentales que tienen por objeto la recuperación funcional. Actualmente, la mayoría de los modelos de SCI en la práctica emplear el uso de la fuerza física contundente para interrumpir mecánicamente y lesionar a la SC. Estos métodos incluyen contusión, compresión, dislocación y transección del SC 2. Se ha sugerido que después de la lesión mecánica primaria una lesión secundaria en forma de conjuntos de isquemia en lesionada en el SC 3,4. La etiología de la isquemia secundaria incluye una amplia degeneración de los tejidos, la hemorragia parenquimatosa y, a veces por la obstrucción de los vasos sanguíneos por edema tisular 5-7. Como resultado de la lesión secundaria de la integridad de SC se ve afectado aún más, las neuronas y las células gliales son severamente deteriorados en la función y viabilidad y sufren apoptosis que conduce a la del infarto de crecimiento durante la fase crónica de la lesión, de forma análoga al crecimiento de la penumbra isquémica después del accidente cerebrovascular 8,9. Varios mecanismos como excitotoxicidad, la producción de radicales libres y la inflamación se han notificado a ser responsable de la muerte celular isquémica tras SCI 10,11. Además, SC isquemia es una complicación grave de la cirugía de reparación de aneurisma de aorta toraco-abdominales que a menudo conducen a la paraplejia en los pacientes 12,13. A pesar de tal impacto clínico de alta muy pocos modelos de isquemia de la médula espinal con alta reproducibilidad están disponibles actualmente.
nt "> Photothrombosis (PT) es un método comúnmente utilizado para la inducción de la isquemia focal en el cerebro 14-20. La técnica es bastante no invasiva, altamente reproducible y produce una lesión isquémica focal precisa en el área expuesta del cerebro 17 -21. Esto se logra mediante la administración sistémica de colorantes fotoactivos como Rosa de Bengala (RB) 16-20,22 o eritrosina B 23 seguido de irradiación localizada de vasos sanguíneos con fuente de luz apropiada. fotoactivación del colorante hace que la generación de radicales libres que perturbar la integridad del endotelio vascular liso, y hacen que las plaquetas se acumulen, que posteriormente se forma un trombo. La obstrucción del flujo sanguíneo por los resultados de trombos en un infarto en la región suministrada por el recipiente 24. Debido a la facilidad de control en el intensidad y duración de la irradiación Este procedimiento produce un infarto muy uniforme y reproducible. Además, este método puede ser empleado para inducir una infarct en varios lugares anatómicos permitiendo espacial (por ejemplo, la materia gris vs. materia blanca) comprensión de los efectos de la isquemia.El objetivo del presente estudio es desarrollar un modelo fácil y altamente reproducible de SC isquemia en ratones. Hemos descrito el procedimiento de un modelo de PT de SC isquemia en ratones. Los resultados de la histología y la inmunotinción demostraron que PT puede inducir eficazmente miocardio SC, la pérdida neuronal y gliosis reactiva.
Protocolo
Nota: Los ratones (C57BL / 6J, macho) edad 10 - 12 semanas fueron usados en este estudio. Todos los procedimientos se realizaron de conformidad con la Guía del NIH para el Cuidado y Uso de Animales de Laboratorio y fueron aprobados por la Universidad de Missouri Institucional Cuidado de Animales y el empleo Comisión (IACUC).
1. Pre-Op
- El día antes de la cirugía autoclave y esterilizar todos los instrumentos quirúrgicos. Envolver los instrumentos y autoclave a 121 ° C a 15 psi durante 30 min seguido por 30 min de secado (121 ° C, 15 psi, 30/30 ciclo). Coloque los instrumentos en un ambiente limpio y estéril hasta su uso posterior.
- Prepare una solución fresca Rosa de Bengala (RB) (20 mg / ml en solución salina estéril) cada vez que antes de la cirugía. Para disolver completamente RB, vórtice del tubo y luego seguido de tratamiento con ultrasonidos durante 5 min a 50/60 Hz con potencia de salida de 19 W. Envuelva el tubo en papel de aluminio y protegerlo de la luz hasta su uso aún más durante surgery.
- Preparar una mezcla de ketamina / xilazina en solución salina estéril. Añadir 125 l de xilazina (concentración al campo: 20 mg / ml) y 325 l de ketmaine (concentración al campo: 100 mg / ml) y 550 l de solución salina estéril para hacer un volumen final de 1 ml de mezcla anestésica.
- Pre-calentar la almohadilla térmica homeotérmico.
- Pre-calentar la lámpara de haluro metálico (fuente de luz para microscopio FN1 epi-fluorescencia) durante 30 minutos para estabilizar la potencia de la lámpara.
- Ajuste del tamaño de la región iluminada a un diámetro de 1 mm utilizando objetivo de 10X y una retícula mediante el ajuste del diafragma de campo en el FN1 vertical microscopio epi-fluorescencia.
2. Procedimiento Quirúrgico
- Anestesiar al ratón con una dosis de ketamina (130 mg / kg B. peso.) Y xilazina (10 mg / kg B. peso.). Basado en el cóctel de 1,3, 4 l por g de ratón B. peso. Se necesitan. Esterilizar el sitio de la inyección con un algodón con alcohol y administrar los anestésicos a través de la intra-peritoneal ruta (IP). Tenga cuidado de no inyectar los anestésicos en los vasos sanguíneos o el músculo como esto retrasaría la inducción y la recuperación del animal.
- Aplique un ungüento de lágrimas artificiales para los dos ojos del ratón para evitar que se seque y coloque el animal sobre el cojín eléctrico para evitar la hipotermia.
- Preparación de los animales
- Compruebe el animal para la anestesia quirúrgica nivel adecuado mediante el uso de la respuesta pizca dedo del pie.
- Una vez que el animal ha alcanzado el nivel quirúrgico de anestesia, cortar el pelo en la superficie dorsal alrededor de la línea media del animal utilizando un cortador de pelo eléctrico. Frote el sitio quirúrgico con etanol al 70%, seguido por la solución de betadine tres veces. Cubra el sitio con un paño quirúrgico estéril hasta el próximo paso.
- Procedimiento quirúrgico para diluir el hueso para exponer la médula espinal
- Coloque el ratón en una posición de decúbito prono sobre la almohadilla de calefacción homeotermos en la plataforma quirúrgica (Figura 1A). Asegura adecuadamente el ratónpostura mediante una abrazadera hocico para mantener una región de cuello alargado (Figura 1A, B).
- Hacer una incisión (aproximadamente 1 cm de longitud), utilizando tijeras quirúrgicas a lo largo de la línea media dorsal se extiende desde la T9 vértebras torácicas a T12. Separar la piel para exponer el área quirúrgica.
- El uso de un bisturí, borrar cuidadosamente el músculo para exponer las espinas dorsales en T9 - T12 vértebras. Deje de sangrado en cada paso aplicando una presión suave con un hisopo de algodón estéril. T10 separado - T12 vértebras desde el músculo circundante y asegurarlas mediante una abrazadera vertebral para estabilizar y evitar cualquier movimiento (Figura 1A, B).
- Usando un taladro de alta velocidad con el hueso pulido broca, con cuidado y suavidad fina la superficie dorsal de la vértebra T10 o T11 para visualizar la vena vertebral posterior y otras embarcaciones pequeñas en la superficie dorsal de la SC (Figura 1C).
- Para evitar el daño térmico debido al calor generado durante el procedimiento de adelgazamiento,aplicar una corriente suave y constante de solución salina normal junto con succión constante para eliminar los escombros.
- Usando un bisturí suavizar cuidadosamente la superficie del hueso hasta que el vaso principal es claramente visible. Tenga cuidado de no dañar la médula espinal durante este proceso.
- Una vez que el vaso sanguíneo se visualiza, RB administrar a una dosis de 30 mg / kg (peso corporal) a través de ruta seno retro-orbital usando una jeringa de insulina.
- Medir el flujo sanguíneo utilizando un medidor de flujo Doppler láser después de 3 min después de la inyección RB si es necesario (Figura 2A, B). Mantener la asepsia durante todo el procedimiento.
3. Inducción de PT
- Colocar el animal en una etapa ajustable posición XY en un Lab-Jack que puede ajustar la altura. Ajuste la posición del ratón por lo que la región expuesta de la médula espinal T11 está directamente bajo el objetivo de 10x del microscopio FN1 epi-fluorescencia (Figura 3A).
- Ajuste el poder de la lifuente de lucha en el 12% e irradiar la región T11 con un diámetro de 0,75 mm en el medio de adelgazada de la médula espinal (Nota: esta región incluye la vena posterior de la médula y otros capilares) con una luz verde (longitud de onda 540-580 nm, que es logrado por el cubo de filtro en el microscopio) a través del objetivo de 10X para 2 min. Tomar imágenes al principio y al final de la irradiación (Figura 3B, C) y registrar el tiempo del experimento en este punto.
- Medir el flujo sanguíneo de nuevo por 10 min si es necesario mediante la colocación de la sonda Doppler láser a la misma posición por encima de la médula espinal como en 2.4.8 (Figura 2A, B).
- Después de la irradiación de verificación para cualquier hemorragia y si ninguno encontrado procede a la sutura del animal. Suturar la fascia superficial junto con los músculos en ambos lados de la médula espinal utilizando una sutura absorbible o tamaño sutura de seda 4-0. Tenga cuidado de no dañar el SC expuesto. Suturar la piel con sutura de seda 4-0. Aplicar Betadine o yodoa los bordes de la piel después de la sutura.
4. Después de la cirugía Cuidado
- Después de sutura, coloque el animal sobre el cojín eléctrico para la recuperación. Después de la recuperación comprobar los animales en busca de signos de déficit neurológico al observar el movimiento de ambas extremidades traseras. No dejar al animal sin vigilancia hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal.
- La transferencia de los animales a la jaula. No devolver el animal que ha sido sometido a cirugía para la compañía de otros animales hasta que se recupere totalmente.
- Compruebe los animales a intervalos regulares. En caso de déficits neurológicos severos, proporcionar atención adecuada como la evacuación de la vejiga, la administración de analgésicos (buprenorfina, 0,05-0,1 mg / kg). Compruebe si hay deshidratación y administrar por vía subcutánea salina normal en caso grave. Por lo general, la buprenorfina (0,1 mg / kg) se administró después de la sutura para aliviar el dolor en el sitio quirúrgico.
- Si los animales no son inmediatamentesacrificados después de la cirugía, pondremos dieta de alto contenido de agua en el suelo de la jaula, por lo que los animales pueden llegar a la comida con facilidad.
5. transcardial de perfusión, la tinción de Nissl y inmunotinción
- Transcardially perfundir el animal como se describió anteriormente 17-20.
- Anestesiar al animal como se describió anteriormente en el protocolo y transcardially perfundir con solución salina tampón fosfato (PBS, pH 7,4), seguido de enfriado en hielo 4% de paraformaldehído (PFA) en PBS.
- Después de la perfusión, retire la médula espinal (SC) y post-arreglarlo en el 4% PFA en PBS a 4 ° CO / N. Transferir el SC fijo en PBS con 30% de sacarosa y consérvelo para 2 - 3 días hasta que se hunde hasta el fondo del tubo.
- El uso de un criostato cortar la médula espinal en 30 micras de espesor secciones y colocarlos en serie en un recubiertos de gelatina portaobjetos de vidrio o en una placa de 48 pocillos con 0,01 M PBS.
- Tinción de Nissl: Para inspeccionar el daño causado por PT realizar una Nissl staining en las secciones de la médula espinal como anteriormente descrito 17-20.
- Brevemente, recoja cada quinto trozo de la médula espinal en los portaobjetos de vidrio y se tiñen con 0.25% cresil violeta. Tomar imágenes de las secciones teñidas (Figura 4).
- La inmunotinción: Como se ha descrito anteriormente utilizando un método sección 17,18,20 flotante.
- Brevemente, manchar las secciones de la médula espinal mediante la incubación de O / N a 4 ° C con conejo anti-glia proteína fibrilar ácida (GFAP) anticuerpo policlonal (1: 300), anticuerpo de conejo anti-NeuN (1: 300), y anti-conejo Iba1 anticuerpo (1: 500) seguido de burro anti conejo Alexa 568-conjugado IgG (1: 400) anticuerpos secundarios durante 4 horas a RT. Tome imágenes con un microscopio de fluorescencia (Figura 5).
Resultados
El objetivo de este estudio era producir isquemia de la médula espinal en ratones utilizando un modelo de PT. Después de la región deseada de hueso por encima de la médula espinal (T10 - T12) se diluyó, Rosa de Bengala se inyectó por vía seno retro-orbital, y la isquemia fue inducida por PT Figura 1A, B muestran el ratón posicionado en una medida quirúrgica. plataforma durante la cirugía. El ratón se mantiene en su lugar por una abrazadera hocico y dos vertebrado ajustable abrazaderas para estabilizar la médula espinal Figura 1C muestran una ventana adelgazada por encima de la médula espinal de T10 -. T12. El vaso sanguíneo principal y sus ramas pueden ser claramente visualizados. Para confirmar la inducción de la isquemia, los cambios en el flujo de sangre se midió usando un medidor de flujo Doppler láser antes y después de PT (Figura 2A, B). Para el análisis, se calculó la disminución en% del flujo sanguíneo utilizando el flujo de sangre basal antes de photothrombosis. El flujo de sangre se redujo a ~ 20% inmediatamente después de la iluminación de luz en comparación wITH el nivel basal antes de la iluminación. Figura 3B, C muestra imágenes fluorescentes de los vasos sanguíneos de la médula espinal en el principio y el final de PT. Iluminación para 2 min inducida coágulo de sangre en los vasos sanguíneos (Figura 3C), lo que sugiere la inducción de la isquemia, consistente con las mediciones de la medidor de flujo Doppler láser. Para inspeccionar el daño causado por PT, los ratones fueron sacrificados 3 días después se realizó PT y tinción de Nissl. Las imágenes tomadas después de la tinción de Nissl mostraron la región del infarto que puede ser claramente demarcada de la región circundante, lo que indica daño en el tejido de la médula espinal y la muerte celular después de PT (Figura 4). La inmunotinción se realizó para NeuN, GFAP y Iba1. Neuronas NeuN + se perdieron en la materia gris en el núcleo isquémico (Figura 5), mientras que la expresión de GFAP se incrementó en la frontera del núcleo isquémico (Figura 5B, véase también la región en caja). Los microglia Iba1 + mostraron una mor globoidesfología (es decir., un cuerpo celular ampliada con los procesos más cortos y menos, ver la región en caja), junto con el aumento de expresión Iba1 (Figura 5C). Aunque hubo una pérdida de tejido en la región del núcleo isquémico debido a la sección tinción flotante, un aumento en la expresión de GFAP y Iba1 en toda la región peri-infarto se puede observar claramente. Estos resultados indican la muerte neuronal y gliosis reactiva en la penumbra después de SC isquemia. Por otro lado, se observaron déficits funcionales sustanciales en los ratones lesionados, es decir, discapacitados movimiento extremidad posterior un día después de PT, lo que indica la parálisis de las extremidades traseras (ver la película).

Figura 1. Modelo PT-inducida por la isquemia en la médula espinal. (A) Fotografías de la plataforma de la cirugía para la médula espinal PT. Recuadro: agranda abrazaderas vertebrales.(B) El ratón se llevó a cabo mediante una abrazadera hocico y por dos abrazaderas vertebrales medida en el escenario. Observe que el hueso se diluyó en T10 -. Región T12 y dos abrazaderas de metal vertebrales fueron utilizados para estabilizar la médula espinal (C) A-zoom en la imagen que muestra la región con el hueso adelgazado por encima de la médula espinal en T10-11 para el inducción de PT. Observe los principales vasos sanguíneos y sus ramas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. médula espinal medición del flujo sanguíneo. (A) La configuración de la medición del flujo sanguíneo superficie de la médula espinal usando un medidor de flujo Doppler láser y el dispositivo estereotáxico para posicionar la sonda. (B)Se midió el flujo de sangre de la médula espinal antes y después de PT. En este experimento, PT se indujo mediante la iluminación con una fuente de luz para 2 min con una potencia de salida 12%. El diámetro de la superficie irradiada fue de 0,75 mm y estaba en el medio de la médula espinal. El flujo de sangre se registró durante un máximo de 5 minutos para obtener la señal estabilizado antes de PT y hasta 10 minutos después de PT. Los datos de cada ratón se normalizaron al valor antes de la iluminación de luz. La gráfica muestra el valor medio de los datos de 3 ratones. La flecha indica el inicio de PT. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3. PT-indujo isquemia de la médula espinal. (A) Fotografía de unaratón coloca en el microscopio para la inducción de PT en la médula espinal. La posición del ratón se puede ajustar en tres dimensiones usando la etapa de deslizamiento XY y un laboratorio-Jack. La luz del objetivo de 10X se centró en la superficie de la médula espinal. (BC) Fluorescente imágenes de los vasos sanguíneos en la médula espinal antes de (B) y después (C) la iluminación después de la inyección de Rosa de Bengala. Observe el coágulo de sangre después de 2 min de irradiación (C) (ver flechas). Haga clic aquí para ver una versión más grande de esta figura.
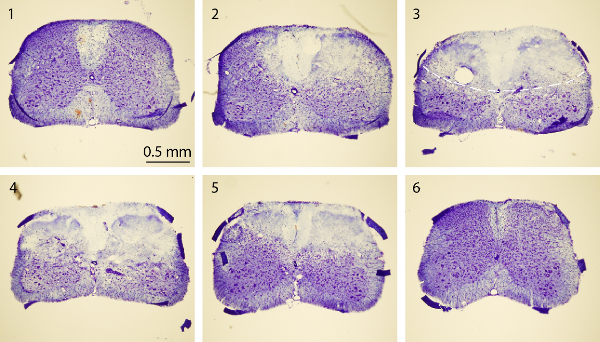
Figura 4. Nissl tinción de la médula espinal. Nissl imágenes de tinción de una serie de secciones transversales de la médula espinal rostral a caudal-que incluyen normales (secciones1 y 6) y epicentro inducida por PT (secciones 2-5). Los ratones fueron sacrificados 3 días después de PT. Cada sección de la médula espinal es de 30 m de espesor. El intervalo entre dos secciones es de 750 micras. La línea discontinua imagen rd 3 en esboza la región del infarto. Por favor, haga clic aquí para ver una versión más grande de esta figura.
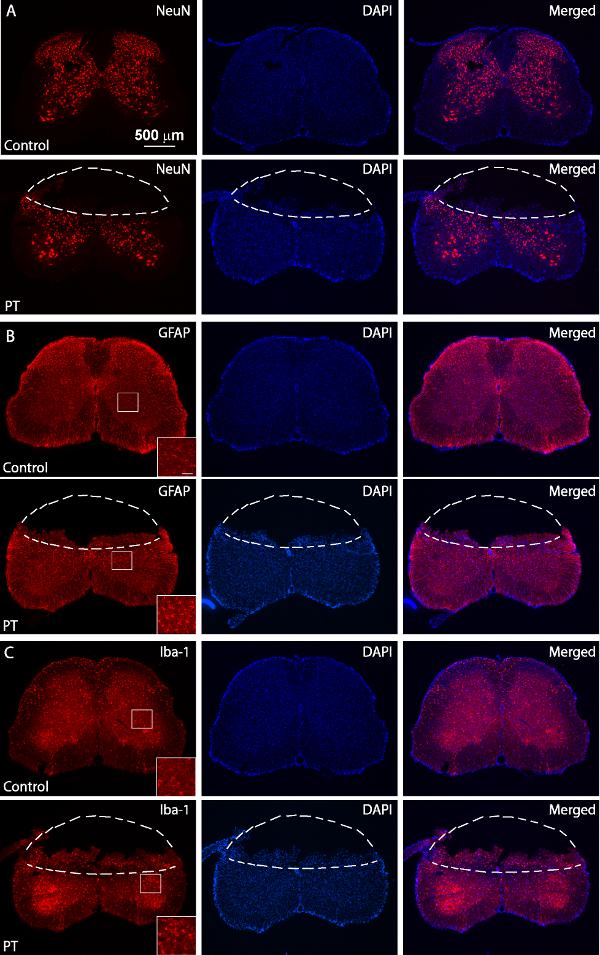
Figura 5. La inmunotinción de NeuN, GFAP y Iba1. Imágenes fluorescentes de NeuN (A), GFAP (B) y Iba1 (C) la tinción de (paneles superiores) normales y PT-heridas (paneles inferiores) Secciones de la médula espinal. El ratón heridos fue sacrificado 3 días después de PT. Las líneas discontinuas separan las regiones de infarto de los tejidos normales. Las regiones en caja muestran imágenes de alta resolución de GFAP y expresión Iba1 con una barra de escala de 50micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Película . PT en la médula espinal inducida por déficit de comportamiento. La película muestra el movimiento de un ratón normal y un PT-lesionado en una jaula. Observe el arrastre de ambas extremidades traseras del ratón con inured la médula espinal, lo que indica la parálisis de las extremidades traseras-(paraplejia). La película fue tomada 24 horas después de PT en el ratón lesionada.
Discusión
En este estudio, hemos descrito un modelo photothrombotic de SC isquemia. Debido a los avances en la ingeniería genética no ha habido un aumento en los ratones transgénicos disponibles en el mercado que ha hecho posible el estudio del impacto de los genes específicos implicados en la fisiopatología isquémica en las CEC. El objetivo del estudio fue desarrollar un modelo reproducible de ratón de la isquemia de la médula espinal. Aquí hemos adaptado un modelo PT cortical para inducir SCI en ratones. Después de la cirugía de la vena y capilares espinal posterior en la cara dorsal de los ratones a nivel de T11 vértebra torácica fueron expuestos. Entonces RB, un colorante fotoactivo disponible comercialmente, se inyectó por vía seno retro-orbital para alcanzar la distribución vascular deseada. A continuación, el vaso sanguíneo expuesto se irradió con una luz verde para inducir la formación de trombo y más tarde en un infarto. Nuestros resultados de métodos histológicos y de inmunotinción mostraron que PT indujo un infarto en la médula espinal y Reactihe gliosis en la región peri-infarto. También se observaron déficits neurológicos como parálisis de las extremidades posteriores. Estos datos sugieren que PT es un modelo adecuado para el estudio de la fisiopatología y los mecanismos de muerte celular después de la lesión. El paso crítico en el protocolo es el uso de un taladro de alta velocidad para adelgazar la superficie de la vértebra para la visualización del vaso sanguíneo en la superficie dorsal de la SC. Este paso se debe realizar con cuidado ya la aplicación de un exceso de presión puede hacer que el taladro para entrar en la cavidad medular y daña la SC. Por otro lado, el adelgazamiento desigual podría resultar en una iluminación inadecuada y puede producir infartos irregulares. Para solucionar este problema, se recomienda una inspección frecuente de la superficie del hueso bajo el microscopio después de cada paso corto de perforación para evaluar el grosor del hueso y para evaluar aún más el uso de la broca. Se recomienda el uso de solución salina estéril al lavado por los escombros, así como para la mejor visualización de la superficie expuesta. El mantenimiento de los contrasasepsia tante durante todo procedimiento quirúrgico, atención post-quirúrgica adecuada del animal puede mejorar la supervivencia de los animales y aumentar la tasa de éxito de los experimentos.
Nuestro modelo actual de PT no requiere la compra de cualesquiera instrumentos caros, como cualquier laboratorio que está equipado con un microscopio de epi-fluorescencia con una fuente de luz (como una lámpara de mercurio, lámparas de halogenuros metálicos, o láser de 488 nm de longitud de onda) puede realizar este procedimiento. Además, esta técnica proporciona control sobre el tamaño del infarto mediante el ajuste del tamaño de la abertura en comparación con otros modelos de isquemia SC como oclusión combinada de la aorta, subclavia izquierda y la arteria mamaria interna 25 y modificado método de sujeción transversal de la aorta 26 que son complicados y están extremadamente invasivo. En nuestro modelo de un taladro de alta velocidad para adelgazar la superficie dorsal de la vértebra para la visualización fue elegido como una alternativa a la laminectomía, método de elección por muchos laboratorios para inducir SCI.Laminectomía implica el corte de las vértebras que puede causar hemorragia excesiva debido a la transección de los vasos sanguíneos vertebrales y esto podría oscurecer el campo para la formación de imágenes. A pesar de que algunos protocolos aconsejan el uso de hisopos de algodón para limpiar el sangrado excesivo durante la laminectomía puede dar lugar a la compresión que puede causar lesiones adicionales a la SC. Además, la superficie expuesta de la médula espinal pueda entrar en contacto directo con la sangre y sus componentes, así como los bordes afilados de los huesos cortados que pueden añadir variabilidad innecesaria para el experimento. Usando el modelo PT actual, infarto con diferente tamaño y la profundidad puede ser generado mediante la simple manipulación de la intensidad de la fuente de luz, duración de la exposición y el área de la superficie expuesta. Aunque el estudio actual genera isquemia en la región central de T11 en el SC, este método también puede generar infartos en diferentes lugares a lo largo rostral-a-caudal, así como dirección lateral de la médula espinal, que MIGht beneficiarse entender el efecto específico de la región de la isquemia en paraplejia. Por otro lado, aunque la iluminación es en la superficie de la médula espinal, la luz podría penetrar a cierta profundidad en el tejido y la lesión también puede ser inducida en la materia gris. Como Rosa de Bengala se distribuye en todo el sistema de circulación, si las especies animales son los mismos, y la edad y peso son similares, esperamos lesión consistente será generado como en la isquemia cortical inducida por PT.
La otra ventaja importante de la isquemia inducida por PT-es muy baja mortalidad de los animales. Baja mortalidad significa estudios de supervivencia a largo plazo pueden ser realizadas que podrían ser útiles para desentrañar el efecto temporal de la lesión isquémica en la recuperación de la supervivencia y la función motora. Este modelo también puede ayudar en la comprensión de los mecanismos de reparación celular que normalmente se producen al final de la fase crónica de la lesión 14,19,27-29. Este modelo también produce déficit de la función motora considerables que pueden Be utiliza para evaluar la eficacia de los agentes neuroprotectores en la recuperación funcional. Además, este modelo también permitirá el estudio de los cambios patológicos después de SCI como la degeneración axonal y la regeneración, neuronal y astrocytic Ca 2+ de señalización y la sobrecarga en ratones vivos utilizando microscopía de dos fotones.
Como el resto de modelos de SCI, PT no carece de inconvenientes. Las desventajas de esta técnica son similares a los observados en PT cortical. Pocas de las deficiencias incluyen la falta de una penumbra isquémica anatómica clara, que es la meta de muchos fármacos neuroprotectores, y la ausencia de reperfusión. Es bien sabido que la reperfusión después de la isquemia se caracteriza por cambios como aumento de la producción de especies reactivas del oxígeno, la infiltración de células inflamatorias y un aumento de la producción de citoquinas 30-32. La falta de reperfusión en PT significa los cambios asociados con la lesión de reperfusión en SC permanecerán difíciles de estudiar el uso de este modelo.Sin embargo, las ventajas de utilizar la isquemia PT inducidos superan a las desventajas y esta técnica proporciona a los investigadores una herramienta fácil de realizar y modelo altamente reproducible de la generación de SCI en ratones.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Esta labor fue apoyada por los Institutos Nacionales de Salud [de Grant no. R01NS069726] y la Asociación Americana del Corazón Grant en Cooperación Financiera No Reembolsable [subvención no. 13GRNT17020004] para SD.
Materiales
| Name | Company | Catalog Number | Comments |
| Rose Bengal | Sigma-Aldrich | 330000 | 20 mg/ml in sterile saline |
| C57BL/6J | Jackson lab | 664 | 22 - 25 g |
| Ketamine | VEDCO | NDC-50989-996-06 | 100 mg/ml |
| Xylazine | VEDCO | NDC-50989-234-11 | 100 mg/ml |
| Betadine solution | Purdue | NDC-67618-150-01 | 10% povidone iodine topical solution |
| Normal saline | Abott Laboratories | 04930-04-10 | For diluting RB, anaesthesia and for preventing tissue from drying |
| Artificial tears ointment | Rugby | NDC-0536-6550-91 | 83% white petrolatum |
| Ethanol | Decon labs.Inc | 2716 | 70% ethanol for disinfection |
| Metal halide lamp | EXFO, Canada | X-Cite 120 PC | Set power at 12% |
| Spring scissors | Fine Science Tool | 15000-10 | for minor dissection |
| Scissors (angled to side) | Fine Science Tool | 14063-011 | No. 3 handle |
| Standard scalpel | Fine Science Tool | 10003-12 | for removing muscle |
| Scalpel blade | Feather | 2976 | No. 10 |
| Forceps (curved) | Fine Science Tool | 11150-10 | for holding tissue |
| Forceps (straight) | Fine Science Tool | 11151-10 | for holding tissue |
| Needle holder | Fine Science Tool | 12002-12 | for suturing |
| Tissue adhesive glue | 3M Vetbond | 1469SB | to adhere to edges of the cut skin |
| Monofilament polypropylene | USSC Sutures | VP-521 | Size = 4-0 (for fascia) |
| Perma-hand silk | Ethicon | 683G | Size = 4-0 (for skin) |
| Micro drill | Roboz Surgical Instrument Co. Inc. | RS-6300 | with bone polishing drill bit |
| Laser doppler flowmeter | Moor Instruments | moorVMS-LDF1 | for monitoring change in blood flow |
| Heating pad | Fine Science Tool | 21052-00 | to prevent hypothermia |
| Lab-Jack | Fisher scientific | 14-673-50 | 4 x 4 in plate to adjust the height of the animal |
| X-Y gliding stage | Amscope | GT100 | for positioning the animal under microscope |
Referencias
- Cadotte, D. W., Fehlings, M. G. Spinal cord injury: a systematic review of current treatment options. Clin Orthop Relat Res. 469 (3), 732-741 (2011).
- Cheriyan, T., et al. Spinal cord injury models: a review. Spinal Cord. 52 (8), 588-595 (2014).
- Young, W. Secondary injury mechanisms in acute spinal cord injury. J Emerg Med. 11, Suppl 1. 13-22 (1993).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Soubeyrand, M., et al. Effect of norepinephrine on spinal cord blood flow and parenchymal hemorrhage size in acute-phase experimental spinal cord injury. Eur Spine J. 23 (3), 658-665 (2014).
- Soubeyrand, M., et al. Real-time and spatial quantification using contrast-enhanced ultrasonography of spinal cord perfusion during experimental spinal cord injury. Spine (Phila Pa 1976). 37 (22), E1376-E1382 (2012).
- Mautes, A. E., Weinzierl, M. R., Donovan, F., Noble, L. J. Vascular events after spinal cord injury: contribution to secondary pathogenesis). Phys Ther. 80 (7), 673-687 (2000).
- Liu, X. Z., et al. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci. 17 (14), 5395-5406 (1997).
- Liu, L., et al. An experimental study of cell apoptosis and correlative gene expression after tractive spinal cord injury in rats. Zhonghua Wai Ke Za Zhi. 42 (23), 1434-1437 (2004).
- Hirose, K., et al. Activated protein C reduces the ischemia/reperfusion-induced spinal cord injury in rats by inhibiting neutrophil activation. Ann Surg. 232 (2), 272-280 (2000).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guerit, J. M., Dion, R. A. State-of-the-art of neuromonitoring for prevention of immediate and delayed paraplegia in thoracic and thoracoabdominal aorta surgery). Ann Thorac Surg. 74 (5), S1867-S1869 (2002).
- Schepens, M. A., Heijmen, R. H., Ranschaert, W., Sonker, U., Morshuis, W. J. Thoracoabdominal aortic aneurysm repair: results of conventional open surgery. Eur J Vasc Endovasc Surg. 37 (6), 640-645 (2009).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Exp Transl Stroke Med. 1, 8(2009).
- Carmichael, S. T. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dietrich, W. D., Ginsberg, M. D., Busto, R., Watson, B. D. Photochemically induced cortical infarction in the rat. 1. Time course of hemodynamic consequences. J Cereb Blood Flow Metab. 6 (2), 184-194 (1986).
- Zhang, W., et al. Neuronal protective role of PBEF in a mouse model of cerebral ischemia. J Cereb Blood Flow Metab. 30 (12), 1962-1971 (2010).
- Li, H., Zhang, N., Sun, G., Ding, S. Inhibition of the group I mGluRs reduces acute brain damage and improves long-term histological outcomes after photothrombosis-induced ischaemia. ASN Neuro. 5 (3), 195-207 (2013).
- Li, H., et al. Histological, cellular and behavioral assessments of stroke outcomes after photothrombosis-induced ischemia in adult mice. BMC Neurosci. 15, 58(2014).
- Wang, T., Cui, W., Xie, Y., Zhang, W., Ding, S. Controlling the Volume of the Focal Cerebral Ischemic Lesion through Photothrombosis. American Journal of Biomedical Sciences. 2 (1), 33-42 (2010).
- Schroeter, M., Jander, S., Stoll, G. Non-invasive induction of focal cerebral ischemia in mice by photothrombosis of cortical microvessels: characterization of inflammatory responses. J Neurosci Methods. 117 (1), 43-49 (2002).
- Boquillon, M., Boquillon, J. P., Bralet, J. Photochemically induced, graded cerebral infarction in the mouse by laser irradiation evolution of brain edema. J Pharmacol Toxicol Methods. 27 (1), 1-6 (1992).
- Kim, G. W., Lewen, A., Copin, J., Watson, B. D., Chan, P. H. The cytosolic antioxidant, copper/zinc superoxide dismutase, attenuates blood-brain barrier disruption and oxidative cellular injury after photothrombotic cortical ischemia in mice. Neuroscience. 105 (4), 1007-1018 (2001).
- Schmidt, A., et al. Photochemically induced ischemic stroke in rats. Exp Transl Stroke Med. 4 (1), 13(2012).
- Lang-Lazdunski, L., et al. Spinal cord ischemia. Development of a model in the mouse. Stroke. 31 (1), 208-213 (2000).
- Wang, Z., et al. Development of a simplified spinal cord ischemia model in mice. J Neurosci Methods. 189 (2), 246-251 (2010).
- Labat-gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. J Vis Exp. (76), (2013).
- Lu, H., et al. Induction and imaging of photothrombotic stroke in conscious and freely moving rats. J Biomed Opt. 19 (9), 96013(2014).
- Seto, A., et al. Induction of ischemic stroke in awake freely moving mice reveals that isoflurane anesthesia can mask the benefits of a neuroprotection therapy. Front Neuroenergetics. 6 (1), (2014).
- Bell, M. T., et al. Toll-like receptor 4-dependent microglial activation mediates spinal cord ischemia-reperfusion injury. Circulation. 128 (11 Suppl 1), S152-S156 (2013).
- Smith, P. D., et al. The evolution of chemokine release supports a bimodal mechanism of spinal cord ischemia and reperfusion injury. Circulation. 126 (11 Suppl 1), S110-S117 (2012).
- Jia, Z., et al. Oxidative stress in spinal cord injury and antioxidant-based intervention. Spinal Cord. 50 (4), 264-274 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados