Method Article
Photothrombosis-indotta ischemia focale come un modello di lesioni del midollo spinale nei topi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Photothrombosis is a minimally invasive and highly reproducible procedure to induce focal ischemia in the spinal cord and serves as a model of spinal cord injury in mice.
Abstract
Spinal cord injury (SCI) is a devastating clinical condition causing permanent changes in sensorimotor and autonomic functions of the spinal cord (SC) below the site of injury. The secondary ischemia that develops following the initial mechanical insult is a serious complication of the SCI and severely impairs the function and viability of surviving neuronal and non-neuronal cells in the SC. In addition, ischemia is also responsible for the growth of lesion during chronic phase of injury and interferes with the cellular repair and healing processes. Thus there is a need to develop a spinal cord ischemia model for studying the mechanisms of ischemia-induced pathology. Focal ischemia induced by photothrombosis (PT) is a minimally invasive and very well established procedure used to investigate the pathology of ischemia-induced cell death in the brain. Here, we describe the use of PT to induce an ischemic lesion in the spinal cord of mice. Following retro-orbital sinus injection of Rose Bengal, the posterior spinal vein and other capillaries on the dorsal surface of SC were irradiated with a green light resulting in the formation of a thrombus and thus ischemia in the affected region. Results from histology and immunochemistry studies show that PT-induced ischemia caused spinal cord infarction, loss of neurons and reactive gliosis. Using this technique a highly reproducible and relatively easy model of SCI in mice can be achieved that would serve the purpose of scientific investigations into the mechanisms of ischemia induced cell death as well as the efficacy of neuroprotective drugs. This model will also allow exploration of the pathological changes that occur following SCI in live mice like axonal degeneration and regeneration, neuronal and astrocytic Ca2+ signaling using two-photon microscopy.
Introduzione
Traumatica lesioni del midollo spinale (SCI) è una condizione clinica devastante che colpisce le funzioni sensomotorie e autonome della SC. I pazienti che sopravvivono SCI sono spesso lasciati con debilitante paraplegia che colpisce in modo significativo le loro attività quotidiane e la qualità della vita 1. SCI modelli sperimentali sono stati uno strumento indispensabile per la ricerca scientifica per capire la fisiopatologia della SIC e processi di riparazione neurale associati. Questi modelli sono stati utilizzati anche per testare l'efficacia preclinica di vari interventi neuroprotettivi sperimentali che mirano a recupero funzionale. Attualmente, la maggior parte dei modelli di SCI, in pratica, impiegare l'uso della forza fisica contundente di interrompere meccanicamente e ferire la SC. Questi metodi includono contusione, la compressione, la dislocazione e recisione della SC 2. È stato suggerito che dopo l'insulto meccanico primario un danno secondario sotto forma di insiemi in ischemia nel SC lesa 3,4. L'eziologia di ischemia secondaria comprende una vasta degenerazione dei tessuti, emorragia parenchimale e talvolta da ostruzione dei vasi sanguigni da parte del tessuto edema 5-7. Come risultato della lesione secondaria l'integrità del SC è ulteriormente influenzata, neuroni e cellule gliali sono gravemente compromessa in funzione e vitalità e apoptosi che porta a infarto crescita durante la fase cronica di lesioni, analoga alla crescita della penombra ischemica ictus seguente 8,9. Diversi meccanismi come eccitotossicità, produzione di radicali liberi, e infiammazione sono stati segnalati per essere responsabile della morte cellulare ischemica seguente SCI 10,11. Inoltre, SC ischemia è una grave complicanza di toraco-aneurisma dell'aorta addominale ambulatori di riparazione che spesso portano a paraplegia nei pazienti 12,13. Nonostante così alto impatto clinico sono attualmente disponibili pochissimi modelli di ischemia del midollo spinale con elevata riproducibilità.
nt "> Photothrombosis (PT) è un metodo comunemente utilizzato per l'induzione di ischemia focale nel cervello 14-20. La tecnica è abbastanza non invasiva, altamente riproducibili e produce una precisa focale lesione ischemica sulla superficie esposta del cervello 17 -21. Ciò si ottiene con la somministrazione sistemica di coloranti fotoattivi come Rosa Bengala (RB) 16-20,22 o Eritrosina B 23 seguita da irradiazione localizzata di vasi sanguigni con sorgente luminosa corretta. Fotoattivazione del colorante provoca la generazione di radicali liberi che compromettere l'integrità dell'endotelio vascolare liscia, e causano le piastrine di accumulare, che forma successivamente un trombo. L'ostruzione del flusso di sangue dai risultati trombo in un infarto nella regione fornito dal recipiente 24. Grazie alla facilità di controllo della intensità e durata dell'irradiazione questa procedura produce un infarto molto uniforme e riproducibile. Inoltre, questo metodo può essere impiegato per indurre un infartot in varie sedi anatomiche abilitazione spaziale (ad esempio, materia grigia vs. materia bianca) comprensione degli effetti di ischemia.Lo scopo del presente studio è di sviluppare un modello semplice e altamente riproducibile di SC ischemia nei topi. Abbiamo descritto la procedura di un modello PT di SC ischemia nei topi. I risultati di istologia e immunostaining dimostrato che TP può effettivamente indurre SC miocardico, perdita neuronale e gliosi reattiva.
Protocollo
Nota: I topi (C57BL / 6J, maschio) di età compresa 10 - 12 settimane sono state utilizzate in questo studio. Tutte le procedure sono state eseguite in conformità con la guida NIH per la cura e l'uso di animali da laboratorio e sono stati approvati dalla University of Missouri Istituzionale Animal Care and Use Committee (IACUC).
1. Pre-Surgery
- Il giorno prima dell'intervento autoclave e sterilizzare tutti gli strumenti chirurgici. Avvolgere gli strumenti e autoclave a 121 ° C a 15 psi per 30 minuti seguiti da 30 minuti di essiccazione (121 o C, 15 psi, 30/30 ciclo). Mettere gli strumenti in un ambiente pulito e sterile fino a nuovo uso.
- Preparare soluzione fresca Rosa Bengala (RB) (20 mg / ml in soluzione fisiologica sterile) ogni volta prima della chirurgia. Per sciogliere completamente RB, vortex il tubo poi seguita da ultrasuoni per 5 min a 50/60 Hz con potenza di uscita di 19 W. Avvolgere il tubo in un foglio di alluminio e proteggerlo dalla luce fino a nuovo utilizzata durante surgery.
- Preparare una miscela di ketamina / xylazina in soluzione fisiologica sterile. Aggiungere 125 ml di xylazina (concentrazione magazzino: 20 mg / ml) e 325 ml di ketmaine (concentrazione magazzino: 100 mg / ml) e 550 ml di soluzione fisiologica sterile per fare un volume finale di 1 ml di miscela anestetica.
- Pre-riscaldare il rilievo di riscaldamento omeotermi.
- Pre-riscaldare la lampada ad alogenuri metallici (sorgente luminosa per microscopio FN1 epi-fluorescenza) per 30 minuti per stabilizzare la potenza della lampada.
- Regolare la dimensione della regione illuminata ad un diametro di 1 mm con obiettivo 10X e un reticolo regolando il diaframma di campo nel FN1 verticale microscopio a epifluorescenza.
2. Procedura chirurgica
- Anestetizzare il mouse con una dose di ketamina (130 mg / kg B. wt.) E xilazina (10 mg / kg B. wt.). Sulla base del cocktail in 1.3, 4 ml per g di topo B. wt. sono necessari. Sterilizzare il sito di iniezione con un batuffolo imbevuto di alcool e somministrare anestetici attraverso intra-peritoneal (IP) del percorso. Fare attenzione a non iniettare anestetici nei vasi sanguigni o muscolare come questo potrebbe ritardare l'induzione e il recupero dell'animale.
- Applicare lacrima artificiale unguento per entrambi gli occhi del mouse per prevenire l'essiccazione e posizionare l'animale sulla piastra elettrica per prevenire l'ipotermia.
- Preparazione di animali
- Controllare l'animale per il corretto livello anestesia chirurgica utilizzando la risposta pinch punta.
- Una volta che l'animale ha raggiunto il livello chirurgico di anestesia, agganciare i capelli sulla superficie dorsale attorno linea mediana dell'animale utilizzando un trimmer capelli elettrici. Scrub il sito chirurgico con il 70% di etanolo seguita da soluzione betadine tre volte. Coprire il sito con un telo chirurgico sterile fino al passaggio successivo.
- Procedura chirurgica per assottigliare l'osso per esporre il midollo spinale
- Posizionare il mouse in posizione prona sul pad riscaldamento omeotermi sulla piattaforma chirurgica (Figura 1A). Correttamente garantire il mousepostura utilizzando un morsetto muso di mantenere una regione del collo allungato (Figura 1A, B).
- Fare un'incisione (lunghezza di circa 1 cm) con le forbici chirurgiche lungo la linea mediana dorsale, che si estende dalle vertebre toraciche T9 a T12. Spostare la pelle per esporre area chirurgica.
- Usando un bisturi, cancellare con attenzione il muscolo per esporre le spine dorsali a T9 - T12 vertebre. Fermare le emorragie in ogni passo applicando una leggera pressione con un batuffolo di cotone sterile. T10 separato - T12 vertebre dal muscolo circostante e fissarli utilizzando un morsetto vertebrale stabilizzare e impedire qualsiasi movimento (Figura 1A, B).
- Utilizzando un trapano ad alta velocità con l'osso di lucidatura punta, attenzione e delicatezza sottile la superficie dorsale del T10 o T11 vertebra di visualizzare la vena dorsale posteriore e altri piccoli vasi sulla superficie dorsale del SC (Figura 1C).
- Per evitare danni termici a causa del calore generato durante il procedimento diradamento,applicare una leggera corrente e costante di soluzione fisiologica con costante aspirazione per rimuovere i detriti.
- Usando un bisturi liscia accuratamente la superficie ossea fino vaso principale è chiaramente visibile. Fare attenzione a non danneggiare il midollo spinale durante questo processo.
- Una volta che il vaso sanguigno viene visualizzato, somministrare RB alla dose di 30 mg / kg (di peso corporeo) attraverso route seno retro-orbitale utilizzando una siringa da insulina.
- Misurare il flusso sanguigno usando un flussometro Laser Doppler dopo 3 min dopo l'iniezione RB se necessario (Figura 2A, B). Mantenere asepsi durante tutta la procedura.
3. Induzione di PT
- Posto l'animale in una fase regolabile posizione XY per un laboratorio di Jack, che può regolare l'altezza. Regolare la posizione del mouse così regione esposta T11 midollo spinale è direttamente sotto l'obiettivo 10X del microscopio FN1 epi-fluorescenza (Figura 3A).
- Impostare la potenza del lifonte ght a 12% e irradiare la regione T11 con un diametro di 0,75 mm mezzo assottigliata midollo spinale (Nota: questa regione comprende la vena vertebrale posteriore e altri capillari) con una luce verde (lunghezza d'onda di 540-580 nm, che è raggiunto dal cubo filtro microscopio) attraverso l'obiettivo 10X per 2 min. Prendere immagini all'inizio e alla fine di irradiazione (Figura 3B, C) e registrare il tempo dell'esperimento a questo punto.
- Misurare nuovamente il flusso di sangue per 10 minuti, se necessario, posizionando la sonda laser Doppler nella stessa posizione sopra il midollo spinale come in 2.4.8 (Figura 2A, B).
- Dopo il check irradiazione per qualsiasi emorragia e se nessuno trovato procedere alla sutura all'animale. Suturare la fascia superficiale insieme con i muscoli sul entrambi i lati del midollo spinale con una sutura assorbibile o 4-0 dimensioni sutura di seta. Fate attenzione a non danneggiare la SC esposta. Suturare la pelle con 4-0 sutura di seta. Applicare Betadine o iodioai bordi della pelle dopo la sutura.
4. post-chirurgia Cura
- Dopo sutura, posizionare l'animale sulla rampa di riscaldamento per il recupero. Dopo il recupero controllare gli animali per i segni di deficit neurologici osservando il movimento di entrambi gli arti posteriori. Non lasciare l'animale incustodito fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale.
- Trasferire gli animali alla gabbia di casa. Non rispedire l'animale che ha subito un intervento chirurgico per la compagnia di altri animali fino alla completa guarigione.
- Controllare gli animali ad intervalli regolari. In caso di gravi deficit neurologici, fornire cure adeguate, come l'evacuazione di vescica, la somministrazione di analgesici (buprenorfina, 0,05-0,1 mg / kg). Verificare la presenza di disidratazione e amministrare normale per via sottocutanea di soluzione salina in caso grave. Di solito, la buprenorfina (0,1 mg / kg) sarà somministrato dopo la sutura per alleviare il dolore nel sito chirurgico.
- Se gli animali non sono immediatamenteeutanasia dopo l'intervento chirurgico, metteremo alto contenuto di acqua dieta sul pavimento della gabbia, così gli animali possono raggiungere il cibo facilmente.
5. transcardial perfusione, Nissl colorazione e Immunostaining
- Transcardiaca profumato l'animale come descritto in precedenza 17-20.
- Anestetizzare l'animale come descritto in precedenza nel protocollo e transcardially profumato con tampone fosfato salino (PBS, pH 7,4), seguito da ghiacciata 4% paraformaldeide (PFA) in PBS.
- Dopo perfusione, rimuovere il midollo spinale (SC) e post-fissarlo in 4% PFA in PBS a 4 ° CO / N. Trasferire il SC fisso in PBS con il 30% di saccarosio e tenerlo per 2 - 3 giorni fino affonda al fondo della provetta.
- Utilizzando un criostato tagliare il midollo spinale in 30 micron sezioni spesse e metterli in serie su una gelatina rivestita vetrini o in una piastra a 48 pozzetti con 0,01 M PBS.
- Colorazione Nissl: per ispezionare il danno causato dalle PT eseguire un Nissl staining su sezioni del midollo spinale come precedentemente descritto 17-20.
- In breve, raccogliere ogni quinta fetta midollo spinale sui vetrini e macchia con 0,25% violetto cresolo. Prendere immagini delle sezioni colorate (Figura 4).
- Immunocolorazione: Come descritto in precedenza utilizzando un galleggiante metodo della sezione 17,18,20.
- Brevemente, macchiare sezioni midollo spinale incubando O / N a 4 ° C con coniglio anti-glia proteina acidica fibrillare (GFAP) anticorpo policlonale (1: 300), coniglio anti-NeuN anticorpi (1: 300), e anti-rabbit anticorpi Iba1 (1: 500) seguita da asino coniglio anti Alexa 568-coniugato IgG (1: 400) anticorpi secondari per 4 ore a temperatura ambiente. Prendere immagini con un microscopio a fluorescenza (Figura 5).
Risultati
Lo scopo di questo studio è stato quello di produrre ischemia del midollo spinale nei topi utilizzando un modello PT. Dopo la regione desiderata di osso sopra del midollo spinale (T10 - T12) è stato diluito, Rosa Bengala stato iniettato attraverso route seno retro-orbitale, e ischemia è stata indotta dal PT Figura 1A, B mostra il mouse posizionato in una chirurgica misura. piattaforma durante l'intervento chirurgico. Il topo è tenuta in posizione da un morsetto muso e due vertebrato regolabile morsetti per stabilizzare il midollo spinale figura 1C mostra una finestra assottigliata sopra del midollo spinale di T10 -. T12. Il vaso sanguigno principale e le sue filiali possono essere chiaramente visualizzati. Per confermare l'induzione di ischemia, cambiamenti nel flusso di sangue è stata misurata usando un laser Doppler flussometro prima e dopo PT (Figura 2A, B). Per l'analisi, il calo in% del flusso di sangue è stato calcolato utilizzando la linea di base del flusso di sangue prima photothrombosis. Il flusso di sangue è scesa al ~ 20% subito dopo l'illuminazione della luce rispetto with il livello basale prima illuminazione. Figura 3B, C mostra immagini fluorescenti di vasi sanguigni del midollo spinale all'inizio e alla fine di PT. Illuminazione per 2 min indotta coagulo di sangue nei vasi sanguigni (Figura 3C), suggerendo l'induzione di ischemia, coerente con le misure del flussimetro laser Doppler. Per ispezionare il danno causato dalle PT, i topi sono stati sacrificati i 3 giorni dopo è stata eseguita PT e Nissl colorazione. Le immagini scattate in seguito Nissl mostrato regione infarto che può essere chiaramente delimitato dalla regione circostante, indicando danni ai tessuti del midollo spinale e la morte cellulare dopo PT (Figura 4). Immunostaining è stata effettuata per NeuN, GFAP e Iba1. NeuN + neuroni sono stati persi nella materia grigia nel nucleo ischemico (Figura 5A), mentre l'espressione di GFAP è stata aumentata al confine del nucleo ischemico (Figura 5B, vedere anche la regione in scatola). Le microglia Iba1 + esibito un mor globoidephology (es., un corpo cellulare allargata con i processi più brevi e meno, vedere la regione in scatola) insieme a una maggiore espressione Iba1 (Figura 5C). Anche se c'è stata una perdita di tessuto nella regione ischemica nucleo dovuto la sezione colorazione galleggiante, un aumento della GFAP ed espressione Iba1 nell'intera regione peri-infartuale può osservare chiaramente. Questi risultati indicano la morte neuronale e gliosi reattiva nella penombra dopo SC ischemia. D'altra parte, deficit funzionali importanti sono stati osservati nei topi feriti, cioè, disabili movimento arto posteriore un giorno dopo PT, indicando paralisi degli arti posteriori (vedere il film).

Figura 1. PT-indotta modello ischemia in midollo spinale. (A) Le fotografie della piattaforma intervento chirurgico per il midollo spinale PT. Inserto: ingrandita fascette vertebrali.(B) Il mouse è stato tenuto da un morsetto muso e da due fascette vertebrali su misura sul palco. Si noti che l'osso è stato diluito al T10 -. Regione T12 e due fascette metalliche vertebrali sono stati usati per stabilizzare il midollo spinale (C) A zoom in immagine che mostra la regione con l'osso assottigliato sopra del midollo spinale a T10-11 per la induzione di PT. Notate i principali vasi sanguigni e le sue filiali. Cliccate qui per vedere una versione più grande di questa figura.

Figura 2. midollo spinale di misurazione del flusso di sangue. (A) La configurazione della misurazione del flusso di sangue del midollo spinale superficie usando un flussimetro laser Doppler e dispositivo stereotassico per posizionare la sonda. (B)Midollo spinale flusso di sangue prima e dopo PT è stato misurato. In questo esperimento, PT è stata indotta illuminando con una sorgente luminosa per 2 min con una potenza del 12%. Il diametro della superficie irradiata a 0,75 mm ed era nel mezzo del midollo spinale. Il flusso di sangue è stato registrato per un massimo di 5 minuti per ottenere il segnale stabilizzato prima di PT e fino a 10 minuti dopo PT. I dati provenienti da ogni mouse è stato normalizzato al valore prima di illuminazione a luce. Il grafico mostra il valore medio dei dati di 3 topi. La freccia indica l'inizio di PT. Clicca qui per vedere una versione più grande di questa figura.

Figura 3. PT-indotta ischemia del midollo spinale. (A) Fotografia di unMouse posizionato sul microscopio per l'induzione PT nel midollo spinale. La posizione del mouse può essere regolata in tre dimensioni utilizzando la fase XY parapendio e un Laboratorio-Jack. La luce del obiettivo 10X è stata focalizzata sulla superficie del midollo spinale. (BC) immagini fluorescenti dei vasi sanguigni nel midollo spinale prima di (B) e dopo (C) l'illuminazione dopo l'iniezione di rosa Bengala. Si noti il coagulo di sangue dopo 2 minuti di irradiazione (C) (vedi frecce). Cliccate qui per vedere una versione più grande di questa figura.
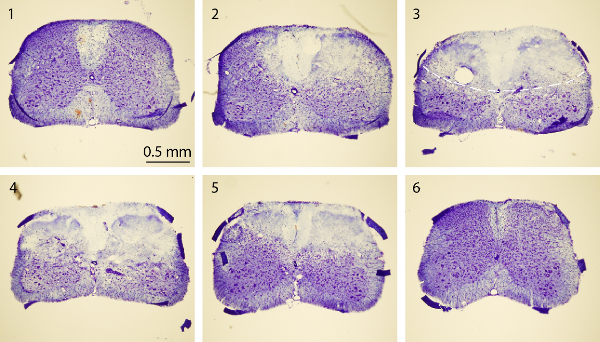
Figura 4. Nissl del midollo spinale. Nissl immagini di colorazione di una serie di sezioni trasversali cordone spinale rostrale-to-caudale che includono normali (sezioni1 e 6) ed epicentro PT-indotta (sezioni 2-5). I topi sono stati sacrificati 3 giorni dopo PT. Ogni sezione del midollo spinale è di 30 micron di spessore. L'intervallo tra due sezioni è di 750 micron. La linea tratteggiata 3 ° immagine in delinea regione infarto. Clicca qui per vedere una versione più grande di questa figura.
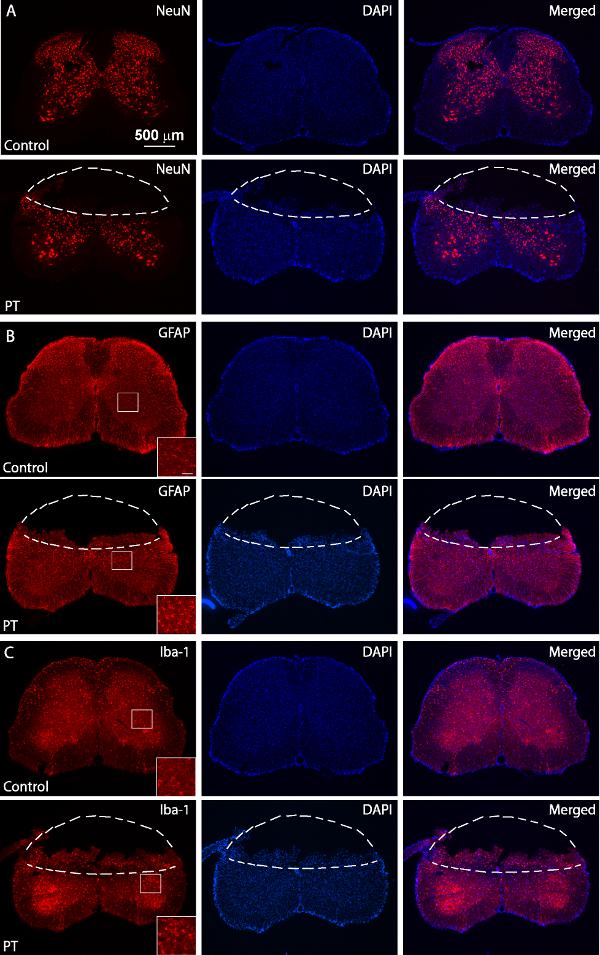
Figura 5. Immunostaining di NeuN, GFAP e Iba1. Immagini fluorescenti di NeuN (A), GFAP (B) e Iba1 (C) colorazione da (pannelli superiori) normale e PT-feriti (pannelli inferiori) sezioni del midollo spinale. Il topo ferito è stato sacrificato 3 giorni dopo il PT. Le linee tratteggiate separano le regioni infarto da tessuti normali. Le regioni in scatola mostrano immagini ad alta risoluzione di GFAP e di espressione Iba1 con una barra di scala di 50micron. Clicca qui per vedere una versione più grande di questa figura.

Movie . PT nel midollo spinale indotta deficit comportamentali. Il film mostra il movimento di un normale e un mouse PT-feriti in una gabbia. Notate il trascinamento di due arti posteriori del mouse con assuefatto midollo spinale, che indica la paralisi di arti posteriori (paraplegia). Il film è stato preso 24 ore dopo PT nel topo ferito.
Discussione
In questo studio, abbiamo descritto un modello photothrombotic di SC ischemia. Grazie ai progressi nel campo dell'ingegneria genetica si è registrato un aumento in commercio topi transgenici che ha reso possibile lo studio l'impatto di specifici geni coinvolti nella patofisiologia ischemico nel SC. Lo scopo dello studio è stato quello di sviluppare un modello riproducibile murino di ischemia del midollo spinale. Qui abbiamo adattato un modello corticale PT per indurre SCI nei topi. Dopo l'intervento chirurgico la vena vertebrale posteriore e capillari sulla parte dorsale di topi a livello di T11 vertebra toracica sono stati esposti. Poi RB, un colorante fotoattivo disponibile in commercio, è stato iniettato attraverso route seno retro-orbitale per ottenere la distribuzione desiderata vascolare. Il vaso sanguigno esposto è stato poi irradiato da una luce verde per indurre la formazione di trombi e successivamente un infarto. I nostri risultati da istologici e immunostaining metodi hanno dimostrato che PT ha indotto un infarto nel midollo spinale e riattive gliosi nella regione peri-infartuale. Sono stati inoltre osservati deficit neurologici come la paralisi degli arti posteriori. Questi dati suggeriscono che la PT è un modello adatto per studiare fisiopatologia e meccanismi di morte cellulare dopo SCI. Il passaggio critico nel protocollo è l'uso di un trapano ad alta velocità per sottile superficie di vertebra per la visualizzazione dei vasi sanguigni sulla superficie dorsale del SC. Questa operazione deve essere accuratamente eseguita come applicazione di una pressione eccessiva potrebbe causare il trapano per entrare cavità spinale e danneggiare la SC. D'altra parte, l'assottigliamento non uniforme potrebbe comportare un'illuminazione impropria e può produrre infarti irregolari. Per risolvere questo problema, l'ispezione frequente della superficie dell'osso al microscopio dopo ogni breve fase di foratura è consigliato per valutare lo spessore dell'osso e di valutare ulteriormente l'uso del trapano. Si consiglia l'uso di soluzione salina sterile per dilavamento i detriti e per la migliore visualizzazione della superficie esposta. Mantenere consasepsi tant durante tutta la procedura chirurgica, la cura adeguata post-chirurgica degli animali può migliorare la sopravvivenza degli animali e aumentare il tasso di successo degli esperimenti.
Il nostro attuale modello di PT non richiede l'acquisto di eventuali strumenti costosi, come qualsiasi laboratorio che è dotato di un microscopio a epifluorescenza con una sorgente di luce (quali la lampada a mercurio, lampada a ioduri metallici, o laser di 488 nm di lunghezza d'onda) può eseguire questa procedura. Inoltre, questa tecnica consente di controllare le dimensioni dell'infarto regolando la dimensione dell'apertura rispetto ad altri modelli di ischemia SC come occlusione combinata di aortica, succlavia sinistra e arteria mammaria interna 25 e modificato croce aortico metodo di bloccaggio 26 che sono complicate e sono estremamente invasiva. Nel nostro modello un trapano ad alta velocità per sottile superficie dorsale della vertebra per la visualizzazione è stata scelta come alternativa alla laminectomia, metodo di scelta per molti laboratori per indurre SCI.Laminectomy comporta il taglio delle vertebre che può causare emorragia eccessiva a causa recisione dei vasi sanguigni vertebrali e questo potrebbe oscurare il campo per l'imaging. Anche se alcuni protocolli consigliano l'uso di tamponi di cotone per cancellare il sanguinamento eccessivo durante laminectomia può causare compressione che può causare ulteriori danni al comitato di vigilanza. Inoltre la superficie esposta del midollo spinale può venire in contatto diretto con il sangue ed i suoi componenti nonché bordi taglienti delle ossa tagliate che possono aggiungere variabilità inutile l'esperimento. Utilizzando il modello PT corrente, infarto con dimensioni e profondità differente può essere generato da semplice manipolazione della intensità della sorgente luminosa, durata dell'esposizione e l'area della superficie esposta. Sebbene lo studio corrente generata ischemia sulla regione centrale del T11 nel SC, questo metodo può anche generare infarti a diverse posizioni lungo rostrale-to-caudale e direzione laterale del midollo spinale, che migHT beneficiare comprendere l'effetto specifico regione di ischemia sulla paraplegia. D'altra parte, anche se l'illuminazione è sulla superficie del midollo spinale, la luce potrebbe penetrare certa profondità nel tessuto e la lesione può anche essere indotta nella materia grigia. Come Rosa Bengala è distribuito in tutto il sistema di circolazione, se le specie animali sono uguali, e l'età e il peso sono simili, ci aspettiamo lesione coerente sarà generato come ischemia corticale indotta da PT.
L'altro grande vantaggio di ischemia PT-indotta è molto bassa mortalità degli animali. Bassa mortalità significa studi di sopravvivenza a lungo termine possono essere effettuate che potrebbero essere utili a svelare nel tempo gli effetti di danno ischemico sulla sopravvivenza e la funzionalità motoria recupero. Questo modello può anche aiutare a comprendere i meccanismi di riparazione cellulari che di solito si verificano in ritardo nella fase cronica di lesioni 14,19,27-29. Questo modello produce anche notevoli carenze funzionali del motore che può Be utilizzato per valutare l'efficacia degli agenti neuroprotettivi sul recupero funzionale. Inoltre, questo modello permetterà anche lo studio delle alterazioni patologiche dopo SCI come la degenerazione assonale e rigenerazione, neuronale e astrociti Ca 2 + Segnalazione e sovraccarico in topi vivi usando la microscopia a due fotoni.
Come tutti gli altri modelli SCI, PT non è privo di inconvenienti. Gli svantaggi di questa tecnica sono simili a quelli osservati in PT corticale. Alcune delle carenze includono mancanza di una penombra ischemica anatomicamente chiaro, che è l'obiettivo di molti farmaci neuroprotettivi, e l'assenza di riperfusione. È ben noto che la riperfusione a seguito di ischemia è caratterizzata da cambiamenti come aumentata produzione di specie reattive dell'ossigeno, infiltrazione di cellule infiammatorie e aumentata produzione di citochine 30-32. La mancanza di riperfusione in PT indica i cambiamenti associati con il danno da riperfusione in SC resteranno difficile studiare con questo modello.Tuttavia, i vantaggi di utilizzare ischemia PT indotte superiori agli svantaggi e questa tecnica fornisce i ricercatori con un facile da eseguire e modello altamente riproducibile di generare SCI nei topi.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health [di Grant no. R01NS069726] e l'American Heart Association Grant nel concedere aiuti [Concessione n. 13GRNT17020004] per SD.
Materiali
| Name | Company | Catalog Number | Comments |
| Rose Bengal | Sigma-Aldrich | 330000 | 20 mg/ml in sterile saline |
| C57BL/6J | Jackson lab | 664 | 22 - 25 g |
| Ketamine | VEDCO | NDC-50989-996-06 | 100 mg/ml |
| Xylazine | VEDCO | NDC-50989-234-11 | 100 mg/ml |
| Betadine solution | Purdue | NDC-67618-150-01 | 10% povidone iodine topical solution |
| Normal saline | Abott Laboratories | 04930-04-10 | For diluting RB, anaesthesia and for preventing tissue from drying |
| Artificial tears ointment | Rugby | NDC-0536-6550-91 | 83% white petrolatum |
| Ethanol | Decon labs.Inc | 2716 | 70% ethanol for disinfection |
| Metal halide lamp | EXFO, Canada | X-Cite 120 PC | Set power at 12% |
| Spring scissors | Fine Science Tool | 15000-10 | for minor dissection |
| Scissors (angled to side) | Fine Science Tool | 14063-011 | No. 3 handle |
| Standard scalpel | Fine Science Tool | 10003-12 | for removing muscle |
| Scalpel blade | Feather | 2976 | No. 10 |
| Forceps (curved) | Fine Science Tool | 11150-10 | for holding tissue |
| Forceps (straight) | Fine Science Tool | 11151-10 | for holding tissue |
| Needle holder | Fine Science Tool | 12002-12 | for suturing |
| Tissue adhesive glue | 3M Vetbond | 1469SB | to adhere to edges of the cut skin |
| Monofilament polypropylene | USSC Sutures | VP-521 | Size = 4-0 (for fascia) |
| Perma-hand silk | Ethicon | 683G | Size = 4-0 (for skin) |
| Micro drill | Roboz Surgical Instrument Co. Inc. | RS-6300 | with bone polishing drill bit |
| Laser doppler flowmeter | Moor Instruments | moorVMS-LDF1 | for monitoring change in blood flow |
| Heating pad | Fine Science Tool | 21052-00 | to prevent hypothermia |
| Lab-Jack | Fisher scientific | 14-673-50 | 4 x 4 in plate to adjust the height of the animal |
| X-Y gliding stage | Amscope | GT100 | for positioning the animal under microscope |
Riferimenti
- Cadotte, D. W., Fehlings, M. G. Spinal cord injury: a systematic review of current treatment options. Clin Orthop Relat Res. 469 (3), 732-741 (2011).
- Cheriyan, T., et al. Spinal cord injury models: a review. Spinal Cord. 52 (8), 588-595 (2014).
- Young, W. Secondary injury mechanisms in acute spinal cord injury. J Emerg Med. 11, Suppl 1. 13-22 (1993).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Soubeyrand, M., et al. Effect of norepinephrine on spinal cord blood flow and parenchymal hemorrhage size in acute-phase experimental spinal cord injury. Eur Spine J. 23 (3), 658-665 (2014).
- Soubeyrand, M., et al. Real-time and spatial quantification using contrast-enhanced ultrasonography of spinal cord perfusion during experimental spinal cord injury. Spine (Phila Pa 1976). 37 (22), E1376-E1382 (2012).
- Mautes, A. E., Weinzierl, M. R., Donovan, F., Noble, L. J. Vascular events after spinal cord injury: contribution to secondary pathogenesis). Phys Ther. 80 (7), 673-687 (2000).
- Liu, X. Z., et al. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci. 17 (14), 5395-5406 (1997).
- Liu, L., et al. An experimental study of cell apoptosis and correlative gene expression after tractive spinal cord injury in rats. Zhonghua Wai Ke Za Zhi. 42 (23), 1434-1437 (2004).
- Hirose, K., et al. Activated protein C reduces the ischemia/reperfusion-induced spinal cord injury in rats by inhibiting neutrophil activation. Ann Surg. 232 (2), 272-280 (2000).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guerit, J. M., Dion, R. A. State-of-the-art of neuromonitoring for prevention of immediate and delayed paraplegia in thoracic and thoracoabdominal aorta surgery). Ann Thorac Surg. 74 (5), S1867-S1869 (2002).
- Schepens, M. A., Heijmen, R. H., Ranschaert, W., Sonker, U., Morshuis, W. J. Thoracoabdominal aortic aneurysm repair: results of conventional open surgery. Eur J Vasc Endovasc Surg. 37 (6), 640-645 (2009).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Exp Transl Stroke Med. 1, 8(2009).
- Carmichael, S. T. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dietrich, W. D., Ginsberg, M. D., Busto, R., Watson, B. D. Photochemically induced cortical infarction in the rat. 1. Time course of hemodynamic consequences. J Cereb Blood Flow Metab. 6 (2), 184-194 (1986).
- Zhang, W., et al. Neuronal protective role of PBEF in a mouse model of cerebral ischemia. J Cereb Blood Flow Metab. 30 (12), 1962-1971 (2010).
- Li, H., Zhang, N., Sun, G., Ding, S. Inhibition of the group I mGluRs reduces acute brain damage and improves long-term histological outcomes after photothrombosis-induced ischaemia. ASN Neuro. 5 (3), 195-207 (2013).
- Li, H., et al. Histological, cellular and behavioral assessments of stroke outcomes after photothrombosis-induced ischemia in adult mice. BMC Neurosci. 15, 58(2014).
- Wang, T., Cui, W., Xie, Y., Zhang, W., Ding, S. Controlling the Volume of the Focal Cerebral Ischemic Lesion through Photothrombosis. American Journal of Biomedical Sciences. 2 (1), 33-42 (2010).
- Schroeter, M., Jander, S., Stoll, G. Non-invasive induction of focal cerebral ischemia in mice by photothrombosis of cortical microvessels: characterization of inflammatory responses. J Neurosci Methods. 117 (1), 43-49 (2002).
- Boquillon, M., Boquillon, J. P., Bralet, J. Photochemically induced, graded cerebral infarction in the mouse by laser irradiation evolution of brain edema. J Pharmacol Toxicol Methods. 27 (1), 1-6 (1992).
- Kim, G. W., Lewen, A., Copin, J., Watson, B. D., Chan, P. H. The cytosolic antioxidant, copper/zinc superoxide dismutase, attenuates blood-brain barrier disruption and oxidative cellular injury after photothrombotic cortical ischemia in mice. Neuroscience. 105 (4), 1007-1018 (2001).
- Schmidt, A., et al. Photochemically induced ischemic stroke in rats. Exp Transl Stroke Med. 4 (1), 13(2012).
- Lang-Lazdunski, L., et al. Spinal cord ischemia. Development of a model in the mouse. Stroke. 31 (1), 208-213 (2000).
- Wang, Z., et al. Development of a simplified spinal cord ischemia model in mice. J Neurosci Methods. 189 (2), 246-251 (2010).
- Labat-gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. J Vis Exp. (76), (2013).
- Lu, H., et al. Induction and imaging of photothrombotic stroke in conscious and freely moving rats. J Biomed Opt. 19 (9), 96013(2014).
- Seto, A., et al. Induction of ischemic stroke in awake freely moving mice reveals that isoflurane anesthesia can mask the benefits of a neuroprotection therapy. Front Neuroenergetics. 6 (1), (2014).
- Bell, M. T., et al. Toll-like receptor 4-dependent microglial activation mediates spinal cord ischemia-reperfusion injury. Circulation. 128 (11 Suppl 1), S152-S156 (2013).
- Smith, P. D., et al. The evolution of chemokine release supports a bimodal mechanism of spinal cord ischemia and reperfusion injury. Circulation. 126 (11 Suppl 1), S110-S117 (2012).
- Jia, Z., et al. Oxidative stress in spinal cord injury and antioxidant-based intervention. Spinal Cord. 50 (4), 264-274 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon