Method Article
Флуоресценции основе удлинения праймера методики определения транскрипционных отправных точках и сайты расщепления РНКаз
В этой статье
Резюме
We here describe a fluorescence based primer extension method to determine transcriptional starting points from bacterial transcripts and RNA processing in vivo using an automated gel sequencer.
Аннотация
Флуоресценции основе удлинения праймера (ФПО) представляет собой молекулярный метод для определения транскрипционных отправные точки или обработки участки молекул РНК. Это достигается с помощью обратной транскрипции РНК интереса с использованием специфических флуоресцентно меченных праймеров и последующий анализ полученных фрагментов кДНК посредством денатурации электрофореза в полиакриламидном геле. Одновременно, традиционный реакции секвенирования Сэнгер запускается на гель для отображения концы фрагментов кДНК с их точными соответствующих баз. В отличие от 5'-RACE (быстрой амплификации концов кДНК), где продукт должен быть клонированной и несколько кандидатов секвенированной, основная часть фрагментов кДНК, порожденных удлинения праймера можно одновременно обнаружить в одной гелевой перспективе. Кроме того, вся процедура (с обратной транскрипцией до конечного анализа результатов) может быть завершена в течение одного рабочего дня. При использовании флуоресцентно меченных праймеров, использование опасных помечены радиоактивным изотопом реагентовможно избежать, и время обработки уменьшается, как продукты могут быть обнаружены во время процедуры электрофореза.
В следующем протоколе, мы опишем люминесцентные праймера метод расширения в естественных условиях, чтобы надежно и быстро обнаружить 5 'концы РНК вывести транскрипции отправные точки и участки для обработки РНК (например, с помощью системных компонентов токсина-антитоксина) в S. стафилококк, Е. палочка и другие бактерии.
Введение
Удлинение праймера 1 представляет собой молекулярный метод для определения 5 'концы конкретных молекул РНК до одной базовой разрешением. Преимущество с другими методами, такими как 5'-RACE (быстрой амплификации концов кДНК) является быстро время обработки и способность легко анализировать смесь различных длин молекул РНК.
Этот метод работает, подвергая молекулы РНК с обратной реакций транскрипции с использованием специфических флуоресцентных праймеров, генерации кДНК фрагменты определенной длины. Эти молекулы кДНК работать параллельно с традиционными Сэнгер секвенирования реакций 2 на денатурирующих полиакриламидных гелей и могут быть обнаружены по их флуоресценции из-за использования флуоресцентно меченных праймеров. Длины фрагментов кДНК затем оценивали по сравнению с секвенирования лестницы, позволяя отображение на концах "5 РНК.
Традиционно праймеров реакции расширения используются в сочетаниис радиоактивными изотопами для обнаружения молекул кДНК на рентгеновских пленок. В связи с опасностями для здоровья, вопросы утилизации отходов и легкостью обработки, новые протоколы используют флуоресценцию для обнаружения удлинения праймера с автоматизированных секвенсоров, хотя их чувствительность несколько ниже. Использование флуоресцентно меченных праймеров, повторяющиеся процедуры радио-маркировка может быть опущен, как люминесцентные грунтовки устойчивы в течение длительного времени (более года в наших руках).
Способ описан здесь использует автоматизированную гель секвенсор, но с небольшими изменениями, капиллярные секвенсеры может быть также использован для разделения и обнаружения кДНК 3. Параллельный характер анализа гель дает возможность обнаружить даже небольшое количество расщепления РНК или обработки. Еще одним преимуществом является высокое разрешение этого метода, как терминал расщепления или обработки даже одной базе могут быть обнаружены.
В связи с обнаружением расщепления РНК или обработки, тypically два различных типа расширений праймеров различают. В одном случае, ферментативная обработка выполняется в пробирке с использованием очищенного РНК и очищенного фермента, в то время как в другом случае, обработка выполняется в естественных условиях, и полученную РНК очищали. В обоих случаях РНК подвергают удлинение праймера проводят в пробирке, однако, в зависимости от источника РНК, либо метод называют в пробирке или в удлинение праймера в естественных условиях. В протоколе приведем здесь, мы сосредоточены только на естественных удлинения праймера в, из-за легкости использования (не очищенных белков необходимо) и возможностью определения транскрипционные отправные точки и обработку, в то же время. Тем не менее, в пробирке расширения праймеров, в принципе, созданной тем же способом и этот протокол может служить в качестве отправной точки.
Способ, показанный здесь, могут быть применены к многих видов бактерий тех пор, пока они поддаются высокойподготовка нуклеиновых кислот чистота и высокодоходным.
Исследования в нашей лаборатории сосредоточена на нормативно рамки токсин-антитоксин (таблица) систем 4,5, поля в которой метод удлинения праймера широко используется. TA-системы представляют собой небольшие генетические элементы, присутствующие в прокариотических геномов, которые состоят из стабильного и активного эндогенно токсичного белка и в основном нестабильной белка или РНК антитоксина, что противодействует токсичности 6,7. Токсин активность иногда оказывает ингибирование репликации, синтеза клеточной стенки или других механизмов, но чаще всего по активности РНКазы 8,9. Как правило, РНКазы специфика определяется путем проведения различных тестов, одним из которых является метод удлинения праймера. Грунтовка реакции удлинительные хорошо подходят для такого применения, как смесь расщепленных фрагментов и полных длины могут быть одновременно анализируют, чтобы определить их 5'-концах. Используя сочетание в пробирке и в естественных расширений праймеров,конкретных токсин РНКазы декольте, например, последовательность специфичность может быть определена 10-13.
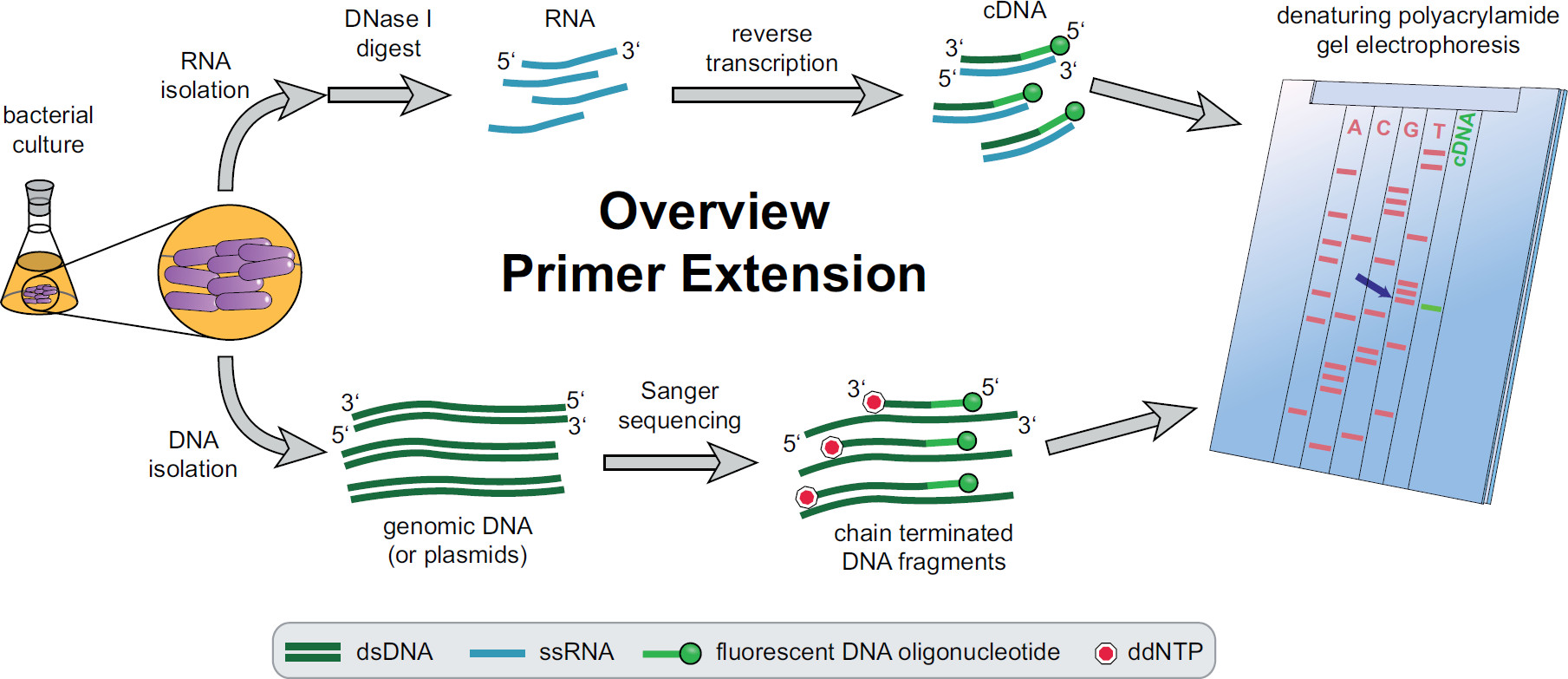
Рисунок 1. Обзор процедуры удлинения праймера. Бактериальные культуры инкубируют и лечение в соответствии с экспериментальными потребностей. Общую РНК экстрагировали из клеток, обработанных ДНКазы I, чтобы удалить следы ДНК и подвергали реакции обратной транскрипции с использованием конкретных целевых флуоресцентных праймеров ДНК, дающие кДНК. Геномную ДНК или плазмиды, извлекаются и впоследствии используется для люминесцентных Сангер секвенирования реакций для сравнения с размером фрагментов кДНК. Продуктов удлинени праймера которые проходят вдоль Сэнгер секвенирования продуктов на денатурирующем полиакриламидном геле мочевины и анализировали с автоматизированной лазерной и микроскопом. Секвенирование база, что линии с полосой кДНК является лаул основание 5'-конца кДНК (синей стрелкой). Более подробная информация в Фекете, и др. 3 Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обзор всей процедуры удлинения праймера можно найти на рисунке 1. Коротко, бактериальные клетки культивируют, собирают, клеточный осадок лизируют и РНК экстрагируют. Очищенная РНК затем обрабатывали ДНКазой I, чтобы удалить следы молекул ДНК, которые могли бы действовать в качестве матриц для обратной транскриптазы. Конкретные флуоресцентные праймеры будут добавлены в РНК, гибридизации в области, представляющей интерес, а затем обратной транскрипции, в результате чего одноцепочечной комплементарной ДНК (кДНК). Секвенирование лестница создается традиционной Sanger секвенирования с использованием флуоресцентных праймеров и разделены на денатурирующего полиакриламидного геля наряду из праймеров фрагментов кДНК расширение. ПолученнуюГель анализируется путем сравнения флуоресцентные полосы, что позволяет идентифицировать 5 'концах интерес. Транскрипции отправные точки и участки обработки Затем оценивается индивидуально по сравнения последовательностей.
протокол
1. High Yield Получение РНК
- Выделение РНК
Примечание: Высокие концентрации суммарной РНК необходимы для реакции удлинения праймера. Наборы столбцов Спин как правило, не дают количество РНК, необходимой (~ 5 - 16 мкг в 5 мкл объем). Поэтому очистка с использованием метода экстракции фенол-тиоцианат-хлороформ кислоты гуанидина рекомендуется, изложены ниже.
ПРИМЕЧАНИЕ: Фенол является канцерогенным, токсичные и коррозионные. Пожалуйста, ознакомьтесь с паспортом безопасности материала и использовать под вытяжкой с соответствующей защитой!- Растут или лечения бактериальных клеток (золотистого стафилококка или кишечной палочки в данном примере), а желательно, и урожай на 10 мин центрифугирования при 4600 × г и 4 ° С. Примечание: Обычно мы собрать полную OD 600 20 - 70. Клеточные осадки могут быть сохранены в течение нескольких недель при температуре -20 ° С.
- Ресуспендируйте осадок клеток в 1 мл кислоты гуанидиния решения тиоцианат-фенол-хлороформ и передать2 мл винт чашку, содержащую 0,5 мл 0,1 мм стекло циркония / оксида кремния бисера.
- Лизиса клеток три раза быстро подготовительной / шарик с насадкой в 6,5 м / с в течение 30 сек в течение трех раундов, охлаждая образцы на льду в течение 5 мин после каждого запуска. Примечание: гомогенизированная образец можно хранить при -80 ° C в течение нескольких недель.
- Инкубируйте лизат в течение 5 мин при комнатной температуре, а затем добавить 200 мкл хлороформа.
- Энергично встряхните или вихрь образец в течение 30 сек, чтобы извлечь РНК.
- Инкубируют при комнатной температуре в течение 3 мин, затем центрифугировать в течение 15 мин при 13000 - 15000 х г и 4 ° С. Примечание: Растворители разделяются на более низкой органической фазы (розовый, содержит белки), межфазного (белый, содержит ДНК) и верхнюю водную фазу (ясно, содержит РНК).
ПРИМЕЧАНИЕ: С этого шага на использовании только РНКазы бесплатно реактивы и пластиковая посуда! - Подготовьте свежий РНКазы 1,5 мл реакционных труб, этикетку, можно добавлять около 500 мкл 100% РНКазы свободной изопропанола каждого (использовать примерно такую же VOЛуме в качестве водной фазы в предыдущем трубки).
- Удерживая трубку под углом и передавать водной фазы (около 500 мкл) на подготовленную труб с использованием РНКазы свободные концы. Не беспокоить межфазной.
- Осадок РНК путем инвертирования несколько раз и инкубации в течение 10 мин при комнатной температуре.
- Центрифуга образцы в течение 15 мин при 13 000 - 15 000 × г и 4 ° С и удалить супернатант с помощью пипетки или аспирации (водоструйного насоса, и искусственное вскармливание). Не беспокоить белую прозрачную РНК гранул в нижней части.
- Добавить 1 мл 70-80% РНКазы свободной этанола (не вихря), чтобы вымыть. Примечание: РНК в этаноле могут быть сохранены в течение нескольких недель при температуре -20 ° С.
- Центрифуга течение 5 мин при 7500 х г и 4 ° С и отбросить супернатант с помощью пипетки или предпочтительно аспирации.
- Воздух сухой осадок РНК в течение 15 - 30 мин под вытяжным шкафом. Не пересушивать, иначе гранулы могут быть трудно растворяться.
- Ресуспендируют гранул в 50 мкл РНКазы свободной DDh 2 O или буфера хранения РНК.
- Измерьте концентрацию РНК с микрообъема UV-VIS спектрофотометр или кварцевую кювету (и обычного фотометр) и перейти к ДНКазы I пищеварения.
- ДНКазы I переваривание РНК, чтобы удалить следы ДНК
Примечание: Так как ДНК может выступать в качестве ложного шаблона в обратной транскрипции (удлинение праймера) реакции, он должен быть удален из образца. Известны различные способы удаления ДНК из РНК решений, которые доступны, как правило, зависят от ДНКазы пищеварения. Простой, но эффективный и экономичный метод для удаления ДНК приводится ниже.- Разогреть на водяной бане до 37 ° С.
- Смешайте соединений, приведенных в таблице 1, в 1,5 мл реакционной трубки.
- Выдержите смесь в течение 1 ч при 37 ° С на водяной бане, а затем перейти непосредственно к экстракции фенолом / хлороформом. Примечание: Тепло инактивация ДНКазы I не рекомендуется, поскольку это может ухудшить РНК.
- Экстракцию фенолом / хлороформом РНК после ДНКазы I пищеварения
Примечание: РНК должны быть очищены для удаления свободных нуклеотидов ДНК-фрагменты и буферных компонентов от ДНКазы I пищеварения. Экстракцию фенолом / хлороформом дает возможность высокой степени извлечения и концентрации образца РНК и, следовательно, описаны ниже. Другие методы очистки РНК также могут быть использованы, если они удовлетворяют этим требованиям.- Сплит 500 мкл ДНКазы I пищеварение смешать в двух 250 мкл образцов в 2 мл реакционных труб.
- Добавить 1 объем (250 мкл) из кислой P / C / I раствора (в водонасыщенного фенола, хлороформа и изопентаноле, соотношение 25: 24: 1, рН 4,5 - 5).
ПРИМЕЧАНИЕ: P решение / C / I является канцерогенным, токсичные и коррозионные. Пожалуйста, ознакомьтесь с паспортом безопасности материала и использовать под вытяжкой с соответствующей защитой! - Энергично вихрь или место в встряхиванием платформы для 1 - 3 мин.
- Центрифуга течение 30 мин при 13000 - 15000 × г и 4 ° С.
- Соберите верхний (водный) фазу и передать чистую пробирку (250 мкл).
- Добавить 1/9 объема (28 мкл) 3 м ацетата натрия рН 5,2.
- Добавить 2,5-3 объемов чистого этанола (700 мкл).
- Смешайте встряхиванием в ближайшее время и место, при -80 ° С в течение 30 мин или при температуре -20 ° С в течение 2 - 3 ч. Если необходимо, хранить РНК O / N при -20 ° С.
- Центрифуга в течение 30 - 60 мин при 13000 - 15000 × г и 4 ° С.
- Удалить супернатант с помощью пипетки или аспирации.
- Промыть осадок путем добавления 1 мл 70% -ного этанола на гранулу. Не вихрь образец.
- Центрифуга образца в течение 5 мин при 13000 - 15000 х г и 4 ° С.
- Удалить супернатант с помощью пипетки или аспирации.
- Воздух сухой осадок под вытяжным шкафом. Храните гранулы при температуре -20 ° CO / N, если необходимо.
- Растворить осадок в 30 мкл обработанной DEPC H 2 O при интенсивном перемешивании в течение 2 мин и использовать это решение, чтобы растворить PELLET соответствующей второй трубы на образец (30 мкл раствора в расчете на одну пару экстракции).
- Измерьте концентрацию РНК, и убедиться, что он превышает 1 мкг / мкл для использования в праймера продлении среднем выраженных мРНК.
- Если необходимо, хранить РНК при -20 ° C в течение нескольких недель до нескольких месяцев.
2. Грунтовка Расширение Реакция
- Грунтовка дизайн
ПРИМЕЧАНИЕ: При проектировании праймеров для расширения эксперимента грунтовки, подчиняются общие руководящие принципы ПЦР дизайна праймеров (см инструкцию на автоматизированную гель секвенсор для получения дополнительной информации и обсуждения раздела в этой статье).- В частности, гарантировать, что праймеры (I) не содержат пробегов оснований, (II) обладают G или С на 3'-конце, (III) имеют сбалансированный GC: AT соотношении, (IV) имеют температуре отжига примерно 55 - 60 ° С, и (v) связывают, по меньшей мере 50 пар оснований, более 100 пар оснований ниже по потоку от области, представляющей интерес, чтобы получить четкое изображение.
- Грунтовка реакция расширение
Примечание: реакции удлинения праймера (синтез кДНК) требуется большое количество матричной РНК. Если суммы РНК материалы выбираются с низким, сигнал может быть слишком низкой для обнаружения! Поэтому мы рекомендуем очистку РНК, как описано выше.
ПРИМЕЧАНИЕ: ВНИМАНИЕ: Использование РНКазы реагентов и пластиковую посуду !!!- Разогреть термо-циклер до температуры 95 ° С и выполнять все дальнейшие шаги инкубации в термо-циклере для простоты использования и воспроизводимости.
- Смешайте соединений из таблицы 2 в ПЦР-пробирку для каждого образца РНК.
- Денатурации образцов в течение 1 мин при 95 ° С.
- Место труб на льду и холод в течение 5 мин для гибридизации РНК и праймеров.
- Установите машину ПЦР до 47 ° С.
- В то же время подготовить обратную транскрипцию мастер-смеси, как описано в таблице 3.
- Добавить 4 мкл обратной транскрипции мастер микс для каждого гибридного РНКобразец.
- Инкубировать пробирки в течение 1 часа при 47 ° С. Примечание: Оптимальная температура для AMV RT 42 ° С, однако более высокие температуры помогают преодолеть вторичные структуры молекул РНК.
- Остановка реакции при нагревании образцов до 95 ° С в течение 2 мин.
ПРИМЕЧАНИЕ: Формамид вызывает коррозию, токсичны и могут быть вредны для неродившегося ребенка. Пожалуйста, ознакомьтесь с паспортом безопасности материала, обращаться с осторожностью и носить соответствующую защиту! - Добавить 6 мкл формамида загрузки красителя (95% (об / об) деионизированной формамида, 10 мМ ЭДТА, 0,05% (вес / объем) бромфенола синего) и хранилище для O / N до двух недель при -20 ° С в темноте.
3. Подготовка секвенирования Лествичник
ПРИМЕЧАНИЕ: реакции секвенирования лестница требует либо умеренное количество плазмид или больших количеств геномной ДНК. Всякий раз, когда это возможно, использование плазмид в реакции последовательности рекомендуется из-за простоты изоляции и высокой сигнал интенсивность. В других случаях, мы обычно используют метод, принятый от Marmur 5,14 подготовить геномной ДНК из E. палочка и С. стафилококк клетки без необходимости использовать фенол. В принципе любой способ, который дает высокое количество и чистоту геномной ДНК может быть использована.
- Геномная Выделение ДНК
- Вырастить 10 мл E. палочка или С. стафилококк клетки O / N в LB, BM 5 или TSB среды.
- Урожай клетки центрифугированием в течение 10 мин при 4600 х г в 15 мл трубки сокола.
- Осадок ресуспендировали в 2 мл буфера Р1, как обнаружено в некоторых мини комплектов подготовки (50 мМ Трис-HCl, рН 8,0, 10 мМ ЭДТА, 100 мкг / мл РНКазы).
- Лизировать клетки для 45 - 60 мин с 20 - 40 мкл лизостафина (0,5 мг / мл, хранение при -20 ° С). Примечание: Для Е. палочки клетки ферментативная предварительная обработка может быть либо опущены или лизоцим, используемые.
- Добавить 100 мкл насыщенного SDS-решения (в 45% этанола) в суспензию и incubatе течение 5 мин при 37 ° С.
- Добавить 650 мкл 5 М NaClO 4 и кратко вихревые клетки.
Примечание: Хлороформ является потенциальным канцерогеном. Пожалуйста, ознакомьтесь с паспортом безопасности материала и использовать под вытяжкой с соответствующей защитой !!! - Добавить 3 мл хлороформа / изопентаноле (24: 1 отношение) к смеси и встряхивают в течение по крайней мере 60 сек. Примечание: Жидкость должна превратиться в однородную белой эмульсии.
- Центрифуга образца в течение 10 мин при 4600 × г и РТ на отдельные фазы.
- Тщательно передачи четкую верхнюю (водный) фазы в новую пробирку. Если раствор мутный, повторить экстракцию хлороформом / изопентаноле. Измеряют объем раствора ДНК и подготовить новую пробирку с 2 объемами этанола (100%).
- Медленно перелить или пипетки раствора ДНК в этаноле, содержащем трубку. Примечание: ДНК должны выпадать в осадок в виде прозрачных, плотные рулоны на дне или при полностью обезвожен в качестве плавучего белого кластера.
- Получить DNA помощью крюков, изготовленных из стекла пипетки Пастера (рис.2) и мыть каждый образец дважды путем погружения в индивидуальной трубки 1 мл 70% -ного этанола.
- Поместите крючки в вертикальном положении в стойке и воздух сухой осадок в течение 60 мин. Если необходимо, хранить высушенный ДНК в течение нескольких дней при комнатной температуре.
- Растворите ДНК путем разрыва ДНК покрыта стеклянные крючки и размещение в 2,0 мл реакционной трубке, содержащей 100 - 500 мкл DDH 2 O. Настройка громкости до конечной концентрации ДНК 1000 - 1500 нг / мкл. С одной реакции секвенирования, используют 10 - 18 мкг геномной ДНК.

Рисунок 2. Инструкция о том, как создать рыбалка ДНК стержень. Удерживая кончик стеклянной пипетки Пастера в пламени горелки Бунзена. Это приводит к тому, стакан, чтобы начать плавления после нескольких секунд, создавая небольшой крюк в тон закончится. Быстро снять с огня и дать остыть в течение 1 мин.
- Плазмиды Изоляция
- Подготовка плазмиды с использованием стандартных наборов мини подготовки и растворить в элюирующего буфера (10 мМ Трис-Cl, рН 8,5). В зависимости от размера плазмиды, используют 100 - 500 нг плазмиды в течение одного секвенирования лестнице.
- Реакция Зангер Секвенирование
Примечание: Найти ниже простой протокол, который использует флуоресцентно меченный праймер для секвенирования с комплектом 7-деаза-дГТФ, который хорошо работает с целью расширения праймеров. Обратитесь к комплект руководстве секвенирования для получения подробной информации. Пожалуйста, обратите внимание, что реакции секвенирования должны использовать один и тот же праймер в качестве праймера реакции удлинения для создания изделий одинаковой длины.- Смешать 12 мкл геномной ДНК (~ 10 - 15 мкг) с 1 мкл ДМСО и 1 мкл флуоресцентно меченого праймера (2 пмоль / мкл).
- Для каждого 1 мкл четырех реакции секвенирования смесей (А, С, G или Т), добавить 3 мкл ДНК / ДМСО / Primer смеси.
- Поместите образцы в машину ПЦР, и выполните следующую программу ПЦР: 95 ° C в течение 2 мин; 35 циклов 95 ° С в течение 20 сек, 54 ° C в течение 20 сек, 70 ° С в течение 30 сек; держать при температуре 4 ° C навсегда.
- После запуска, удалите образцы из машины, добавить 6 мкл красителем и магазина на льду (на короткий срок) или при температуре -20 ° С в течение нескольких дней до нескольких недель.
4. Гель установки и устройство Run
Примечание: Подробная информация о том, как аппарат секвенирования гель собран, гель подготовили и как гель запуска можно найти в протоколе производителя.
- Препараты
- Подготовка 10x TBE как указано в таблице 4.
- В день гелевой перспективе подготовить 1 л 1x TBE буфере сверхчистой DDH 2 O.
- Подготовка 10% (вес / объем) APS. Примечание: Можно хранить в 200 мкл аликвоты при -20 ° С в течение нескольких месяцев, но активность может уменьшаться с течением времени <./ LI>
- Собрание гель литья камеры
- Избегайте пыли и ворсинок между стеклянными пластинами. Поэтому тщательно чистые рабочие поверхности с помощью влажных салфеток.
- Очистить пару 25 см стеклянных пластин с использованием одноразовых бумажных полотенец и дистиллированную воду с обеих сторон, а затем изопропанол для внутренней стороне стеклянных пластин.
- Поместите 0,25 мм проставки на задней стеклянной пластины и снизить зубчатым стеклянную пластину сверху (Рисунок 3).
- Прикрепите гель рельсов с обеих сторон стеклянных пластин с вырезом конце и пилотов железнодорожного въезда, стоящих перед вверх и затяните ручки слегка.

Рисунок 3. разобранном виде электрофореза гель стеклянных пластин. Стеклянных пластин следует использовать направленно. Позаботьтесь, чтобы столкнуться с внутренней стороны стеклянных пластин внутрь и внешнеесторону наружу.

Рисунок 4. вид устройства в сборе гель. После введения раствора геля, карманные прокладка помещена в растворе между стеклянными пластинами. Кастинг пластину затем скользнул между передней стеклянной пластины и гелевых рельсов и обеспечены крепления железнодорожных ручки.
- Кастинг гель
ПРИМЕЧАНИЕ: не полимеризуется акриламида нейротоксичен! Пожалуйста, ознакомьтесь с паспортом безопасности материала и использовать с соответствующей защитой !!!- Добавить соединений, приведенных в таблице 5, в химический стакан и смешать с помощью мешалки и магнитной мешалкой.
- Сразу после добавления APS и TEMED, занимают раствора геля в 50 мл шприца и поместите 0,45 нм фильтр на на кончике.
- Либо провести верхний край стеклянной пластины с одной стороны или разместить сэндвич-ч в кастинге геля стоять создать наклон под углом 10 - 20 °.
- Медленно обойтись раствора геля между стеклянными пластинами при непрерывном перемещении наконечника шприца от одной стороны к другой, и прекратить как только раствор геля соответствует нижний конец.
- Перемещение в сторону или полностью удалить любые образовавшиеся пузыри, используя пузырь крючок.
- Вставьте гель карманные распорку (0,25 мм) между стеклянными пластинами на зубчатый конец, погрузить в раствор геля и исправить путем присоединения литья пластину.
- Закрепите верхний железнодорожные болты слегка (рисунок 4 для полностью собранного устройства).
- Пусть гель набор для 1 - 2 ч.
- Снимите литье пластины и карманные прокладку и очистите карман от соли и геля остатков.
- Промыть DDh 2 O и вытереть излишки раствора с тканей работ.
- Запуск и визуализации геля
ПРИМЕЧАНИЕ: Гели секвенирования непосредственно подвергали электрофорезу в геле томографа, в то время какфлуоресценции одновременно обнаружить с помощью лазерного микроскопа. В отличие от обычной гель-электрофореза, где гель запуска, а затем окрашивали и визуализировали, блок детектирования является фиксированной и сканирует диапазон частот в реальном масштабе времени, когда они проходят лазер. Ниже процедуры для обеспечения сбора ImagIR данных на OS / 2 очерчено, которые могут быть приняты для более поздних версий. Для получения дополнительной информации обратитесь к руководству пользователя.- Авто держатель буферной емкости в гелевых рельсов на передних стеклянных пластин и затяните ручки.
- Поместите гель в геле бака нижнего автоматизированной гель тепловизор с нагревательного элемента и исправить, сдвинув пилота входа железнодорожного в аппарат скобках.
- Заполните 1x буфер TBE в нижних и верхних буферных камер геля, закройте нижнюю буферную камеру и подключите верхнюю палату буфера к власти с помощью кабеля питания.
- Если присутствует, очистите гель карман из соляных остатков по несколько раз пипеткой буфер в карман.
- Закройте верхнюю камеру буферной емкости с помощью верхнюю крышку буфера.
- Закройте дверцу машины и переключиться на тепловизор и компьютер и запустите программу сбора База ImagIR данных.
- Создайте новый файл проекта (File> New ...), ввести имя файла проекта, выбрать соответствующие лазерные диапазоны (700 или 800 нм) и подтвердить кнопкой ОК.
- Выберите Настройки-> Автоусиление ... из меню изображения в верхней, нажмите Auto, чтобы начать автоматический измерение усиления и принять настройки, нажав кнопку ОК.
- Фокус лазер, выбрав Настройки-> Фокус ... из меню управления сканером, нажав на кнопку Auto и принятия настройки, нажав кнопку ОК.
- Повторите процедуру автоматического усиления, чтобы приспособиться к новой ориентированной области.
- Настройка управления сканером соответствии с этими настройками: 2000 V, 35 мА, 45 Вт, 45 ° C, Scan фильтр: 3, Скорость сканирования: 3.
- Prerun пустой гель в течение 20 мин (выбран напряжения и нажмите ).
- В то же время, нагревать секвенирования лестнице и продуктов удлинени праймера в машине ПЦР в течение 2 мин до 90 ° С, затем охлаждают на льду.
- Остановите электрофорез, открыть автоматизированный гель секвенсор и снимите верхнюю крышку буферной емкости.
- Вставьте акулы зубную гребенку между стеклянными пластинами и слегка прокалывают гель с зубов акулы (рисунок 5).
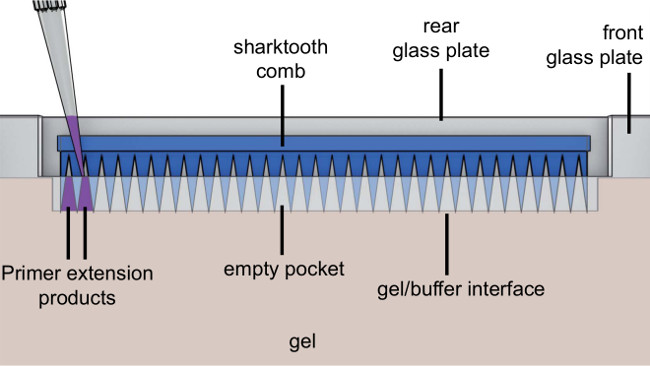
Рисунок 5. Крупным планом геля с акулой зуба гребенки. Образец (фиолетовый) применяется между зубами акул.
- Пипетка либо 1 - 2 мкл праймера продукты удлинения или секвенирование лестничные реакции в каждом кармане гель (образованной из акульих зубов).
- Если не все карманы нужны, заполнить пустые карманы с красителем, чтобы предотвратить впоследовательное поведение бег.
- Закройте буферную емкость и дверь гель секвенсор.
- Начните электрофорез и включить лазерный (Select напряжение на и лазер на и нажмите ).
- Стоп-электрофореза раз область интереса прошел лазер.
Результаты
Как показано на рисунке 6, праймер реакции расширение может использоваться для определения транскрипционные начальные точки транскриптов, представляющим интерес, и может помочь вывести промоторные области (обычно идентифицируется -10 и -35 элементов). Самый верхний (длинный) Фрагмент кДНК представляет собой 5 'конец мРНК и, следовательно, может быть легко отображены в сравнении с секвенирования лестнице.

Рисунок 6. Представитель результатом реакции удлинения праймера. На левой стороне полном объеме в естественных условиях удлинения праймера гель от Е. палочка с различными плазмид показано. Отдельные сферы интересов увеличены. В верхней части (А), определение OmpA транскрипции отправной точки изображен. Обратная транскрипция останавливается на 5'-конце мРНК и, следовательно, создает полосу РНК полной длины (Indicated стрелкой). По согласованию группу кДНК с секвенирования лестницы, 5'-конец мРНК может быть определена, как показано на прилагаемом последовательности. В нижней части (B), расщепление транскрипта OmpA по YoeB-seq2 РНКазы показано. Полосы 1 - 3 представляют образцы, в которых токсин YoeB-seq2 отсутствует или неактивен, в то время как переулков 4 - 5 представляют образцы с активной РНКазы, совпадающий с отсутствием и наличием кДНК продукции. Две основные продукты расщепления создаются как показано стрелками. ДдНТФ используется в каждой полосе и соответствующего РНК-основания секвенирования лестницы помечен. Транскриптов части обозначены синим цветом, промоторных элементов и августа стартового кодона с помощью пурпурного шрифтом. Для получения дополнительной информации; увидеть оригинальный исследовательский статью из Нолл и др., микробиологии 159, 1575-1585 (2013). Пожалуйста, нажмите здесь, чтобыпросмотреть большую версию этого рисунка.
В примере, показанном на фиг.6, TSP из OmpA мРНК была определена, чтобы быть G основание (со стрелкой в последовательности ниже гель). Это согласуется с OmpA TSP, опубликованной до 15. В -35 и -10 элементы промотора может быть выведена быть TTGTAA и TAGACT 16 как мотивы отличаются только два основания каждый из соответствующих консенсусных последовательностей (TTGACA и TATAAT соответственно).
В отличие от других способов, таких как 5 'RACE, грунтовки реакции расширения могут быть использованы, чтобы точно определить и количественно расщепление РНК-молекул. Расщепление молекул РНК создает свободные концы 5 ', которые могут быть одновременно обнаруженных как кДНК полос в геле. Определение несколько продуктов расщепления одной мРНК является более трудным в 5 'RACE экспериментов, так как несколько ПЦР-продукты должны быть упорядочены для получения продуктов расщеплениячто представляют собой лишь малую часть от общего (необработанного) РНК навалом.
В нижней части фиг.6, отображение РНК к расщеплению с помощью РНКазы изображен. Как описано выше 5, РНКазы YoeB-seq2, часть TA-системы от S. equorum 17, расщепляет мРНК, близкие к стартового кодона. Это расщепление можно ингибировать путем родственного анти-токсина YefM-SEQ2. Когда РНКазы YoeB нет или неактивным (дорожки 1 - 3), не праймеров продукты расширение не образуются вблизи стартового кодона. Всякий раз, когда активность РНКазы присутствует (дорожки 4 и 5), две сильные полосы незадолго ниже по потоку от начала появляться кодон. Используя этот подход, декольте модели могут быть легко идентифицированы.
На рисунке 7 показана не удалось праймера эксперимент расширение. Из-за избыточного РНК в реакции обратной транскрипции, количество генерируемого кДНК создает такой сильный сигнал, что индивидуальное группа кДНКы не могут быть выделены. Это делает конечный определение РНК 5 'невозможно.
При использовании высоко выраженные РНК в реакции удлинения праймера, например, рибосомальной РНК (как показано на рисунке 7), риск более открытые участки возрастает. Таким образом, количество общей РНК шаблона должен быть настроен на обилие РНК интереса. В отличие от этого, когда транскрипты интерес представляют только небольшое количество общей РНК, количество в реакции обратной транскрипции должна быть увеличена, в противном случае сигналы будут слишком слабый (не показан). Это также относится к реакции секвенирования Sanger, как многокопийных шаблонов на клетку (например, генов рРНК или генов, кодируемых на плазмид) приводит к значительно более сильным сигналом.
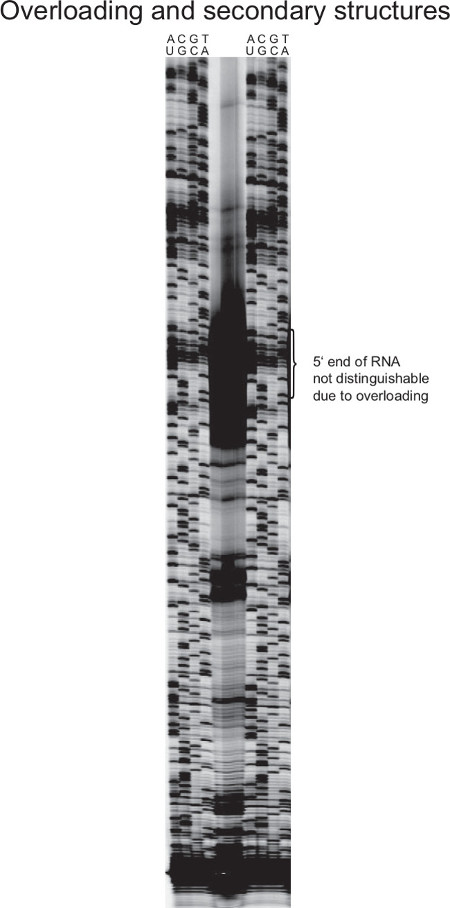
Рисунок 7. Представитель результатом неудавшейся удлинения праймера от нг> С. стафилококк. 16S РНК является весьма распространены в бактериальных клетках. Это приводит к сильным сигналам обратной транскрипции при умеренных количеств суммарной РНК используются. В случае, изображенном здесь, сильные полосы кДНК замаскировать точную 5 'конец и, следовательно, предотвратить 5' отображение. Кроме того, рибосомных РНК являются высоко структурированными и, следовательно, может прекратить обратную транскрипцию преждевременно, производя короткие продукты кДНК, которые не представляют полные фрагменты длины. В этом случае обратный увеличением температуры транскрипции, вместе с теплостойкой обратной транскриптазы может облегчить синтезировать прошлые вторичные структуры. Из-за множества копий последовательности в геномной ДНК, секвенирование Сангер лестница сильнее, чем для генов единственном экземпляре. Для улучшения гель картину, РНК и ДНК составляет для обратной транскрипции и реакцию Сангер должна быть уменьшена, и / или меньше, продукт применяется к гелю._upload / 52134 / 52134fig7large.jpg "цель =" _ пустой "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Таблица 1: ДНКазы I переваривание РНК.
| Вещество | Количество |
| РНК из ступеньку выше | 70 - 100 мкг |
| 10x ДНКазы I буфера (100 мМ Трис, рН 7,5, 25 мМ MgCl 2, 5 мМ CaCl 2) | 50 мкл |
| ДНКазы I, РНКазы (2 U / мкл) | 10,0 мкл (до 10 мкг РНК на 1 мкл ДНКазы I) |
| Принесите объем до 500 мкл с DDh 2 O (DEPC лечение) | |
Объем Реакция и количество ДНКазы I можно масштабировать вверх или вниз в зависимости от суммы Oе РНК используется.
Таблица 2: РНК-гибридизации праймера.
| Соединение | Сумма для одной реакции |
| РНК | 5 - 15 мкг |
| Флуоресцентно меченый праймер | 2 пмоль |
| Принесите объем до 6 мкл с DDh 2 O (DEPC лечение) | |
Настройте один реакцию на отсчет РНК и грунтовки.
Таблица 3: Удлинение праймера Master Mix.
| Соединение | Сумма для одной реакции |
| DDh 2 O (DEPC лечение) | 1,3 мкл |
| AMV RT буфера (10x) | 1.0мкл |
| дНТФ (10 мм, РНКазы) | 1,0 мкл |
| РНКазы ингибитор | 0,2 мкл |
| AMV обратной транскриптазы (RT) (20 - 25 ед / мкл) | 0,5 мкл |
Масштабирование до числа реакций, необходимых.
Таблица 4: 10x КЭ рецепт.
| Вещество | Количество |
| База Трис | 107,8 г |
| Борная кислота | 55,0 г |
| ЭДТА | 7,4 г |
| Принесите объем до 1000 мл с особо чистой DDh 2 O и фильтр для удаления пыли и ворсинок | |
Фильтры для удаления пыли и пуха и магазин на 4 °C.
Таблица 5: гель рецепт Секвенирование.
| Соединение | Количество |
| Мочевина | 10,5 г |
| DDh 2 O (MilliQ) | 13,0 мл |
| 10x КЭ | 2,5 мл |
| Решение XL Быстрая гель | 5,0 мл |
| TEMED (N, N, N ', N'-Tetramethylethane-1,2-диамина) | 25 мкл |
| APS (персульфат аммония, 10%) | 175 мкл |
Процесс гель раствор быстро после добавления TEMED и APS.
Обсуждение
Расширение Люминесцентная грунтовка представляет собой простой и быстрый способ определения 5 'концы РНК, либо для TSP- или вторичной идентификации обработки РНК. Благодаря использованию флуоресцентных праймеров, реакции могут быть созданы и работают без дополнительных мер безопасности (в отличие от случая радиоактивно меченых праймеров). Как образцы будут обнаружены с помощью флуоресценции, они могут быть отображены в то время как электрофорез в ходе которого позволяет проводить быстрый анализ в сравнении с радиоактивными методами, где рентгеновские пленки, обычно используемых.
В целом, качество реакции удлинения праймера сильно зависит от сорта и возможностей связывания праймера. Если сайт связывания выбирается слишком близко к зоне интереса, грунтовки мазки могут маскировать сигнал, в то время как сайт связывания слишком далеко (> 300 б.п.) от «конца 5 может привести к плохой сигнал.
Флуоресцентный краситель должен быть ковалентно связаны с5 'концу олигонуклеотида пользовательских ДНК в процессе синтеза, и олигонуклеотид должен быть очищен с помощью ВЭЖХ, чтобы предотвратить помехи в реакции обратной транскрипции с помощью остаточных солей. Олигонуклеотиды с соответствующей модификацией красителя (см список реагентов стол для получения дополнительной информации о совместимых красителей) можно заказать в большинстве синтеза олигонуклеотида компаний и должны храниться в темноте. К сожалению, мы не знаем ни ферментативных методов для крепления краситель на ранее существующих олигонуклеотидов, как можно с меченых нуклеотидов.
В системе секвенирования, описанного здесь, две разные флуоресцентные красители могут быть использованы для одновременного обнаружения двух образцов, а их возбуждения (около 700 и 800 нм) и эмиссионные спектры отличны. Помимо оригинальных красителей производителя, другие красители, такие как указано в списке реагенты могут быть использованы для получения превосходных результатов.
Еще одним важным фактором для прИМЕР реакции расширения является качество РНК и количество. Следует проявлять осторожность, чтобы удалить загрязнения ДНК, как обратные транскриптазы, такие как AMV RT можно использовать ДНК в качестве матрицы 18.
Как показано на фиг.7, обнаруженный уровень сигнала полосы в геле перспективе зависит от количества РНК, используемого в реакции обратной транскрипции. Поэтому очень важно, чтобы регулировать количество общей РНК, в зависимости от пропорционального количества РНК процентной присутствующего в образце. Низкая чувствительность данного метода также является одним из его недостатков, так как низкие, выраженные РНК может быть трудно обнаружить. Если сигналы не могут быть обнаружены вообще, количество общей РНК может быть увеличена или РНК интерес может быть искусственно избыточно экспрессируется из плазмиды.
Чувствительность обнаружения Гель для флуоресценции основе удлинения праймера составляет около десять раз ниже, чем 32 P или 33 P радиоактивным изотопом основе удлинения праймера 19, Однако, этот недостаток может быть компенсирован путем регулирования количества кДНК наносили на гель с или путем увеличения количества РНК-матрицы, используемой в реакции обратной транскрипции. В большинстве случаев, чувствительность достаточно высока для удовлетворительных результатов 4,5. Чувствительность, сходные с радиоактивными расширений праймеров были зарегистрированы при использовании люминесцентных праймеров в комбинации с капиллярной секвенсор 3, с преимуществом коротких временах экспозиции.
Затраты сравнение флуоресценции и радиоактивности грунтовка расширений трудно, так как они зависят от нескольких факторов, таких как доступных машин, грунтовок, лестничных реакций, наличие и содержание в лабораторию для работы с радиоактивными веществами, захоронения радиоактивных отходов, обучение и индивидуальных рисков для здоровья , Люминесцентные грунтовки о пять-десять раз дороже, чем не-меченых стандартных праймеров (20 б.п.). Однако эти праймеры могут быть использованы в течение по крайней мерев год (что более вероятно несколько лет) по сравнению с 32 P меченых праймеров, которые имеют гораздо более короткий период полураспада. Повторно маркировки праймеров является трудоемким и дорогостоящим, из-за потребности в новом радиоактивного материала в короткие промежутки времени. Если же набор праймеров используется на протяжении длительного периода времени, флуоресцентные праймеры дешевле, чем обычные, радиоактивно меченых праймеров. Главное стоимость будет, однако, быть флуоресцентный секвенсор или тепловизор и приобретение аппарата исключительно с целью расширения праймеров не может быть рентабельным. Метод, описанный здесь весьма интересна для групп, которые находятся в распоряжении или имеющих доступ к такой машине.
Если автоматизированное гель секвенсор не доступен, другие методы обнаружения флуоресценции могут быть использованы также. В этом случае, гель может работать в стандартном аппарате для электрофореза, сушат при необходимости, а затем переносили на флуоресцентном томографа (модели доступны, которые похожи на FLatbed сканеры). Хотя преимущество визуализации геля во время бега теряется, использование радиоактивных изотопов можно избежать таким образом, важным преимуществом для экспериментатора. Кроме того, при наличии, капиллярная секвенсор может использоваться для разделения и в режиме реального времени обнаружения, которые могут помочь повысить чувствительность.
Различные методы были опубликованы на том, как использовать люминесцентные удлинения праймера с машин автоматизированная гель секвенирования или капиллярных секвенсорами, однако эти методы часто требуют кДНК осадков шаг к концентрации образца (и удаления примесей) 19. В способе, представленном здесь, осаждение ДНК не является необходимым, таким образом, сокращая время приготовления. Что еще более важно, однако, пропуска этого этапа позволяет полу-количественно определить количество молекул РНК в образце, как несогласованности процедуры осадков может быть устранена.
Следует отметить,, что, хотя5 'концы молекул РНК могут быть отображены в праймеров реакций расширения, обрабатываются и первичные концы (транскрипционные отправных точек) не может быть легко отличить. Чтобы обойти эти ограничения, тщательное планирование экспериментов с соответствующим контролем важно. Очевидные промоторные последовательности могут указывать на наличие транскрипции отправной точки и мутации или удаление промоторные элементы должны затем отменить кДНК полосы. С другой стороны, если такие последовательности отсутствует или специфические консенсусные последовательности присутствуют, эти полосы могут быть вызваны обработки РНК. Если обработка ферментом известно и может быть очищен, в пробирке расширения праймеров может привести разъяснения, как транскрипции и обработки могут быть разделены. Кроме того, другие методы, такие как 5 'RACE (в том числе ферментативной обогащения необработанных молекул РНК) могут дополнить праймеров расширений, чтобы отличить начала транскрипции сайты из процессинга РНК.
Чте метод удлинения праймера часто по сравнению с другими методами, такими как 5 'RACE и S1 анализов на защиту нуклеазы и, таким образом, ее полезность иногда ставится под сомнение. Методы RNAseq в сочетании с следующего поколения секвенирования например может помочь определить, ОТУ и обработки сайты многих РНК параллельно, однако финансовое бремя и bioinformatical работы требуется сделать это довольно неэкономично для отдельных РНК, представляющих интерес. 5'-RACE, с другой стороны дешевле и результаты легче анализировать, но если РНК обрабатываются различными способами или нескольких начальных точек транскрипции присутствуют, продукт должен быть клонированы и большое количество кандидатов должны быть упорядочены по получение репрезентативной вид РНК, представляющих интерес.
Поэтому, несмотря на новые методы возникнув на протяжении многих лет, даже сегодня грунтовка расширения имеют в них отпадет в связи с простотой использования, низкая стоимость и короткие сроки выполнения работ, что особенно вернодля флуоресцентной основе метода, изложенного здесь.
Раскрытие информации
The authors have nothing to disclose that would present a conflict of interest.
Благодарности
We thank Anne Wochele for her assistance in the laboratory and Vera Augsburger for help with the automated gel sequencer. We thank the Deutsche Forschungsgemeinschaft for funding by grants BE4038/2 and BE4038/5 within the “priority programmes” SPP1316 and SPP1617.
Материалы
| Name | Company | Catalog Number | Comments |
| AMV Reverse Transcriptase (20-25 U/µl) | NEB / Roche | NEB: M0277-T / Roche: 10109118001 | |
| DNase I (RNase free) | Ambion (life technologies) | AM2222 | |
| FastPrep-24 Instrument | MPBio | 116004500 | |
| Fluorescently labeled primers | Biomers | n/a | 5’ DY-681 modification of “ordinary” DNA oligonucleotides. Compatible dyes such as the LICOR IRDye 700/800 are also available from other suppliers such as IDTdna. |
| Li-Cor 4200 Sequencer incl. ImagIR Data collection software | Li-Cor | Product discontinued | |
| NanoDrop 2000 | Thermo Scientific | ||
| Nuclease free water | Ambion (life technologies) | AM9915G | |
| Plasmid mini preparation kit | QIAGEN | 12125 | |
| RapidGel-XL-40% Concentrate | USB | US75863 | |
| RNA STORAGE BUFFER | Ambion (life technologies) | AM7000 | |
| Roti-Aqua-P/C/I | Carl Roth | X985.3 | Alternative: “Acid-Phenol:Chloroform, pH 4.5 (with IAA, 125:24:1)” from Ambion (AM9720) |
| SUPERase•In RNase Inhibitor | Ambion (life technologies) | AM2696 | |
| Thermo Sequenase fluorescently labelled primer cycle sequencing kit with 7-deaza-dGTP | GE Healthcare | RPN2538 | |
| TRIzol reagent | life technologies | 15596-026 | |
| Zirconia/Silica Beads 0.1 mm | BioSpec | 11079101z |
Ссылки
- Simpson, C. G., Brown, J. W. Primer extension assay. Methods Mol. Biol. 49, 249-256 (1995).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. U. S. A. 74, 5463-5467 (1977).
- Fekete, R. A., Miller, M. J., Chattoraj, D. K. Fluorescently labeled oligonucleotide extension: a rapid and quantitative protocol for primer extension. Biotechniques. 35, 90-94 (2003).
- Schuster, C. F., et al. Characterization of a mazEF Toxin-Antitoxin Homologue from Staphylococcus equorum. J. Bacteriol. 195, 115-125 (2013).
- Nolle, N., Schuster, C. F., Bertram, R. Two paralogous yefM-yoeB loci from Staphylococcus equorum encode functional toxin-antitoxin systems. Microbiology. 159, 1575-1585 (2013).
- Yamaguchi, Y., Park, J. H., Inouye, M. Toxin-antitoxin systems in bacteria and archaea. Annu. Rev. Genet. 45, 61-79 (2011).
- Schuster, C. F., Bertram, R. Toxin-antitoxin systems are ubiquitous and versatile modulators of prokaryotic cell fate. FEMS Microbiol. Lett. 340, 73-85 (2013).
- Goeders, N., Van Melderen, L. Toxin-antitoxin systems as multilevel interaction systems. Toxins. 6, 304-324 (2014).
- Yamaguchi, Y., Inouye, M. mRNA interferases, sequence-specific endoribonucleases from the toxin-antitoxin systems. Progress in molecular biology and translational science. 85, 467-500 (2009).
- Park, J. H., Yamaguchi, Y., Inouye, M. Bacillus subtilis MazF-bs (EndoA) is a UACAU-specific mRNA interferase. FEBS Lett. 585, 2526-2532 (2011).
- Zhu, L., et al. et al.Staphylococcus aureus MazF specifically cleaves a pentad sequence, UACAU, which is unusually abundant in the mRNA for pathogenic adhesive factor SraP. J. Bacteriol. 191, 3248-3255 (2009).
- Zhu, L., et al. The mRNA interferases, MazF-mt3 and MazF-mt7 from Mycobacterium tuberculosis target unique pentad sequences in single-stranded RNA. Mol. Microbiol. 69, 559-569 (2008).
- Fu, Z., Donegan, N. P., Memmi, G., Cheung, A. L. Characterization of MazFSa, an endoribonuclease from Staphylococcus aureus. J. Bacteriol. 189, 8871-8879 (2007).
- Marmur, J. A procedure for the isolation of deoxyribonucleic acid from micro-organisms. J. Mol. Biol. 3, 208-218 (1961).
- Emory, S. A., Belasco, J. G. The ompA 5' untranslated RNA segment functions in Escherichia coli as a growth-rate-regulated mRNA stabilizer whose activity is unrelated to translational efficiency. J. Bacteriol. 172, 4472-4481 (1990).
- Cole, S. T., Bremer, E., Hindennach, I., Henning, U. Characterisation of the promoters for the ompA gene which encodes a major outer membrane protein of Escherichia coli. Mol. Gen. Genet. 188, 472-479 (1982).
- Schleifer, K. H., Kilpper-Bälz, R., Devriese, L. Staphylococcus arlettae sp. nov., S. equorum sp. nov. and S. kloosii sp. nov.: Three New Coagulase-Negative, Novobiocin-Resistant Species from Animals. Syst. Appl. Microbiol. 5, 501-509 Forthcoming.
- Yu, H., Goodman, M. F. Comparison of HIV-1 and avian myeloblastosis virus reverse transcriptase fidelity on RNA and DNA templates. J. Biol. Chem. 267, 10888-10896 (1992).
- Ying, B. W., Fourmy, D., Yoshizawa, S. Substitution of the use of radioactivity by fluorescence for biochemical studies of RNA. RNA. 13, 2042-2050 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены