Method Article
Формирование упорядоченных биомолекулярных структур по самосборки коротких пептидов
В этой статье
Резюме
Эта статья описывает формирование высокоупорядоченных на основе пептидов структур по стихийного процесса самосборки. Метод использует имеющиеся в продаже пептиды и общего лабораторного оборудования. Этот метод может быть применен к большому разнообразию пептидов и может привести к обнаружению новых основе пептидов сборок.
Аннотация
В природе, сложные функциональные структуры образованы самосборки биомолекул в мягких условиях. Понимание силы, которые управляют самосборки и имитировать этот процесс в пробирке будет привести к значительным достижениям в области материаловедения и нанотехнологий. Среди доступных биологический строительных блоков, пептиды имеют ряд преимуществ, как они представляют значительную разнообразие, их синтез в больших масштабах проста, и они могут быть легко изменены с биологических и химических образований 1,2. Несколько классов, предназначенных пептидов, таких как циклические пептиды, амфифильные пептиды и конъюгаты пептида самосборке в упорядоченные структуры в растворе. Homoaromatic дипептиды, представляют собой класс коротких самособирающихся пептидов, которые содержат всю молекулярную информацию, необходимую для формирования упорядоченные структуры, такие как нанотрубки, сфер и фибрилл 3-8. Большое разнообразие этих пептидов является коммерчески доступным. 9 Протоколы представленные здесь могут быть адаптированы к другим классам пептидов или биологическая строительных блоков и потенциально может привести к открытию новых пептидных структур на основе и лучше контролировать их сборки.
Введение
Природа формы заказаны и функциональных структур в процессе биомолекулярной самостоятельной сборки. Понимание силы, которые управляют этой стихийный процесс может привести к способности имитировать самосборки в пробирке и, следовательно, к значительному прогрессу в области материаловедения 10,11. Пептиды, в частности, весьма перспективны в качестве биомолекул строительного блока, так как они представляют большой структурное разнообразие, простоту химического синтеза, и может быть легко функционализированных биологических и химических образований. Поле пептидной самосборки был впервые Гадири и его коллег, которые продемонстрировали самосборки пептидных нанотрубок циклических пептидов с чередующимися D-и L-аминокислоты 12. Другие успешные подходы к проектированию пептидных сборок включают линейные bolaamphiphile пептиды 5, амфифилы (AP) 6, несопряженные самодополнительных ионные пептиды 13, поверхностно-как пептиды 4,14, и диблочный copolypeptides 15.
В последнее время подход включает самосборки коротких ароматических пептидов, называется homoaromatic дипептиды. Эти пептиды содержат только две аминокислоты с ароматический характер (например Phe-Phe, трет-бутилдикарбоната (Boc)-Phe-Phe) 7,8,16-21. Структуры, образованные этими homoaromatic пептидов включают трубчатые структуры, сферы, листообразных узлов и волокон 6,8,15,21-32. Волокна в некоторых случаях генерировать фибрилл сетку, который дает гидрогель 33-37. Эти сборки были использованы для применений биодатчиков, доставки лекарств, молекулярной электроники и т.д.. 38-45
Эта статья описывает экспериментальные шаги, необходимые для того, чтобы начать спонтанное самосборки homoaromatic пептидов. Кроме того, он представляет процесс пептида coassembly. Этот процесс включает в самосборки более чем одного типа пептидамономер.
Наша демонстрация включает coassembly двух коммерчески доступных пептидов: дифенилаланин пептид (NH 2-Phe-Phe-COOH) и его Вос-защищенный аналог (Boc-Phe-Phe-OH). Каждый из пептидов объединяющаяся в надмолекулярной структурой: дифенилаланин пептидные форм трубчатые сборками и Вос-Phe-Phe-OH пептидные объединяющаяся в либо сфер или волокон в зависимости от растворителя 7,17,46. Мы смешал два пептида в определенных соотношениях и характеризуется приведенных сборок с помощью электронной микроскопии, силовой микроскопии и ИК-спектроскопии. Методы продемонстрировали формирование структуры на основе пептидов, которая состоит из сферических элементов с диаметром в несколько микрон (1-4 мкм), которые соединены удлиненных сборок с диаметром несколько сотен нанометров (~ 300-800 нм) . Сборки напоминают бисером строк в их морфологии, а сферические структуры, кажется, с резьбой наудлиненные сборки. Поэтому мы назвали эти сборки "биомолекулярные ожерелья". В "биомолекулярные ожерелья" может служить в качестве нового биоматериала, как доставки лекарств агента или в качестве каркаса для электронных приложений. Кроме того, процесс, который приводит к самосборке пептидов могут быть использованы с другими классами пептидов и биомолекул. Это может привести к лучшему пониманию сил, участвующих в самостоятельной сборки и формирования новых упорядоченных структур.
протокол
1. Самосборка Homoaromatic дипептидов
- Взвесить желаемый пептид в лиофилизированной форме (например, NH 2-Phe-Phe-OH, Boc-Phe-Phe-COOH) и Подготовка исходного раствора путем растворения пептида в 1,1,1,3,3,3-гексафтор -2-пропанол (HFP) до соответствующей концентрации (например, 100 мг / мл для NH 2-Phe-Phe-OH и Boc-Phe-Phe-COOH) 7,17,46.
- Смешайте раствор с помощью вихря и место на скамейке, пока пептид полностью не растворится и раствор кажется очевидным (несколько минут).
- Развести маточного раствора пептида, в подходящем растворителе, до соответствующей концентрации (например, 2 мг / мл NH 2-Phe-Phe-OH в тройной дистиллированной воде (TDW) для формирования нанотрубок; добавлением 2 мкл пептида Исходный раствор до 98 мкл TDW, 5 мг / мл Вос-Phe-Phe-COOH в этаноле для формирования сферических структур).
- Держите раствора при комнатной температуре в течение 24ч.
- Для того чтобы избежать любого preaggregation, готовят свежие растворы для каждого эксперимента.
2. Coassembly о двух Homoaromatic дипептидов
- Готовят раствор 50%-ного этанола путем смешивания равных объемов TDW и абсолютного этанола. Используйте вихрь смешивать два решения.
- Взвесить 2 мг пептида NH 2-Phe-Phe-OH и 1 мг пептида Boc-Phe-Phe-OH. Растворить каждого пептида в HFP до концентрации 100 мг / мл.
- Смешайте пептиды растворы с использованием вихрь и разместить их на скамейке, пока пептиды не полностью растворяются и решения кажутся понятными.
- Смесь пептидов растворы в желаемом соотношении. В этом конкретном эксперименте смесь 10 мкл пептида NH 2-Phe-Phe-OH с 6 мкл пептида Boc-Phe-Phe-OH (до конечной соотношении 5:03 соответственно). В связи с высокой волатильностью растворителя HFP, рекомендуется подготовить большое количество этого раствора (на лугул 10 мкл).
- Используйте вихрь смешивать смешанные пептиды маточного раствора.
- Развести смешанные пептиды исходного раствора с 50%-ным этанолом до желаемой конечной концентрации. В этом конкретном эксперименте, чтобы получить конечную концентрацию 5 мг / мл в течение NH 2-Phe-Phe-OH и 3 мг / мл в течение Boc-Phe-Phe-OH соответственно, добавляют 8 мкл смешанного раствора пептидов до 92 мкл 50% раствора этанола. Используйте пипетку, чтобы мягко перемешать раствор.
- Хранить раствор при комнатной температуре в течение 24 часов.
- Следует отметить, что в связи с высоко летучей природы растворителя, эксперименты чувствительны к небольшим изменениям концентрации пептидов. Поэтому свежие растворы должны быть готовы для каждого эксперимента.
3. Характеристика из самоорганизующихся структур с помощью сканирующей электронной микроскопии (SEM)
- Через 24 ч инкубации наносить каплю 10 мкл раствора пептидов на стеклянной бухтыг скольжения и сухой при комнатной температуре.
- Пальто образец на стекло с тонким слоем золота (несколько нанометров) с использованием покрыти распылением в течение 90 сек.
- Изображение сборки с использованием СЭМ работает на 10-20 кВ.
4. Характеристика из самоорганизующихся структур с помощью просвечивающей электронной микроскопии (ПЭМ)
- Поместите каплю 10 мкл пептидов раствора на 200 меш медную сетку, покрытой углеродом и стабилизированной опоры полимерной пленки.
- После 1 мин удалить лишнюю жидкость с использованием фильтровальной бумаги.
- Приготовьте раствор 2% уранилацетатом в TDW. Фильтр решение с помощью блока фильтров 0,22 мкм.
- Чтобы окрасить образец (отрицательный окрашивания), поместите каплю 10 мкл уранилацетатом решения по сетке.
- После 30 сек удалить лишнюю жидкость с помощью фильтровальной бумаги. Следует отметить, что, хотя отрицательный окрашивание повышает контрастность изображений, это не является необходимым во всех случаях.
- Изображение образец на гоэ сетки с помощью ПЭМ, работающих на 120 кВ.
5. Трехмерная Характеристика Ассамблей атомно-силовой микроскопии (АСМ)
- Подготовка пробы для анализа АСМ с использованием процедуры, описанной в пункте 3.1.
- Проанализируйте пробу на стекле с помощью инструмента АСМ работает в режиме переменного тока. Использование кремниевых кантилеверов с пружины 3 н / м и резонансной частотой 75 кГц.
- Начните путем сканирования большую площадь сетки, чтобы найти желаемую структуру. Тогда сосредоточиться на конкретной меньшей площади и сканирования (размер сканирования составляла 2,5 мкм х 2,5 мкм для изображения, включенные в этой рукописи).
6. Характеристика вторичной структуры по ИК-Фурье
- Нанесите каплю 30 мкл раствора пептидов к окну CaF 2.
- Разрешить решение сохнуть при комнатной температуре.
- Адсорбция воды в спектре ИК в 1650 см -1.Этот пик в центре амидной группы I пептидной связи. Это также типичная пик α-спиральные структуры пептидов и белков 47. Для того чтобы преодолеть эту проблему и избежать сигнал воды, обмен водорода к дейтерия должна быть выполнена. Поместите каплю оксида дейтерия (D 2 O) на высушенного образца пептида. Падение должно быть достаточно большим, чтобы полностью покрыть пептида депозит на окне.
- Разрешить образец сушить под вакуумом.
- Повторите шаги 6.3 и 6.4 2x для обеспечения максимального обмена водорода к дейтерия. Сохранить образец под вакуумом до ее анализа.
- Запишите спектры ИК-Фурье с использованием дейтерированного триглицинсульфата (DTGS) детектора. Система FT-ИК-спектр включает генератор продувочного газа, чтобы предотвратить влажности в среде образца. Для образцов коротких пептидов, то лучше для сканирования образца 2000 х при разрешении 4 см -1. Пропускание минимальные значения могут быть определены таким образомftware поставляется вместе с прибором.
Результаты
Эта статья описывает способ формирования упорядоченных структур в нано-и микронных масштабах по самосборки пептидов. Для того чтобы продемонстрировать это простой процесс, мы представляем и охарактеризовать coassembly двух простых ароматических пептидов (рис. 1). Один из пептидов является NH 2-Phe-Phe-OH (дифенилаланин) пептид, который может самосборке в водном растворе в полых трубчатых структур нанометровых размеров с 7. Другой пептид является его Вос-защищенный аналог, Boc-Phe-Phe-OH. Этот пептид может образовывать фибриллярных структур в водных растворах и сферических агрегатов в этаноле 17,46. Мы предположили, что эти пептиды бы coassemble в структуру, которая сочетает в себе два упомянутых элементов. Используя анализ SEM, мы показали, что смешанные пептидов, образованных архитектуру сферических агрегатов с диаметром в несколько микрон, соединенных удлиненных структур с диаметром в несколько HUNDRред нм (рис. 2). В связи с высоким сходством в морфологии к бисерные строки, мы назвали эти структуры «молекулярные ожерелья". АСМ анализ этих структур четко продемонстрировали свою трехмерную компоновку (рис. 3). Кроме того, SEM анализ различных регионах различных образцов показал, что этот процесс происходил с высоким выходом (фиг.2В).
ИК-Фурье анализа представил информацию о вторичной структуре пептидов сборок. Поглощение спектр амидной группы I сферических агрегатов, образованных пептида Boc-Phe-Phe-OH (5 мг / мл, 50% этанол) показал единственный пик Амид I при 1657 см -1, указывающее α спирали конформацию. Трубчатые структуры, образованные пептида NH 2-Phe-Phe-OH (2 мг / мл, 50% этанол) показал две отличительные пики, по одному на 1613 см -1, а другой на 1682 см -1. Эти пики коррелирует остроумие ха-β-лист вторичная структура. ИК-спектр молекулярно-биологических ожерелья, образованных coassembly из двух пептидов, отличалась от назначения для каждого отдельного пептида, как он включает два пика: один пик при 1653 см -1, что соответствует с спиральной структуры α и другой пик в 1684 см -1, которые имеют отношение к β-поворота конформации (рис. 4) 48. Разница между различными спектрами указывает уникальную структуру для молекулярно-биологических ожерелья.

Рисунок 1. Coassembly пептидов NH 2-Phe-Phe-OH и Boc-Phe-Phe-OH. Схематическое изображение процесса coassembly.
в "FO: Пребывание" / files/ftp_upload/50946/50946fig2highres.jpg "Первоначально" / files/ftp_upload/50946/50946fig2.jpg "/>
Рисунок 2. Электронная микроскопия анализ молекулярных ожерелий; А) и В) SEM микрофотографии; C) ПЭМ микрофотография.
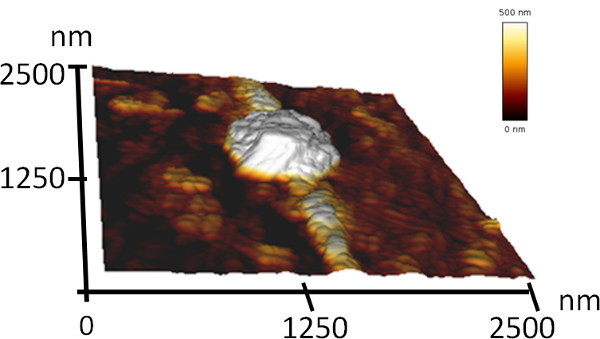
Рисунок 3. Трехмерная топография АСМ изображение молекулярных ожерелий.

Рисунок 4. ИК-анализ различных самособирающихся структур. ИК-спектр, полученный из образца сфер, образованных Boc-Phe-Phe-OH (красный), в трубчатых структур FOrmed на NH 2-Phe-Phe-OH (зеленый) и молекулярных ожерелий, образованных coassembly этих двух пептидов (фиолетовый).
Обсуждение
Таким образом, эта статья демонстрирует легкость, в котором на основе пептидов сборки могут быть сформированы в пробирке. Процесс включает в себя коммерчески доступные пептиды и растворители, и это происходит спонтанно в условиях окружающей среды, при добавлении полярном растворителе в пробирке. Очень важно использовать HFP качестве растворителя пептидов, из-за низкой растворимости пептидов в других органических растворителей. Кроме того, из-за высокой летучести HFP необходимо готовить свежий исходный раствор для каждого эксперимента. Кроме того, объем исходного раствора должна быть выше, чем 10 мкл и передача растворенного пептида в полярном растворителе (воде) должно быть сделано быстро.
Следует отметить, что этот способ для сольватации и самосборки пептида является одним из возможных подходов, как правило, используется для этих ароматических пептидов. Другие подходы, однако, это возможно. Кроме того, концентрация фондовой Solut ион пептида в HFP высока в этих экспериментах, чтобы минимизировать концентрацию ГФП в конечном растворе.
Эта рукопись также представлены некоторые из основных методов для характеризации на основе пептидов структур, таких как АСМ, ПЭМ, РЭМ, и ИК-Фурье. Используя методы микроскопии можно получить информацию о морфологии агрегатов. Поскольку размеры этих сборок в пределах от сотен нанометров до нескольких микрон, то достаточно использовать стандартную электронной микроскопии для их идентификации. Микроскопы сверхвысокого разрешения было бы полезно для структур, которые меньше 100 нм в диаметре и когда изображений без проводящего покрытия (например золото) желательно. В некоторых случаях зарядка структур электронным пучком электронного микроскопа может произойти из-за органической природы структуры. Это может быть решена за счет снижения напряжения в операционной системе.
т "> Дополнительный анализ, ИК-Фурье спектроскопии, является методом среднего разрешения, который предоставляет информацию о вторичной структуре сборок. В этой рукописи, измерения проводились на сухих образцов, однако можно изучать структуру сборок в растворе фазе с использованием жидкости клетку.Взятые вместе, подход, представленный здесь самосборки пептидов может быть адаптирована к другим классам пептидов и может привести к лучшему пониманию сил и взаимодействий в процессе. Кроме того, это также может привести к образованию новых молекулярно-биологических сборок.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Эта работа была поддержана Марии Кюри Международного реинтеграции Грант и Фондом немецко-Израиль. Мы признаем, г-Яир Razvag для анализа АСМ.
Материалы
| Name | Company | Catalog Number | Comments |
| NH2-Phe-Phe-OH | Bachem | G-2925.0001 | |
| Boc-Phe-Phe-OH | Bachem | A-3205.0005 | |
| 1,1,1,3,3,3-hexafluoro-2-propanol | Sigma-Aldrich | 52512-100ML | |
| Ethanol absolute (Dehydrated) AR sterile | Bio-Lab Ltd. | 52555 | Blending with TDW for the preparation of 50% solution |
| Uranyl acetate | Sigma-Aldrich | 73943 | For negative staining. It is possible to work without it. |
| glass cover slip | Marienfeld Laboratory Glassware | 110590 | |
| TEM grids | Electron Microscopy Sciences | FCF200-Cu-50 | Formvar/Carbon 200 Mesh, Cu |
| Quantitive filter paper | Whatman | 1001055 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich | 151882-100G | 99.9 atom % D |
| CaF2 window | PIKE Technologies | 160-1212 | 25 mm x 2 mm window. For FT-IR measurments |
| AFM tips | NanoScience Instruments | CFMR | Aspire probes, CFMR-25 series |
| Filter units | Millipore | SLGV033RS | Millex-GV, 0.22 μm, PVDF, 33 mm, gamma sterilized |
| SEM | FEI | Quanta 200 ESEM | |
| TEM | FEI | Tecnai T12 G2 Spirit | |
| AFM | JPK Instruments | A JPK NanoWizard3 | |
| FT-IR | Thermo Fisher Scientific | Nicolet 6700 advanced gold spectrometer | |
| FT-IR Purge | Parker | BALSTON FT-IR Purge Gas Generator model 75-52 | |
| OMNIC (Nicolet) software | Thermo Nicolet Corporation | For FT-IR spectra analysis | |
| Vortex mixer | Wisd Laboratory Equipment | ViseMix VM | |
| Weight | Mettler Toledo | NewClassic MS | |
| Sputter coater | Polaron | SC7640 Sputter Coater |
Ссылки
- Rajagopal, K., Schneider, J. P. Self-assembling peptides and proteins for nanotechnological applications. Curr. Opin. Struc. Biol. 14, 480-486 (2004).
- Ulijn, R. V., Smith, A. M. Designing peptide based nanomaterials. Chem. Soc. Rev. 37, 664-675 (2008).
- Bong, D. T., Clark, T. D., Granja, J. R., Ghadiri, M. R. Self-assembling organic nanotubes. Angew. Chem. Int. Ed. 40, 988-1011 (2001).
- Vauthey, S., Santoso, S., Gong, H. Y., Watson, N., Zhang, S. G. Molecular self-assembly of surfactant-like peptides to form nanotubes and nanovesicles. P. Natl. Acad. Sci. U.S.A. 99, 5355-5360 (2002).
- Matsui, H., Gologan, B. Crystalline glycylglycine bolaamphiphile tubules and their pH-sensitive structural transformation. J. Phys. Chem. B. 104, 3383-3386 (2000).
- Hartgerink, J. D., Beniash, E., Stupp, S. I. Self-assembly and mineralization of peptide-amphiphile nanofibers. Science. 294, 1684-1688 (2001).
- Reches, M., Gazit, E. Casting metal nanowires within discrete self-assembled peptide nanotubes. Science. 300, 625-627 (2003).
- Reches, M., Gazit, E. Molecular self-assembly of peptide nanostructures: mechanism of association and potential uses. Curr. Nanosci. 2, 105-111 (2006).
- Yuran, S., Razvag, Y., Reches, M. Coassembly of Aromatic Dipeptides into Biomolecular Necklaces. ACS Nano. 6, 9559-9566 (2012).
- Zhang, S. G. Emerging biological materials through molecular self-assembly. Biotechnol. Adv. 20, 321-339 (2002).
- Zhang, S. G. Fabrication of novel biomaterials through molecular self-assembly. Nat. Biotechnol. 21, 1171-1178 (2003).
- Hartgerink, J. D., Granja, J. R., Milligan, R. A., Ghadiri, M. R. Self-assembling peptide nanotubes. J. Am. Chem. Soc. 118, 43-50 (1996).
- Holmes, T. C., et al. Extensive neurite outgrowth and active synapse formation on self-assembling peptide scaffolds. P. Natl. Acad. Sci. U.S.A. 97, 6728-6733 (2000).
- Santoso, S., Hwang, W., Hartman, H., Zhang, S. G. Self-assembly of surfactant-like peptides with variable glycine tails to form nanotubes and nanovesicles. Nano Lett. 2, 687-691 (2002).
- Bellomo, E. G., Wyrsta, M. D., Pakstis, L., Pochan, D. J., Deming, T. J. Stimuli-responsive polypeptide vesicles by conformation-specific assembly. Nat. Mater. 3, 244-248 (2004).
- Reches, M., Gazit, E. Formation of closed-cage nanostructures by self-assembly of aromatic dipeptides. Nano Lett. 4, 581-585 (2004).
- Reches, M., Gazit, E. Self-assembly of peptide nanotubes and amyloid-like structures by charged-termini-capped diphenylalanine peptide analogues. Isr. J. Chem. 45, 363-371 (2005).
- Park, J., Kahng, B., Kamm, R. D., Hwang, W. Atomistic simulation approach to a continuum description of self-assembled beta-sheet filaments. Biophys. J. 90, 2510-2524 (2006).
- Yan, X., et al. Reversible transitions between peptide nanotubes and vesicle-like structures including theoretical modeling studies. ChemEur. J. 14, 5974-5980 (2008).
- Yan, X., et al. Transition of cationic dipeptide nanotubes into vesicles and oligonucleotide delivery. Angew. Chem. Int. Ed. 46, 2431-2434 (2007).
- Burkoth, T. S., et al. Structure of the beta-amyloid (10-35) fibril. J. Am. Chem. Soc. 122 (10-35), 7883-7889 (2000).
- Aggeli, A., et al. Hierarchical self-assembly of chiral rod-like molecules as a model for peptide beta-sheet tapes, ribbons, fibrils, and fibers. P. Natl. Acad. Sci. U.S.A. 98, 11857-11862 (2001).
- Hamley, I. W. Peptide fibrillization. Angew. Chem. Int. Ed. 46, 8128-8147 (2007).
- Maji, S. K., Haldar, D., Drew, M. G. B., Banerjee, A., Das, A. K. Self-assembly of beta-turn forming synthetic tripeptides into supramolecular beta-sheets and amyloid-like fibrils in the solid state. Tetrahedron. 60, 3251-3259 (2004).
- Jahn, T. R., Parker, M. J., Homans, S. W., Radford, S. E. Amyloid formation under physiological conditions proceeds via a native-like folding intermediate. Nat. Struct. Mol. Biol. 13, 195-201 (2006).
- Shimada, T., Sakamoto, N., Motokawa, R., Koizumi, S., Tirrell, M. Self-assembly process of peptide amphiphile worm-like micelles. J. Phys. Chem. B. 116, 240-243 (2012).
- Sedman, V. L., et al. Surface-templated fibril growth of peptide fragments from the shaft domain of the adenovirus fibre protein. Protein Pept. Lett. 18, 268-274 (2011).
- Choi, S. -j, et al. Differential self-assembly behaviors of cyclic and linear peptides. Biomacromolecules. 13, 1991-1995 (2012).
- Ghosh, S., Reches, M., Gazit, E., Verma, S. Bioinspired design of nanocages by self-assembling triskelion peptide elements. Angew. Chem. Int. Ed. 46, 2002-2004 (2007).
- Li, L. C., et al. Self-assembling nanotubes consisting of rigid cyclic gamma-peptides. Adv. Funct. Mater. 22, 3051-3056 (2012).
- Krysmann, M. J., et al. Self-assembly of peptide nanotubes in an organic solvent. Langmuir. 24, 8158-8162 (2008).
- Segman-Magidovich, S., et al. Sheet-like assemblies of charged amphiphilic alpha/beta-peptides at the air-water interface. ChemEur. J. 17, 14857-14866 (2011).
- Jayawarna, V., et al. Nanostructured hydrogels for three-dimensional cell culture through self-assembly of fluorenylmethoxycarbonyl-dipeptides. Adv. Mater. 18, 611-614 (2006).
- Mahler, A., Reches, M., Rechter, M., Cohen, S., Gazit, E. Rigid, self-assembled hydrogel composed of a modified aromatic dipeptide. Adv. Mater. 18, 1365-1368 (2006).
- Ryan, D. M., Doran, T. M., Anderson, S. B., Nilsson, B. L. Effect of C-terminal modification on the self-assembly and hydrogelation of fluorinated Fmoc-Phe derivatives. Langmuir. 27, 4029-4039 (2011).
- Jung, J. P., Gasiorowski, J. Z., Collier, J. H. Fibrillar peptide gels in biotechnology and biomedicine. Biopolymers. 94, 49-59 (2010).
- Xing, B. G., et al. Hydrophobic interaction and hydrogen bonding cooperatively confer a vancomycin hydrogel: A potential candidate for biomaterials. J. Am. Chem. Soc. 124, 14846-14847 (2002).
- Gore, T., Dori, Y., Talmon, Y., Tirrell, M., Bianco-Peled, H. Self-assembly of model collagen peptide amphiphiles. Langmuir. 17, 5352-5360 (2001).
- Ashkenasy, N., Horne, W. S., Ghadiri, M. R. Design of self-assembling peptide nanotubes with delocalized electronic states. Small. 2, 99-102 (2006).
- Mizrahi, M., Zakrassov, A., Lerner-Yardeni, J., Ashkenasy, N. Charge transport in vertically aligned, self-assembled peptide nanotube junctions. Nanoscale. 4, 518-524 (2012).
- Ryu, J., Lim, S. Y., Park, C. B. Photoluminescent peptide nanotubles. Adv. Mater. 21, 1577-1581 (2009).
- Ryu, J., Kim, S. -W., Kang, K., Park, C. B. Synthesis of diphenylalanine/cobalt oxide hybrid nanowires and their application to energy storage. ACS Nano. 4, 159-164 (2010).
- Yan, X., Zhu, P., Li, J. Self-assembly and application of diphenylalanine-based nanostructures. Chem. Soc. Rev. 39, 1877-1890 (2010).
- Amdursky, N., et al. Blue luminescence based on quantum confinement at peptide nanotubes. Nano Lett. 9, 3111-3115 (2009).
- Maity, S., Jana, P., Maity, S. K., Haldar, D. Mesoporous vesicles from supramolecular helical peptide as drug carrier. Soft Matter. 7, 10174-10181 (2011).
- Adler-Abramovich, L., et al. Self-assembled organic nanostructures with metallic-like stiffness. Angew. Chem. Int. Ed. 49, 9939-9942 (2010).
- Pelton, J. T., McLean, L. R. Spectroscopic methods for analysis of protein secondary structure. Anal. Biochem. 277, 167-176 (2000).
- Haris, P. I., Chapman, D. The conformational analysis of peptides using fourier-transform IR spectroscopy. Biopolymers. 37, 251-263 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены