Method Article
Formation de structures ordonnées biomoléculaires par l'auto-assemblage de peptides courts
Dans cet article
Résumé
Ce document décrit la formation de structures à base de peptides hautement ordonnés par le processus spontané d'auto-assemblage. Le procédé utilise des peptides disponibles dans le commerce et l'équipement de laboratoire commun. Cette technique peut être appliquée à une grande variété de peptides et peut conduire à la découverte de nouveaux assemblages à base de peptides.
Résumé
Dans la nature, des structures fonctionnelles complexes sont formés par l'auto-assemblage de biomolécules dans des conditions douces. Comprendre les forces qui contrôlent l'auto-assemblage et en imitant ce processus in vitro apportera des avancées majeures dans les domaines de la science des matériaux et de la nanotechnologie. Parmi les blocs de construction disponibles biologique, les peptides ont plusieurs avantages, car ils présentent une importante diversité, leur synthèse à grande échelle est simple, et ils peuvent facilement être modifiées avec des entités biologiques et chimiques 1,2. Plusieurs classes de peptides conçus comme des peptides cycliques, des peptides amphiphiles et des conjugués peptide-s'auto-assembler en structures ordonnées en solution. Dipeptides homoaromatiques, sont une classe de peptides auto-assemblés courtes qui contiennent toutes les informations nécessaires moléculaire pour former des structures ordonnées telles que les nanotubes, des sphères et des fibrilles 8.3. Une grande variété de ces peptides est disponible dans le commerce. 9 Les protocoles présentés ici peuvent être adaptées à d'autres classes de peptides ou des blocs de construction biologique et peuvent potentiellement conduire à la découverte de nouvelles structures à base de peptides et d'un meilleur contrôle de leur assemblage.
Introduction
formes de la nature et des structures ordonnées fonctionnelle par le processus de l'auto-assemblage biomoléculaire. Comprendre les forces qui régissent ce processus spontané peut conduire à la capacité d'imiter l'auto-assemblage in vitro et par conséquent à des avancées majeures dans le domaine des sciences des matériaux 10,11. Peptides, en particulier, sont très prometteurs comme un bloc de construction biomoléculaire, car ils présentent grande diversité structurelle, la facilité de la synthèse chimique, et peuvent facilement être fonctionnalisés avec des entités biologiques et chimiques. Le domaine de peptide auto-assemblage a été lancée par Ghadiri et ses collègues, qui ont manifesté l'auto-assemblage de nanotubes de peptides par des peptides cycliques avec une alternance de D-et L-acides aminés 12. D'autres approches réussies à la conception d'ensembles de peptides comprennent des peptides linéaires de bolaamphiphile 5, amphiphiles (AP) 6, les peptides non conjugués auto-complémentaires ioniques 13, les peptides de type tensioactif 4,14, et deux blocs copolypeptides 15.
Une approche plus récente consiste à l'auto-assemblage de peptides courts aromatiques, appelé dipeptides homoaromatiques. Ces peptides comprennent seulement deux acides aminés avec la nature aromatique (par exemple, Phe-Phe, le dicarbonate de tert-butyle (Boc)-Phe-Phe) 7,8,16-21. Les structures formées par ces peptides homoaromatiques comprennent des structures tubulaires, des sphères, des assemblages en forme de feuilles et de fibres 6,8,15,21-32. Les fibres dans certains cas de générer un treillis de fibrilles qui donne un hydrogel de 33 à 37. Ces assemblées ont été exploitées pour des applications de biocapteurs, administration de médicaments, l'électronique moléculaire, etc 38-45.
Ce document décrit les étapes expérimentales nécessaires pour commencer l'auto-assemblage spontané de peptides homoaromatiques. En outre, elle présente le processus de peptide co-assemblage. Ce processus implique l'auto-assemblage de plus d'un type de peptidemonomère.
Notre démonstration comprend le co-assemblage de deux peptides disponibles dans le commerce: le peptide diphénylalanine (NH 2-Phe-Phe-COOH) et son analogue protégé Boc (Boc-Phe-Phe-OH). Chacun des peptides s'auto-assemble en une structure supramoléculaire: les formulaires diphénylalanine peptidiques assemblages tubulaires et les Boc-Phe-Phe-OH peptides s'auto-assemble en soit des sphères ou des fibres en fonction du solvant 7,17,46. Nous avons mélangé les deux peptides dans certains ratios et caractérisé les assemblées entraîné par microscopie électronique, la microscopie à force et la spectroscopie FT-IR. Les méthodes ont démontré la formation d'une structure à base de peptide qui est constitué d'éléments sphériques ayant un diamètre de quelques microns (1-4 um) qui sont reliées par des assemblages de forme allongée d'un diamètre de quelques centaines de nanomètres (~ 300 à 800 nm) . Les assemblages ressemblent cordes perlées dans leur morphologie, les structures sphériques semblent être vissé sur leensembles allongés. Nous avons appelé donc ces ensembles "colliers" biomoléculaires. Les "colliers biomoléculaires» pourraient servir de nouveau biomatériau, comme un agent de l'administration de médicaments ou comme un échafaudage pour des applications électroniques. De plus, la procédure qui conduit à l'auto-assemblage des peptides peut être utilisé avec d'autres classes de peptides et de biomolécules. Elle peut conduire à une meilleure compréhension des forces impliquées dans l'auto-assemblage et la formation de nouvelles structures ordonnées.
Protocole
Une. L'auto-assemblage de homoaromatiques Dipeptides
- Peser le peptide souhaité sous sa forme lyophilisée (par exemple, NH 2-Phe-Phe-OH, Boc-Phe-Phe-COOH) et de préparer une solution mère en dissolvant le peptide dans du 1,1,1,3,3,3-hexafluoro -2-propanol (HFP) à la concentration appropriée (par exemple 100 mg / ml de NH 2-Phe-Phe-OH et Boc-Phe-Phe-COOH) 7,17,46.
- Mélanger la solution avec vortex et place sur le banc jusqu'à ce que le peptide est complètement dissous et la solution semble clair (quelques minutes).
- Diluer la solution de peptide de magasin, avec un solvant approprié, à la concentration appropriée (par exemple, 2 mg / ml de NH 2-Phe-Phe-OH dans de l'eau distillée triple (TDW) pour la formation de nanotubes, en ajoutant 2 ul du peptide solution mère à 98 ul TDW, 5 mg / ml de Boc-Phe-Phe-COOH dans l'éthanol pour la formation de structures sphériques).
- Conserver la solution à température ambiante pendant 24h.
- Afin d'éviter toute preaggregation, préparer des solutions mères fraîches pour chaque expérience.
2. Co-assemblage de deux dipeptides homoaromatiques
- Préparer une solution de 50% d'éthanol en mélangeant des volumes égaux d'éthanol absolu et TDW. Utilisez vortex pour mélanger les deux solutions.
- Peser 2 mg du peptide NH 2-Phe-Phe-OH et 1 mg du peptide Boc-Phe-Phe-OH. Dissoudre chaque peptide dans HFP à une concentration de 100 mg / ml.
- Mélanger les peptides solutions d'aide vortex et les placer sur le banc jusqu'à ce que les peptides sont complètement dissous et les solutions semblent claires.
- Mélanger les peptides solutions d'actions à la proportion souhaitée. Dans cette expérience spécifique mélanger 10 ul de peptide NH2-Phe-Phe-OH avec 6 pi du peptide Boc-Phe-Phe-OH (à un rapport final de 05:03 respectivement). En raison de la forte volatilité du solvant HFP, il est recommandé de préparer une grande quantité de cette solution mère (à least 10 pi).
- Utilisez vortex pour mélanger la solution stock de peptides mélangés.
- Diluer la solution mère de peptides mélangés avec 50% d'éthanol à la concentration finale souhaitée. Dans cette expérience particulière, de manière à obtenir une concentration finale de 5 mg / ml de NH 2-Phe-Phe-OH et 3 mg / ml de Boc-Phe-Phe-OH respectivement, ajouter 8 l de la solution mère des peptides mélangés à 92 ul de la solution d'éthanol à 50%. Utiliser une pipette pour mélanger doucement la solution.
- Conserver la solution à température ambiante pendant 24 heures.
- Il convient de noter qu'en raison de la nature très volatile du solvant, les expériences sont sensibles à de petits changements dans la concentration des peptides. Par conséquent, les solutions de base fraîches doivent être préparées pour chaque expérience.
3. Caractérisation des structures auto-assemblées à l'aide microscopie électronique à balayage (MEB)
- Après 24 heures d'incubation, appliquer une goutte de 10 ul de la solution de peptides sur une crique de verrer glissement sec et à température ambiante.
- Manteau de l'échantillon sur le verre avec une couche mince d'or (quelques nanomètres) à l'aide d'une coucheuse par pulvérisation cathodique pendant 90 sec.
- L'image des assemblées à l'aide de SEM fonctionnant à 10-20 kV.
4. Caractérisation des structures auto-assemblées à l'aide microscopie électronique à transmission (MET)
- Placer une goutte de 10 ul de la solution de peptides sur une grille de cuivre à 200 mailles recouverte de carbone et stabilisé par un support de film polymère.
- Après 1 min enlever le liquide en excès avec un papier filtre.
- Préparer une solution de 2% d'acétate d'uranyle dans TDW. Filtrer la solution à l'aide de l'unité de filtre de 0,22 um.
- Pour colorer l'échantillon (coloration négative), déposer une goutte de 10 solution d'acétate d'uranyle pi sur la grille.
- Après 30 sec enlever l'excès de liquide avec un papier filtre. Il convient de noter que, bien que la coloration négative améliore le contraste de l'image, il n'est pas indispensable dans tous les cas.
- L'image de l'échantillon sur ee grille par TEM fonctionnant à 120 kV.
5. Caractérisation tridimensionnelle des assemblées par microscopie à force atomique (AFM)
- Préparer un échantillon pour l'analyse de l'AFM en utilisant la procédure décrite au paragraphe 3.1.
- Analyser l'échantillon sur le verre à l'aide d'un instrument AFM fonctionnant en mode AC. Utilisation cantilevers de silicium avec une constante de rappel de 3 N / m et une fréquence de résonance de 75 kHz.
- Commencer par balayage d'une grande surface de la grille, afin de trouver la structure désirée. Puis se concentrer sur une zone spécifique plus petit et le scanner (la taille de balayage est de 2,5 um x 2,5 um pour l'image incluse dans ce manuscrit).
6. La caractérisation de la structure secondaire par FT-IR
- Appliquer une goutte de 30 ul de la solution de peptides à une fenêtre de CaF 2.
- Laisser sécher la solution à la température ambiante.
- L'adsorption de l'eau dans le spectre IR est à 1650 cm -1.Ce pic est au centre de la bande amide I de la liaison peptidique. Il est également un pic typique pour structures α-hélicoïdale de peptides et de protéines 47. Afin de surmonter ce problème et éviter le signal de l'eau, un échange hydrogène-deutérium-à doit être effectuée. Placer une goutte de l'oxyde de deutérium (D 2 O) sur l'échantillon de peptide séché. La chute doit être suffisamment grand pour recouvrir complètement le dépôt de peptide sur la fenêtre.
- Laisser l'échantillon à sécher sous vide.
- Répéter les étapes 6.3 et 6.4 pour assurer un échange 2x maximale hydrogène-à-deutérium. Enregistrer l'échantillon sous vide jusqu'à son analyse.
- Enregistrer les spectres FT-IR en utilisant un sulfate de triglycine deutéré (DTGS) de détecteur. Le système FT-IR comprend un générateur de gaz de purge, afin d'empêcher l'humidité dans les environs de l'échantillon. Pour les échantillons de peptides courts, il est préférable d'analyser l'échantillon 2000 x à une résolution de 4 cm -1. Les valeurs minimales de transmittance peuvent être déterminées par la manièreftware fourni avec l'instrument.
Résultats
Ce document décrit un procédé pour la formation de structures ordonnées à la nano-échelle micrométrique et par l'auto-assemblage des peptides. Afin de démontrer ce processus simple, nous présentons et caractériser le co-assemblage de deux peptides aromatiques simples (figure 1). L'un des peptides est la NH 2-Phe-Phe-OH (diphénylalanine) peptide, qui peut s'auto-assembler en une solution aqueuse dans des structures tubulaires creuses de dimensions nanométriques 7. L'autre peptide est l'analogue protégé Boc, Boc-Phe-Phe-OH. Ce peptide peut former des structures fibrillaires dans des solutions aqueuses et des assemblages sphériques dans l'éthanol 17,46. Nous avons supposé que ces peptides seraient co-assemblent en une structure qui combine les deux éléments mentionnés. En utilisant une analyse SEM, nous avons révélé que les peptides mixtes formés d'une architecture d'assemblages sphériques avec un diamètre de quelques microns reliés par des structures allongées d'un diamètre de quelques hundrnanomètres ed (Figure 2). En raison de la grande ressemblance morphologique à cordes perlées, nous avons appelé ces structures "colliers moléculaires". analyse de l'AFM de ces structures a clairement démontré leur disposition tridimensionnelle (Figure 3). En outre, l'analyse MEB des différentes régions de différents échantillons indique que ce processus s'est produite avec un rendement élevé (Figure 2b).
Analyse FT-IR a fourni des informations sur la structure secondaire des ensembles de peptides. Le spectre de la bande amide I des assemblages sphériques formés par le peptide Boc-Phe-Phe-OH (5 mg / ml, éthanol 50%), l'absorbance en évidence qu'un seul pic à l'amide I 1657 cm -1 indiquant une conformation de l'hélice α. Les structures tubulaires formées par le peptide NH 2-Phe-Phe-OH (2 mg / ml, éthanol 50%) ont montré deux pics distincts, l'un à 1 613 cm -1 et l'autre à 1682 cm -1. Ces pics corrélés esprit ha β-feuille de la structure secondaire. Le spectre FT-IR des colliers biomoléculaires, formés par la co-assemblage des deux peptides, différente de l'affectation pour chaque peptide individuel tel qu'il comprend deux pics: un pic à 1653 cm -1, ce qui correspond à une structure d'hélice α et un autre pic à 1684 cm-1 qui se rapporte à une conformation β-tour (figure 4) 48. La différence entre les différents spectres indique une structure unique pour des colliers biomoléculaires.

Figure 1. Co-assemblage des peptides NH 2-Phe-Phe-OH et Boc-Phe-Phe-OH. Illustration schématique du processus de co-assemblage.
dans "fo: src =" / files/ftp_upload/50946/50946fig2highres.jpg "src =" / files/ftp_upload/50946/50946fig2.jpg "/>
Figure 2. Analyse par microscopie électronique des colliers moléculaires; A) et B) micrographies MEB, C) Une micrographie TEM.
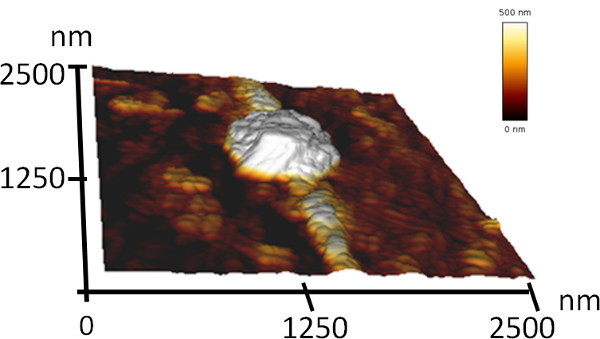
Figure 3. Image tridimensionnelle topographie AFM des colliers moléculaires.

Figure 4. Une analyse FT-IR des différentes structures auto-assemblées. Spectre FT-IR obtenu à partir de l'échantillon des sphères formées par Boc-Phe-Phe-OH (rouge), la structure tubulaire fOrmed par NH 2-Phe-Phe-OH (vert) et les colliers moléculaires formées par le co-assemblage de ces deux peptides (violets).
Discussion
En résumé, ce document montre la facilité avec laquelle les assemblages à base de peptides peuvent être formés in vitro. Le procédé implique des peptides et des solvants disponibles dans le commerce, et il se produit spontanément dans les conditions ambiantes, lors de l'addition d'un solvant polaire pour le tube à essai. Il est essentiel d'utiliser un solvant HFP comme des peptides, en raison de la faible solubilité des peptides dans d'autres solvants organiques. En outre, en raison de la forte volatilité des HFP il est nécessaire de préparer une solution de pâte fraîche pour chaque expérience. En outre, le volume de la solution de réserve doit être supérieure à 10 ul et le transfert du peptide dissous dans le solvant polaire (eau) qui doit être fait rapidement.
Il est à noter que cette méthode pour la solvatation et l'auto-assemblage du peptide est une approche possible, typiquement utilisé pour ces peptides aromatiques. D'autres approches sont cependant possibles. En outre, la concentration du stock solut ion du peptide en HFP est élevée dans ces expériences, afin de minimiser la concentration du HFP dans la solution finale.
Ce manuscrit présente également certaines des principales techniques pour la caractérisation des structures à base de peptides, comme l'AFM, TEM, SEM, et FT-IR. En utilisant des techniques de microscopie, il est possible d'obtenir des informations sur la morphologie des assemblages. Comme les dimensions de ces assemblages aller de quelques centaines de nanomètres à plusieurs microns, il est suffisant d'utiliser la microscopie électronique standard pour leur caractérisation. Microscopes ultra-haute résolution serait utile pour des structures qui sont inférieures à 100 nm de diamètre et lorsque l'imagerie sans un revêtement conducteur (par exemple en or) est souhaitée. Dans certains cas, le chargement des structures de par le faisceau d'électrons du microscope électronique peut se produire en raison de la nature biologique de la structure. Ceci peut être résolu par l'abaissement de la tension du système d'exploitation.
t "> analyse complémentaires, la spectroscopie FT-IR, est une méthode de résolution moyenne qui fournit des informations sur la structure secondaire des ensembles. Dans ce manuscrit, les mesures ont été effectuées sur des échantillons secs, mais il est possible d'étudier la structure des assemblages dans la solution de phase en utilisant une cellule de fluide.Dans l'ensemble, l'approche présentée ici pour l'auto-assemblage de peptides peut être adapté à d'autres classes de peptides et pourrait conduire à une meilleure compréhension des forces et des interactions au cours du processus. En outre, elle peut aussi conduire à la formation de nouveaux assemblages biomoléculaires.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Ce travail a été soutenu par la réintégration internationale Marie Curie Grant et par la Fondation allemande Israël. Nous reconnaissons M. Yair Razvag pour l'analyse AFM.
matériels
| Name | Company | Catalog Number | Comments |
| NH2-Phe-Phe-OH | Bachem | G-2925.0001 | |
| Boc-Phe-Phe-OH | Bachem | A-3205.0005 | |
| 1,1,1,3,3,3-hexafluoro-2-propanol | Sigma-Aldrich | 52512-100ML | |
| Ethanol absolute (Dehydrated) AR sterile | Bio-Lab Ltd. | 52555 | Blending with TDW for the preparation of 50% solution |
| Uranyl acetate | Sigma-Aldrich | 73943 | For negative staining. It is possible to work without it. |
| glass cover slip | Marienfeld Laboratory Glassware | 110590 | |
| TEM grids | Electron Microscopy Sciences | FCF200-Cu-50 | Formvar/Carbon 200 Mesh, Cu |
| Quantitive filter paper | Whatman | 1001055 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich | 151882-100G | 99.9 atom % D |
| CaF2 window | PIKE Technologies | 160-1212 | 25 mm x 2 mm window. For FT-IR measurments |
| AFM tips | NanoScience Instruments | CFMR | Aspire probes, CFMR-25 series |
| Filter units | Millipore | SLGV033RS | Millex-GV, 0.22 μm, PVDF, 33 mm, gamma sterilized |
| SEM | FEI | Quanta 200 ESEM | |
| TEM | FEI | Tecnai T12 G2 Spirit | |
| AFM | JPK Instruments | A JPK NanoWizard3 | |
| FT-IR | Thermo Fisher Scientific | Nicolet 6700 advanced gold spectrometer | |
| FT-IR Purge | Parker | BALSTON FT-IR Purge Gas Generator model 75-52 | |
| OMNIC (Nicolet) software | Thermo Nicolet Corporation | For FT-IR spectra analysis | |
| Vortex mixer | Wisd Laboratory Equipment | ViseMix VM | |
| Weight | Mettler Toledo | NewClassic MS | |
| Sputter coater | Polaron | SC7640 Sputter Coater |
Références
- Rajagopal, K., Schneider, J. P. Self-assembling peptides and proteins for nanotechnological applications. Curr. Opin. Struc. Biol. 14, 480-486 (2004).
- Ulijn, R. V., Smith, A. M. Designing peptide based nanomaterials. Chem. Soc. Rev. 37, 664-675 (2008).
- Bong, D. T., Clark, T. D., Granja, J. R., Ghadiri, M. R. Self-assembling organic nanotubes. Angew. Chem. Int. Ed. 40, 988-1011 (2001).
- Vauthey, S., Santoso, S., Gong, H. Y., Watson, N., Zhang, S. G. Molecular self-assembly of surfactant-like peptides to form nanotubes and nanovesicles. P. Natl. Acad. Sci. U.S.A. 99, 5355-5360 (2002).
- Matsui, H., Gologan, B. Crystalline glycylglycine bolaamphiphile tubules and their pH-sensitive structural transformation. J. Phys. Chem. B. 104, 3383-3386 (2000).
- Hartgerink, J. D., Beniash, E., Stupp, S. I. Self-assembly and mineralization of peptide-amphiphile nanofibers. Science. 294, 1684-1688 (2001).
- Reches, M., Gazit, E. Casting metal nanowires within discrete self-assembled peptide nanotubes. Science. 300, 625-627 (2003).
- Reches, M., Gazit, E. Molecular self-assembly of peptide nanostructures: mechanism of association and potential uses. Curr. Nanosci. 2, 105-111 (2006).
- Yuran, S., Razvag, Y., Reches, M. Coassembly of Aromatic Dipeptides into Biomolecular Necklaces. ACS Nano. 6, 9559-9566 (2012).
- Zhang, S. G. Emerging biological materials through molecular self-assembly. Biotechnol. Adv. 20, 321-339 (2002).
- Zhang, S. G. Fabrication of novel biomaterials through molecular self-assembly. Nat. Biotechnol. 21, 1171-1178 (2003).
- Hartgerink, J. D., Granja, J. R., Milligan, R. A., Ghadiri, M. R. Self-assembling peptide nanotubes. J. Am. Chem. Soc. 118, 43-50 (1996).
- Holmes, T. C., et al. Extensive neurite outgrowth and active synapse formation on self-assembling peptide scaffolds. P. Natl. Acad. Sci. U.S.A. 97, 6728-6733 (2000).
- Santoso, S., Hwang, W., Hartman, H., Zhang, S. G. Self-assembly of surfactant-like peptides with variable glycine tails to form nanotubes and nanovesicles. Nano Lett. 2, 687-691 (2002).
- Bellomo, E. G., Wyrsta, M. D., Pakstis, L., Pochan, D. J., Deming, T. J. Stimuli-responsive polypeptide vesicles by conformation-specific assembly. Nat. Mater. 3, 244-248 (2004).
- Reches, M., Gazit, E. Formation of closed-cage nanostructures by self-assembly of aromatic dipeptides. Nano Lett. 4, 581-585 (2004).
- Reches, M., Gazit, E. Self-assembly of peptide nanotubes and amyloid-like structures by charged-termini-capped diphenylalanine peptide analogues. Isr. J. Chem. 45, 363-371 (2005).
- Park, J., Kahng, B., Kamm, R. D., Hwang, W. Atomistic simulation approach to a continuum description of self-assembled beta-sheet filaments. Biophys. J. 90, 2510-2524 (2006).
- Yan, X., et al. Reversible transitions between peptide nanotubes and vesicle-like structures including theoretical modeling studies. ChemEur. J. 14, 5974-5980 (2008).
- Yan, X., et al. Transition of cationic dipeptide nanotubes into vesicles and oligonucleotide delivery. Angew. Chem. Int. Ed. 46, 2431-2434 (2007).
- Burkoth, T. S., et al. Structure of the beta-amyloid (10-35) fibril. J. Am. Chem. Soc. 122 (10-35), 7883-7889 (2000).
- Aggeli, A., et al. Hierarchical self-assembly of chiral rod-like molecules as a model for peptide beta-sheet tapes, ribbons, fibrils, and fibers. P. Natl. Acad. Sci. U.S.A. 98, 11857-11862 (2001).
- Hamley, I. W. Peptide fibrillization. Angew. Chem. Int. Ed. 46, 8128-8147 (2007).
- Maji, S. K., Haldar, D., Drew, M. G. B., Banerjee, A., Das, A. K. Self-assembly of beta-turn forming synthetic tripeptides into supramolecular beta-sheets and amyloid-like fibrils in the solid state. Tetrahedron. 60, 3251-3259 (2004).
- Jahn, T. R., Parker, M. J., Homans, S. W., Radford, S. E. Amyloid formation under physiological conditions proceeds via a native-like folding intermediate. Nat. Struct. Mol. Biol. 13, 195-201 (2006).
- Shimada, T., Sakamoto, N., Motokawa, R., Koizumi, S., Tirrell, M. Self-assembly process of peptide amphiphile worm-like micelles. J. Phys. Chem. B. 116, 240-243 (2012).
- Sedman, V. L., et al. Surface-templated fibril growth of peptide fragments from the shaft domain of the adenovirus fibre protein. Protein Pept. Lett. 18, 268-274 (2011).
- Choi, S. -j, et al. Differential self-assembly behaviors of cyclic and linear peptides. Biomacromolecules. 13, 1991-1995 (2012).
- Ghosh, S., Reches, M., Gazit, E., Verma, S. Bioinspired design of nanocages by self-assembling triskelion peptide elements. Angew. Chem. Int. Ed. 46, 2002-2004 (2007).
- Li, L. C., et al. Self-assembling nanotubes consisting of rigid cyclic gamma-peptides. Adv. Funct. Mater. 22, 3051-3056 (2012).
- Krysmann, M. J., et al. Self-assembly of peptide nanotubes in an organic solvent. Langmuir. 24, 8158-8162 (2008).
- Segman-Magidovich, S., et al. Sheet-like assemblies of charged amphiphilic alpha/beta-peptides at the air-water interface. ChemEur. J. 17, 14857-14866 (2011).
- Jayawarna, V., et al. Nanostructured hydrogels for three-dimensional cell culture through self-assembly of fluorenylmethoxycarbonyl-dipeptides. Adv. Mater. 18, 611-614 (2006).
- Mahler, A., Reches, M., Rechter, M., Cohen, S., Gazit, E. Rigid, self-assembled hydrogel composed of a modified aromatic dipeptide. Adv. Mater. 18, 1365-1368 (2006).
- Ryan, D. M., Doran, T. M., Anderson, S. B., Nilsson, B. L. Effect of C-terminal modification on the self-assembly and hydrogelation of fluorinated Fmoc-Phe derivatives. Langmuir. 27, 4029-4039 (2011).
- Jung, J. P., Gasiorowski, J. Z., Collier, J. H. Fibrillar peptide gels in biotechnology and biomedicine. Biopolymers. 94, 49-59 (2010).
- Xing, B. G., et al. Hydrophobic interaction and hydrogen bonding cooperatively confer a vancomycin hydrogel: A potential candidate for biomaterials. J. Am. Chem. Soc. 124, 14846-14847 (2002).
- Gore, T., Dori, Y., Talmon, Y., Tirrell, M., Bianco-Peled, H. Self-assembly of model collagen peptide amphiphiles. Langmuir. 17, 5352-5360 (2001).
- Ashkenasy, N., Horne, W. S., Ghadiri, M. R. Design of self-assembling peptide nanotubes with delocalized electronic states. Small. 2, 99-102 (2006).
- Mizrahi, M., Zakrassov, A., Lerner-Yardeni, J., Ashkenasy, N. Charge transport in vertically aligned, self-assembled peptide nanotube junctions. Nanoscale. 4, 518-524 (2012).
- Ryu, J., Lim, S. Y., Park, C. B. Photoluminescent peptide nanotubles. Adv. Mater. 21, 1577-1581 (2009).
- Ryu, J., Kim, S. -W., Kang, K., Park, C. B. Synthesis of diphenylalanine/cobalt oxide hybrid nanowires and their application to energy storage. ACS Nano. 4, 159-164 (2010).
- Yan, X., Zhu, P., Li, J. Self-assembly and application of diphenylalanine-based nanostructures. Chem. Soc. Rev. 39, 1877-1890 (2010).
- Amdursky, N., et al. Blue luminescence based on quantum confinement at peptide nanotubes. Nano Lett. 9, 3111-3115 (2009).
- Maity, S., Jana, P., Maity, S. K., Haldar, D. Mesoporous vesicles from supramolecular helical peptide as drug carrier. Soft Matter. 7, 10174-10181 (2011).
- Adler-Abramovich, L., et al. Self-assembled organic nanostructures with metallic-like stiffness. Angew. Chem. Int. Ed. 49, 9939-9942 (2010).
- Pelton, J. T., McLean, L. R. Spectroscopic methods for analysis of protein secondary structure. Anal. Biochem. 277, 167-176 (2000).
- Haris, P. I., Chapman, D. The conformational analysis of peptides using fourier-transform IR spectroscopy. Biopolymers. 37, 251-263 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon