Method Article
短いペプチドの自己組織化によって順序付け生体分子構造の形成
要約
本論文では、自己組織化の自発的プロセスによる高度に秩序ペプチドベースの構造の形成を説明しています。この方法は、市販のペプチドおよび共通実験装置を利用しています。この技術は、ペプチドの多種多様に適用することができる、新たなペプチドベースアセンブリの発見につながることができる。
要約
自然界では、複雑な機能的構造は、温和な条件下での生体分子の自己集合により形成される。自己組織化を制御する力を理解し、in vitroで 、このプロセスを模倣することは、材料科学、ナノテクノロジーの分野で大きな進歩をもたらす。それらはかなりの多様性を提示するように、利用可能な生物学的なビルディングブロックの中では、ペプチドは、大規模での合成が簡単であり、いくつかの利点を有し、それらは容易に生物学的および化学的実体1,2で修飾することができる。このような環状ペプチド、両親媒性ペプチドおよびペプチド結合体溶液中の秩序構造に自己組織化するよう設計されたペプチドのいくつかのクラス。ホモ芳香族ジペプチドは、例えば、ナノチューブ、球体及びフィブリル3-8のような秩序構造を形成するのに必要な全ての分子の情報を含むショート自己組織化ペプチドのクラスである。これらのペプチドの多種多様な市販されている。 。9ここに提示プロトコルが潜在的にできるペプチド又は生物学的なビルディング·ブロックの他のクラスに適合することができる新しいペプチドベースの構造の発見に、それらの集合体のよりよい制御につながる。
概要
自然形態は、生体分子の自己組織化のプロセスによって秩序構造と機能。この自発的なプロセスを支配する力を理解することは、in vitroで自己組織化を模倣する能力、その結果、材料科学10,11の分野で大きな進歩をもたらす可能性がある。ペプチドは、具体的には、それらは大きな構造的多様性、化学合成の容易さを提供するため、生体分子の構成要素として大きな期待を保持し、容易に生物学的および化学的実体で官能化することができる。ペプチドの自己集合のフィールドがGhadiri及びD-及びL-アミノ酸12を交互に環状ペプチドによるペプチドナノチューブの自己集合を示した彼の同僚によって開拓された。ペプチド集合体の設計に他の成功したアプローチは、線形bolaamphiphileペプチド5、両親媒性物質(AP)6、非共役自己相補イオン性ペプチド13、界面活性剤様ペプチド、 4,14、およびジブロックコポリ15。
より最近のアプローチは短い芳香族ペプチドの自己組織化を必要とする、ホモ芳香族ジペプチドと呼ばれる。これらのペプチドは、芳香族の性質( 例えば、フェニルアラニン-フェニルアラニン、tert-ブチルジカーボネート(Boc)でのPhe-Pheを- )7,8,16-21のみで2つのアミノ酸を含む。これらのホモ芳香族ペプチドにより形成される構造は、管状構造、球状、板状集合体および繊維6,8,15,21-32が含まれています。いくつかのケースでは繊維がヒドロゲル33-37が得フィブリルメッシュを生成します。これらのアセンブリは、バイオセンシング、薬物送達、分子エレクトロニクスなどのアプリケーションのために利用されている。38〜45
本論文では、ホモ芳香族ペプチドの自発的な自己組織化を開始するために必要とされる実験的な手順について説明します。また、coassemblyペプチドのプロセスを示す。このプロセスは、ペプチドの複数のタイプの自己集合を含むモノマー。
ジフェニルアラニンペプチド(NH 2-Pheを-Pheを-COOH)とそのBocはアナログを保護された(のBoc-Pheを-Pheを-OH):私たちのデモでは、2つの市販のペプチドのcoassemblyが含まれています。溶剤7,17,46に応じて、球または繊維のいずれかにジフェニルアラニンペプチドの形の管状アセンブリおよびBoc-Pheを-Pheを-OHペプチド自己集合:超分子構造へのペプチドの自己集合のそれぞれ。我々は、一定の比率で二つのペプチドを配合し、電子顕微鏡、力顕微鏡法およびFT-IR分光法により得られたアセンブリを特徴とする。方法は、数百ナノメートル(〜300〜800ナノメートル)の直径を有する細長いアセンブリによって接続される数ミクロン(1-4ミクロン)の直径を有する球状の要素から構成されているペプチドベースの構造の形成を示した。球状構造がに螺ているように見えるようにアセンブリは、その形態にビーズの文字列に似ている細長いアセンブリ。そこで我々は、これらのアセンブリ「生体分子ネックレス」と呼ばれる。 「生体分子ネックレスは「薬物送達剤として、または電子的用途のための足場として、新しい生体材料となる恐れがあります。さらに、ペプチドの自己集合をもたらす手順は、ペプチド及び生体分子の他のクラスで利用されてもよい。これは、自己集合し、新しい秩序構造の形成に関与する力のよりよい理解につながる可能性がある。
プロトコル
1。ホモ芳香族ジペプチドの自己組織化
- その凍結乾燥形態( 例えば、NH 2 -フェニルアラニン-フェニルアラニン-OH、をBoc-フェニルアラニン-フェニルアラニン-COOH)で所望のペプチドを秤量し、1,1,1,3,3,3 -ヘキサペプチドを溶解することにより原液を調製-2 -プロパノール7,17,46(NH 2-PheをPheで-OHおよびBoc-Pheを-フェニルアラニン-COOHための例えば 、100 mg / ml)を適当な濃度に(HFP)。
- ペプチドが完全に溶解し、溶液が(数分)明らかであると思われるまで、ベンチに渦と場所を使用して溶液を混合する。
- ペプチドの2μLを加えることで、適切な濃度(ナノチューブの形成のための三次蒸留水にNH 2-Pheを-Pheを-OH(TDW)の例えば 2ミリグラム/ mlに、適切な溶媒を用いて、ペプチドストック溶液を希釈98μLTDW、球状構造を形成するためのエタノール中のBoc-Pheを-Pheを-COOHの5 mg / ml)をへの原液。
- 24室温で溶液を準備しておく時間。
- 任意の事前集計を避けるために、各実験のために新鮮なストック溶液を調製する。
2。二つのホモ芳香族ジペプチドのCoassembly
- TDWと無水エタノールを等量混合し、50%エタノール溶液を調製する。 2溶液を混合し、ボルテックスを使用しています。
- NH 2-Pheを-Pheを-OHペプチドおよびBoc-Pheを-Pheを-OHペプチドの1ミリグラムの2 mgの重量を量る。 100ミリグラム/ mlの濃度にHFPの各ペプチドを溶解する。
- ボルテックスを用いてペプチドストック溶液を混合したペプチドが完全に溶解し、解決策が明確に見えるされるまで、ベンチの上に置きます。
- ペプチドを所望の比率にストック溶液をブレンド。この特定の実験では(それぞれ午前5時03分の最終比)のBoc-Pheを-Pheを-OHペプチドの6μLと、NH 2-Pheを-Pheを-OHペプチドの10μLをブレンド。原因HFP溶媒の揮発性が高いためには、(この原液を大量に用意することをお勧めしますLEAでST 10μL)。
- ブレンドされたペプチドストック溶液を混合する渦を使用してください。
- 所望の最終濃度まで50%エタノールを用いてブレンドしたペプチドストック溶液を希釈する。この特定の実験では、それぞれのBoc-フェニルアラニン-フェニルアラニン-OHためのNH 2 -フェニルアラニン-フェニルアラニン-OHおよび3 mg / mlのために5 mg / mlの終濃度を得るために、ブレンドされたペプチドストック溶液8μlを加える50%エタノール溶液92μlをする。優しく溶液を混合するため、ピペットを使用しています。
- 24時間、この溶液を室温で保管してください。
- それは、溶媒の揮発性の高い性質のために、実験は、ペプチドの濃度の小さな変化に敏感であることに留意すべきである。したがって、新鮮なストック溶液を、各実験のために準備する必要があります。
3。走査型電子顕微鏡(SEM)を用いて自己組織化構造のキャラクタリゼーション
- インキュベーションの24時間後、ガラス入り江に対するペプチド溶液10μl降下を適用RTでRスリップとドライ。
- コート90秒間スパッターコーターを用い、金の薄い層(数ナノメートル)を有するガラス上の試料。
- 画像アセンブリを10から20 kVので作動するSEMを用いて。
4。透過型電子顕微鏡(TEM)を用いて自己組織化構造のキャラクタリゼーション
- 200メッシュの銅グリッドカーボンで覆われ、高分子フィルム支持体によって安定化に対するペプチド溶液10μlの滴を置き。
- 1分後、ろ紙を用いて余分な水分を取り除く。
- TDWの2%酢酸ウラニル溶液を調製。 0.22μmのフィルターユニットを用いて溶液を濾過する。
- サンプル(ネガティブ染色)を染色するために、グリッド上の10μlの酢酸ウラニル溶液の液滴を配置します。
- 30秒後にろ紙を用いて余分な水分を取り除く。これは、ネガティブ染色画像のコントラストを向上するが、それはすべての場合には必須ではないことに留意すべきである。
- 番目の画像上のサンプル120 kVので動作TEMによる電子グリッド。
5。原子間力顕微鏡(AFM)によるアセンブリの三次元キャラ
- パラグラフ3.1に記載した手順を用いてAFM分析のためのサンプルを準備します。
- ACモードで動作し、AFM装置を用いてガラス上の試料を分析する。 3 N / mのバネ定数および75kHzでの共振周波数を有するシリコンカンチレバーを使用する。
- 所望の構造を見つけるために、グリッドの大きな領域を走査することによって開始する。その後、特定の小さな領域に集中し、(スキャンサイズは、画像のために×2.5〜2.5μmであった。この原稿に含まれています)、それをスキャンします。
6。 FT-IRによる二次構造のキャラクタリゼーション
- CaF 2の窓にペプチド溶液30μl降下を適用します。
- 溶液を室温で乾燥させます。
- IRスペクトルにおける水の吸着1,650 cmと-1である。このピークは、ペプチド結合のアミドIバンドの中心にある。また、ペプチドおよびタンパク質47のα-ヘリックス構造の典型的なピークである。この問題を克服し、水のシグナルを回避するために、水素対重水素交換を行わなければならない。乾燥したペプチド試料に重水(D 2 O)のドロップを置きます。低下は完全にウィンドウ上のペプチドの沈殿物をカバーするのに十分な大きさでなければなりません。
- サンプルは真空下で乾燥させます。
- 繰り返しは、最大の水素対重水素交換を確実にするために6.3と6.4倍を繰り返します。その分析まで真空下でサンプルを保存します。
- 重水素化硫酸トリグリシン(DTGS)検出器を用いたFT-IRスペクトルを記録します。 FT-IRシステムは、試料の周囲の湿度を防ぐために、パージガス発生器を含む。短いペプチドのサンプルについては、それを4センチメートル-1の分解能で試料を2000 Xをスキャンすることをお勧めします。透過率の極小値は、そうすることによって決定することができるftware器に付属。
結果
本稿では、ペプチドの自己組織化によるナノおよびマイクロメートルスケールでの秩序構造を形成するための方法を説明します。我々が存在し、この単純なプロセスを示し、2の単純な芳香族ペプチドのcoassembly( 図1)を特徴づけるために。ペプチドの一つは、ナノメートル寸法7を備えた中空の管状構造に水溶液中で自己集合することができ、NH 2-Pheを-Pheを-OH(ジフェニルアラニン)ペプチドである。他のペプチドは、そのBocで保護されたアナログ、のBoc-Pheを-Pheを-OHである。このペプチドは、エタノール17,46水性溶液および球状アセンブリ内の線維状構造を形成することができる。私たちは、これらのペプチドが上記の2つの要素を組み合わせた構造にcoassembleあると想定しています。 SEM分析を用いて、ブレンドのペプチドは、いくつかのhundrの直径を有する細長い構造で接続された数ミクロンの直径を有する球状の組立体の構造を形成していることがわかっEDのナノメートル( 図2)。原因ビーズの文字列への形態の高い類似性のために、我々は、これらの構造「分子ネックレス」と呼ばれる。これらの構造のAFM分析は、明らかにそれらの三次元配置( 図3)を示した。加えて、様々な試料の異なる領域のSEM分析は、このプロセスが高収率( 図2b)が発生したことを示した。
FT-IR分析により、ペプチドアセンブリの二次構造に関する情報を提供した。ペプチドのBoc-フェニルアラニン-フェニルアラニン-OH(5 mg / mlで、50%エタノール)によって形成された球状の組立体のアミドIバンドの吸光度スペクトルはαヘリックスコンホメーションを示す1657センチメートル-1における単一のアミドIのピークを示した。 NH 2-Pheを-フェニルアラニン-OHのペプチド(2 mg / mlで、50%エタノール)によって形成される管状構造は、2つの特徴的なピークが、1682センチメートル少なくとも1613センチメートル一つ-1およびその他-1を示した。これらのピークは、ウィットに相関 HAβシート二次構造。 1653センチメートル-1αへリックス構造と他のピークに対応するで一つのピーク:それは二つのピークを含んでいたように、2つのペプチドのcoassemblyによって形成される生体分子のネックレスのFT-IRスペクトルは、各々のペプチドに対する割り当て異なっ1684センチメートル-1βターンコンフォメーション( 図4)48に関係で。様々なスペクトルの違いは、生体分子のネックレスのためのユニークな構造を示している。

図1。ペプチドはNH 2-PheをPheで-OH-及びBoc-PheをPheで-OH-のCoassembly。coassemblyプロセスの模式図。
「FO:SRC = "中" / files/ftp_upload/50946/50946fig2highres.jpg "SRC =" / files/ftp_upload/50946/50946fig2.jpg />
図2。分子ネックレスの電子顕微鏡分析、A)及びB)のSEM顕微鏡写真、C)TEM顕微鏡写真。
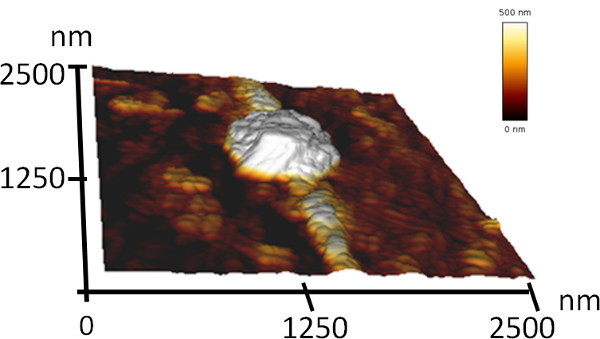
図3。分子ネックレスの三次元原子間力顕微鏡の地形イメージ 。

図4。別の自己集合構造のFT-IR分析 。のBoc-フェニルアラニン - フェニルアラニン-OH(赤)、管状構造fで形成された球の試料から得られたFT-IRスペクトルNH 2-Pheを-フェニルアラニン-OH(緑)、これら二つのペプチド(紫)のcoassemblyによって形成される分子ネックレスによってormed。
ディスカッション
要約すると、本論文では、ペプチドベースのアセンブリはインビトロで形成することができる容易さを示しています。プロセスは、市販のペプチドおよび溶媒を伴い、それは試験管に極性溶媒を添加すると、周囲条件下で自発的に起こる。それは、他の有機溶媒にペプチドの溶解度が低いため、ペプチドの溶媒としてHFPを使用することが重要です。また、HFPの高い揮発性のために、各実験のために新鮮なストック溶液を調製する必要がある。また、原液の量は10μLを超えると極性溶媒(水)中に溶解したペプチドの移動が迅速に行われるべきである必要があります。
これは、ペプチドの溶媒和および自己集合のためのこの方法は、典型的には、これらの芳香族ペプチドを用い、一つの可能なアプローチであることに留意すべきである。他のアプローチは、しかしながら、可能である。また、在庫のsolutを濃度 HFP中のペプチドのイオンは、最終溶液中のHFPの濃度を最小限にするために、これらの実験における高い。
この原稿はまた、AFM、TEM、SEM、およびFT-IRなどのペプチド系構造の特性評価のための主要な技術のいくつかを紹介。顕微鏡技術を使用すると、アセンブリの形態に関する情報を得ることができる。これらのアセンブリの寸法が数百ナノメートルから数ミクロンの範囲であるので、それらの特徴付けのために、標準的な電子顕微鏡を使用することで十分である。超高分解能顕微鏡は、100nm未満の直径以下とするとき、導電性被膜( 例えば 、金)のない撮像が望まれるある構造のために有用であろう。いくつかの場合において、電子顕微鏡の電子ビームによる構造体の帯電は、構造の有機の性質のために生じ得る。これは、オペレーティングシステムの電圧を下げることによって解決することができる。
t "の>追加分析、FT-IR分光法は、アセンブリの二次構造に関する情報を提供する媒体解消方法であり、この論文では、測定は、乾燥サンプルで実施されたが、それは、アセンブリの構造を研究することが可能である流体セルを用いて溶液相である。まとめると、ペプチドの自己集合のためにここに提示アプローチは、ペプチドの他のクラスに適合させることができ、プロセス中の力との相互作用のよりよい理解につながる可能性がある。さらに、それはまた、新たな生体分子集合体の形成をもたらし得る。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
この作品は、マリー·キュリー国際社会復帰グラントにより、ドイツ語·イスラエル財団によってサポートされていました。私たちは、AFM分析のために氏YAIR Razvagを認める。
資料
| Name | Company | Catalog Number | Comments |
| NH2-Phe-Phe-OH | Bachem | G-2925.0001 | |
| Boc-Phe-Phe-OH | Bachem | A-3205.0005 | |
| 1,1,1,3,3,3-hexafluoro-2-propanol | Sigma-Aldrich | 52512-100ML | |
| Ethanol absolute (Dehydrated) AR sterile | Bio-Lab Ltd. | 52555 | Blending with TDW for the preparation of 50% solution |
| Uranyl acetate | Sigma-Aldrich | 73943 | For negative staining. It is possible to work without it. |
| glass cover slip | Marienfeld Laboratory Glassware | 110590 | |
| TEM grids | Electron Microscopy Sciences | FCF200-Cu-50 | Formvar/Carbon 200 Mesh, Cu |
| Quantitive filter paper | Whatman | 1001055 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich | 151882-100G | 99.9 atom % D |
| CaF2 window | PIKE Technologies | 160-1212 | 25 mm x 2 mm window. For FT-IR measurments |
| AFM tips | NanoScience Instruments | CFMR | Aspire probes, CFMR-25 series |
| Filter units | Millipore | SLGV033RS | Millex-GV, 0.22 μm, PVDF, 33 mm, gamma sterilized |
| SEM | FEI | Quanta 200 ESEM | |
| TEM | FEI | Tecnai T12 G2 Spirit | |
| AFM | JPK Instruments | A JPK NanoWizard3 | |
| FT-IR | Thermo Fisher Scientific | Nicolet 6700 advanced gold spectrometer | |
| FT-IR Purge | Parker | BALSTON FT-IR Purge Gas Generator model 75-52 | |
| OMNIC (Nicolet) software | Thermo Nicolet Corporation | For FT-IR spectra analysis | |
| Vortex mixer | Wisd Laboratory Equipment | ViseMix VM | |
| Weight | Mettler Toledo | NewClassic MS | |
| Sputter coater | Polaron | SC7640 Sputter Coater |
参考文献
- Rajagopal, K., Schneider, J. P. Self-assembling peptides and proteins for nanotechnological applications. Curr. Opin. Struc. Biol. 14, 480-486 (2004).
- Ulijn, R. V., Smith, A. M. Designing peptide based nanomaterials. Chem. Soc. Rev. 37, 664-675 (2008).
- Bong, D. T., Clark, T. D., Granja, J. R., Ghadiri, M. R. Self-assembling organic nanotubes. Angew. Chem. Int. Ed. 40, 988-1011 (2001).
- Vauthey, S., Santoso, S., Gong, H. Y., Watson, N., Zhang, S. G. Molecular self-assembly of surfactant-like peptides to form nanotubes and nanovesicles. P. Natl. Acad. Sci. U.S.A. 99, 5355-5360 (2002).
- Matsui, H., Gologan, B. Crystalline glycylglycine bolaamphiphile tubules and their pH-sensitive structural transformation. J. Phys. Chem. B. 104, 3383-3386 (2000).
- Hartgerink, J. D., Beniash, E., Stupp, S. I. Self-assembly and mineralization of peptide-amphiphile nanofibers. Science. 294, 1684-1688 (2001).
- Reches, M., Gazit, E. Casting metal nanowires within discrete self-assembled peptide nanotubes. Science. 300, 625-627 (2003).
- Reches, M., Gazit, E. Molecular self-assembly of peptide nanostructures: mechanism of association and potential uses. Curr. Nanosci. 2, 105-111 (2006).
- Yuran, S., Razvag, Y., Reches, M. Coassembly of Aromatic Dipeptides into Biomolecular Necklaces. ACS Nano. 6, 9559-9566 (2012).
- Zhang, S. G. Emerging biological materials through molecular self-assembly. Biotechnol. Adv. 20, 321-339 (2002).
- Zhang, S. G. Fabrication of novel biomaterials through molecular self-assembly. Nat. Biotechnol. 21, 1171-1178 (2003).
- Hartgerink, J. D., Granja, J. R., Milligan, R. A., Ghadiri, M. R. Self-assembling peptide nanotubes. J. Am. Chem. Soc. 118, 43-50 (1996).
- Holmes, T. C., et al. Extensive neurite outgrowth and active synapse formation on self-assembling peptide scaffolds. P. Natl. Acad. Sci. U.S.A. 97, 6728-6733 (2000).
- Santoso, S., Hwang, W., Hartman, H., Zhang, S. G. Self-assembly of surfactant-like peptides with variable glycine tails to form nanotubes and nanovesicles. Nano Lett. 2, 687-691 (2002).
- Bellomo, E. G., Wyrsta, M. D., Pakstis, L., Pochan, D. J., Deming, T. J. Stimuli-responsive polypeptide vesicles by conformation-specific assembly. Nat. Mater. 3, 244-248 (2004).
- Reches, M., Gazit, E. Formation of closed-cage nanostructures by self-assembly of aromatic dipeptides. Nano Lett. 4, 581-585 (2004).
- Reches, M., Gazit, E. Self-assembly of peptide nanotubes and amyloid-like structures by charged-termini-capped diphenylalanine peptide analogues. Isr. J. Chem. 45, 363-371 (2005).
- Park, J., Kahng, B., Kamm, R. D., Hwang, W. Atomistic simulation approach to a continuum description of self-assembled beta-sheet filaments. Biophys. J. 90, 2510-2524 (2006).
- Yan, X., et al. Reversible transitions between peptide nanotubes and vesicle-like structures including theoretical modeling studies. ChemEur. J. 14, 5974-5980 (2008).
- Yan, X., et al. Transition of cationic dipeptide nanotubes into vesicles and oligonucleotide delivery. Angew. Chem. Int. Ed. 46, 2431-2434 (2007).
- Burkoth, T. S., et al. Structure of the beta-amyloid (10-35) fibril. J. Am. Chem. Soc. 122 (10-35), 7883-7889 (2000).
- Aggeli, A., et al. Hierarchical self-assembly of chiral rod-like molecules as a model for peptide beta-sheet tapes, ribbons, fibrils, and fibers. P. Natl. Acad. Sci. U.S.A. 98, 11857-11862 (2001).
- Hamley, I. W. Peptide fibrillization. Angew. Chem. Int. Ed. 46, 8128-8147 (2007).
- Maji, S. K., Haldar, D., Drew, M. G. B., Banerjee, A., Das, A. K. Self-assembly of beta-turn forming synthetic tripeptides into supramolecular beta-sheets and amyloid-like fibrils in the solid state. Tetrahedron. 60, 3251-3259 (2004).
- Jahn, T. R., Parker, M. J., Homans, S. W., Radford, S. E. Amyloid formation under physiological conditions proceeds via a native-like folding intermediate. Nat. Struct. Mol. Biol. 13, 195-201 (2006).
- Shimada, T., Sakamoto, N., Motokawa, R., Koizumi, S., Tirrell, M. Self-assembly process of peptide amphiphile worm-like micelles. J. Phys. Chem. B. 116, 240-243 (2012).
- Sedman, V. L., et al. Surface-templated fibril growth of peptide fragments from the shaft domain of the adenovirus fibre protein. Protein Pept. Lett. 18, 268-274 (2011).
- Choi, S. -j, et al. Differential self-assembly behaviors of cyclic and linear peptides. Biomacromolecules. 13, 1991-1995 (2012).
- Ghosh, S., Reches, M., Gazit, E., Verma, S. Bioinspired design of nanocages by self-assembling triskelion peptide elements. Angew. Chem. Int. Ed. 46, 2002-2004 (2007).
- Li, L. C., et al. Self-assembling nanotubes consisting of rigid cyclic gamma-peptides. Adv. Funct. Mater. 22, 3051-3056 (2012).
- Krysmann, M. J., et al. Self-assembly of peptide nanotubes in an organic solvent. Langmuir. 24, 8158-8162 (2008).
- Segman-Magidovich, S., et al. Sheet-like assemblies of charged amphiphilic alpha/beta-peptides at the air-water interface. ChemEur. J. 17, 14857-14866 (2011).
- Jayawarna, V., et al. Nanostructured hydrogels for three-dimensional cell culture through self-assembly of fluorenylmethoxycarbonyl-dipeptides. Adv. Mater. 18, 611-614 (2006).
- Mahler, A., Reches, M., Rechter, M., Cohen, S., Gazit, E. Rigid, self-assembled hydrogel composed of a modified aromatic dipeptide. Adv. Mater. 18, 1365-1368 (2006).
- Ryan, D. M., Doran, T. M., Anderson, S. B., Nilsson, B. L. Effect of C-terminal modification on the self-assembly and hydrogelation of fluorinated Fmoc-Phe derivatives. Langmuir. 27, 4029-4039 (2011).
- Jung, J. P., Gasiorowski, J. Z., Collier, J. H. Fibrillar peptide gels in biotechnology and biomedicine. Biopolymers. 94, 49-59 (2010).
- Xing, B. G., et al. Hydrophobic interaction and hydrogen bonding cooperatively confer a vancomycin hydrogel: A potential candidate for biomaterials. J. Am. Chem. Soc. 124, 14846-14847 (2002).
- Gore, T., Dori, Y., Talmon, Y., Tirrell, M., Bianco-Peled, H. Self-assembly of model collagen peptide amphiphiles. Langmuir. 17, 5352-5360 (2001).
- Ashkenasy, N., Horne, W. S., Ghadiri, M. R. Design of self-assembling peptide nanotubes with delocalized electronic states. Small. 2, 99-102 (2006).
- Mizrahi, M., Zakrassov, A., Lerner-Yardeni, J., Ashkenasy, N. Charge transport in vertically aligned, self-assembled peptide nanotube junctions. Nanoscale. 4, 518-524 (2012).
- Ryu, J., Lim, S. Y., Park, C. B. Photoluminescent peptide nanotubles. Adv. Mater. 21, 1577-1581 (2009).
- Ryu, J., Kim, S. -W., Kang, K., Park, C. B. Synthesis of diphenylalanine/cobalt oxide hybrid nanowires and their application to energy storage. ACS Nano. 4, 159-164 (2010).
- Yan, X., Zhu, P., Li, J. Self-assembly and application of diphenylalanine-based nanostructures. Chem. Soc. Rev. 39, 1877-1890 (2010).
- Amdursky, N., et al. Blue luminescence based on quantum confinement at peptide nanotubes. Nano Lett. 9, 3111-3115 (2009).
- Maity, S., Jana, P., Maity, S. K., Haldar, D. Mesoporous vesicles from supramolecular helical peptide as drug carrier. Soft Matter. 7, 10174-10181 (2011).
- Adler-Abramovich, L., et al. Self-assembled organic nanostructures with metallic-like stiffness. Angew. Chem. Int. Ed. 49, 9939-9942 (2010).
- Pelton, J. T., McLean, L. R. Spectroscopic methods for analysis of protein secondary structure. Anal. Biochem. 277, 167-176 (2000).
- Haris, P. I., Chapman, D. The conformational analysis of peptides using fourier-transform IR spectroscopy. Biopolymers. 37, 251-263 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved