Method Article
Formación de estructuras biomoleculares ordenada por el auto-ensamblaje de péptidos cortos
En este artículo
Resumen
En este trabajo se describe la formación de estructuras a base de péptidos altamente ordenadas por el proceso espontáneo de auto-ensamblaje. El método utiliza péptidos disponibles comercialmente y equipo de laboratorio común. Esta técnica se puede aplicar a una gran variedad de péptidos y puede conducir al descubrimiento de nuevos conjuntos basados en péptidos.
Resumen
En la naturaleza, las estructuras funcionales complejos se forman por el auto-ensamblaje de biomoléculas en condiciones suaves. La comprensión de las fuerzas que controlan auto-ensamblaje e imitando este proceso in vitro traerá consigo importantes avances en las áreas de ciencias de los materiales y la nanotecnología. Entre los bloques de construcción biológicos disponibles, los péptidos tienen varias ventajas ya que presentan una diversidad sustancial, su síntesis en gran escala es sencillo, y que pueden ser fácilmente modificados con entidades biológicas y químicas 1,2. Varias clases de péptidos diseñados tales como péptidos cíclicos, péptidos de anfífilo y-péptido conjugados de auto-ensamblarse en estructuras ordenadas en solución. Dipéptidos homoaromáticos, son una clase de péptidos auto-ensambladas cortos que contienen toda la información molecular necesaria para formar estructuras ordenadas tales como nanotubos, esferas y fibrillas de 3-8. Una gran variedad de estos péptidos está disponible comercialmente. 9 Los protocolos presentados aquí pueden adaptarse a otras clases de péptidos o bloques de construcción biológica y pueden potencialmente conducir al descubrimiento de nuevas estructuras a base de péptidos y para un mejor control de su montaje.
Introducción
Formas Naturaleza estructuras ordenadas y funcionales en el proceso de auto-ensamblaje biomolecular. La comprensión de las fuerzas que rigen este proceso espontáneo puede conducir a la capacidad de imitar auto-ensamblaje in vitro y en consecuencia a los grandes avances en el área de ciencias de los materiales 10,11. Los péptidos, específicamente, una gran promesa como un bloque de construcción biomolecular, ya que presentan gran diversidad estructural, facilidad de síntesis química, y pueden ser fácilmente funcionalizados con entidades biológicas y químicas. El campo de los péptidos auto-ensamblaje fue iniciado por Ghadiri y sus colegas, quienes demostraron el auto-ensamblaje de nanotubos peptídicos mediante péptidos cíclicos con ácidos y D-12 L-aminoácidos alterna. Otros enfoques exitosos para el diseño de ensamblajes de péptidos incluyen péptidos lineales bolaamphiphile 5, amphiphiles (AP) 6, péptidos iónicos autocomplementarias no conjugados 13, péptidos similares a tensioactivos 4,14, y dibloque copolypeptides 15.
Un enfoque más reciente es el de la auto-ensamblaje de péptidos cortos aromáticos, denominado dipéptidos homoaromáticos. Estos péptidos comprenden sólo dos aminoácidos con la naturaleza aromático (por ejemplo, Phe-Phe, dicarbonato de terc-butilo (Boc)-Phe-Phe) 7,8,16-21. Las estructuras formadas por estos péptidos homoaromáticos incluyen estructuras tubulares, esferas, conjuntos laminares y fibras 6,8,15,21-32. Las fibras en algunos casos generar una malla de fibrillas que se obtiene un hidrogel 33-37. Estos conjuntos han sido explotados para aplicaciones de biosensores, la administración de fármacos, la electrónica molecular, etc. 38-45
Este documento describe los pasos experimentales necesarios para poner en marcha el auto-ensamblaje espontáneo de péptidos homoaromáticos. Además, se presenta el proceso de péptido coassembly. Este proceso implica el auto-ensamblaje de más de un tipo de péptidomonómero.
Nuestra demostración incluye la coassembly de dos péptidos disponibles comercialmente: el péptido difenilalanina (NH 2-Phe-Phe-COOH) y su análogo protegido con Boc (Boc-Phe-Phe-OH). Cada uno de los péptidos auto-ensambla en una estructura supramolecular: los formularios de péptidos difenilalanina conjuntos tubulares y el péptido auto-ensambla Boc-Phe-Phe-OH en cualquiera de esferas o fibras dependiendo del disolvente 7,17,46. Mezclamos los dos péptidos en ciertas proporciones y caracterizaron los conjuntos resultantes mediante microscopía electrónica, microscopía de fuerza y la espectroscopia FT-IR. Los métodos demostraron la formación de una estructura basada en péptidos que se compone de elementos esféricos con un diámetro de varias micras (1-4 micras) que están conectados por conjuntos alargados con un diámetro de unos pocos cientos de nanómetros (~ 300-800 nm) . Los conjuntos de cadenas de cuentas parecen en su morfología, como las estructuras esféricas parecen ser roscado en laconjuntos alargados. Por ello denominamos estas asambleas "collares biomoleculares". Los "collares biomoleculares" pueden servir como un nuevo biomaterial, como un agente de administración de fármacos o como un andamio para aplicaciones electrónicas. Por otra parte, el procedimiento que conduce a la auto-ensamblaje de péptidos se puede utilizar con otras clases de péptidos y biomoléculas. Todo ello puede conducir a una mejor comprensión de las fuerzas que intervienen en el autoensamblaje y la formación de nuevas estructuras ordenadas.
Protocolo
1. El autoensamblaje de homoaromáticos Dipéptidos
- Pesar el péptido deseado en su forma liofilizada (por ejemplo, NH2-Phe-Phe-OH, Boc-Phe-Phe-COOH) y preparar una solución madre disolviendo el péptido en 1,1,1,3,3,3-hexafluoro -2-propanol (HFP) a la concentración apropiada (por ejemplo, 100 mg / ml de NH 2-Phe-Phe-OH y Boc-Phe-Phe-COOH) 7,17,46.
- Mezclar la solución con vórtice y el lugar en el banco hasta que el péptido se disuelva completamente y la solución parece clara (unos pocos minutos).
- Diluir la solución de péptido de stock, con un disolvente adecuado, a la concentración apropiada (por ejemplo, 2 mg / ml de NH 2-Phe-Phe-OH en agua destilada Triple (PST) para la formación de nanotubos; mediante la adición de 2 l de péptido solución madre a 98 l TDW, 5 mg / ml de Boc-Phe-Phe-COOH en etanol para la formación de estructuras esféricas).
- Mantenga la solución a temperatura ambiente durante 24hora
- Con el fin de evitar cualquier preaggregation, preparar soluciones madre frescos para cada experimento.
2. Coassembly de Dos homoaromáticos Dipéptidos
- Preparar una solución de etanol al 50% mediante la mezcla de volúmenes iguales de TDW y etanol absoluto. Utilice vórtice para mezclar las dos soluciones.
- Pesar 2 mg del péptido NH 2-Phe-Phe-OH y 1 mg del péptido Boc-Phe-Phe-OH. Disolver cada péptido en HFP a una concentración de 100 mg / ml.
- Mezclar los péptidos soluciones madre utilizando vórtice y colocarlos en el banco hasta que los péptidos se disolvieron por completo y las soluciones parecen claras.
- Mezcla los péptidos soluciones madre a la relación deseada. En este experimento específico mezclar 10 l de péptido NH 2-Phe-Phe-OH con 6 l de péptido Boc-Phe-Phe-OH (hasta una relación final de 05:03, respectivamente). Debido a la alta volatilidad del disolvente HFP, se recomienda preparar una gran cantidad de esta solución madre (por lo leao 10 l).
- Utilice vortex para mezclar la solución de péptidos mezclados.
- Diluir la solución madre de péptidos mezclados con etanol al 50% a la concentración final deseada. En este experimento específico, con el fin de obtener una concentración final de 5 mg / ml de NH 2-Phe-Phe-OH y 3 mg / ml para Boc-Phe-Phe-OH, respectivamente, añadir 8 l de la solución madre de péptidos mezclados a 92 l de la solución de etanol al 50%. Utilice una pipeta para mezclar suavemente la solución.
- Mantenga la solución a temperatura ambiente durante 24 horas.
- Cabe señalar que debido a la naturaleza altamente volátil del disolvente, los experimentos son sensibles a pequeños cambios en la concentración de los péptidos. Por lo tanto, nuevas soluciones madre deben prepararse para cada experimento.
3. Caracterización de los auto-ensambladas Estructuras Usando microscopía electrónica de barrido (SEM)
- Después de 24 horas de incubación, se aplica una gota de 10 l de la solución de los péptidos en una cala de vidrior resbalón y seco a temperatura ambiente.
- Escudo de la muestra en el vaso con una fina capa de oro (de unos pocos nanómetros) usando un revestidor por bombardeo iónico durante 90 segundos.
- Imagen de los ensamblados mediante SEM funciona a 10-20 kV.
4. Caracterización de los auto-ensambladas Estructuras Utilizando Microscopía Electrónica de Transmisión (TEM)
- Coloque una gota de 10 l de la solución de los péptidos sobre una rejilla de cobre de malla 200 cubierto de carbono y estabilizado por un soporte de película de polímero.
- Después de 1 min retirar el exceso de líquido con papel de filtro.
- Preparar una solución de 2% de acetato de uranilo en TDW. Se filtra la solución con unidad de filtro de 0,22 micras.
- Para la tinción de la muestra (tinción negativa), coloque una gota de 10 l de solución de acetato de uranilo en la parrilla.
- Después de 30 segundos quitar el exceso de líquido con papel de filtro. Cabe señalar que aunque la tinción negativa mejora el contraste de las imágenes, no es esencial en todos los casos.
- Imagen de la muestra en el the rejilla por TEM que opera a 120 kV.
5. Caracterización tridimensional de las Asambleas por Microscopía de Fuerza Atómica (AFM)
- Preparar una muestra para el análisis AFM usando el procedimiento descrito en el apartado 3.1.
- Analizar la muestra sobre el vidrio utilizando un instrumento AFM se trabaja en modo de CA. Utilice palancas de silicio con una constante de resorte de 3 N / m y una frecuencia de resonancia de 75 kHz.
- Iniciar mediante el escaneo de un área grande de la red, con el fin de encontrar la estructura deseada. Luego concéntrese en un área más pequeña específico y escanearlo (el tamaño de escaneo fue de 2,5 m x 2,5 m para la imagen incluida en este manuscrito).
6. Caracterización de la estructura secundaria por FT-IR
- Aplique una gota de 30 l de la solución de los péptidos a una ventana de CaF 2.
- Deje que la solución se seque a temperatura ambiente.
- La adsorción de agua en el espectro IR es a 1650 cm -1.Este pico está en el centro de la banda de amida I del enlace peptídico. También es un pico típico para estructuras α-helicoidal de péptidos y proteínas 47. Con el fin de superar este problema y evitar la señal de agua, se debe realizar un intercambio de hidrógeno a deuterio. Coloque una gota de óxido de deuterio (D2O) en la muestra de péptido se secó. La caída debe ser lo suficientemente grande como para cubrir completamente el depósito de péptido en la ventana.
- Permita que la muestra se seque al vacío.
- Repita los pasos 6.3 y 6.4 2x para asegurar el intercambio máxima-hidrógeno-deuterio. Guarde la muestra bajo vacío hasta su análisis.
- Registre los espectros FT-IR usando una triglicina sulfato deuterado detector (DTGS). El sistema FT-IR incluye un generador de gas de purga, con el fin de evitar que la humedad en los alrededores de la muestra. Para las muestras de péptidos cortos, lo mejor es escanear la muestra 2000 x con una resolución de 4 cm -1. Los valores mínimos de transmitancia se pueden determinar por el modoftware suministrado con el instrumento.
Resultados
En este trabajo se describe un método para la formación de estructuras ordenadas en la nano-y micrométrico escala por el auto-ensamblaje de péptidos. Con el fin de demostrar este sencillo proceso presentamos y caracterizar la coassembly de dos péptidos aromáticos simples (Figura 1). Uno de los péptidos es el 2-Phe-Phe-OH (difenilalanina) péptido NH, que puede auto-ensamblan en una solución acuosa en estructuras tubulares huecos con dimensiones nanométricas 7. El otro péptido es su análogo protegido con Boc, Boc-Phe-Phe-OH. Este péptido puede formar estructuras fibrilares en soluciones acuosas y conjuntos esféricas en etanol 17,46. Asumimos que estos péptidos se ensamblan en una estructura que combina los dos elementos mencionados. Utilizando el análisis de SEM, que reveló que los péptidos mezclados forman una arquitectura de conjuntos esféricas con un diámetro de varias micras conectados por estructuras alargadas con un diámetro de unos pocos centenares de enenanómetros ed (Figura 2). Debido a la gran similitud en la morfología de las cadenas de cuentas, que denominamos estas estructuras "collares moleculares". Análisis por MFA de estas estructuras demostró claramente su disposición tridimensional (Figura 3). Además, el análisis SEM de diferentes regiones de diferentes muestras indicó que este proceso se produjo con un alto rendimiento (Figura 2b).
Análisis FT-IR proporcionó información sobre la estructura secundaria de los péptidos asambleas. El espectro de absorbancia de la banda de amida I de los conjuntos esféricas formadas por el péptido Boc-Phe-Phe-OH (5 mg / ml, etanol 50%) mostró un único pico de amida I en 1657 cm -1 que indica una conformación de hélice α. Las estructuras tubulares formadas por el péptido NH 2-Phe-Phe-OH (2 mg / ml, etanol 50%) mostraron dos picos distintivos, uno en 1613 cm-1 y el otro a 1682 cm -1. Estos picos correlacionados ingenio ja β-hoja de estructura secundaria. El espectro de FT-IR de los collares biomoleculares, formadas por la coassembly de los dos péptidos, difería de la asignación para cada péptido individual, ya que comprendían dos picos: un pico a 1653 cm -1 que se corresponde con una estructura de hélice α y otro pico en 1684 cm -1 que se relaciona con una conformación β-turn (Figura 4) 48. La diferencia entre los diversos espectros indica una estructura única para collares biomoleculares.

Figura 1. Coassembly de los péptidos NH2-Phe-Phe-OH y Boc-Phe-Phe-OH. Ilustración esquemática del proceso coassembly.
en "fo: src =" / files/ftp_upload/50946/50946fig2highres.jpg "src =" / files/ftp_upload/50946/50946fig2.jpg "/>
Figura 2. Análisis de microscopía de electrones de los collares moleculares; A) y B) micrografías SEM; C) Una micrografía TEM.
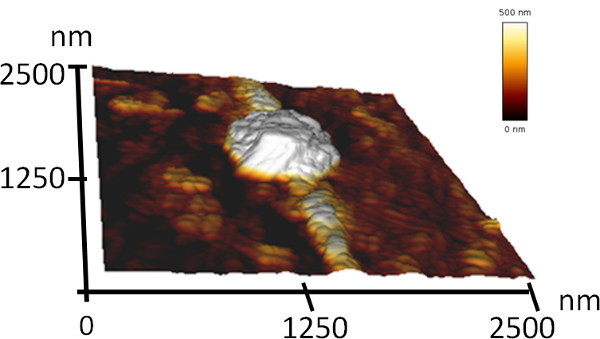
Figura 3. Imagen tridimensional topografía de AFM de los collares moleculares.

Figura 4. Análisis FT-IR de las diferentes estructuras auto-ensambladas. Espectro de FT-IR obtenido a partir de la muestra de las esferas formadas por Boc-Phe-Phe-OH (rojo), la estructuras tubulares fOrmed por NH 2-Phe-Phe-OH (verde) y los collares moleculares formados por la coassembly de estos dos péptidos (púrpuras).
Discusión
En resumen, este trabajo demuestra la facilidad con la que conjuntos basados en péptidos se pueden formar in vitro. El proceso consiste en péptidos y disolventes disponibles comercialmente, y se produce espontáneamente en condiciones ambientales, después de la adición de un disolvente polar para el tubo de ensayo. Es crucial usar HFP como disolvente de los péptidos, debido a la baja solubilidad de los péptidos en otros disolventes orgánicos. Además, debido a la alta volatilidad de HFP es necesario para preparar la solución madre fresca para cada experimento. Por otra parte, el volumen de la solución madre debe ser superior a 10 l y la transferencia del péptido disuelto en el disolvente polar (agua) que se debe hacer rápidamente.
Cabe señalar que este método para la solvatación y auto-ensamblaje del péptido es un posible enfoque, usado típicamente para estos péptidos aromáticos. Otros enfoques, sin embargo, son posibles. Además, la concentración de la población de solut iones del péptido en HFP es alta en estos experimentos con el fin de minimizar la concentración de HFP en la solución final.
Este manuscrito también presenta algunas de las principales técnicas para la caracterización de las estructuras a base de péptidos, tales como AFM, TEM, SEM, y FT-IR. El uso de técnicas de microscopía, es posible obtener información sobre la morfología de las asambleas. Puesto que las dimensiones de estos conjuntos van desde cientos de nanómetros a varios micrones, es suficiente para utilizar la microscopía electrónica estándar para su caracterización. Microscopios de ultra-alta resolución, puede ser útil para estructuras que son menos de 100 nm de diámetro y cuando se desea la formación de imágenes sin un revestimiento conductor (por ejemplo, oro). En algunos casos, la carga de las estructuras por el haz de electrones del microscopio electrónico se puede producir debido a la naturaleza orgánica de la estructura. Esto se puede resolver mediante la reducción de la tensión del sistema operativo.
t "> El análisis adicional, la espectroscopia FT-IR, es un método de resolución media que proporciona información sobre la estructura secundaria de las asambleas. En este manuscrito, las mediciones se realizaron sobre muestras secas, sin embargo, es posible estudiar la estructura de las asambleas en la solución de fase usando una celda de fluido.Tomados en conjunto, el enfoque que aquí se presenta para el auto-ensamblaje de péptidos se puede adaptar a otras clases de péptidos y podría conducir a una mejor comprensión de las fuerzas y de las interacciones durante el proceso. Además, también puede conducir a la formación de nuevos conjuntos biomoleculares.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue apoyado por el Marie Curie Internacional Reintegración Grant y por la Fundación Alemana-Israel. Reconocemos el Sr. Yair Razvag para el análisis de AFM.
Materiales
| Name | Company | Catalog Number | Comments |
| NH2-Phe-Phe-OH | Bachem | G-2925.0001 | |
| Boc-Phe-Phe-OH | Bachem | A-3205.0005 | |
| 1,1,1,3,3,3-hexafluoro-2-propanol | Sigma-Aldrich | 52512-100ML | |
| Ethanol absolute (Dehydrated) AR sterile | Bio-Lab Ltd. | 52555 | Blending with TDW for the preparation of 50% solution |
| Uranyl acetate | Sigma-Aldrich | 73943 | For negative staining. It is possible to work without it. |
| glass cover slip | Marienfeld Laboratory Glassware | 110590 | |
| TEM grids | Electron Microscopy Sciences | FCF200-Cu-50 | Formvar/Carbon 200 Mesh, Cu |
| Quantitive filter paper | Whatman | 1001055 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich | 151882-100G | 99.9 atom % D |
| CaF2 window | PIKE Technologies | 160-1212 | 25 mm x 2 mm window. For FT-IR measurments |
| AFM tips | NanoScience Instruments | CFMR | Aspire probes, CFMR-25 series |
| Filter units | Millipore | SLGV033RS | Millex-GV, 0.22 μm, PVDF, 33 mm, gamma sterilized |
| SEM | FEI | Quanta 200 ESEM | |
| TEM | FEI | Tecnai T12 G2 Spirit | |
| AFM | JPK Instruments | A JPK NanoWizard3 | |
| FT-IR | Thermo Fisher Scientific | Nicolet 6700 advanced gold spectrometer | |
| FT-IR Purge | Parker | BALSTON FT-IR Purge Gas Generator model 75-52 | |
| OMNIC (Nicolet) software | Thermo Nicolet Corporation | For FT-IR spectra analysis | |
| Vortex mixer | Wisd Laboratory Equipment | ViseMix VM | |
| Weight | Mettler Toledo | NewClassic MS | |
| Sputter coater | Polaron | SC7640 Sputter Coater |
Referencias
- Rajagopal, K., Schneider, J. P. Self-assembling peptides and proteins for nanotechnological applications. Curr. Opin. Struc. Biol. 14, 480-486 (2004).
- Ulijn, R. V., Smith, A. M. Designing peptide based nanomaterials. Chem. Soc. Rev. 37, 664-675 (2008).
- Bong, D. T., Clark, T. D., Granja, J. R., Ghadiri, M. R. Self-assembling organic nanotubes. Angew. Chem. Int. Ed. 40, 988-1011 (2001).
- Vauthey, S., Santoso, S., Gong, H. Y., Watson, N., Zhang, S. G. Molecular self-assembly of surfactant-like peptides to form nanotubes and nanovesicles. P. Natl. Acad. Sci. U.S.A. 99, 5355-5360 (2002).
- Matsui, H., Gologan, B. Crystalline glycylglycine bolaamphiphile tubules and their pH-sensitive structural transformation. J. Phys. Chem. B. 104, 3383-3386 (2000).
- Hartgerink, J. D., Beniash, E., Stupp, S. I. Self-assembly and mineralization of peptide-amphiphile nanofibers. Science. 294, 1684-1688 (2001).
- Reches, M., Gazit, E. Casting metal nanowires within discrete self-assembled peptide nanotubes. Science. 300, 625-627 (2003).
- Reches, M., Gazit, E. Molecular self-assembly of peptide nanostructures: mechanism of association and potential uses. Curr. Nanosci. 2, 105-111 (2006).
- Yuran, S., Razvag, Y., Reches, M. Coassembly of Aromatic Dipeptides into Biomolecular Necklaces. ACS Nano. 6, 9559-9566 (2012).
- Zhang, S. G. Emerging biological materials through molecular self-assembly. Biotechnol. Adv. 20, 321-339 (2002).
- Zhang, S. G. Fabrication of novel biomaterials through molecular self-assembly. Nat. Biotechnol. 21, 1171-1178 (2003).
- Hartgerink, J. D., Granja, J. R., Milligan, R. A., Ghadiri, M. R. Self-assembling peptide nanotubes. J. Am. Chem. Soc. 118, 43-50 (1996).
- Holmes, T. C., et al. Extensive neurite outgrowth and active synapse formation on self-assembling peptide scaffolds. P. Natl. Acad. Sci. U.S.A. 97, 6728-6733 (2000).
- Santoso, S., Hwang, W., Hartman, H., Zhang, S. G. Self-assembly of surfactant-like peptides with variable glycine tails to form nanotubes and nanovesicles. Nano Lett. 2, 687-691 (2002).
- Bellomo, E. G., Wyrsta, M. D., Pakstis, L., Pochan, D. J., Deming, T. J. Stimuli-responsive polypeptide vesicles by conformation-specific assembly. Nat. Mater. 3, 244-248 (2004).
- Reches, M., Gazit, E. Formation of closed-cage nanostructures by self-assembly of aromatic dipeptides. Nano Lett. 4, 581-585 (2004).
- Reches, M., Gazit, E. Self-assembly of peptide nanotubes and amyloid-like structures by charged-termini-capped diphenylalanine peptide analogues. Isr. J. Chem. 45, 363-371 (2005).
- Park, J., Kahng, B., Kamm, R. D., Hwang, W. Atomistic simulation approach to a continuum description of self-assembled beta-sheet filaments. Biophys. J. 90, 2510-2524 (2006).
- Yan, X., et al. Reversible transitions between peptide nanotubes and vesicle-like structures including theoretical modeling studies. ChemEur. J. 14, 5974-5980 (2008).
- Yan, X., et al. Transition of cationic dipeptide nanotubes into vesicles and oligonucleotide delivery. Angew. Chem. Int. Ed. 46, 2431-2434 (2007).
- Burkoth, T. S., et al. Structure of the beta-amyloid (10-35) fibril. J. Am. Chem. Soc. 122 (10-35), 7883-7889 (2000).
- Aggeli, A., et al. Hierarchical self-assembly of chiral rod-like molecules as a model for peptide beta-sheet tapes, ribbons, fibrils, and fibers. P. Natl. Acad. Sci. U.S.A. 98, 11857-11862 (2001).
- Hamley, I. W. Peptide fibrillization. Angew. Chem. Int. Ed. 46, 8128-8147 (2007).
- Maji, S. K., Haldar, D., Drew, M. G. B., Banerjee, A., Das, A. K. Self-assembly of beta-turn forming synthetic tripeptides into supramolecular beta-sheets and amyloid-like fibrils in the solid state. Tetrahedron. 60, 3251-3259 (2004).
- Jahn, T. R., Parker, M. J., Homans, S. W., Radford, S. E. Amyloid formation under physiological conditions proceeds via a native-like folding intermediate. Nat. Struct. Mol. Biol. 13, 195-201 (2006).
- Shimada, T., Sakamoto, N., Motokawa, R., Koizumi, S., Tirrell, M. Self-assembly process of peptide amphiphile worm-like micelles. J. Phys. Chem. B. 116, 240-243 (2012).
- Sedman, V. L., et al. Surface-templated fibril growth of peptide fragments from the shaft domain of the adenovirus fibre protein. Protein Pept. Lett. 18, 268-274 (2011).
- Choi, S. -j, et al. Differential self-assembly behaviors of cyclic and linear peptides. Biomacromolecules. 13, 1991-1995 (2012).
- Ghosh, S., Reches, M., Gazit, E., Verma, S. Bioinspired design of nanocages by self-assembling triskelion peptide elements. Angew. Chem. Int. Ed. 46, 2002-2004 (2007).
- Li, L. C., et al. Self-assembling nanotubes consisting of rigid cyclic gamma-peptides. Adv. Funct. Mater. 22, 3051-3056 (2012).
- Krysmann, M. J., et al. Self-assembly of peptide nanotubes in an organic solvent. Langmuir. 24, 8158-8162 (2008).
- Segman-Magidovich, S., et al. Sheet-like assemblies of charged amphiphilic alpha/beta-peptides at the air-water interface. ChemEur. J. 17, 14857-14866 (2011).
- Jayawarna, V., et al. Nanostructured hydrogels for three-dimensional cell culture through self-assembly of fluorenylmethoxycarbonyl-dipeptides. Adv. Mater. 18, 611-614 (2006).
- Mahler, A., Reches, M., Rechter, M., Cohen, S., Gazit, E. Rigid, self-assembled hydrogel composed of a modified aromatic dipeptide. Adv. Mater. 18, 1365-1368 (2006).
- Ryan, D. M., Doran, T. M., Anderson, S. B., Nilsson, B. L. Effect of C-terminal modification on the self-assembly and hydrogelation of fluorinated Fmoc-Phe derivatives. Langmuir. 27, 4029-4039 (2011).
- Jung, J. P., Gasiorowski, J. Z., Collier, J. H. Fibrillar peptide gels in biotechnology and biomedicine. Biopolymers. 94, 49-59 (2010).
- Xing, B. G., et al. Hydrophobic interaction and hydrogen bonding cooperatively confer a vancomycin hydrogel: A potential candidate for biomaterials. J. Am. Chem. Soc. 124, 14846-14847 (2002).
- Gore, T., Dori, Y., Talmon, Y., Tirrell, M., Bianco-Peled, H. Self-assembly of model collagen peptide amphiphiles. Langmuir. 17, 5352-5360 (2001).
- Ashkenasy, N., Horne, W. S., Ghadiri, M. R. Design of self-assembling peptide nanotubes with delocalized electronic states. Small. 2, 99-102 (2006).
- Mizrahi, M., Zakrassov, A., Lerner-Yardeni, J., Ashkenasy, N. Charge transport in vertically aligned, self-assembled peptide nanotube junctions. Nanoscale. 4, 518-524 (2012).
- Ryu, J., Lim, S. Y., Park, C. B. Photoluminescent peptide nanotubles. Adv. Mater. 21, 1577-1581 (2009).
- Ryu, J., Kim, S. -W., Kang, K., Park, C. B. Synthesis of diphenylalanine/cobalt oxide hybrid nanowires and their application to energy storage. ACS Nano. 4, 159-164 (2010).
- Yan, X., Zhu, P., Li, J. Self-assembly and application of diphenylalanine-based nanostructures. Chem. Soc. Rev. 39, 1877-1890 (2010).
- Amdursky, N., et al. Blue luminescence based on quantum confinement at peptide nanotubes. Nano Lett. 9, 3111-3115 (2009).
- Maity, S., Jana, P., Maity, S. K., Haldar, D. Mesoporous vesicles from supramolecular helical peptide as drug carrier. Soft Matter. 7, 10174-10181 (2011).
- Adler-Abramovich, L., et al. Self-assembled organic nanostructures with metallic-like stiffness. Angew. Chem. Int. Ed. 49, 9939-9942 (2010).
- Pelton, J. T., McLean, L. R. Spectroscopic methods for analysis of protein secondary structure. Anal. Biochem. 277, 167-176 (2000).
- Haris, P. I., Chapman, D. The conformational analysis of peptides using fourier-transform IR spectroscopy. Biopolymers. 37, 251-263 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados