Method Article
Bildung geordneter Strukturen Biomolekulare durch die Selbstorganisation von kurzen Peptiden
In diesem Artikel
Zusammenfassung
Dieses Papier beschreibt die Bildung von hochgeordnete Strukturen auf Peptid-Basis durch die spontane Prozeß der Selbstorganisation. Das Verfahren nutzt Handel befindlichen Peptiden und gemeinsame Laborgeräte. Diese Technik kann auf eine Vielzahl von Peptiden angewendet werden und kann auf die Entdeckung von neuen Peptid-basierten Anordnungen führen.
Zusammenfassung
In der Natur werden die komplexen funktionellen Strukturen durch Selbstorganisation von Biomolekülen unter milden Bedingungen gebildet. Das Verständnis der Kräfte, die Selbstorganisation zu steuern und imitiert diesen Vorgang in vitro wird über große Fortschritte in den Bereichen Materialwissenschaft und Nanotechnologie zu bringen. Unter den verfügbaren biologischen Bausteine sind Peptide mehrere Vorteile, da sie erhebliche Vielfalt zu präsentieren, deren Synthese im großen Maßstab ist einfach, und sie können leicht mit biologischen und chemischen Einheiten 1,2 geändert werden. Mehrere Klassen entworfen Peptide wie zyklische Peptide, amphiphile Peptide und Peptid-Konjugate Selbstorganisation zu geordneten Strukturen in Lösung. Homoaromatische Dipeptide, sind eine Klasse von kurzen selbstorganisierten Peptide, die alle erforderlichen Informationen, um molekulare geordnete Strukturen wie Nanoröhren, Kugeln und Fibrillen bilden 3-8 enthalten. Eine Vielzahl dieser Peptide ist im Handel erhältlich. 9. Die hier vorgestellten Protokolle können andere Klassen von Peptiden oder biologische Bausteine und möglicherweise angepasst werden kann zur Entdeckung neuer Peptidstrukturen und eine bessere Kontrolle ihrer Montage.
Einleitung
Naturformen bestellt und Funktionsstrukturen durch das Verfahren der biomolekularen Selbstmontage. Das Verständnis der Kräfte, die diese spontane Prozess regieren kann auf die Fähigkeit zur Selbstorganisation in vitro zu großen Fortschritten im Bereich der Materialwissenschaften 10,11 imitieren und damit zu führen. Peptide, insbesondere ein großes Versprechen als biomolekulare Baustein, da sie große Strukturvielfalt, einfache chemische Synthese zu präsentieren, und kann leicht mit biologischen und chemischen Einheiten funktionalisiert werden. Das Gebiet der Peptidselbstorganisation durch Ghadiris und seiner Kollegen, die die Selbstorganisation von Peptid-Nanoröhren durch cyclische Peptide mit alternierenden D-und L-Aminosäuren 12 gezeigt, voran. Andere erfolgreiche Ansätze für den Entwurf von Peptidanordnungen umfassen lineare Peptide Bolaamphiphil 5, Amphiphile (AP) 6, nichtkonjugierten selbstkomplementären ionischen Peptide 13, Tensid-ähnliche Peptide 4,14 und Diblock Copolypeptide 15.
Ein neuerer Ansatz ist die Selbstorganisation von kurzen Peptiden aromatischen, bezeichnet als homoaromatische Dipeptide. Diese Peptide umfassen nur zwei Aminosäuren mit aromatischer Natur (z. B. Phe-Phe-, tert-Butyldicarbonat (Boc)-Phe-Phe) 7,8,16-21. Die von diesen Peptiden gebildet homoaromatische Strukturen sind röhrenförmige Strukturen, Kugeln, blattartige Baugruppen und Fasern 6,8,15,21-32. Die Fasern in einigen Fällen erzeugen eine Fibrillen-Netz, das ein Hydrogel 33-37 ergibt. Diese Baugruppen sind für Anwendungen von Biosensoren, Drug Delivery, molekulare Elektronik, etc. genutzt. 38-45
Dieses Papier beschreibt die experimentellen Schritte, um die spontane Selbstorganisation von homoaromatischen Peptide starten benötigt. Darüber hinaus stellt sie den Prozess der Peptid Coassemblierung. Dieser Prozess beinhaltet die Selbstanordnung von mehr als einem Typ von PeptidMonomer.
Unsere Demonstration umfasst die Coassemblierung zweier kommerziell erhältlicher Peptide: Peptid die Diphenylalanin (NH 2-Phe-Phe-COOH) und Boc geschützte Analogon (Boc-Phe-Phe-OH). Jedes der Peptide selbst montiert in eine super Struktur: Die Diphenylalanin Peptid Formen Rohrbaugruppen und die Boc-Phe-Phe-OH Peptidselbstorganisation in entweder Kugeln oder Fasern je nach Lösungsmittel 7,17,46. Wir mischten die beiden Peptide in bestimmten Verhältnissen und dadurch die Folge Anordnungen durch Elektronenmikroskopie, Kraftmikroskopie und FT-IR-Spektroskopie. Die Verfahren zeigten die Bildung einer Peptid-Struktur, die auf der Basis von kugelförmigen Elementen mit einem Durchmesser von mehreren Mikrometern (1-4 um), die durch längliche Anordnungen mit einem Durchmesser von einigen hundert Nanometern verbunden sind (~ 300-800 nm) besteht . Die Anordnungen ähneln Perlen Strings in ihrer Morphologie, wie die sphärischen Strukturen scheinen auf die Gewinde werdenlängliche Baugruppen. Deshalb bezeichnet diese Baugruppen "biomolekularen Halsketten". Die "biomolekularen Halsketten" könnte als neues Biomaterial zu dienen, als Drug-Delivery-Agent oder als Gerüst für elektronische Anwendungen. Darüber hinaus kann das Verfahren, das zum Selbstorganisation von Peptiden führt mit anderen Klassen von Peptiden und Biomolekülen verwendet werden. Es kann zu einem besseren Verständnis der bei der Selbstorganisation und die Bildung von neuen geordneten Strukturen auftretenden Kräfte führen.
Protokoll
1. Die Selbstorganisation von homoaromatischen Dipeptide
- Wiegen Sie das gewünschte Peptid in seiner gefriergetrockneter Form (z. B. NH 2-Phe-Phe-OH, Boc-Phe-Phe-COOH) und bereiten eine Stammlösung durch Lösen des Peptids in 1,1,1,3,3,3-Hexafluor -2-propanol (HFP) mit der entsprechenden Konzentration (beispielsweise 100 mg / ml für die NH 2-Phe-Phe-OH und Boc-Phe-Phe-COOH) 7,17,46.
- Mischen Sie die Lösung mit Wirbel und Platz auf der Bank, bis das Peptid vollständig gelöst und die Lösung scheint klar (ein paar Minuten).
- Verdünnt das Peptidstammlösung mit einem geeigneten Lösungsmittel, auf die geeignete Konzentration (beispielsweise 2 mg / ml NH 2-Phe-Phe-OH in Wasser dreifach destilliert (TDW) zur Bildung von Nanoröhrchen, indem 2 ul der Peptid Stammlösung zu 98 &mgr; l TDW, 5 mg / ml Boc-Phe-Phe-COOH in Ethanol zur Bildung von sphärischen Strukturen).
- Die Lösung wird bei RT für 24hr.
- Um jede preaggregation vermeiden, sind die frischen Lösungen für jedes Experiment.
2. Cozusammenlagerung von zwei homoaromatische Dipeptide
- Eine Lösung aus 50% Ethanol durch Mischen gleicher Volumina von absolutem Ethanol und TDW. Verwenden Wirbel um die beiden Lösungen mischen.
- Wiegt 2 mg des NH 2-Phe-Phe-OH-Peptid und 1 mg des Boc-Phe-Phe-OH-Peptids. Lösen jedes Peptid in HFP zu einer Konzentration von 100 mg / ml.
- Mischen Sie die Peptide Stammlösungen mit Wirbel und legen Sie sie auf der Bank, bis die Peptide vollständig gelöst und die Lösungen scheinen klar.
- Mischen Sie die Peptide Stammlösungen in das gewünschte Verhältnis. In diesem speziellen Experiment Mischung 10 ul der NH 2-Phe-Phe-OH Peptid mit 6 ul des Boc-Phe-Phe-OH-Peptid (bis zu einer endgültigen Verhältnis 5:3 beziehungsweise). Aufgrund der hohen Volatilität der HFP Lösungsmittel, ist es empfehlenswert, eine große Menge von dieser Stammlösung werden (bei least 10 ul).
- Verwenden Wirbel um die gemischte Peptide Stammlösung mischen.
- Verdünnen Sie die Blended-Peptide Stammlösung mit 50% Ethanol in die gewünschte endgültige Konzentration. In diesem speziellen Experiment, um eine Endkonzentration von 5 mg / ml für die NH 2-Phe-Phe-OH und 3 mg / ml Boc-Phe-Phe-OH bzw. zu schneiden, 8 &mgr; l der Stammlösung vermischten Peptide 92 &mgr; l der 50% igen Ethanol-Lösung. Mit einer Pipette vorsichtig mischen Sie die Lösung.
- Die Lösung wird bei RT für 24 Stunden.
- Es sei darauf hingewiesen, dass aufgrund der sehr flüchtigen Natur des Lösungsmittels, die Experimente sind empfindlich gegenüber kleinen Änderungen in der Konzentration der Peptide werden. Daher sollten frische Stammlösungen für jedes Experiment vorbereitet werden.
3. Charakterisierung der Selbst montiert Strukturen mit Rasterelektronenmikroskopie (SEM)
- Nach 24 Stunden Inkubation, gelten ein 10 ul Tropfen der Lösung Peptide auf einem Glas Buchtr Schlupf und trocken bei RT.
- Beschichtung der Probe auf dem Glas mit einer dünnen Schicht aus Gold (wenige Nanometer) unter Verwendung eines Sputter-Beschichtungsvorrichtung für 90 Sekunden.
- Bild die Baugruppen mit SEM, die bei 10-20 kV.
4. Charakterisierung der Selbst montiert Strukturen mit Transmissionselektronenmikroskopie (TEM)
- Legen Sie eine 10 &mgr; l-Tropfen der Lösung Peptide auf einem 200-Mesh-Kupfergitter mit Kohlenstoff bedeckt und durch eine Polymer-Trägerfilm stabilisiert.
- Nach 1 min die überschüssige Flüssigkeit mit Filterpapier.
- Bereiten Sie eine Lösung von 2% Uranylacetat in TDW. Die Lösung wird mit 0,22 um-Filtereinheit.
- Um das Beispiel (negative Färbung) Fleck, einen Tropfen von 10 ul Uranylacetatlösung in der Startaufstellung.
- Nach 30 sec entfernen überschüssige Flüssigkeit mit Filterpapier. Es sei angemerkt, dass, obwohl eine negative Färbung verbessert den Kontrast der Bilder, ist es nicht wesentlich, in allen Fällen.
- Bild der Probe auf the Gitter durch TEM bei 120 kV.
5. Dreidimensionale Charakterisierung der Versammlungen von Atomic Force Microscopy (AFM)
- Bereiten Sie eine Probe für die AFM-Analyse unter Verwendung des in Absatz 3.1 beschriebenen Verfahren.
- Analysieren Sie die Probe auf dem Glas mittels einer AFM-Instrument arbeiten im AC-Modus. Verwenden Siliziumcantilevern mit einer Federkonstante von 3 N / m und einer Resonanzfrequenz von 75 kHz.
- Starten durch Abtasten einer großen Fläche des Gitters, um die gewünschte Struktur zu finden. Dann konzentrieren sich auf einen bestimmten kleineren Bereich und scannen sie (die Scan-Größe 2,5 x 2,5 um um für das Bild in dieser Handschrift enthalten).
6. Charakterisierung der Sekundärstruktur von FT-IR
- Tragen Sie eine 30 ul Tropfen der Peptide Lösung zu einem CaF2-Fenster.
- Die Lösung wird bei Raumtemperatur trocknen.
- Die Adsorption von Wasser in dem IR-Spektrum ist auf 1.650 cm -1.Dieser Peak ist in der Mitte der Amid-I-Bande der Peptidbindung. Es ist auch eine typische Spitzen für α-Helix-Strukturen von Peptiden und Proteinen 47. Um dieses Problem zu überwinden, und das Signal von Wasser zu vermeiden, muss ein Wasserstoff-zu-Deuterium-Austausch durchgeführt werden. Geben Sie einen Tropfen von Deuteriumoxid (D 2 O) auf die getrocknete Peptidprobe. Der Tropfen sollte groß genug sein, um das Peptid Beläge auf der komplett abzudecken.
- Die Probe wird unter Vakuum zu trocknen.
- Wiederholen Sie die Schritte 6.3 und 6.4, 2x, um eine maximale Wasserstoff-Deuterium-Austausch zu gewährleisten. Speichern Sie die Probe unter Vakuum bis zu ihrer Analyse.
- Notieren Sie sich die FT-IR-Spektren mit einem deuterierten Triglycinsulfat (DTGS)-Detektor. Die FT-IR-System beinhaltet einen Reinigungsgasgenerator, um die Luftfeuchtigkeit in der Umgebung der Probe zu verhindern. Bei Proben von kurzen Peptiden, ist es am besten, um die Probe mit einer Auflösung von 4 cm -1 scannen 2.000 x. Die Durchlässigkeit Minimalwerte können durch die so bestimmt werden,ftware mit dem Gerät geliefert.
Ergebnisse
Dieses Dokument beschreibt ein Verfahren zur Bildung geordneter Strukturen in der Nano-und Mikrometerskala durch die Selbstorganisation von Peptiden. Um dieses einfache Verfahren präsentieren wir demonstrieren und zu charakterisieren, die Coassemblierung von zwei einfachen aromatischen Peptide (Abbildung 1). Eines der Peptide, die NH 2-Phe-Phe-OH (Diphenylalanin)-Peptid, das durch Selbstorganisation kann in einer wässrigen Lösung in das hohle röhrenförmige Strukturen mit Abmessungen im Nanometerbereich 7. Das andere Peptid Boc geschützten Analogon, Boc-Phe-Phe-OH. Dieses Peptid kann fibrilläre Strukturen in wässrigen Lösungen und sphärische Baugruppen in Ethanol 17,46 bilden. Wir nahmen an, dass diese Peptide würden in eine Struktur, die die beiden genannten Elemente kombiniert coassemble. Verwendung von SEM-Analyse zeigte, dass wir die vermischten Peptide gebildet, das eine Architektur sphärische Baugruppen mit einem Durchmesser von mehreren Mikrometern durch längliche Strukturen mit einem Durchmesser von wenigen hundr verbundened nm (Abb. 2). Aufgrund der hohen Ähnlichkeit in der Morphologie zu Perlen-Strings, bezeichnet man diese Strukturen "molekularen Ketten". AFM-Analyse dieser Strukturen deutlich gezeigt, deren dreidimensionale Anordnung (Fig. 3). Außerdem SEM-Analyse der verschiedenen Regionen der verschiedenen Proben zeigten, dass dieser Prozess stattgefunden mit hoher Ausbeute (Abb. 2b).
FT-IR-Analyse bereitgestellten Informationen auf die Sekundärstruktur der Peptide Baugruppen. Das Absorptionsspektrum des Amid-I-Bande der Kugelanordnungen durch das Peptid Boc-Phe-Phe-OH (5 mg / ml, 50% Ethanol) gebildet zeigte einen einzelnen Peak bei Amid-I 1.657 cm -1, was eine α-Helix-Konformation. Die von der NH 2-Phe-Phe-OH-Peptid (2 mg / ml, 50% Ethanol) gebildeten röhrenförmigen Strukturen zeigte zwei unterschiedliche Peaks, einen bei 1613 cm -1 und die andere bei 1.682 cm -1. Diese Peaks korreliert Witz ha β-Faltblatt-Sekundärstruktur. Die FT-IR-Spektrum der biomolekularen Ketten, die Coassemblierung der beiden Peptide gebildet, unterschied sich von der Zuordnung für jedes einzelne Peptid, wie es aus zwei Peaks: einen Peak bei 1.653 cm -1, die mit einer α-Helix-Struktur und einem anderen Peak entspricht bei 1.684 cm -1, die einer β-Turn-Konformation (Fig. 4) 48 betrifft. Der Unterschied zwischen den verschiedenen Spektren zeigt eine einzigartige Struktur für biomolekulare Ketten.

Fig. 1 ist. Coassemblierung der Peptide NH 2-Phe-Phe-OH und Boc-Phe-Phe-OH. Schematische Darstellung des Prozesses Coassemblierung.
in "fo: src =" / files/ftp_upload/50946/50946fig2highres.jpg "src =" / files/ftp_upload/50946/50946fig2.jpg "/>
2. Elektronenmikroskopische Analyse der Molekülketten, A) und B) REM-Aufnahmen, c) eine TEM-Aufnahme.
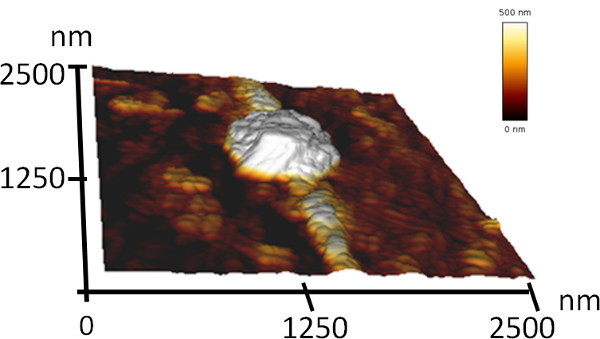
3. Dreidimensionale AFM Topographie der Molekülketten.

4. FT-IR-Analyse der einzelnen selbstorganisierten Strukturen. FT-IR-Spektrum der Probe, die von Boc-Phe-Phe-OH (rot), der röhrenförmigen Strukturen gebildet f erhaltenen SphärenORMED von NH 2-Phe-Phe-OH (grün) und den molekularen Ketten durch die Coassemblierung dieser beiden Peptide (lila) gebildet.
Diskussion
Zusammenfassend zeigt dieses Dokument die Leichtigkeit, mit der Peptid-basierten Anordnungen können in vitro gebildet werden. Das Verfahren beinhaltet im Handel befindlichen Peptiden und Lösungsmittel, und es tritt spontan unter Umgebungsbedingungen durch die Zugabe eines polaren Lösungsmittels in das Reagenzglas. Es ist entscheidend, HFP als Lösungsmittel der Peptide zu verwenden, aufgrund der geringen Löslichkeit der Peptide in anderen organischen Lösungsmitteln. Darüber hinaus aufgrund der hohen Volatilität der HFP ist es notwendig, frischen Lösung für jedes Experiment vorzubereiten. Darüber hinaus sollte das Volumen der Stammlösung von mehr als 10 ul, und der Transfer des Peptids, gelöst in dem polaren Lösungsmittel (Wasser) sollte schnell durchgeführt werden können.
Es sei darauf hingewiesen, dass diese Methode für die Solvatation und Selbstorganisation des Peptids ist eine mögliche Vorgehensweise, die typischerweise für diesen aromatischen Peptide verwendet werden. Andere Ansätze sind jedoch möglich. Darüber hinaus ist die Konzentration der Stamm SOLUT Ion des Peptids in HFP ist, um die Konzentration an HFP in der endgültigen Lösung zu minimieren Hoch in diesen Experimenten.
Diese Handschrift zeigt auch einige der wichtigsten Techniken zur Charakterisierung von Peptid-basierte Strukturen, wie AFM, TEM, SEM und FT-IR. Verwendung von Mikroskopie-Techniken ist es möglich, Informationen über die Morphologie der Baugruppen zu erhalten. Da die Abmessungen dieser Baugruppen im Bereich von Hunderten von Nanometern bis zu einigen Mikrometern, ist es ausreichend, Standard-Elektronenmikroskopie für die Charakterisierung verwendet. Ultrahochauflösenden Geräten nützlich für Strukturen, die kleiner als 100 nm im Durchmesser und bei der Abbildung ohne leitfähige Beschichtung (z. B. Gold) ist erwünscht sind. In einigen Fällen kann die Aufladung der Strukturen durch den Elektronenstrahl des Elektronenmikroskops treten aufgrund der organischen Natur der Struktur. Dies kann durch Senken der Spannung des Betriebssystems gelöst werden.
t "> Zusatzanalyse, FT-IR-Spektroskopie ist eine Methode, die mittlere Auflösung Informationen über die Sekundärstruktur der Baugruppen bietet. In diesem Manuskript wurden die Messungen an trockenen Proben durchgeführt, jedoch ist es möglich, die Struktur der Baugruppen studieren in der Lösungsphase unter Verwendung eines Wirbelzelle.Zusammengenommen kann der Ansatz für die Selbstorganisation von Peptiden hier vorgestellt auf andere Klassen von Peptiden angepaßt werden und könnte zu einem besseren Verständnis der Kräfte und Wechselwirkungen während des Prozesses führen. Darüber hinaus kann es auch zur Bildung von neuen biomolekularen Anordnungen führen.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen konkurrieren.
Danksagungen
Diese Arbeit wurde von der Marie-Curie International Reintegration Grant und von der Deutsch-Israel-Stiftung. Wir erkennen an, Herr Yair Razvag für AFM-Analyse.
Materialien
| Name | Company | Catalog Number | Comments |
| NH2-Phe-Phe-OH | Bachem | G-2925.0001 | |
| Boc-Phe-Phe-OH | Bachem | A-3205.0005 | |
| 1,1,1,3,3,3-hexafluoro-2-propanol | Sigma-Aldrich | 52512-100ML | |
| Ethanol absolute (Dehydrated) AR sterile | Bio-Lab Ltd. | 52555 | Blending with TDW for the preparation of 50% solution |
| Uranyl acetate | Sigma-Aldrich | 73943 | For negative staining. It is possible to work without it. |
| glass cover slip | Marienfeld Laboratory Glassware | 110590 | |
| TEM grids | Electron Microscopy Sciences | FCF200-Cu-50 | Formvar/Carbon 200 Mesh, Cu |
| Quantitive filter paper | Whatman | 1001055 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich | 151882-100G | 99.9 atom % D |
| CaF2 window | PIKE Technologies | 160-1212 | 25 mm x 2 mm window. For FT-IR measurments |
| AFM tips | NanoScience Instruments | CFMR | Aspire probes, CFMR-25 series |
| Filter units | Millipore | SLGV033RS | Millex-GV, 0.22 μm, PVDF, 33 mm, gamma sterilized |
| SEM | FEI | Quanta 200 ESEM | |
| TEM | FEI | Tecnai T12 G2 Spirit | |
| AFM | JPK Instruments | A JPK NanoWizard3 | |
| FT-IR | Thermo Fisher Scientific | Nicolet 6700 advanced gold spectrometer | |
| FT-IR Purge | Parker | BALSTON FT-IR Purge Gas Generator model 75-52 | |
| OMNIC (Nicolet) software | Thermo Nicolet Corporation | For FT-IR spectra analysis | |
| Vortex mixer | Wisd Laboratory Equipment | ViseMix VM | |
| Weight | Mettler Toledo | NewClassic MS | |
| Sputter coater | Polaron | SC7640 Sputter Coater |
Referenzen
- Rajagopal, K., Schneider, J. P. Self-assembling peptides and proteins for nanotechnological applications. Curr. Opin. Struc. Biol. 14, 480-486 (2004).
- Ulijn, R. V., Smith, A. M. Designing peptide based nanomaterials. Chem. Soc. Rev. 37, 664-675 (2008).
- Bong, D. T., Clark, T. D., Granja, J. R., Ghadiri, M. R. Self-assembling organic nanotubes. Angew. Chem. Int. Ed. 40, 988-1011 (2001).
- Vauthey, S., Santoso, S., Gong, H. Y., Watson, N., Zhang, S. G. Molecular self-assembly of surfactant-like peptides to form nanotubes and nanovesicles. P. Natl. Acad. Sci. U.S.A. 99, 5355-5360 (2002).
- Matsui, H., Gologan, B. Crystalline glycylglycine bolaamphiphile tubules and their pH-sensitive structural transformation. J. Phys. Chem. B. 104, 3383-3386 (2000).
- Hartgerink, J. D., Beniash, E., Stupp, S. I. Self-assembly and mineralization of peptide-amphiphile nanofibers. Science. 294, 1684-1688 (2001).
- Reches, M., Gazit, E. Casting metal nanowires within discrete self-assembled peptide nanotubes. Science. 300, 625-627 (2003).
- Reches, M., Gazit, E. Molecular self-assembly of peptide nanostructures: mechanism of association and potential uses. Curr. Nanosci. 2, 105-111 (2006).
- Yuran, S., Razvag, Y., Reches, M. Coassembly of Aromatic Dipeptides into Biomolecular Necklaces. ACS Nano. 6, 9559-9566 (2012).
- Zhang, S. G. Emerging biological materials through molecular self-assembly. Biotechnol. Adv. 20, 321-339 (2002).
- Zhang, S. G. Fabrication of novel biomaterials through molecular self-assembly. Nat. Biotechnol. 21, 1171-1178 (2003).
- Hartgerink, J. D., Granja, J. R., Milligan, R. A., Ghadiri, M. R. Self-assembling peptide nanotubes. J. Am. Chem. Soc. 118, 43-50 (1996).
- Holmes, T. C., et al. Extensive neurite outgrowth and active synapse formation on self-assembling peptide scaffolds. P. Natl. Acad. Sci. U.S.A. 97, 6728-6733 (2000).
- Santoso, S., Hwang, W., Hartman, H., Zhang, S. G. Self-assembly of surfactant-like peptides with variable glycine tails to form nanotubes and nanovesicles. Nano Lett. 2, 687-691 (2002).
- Bellomo, E. G., Wyrsta, M. D., Pakstis, L., Pochan, D. J., Deming, T. J. Stimuli-responsive polypeptide vesicles by conformation-specific assembly. Nat. Mater. 3, 244-248 (2004).
- Reches, M., Gazit, E. Formation of closed-cage nanostructures by self-assembly of aromatic dipeptides. Nano Lett. 4, 581-585 (2004).
- Reches, M., Gazit, E. Self-assembly of peptide nanotubes and amyloid-like structures by charged-termini-capped diphenylalanine peptide analogues. Isr. J. Chem. 45, 363-371 (2005).
- Park, J., Kahng, B., Kamm, R. D., Hwang, W. Atomistic simulation approach to a continuum description of self-assembled beta-sheet filaments. Biophys. J. 90, 2510-2524 (2006).
- Yan, X., et al. Reversible transitions between peptide nanotubes and vesicle-like structures including theoretical modeling studies. ChemEur. J. 14, 5974-5980 (2008).
- Yan, X., et al. Transition of cationic dipeptide nanotubes into vesicles and oligonucleotide delivery. Angew. Chem. Int. Ed. 46, 2431-2434 (2007).
- Burkoth, T. S., et al. Structure of the beta-amyloid (10-35) fibril. J. Am. Chem. Soc. 122 (10-35), 7883-7889 (2000).
- Aggeli, A., et al. Hierarchical self-assembly of chiral rod-like molecules as a model for peptide beta-sheet tapes, ribbons, fibrils, and fibers. P. Natl. Acad. Sci. U.S.A. 98, 11857-11862 (2001).
- Hamley, I. W. Peptide fibrillization. Angew. Chem. Int. Ed. 46, 8128-8147 (2007).
- Maji, S. K., Haldar, D., Drew, M. G. B., Banerjee, A., Das, A. K. Self-assembly of beta-turn forming synthetic tripeptides into supramolecular beta-sheets and amyloid-like fibrils in the solid state. Tetrahedron. 60, 3251-3259 (2004).
- Jahn, T. R., Parker, M. J., Homans, S. W., Radford, S. E. Amyloid formation under physiological conditions proceeds via a native-like folding intermediate. Nat. Struct. Mol. Biol. 13, 195-201 (2006).
- Shimada, T., Sakamoto, N., Motokawa, R., Koizumi, S., Tirrell, M. Self-assembly process of peptide amphiphile worm-like micelles. J. Phys. Chem. B. 116, 240-243 (2012).
- Sedman, V. L., et al. Surface-templated fibril growth of peptide fragments from the shaft domain of the adenovirus fibre protein. Protein Pept. Lett. 18, 268-274 (2011).
- Choi, S. -j, et al. Differential self-assembly behaviors of cyclic and linear peptides. Biomacromolecules. 13, 1991-1995 (2012).
- Ghosh, S., Reches, M., Gazit, E., Verma, S. Bioinspired design of nanocages by self-assembling triskelion peptide elements. Angew. Chem. Int. Ed. 46, 2002-2004 (2007).
- Li, L. C., et al. Self-assembling nanotubes consisting of rigid cyclic gamma-peptides. Adv. Funct. Mater. 22, 3051-3056 (2012).
- Krysmann, M. J., et al. Self-assembly of peptide nanotubes in an organic solvent. Langmuir. 24, 8158-8162 (2008).
- Segman-Magidovich, S., et al. Sheet-like assemblies of charged amphiphilic alpha/beta-peptides at the air-water interface. ChemEur. J. 17, 14857-14866 (2011).
- Jayawarna, V., et al. Nanostructured hydrogels for three-dimensional cell culture through self-assembly of fluorenylmethoxycarbonyl-dipeptides. Adv. Mater. 18, 611-614 (2006).
- Mahler, A., Reches, M., Rechter, M., Cohen, S., Gazit, E. Rigid, self-assembled hydrogel composed of a modified aromatic dipeptide. Adv. Mater. 18, 1365-1368 (2006).
- Ryan, D. M., Doran, T. M., Anderson, S. B., Nilsson, B. L. Effect of C-terminal modification on the self-assembly and hydrogelation of fluorinated Fmoc-Phe derivatives. Langmuir. 27, 4029-4039 (2011).
- Jung, J. P., Gasiorowski, J. Z., Collier, J. H. Fibrillar peptide gels in biotechnology and biomedicine. Biopolymers. 94, 49-59 (2010).
- Xing, B. G., et al. Hydrophobic interaction and hydrogen bonding cooperatively confer a vancomycin hydrogel: A potential candidate for biomaterials. J. Am. Chem. Soc. 124, 14846-14847 (2002).
- Gore, T., Dori, Y., Talmon, Y., Tirrell, M., Bianco-Peled, H. Self-assembly of model collagen peptide amphiphiles. Langmuir. 17, 5352-5360 (2001).
- Ashkenasy, N., Horne, W. S., Ghadiri, M. R. Design of self-assembling peptide nanotubes with delocalized electronic states. Small. 2, 99-102 (2006).
- Mizrahi, M., Zakrassov, A., Lerner-Yardeni, J., Ashkenasy, N. Charge transport in vertically aligned, self-assembled peptide nanotube junctions. Nanoscale. 4, 518-524 (2012).
- Ryu, J., Lim, S. Y., Park, C. B. Photoluminescent peptide nanotubles. Adv. Mater. 21, 1577-1581 (2009).
- Ryu, J., Kim, S. -W., Kang, K., Park, C. B. Synthesis of diphenylalanine/cobalt oxide hybrid nanowires and their application to energy storage. ACS Nano. 4, 159-164 (2010).
- Yan, X., Zhu, P., Li, J. Self-assembly and application of diphenylalanine-based nanostructures. Chem. Soc. Rev. 39, 1877-1890 (2010).
- Amdursky, N., et al. Blue luminescence based on quantum confinement at peptide nanotubes. Nano Lett. 9, 3111-3115 (2009).
- Maity, S., Jana, P., Maity, S. K., Haldar, D. Mesoporous vesicles from supramolecular helical peptide as drug carrier. Soft Matter. 7, 10174-10181 (2011).
- Adler-Abramovich, L., et al. Self-assembled organic nanostructures with metallic-like stiffness. Angew. Chem. Int. Ed. 49, 9939-9942 (2010).
- Pelton, J. T., McLean, L. R. Spectroscopic methods for analysis of protein secondary structure. Anal. Biochem. 277, 167-176 (2000).
- Haris, P. I., Chapman, D. The conformational analysis of peptides using fourier-transform IR spectroscopy. Biopolymers. 37, 251-263 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten