Method Article
Использование сокультивирования обнаружить химически опосредованной межвидовых взаимодействий
В этой статье
Резюме
Бактерии производят секретируемых соединений, которые имеют потенциал, чтобы влиять на физиологию их микробных соседей. Здесь мы опишем экран сокультивирования, который позволяет обнаруживать таких химически опосредованных межвидовых взаимодействий, смешивая почвенных микробов с люминесцентными транскрипционных штаммов корреспондент Сенная палочка на твердых средах.
Аннотация
В природе бактерии редко существуют изолированно, они вместо того, чтобы в окружении множества разнообразных других микроорганизмов, которые изменяют местную окружающую среду путем секреции метаболитов. Эти метаболиты имеют потенциал, чтобы модулировать физиологию и дифференциацию их микробных соседей и, вероятно, важными факторами в установлении и поддержании сложных микробных сообществ. Мы разработали экран сокультивирования флуоресценции основе для выявления таких химически опосредованных микробных взаимодействий. Экран включает объединение флуоресцентный транскрипции репортера напряжение экологических микробов на твердых средах и позволяет колонии расти в сокультивирования. Люминесцентная транскрипции репортер разработан таким образом, что выбранный бактериальный штамм флуоресцирует, когда он выражает особую фенотип интерес (т.е. формирование биопленки, споруляция, производства фактором вирулентности, и т.д..) Скрининг проводится в условиях роста Wheповторное этого фенотипа не выражена (и, следовательно репортер штамм обычно нефлуоресцентный). Когда окружающей микроб выделяет метаболит, который активирует этот фенотип, это диффундирует через агар и активирует флуоресцентного репортера конструкцию. Это позволяет индуцировать-метаболит продуцирующих микроб быть обнаружены: они являются наиболее нефлуоресцирующих колонии проксимальнее флуоресцентных колоний. Таким образом, этот экран позволяет идентифицировать экологических микроорганизмов, которые продуцируют к диффузии метаболитов, которые активируют определенный физиологический ответ у репортера штамма. Эта публикация обсуждает, как: а) выбрать соответствующие условия сокультивирования скрининга, б) подготовить репортеру и охраны окружающей среды микробов для скрининга, в) выполнять экран сокультивирования, г) изолировать предполагаемый вызывая организмов, и д) подтвердить свою деятельность в средней экране. Мы разработали этот метод для выявления почвенных организмов, которые активируют биопленки матрицу-производство в Сенная палочка
Введение
Мы заинтересованы в понимании того, как метаболиты, что бактерии выделяют влияют на физиологию и развитие соседних микробов. Многие метаболиты были охарактеризованы для их биологически активных воздействий на других микробов. Два хорошо описанные примеры включают антибиотики, которые ингибируют рост других микробов, и молекулы кворума, которые изменяют глобальную экспрессию генов других микробов. Тем не менее, бактерии производят многие другие малые молекулы натуральные продукты, которые не имеют никаких известных биологической активности 1. Мы предполагаем, что бактерии развивались и сохранили способность производить некоторые из этих метаболитов, потому что они позволяют им модулировать клеточную физиологию их микробных соседей в сложных микробных сообществ, которые существуют в пределах большинство бактерий.
Типы Сенная палочка клеток
Мы сосредоточили наши исследования по химически опосредованных микробных взаимодействий, которые включают BacilСЗП Сенная. Это не только из-за его статуса как грамположительных модели бактерии и полученные генетических инструментов, доступных для его манипуляции, но и из-за его способности дифференцироваться в характеризующихся типов клеток. Примеры включают в себя клетки, которые: бассейн; производящие внеклеточный матрикс, который необходим для формирования надежной биопленки; компетентные занять ДНК из окружающей среды, а также спорами, среди прочего: 2. Каждый из этих типов клеток выражает характерную транскрипции регулона, что делает их физиологически и / или физически отличны от их генетически идентичных элементов одного уровня. По многим условий роста, несколько типов клеток сосуществуют как различные субпопуляции в пределах одного колонии B. Сенная клетки 3. Хотя многие виды бактерий могут проявлять аналогичную типа клеток неоднородность, это явление было особенно хорошо учился в B. Сенная.
В частности, генов, которые упрegulated внутри каждого из этих конкретных B. типы SUBTILIS клеток выявлено не было. Определение таких генов активируется имеет важное значение для работы, описанной здесь, потому что многие из этих микробных фенотипов интерес представляют трудно или невозможно наблюдать непосредственно. Например, мы не можем визуально обнаружить черта такие как плавание на твердых (1,5%) пластин агара, хотя субпопуляции B. Сенная клетки производят жгутики в этих условиях 3. Другим примером является биопленки матрица-производство. Производство Матрица могут быть визуализированы морфологии колоний (как это приводит к макроскопически морщинистой колоний), но только на определенной среде для роста, и только после нескольких дней роста 4. Однако, зная, какие гены активируется во время дифференцировки, можно построить транскрипции журналистам, которые действуют в качестве маркеров для клеточной дифференцировки в этих типах клеток.
Репортер конструкции
Это люминесцентные тranscriptional репортеры состоят из промоутеров для специфических генов камерного типа вождения производство геном-репортером, например флуоресцентный белок. Примеры включают P HAG-YFP (для купания клетки), P Тапа-YFP (для матричных-продуцирующие клетки биопленки) и Р SSPB-YFP (для спорулирующим клетки), где Р х указывает промоторную область для генной х. Эти репортер конструкции интегрированы в нейтральном локуса на хромосоме (фиг. 1 и см. ниже), так что родной регулирование фенотипа остается нетронутой. Однако теперь, когда клетка выражает эту фенотип, но и выражает флуоресцентный белок. Это обеспечивает легко визуализировать Считывание активации конкретного поведения фенотипической, что позволяет нам экран для микробов, которые активируют эту физиологическую реакцию. Хотя такие журналисты, как правило, используется в микробиологии, они не были широко применяется в экранах в IDENTIFу метаболические взаимодействия между микробами до этого метода была описана 5.
Есть ряд важных соображений в проектировании и строительстве камерного типа конкретных штаммов репортеров. Мы использовали исключительно транскрипционные флуоресцентные журналистам, хотя другие виды конструкций, конечно, возможны. Мы не рекомендуем использовать трансляционных слияний в качестве маркеров для типа клеток дифференциации в нашем экране, однако, по двум причинам: 1) желание покинуть родной камерного типа конкретных белка невозмутимо и 2) признание того, что диффузное, клеточно- Широкий флуоресценции будет легче обнаружить, чем локализованной Puncta в клетках (общей с поступательным слияния).
Выбор ген Репортер
После принятия решения использовать транскрипцию как считывания, ген-репортер должен быть выбран (например, LacZ, флуоресценции или люциферазу). LacZ имеет то преимущество, нуждающихся мере специальныйIzed оборудование для обнаружения, но есть гораздо выше вероятность ложных срабатываний среди экологических микробов. В наших руках, фоновый уровень Lac + организмов среди почвенных микробов было непомерно высокой (>> 10% почвенных микробов были синие (Lac +) на Х-Gal пластин; данные не представлены). Вполне возможно, что путем титрования концентрации Х-Gal в среде, то это может быть оптимизирован, чтобы позволить использование Х-гал репортера, хотя мы не пытались это. Люциферазную обеспечивает высокую чувствительность обнаружения и является наиболее ортогональным репортер: почти нет шансов на экологические микробы по своей сути люминесцентные. Тем не менее, мы обнаружили, что трудно определить приборы в нашем учреждении, что позволило определять люминесценции через целых чашки Петри, а большинство из них были предназначены для сканирования только локализованные регионы в мульти-луночных планшетах. Там также может быть осложнения в визуализации люминесцентных колонии таким образом, чтобы также позволило одновременное Физическоеolation индуцировать организмов. При использовании доверенных лиц, возможно, сделали это возможным, мы вместо этого решили использовать люминесцентные транскрипционные журналистам, которые были доказаны, чтобы работать в B. зиЫШз, при условии, адекватную чувствительность обнаружения и низкой ложных срабатываний среди почвенных организмов, и разрешено использовать из легко доступного оборудования и для визуализации и процедурах изоляции.
Выбор флуорофора
Удельный флуорофором выбран будет зависеть от ваших видов бактерий, агар ростовую среду вы используете, и частности фильтр флуоресценции устанавливает у вас имеется. С нашей аппаратуры, мы обнаружили, что и Б. себя и агар они были выращены на выставлены меньше фоновой флуоресценции, когда были использованы YFP (желтый флуоресцентный белок) фильтры, что делает, что репортер превосходит GFP (зеленый флуоресцентный белок) в наших руках Сенная колонии. Использование кодонов флуоресцирующих белков являютсячасто оптимизированы для эукариот, поэтому важно, чтобы выбрать флуорофором либо известны из литературы для работы в ваших видов бактерий, или для проверки его явно с помощью конститутивный промотор. Большое количество постоянно меняющимися вариантов флуоресцентный белок в настоящее время доступны 6, которые были рассмотрены в ряде источников 7,8, некоторые из которых явно дать указания относительно выбора соответствующего флуоресцентный белок для вашего эксперимента 9.
Выбор Промоутер
Выбор промотора во многом будет зависеть от вашего типа клеток или фенотипа интерес. Для организмов, таких как B. Сенная, некоторые конкретные гены-репортеры камерного типа были созданы в литературе. Для других бактериальных штаммов, рассматривая микрочипов или транскрипционные данные необходимо будет предоставить информацию о том, какие гены сильно активируется в условиях, когда ваш тип ячейки интересомс проявленная. Недавнее исследование в каталог транскрипцию B. Сенная под 104 различных условиях роста с использованием облицовочных микрочипов 10. Эта статья предоставляет исчерпывающую информацию о том, какие гены сильно активируется при различных условиях, которые имеет неоценимое значение для менее хорошо охарактеризованных фенотипов.
Вместо отображения точных промоторные области для каждого интересующего гена, мы обычно просто использовать последовательность 200-500 п.н. выше гена в качестве промотора. Точная длина последовательности зависит от геномной контексте: короткие регионы используются, когда необходимо, чтобы избежать в том числе добывающих кодирующие области из соседних открытые рамки считывания.
Обычный локусов и интеграция
Как сохранить репортер конструкция в вашем бактериального штамма становится последний вопрос в проектировании флуоресцентный транскрипции репортера напряжение. У бактерий интересующих генов часто поддерживаетсяна плазмид с использованием выбор антибиотика. Тем не менее, это не всегда возможно использовать антибиотики в течение сокультивирования не убивая окружающей среды микробов. Если плазмиды стабильно поддерживается в своих бактериальных видов, это может быть возможным выращивать ваши бактерии, содержащие плазмиды-репортера иметь в присутствии антибиотиков, чтобы подготовить репортера для скрининга, а затем устранить антибиотики во время самой сокультивирования в надежде, что плазмида будет в достаточной степени поддерживается для обеспечения флуоресценции. Однако, если плазмиды легко теряются в бактерии или теряются в стрессовых условиях, это не будет жизнеспособным вариантом. Во многих случаях наилучшим решением будет интегрировать репортерной конструкцией на бактериальной хромосоме, которая позволяет стабильное поддержание репортера даже при отсутствии отбора. Для того, чтобы интеграция не нарушить нормальную экспрессию или регулирование вашего интересующего гена, мы рекомендуем интеграции в внематочной месте на хромосоме, что примернон выступать в качестве "нейтрального локуса." В B. Сенная эти интеграционные сайты гены, - когда мутировал - передать фенотип в определенной минимальной среде (с учетом интегранты быть определены без выбора антибиотиков), но не изменяют рост или цены споруляцию в мультимедиа, и включают в себя такие гены, как Amye, Laca, THRc, Pyrd, gltA, и SACA (транспортирующей возможность использовать крахмал, β-галактозиды, треонин, урацил, глутамат, и сахароза, соответственно) 11-13.
В то время как интеграция в этих генов были надежно использоваться в течение многих лет в В. Сенная (особенно на Amye и Laca), похожи знания не могут быть доступны для генов во многих других видов бактерий. Использование фагов участков присоединения большие альтернативы для нейтральных хромосомных участков интеграции: многие видоспецифичность 14-16, а также общие интеграционные сайты, такие как места прикрепления TN7 (ATT TN7) имеютбыли определены и использоваться для генных вставок во многих видов бактерий 17,18.
Экологические микробы
Мы используем почву в качестве непосредственного источника экологических микробов для нашего экрана сокультивирования. Почва содержит большое разнообразие микробов, и многие из этих организмов богатый источник натуральных продуктов. С помощью жидких суспензий почвы, размещенные непосредственно на пластины с нашим флуоресцентного транскрипции репортера деформации (без предварительного выделения бактерий из почвы), мы значительно упростить экспериментальный подход. Почва может быть либо использованы сразу же после сбора урожая, или быть заморожены при -80 ° С для последующего использования. Немедленное использование имеет то преимущество, что большее разнообразие микробов потенциально можно выращивать, в том числе те, которые не выживут замораживания хорошо. Это имеет тот недостаток, что концентрация возделываемых почвенных организмов из этих образцов, неизвестно, увеличивая количество экранов пластин, которые должны быть использованы. ДельAyed использование имеет то преимущество, что КОЕ / мл для каждого источника почвы можно определить заранее, что позволяет оптимизированы количество колоний быть выращены на каждом экране пластины. Тем не менее, он требует, чтобы почва организмы способны выживать замерзания.
Обратите внимание, что диверсификация индуктора бассейн рассматривается (т.е. источников почвы), как представляется, более эффективны при выявлении новых межвидовые взаимодействия, чем углубленного скрининга на той же почве: больше филогенетическое разнообразие наблюдалось в хиты, выявленных в нашем экране матрица индукции как дополнительные источники почвы были рассмотрены, а не скрининга те же источники почвы более тщательно (Е.А. Shank и Р. Kolter, Гарвардской медицинской школы, неопубликованные результаты).
Обзор
Подход, который мы описываем здесь проста с точки зрения его технических требований. Она включает в себя: 1) построение флуоресцентный транскрипции репортера в B. Сенная илидругие виды бактерий из интереса, 2) определение условий, при которых этот репортер не активирован, 3) подготовка аликвоты этого репортера деформации и организмы могут быть экранированных (в нашем случае почвы, но и другие источники могут быть использованы вместо), 4) смешивание этих два комплекта микробов на твердых средах, 5) идентификации и выделения предполагаемый вызывая организмов, и 6), подтверждающий, что эти организмы действительно активировать эту фенотип в средней экране. После идентификации эти организмы и их метаболиты дают нам химических средств для модуляции бактериальной поведение, чтобы изучить бактериальной физиологии и микробных взаимодействий, а также выступать в качестве потенциально новых строительных лесов для будущих терапевтических соединений.
протокол
1. Выберите гена-репортера и Построить Люминесцентная транскрипции Reporter
Для В. зиЫШз:
- См. статью Юпитера в ссылки 19 для протокола, описывающего строительство люминесцентных транскрипционных репортеров в Сенная палочка.
Для других видов бактерий:
- Определение ген, который активируется во время физиологической реакции, представляющей интерес. Это может быть основано на существующей литературы или транскрипции анализа микроба при определенных условиях.
- Построить флуоресцентный транскрипции корреспондента этого гена, чтобы выступать в качестве прокси для изменения фенотипа. Эта конструкция должна включать промотор этого активируется ген вождения производство соответствующего флуоресцентного белка (см. рисунок 1).
- Интеграция эту конструкцию в нейтральное локуса на хромосоме. Это гарантирует, что родной регавляет из интересующего гена не нарушается, и устраняет необходимость механизмов отбора плазмиды (например, антибиотиков), которые могли бы помешать росту экологических микробов.
2. Определите сокультивирования Условия
Для Б. Сенная P Тапа-YFP репортера:
- Использование 0.1x Л.Б., Леннокс (1 г триптон, 0,5 г дрожжевого экстракта, 0,5 г NaCl на литр) среда для этого журналиста, так как В. Сенная матрица-производительности минимально на Лурия бульона 20. Эта среда позволяет Б. Сенная колонии вырастет до субмиллиметровых но наблюдаемой размера, позволяя при этом разнообразный таксонов из почвы расти 5.
- Включите 100 мм MOPS буфер свести к минимуму возможные изменения рН.
Для других видов бактерий:
- Используйте опубликованы транскрипции данных или эмпирически проверить различные условия культивирования для выявления тот, где микроб растет, но activatioн флуоресцентного репортера можно пренебречь (чтобы его активация быть обнаружен, когда репортер штамм выращивают в сокультивирования с индуцирующих микробов.)
- Использование среды с низким содержанием питательных веществ (по отношению к традиционно богатых микробиологических сред) при отборе окружающей среды микробы из верховых средах (таких, как почвы), так как многие олиготрофные бактерии не растут, когда представлены условиях высокой питательной 21. Низкий питательная среда также уменьшает размеры колоний, увеличивая пропускную способность экрана.
- Выберите среду с низкой фоновой флуоресценции и хорошей оптической прозрачностью.
- Оптимизация температуры роста, чтобы позволить как репортер штамм и экологические микробы расти одновременно.
- Рассмотрим добавление буферного агента. Использование буфера в пластинах снизит возможность обнаружения рН-опосредованного изменения в физиологии 22, если такие взаимодействия не представляют интерес.
3. Подготовка Reporter аликвоты
Для Б. Сенная P Тапа-YFP репортера:
- Подряд репортер штамм от -80 ° C замороженной на свежий LB пластины, используя стерильный зубочистку или аппликатора.
- Расти в течение ночи при 30 ° С.
- Выполнение серийных разведений в жидкой культуре, чтобы минимизировать фоновой флуоресценции, возникающей от роста на твердой среде:
- Инокуляции жидкой культуры 5 мл LB и расти при встряхивании при 37 ° С
- Когда культура достигает OD 600 ~ 0,6, развести в 5 мл свежего LB к OD 600 0,02.
- Расти при 37 ° С снова при встряхивании, пока культуры не достигнет OD 600 ~ 0,6.
- Повторите серийные разведения роста в общей сложности 3 раза.
- Пусть конечная культура серийное разведение вырасти до OD 600 ~ 0,4.
- Добавить глицерин до 15-20%.
- Алиготе 50-200 мкл в 0,5 мл микроцентрифужные пробирки и заморозить при температуре -80 ° С.
- Мамаке эквивалентные аликвоты для нефлуоресцентный родительского штамма репортера (они будут обязаны во время вторичного скрининга).
Для других видов бактерий:
- Использование клеток, которые имеют низкий фоновой флуоресценции (т.е. выращивают в условиях, когда имеется мало выражение из промотора, используемого в репортером).
- Сделать и заморозить аликвоты, содержащие известные КОЕ / мл (колониеобразующих единиц на мл) репортера деформации, так что соответствующее число колоний можно выращивать на каждом экране сокультивирования пластины (см. выше раздел для деталей).
- Сделать эквивалентные аликвоты для нефлуоресцентный родительского штамма (они будут обязаны во время вторичного скрининга).
4. Получить для внесения образцов
- Сбор почву в стерильные конические пробирки или стерильные мешки, используя шпатель, отбрасывая верхние 0,5 см открытой поверхности почвы.
- Добавить стерильный физиологический раствор (0,85% NaCl) в соотношении 10 мл на 1 гпочвы с получением суспензии почвы.
- Выберите способ выбить бактерии от частиц почвы: а) немедленное использование свежего образца или б) с задержкой использование после замораживания образца.
- Для немедленного использования, вихрь суспензия в течение 1 мин.
- За несвоевременное использования, смешать суспензии почвы в смесителе в течение трех циклов 1 мин, помещая кувшин блендера на льду в течение 1 мин покоится между смешивания циклов.
- Пусть суспензия почвы довольствоваться ~ 1 мин.
- Перемещение верхний водный слой в свежую пробирку.
- Добавить глицерин до конечной концентрации 15-20%.
- Алиготе 50-200 мкл в 0,5 мл микроцентрифужные пробирки и заморозить при температуре -80 ° С.
5. Определите КОЕ / мл ледяной Reporter и почвенные Аликвоты
- Оттепель мерзлого грунта и репортер аликвоты. Почвенные микробы могут быть оттаивали на льду. Поскольку Б. Сенная лизирует при 4 ° С, эти аликвоты должны быть быстро оттаивают при комнатной температуре, чтобы минимизировать время, затрачиваемое при низкой температуре.
- Сделать два репликации сериал разведения (до 10 -8) в 0,1 × LB или другого изотоническим буфером.
- Пластинчатые 5 мкл каждого пятна серийного разведения на агаровых пластинах той же среды, которая будет использоваться для совместного культивирования скрининга.
- Расти при комнатной температуре (или температуре, которые будут использовать для скрининга).
- На следующий день, подсчитывают количество колоний в каждой точке и вычислить КОЕ / мл каждого из замороженных аликвот.
6. Подтвердите Алиготе концентрации для пластин Спрэд экрана
- Оттепель замороженных аликвоты, как в пункте 5.1.
- Разбавить до 1 × 10 5, 2,5 × 10 5, 5 х 10 5, 1 х 10 6, и 2,5 х 10 7 КОЕ / мл.
- Добавить 50 мкл место каждого разведения в центре отдельных пластин. Они должны дать тарелки с расчетным оптимума 25000 колоний на чашку, а также 2 - и 5 - кратный более и менее, что позволяет лучше фактическая разбавления, которые будут определены.
- Добавьте примерно 20 стерильные стеклянные (3 мм) шарики отаккуратным постукиванием их на тарелку. Бусы обеспечить более равномерное распределение колоний по всей пластине, чем гнутое стекло разбрасыватель делает.
- Распространение клетки, сохраняя пластины по крышке и встряхивая их назад и вперед, вращая их, как вы работаете, пока жидкость не впитается. Не продолжайте трясти бусы раз пластинка сухая, в противном случае он начнет убивать бактерии.
- Флип тарелки над и выбросить шарики в сточных стакан, содержащий этанол.
- Пусть пластины растут на время вашего анализа (например, 24 ч) при правильной температуре для вашего анализа (например, 24 ° C / RT).
- Использование рассекает стереоскоп, подсчитать количество колоний в двух или более полей зрения.
- Рассчитать количество колоний на единицу площади, и определить, сколько колонии на каждой пластине.
- Отрегулируйте будущих разведения по мере необходимости. Фактическое число колоний не так важно, как то же самое число в каждой сопоставимой сито.
7. Подготовка совместного культивирования Плиты
- Оттепель репортер Аликвоту (и аликвоты почвы, если замороженные), как в пункте 5.1.
- Развести репортер (до концентраций, оптимизированных в разделе 6) в 0,1 × LB или другой низкой питательных веществ, изотонический раствор.
- Для мерзлого грунта: развести в концентрации оптимизированной в разделе 6 в 0,1 × LB или другой низкой питательных веществ, изотонический раствор.
- Для свежую почву: Сделайте разведения свежей суспензии почвы, основанные на прогнозировании, что КОЕ / мл суспензии почвы может составлять от 10 -4 до 10 -9 КОЕ / мл.
- Пятно 50 мкл почвы и репортеров разведения Onto центре экрана сокультивирования пластины. Кроме того, плиты почвы в покое и одиночестве в качестве контроля репортер.
- Распространение с помощью стеклянных шариков, как описано в шаге 6.4-6.6.
- Если есть известные условия роста, которые активируют свой флуоресцентный репортер, серию или пластины ваш корреспондент в этих условиях и расти, чтобы использовать в качестве положительного контроля во время скрининга.
- Инкубировать при 24 ° С в течение 24 - 28 часов (или в зависимости от конкретной репортер / анализа)
8. Экран сокультивирования Пластины для флуоресценции
- Использование светлое освещение, сосредоточить свое стереоскоп так что колонии являются точными.
- Посмотрите на почвенно-только пластин, чтобы определить, является ли ваш образец почвы autofluorescent колонии. Если это так, почва может привести к высокой скорости ложных срабатываний (с сопутствующим увеличением вторичного скрининга).
- Используйте высокое отношение репортера: почвы в ваших сокультивирования пластин, чтобы увеличить вероятность, что индуктор будет окруженный несколькими колониями репортеров, уменьшая вероятность их будет обнаружен как ложных срабатываний (рис. 2).
- Используйте другой флуоресцентный белок (один, который излучает в другой канал).
- Определить сроки анализа. Для большинства новых репортеров, сроки потенциальной индукции неизвестно, и, таким образом, должна быть определена эмпирически.
- Начать скрининг на флуоресценции, как только колонии становятся отчетливо видны с вскрытии стереоскопе (увеличение ~ 30X) и продолжают периодически рассмотрении пластины, пока рост не прекратится и / или фоновой флуоресценции становится слишком высокой.
- После того, как временное окно потенциальной индукции определяется для конкретного репортера, он должен быть одинаков для всех чашках, содержащих сокультивирования, что репортер, упрощая мониторинг экрана пластин. Для В. Сенная P Тапа-YFP репортер, подходящее время, чтобы изучить пластины между 24-28 час после посева клеток; для B. Сенная P SSPB-YFP репортер, он находится между 26-32 час роста.
- Максимальное использование чувствительность флуоресценции:
- Убедитесь, что ваш флуоресценции рассекает сферу находится в темной комнате или в окружении плотными шторами. Индукционная, вероятно, будет менее интенсивным, чем конструктивно производства FP и требует больших Sensiсверхпроводимости обнаружить.
- Дайте время флуоресценция лампа для стабилизации и ваши глаза привыкли к темноте, прежде чем пытаться обнаружить флуоресценции от ваших сокультивирования пластин (по крайней мере, 1-2 мин).
- Использование положительного контроля (если у вас есть), убедитесь, что увеличение вы используете позволяет обнаружить флуоресценцию. Увеличение, как правило, лучше всего, если ваше поле зрения составляет примерно 30-50x ваш типичный диаметр колонии (200-400X).
- Выключите яркий свет и открыть затвор для вашего флуоресценции.
- После того как ваши глаза привыкли к темноте, медленно перемещайте пластину назад и вперед через поле зрения, ищу ярких пятен.
- Начать с верхней пластиной и использовать зигзагообразным образом, чтобы перемещать стороны пластины в сторону по мере продвижения к нижней части пластины.
- Практика перемещения пластины в светлого, чтобы получить представление о том, как медленно, чтобы перейти к плите, и быть уверенным, что вы охватывающих весь сюрФронтальная поверхность.
- Перемещение пластины достаточно медленно, что колонии не станет размытым. Лучше оверсэмплинга поверхность, а не мисс областях.
- После одного полного размаха, поверните пластину на 90 ° и повторите. Глаза человека удивительно хороша в обнаружении даже слабый флуоресценции с помощью этого метода.
- Если вы обнаружили флуоресценцию, прекратить движение пластину и вернуться назад и найти флуоресцентного область.
- Включение светлого медленно, определить, является ли флуоресценции связана с бактериальной колонии (и не autofluorescent детрит почва или медиа-компоненты). Если да, то нефлуоресцентный колонии проксимальных к флуоресцентным колонии являются предполагаемые индуцирующие организмы.
9. Изолировать предполагаемых индуцирующие организмов
- После того, как индуцированные (люминесцентные) колонии были выявлены, изолировать тех колоний, секретирующих побуждающие соединений.
- Если достаточно высокая концентрация репортерных колоний, растущих на пластине(> 0,5:1 репортер: почва КОЕ), предполагаемые колонии индуцирующие будет окружен несколькими флуоресцентными колоний (опять же, см. рисунок 2).
- В случаях, когда сложность роста сокультивирования делает его неоднозначным которые колония является индуктором, изолировать несколько потенциальных колонии индуцирования для последующего тестирования на вторичном экране.
- Локализация колоний вы хотите забрать в центре поля зрения.
- Если они близки к краю пластины, поверните пластину так, чтобы кромка пластины от своей доминирующей стороны (т.е. если вы правша, поставить губу пластины слева). Это позволяет приблизиться к колонии под небольшим углом, что повышает точность вашей комплектации.
- Поместите свежие пластины подряд предполагаемые индуцирующие организмов на в близлежащие, а также химическом стакане отходов Утилизацию использованных советы в.
- Оставив флуоресценции лампу, поверните яркий свет медленнона, так что вы сможете определить (по форме и расположению), флуоресцентный колонию и окружающие предполагаемые индуцирующие организмов. Возможно, вам придется идти вперед и назад со светом несколько раз, чтобы быть в состоянии идентифицировать колонии вы хотите забрать, когда нет флуоресценции и только яркий свет.
- Используйте стеклянную палочку (200 мм длиной диаметр х 5 мм), чтобы забрать стерильный, круглый 200 мкл гель-наливного наконечника и удерживайте его как карандаш. Это сбор инструмент вы будете использовать для изоляции отдельных колоний.
- Отдых ваш внешний ладонью на сцену, чтобы стабилизировать его на рабочей поверхности. Наведите другую руку на внутренней, стороны большого пальца вашей руки, чтобы стабилизировать свой инструмент комплектования.
- При необходимости перевернуть снова между видом флуоресценции и светлого определить колонии, которые вы хотите выбрать.
- Ведение пипетки над поверхностью пластины, переместить его в поле зрения и в центре его над колонии вы хотели бы выбрать. Кончик будет не в фокусе.
- Используя внешний край руке (который покоится на столике микроскопа или рабочей поверхности), поворачиваться пипетки медленно вниз в колонию, чтобы ее взяли. Нажмите ее очень легко, стараясь минимизировать сколько других колоний кончик контакты.
- Без поворота инструмента, сбор полосу на участке свежим пластины. Распространение с помощью легких прикосновений, чтобы избежать строжки агар. Поскольку количество клеток, передаваемых с помощью этого метода весьма мала (колонии гораздо меньше, чем обычно манипулировать), один непрерывный полоса приведет изолированных колоний.
- Повторите этот процесс с другими предполагаемыми индуцирующих организмов.
- Инкубируют планшеты при 24 ° C (или температуре вашего анализа).
10. Подряд Предполагаемые индуцирующие Организмы получить выделенной отдельной колонии
- Использование стереоскоп, определить - на основе структуры колонии или морфологии - есть ли различные типы колоний, содержащиеся в каждом из вашего предполагаемого подобрал индucing организмов.
- Посмотрите на колониях с использованием той стадии, когда можно осветить колонии от обоих выше, а также снизу для выявления потенциальных различий колонии.
- Restreak каждого отдельного морфотип на свежий пластины и инкубировать до выросли.
- Restreak еще раз и отращивать. Если разные морфотипы сохраняются, продолжают restreak к чистоте.
11. Retest предполагаемых индуцирующие организмов в средней экране
- Retest все предполагаемых вызывающих организмов в средней экране, чтобы определить, какие активации флуоресцентный транскрипции репортера. Дополнительный экран состоит из газона микроколоний флуоресцентного транскрипции репортера деформации, наряду с контрольными пластинами, на которые предполагаемые индуцирующие организмы исправленной или пятнистый.
- Настройте три одинаковых пластин: один, содержащий микроколония газон флуоресцентного транскрипции репортера деформации (в то же концентрациейс использовалась в течение сокультивирования скрининга), один, содержащий микроколония газон родительского штамма дикого типа без флуоресценции репортера, и один, не содержащий газон.
- Отметить верхнюю часть спины каждой пластины для определения ориентации пластины.
- Добавить маркеры позиционных для Патчи / мест; до десяти предполагаемых вызывающие организмы могут быть проверены на каждого набора пластин (рис. 3).
- Оттепель газон аликвоты (репортер и нефлуоресцентный родительского штамма), как в пункте 5.1.
- Спред 50 мкл разведения 5 х 10 5 КОЕ / мл на газон пластин (или других оптимизированных разведения) с использованием стерильных бусы, как в пункте 6.4.
- Пусть пластины сухой.
- Патч или пятно предполагаемый вызывая организмов:
- Выберите исправлений, если проще и быстрее подход лучшего, и это приемлемо иметь меньше точное число клеток на хранение. Чтобы залатать:
- Прикоснитесь стерильный зубочистку в колонию для теста - не подобрать все клетки.
- Патч (сделать небольшой полоса) на пустой тарелке.
- Повторите патч с пресной зубочисткой на репортера пластины.
- Повторите патч с пресной зубочисткой на контрольной чашке.
- Выберите пятен, если количественное и воспроизводимым подход лучшего. Зрительные позволяет количество депонированных клеток нормированным (см. ссылку 5 для более подробной информации), и позволяет относительной активности различных индуцирующих организмов для сравнения. Чтобы определить:
- Ресуспендируйте предполагаемый вызывая организмов в 1 мл жидких сред в стерильный пластиковый кювете.
- Возьмите OD 600 из resuspensions.
- Используя формулу Х = 250 ÷ (OD 600 - 0,5), добавить громкости X для каждого ресуспендированием к 500 мкл жидкой среды, чтобы получить решение с OD 600 0.5. Этот метод упрощает необходимые шаги пипетирования при выполнении нескольких разведения нормализовать ОР, потому что вы можете использовать тот же объем (500 мкл) для всех ваших разбавителей.
- Пятно 1 мкл каждого OD-нормированный ресуспендирования в каждом из трех пластин.
- Выберите исправлений, если проще и быстрее подход лучшего, и это приемлемо иметь меньше точное число клеток на хранение. Чтобы залатать:
- Пусть растут при 24 ° С в течение 24-28 ч (или в зависимости от конкретной репортер / анализа).
- Используйте флуоресцентный рассекает микроскопом, чтобы определить предполагаемые индуцирующие организмов, которые активируют свой флуоресцентный напряжение репортер, но не ваш родительский штамм управления. Эти изоляты ваши положительные просмотров - экологические микробы, которые выделяют соединения, которые вызывают ваш фенотип интерес.
Результаты
Этот экран был использован для идентификации почвенных организмов секреции соединений, которые изменяют физиологию B. Сенная. Результаты, описанные здесь сосредоточиться на матрицы производящих типа клеток B. Сенная, который производит белок и экзополисахарид, которые необходимы для надежной образования биопленки в этой бактерии. Мы выбрали промотор оперона тапа-sipW-Таса для нашей флуоресцентного репортера конструкции (P Тапа-YFP). Этот оперон кодирует белок структурный компонент матрицы и активируется во время производства биопленки матрицы 23. Наша матрица репортер (рис. 1) был построен, как описано выше 19.
Предыдущая работа показала, что Б. Сенная производит матрицы в ответ на кворума зондирования, как сурфактин на собственного производства молекулы, а также очищенных метаболитов, продуцируемых другими почвенных бактерий 20. Мы были заинтересованы в расширенииисследования как таковые по расследованию в более широком смысле, который почвенные микробы сделать метаболиты способны индуцировать выработку матрицу в B. Сенная. Мы решили использовать разбавленный LB для роста, так как эта среда уже было известно, привести к ухудшению производства матрицы 20, если нас с условием роста, где наш корреспондент штамм нефлуоресцентный. Затем оптимизировали количество колоний, подходящих для скрининга при этих условиях роста. В целях оптимизации каждого экрана пластину, необходимо определить, сколько колонии растут из замороженных почв и репортеров аликвоты и что соответствующая концентрация колоний и питательных условий. В идеале мы хотим, чтобы каждый сокультивирования пластина содержит эквивалентное количество почвы и репортеров колоний (т.е. соотношении 1:1 из репортера: почва) и быть близко друг к другу, отдельные колонии. Это высокое отношение репортер колоний увеличивает вероятность того, что индуктор будет активировать несколько прилегающих к нему репортер колонии. Наличие нескольких переменного токаtivated индуктор колонии окружающие предполагаемый индуктором колонии повышает доверие выявлением фактической индуцирующие организм (рис. 2). Содержание питательных веществ контролирует степень формирования рост / колоний в то время как разбавление инокулята определяет, является ли надлежащим образом диспергированы полученные колонии. На стандартном 10 см диаметром Петри пластины с низким питательной среде, мы обнаружили, что всего около 25 000 колоний на чашку (50 мкл 5 х 10 5 КОЕ / мл разведения) предоставил лучшее разделение B. Сенная колонии на 0.1x LB MOPS среды (рис. 4).
Несмотря на то, рассчитанный КОЕ / мл от серийных разведений обеспечивает приблизительное концентрацию бактерий в аликвотах, необходимо обеспечить, чтобы концентрация полученных колоний подходит, когда весь пластина распространяется с клетками. Рассчитанная КОЕ / пластина и текущая КОЕ / пластина не всегда совпадают (рис. 4 ). Покрытие колонии газоны эквивалентных концентрациях важно, чтобы различные штаммы репортер в сравнении (в противном случае различия в наличие питательных веществ может привести к изменению их физиологическое состояние и влиять на результаты).
После подготовки аликвоты репортера и почвы, мы смешали их на экране сокультивирования пластин и исследовали их на флуоресценцию с помощью стереоскоп (рис. 5). Мы также покрытием элементы управления, которые были только инокулированные либо почве или B. Сенная P Тапа-YFP репортер штамм. Б. Сенная производит биопленки матрицу (флуоресценции) в ответ на многочисленные микробов из почвы, как видно флуоресцентными колоний в образе сокультивирования на рисунке 5. Для почв обследованных нами, у нас были высокие показатели хит для P Тапа-YFP репортера. Как описано в ссылке 5, между 12-67% изолятов (от шести различных образцов почвы) была способность к промсе флуоресценции в P Тапа-YFP репортера штамма. Это в отличие от наших неопубликованных результатов аналогичных экранов с использованием споруляцию (P SSPB-YFP) и компетентность (P ComG-YFP) журналистам. После обширного скрининга (> 200000 колоний для каждого репортера), только два организмы были выявлены, которые индуцируют образование спор, в то время как ни один не был идентифицирован, которые индуцируют компетенции. Таким образом, темпы хит для различных типов клеток являются весьма переменной и может быть трудно предсказать заранее.
Затем мы выбрали отдельные предполагаемые колонии индуцирующие. Колонии на экране сокультивирования пластин достаточно малы по низким питательной среде мы рекомендуем (диаметр субмиллиметровой). Тем не менее, можно точно подобрать и изолировать очень небольшие колонии вручную (рис. 6) в пределах от сложного сокультивирования сито. Ручной метод, который мы используем прост и не требует ни специальных инструментов, ни стерилизация пламенем. Эти предполагаемые колонии индуктор затем restruck к изоляции. Поскольку сокультивирования пластины переполнены колонии, она не является необычным - даже при очень тщательном сбор техника - чтобы иметь более одного организм растущий из каждого предполагаемого образца индуктора. Тщательное изучение должно позволить изоляцию морфологически различных колоний. Все предполагаемые индуцирующие организмы затем проверяется в средней экране. Положительные и отрицательные результаты как в патче и метода точечной показаны на рисунке 3. Принимая во внимание их плотную рост, нашу способность физически собрать вызывая колонии от сокультивирования пластин неплохой, с примерно 50% колоний, рассмотренных в наш вторичный экран будучи истинными положительные стороны. Дополнительные результаты с этого экрана, а также последующая работа выхода из него были описаны ранее 5.
/ Ftp_upload/50863/50863fig1.jpg "/>
Рисунок 1. Люминесцентная транскрипции репортер конструкция. Синий овал представляет собой бактериальную клетку и пунктирная линия представляет свою хромосому. Этот пример показывает, флуоресцентный транскрипции репортера по производству матрицы. Нативный локус остается неизменным (P матрицы на матрицу, где "P" и стрелка указывает промоторную область), в то время как репортерной конструкцией (P-матрица YFP) вставляется в другом месте в хромосоме в нейтральном локуса.
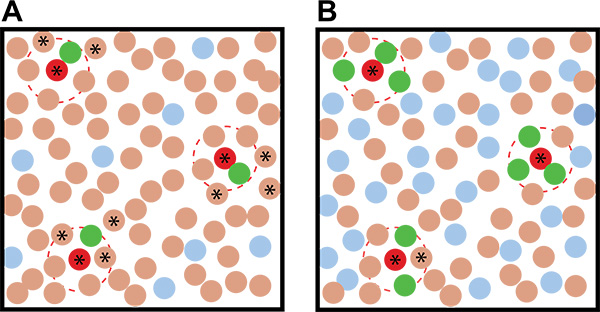
Рисунок 2. Идеализированные примеры сокультивирования результатов скрининга с различным соотношением репортера: экологические микробов. A) Использование низкую репортеру: соотношение окружающей микроб приводит к более неоднозначности в определении предполагаемых побуждающие организмов, чем когда B) Высокая репортер: соотношение окружающей микроб используется. Коричневые круги представляют организмы почвы, красные круги представляют побуждающие организмы почвы, синие круги представляют неиндуцированных репортер колонии, а зеленые колонии представляют индуцированные репортер колонии. Пунктирные красные линии указывают радиус действия индуцирующего метаболита. Звезды указывают нефлуоресцентный колонии, - на основе их близости к флуоресцентных колоний - являются предполагаемые индуцирующие организмов и должны быть собраны и повторно на вторичном экране.
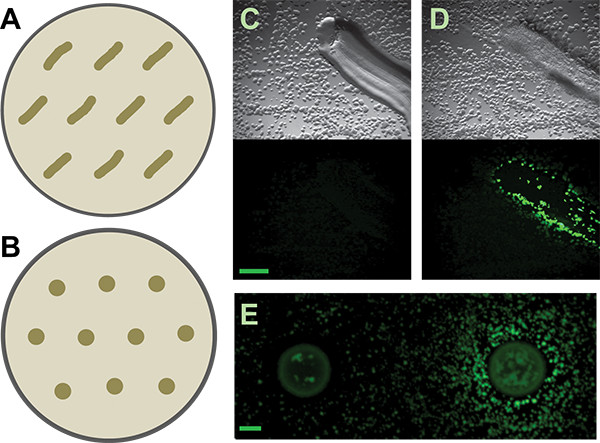
Рисунок 3. Вторичный экран. А и В) Схемы как распределить исправлена или пятнистый изолирует от вторичных экрана пластин, соответственно, для В. Сенная матрица репортер. Более щедрым расстояние может потребоваться для других журналистов или вызывающих изолятов, отдзаканчивающийся диффузионной их активных метаболитов. C и D) Представитель результаты от исправленной почвы изолятов, которые отрицательной и положительной, соответственно, для индукции B. Сенная P Тапа-YFP-репортер. Топ панели являются Светлопольные изображения; нижние панели являются флуоресцентные изображения. Шкала бар составляет 1 мм. Е) Отрицательные и положительные результаты от пятнистой почвы изолирует за тот же репортер. Шкала бар составляет 2 мм.

Рисунок 4. Определение концентрации микроколония. Распределение и размер ваших колоний будет зависеть как от питательных и клеточных концентраций. A) Различия в росте B. Сенная по 0.01x LB (верхний ряд) по сравнению с 0.08x LB (нижний ряд). Клетки на 0.01x LB не образуют в микроколоний, а тшланг на 0.08x LB сделать. (Заметим, что для наших экранах мы увеличили питательных веществ немного от приведенных здесь:. От 0.08x LB в 0,1 × LB) Эти изображения от 1 мкл пятен последовательных 1:05 разведения в известной КОЕ / мл. Экстраполируя эти концентрации, чтобы получить подобные распределения колоний по всей пластине 10 см Петри потребует покрытие (слева направо): 3200000; 640000 и 128000 КОЕ всего за тарелку. Тем не менее, подзорные приводит к неравномерному распределению клеток (они сосредоточены на том месте, краев) по сравнению с распространением клеток по всей пластине. Таким образом, после выбора концентрации питательных веществ, важно рассмотреть пластины распространяются с различными концентрациями. Шкала бар составляет 0,1 мм B) Эти панели показывают результаты распространения (слева направо) 50000;. 25000 и 5000 всего КОЕ на чашку на 0.08x LB пластин. Из этих образов, мы выбрали 25 000 как наш целевой количество КОЕ / пластины. Шкала бар составляет 0,1 мм.

Рисунок 5. Сокультивирования из B. Сенная P Тапа-YFP смешивается с почвенных организмов. Наложение светлого и флуоресценции изображение с экрана сокультивирования пластины, содержащей B. Сенная P Тапа-YFP матрица репортер смешивается с почвенных организмов. Arrowhead указывает предполагаемый индуктор окруженный флуоресценции репортера микроколоний. Шкала бар составляет 1 мм.
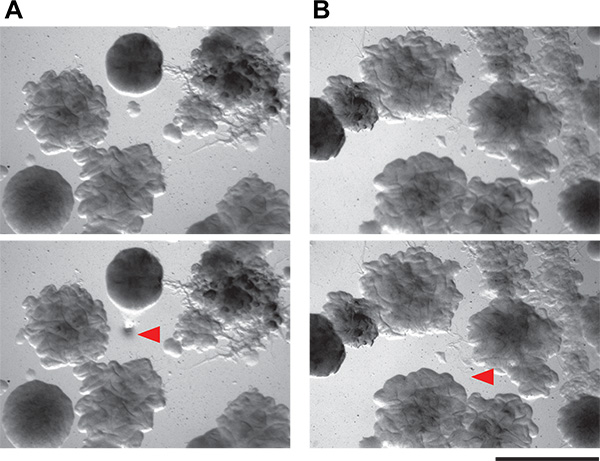
Рисунок 6. Демонстрация целесообразности выделения крошечные бактериальных колоний от сокультивирования пластин. А и Б) Эти панели показывают два поля зрения агаровых чашках, содержащих сложные микробные сообщества из почвы. Колонии в виде небольших, как 0,1 мм, могут быть выделены с помощью техники комплектования описаннуюздесь. Топ панели поле зрения перед колонией, Сбор и нижняя панель те же поля зрения после колонии сбора. Красные стрелки показывают, где клетки были удалены.
Обсуждение
Одним из ограничений, присущих этому протоколу в том, что она опирается на cultivability микробных организмов. Как было хорошо документированы 24, наиболее микробная жизнь на планете не может (пока) можно выращивать в условиях культивирования разведанных на сегодняшний день. Таким образом, огромное количество взаимодействий между микробных видов, которые происходят в естественных условиях будет остаться незамеченными при использовании этого подхода. Однако, так как наше желание, чтобы не только определить наличие таких взаимодействий, но потом также изучить механизмы и молекул, участвующих в посредничестве их, способность культивировать эти микробы является необходимостью. Даже в пахотных видов, эта область была плохо изучены, что делает описанный подход здесь ценный вклад в качестве метода выявления химически опосредованных взаимодействий между микробами. Кроме того, хотя этот протокол был оптимизирован для скрининга матрицы-индукции Сенная палочка, она может теоретически быть применены ку транскрипции люминесцентные репортер в любых других видов бактерий.
Другой связанный ограничением этого подхода является то, что этот экран (по определению) требуется сокультивирования. В естественных условиях, микробы с различными темпами роста все еще может сосуществовать в пространственной близости, используя при этом различные экологические ниши. Такие микробные взаимодействия бы остаться незамеченными на нашем экране сокультивирования, однако, что только позволит рост экологических микробов с питательными требованиями и темпов роста, аналогичных тем, из репортеров видов. Модификации, которые отделяют рост потенциальных индуцирующих организмов от роста репортерного деформации, конечно, возможны. Мы также предполагается, что рост гиф грибков - обычные в почве - может вызвать трудности на экране со-культуры. В то время как короткие сроки нашей экране с Б. Сенная означало, что несколько грибов были обнаружены, добавив, противогрибковые соединения в среде роста мог мinimize эту озабоченность.
Возможность выбора соответствующего фенотипа и ген флуоресцентного репортерного конструкта не должно быть трудно, учитывая множество последовательности и транскрипционных данных либо уже имеющихся или легко доступны для многих видов бактерий. Трудность, однако, с подходом, описанным здесь является необходимость определить условия роста, которые минимизируют фоновой флуоресценции вашего репортера деформации, что позволяет обнаруживать индукции флуоресценции. Идентификация этих условиях часто должно быть сделано опытным путем, хотя транскрипции данные могут помочь результаты этого поиска (например данные плитка микрочипов, доступные для роста В. зиЫШз позволяет идентифицировать условиях, когда гены интерес слабо выражены 10). Для некоторых журналистов это эмпирическое поиск может быть сложным, отчасти потому, что выражение многих бактериальных фенотипов неоднородна. Другими словами, это редко можно найти Conditions, в котором нет клеток в популяции не выражают фенотипа X. Таким образом, в зависимости от количества клеток в этой подгруппе и силы экспрессии гена, может быть трудно определить условия, которые обеспечивают достаточно низкую фоновой флуоресценции, чтобы индукционный быть обнаружены . Альтернативой этой эмпирической поисках идеальных условиях скрининга может быть, чтобы "настроиться" на уровни экспрессии репортера с помощью направленного мутагенеза. Изменяя промоторную область и / или сайта связывания рибосом репортерного конструкта, уровни фоновой флуоресценции может быть уменьшена. Это может расширить полезность этого экрана, позволяя даже гены с некоторой конструктивной активации должны быть рассмотрены для индукции.
После того, как индуцирующие организмы были определены и подтверждены в средней экране, они могут быть филогенетически определены путем секвенирования их гена 16S рРНК. Кроме того, можно количественно оценить степень флуоресценциилюминесценции с использованием OD 600-нормализованное место на вторичном экране 5. Это может предоставить информацию о том, какие члены общины производить соединения, которые влияют на ваш репортер процедить и в какой степени. Следовательно, это может привести к гипотезам о которых микробные взаимодействия могут быть, происходящих в естественных условиях, а также возможность изучить потенциал коэволюции этих производящих и ответы организмов. Другие будущие направления включают выяснения структуры секретированного самой молекулы, определяющие механизм (ы), с помощью которого отвечая организм воспринимает это соединение, и использовать его в качестве химического средства модулировать бактериальных фенотипы.
Даже с изложенных выше соображений, метод, описанный здесь является значительным вкладом. Это позволяет избежать трудозатраты при сборке библиотеки экологических микробов, но позволяет их физическое разделение и изоляцию с помощью твердых средах. Сила этого экрана сокультивирования является то, чтоона обеспечивает концептуально и технически простой метод на экран через тысячи видов микроорганизмов для выявления тех, которые секретируют биологически активных соединений, представляющих интерес, будучи применимы ко многим видов бактерий и фенотипов.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Автор благодарит Роберто Kolter (Гарвардская медицинская школа) за его неоценимые советы и помощь в процессе разработки этого экрана сокультивирования. Она также благодаря Мэтью державы за чтение рукописи для ясности, и Чиа-ух Ченг за помощь в получении Рисунок 6.
Материалы
| Name | Company | Catalog Number | Comments |
| Spectrophotometer | Any spectrophotomer capable of measuing OD600 absorbance values. | ||
| Luria broth, Lennox | VWR | 80017-484 | Alternative media sources may be necessary. |
| Glass beads, 3 mm | VWR | 26396-508 | |
| Gel loading tips, round | VWR | 29442-666 | |
| Glass rods | VWR | 59060-069 | |
| Fluorescence dissecting stereoscope | Zeiss | N/A | The author used a Zeiss Stemi SV6 dissection stereoscope with an EXFO X-cite 120 fluorescent light source, a long-pass YFP filter cube, an achromat 0.63X objective, 10X eyepieces, and an Axio HRC HR digital camera. Most screening was done with the focusing mount at 2.0-3.2X. Any dissecting stereoscope with fluorescence capabilities is fine, provided you have the correct filters for the FP you are using. It is best if there is a shutter that allows you to easily switch between brightfield and fluorescense, as well as a stage that allows illumination from above and below. If you want to capture images, an attached camera is also necessary. |
Ссылки
- Berdy, J. Bioactive microbial metabolites. J. Antibiot. 58, 1-26 (2005).
- Lopez, D., Vlamakis, H., Kolter, R. Generation of multiple cell types in Bacillus subtilis. FEMS Microbiol. Rev. 33, 152-163 (2009).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Shank, E. A., et al. Interspecies interactions that result in Bacillus subtilis forming biofilms are mediated mainly by members of its own genus. Proc. Natl. Acad. Sci. U.S.A. 108, 1236-1243 (2011).
- Piston, D. W., Patterson, G. H., Lippincott-Schwartz, J., Claxton, N. S., Davidson, M. W. . Introduction to Fluorescent Proteins. , (2013).
- Chudakov, D. M., Matz, M. V., Lukyanov, S., Lukyanov, K. A. Fluorescent proteins and their applications in imaging living cells and tissues. Physiol. Rev. 90, 1103-1163 (2010).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J. Cell Sci. 120, 4247-4260 (2007).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Nicolas, P., et al. Condition-dependent transcriptome reveals high-level regulatory architecture in Bacillus subtilis. Science. 335, 1103-1106 (2012).
- Middleton, R., Hofmeister, A. New shuttle vectors for ectopic insertion of genes into Bacillus subtilis. Plasmid. 51, 238-245 (2004).
- Shimotsu, H., Henner, D. J. Construction of a single-copy integration vector and its use in analysis of regulation of the trp operon of Bacillus subtilis. Gene. 43, 85-94 (1986).
- Guerout-Fleury, A. M., Frandsen, N., Stragier, P. Plasmids for ectopic integration in Bacillus subtilis. Gene. 180, 57-61 (1996).
- Semsey, S., Blaha, B., Koles, K., Orosz, L., Papp, P. P. Site-specific integrative elements of rhizobiophage 16-3 can integrate into proline tRNA (CGG) genes in different bacterial genera. J. Bacteriol. 184, 177-182 (2002).
- Charpentier, E., et al. Novel cassette-based shuttle vector system for gram-positive bacteria. Appl. Environ. Microbiol. 70, 6076-6085 (2004).
- Yang, H. Y., Kim, Y. W., Chang, H. I. Construction of an integration-proficient vector based on the site-specific recombination mechanism of enterococcal temperate phage phiFC1. J. Bacteriol. 184, 1859-1864 (2002).
- Choi, K. H., Schweizer, H. P. mini-Tn7 insertion in bacteria with single attTn7 sites: example Pseudomonas aeruginosa. Nat. Protoc. 1, 153-161 (2006).
- Craig, N. L. Tn7: a target site-specific transposon. Mol. Microbiol. 5, 2569-2573 (1991).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (60), e3796 (2012).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Vartoukian, S. R., Palmer, R. M., Wade, W. G. Strategies for culture of 'unculturable' bacteria. FEMS Microbiol. Lett. 309, 1-7 (2010).
- Romano, J. D., Kolter, R. Pseudomonas-Saccharomyces interactions: influence of fungal metabolism on bacterial physiology and survival. J. Bacteriol. 187, 940-948 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Zengler, K., et al. Cultivating the uncultured. Proc. Natl. Acad. Sci. U.S.A. 99, 15681-15686 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены