Method Article
Usando Coculture detectar quimicamente mediada interespécies Interações
Neste Artigo
Resumo
As bactérias produzem compostos secretados que têm o potencial de afetar a fisiologia de seus vizinhos microbianas. Aqui nós descrevemos uma tela de co-cultura, que permite a detecção de tais quimicamente mediadas entre espécies interações misturando os micróbios do solo com cepas repórter transcrição fluorescentes de Bacillus subtilis em meios sólidos.
Resumo
Na natureza, as bactérias raramente existem isoladamente, pois eles estão em lugar cercado por um conjunto diversificado de outros microorganismos que alteram o meio ambiente local através da secreção de metabólitos. Estes metabolitos têm o potencial de modular a fisiologia ea diferenciação de seus vizinhos microbiana e são prováveis fatores importantes para a criação e manutenção de comunidades microbianas complexas. Nós desenvolvemos uma tela à base de co-cultura de fluorescência para identificar tais interacções microbianas quimicamente mediados. A tela envolve a combinação de uma transcrição repórter tensão fluorescente com micróbios ambientais em meios sólidos e permitindo que as colônias de crescer em co-cultura. O repórter transcricional fluorescente é projetado de modo que a estirpe bacteriana escolhido fluorescência quando é expressar um fenótipo de interesse particular (ou seja, a formação de biofilme, esporulação, a produção de fator de virulência, etc.) A triagem é realizada sob condições de crescimento where este fenótipo não é expresso (e, por conseguinte, a estirpe repórter é tipicamente não fluorescente). Quando um micróbio ambiental segrega um metabolito que activa este fenótipo, difunde-se através do ágar e ativa a construção repórter fluorescente. Isto permite que a indução de-produzir metabolito micróbio para ser detectado: eles são as colónias não fluorescentes mais proximais às colónias fluorescentes. Assim, esta tela permite a identificação de micróbios ambientais que produzem metabólitos difusíveis que ativam uma resposta fisiológica especial em uma cepa repórter. Esta publicação aborda como: a) selecionar as condições de co-cultura de rastreio adequados, b) preparar o repórter e micróbios ambientais para o rastreio, c) executar a tela de co-cultura, d) isolar putativo induzindo organismos, e e) confirmar a sua atividade em uma tela secundária. Nós desenvolvemos este método para triagem de organismos do solo que ativam biofilme matriz de produção em Bacillus subtilis
Introdução
Estamos interessados em compreender como os metabólitos que as bactérias segregam afetam a fisiologia eo desenvolvimento de micróbios vizinhos. Muitos metabolitos têm sido caracterizados pelos seus efeitos bioactivos sobre os outros micróbios. Dois exemplos bem descritos incluem os antibióticos, os quais inibem o crescimento de outros micróbios e as moléculas de quorum sensing, que alteram a expressão génica global de outros micróbios. No entanto, as bactérias produzem muitos outros produtos naturais de moléculas pequenas que não têm bioatividades conhecidos 1. Nós supomos que as bactérias têm evoluído e preservada a capacidade de produzir alguns destes metabolitos porque lhes permitem modular a fisiologia celular de seus vizinhos microbianos nas comunidades microbianas complexas dentro do qual a maioria das bactérias existentes.
Tipos de células de Bacillus subtilis
Nós nos concentramos nossos estudos sobre as interações microbianas quimicamente mediadas que envolvem Bacilsubtilis lus. Isto não é só por causa de seu status como a bactéria modelo Gram-positivas e as ferramentas genéticas resultantes disponíveis para sua manipulação, mas também devido à sua capacidade de se diferenciar em tipos de células caracterizadas. Exemplos incluem células que são: natação; produzem a matriz extracelular que é necessária para a formação de biofilme robusta; competentes para tomar-se o ADN a partir do ambiente, e esporulação, entre outros, 2. Cada um destes tipos de células expressa um regulão transcricional característica que torna fisiologicamente e / ou fisicamente distintos dos seus irmãos geneticamente idênticos. Sob muitas condições de crescimento, vários tipos de células como coexistir várias subpopulações dentro de uma única colónia de B. células subtilis 3. Embora muitas espécies de bactérias podem apresentar análogo tipo de célula heterogeneidade, esse fenômeno tem sido particularmente bem estudada em B. subtilis.
Em particular, os genes que são upregulated dentro de cada uma delas específica B. tipos celulares subtilis foram identificados. A identificação de tais genes regulados positivamente é essencial para o trabalho aqui descrito, porque muitos destes fenótipos microbianos de interesse são difíceis ou impossíveis de se observar directamente. Por exemplo, não podemos detectar visualmente um traço, como natação em sólidos (1,5%) placas de ágar, apesar de uma subpopulação de B. células subtilis produzir flagelos nessas condições 3. Um outro exemplo é a produção de matriz de biofilme. Produção Matrix pode ser visualizado por morfologia da colônia (pois resulta em colônias macroscopicamente enrugados), mas apenas em determinado meio de crescimento, e só depois de vários dias de crescimento 4. No entanto, sabendo que os genes são regulados positivamente durante a diferenciação, podemos construir os repórteres de transcrição que actuam como marcadores de diferenciação celular para estes tipos de células.
Construções repórter
Estes fluorescente trepórteres ranscriptional constituído pelos promotores de genes específicos do tipo de células conduzindo a produção de um gene repórter, por exemplo, uma proteína fluorescente. Exemplos incluem P hag-YFP (para natação células), P Tapa-YFP (para as células produtoras de matriz do biofilme), e P SSPB-YFP (por esporulação células), onde P x indica a região do promotor para o gene de x. Estas construções repórter são integrados em um locus neutro no cromossoma (Figura 1 e ver abaixo) de modo a que a regulação natural do fenótipo é deixada intacta. No entanto, agora, quando uma célula expressa este fenótipo, que também expressa uma proteína fluorescente. Isso proporciona uma leitura fora facilmente visualizado da ativação de determinado comportamento fenotípica, permitindo-nos para triagem de micróbios que ativam esta resposta fisiológica. Embora tais repórteres são comumente usados em microbiologia, eles não têm sido amplamente aplicada em telas para identifinterações metabólicas y entre micróbios antes deste método foi descrito 5.
Há uma série de considerações importantes na concepção e construção de linhagens de células-repórter específicos do tipo. Utilizamos repórteres fluorescentes exclusivamente de transcrição, embora outros tipos de construções são certamente possível. Nós desencorajamos o uso de fusões traducionais como marcadores para diferenciação tipo de célula em nossa tela, no entanto, por duas razões: 1) o desejo de deixar o tipo específico de célula proteína nativa imperturbável, e 2) o reconhecimento de que uma difusa, célula- grande fluorescência será mais fácil de detectar do que puncta localizada no interior das células (comum com fusões de translação).
Selecção do gene repórter
Após decidir usar a transcrição de um-para ler, o gene repórter tem de ser seleccionada (por exemplo, LacZ, fluorescência, ou luciferase). LacZ tem a vantagem de necessitar de menos especializado equipamento para detectar, mas há uma probabilidade muito maior de falsos positivos entre os micróbios ambientais. Nas nossas mãos, o nível de Lac + organismos entre os micróbios do solo do fundo era proibitivamente alta (>> 10% de micróbios do solo eram azuis (Lac +) em placas de X-gal, dados não mostrados). É possível que por titulação da concentração de X-gal no meio, isto pode ser optimizado para permitir a utilização de um repórter com X-gal, mas não esta tentativa. Luciferase oferece alta sensibilidade de detecção e é a repórter mais ortogonal: não há quase nenhuma chance de micróbios ambientais sendo luminescente inerentemente. No entanto, descobrimos que é difícil identificar instrumentação em nossa instituição que permitiu a detecção de luminescência através de placas de Petri inteiras, como a maioria foi projetado para digitalizar regiões localizadas apenas em placas de multi-bem. Também pode haver complicações em visualizar colônias luminescentes de uma maneira que também permitiu a física simultânea éolation de organismos indutores. Enquanto estiver usando fiduciários pode ter feito isso possível, nós em vez optou por usar repórteres transcricionais fluorescentes, que foram provados trabalhar em B. subtilis, uma sensibilidade adequada e de detecção de baixas taxas de falsos positivos entre os organismos do solo, e deixou-se o uso de instrumentação facilmente disponível para visualização e os procedimentos de isolamento.
Seleção Fluoróforo
O fluoróforo específico escolhido dependerá de suas espécies de bactérias, o meio de crescimento agar você está usando, eo filtro de fluorescência especial define que você tem disponível. Com a nossa instrumentação, descobrimos que tanto o B. subtilis colônias si e do ágar foram cultivadas em exibiram fundo menos fluorescência quando foram usados filtros YFP (proteína fluorescente amarela), fazendo com que o repórter superior a GFP (proteína fluorescente verde) em nossas mãos. A utilização do codão de proteínas fluorescentes sãofreqüência otimizada para eucariotos, tornando-se importante para selecionar um fluoróforo ou conhecidos da literatura para trabalhar em suas espécies bacterianas, ou para testá-lo explicitamente usando um promotor constitutivo. Um grande número de constante evolução variantes da proteína fluorescente estão disponíveis 6, que foram revistas em uma série de fontes de 7,8, alguns dos quais prevêem expressamente a orientação sobre a escolha de uma proteína fluorescente apropriado para a sua experiência 9.
Seleção Promotor
A seleção de um promotor vai depender muito do seu tipo de célula ou fenótipo de interesse. Para os organismos tais como B. subtilis, alguns genes repórter específicos do tipo de célula ter sido estabelecida na literatura. Para outras cepas de bactérias, examinando microarray ou transcrição de dados será necessário fornecer informações sobre quais genes são altamente regulada de acordo com as condições em que o seu tipo de célula de interesse is manifestado. Um estudo recente catalogado a transcrição de B. subtilis sob 104 diferentes condições de crescimento, utilizando microarrays azulejos 10. Este documento fornece informações abrangentes sobre quais genes são altamente regulada em diferentes condições, o que é de valor inestimável para os fenótipos menos bem caracterizados.
Ao invés de mapear regiões promotoras específicas para cada gene de interesse, que normalmente simplesmente utilizar a sequência de 200-500 pb a montante do gene como promotor. O comprimento exacto sequência depende do contexto genómico: regiões mais curtas são utilizados quando necessário para evitar a inclusão de regiões codificantes a montante da vizinha grelhas de leitura abertas.
Loci e integração Neutro
Como manter a construção repórter na sua estirpe bacteriana torna-se a última pergunta na concepção de uma fluorescente tensão transcricional repórter. Em bactérias, os genes de interesse são frequentemente mantidosem plasmídeos utilizando selecção de antibiótico. No entanto, pode não ser possível a utilização de antibióticos durante a co-cultura sem matar os microrganismos ambientais. Se os plasmídeos são mantidos estavelmente nas suas espécies bacterianas, pode ser possível aumentar suas bactérias contendo um plasmídeo repórter-borne, na presença de antibióticos para se preparar o repórter para o rastreio, e, em seguida, eliminar o uso de antibióticos durante o próprio co-cultura, na esperança de que o plasmídeo vai ser suficientemente mantidas para permitir a fluorescência. No entanto, se plasmídeos são facilmente perdidos em sua bactéria, ou são perdidos em condições de estresse, isso não vai ser uma opção viável. Em muitos casos, a melhor solução será integrar a construção repórter no cromossoma bacteriano, que permite a manutenção estável do repórter, mesmo na ausência de selecção. Para que a integração para não atrapalhar a expressão normal ou regulação de seu gene de interesse, recomendamos a integração em um site ectópica no cromossomo que can actuar como um "locus de ponto morto." Em B. subtilis estes locais de integração são genes que - quando mutado - transmitir um fenótipo em certos meios de comunicação mínima (permitindo que integrantes de ser identificado sem seleção antibiótico), mas não alteram o crescimento ou a produção de esporos em rich media, e incluem genes como Amye, Laca, thrC, pyrD, gltA, e Saca (transmitindo a capacidade de utilizar o amido, β-galactósidos, treonina, uracilo, glutamato, e de sacarose, respectivamente) 11-13.
Embora a integração destes genes têm sido eficazmente utilizados durante muitos anos em B. subtilis (particularmente em Amye e Laca), conhecimento similar pode não estar disponível para genes em muitas outras espécies bacterianas. O uso de pontos de ligação de fagos são ótimas alternativas para os locais de integração cromossômicas neutros: muitas espécies específicas 14-16, bem como sites gerais de integração, como local de ligação a Tn7 (att Tn7) têmforam identificados e utilizados para as inserções de genes em muitas espécies bacterianas 17,18.
Micróbios ambientais
Nós usamos o solo como uma fonte direta de micróbios ambientais para nossa tela de co-cultura. O solo contém uma grande diversidade de microrganismos, e muitos desses organismos são fonte rica de produtos naturais. Utilizando suspensões líquidas de solo colocadas directamente em placas com a estirpe repórter fluorescente transcrição (sem isolamento prévio das bactérias do solo), é possível simplificar consideravelmente a abordagem experimental. O solo pode ser usado imediatamente após a colheita, ou congeladas a -80 ° C para uso futuro. O uso imediato tem a vantagem de uma maior diversidade de micróbios potencialmente podem ser cultivadas, incluindo aqueles que não irão sobreviver a congelação bem. Tem a desvantagem de que a concentração de organismos do solo cultivável a partir destas amostras é desconhecida, o aumento do número de placas de tela que tem de ser usado. Delayed utilização tem a vantagem de que os ufc / ml para cada fonte de solo pode ser determinada previamente, permitindo que um número optimizado de colónias a ser cultivado em cada placa de tela. No entanto, é necessário que os organismos do solo ser capaz de sobreviver congelamento.
Note-se que a diversificação da piscina indutor sendo examinado (ou seja, as fontes de solo) parece ser mais eficaz na identificação de novas interações entre espécies de triagem em profundidade sobre o mesmo solo: maior diversidade filogenética foi observada nos acessos identificados em nossa tela de matriz de indução como fontes adicionais de solo foram examinados em vez de triagem das mesmas fontes de solo mais profundamente (EA Shank e R. Kolter, Harvard Medical School, resultados não publicados).
Visão global
A abordagem que descrevemos aqui é simples em termos de seus requisitos técnicos. Trata-se: 1) a construção de uma transcrição repórter fluorescente em B. subtilis ou umaoutras espécies de bactérias de interesse, 2) identificar as condições em que este repórter não está activado, 3) a preparação de aliquotas desta estirpe repórter e os organismos a serem rastreadas (no nosso caso o solo, mas outras fontes podem ser utilizadas em vez disso), 4) misturando estes dois conjuntos de micróbios em meios sólidos, 5) identificar e isolar putativo induzindo organismos, e 6), confirmando que estes organismos, de fato ativar este fenótipo em uma tela secundária. Uma vez identificados, estes organismos e seus metabolitos nos fornecem ferramentas químicas para modular o comportamento de bactérias, para estudar a fisiologia bacteriana e interacções microbianas, e para actuar potencialmente como novos suportes para compostos terapêuticos futuras.
Protocolo
1. Selecione um gene repórter e construir um repórter fluorescente Transcriptional
Para B. subtilis:
- Veja o artigo Jove em referência 19 para um protocolo que descreve a construção de repórteres transcricionais fluorescentes em Bacillus subtilis.
Por outras espécies bacterianas:
- Identificar um gene que é regulada positivamente durante a resposta fisiológica de interesse. Isto pode basear-se na literatura existente ou análise de transcrição do micróbio em condições particulares.
- Construir um repórter transcricional fluorescente para este gene para agir como um proxy para a mudança no fenótipo. Esta construção deve incluir o promotor desse gene regulada positivamente dirigir a produção de uma proteína fluorescente apropriado (ver Figura 1).
- Integrar esta construção em um lugar neutro no cromossomo. Isso garante que reg nativalação do gene de interesse não é perturbada, e evita a necessidade de mecanismos de selecção de plasmídeo (por exemplo, antibióticos) que possam interferir com o crescimento de micróbios ambientais.
2. Determinar as condições de co-cultura
Para B. subtilis P tapa-YFP repórter:
- Utilização 0.1x LB, Lennox (1 g de triptona, 0,5 g de extracto de levedura, 0,5 g de NaCl por litro) médio para este repórter, uma vez que B. subtilis matriz de produção é mínimo em Caldo de Luria 20. Este meio permite B. colônias subtilis crescer para submillimeter mas o tamanho observável, permitindo taxa diferente de solo para crescer 5.
- Incluir tampão 100 mM MOPS para minimizar as alterações de pH potenciais.
Por outras espécies bacterianas:
- Usar os dados publicados da transcrição ou empiricamente testar diversas condições de cultura para identificar um onde o micróbio cresce, mas o activation do repórter fluorescente é negligenciável (para permitir a sua activação ser detectado quando a estirpe repórter é cultivado em co-cultura com microorganismos que induzem.)
- Use um meio com baixo teor de nutrientes (em relação a meios microbiológicos tradicionalmente ricos) na triagem micróbios ambientais de ambientes oligotróficos (como o solo), uma vez que muitas bactérias oligotróficas não crescem quando se apresenta com condições de alta de nutrientes 21. Um meio baixo nutriente também reduz o tamanho da colônia, aumentando a taxa de transferência da tela.
- Escolha um meio com baixa fluorescência de fundo e boa claridade óptica.
- Otimizar temperatura de crescimento para permitir que tanto a tensão repórter e micróbios ambientais para crescer simultaneamente.
- Considere a adição de um agente de tamponamento. A utilização de tampão de placas vai reduzir a possibilidade de detecção de alterações mediadas por pH na fisiologia 22, a menos que tais interacções são de interesse.
3. Prepare Repórter Alíquotas
Para B. subtilis P tapa-YFP repórter:
- Streak repórter tensão de -80 ° C estoque congelado em uma placa de LB fresco usando um palito estéril ou aplicador stick.
- Crescer durante a noite a 30 ° C.
- Efectuar diluições em série em cultura líquida para minimizar a fluorescência de fundo resultante de crescimento em meio sólido:
- Inocular 5 ml de uma cultura líquida de LB e crescer com agitação a 37 ° C.
- Quando a cultura atinge uma DO600 ~ 0,6, dilui-se em 5 ml de LB fresco a um OD600 de 0,02.
- Crescer a 37 ° C de novo, com agitação, até as culturas atinge OD600 ~ 0,6.
- Repita diluições de crescimento de série um total de 3x.
- Vamos cultura última diluição em série crescer para OD 600 ~ 0.4.
- Adicionar glicerol a 15-20%.
- Aliquota 50-200 ul em 0,5 ml tubos de microcentrífuga e congelar a -80 ° C.
- Make alíquotas equivalentes para a pressão dos pais não fluorescente do repórter (que será necessário durante a triagem secundária).
Por outras espécies bacterianas:
- Usar as células que possuem um baixo ruído de fundo de fluorescência (isto é, são cultivadas sob condições onde há pouca expressão do promotor utilizado no repórter).
- Faça e congelar alíquotas contendo conhecidos ufc / ml (unidades formadoras de colônias por ml) da cepa repórter para que um número adequado de colônias podem ser cultivadas em cada prato tela co-cultura (ver secção acima para mais detalhes).
- Faça alíquotas equivalentes para a pressão dos pais não fluorescente (que será necessário durante a triagem secundária).
4. Obtenção de amostras de solo
- Coletar solo em tubos cônicos estéreis ou sacos estéreis, utilizando uma espátula, descartando o início de 0,5 cm da superfície do solo exposto.
- Adicionar solução salina estéril (0,85% NaCl) a uma razão de 10 ml por 1 g dede solo para formar uma suspensão do solo.
- Selecione um método para retirar as bactérias de partículas do solo: a) o uso imediato de amostra fresca ou b) utilização adiada após o congelamento da amostra.
- Para uso imediato, lama vortex por 1 min.
- Para uso tardio, misturar lama do solo no liquidificador por três ciclos de 1 min, colocando o copo no gelo por 1 min descansa entre os ciclos de mistura.
- Vamos suspensão solo contentar com ~ 1 min.
- Mover camada aquosa superior para um tubo fresco.
- Adicionar glicerol a uma concentração final de 15-20%.
- Aliquota 50-200 ul em 0,5 ml tubos de microcentrífuga e congelar a -80 ° C.
5. Determine ufc / mL de Congelados repórter e alíquotas de solo
- Descongele um solo e repórter congelado alíquota. Micróbios do solo pode ser descongeladas em gelo. Porque B. subtilis lise a 4 ° C, estas alíquotas devem ser descongeladas rapidamente a RT para minimizar o tempo gasto, a baixa temperatura.
- Faça duas Seria replicarl (diluições a 10 -8) em 0,1 x LB ou outro tampão isotónica.
- Placa 5 pontos ul de cada diluição em série em placas de agar do mesmo meio que vai ser usado para o rastreio de co-cultura.
- Crescer no RT (ou a temperatura que será utilizado para a triagem).
- No dia seguinte, contar o número de colónias dentro de cada local e calcular ufc / ml de cada uma das aliquotas congeladas.
6. Confirme alíquotas concentrações para placas de tela Espalhe
- Descongelar uma alíquota congelada como no passo 5.1.
- Dilui-se a 1 x 10 5, 2,5 x 10 5, 5 x 10, 5, 1 x 10 6 e 2,5 x 10 7 ufc / mL.
- Adicionar 50 ul de cada diluição de ponto de centro das placas individuais. Estes devem produzir chapas com o óptimo calculado de 25.000 colónias por placa, bem como 2 - e 5 - vezes mais e menos, permitindo a melhor diluição real a ser determinado.
- Adicionar cerca de 20 vidro estéril (3 mm) contas porsuavemente tocando-lhes na placa. Contas de proporcionar uma distribuição mais uniforme das colónias ao longo da placa do que um espalhador de vidro encurvada faz.
- Espalhe as células, mantendo pratos na bancada e sacudindo-os e para trás, girando-os como você trabalha, até que o líquido tenha sido absorvido. Não continue a apertar as contas uma vez que a placa estiver seca, caso contrário ele vai começar a matar as bactérias.
- Virar sobre placas e descartar contas em copo de resíduos contendo etanol.
- Vamos placas crescer durante o tempo de seu ensaio (por exemplo, 24 horas) à temperatura correcta para o seu ensaio (por exemplo, 24 ° C / RT).
- Usando um estereoscópio dissecando, contar o número de colônias em dois ou mais campos de visão.
- Calcule o número de colônias por área, e determinar quantos são colônias em cada placa.
- Ajuste diluições futuro, se necessário. O número real de colónias não é tão importante como tendo o mesmo número de cada placa da tela comparáveis.
7. Prepare placas co-cultura
- Alíquota Thaw repórter (e alíquota do solo se congelado) como no passo 5.1.
- Diluir repórter (a concentrações otimizadas na secção 6) em 0,1 x LB ou outro baixo de nutrientes, solução isotônica.
- Para o solo congelado: Diluir a concentração otimizada na secção 6 em 0,1 x LB ou outro baixo de nutrientes, solução isotônica.
- Para solo fresco: Fazer diluições de lama fresca no solo, com base na previsão de que os ufc / mL da suspensão de solo pode variar de 10 -4 a 10 -9 ufc / ml.
- Ponto 50 mL de solo e repórter diluições Onto centro da placa tela co-cultura. Além disso, a placa de solo sozinho e repórter sozinho como controlos.
- Espalhe usando esferas de vidro, tal como descrito no passo 6,4-6,6.
- Se existem condições de crescimento conhecidos que activam o repórter fluorescente, sequência ou sua placa repórter sob estas condições e crescem para usar como um controlo positivo durante o rastreio.
- Incubar a 24 ° C por 24 - 28 horas (ou, conforme apropriado para o seu repórter / ensaio)
8. Placas de co-cultura de Tela para fluorescência
- Usando iluminação de campo claro, focar sua estereoscópio para que as colônias são nítidas.
- Olhe para as placas só no solo para determinar se a sua amostra de solo tem autofluorescent colônias. Se assim for, este solo pode resultar numa elevada taxa de falsos positivos (com um aumento concomitante no rastreio secundário).
- Use uma alta proporção de repórter: do solo em suas placas co-cultura para aumentar a chance de que um indutor será cercado por várias colônias repórter, reduzindo a chance de que eles serão detectados como falsos-positivos (Figura 2).
- Utilizar uma proteína fluorescente diferente (que emite num canal diferente).
- Determine o tempo de ensaio. Para a maioria dos novos jornalistas, o momento da indução potencial é desconhecido e, portanto, deve ser determinada empiricamente.
- Comece a triagem para fluorescência, logo que as colônias tornam-se claramente visíveis com o estereoscópio de dissecação (ampliação ~ 30X) e continuar a analisar periodicamente as placas até que o crescimento cessou e / ou fluorescência de fundo torna-se muito alto.
- Uma vez que a janela de tempo de indução potencial é determinada para um determinado repórter, deve ser semelhante para todas as placas que contêm co-cultura que repórter, o que simplifica o controlo das placas de tela. Para a B. repórter subtilis P tapa-YFP, o momento adequado para examinar as placas é entre 24-28 horas após o plaqueamento das células, pois o B. subtilis P SSPB-YFP repórter, é entre 26-32 horas de crescimento.
- Maximize a sua sensibilidade de fluorescência:
- Garantir a sua fluorescência dissecar escopo é em um quarto escuro ou rodeado por cortinas opacas. Indução provavelmente serão menos intensas do que um FP constitutivamente produzido e requer uma maior sensibilidadedade de detectar.
- Dê tempo para que a lâmpada fluorescente para estabilizar e seus olhos para ajustar à escuridão antes de tentar detectar a fluorescência de suas placas co-cultura (pelo menos 1-2 min).
- Usando um controle positivo (se tiver), certifique-se que a ampliação que você está usando permite detectar a fluorescência. A ampliação é geralmente melhor se o seu campo de visão é de aproximadamente 30-50x o diâmetro típico colônia (200-400X).
- Desligue a luz brilhante e abrir o obturador para a sua fluorescência.
- Depois seus olhos se adaptaram à escuridão, mover-se lentamente a placa frente e para trás através de seu campo de visão, à procura de pontos brilhantes.
- Iniciar a partir do topo da placa e usar um padrão em zigue-zague para mover o lado-a-lado da placa à medida que move em direcção ao fundo do prato.
- Prática de mover a placa em campo claro para ter uma noção de como lentamente se mudar para placa, e para ter certeza de que você está cobrindo todo o surárea enfrentar.
- Mova a placa devagar o suficiente para que as colônias não se tornar embaçada. É melhor oversample a superfície em vez de áreas de perder.
- Após uma varredura completa, desligue a placa de 90 ° e repita. Os olhos humanos são muito bons em detectar até desmaiar fluorescência através deste método.
- Se você detectar fluorescência, parar de se mover a placa e voltar e encontrar a área fluorescente.
- Rodar o campo claro lentamente, determinar se a fluorescência associada com uma colónia de bactérias (e não autofluorescente detritos solo ou componentes de meios). Se assim for, as colônias não fluorescentes proximais para a colônia fluorescente são organismos induzindo putativos.
9. Isolar putativos Indutores Organismos
- Uma vez induzidas (fluorescentes) colónias foram identificadas, isolar aquelas colónias que segregam os compostos indutores.
- Se uma concentração de colónias repórter suficientemente elevada estão a crescer na chapa(> 0,5:1 repórter: ufc solo), as colônias indutores putativos será cercado por várias colônias fluorescentes (mais uma vez, ver Figura 2).
- Em casos onde a complexidade do crescimento cocultura torna ambígua que colónia é o indutor, isolar vários potenciais indutores colónias para teste subsequente no ecrã secundário.
- Localize as colônias que você quer pegar no centro do campo de visão.
- Se eles estão perto da borda da placa, gire a placa de modo que a borda da placa está longe de sua mão dominante (ou seja, se você é destro, coloque a borda da placa no lado esquerdo). Isto permite-lhe abordar as colônias em um ângulo baixo, o que melhora a precisão da sua colheita.
- Coloque placas frescas para raia os organismos induzindo putativos para nas proximidades, bem como um copo de resíduos para descarte pontas usadas em.
- Deixando a lâmpada fluorescente, ligue a luz brilhante lentamentediante, de modo que você será capaz de identificar (pela forma e posição), a colônia fluorescente e os supostos organismos induzindo circundantes. Você pode precisar de ir e voltar com a luz algumas vezes para ser capaz de identificar as colônias que você quer pegar, quando não há fluorescência e apenas a luz brilhante.
- Use uma vareta de vidro (200 mm de comprimento mm de diâmetro x 5) para pegar uma estéril, redondo de 200 mL gel-loading ponta e segurá-la como um lápis. Esta é a ferramenta que você escolher irá utilizar para isolar colônias individuais.
- Repouse a palma exterior contra o palco para estabilizá-lo na superfície de trabalho. Coloque a outra mão no lado interno, polegar de sua mão para estabilizar a sua ferramenta de colheita.
- Se necessário, virar novamente entre as visões de fluorescência e campo claro para identificar as colônias que você deseja escolher.
- Manter a ponta da pipeta sobre a superfície da placa, mova-o em seu campo de visão e centralizá-lo acima da colônia você gostaria de escolher. A dica será fora de foco.
- Usando a borda externa da mão (que está descansando no palco microscópio ou superfície de trabalho), gire a ponta da pipeta lentamente para a colônia para ser escolhido. Tocá-lo levemente, tentando minimizar quantas outras colônias os contatos ponta.
- Sem girar a ferramenta de colheita, raia em uma seção de um novo prato. Espalhe com um toque suave para evitar cinzelamento o ágar. Uma vez que o número de células transferidas por este método é bastante pequeno (as colónias são muito menores do que tipicamente manipulado), uma única sequência contínua irá resultar em colónias isoladas.
- Repita esse processo com outros organismos indutores putativos.
- Incubar as placas a 24 ° C (ou a temperatura do seu ensaio).
10. Streak putativos Indutores Organismos obter colônias isoladas Solteiro
- Usando um estereoscópio, determinar - com base na estrutura de colônia ou morfologia - se existem diferentes tipos de colônias contidos dentro de cada um a sua ind pegou putativoucing organismos.
- Olhe para as colônias, utilizando uma fase em que você pode iluminar as colônias de ambos acima, bem como de baixo para detectar diferenças de colônias em potencial.
- Restreak cada morfotipo diferente para uma nova placa e incubar até cresceu.
- Restreak mais uma hora e deixou crescer. Se diferentes morfotipos persistir, continuar a restreak a pureza.
11. Teste novamente putativos Indutores Organismos na tela secundária
- Retestar todos os organismos que induzem putativos num ecrã secundário para determinar que está a activar a transcrição repórter fluorescente. A tela secundária consiste em um gramado de microcolônias da fluorescente tensão transcricional repórter, junto com placas de controle, no qual os organismos induzindo putativos são corrigidos ou manchados.
- Configure três placas idênticas: um contendo um gramado microcolony da fluorescente tensão transcricional repórter (na mesma concentração de ums foi utilizado durante o rastreio de co-cultura), um contendo um relvado microcolônia da estirpe do tipo selvagem, sem um repórter fluorescente, e uma que não contém qualquer relvado.
- Marcar a parte superior das costas de cada placa para determinar a orientação do prato.
- Adicionar marcadores de posição para os patches / manchas; até dez organismos induzem putativos podem ser testados em cada conjunto de placas (Figura 3).
- Alíquotas gramado Thaw (repórter e não fluorescente tensão dos pais) como no passo 5.1.
- Espalhe 50 ul de uma diluição de 5 x 10 5 ufc / mL em placas de relva (ou outras diluições optimizados) usando grânulos estéreis como no passo 6.4.
- Vamos placas seco.
- Patch ou manchar putativo induzindo organismos:
- Escolha patching se uma abordagem mais fácil e mais rápido for desejado, e é aceitável ter um número menor de células depositadas preciso. Para corrigir:
- Toque em um palito estéril para a colônia de teste - não pegar todas as células.
- Patch (fazer uma pequena raia) sobre a placa em branco.
- Repita patch com palito fresco no prato repórter.
- Repita patch com palito fresco na placa de controle.
- Selecione a mancha se uma abordagem quantitativa e reprodutível é desejada. Mancha permite que o número de células depositadas ser normalizadas (ver referência 5 para detalhes completos), e permite que a potência relativa de diferentes organismos indutores a serem comparadas. Para detectar:
- Ressuspender putativo induzir organismos em 1 ml de meio líquido num cadinho de plástico estéril.
- Leve o OD 600 dos resuspensions.
- Usando a fórmula X = 250 ÷ (OD 600-0,5), adicionar o volume X de cada resuspensão de 500 mL de meio líquido para obter uma solução com uma DO600 de 0,5. Este método simplifica os passos de pipetagem necessários ao executar várias diluições para normalizar OD de porque você pode usar o mesmo volume (500 mL) para todos os seus diluentes.
- Ponto 1 ul de cada resuspensão OD-normalizados para cada um dos três blocos.
- Escolha patching se uma abordagem mais fácil e mais rápido for desejado, e é aceitável ter um número menor de células depositadas preciso. Para corrigir:
- Vamos crescer a 24 ° C por 24-28 horas (ou, conforme apropriado para o seu repórter / ensaio).
- Use o microscópio de dissecação fluorescentes para identificar os organismos induzindo putativos que ativam sua tensão repórter fluorescente, mas não a sua estirpe de controlo parental. Estes isolados são seus sucessos positivos - os micróbios ambientais que secretam compostos que induzem o seu fenótipo de interesse.
Resultados
Esta tela foi utilizado para identificar organismos do solo que segregam uma substância que altera a fisiologia do B. subtilis. Os resultados descritos aqui focar o tipo de células produtoras de matriz de B. subtilis, que produz a proteína e exopolissacarídeo que são necessários para a formação de biofilme robusta nesta bactéria. Nós selecionamos o promotor do operon Tapa-sipW-tasa para nossa construção repórter fluorescente (P tapa-YFP). Este operão codifica o componente estrutural de proteína da matriz e é regulada positivamente durante a produção da matriz do biofilme 23. Nosso repórter matriz (Figura 1) foi construído tal como foi previamente descrito 19.
Os trabalhos anteriores mostraram que B. subtilis produz matriz em resposta ao quorum-sensing-como molécula surfactina auto-produzido, bem como metabólitos purificados produzidos por outras bactérias do solo 20. Estávamos interessados em expandir oestudos si para investigar de forma mais ampla que os micróbios do solo fazem metabólitos capazes de induzir a produção da matriz em B. subtilis. Nós eleito para usar diluída LB para o crescimento, uma vez que este meio já era conhecido por levar a uma má produção de matriz 20, proporcionando-nos uma condição de crescimento, onde o nosso esforço foi repórter não fluorescente. Em seguida, otimizou o número de colônias apropriadas para a seleção sob estas condições de crescimento. A fim de otimizar cada placa de tela, é necessário determinar quantas colônias brotar do solo e repórter alíquotas congeladas e que a concentração adequada de colônias e condições nutricionais são. O ideal é que queremos cada placa de co-cultura para conter um número equivalente de solo e repórter colônias (ou seja, uma proporção de 1:01 repórter: solo) e de ser espaçados, colônias individuais. Esta alta taxa de colônias repórter aumenta a probabilidade de que um indutor irá ativar várias colônias repórter circundantes. Tendo ac múltiplacolônias indutor tivated em torno de uma suposta confiança indutor colônia aumenta na identificação do organismo indutor real (Figura 2). O teor de nutrientes controla a extensão de formação de crescimento / colónia enquanto a diluição do inoculo determina se as colónias resultantes são adequadamente dispersas. Em uma placa de Petri 10 cm de diâmetro com um meio padrão nutriente de baixo, verificou-se que cerca de 25.000 colónias total por placa (50 ul de 5 x 10 5 ufc / mL de diluição) proporcionou a melhor separação de B. subtilis colônias em meio LB 0,1 x MOPS (Figura 4).
Embora o ufc calculado / ml a partir das diluições em série proporciona uma concentração aproximada de bactérias nas alíquotas, que é necessário para assegurar que a concentração das colónias resultantes é apropriado quando a totalidade da placa é espalhado com as células. O ufc / placa calculados e reais ufc / placa nem sempre são idênticos (Figura 4 ). Galvanização gramados colônia de concentrações equivalentes é importante para permitir que diferentes cepas repórter a ser comparado (caso contrário, as diferenças na disponibilidade de nutrientes pode alterar seu estado fisiológico e interferir nos resultados).
Após a preparação de aliquotas do repórter e do solo, misturou-se-lhes em placas de co-cultura de tela e examiná-los quanto à fluorescência utilizando um microscópio estereoscópico (Figura 5). Também banhado controles que só foram inoculados com tanto solo ou a B. subtilis P tapa-YFP tensão repórter. B. subtilis produz matriz do biofilme (fluorescência) em resposta a vários micróbios do solo como pode ser visto pelas colónias fluorescentes na imagem de co-cultura na Figura 5. Para os solos que examinamos, tivemos altas taxas de sucesso para o repórter P tapa-YFP. Tal como descrito na referência 5, entre 12-67% das amostras (a partir de seis amostras de solo diferentes) tinham a capacidade de indufluorescência ce na cepa repórter P tapa-YFP. Isso está em contraste com os nossos resultados inéditos de telas análogos utilizando a esporulação (P SSPB-YFP) e competência (P COMG-YFP) jornalistas. Após uma extensa triagem (> 200.000 colônias para cada repórter), apenas dois organismos foram identificados que induzir a esporulação, enquanto nenhum foi identificado que induzem competência. Assim, as taxas de acerto para diferentes tipos de células são altamente ser variável e pode ser difícil de prever com antecedência.
Em seguida, pegou colônias indutores putativos individuais. As colônias nas placas de tela co-cultura são muito pequenas no meio baixo-nutriente recomendamos (diâmetro submillimeter). No entanto, é possível escolher com precisão e isolar muito pequenas colónias de mão (Figura 6) a partir de dentro de uma placa de tela complicado cocultura. O método manual que usamos é simples e não requer nem ferramentas especializadas nem esterilização chama. Estas colónias indutor putativas são então restruck para isolamento. Porque as placas de co-cultura estão lotados com as colônias, não é raro - mesmo com a técnica de colheita muito cuidado - para ter mais de um organismo em crescimento de cada amostra indutor putativo. Um exame cuidadoso deve permitir o isolamento de colônias morfologicamente distintas. Todos os organismos induzem putativas são então testados em um ecrã secundário. Os resultados positivos e negativos de ambos o remendo e método de mancha são mostrados na Figura 3. Considerando-se o seu crescimento denso, a nossa capacidade de coletar fisicamente induzindo colônias das placas de co-cultura foi muito bom, com cerca de 50% das colônias examinadas em nossa tela secundária sendo verdadeiros positivos. Resultados adicionais a partir desta tela, bem como o acompanhamento do trabalho que emerge dela ter sido descrito anteriormente 5.
/ Ftp_upload/50863/50863fig1.jpg "/>
Figura 1. Transcricional fluorescente repórter construto. The oval azul representa uma célula bacteriana ea linha tracejada representa seu cromossomo. Este exemplo mostra um repórter fluorescente transcricional para a produção de matriz. O locus nativo permanece intacto (P matriz-matriz, em que "P" e a seta indica a região do promotor), enquanto a construção repórter (P matriz-YFP) é inserido em outro lugar no cromossoma no locus neutro.
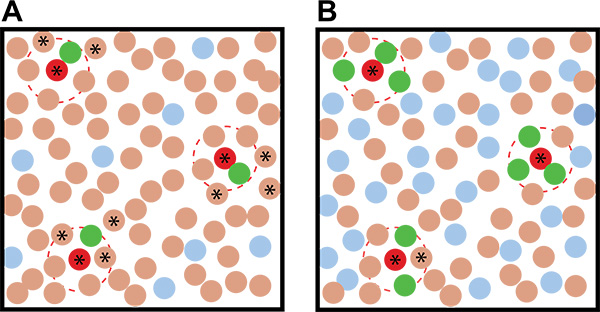
Figura 2. Exemplos idealizada de co-cultura rastreio resultados com diferentes proporções de o repórter: micróbios ambientais. A) Usando um baixo repórter: relação micróbio ambiental conduz a uma maior ambigüidade na identificação de supostos organismos indutores do que quando B) Um alto repórter: relação micróbio ambiental é usado. Os círculos marrons representam os organismos do solo, os círculos vermelhos representam induzindo os organismos do solo, os círculos azuis representam colônias repórter uninduced, e as colônias verdes representam colônias repórter induzidas. As linhas tracejadas indicam vermelho o raio de acção do metabolito indução. Estrelas indicam colônias não fluorescentes que - com base em sua proximidade com as colônias fluorescentes - são organismos que induzem putativos e deve ser escolhido e reanalisada na tela secundária.
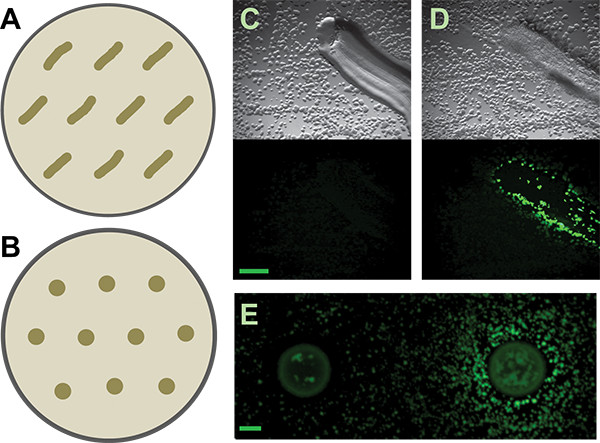
Figura 3. Tela secundária. A e B) Esquema de como distribuir patched ou manchado isolados em placas de ecrã secundário, respectivamente, para a B. subtilis repórter matriz. Espaçamento mais generoso pode ser necessária para outros repórteres ou isolados que induzem, depterminando na difusibilidade de seus metabólitos ativos. C e D) Os resultados representativos de solo corrigido isolados que são negativos e positivos, respectivamente, para induzir a B. subtilis P tapa-YFP-repórter. Painéis de topo são as imagens de campo claro; painéis inferiores são as imagens de fluorescência. Barra de escala é de 1 mm. E) negativo e resultados positivos a partir do solo manchado isola para o mesmo repórter. Barra de escala é de 2 mm.

Figura 4. Determinação da concentração microcolony. A distribuição eo tamanho de seus colônias depende tanto as concentrações de nutrientes e celulares. D) As diferenças no crescimento de B. subtilis sobre 0.01x LB (linha superior) versus 0.08x LB (linha inferior). Células em 0.01x LB não formam em microcolônias, enquanto tmangueira em 0.08x LB fazer. (Observe que, para nossas telas aumentamos os níveis de nutrientes ligeiramente dos apresentados aqui:. 0.08x de LB para 0,1 x LB) Estas imagens são a partir de 1 ul de pontos seqüenciais 01:05 diluições no conhecido ufc / ml. Extrapolando a partir destas concentrações, para obter distribuições semelhantes de colônias através de uma placa de 10 centímetros Petri exigiria chapeamento (da esquerda): 3.200.000; 640.000 e 128.000 total de ufc por placa. No entanto, os resultados da mancha de distribuição desigual de células (que estão concentrados nas extremidades do ponto) em comparação com células de propagação ao longo de toda a placa. Assim, uma vez que uma concentração de nutrientes é seleccionado, é importante examinar as placas espalhadas com uma variedade de concentrações. A barra de escala é de 0,1 mm B) Estes painéis mostram os resultados de difusão (a partir da esquerda) 50.000;. 25.000 e 5.000 ufc total por placa em placas LB 0.08x. A partir dessas imagens, foram selecionados 25.000 como nosso alvo número de ufc / placa. Barra de escala é de 0,1 mm.

Figura 5. Coculture de B. subtilis P tapa-YFP misturado com os organismos do solo. Overlay de imagem de fluorescência de campo claro e de uma placa de tela co-cultura contendo o B. subtilis P tapa-YFP repórter matriz misturado com organismos do solo. Ponta de seta indica indutor putativo rodeado por microcolónias fluorescência repórter. Barra de escala é de 1 mm.
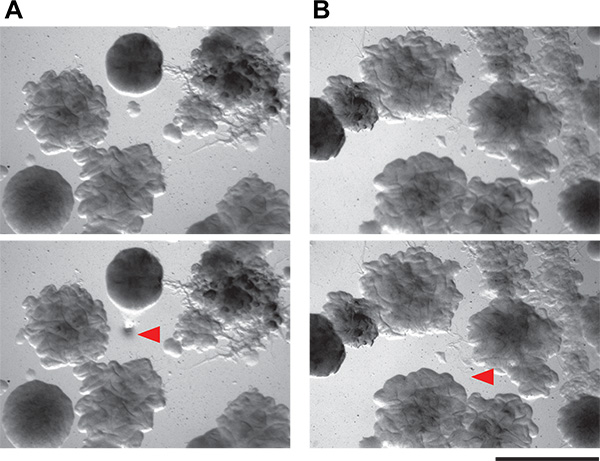
Figura 6. A demonstração da viabilidade de isolar pequenas colônias de bactérias a partir de placas de co-cultura. A e B) Estes painéis mostram os dois campos de visão de placas de ágar que contêm as comunidades microbianas complexos de solo. Colónias como pequenas quanto 0,1 mm, podem ser isolados utilizando a técnica de separação descritoaqui. Principais painéis são o campo de visão antes de pegar colônia, e painel de fundo são os mesmos campos de visão depois de colônia colheita. Setas vermelhas indicam que as células foram removidas.
Discussão
Uma das limitações inerentes a este protocolo é que ele conta com o cultivabilidade de organismos microbianos. Como tem sido bem documentada 24, mais a vida microbiana no planeta não pode (ainda) ser cultivadas sob as condições de cultura exploradas até o momento. Assim, um grande número de interações entre espécies microbianas que estão ocorrendo em ambientes naturais vai passar despercebido usando essa abordagem. No entanto, uma vez que o nosso desejo é o de identificar não só a existência de tais interacções, mas, em seguida, também estudar os mecanismos e as moléculas envolvidas na mediação eles, a capacidade para cultivar estes micróbios é uma necessidade. Mesmo dentro das espécies cultiváveis, esta área tem sido pouco explorado, tornando a abordagem descrita aqui uma valiosa contribuição como um método para identificar interações quimicamente mediadas entre micróbios. Além disso, embora a este protocolo foi optimizado para o rastreio de matriz de indução de Bacillus subtilis, que pode, teoricamente, ser aplicadas a umrepórter fluorescente transcricional y em quaisquer outras espécies de bactérias.
Outra limitação relacionada dessa abordagem é que esta tela (por definição) requer co-cultura. Em ambientes naturais, os micróbios com diferentes taxas de crescimento ainda podem coexistir em proximidade espacial ao explorar diferentes nichos ambientais. Tais interações microbianas iria passar despercebido por nossa tela de co-cultura, no entanto, que só irá permitir o crescimento de micróbios ambientais com exigências nutricionais e taxas de crescimento semelhantes às das espécies repórter. Modificações que iria separar o crescimento dos organismos potenciais indutores do crescimento da estirpe repórter são certamente possíveis. Também previu que o crescimento de hifas de fungos - comuns no solo - pode causar dificuldades na tela de co-cultura. Embora a curto prazo da nossa tela com B. subtilis significava que foram detectados alguns fungos, a adição de compostos anti-fúngicos para o meio de crescimento pudesse minimize essa preocupação.
A capacidade de selecionar um fenótipo e gene apropriado para a construção repórter fluorescente não deve ser difícil, considerando a riqueza de sequenciamento de dados e de transcrição ou já disponíveis ou facilmente obtidos para muitas espécies bacterianas. No entanto, uma dificuldade com a abordagem descrita aqui é a necessidade de identificar as condições de crescimento que minimizam a fluorescência da sua estirpe repórter de fundo, permitindo a detecção de indução de fluorescência. A identificação destas condições deve ser feita frequentemente de forma empírica, embora os dados de transcrição pode ajudar esta pesquisa (por exemplo, os dados de azulejos microarray disponíveis para o crescimento de B. subtilis permitir a identificação das condições onde os genes de interesse são fracamente expressas 10). Para alguns jornalistas esta pesquisa empírica pode ser difícil, em parte porque a expressão de muitos fenótipos bacterianas é heterogênea. Em outras palavras, é raro encontrar cs condições em que não há células dentro da população está expressando Fenótipo X. Assim, dependendo do número de células, no que subpopulação e a força de expressão do gene, que podem ser difíceis de identificar as condições que proporcionam suficientemente baixo de fluorescência de fundo para permitir a indução de ser detectada . Uma alternativa para esta pesquisa empírica para as condições ideais de rastreio podem ser de "afinar" o nível do repórter usando mutagénese dirigida de expressão. Ao alterar a região do promotor e / ou local de ligação do ribossoma da construção repórter, os níveis de fluorescência de fundo pode ser reduzida. Isso poderia expandir a utilidade desta tela, permitindo que até mesmo genes com algum ativação constitutiva de ser examinado para indução.
Uma vez que os organismos indutores foram identificados e confirmados numa segunda tela, que pode ser identificado por filogeneticamente sequenciar o gene 16S rRNA. Também é possível quantificar a medida de fluorescênciacência usando OD local 600 normalizada no ecrã secundário 5. Isso pode fornecer informações sobre o que os membros da comunidade produzir compostos que afetam a sua tensão repórter e em que medida. Consequentemente, isso pode levar a hipóteses sobre qual interações microbianas podem estar ocorrendo em ambientes naturais ea capacidade de explorar a coevolução potencial destes organismos produtores e responder. Outras indicações futuras incluem elucidar a estrutura da própria molécula secretada, a determinação do mecanismo (s) pelo qual o organismo responde detecta este composto, e usá-lo como uma ferramenta química modular fenótipos bacterianas.
Mesmo com as considerações acima referidas, o método descrito aqui é uma contribuição significativa. Isso evita o trabalho envolvido na montagem de uma biblioteca de micróbios ambientais, mas permite a separação física e isolamento por meios sólidos. A força desta tela é que co-culturafornece um método tecnicamente simples e conceptualmente a tela através de milhares de espécies de microorganismos para identificar aqueles que segregam os compostos bioactivos de interesse, enquanto que é aplicável a muitas espécies de bactérias e fenótipos.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
O autor agradece a Roberto Kolter (Harvard Medical School) para o seu conselho e assistência durante o desenvolvimento desta tela co-cultura de valor inestimável. Ela também graças Matthew Powers para a leitura do manuscrito para a clareza e Chia-yi Cheng para a assistência com a obtenção Figura 6.
Materiais
| Name | Company | Catalog Number | Comments |
| Spectrophotometer | Any spectrophotomer capable of measuing OD600 absorbance values. | ||
| Luria broth, Lennox | VWR | 80017-484 | Alternative media sources may be necessary. |
| Glass beads, 3 mm | VWR | 26396-508 | |
| Gel loading tips, round | VWR | 29442-666 | |
| Glass rods | VWR | 59060-069 | |
| Fluorescence dissecting stereoscope | Zeiss | N/A | The author used a Zeiss Stemi SV6 dissection stereoscope with an EXFO X-cite 120 fluorescent light source, a long-pass YFP filter cube, an achromat 0.63X objective, 10X eyepieces, and an Axio HRC HR digital camera. Most screening was done with the focusing mount at 2.0-3.2X. Any dissecting stereoscope with fluorescence capabilities is fine, provided you have the correct filters for the FP you are using. It is best if there is a shutter that allows you to easily switch between brightfield and fluorescense, as well as a stage that allows illumination from above and below. If you want to capture images, an attached camera is also necessary. |
Referências
- Berdy, J. Bioactive microbial metabolites. J. Antibiot. 58, 1-26 (2005).
- Lopez, D., Vlamakis, H., Kolter, R. Generation of multiple cell types in Bacillus subtilis. FEMS Microbiol. Rev. 33, 152-163 (2009).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Shank, E. A., et al. Interspecies interactions that result in Bacillus subtilis forming biofilms are mediated mainly by members of its own genus. Proc. Natl. Acad. Sci. U.S.A. 108, 1236-1243 (2011).
- Piston, D. W., Patterson, G. H., Lippincott-Schwartz, J., Claxton, N. S., Davidson, M. W. . Introduction to Fluorescent Proteins. , (2013).
- Chudakov, D. M., Matz, M. V., Lukyanov, S., Lukyanov, K. A. Fluorescent proteins and their applications in imaging living cells and tissues. Physiol. Rev. 90, 1103-1163 (2010).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J. Cell Sci. 120, 4247-4260 (2007).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Nicolas, P., et al. Condition-dependent transcriptome reveals high-level regulatory architecture in Bacillus subtilis. Science. 335, 1103-1106 (2012).
- Middleton, R., Hofmeister, A. New shuttle vectors for ectopic insertion of genes into Bacillus subtilis. Plasmid. 51, 238-245 (2004).
- Shimotsu, H., Henner, D. J. Construction of a single-copy integration vector and its use in analysis of regulation of the trp operon of Bacillus subtilis. Gene. 43, 85-94 (1986).
- Guerout-Fleury, A. M., Frandsen, N., Stragier, P. Plasmids for ectopic integration in Bacillus subtilis. Gene. 180, 57-61 (1996).
- Semsey, S., Blaha, B., Koles, K., Orosz, L., Papp, P. P. Site-specific integrative elements of rhizobiophage 16-3 can integrate into proline tRNA (CGG) genes in different bacterial genera. J. Bacteriol. 184, 177-182 (2002).
- Charpentier, E., et al. Novel cassette-based shuttle vector system for gram-positive bacteria. Appl. Environ. Microbiol. 70, 6076-6085 (2004).
- Yang, H. Y., Kim, Y. W., Chang, H. I. Construction of an integration-proficient vector based on the site-specific recombination mechanism of enterococcal temperate phage phiFC1. J. Bacteriol. 184, 1859-1864 (2002).
- Choi, K. H., Schweizer, H. P. mini-Tn7 insertion in bacteria with single attTn7 sites: example Pseudomonas aeruginosa. Nat. Protoc. 1, 153-161 (2006).
- Craig, N. L. Tn7: a target site-specific transposon. Mol. Microbiol. 5, 2569-2573 (1991).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (60), e3796 (2012).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Vartoukian, S. R., Palmer, R. M., Wade, W. G. Strategies for culture of 'unculturable' bacteria. FEMS Microbiol. Lett. 309, 1-7 (2010).
- Romano, J. D., Kolter, R. Pseudomonas-Saccharomyces interactions: influence of fungal metabolism on bacterial physiology and survival. J. Bacteriol. 187, 940-948 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Zengler, K., et al. Cultivating the uncultured. Proc. Natl. Acad. Sci. U.S.A. 99, 15681-15686 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.