Method Article
Utilizzo di co-coltura per rilevare chimicamente mediata interspecie Interazioni
In questo articolo
Riepilogo
I batteri producono composti secreti che hanno il potenziale per influenzare la fisiologia dei loro vicini microbiche. Qui si descrive una schermata co-coltura che permette la rilevazione di tali interspecie interazioni mediate chimicamente mescolando microbi del suolo con fluorescenti ceppi giornalista trascrizionali di Bacillus subtilis su supporti solidi.
Abstract
In natura, i batteri esistono raramente in isolamento, sono invece circondati da una gamma diversificata di altri microrganismi che alterano l'ambiente locale secernendo metaboliti. Questi metaboliti hanno il potenziale di modulare la fisiologia e la differenziazione dei loro vicini microbiche e sono probabilmente fattori importanti per la creazione e il mantenimento di comunità microbiche complesse. Abbiamo sviluppato uno schermo coculture basato sulla fluorescenza per identificare tali interazioni microbiche mediate chimicamente. La schermata richiede la combinazione di un trascrizionale ceppo reporter fluorescente con i microbi ambientali su supporti solidi e permettendo le colonie di crescere in co-coltura. Il reporter trascrizionale fluorescente è progettato in modo che il ceppo batterico scelta fluorescente quando si esprime un particolare fenotipo di interesse (cioè la formazione di biofilm, sporulazione, la produzione di fattore di virulenza, ecc.) Lo screening viene effettuata in condizioni di crescita where questo fenotipo non è espressa (e quindi il ceppo giornalista è tipicamente non fluorescente). Quando un microbo ambientale secerne un metabolita che attiva questo fenotipo, si diffonde attraverso la agar e attiva il costrutto reporter fluorescente. Questo permette al inducendo--metabolita produzione microbo da rilevare: sono le colonie non fluorescente più prossimali alle colonie fluorescenti. Così, questa schermata permette l'identificazione di microbi ambientali che producono metaboliti diffusibili che attivano una particolare risposta fisiologica in un ceppo giornalista. Questa pubblicazione illustra come: a) selezionare adeguate condizioni di co-coltura di screening, b) preparare il giornalista e microbi ambientali per lo screening, c) eseguire lo schermo co-coltura, d) isolare putativo indurre gli organismi, ed e) confermano la loro attività in uno schermo secondario. Abbiamo sviluppato questo metodo per schermare per gli organismi del suolo che attivano biofilm matrice-produzione in Bacillus subtilis
Introduzione
Siamo interessati a capire come i metaboliti che i batteri secernono influenzano la fisiologia e lo sviluppo di microbi vicini. Molti metaboliti sono stati caratterizzati per i loro effetti bioattivi su altri microbi. Due esempi ben descritti comprendono antibiotici, che inibiscono la crescita di altri microbi, e molecole quorum sensing, che alterano l'espressione genica globale di altri microbi. Tuttavia, i batteri producono molti altri piccoli prodotti naturali molecola che non hanno conosciuto bioattività 1. Noi ipotizziamo che i batteri si sono evoluti e conservato la capacità di produrre alcuni di questi metaboliti perché consentono loro di modulare la fisiologia cellulare dei loro vicini microbica nelle comunità microbiche complesse all'interno delle quali esistono maggior parte dei batteri.
Tipi cellulari Bacillus subtilis
Abbiamo concentrato i nostri studi sulle interazioni microbiche mediate chimicamente che coinvolgono Bacilsubtilis LU. Questo non solo a causa del suo status di modello batterio Gram-positivi e gli strumenti genetici risultanti disponibili per la sua manipolazione, ma anche per la sua capacità di differenziarsi in tipi cellulari caratterizzati. Esempi includono cellule che sono: nuoto, producono la matrice extracellulare che è necessario per la formazione di biofilm robusta; competenti ad assumere DNA dall'ambiente e sporulanti, tra gli altri 2. Ognuno di questi tipi di cellule esprime una caratteristica regulon trascrizionale che li rende fisiologicamente e / o fisicamente distinti dai loro fratelli geneticamente identici. Sotto molte condizioni di crescita, più tipi di cellule coesistono varie sottopopolazioni all'interno di una singola colonia di B. cellule subtilis 3. Sebbene molte specie di batteri possono presentare analogo tipo cellulare eterogeneità, questo fenomeno è stato particolarmente studiato in B. subtilis.
In particolare, i geni che sono UPRegulated all'interno di ciascuno di questi specifici B. Sono stati identificati tipi cellulari subtilis. Identificare tali geni upregulated è essenziale per il lavoro qui descritto perché molti di questi fenotipi microbici di interesse sono difficili o impossibili da osservare direttamente. Per esempio, non siamo in grado di rilevare visivamente un tratto come il nuoto su solide (1,5%) piastre di agar, anche se una sottopopolazione di B. cellule subtilis producono flagelli in queste condizioni 3. Un altro esempio è biofilm matrice-produzione. Produzione Matrix può essere visualizzato da morfologia delle colonie (come risulta nelle colonie macroscopicamente rugose), ma solo su determinati mezzo di crescita, e solo dopo diversi giorni di crescita 4. Tuttavia, conoscendo quali geni sono upregulated durante la differenziazione, possiamo costruire reporter trascrizionali che agiscono come marcatori di differenziazione cellulare in questi tipi cellulari.
Costrutti reporter
Queste t fluorescentereporter ranscriptional costituiti dai promotori per i geni specifici di tipo a cella guidare la produzione di un gene reporter, per esempio una proteina fluorescente. Gli esempi includono P HAG-YFP (per il nuoto celle), P Tapa-YFP (per le celle della matrice che producono biofilm), e P SSPB-YFP (per sporulanti celle), dove P x indica la regione del promotore per il gene x. Questi costrutti reporter sono integrati in un locus neutro sul cromosoma (Figura 1 e, vedi sotto) in modo che la regolazione nativo del fenotipo è lasciata intatta. Tuttavia, ora quando una cellula esprime questo fenotipo, esprime anche una proteina fluorescente. Ciò fornisce un read-out facilmente visualizzati dell'attivazione del comportamento particolare fenotipica, che ci permette di screening per i microbi che attivano questa risposta fisiologica. Sebbene tali giornalisti sono comunemente utilizzati in microbiologia, non sono stati ampiamente applicati in schermi a identifinterazioni metaboliche y tra i microbi prima di questo metodo è stato descritto 5.
Ci sono una serie di considerazioni importanti nella progettazione e costruzione di cellule-tipo-specifici ceppi Reporter. Abbiamo utilizzato reporter fluorescenti esclusivamente trascrizionali, sebbene altri tipi di costrutti sono certamente possibili. Noi scoraggiamo l'uso di fusioni traslazionali come marcatori per tipo di cellula differenziazione nel nostro schermo, però, per due motivi: 1) il desiderio di lasciare la cella-specifico del tipo proteina nativa imperturbabile, e 2) il riconoscimento che una diffusa, cellula- ampia fluorescenza sarà più facile da rilevare rispetto puncta localizzata all'interno delle cellule (comune con fusioni traslazionali).
Selezione gene reporter
Dopo aver deciso di utilizzare trascrizione come-out leggere, il gene reporter deve essere selezionata (ad esempio LacZ, fluorescenza, o luciferasi). LacZ ha il vantaggio di subire almeno specialezato apparecchiature per rilevare, ma vi è un rischio molto più elevato di falsi positivi tra microbi ambientali. Nelle nostre mani, il livello di Lac + organismi tra i microbi del suolo di sottofondo era proibitivo (>> 10% dei microbi del suolo erano blu (Lac +) su piastre X-gal, i dati non riportati). E 'possibile che titolando la concentrazione di X-gal in mezzo, questo potrebbe essere ottimizzata per consentire l'uso di un reporter X-gal, anche se non abbiamo tentato questa. Luciferase fornisce elevata sensibilità di rilevazione ed è il giornalista più ortogonale: non c'è quasi nessuna possibilità di microbi ambientali essendo luminescenti intrinsecamente. Tuttavia, abbiamo trovato difficile individuare la strumentazione presso il nostro istituto che ha permesso la rilevazione di luminescenza in intere lastre di Petri, come la maggior parte sono stati progettati per eseguire la scansione solo le regioni localizzate in piastre multi-pozzetto. Ci potrebbe anche essere complicazioni nella visualizzazione colonie luminescenti in un modo che ha permesso anche la fisica contemporanea èolation degli organismi inducono. Durante l'utilizzo fiduciari può aver reso possibile tutto questo, abbiamo invece deciso di utilizzare giornalisti trascrizionali fluorescenti, che sono stati dimostrato di funzionare in B. subtilis, purché adeguata sensibilità di rilevazione e di bassi tassi di falsi positivi tra gli organismi del suolo, e ha permesso di utilizzare facilmente di strumentazione disponibile sia per la visualizzazione e procedure di isolamento.
Selezione fluoroforo
Il fluoroforo specifica scelta dipenderà dalla vostra specie batteriche, il mezzo di agar di crescita che si sta utilizzando, e la particolare filtro di fluorescenza imposta che avete a disposizione. Con la nostra strumentazione, abbiamo scoperto che sia la B. subtilis se stessi e l'agar sono state coltivate su esposto sfondo meno fluorescenza quando sono stati usati filtri YFP (proteina fluorescente gialla), rendendo il giornalista superiore a GFP (green fluorescent protein) nelle nostre mani colonie. Il codon usage di proteine fluorescenti sonofrequentemente ottimizzato per eucarioti, che rende importante scegliere un fluoroforo sia noto dalla letteratura per lavorare nei vostri specie batteriche, o per testare esplicitamente utilizzando un promotore costitutivo. Un gran numero di continua evoluzione varianti proteiche fluorescente sono attualmente disponibili 6, che sono stati esaminati in un certo numero di fonti di 7,8, alcune delle quali prevedono esplicitamente una guida su come scegliere una proteina fluorescente appropriato per l'esperimento 9.
Selezione Promoter
La scelta di un promotore dipenderà in gran parte dal tipo di cellulare o fenotipo di interesse. Per organismi come B. subtilis, alcuni specifici geni reporter cellula-tipo sono state stabilite in letteratura. Per gli altri ceppi batterici, l'esame microarray o dati trascrizionali sarà necessario fornire informazioni su quali geni sono altamente upregulated nelle condizioni in cui il tipo di cellule di interesse is manifesto. Uno studio recente catalogato la trascrizione di B. subtilis inferiore a 104 diverse condizioni di crescita utilizzando microarrays piastrellatura 10. Questo documento fornisce informazioni complete su quali geni sono altamente sovraregolati in condizioni differenti, che è prezioso per fenotipi meno ben caratterizzati.
Invece di mappatura regioni promotrici precise per ogni gene di interesse, di solito è sufficiente utilizzare la sequenza di 200-500 bp a monte del gene come il promotore. La lunghezza esatta sequenza dipende dal contesto genomico: regioni corte vengono utilizzate quando necessario per evitare comprese le regioni codificanti monte dalla vicina open reading frame.
Loci Neutro e l'integrazione
Come mantenere il costrutto giornalista nel vostro ceppo batterico diventa la domanda finale nella progettazione di una fluorescente ceppo trascrizionale giornalista. Nei batteri, i geni di interesse sono spesso mantenutesu plasmidi che utilizzano la selezione antibiotica. Tuttavia, potrebbe non essere possibile usare antibiotici durante coculture senza uccidere i microbi ambientali. Se plasmidi sono stabilmente mantenuti nelle specie batteriche, potrebbe essere possibile crescere i vostri batteri che contiene un plasmide reporter-borne in presenza di antibiotici per preparare il giornalista per lo screening, e quindi eliminare gli antibiotici durante la co-coltura stessa, nella speranza che il plasmide sarà essere mantenuto sufficientemente per consentire fluorescenza. Tuttavia, se i plasmidi possono essere facilmente perse nel batterio, o si perdono in condizioni di stress, questo non sarà una valida opzione. In molti casi, la soluzione migliore sarà l'integrazione del costrutto giornalista sul cromosoma batterico, che permette il mantenimento stabile del reporter anche in assenza di selezione. Affinché l'integrazione per non disturbare la normale espressione o il regolamento del gene di interesse, si consiglia di integrare in un sito ectopica sul cromosoma che can agire come un "locus neutrale". In B. subtilis questi siti integrazione sono geni che - se mutati - trasmettere un fenotipo in alcuni media minima (permettendo integrants di identificare senza selezione antibiotico), ma non modificare i tassi di crescita o sporulazione in rich media, e includere tali geni come amyE, Laca, THRC, pyrD, gltA, e SACA (trasmettere la capacità di utilizzare l'amido, β-galattosidi, treonina, uracile, glutammato, e saccarosio, rispettivamente) 11-13.
Mentre l'integrazione in questi geni sono stati utilizzati in modo affidabile per molti anni a B. subtilis (in particolare a amyE e Laca), la conoscenza simile potrebbe non essere disponibile per i geni in molte altre specie batteriche. L'uso di siti di attaccamento fagi sono ottime alternative per siti di integrazione cromosomiche neutri: molte specie-specifico 14-16, così come i siti generali di integrazione, come il sito di attacco TN7 (att TN7) hannostate identificate e utilizzate per inserimenti gene in molte specie batteriche 17,18.
Microbi ambientali
Usiamo suolo come fonte diretta di microbi ambientali per il nostro schermo co-coltura. Il terreno contiene una grande diversità di microbi, e molti di questi organismi sono ricca fonte di prodotti naturali. Utilizzando sospensioni liquide di terreno collocati direttamente sulle piastre con il nostro fluorescente ceppo giornalista trascrizionale (senza isolare batteri dal suolo), si semplificare notevolmente l'approccio sperimentale. Il terreno può essere utilizzata immediatamente dopo la raccolta, o essere congelato a -80 ° C per un uso futuro. Uso immediato ha il vantaggio che una maggiore diversità di microbi possono potenzialmente essere coltivate, compresi quelli che non sopravviverà congelamento bene. Esso ha lo svantaggio che la concentrazione degli organismi del terreno coltivabili da questi campioni è sconosciuto, aumentando il numero di piastre di schermo che deve essere utilizzato. Deluso ayed ha il vantaggio che i cfu / ml per ciascuna sorgente suolo possono essere determinati in anticipo, consentendo un numero ottimizzato di colonie di essere coltivate su ciascuna piastra schermo. Tuttavia, esso richiede che gli organismi del suolo siano in grado di sopravvivere congelamento.
Si noti che la diversificazione della piscina induttore in fase di esame (cioè le fonti del suolo) sembra essere più efficace a individuare nuove interazioni interspecie dello screening approfondito sullo stesso terreno: maggiore diversità filogenetica è stato osservato nei risultati individuati nel nostro schermo a matrice induzione Fonti del suolo supplementari sono stati esaminati, piuttosto che di screening le stesse fonti suolo più a fondo (EA Tibia e R. Kolter, Harvard Medical School, risultati non pubblicati).
Panoramica
L'approccio che descriviamo qui è semplice in termini di requisiti tecnici. Si tratta di: 1) costruire una trascrizionale reporter fluorescente in B. subtilis o unaltre specie batteriche di interesse, 2) le condizioni di questo giornalista non è attivato di identificazione, 3) preparazione di aliquote di questo ceppo giornalista e organismi che saranno proiettati (nel nostro caso del suolo, ma altre fonti potrebbero essere utilizzati al posto), 4) mescolando questi due gruppi di microbi su supporti solidi, 5) individuare e isolare putativo inducendo organismi e 6), a conferma che questi organismi effettivamente attivano questo fenotipo in uno schermo secondario. Una volta identificati, questi organismi e dei loro metaboliti ci forniscono gli strumenti chimici per modulare il comportamento dei batteri, per studiare la fisiologia dei batteri e delle interazioni microbiche, e di agire come potenzialmente nuovi ponteggi per i composti terapeutici futuri.
Protocollo
1. Selezionare un gene reporter e costruire un reporter fluorescente trascrizionale
Per B. subtilis:
- Vedi l'articolo JoVE in riferimento 19 per un protocollo che descrive la costruzione di giornalisti trascrizionali fluorescenti in Bacillus subtilis.
Per le altre specie batteriche:
- Identificare un gene che è upregulated durante la risposta fisiologica di interesse. Questo può essere basata sulla letteratura esistente o analisi trascrizionale del microrganismo in condizioni particolari.
- Costruire un reporter trascrizionale fluorescente per questo gene di agire come proxy per il cambiamento del fenotipo. Questo costrutto dovrebbe includere il promotore di questo gene upregulated guidare la produzione di una proteina fluorescente appropriato (vedere Figura 1).
- Integrare questo costrutto in un luogo neutrale sul cromosoma. Ciò garantisce che reg nativomento del gene di interesse non interrompere, ed evita la necessità di meccanismi di selezione plasmide (ad esempio antibiotici) che potrebbero interferire con la crescita di microbi ambientali.
2. Determinare coculture Condizioni
Per B. subtilis P tapa-YFP giornalista:
- Usa 0.1x LB, Lennox (1 g tryptone, 0,5 g di estratto di lievito, 0,5 g NaCl per litro) medio per questo giornalista, poiché B. subtilis matrice-produzione è minima in Luria Broth 20. Questo mezzo permette B. colonie subtilis a crescere a submillimetrica ma la dimensione osservabile, pur consentendo taxa diversi dal suolo per crescere 5.
- Includere 100 tampone MOPS mm a minimizzare le potenziali variazioni di pH.
Per le altre specie batteriche:
- Utilizzare pubblicato i dati trascrizionali o empiricamente testare diverse condizioni di coltura per identificare quella in cui il microbo cresce, ma il activation del reporter fluorescente è trascurabile (per consentire la sua attivazione da rilevare quando il ceppo giornalista viene coltivato in co-coltura con microbi che inducono.)
- Utilizzare un supporto a basso contenuto di nutrienti (rispetto al tradizionale rich media microbiologici) quando lo screening microbi ambientali da ambienti oligotrofiche (come il suolo), dal momento che molti batteri oligotrofici non crescono quando sono presentati con condizioni di alta nutrienti 21. Un mezzo nutriente basso riduce anche le dimensioni delle colonie, aumentando la produttività dello schermo.
- Selezionare un supporto con sfondo bassa fluorescenza e buona chiarezza ottica.
- Ottimizzare temperatura di crescita per consentire sia il ceppo giornalista e microbi ambientali a crescere contemporaneamente.
- Considerare l'aggiunta di un agente tamponante. L'uso di tampone nelle piastre ridurrà la possibilità di rilevare variazioni di pH-mediata nella fisiologia 22, a meno che tali interazioni sono di interesse.
3. Preparare Reporter Aliquote
Per B. subtilis P tapa-YFP giornalista:
- Streak giornalista ceppo da -80 ° C azionari congelati su un piatto LB fresco con uno stuzzicadenti sterile o un bastoncino applicatore.
- Crescere una notte a 30 ° C.
- Effettuare diluizioni seriali in coltura liquida per ridurre al minimo fluorescenza di fondo derivante da una crescita su un terreno solido:
- Seminare una 5 ml di liquido cultura della LB e crescere con agitazione a 37 ° C.
- Quando la coltura raggiunge un diametro esterno 600 ~ 0,6, diluire in 5 ml di LB fresco ad una OD 600 di 0,02.
- Coltivare a 37 ° C di nuovo in agitazione fino culture raggiunge OD 600 ~ 0.6.
- Ripetere diluizioni seriali di crescita per un totale di 3x.
- Lasciate cultura diluizione seriale finale crescere per OD 600 ~ 0.4.
- Aggiungere glicerolo al 15-20%.
- Aliquota 50-200 ml in provette da 0,5 ml microcentrifuga e congelare a -80 ° C.
- Mammake aliquote equivalenti per ceppo non fluorescente del reporter (che saranno tenuti durante lo screening secondario).
Per le altre specie batteriche:
- Utilizzare cellule che hanno un background bassa fluorescenza (cioè vengono coltivate in condizioni in cui vi è poca espressione dal promotore utilizzato nel giornalista).
- Marca e congelare aliquote contenenti note cfu / ml (unità formanti colonia per ml) del ceppo giornalista in modo che un numero adeguato di colonie può essere coltivata in ogni piatto schermo co-coltura (vedi sezione sopra per i dettagli).
- Fai aliquote equivalenti per ceppo non fluorescente (che saranno tenuti durante lo screening secondario).
4. Ottenere campioni di terreno
- Raccogliere il terreno in provette coniche sterili o sacchetti sterili utilizzando una spatola, scartando i primi 0,5 centimetri di suolo superficie esposta.
- Aggiungere salina sterile (0,85% NaCl) con un rapporto di 10 ml per 1 gdi terreno per fare un slurry suolo.
- Selezionare un metodo per rimuovere i batteri da particelle di terreno: a) l'utilizzo immediato di campione fresco o b) uso in ritardo dopo il congelamento del campione.
- Per l'uso immediato, vortice liquami per 1 min.
- Per l'utilizzo in ritardo, si fondono liquami suolo in frullatore per tre cicli di 1 min, ponendo il vaso del frullatore in ghiaccio per 1 min pause tra i cicli di miscelazione.
- Lasciate liquami suolo accontentarsi di ~ 1 min.
- Spostare strato superiore acquosa in una nuova provetta.
- Aggiungere glicerolo ad una concentrazione finale del 15-20%.
- Aliquota 50-200 ml in provette da 0,5 ml microcentrifuga e congelare a -80 ° C.
5. Determinare cfu / ml di Ghiacciato Reporter e le aliquote del suolo
- Scongelare un terreno e giornalista aliquota congelata. Microbi del suolo possono essere scongelati in ghiaccio. Perché B. subtilis lisi a 4 ° C, tali aliquote devono essere scongelati rapidamente a temperatura ambiente per ridurre al minimo il tempo trascorso a bassa temperatura.
- Fai due replicare seriadiluizioni l (per 10 -8) a 0.1x LB o altro tampone isotonica.
- Tavola 5 punti ml di ogni diluizione seriale su piastre di agar dello stesso mezzo che verrà utilizzato per lo screening di co-coltura.
- Coltivare a RT (o la temperatura che verrà utilizzato per lo screening).
- Il giorno dopo, contare il numero di colonie all'interno di ogni punto e calcolare cfu / ml di ciascuna delle aliquote congelate.
6. Conferma aliquote concentrazioni per placche di schermo spread
- Scongelare una aliquota congelata come al punto 5.1.
- Diluire a 1 x 10 5, 2.5 x 10 5, 5 x 10 5, 1 x 10 6, e 2,5 x 10 7 cfu / ml.
- Aggiungere 50 ml macchia di ciascuna diluizione al centro dei piatti individuali. Questi dovrebbero produrre lastre con l'ottimale calcolato di 25.000 colonie per piastra, così come 2 - e 5 - volte più e meno, consentendo la migliore diluizione effettiva da determinare.
- Aggiungere circa 20 di vetro sterile (3 mm) perle dili picchiettando delicatamente sulla piastra. Beads forniscono una distribuzione più uniforme delle colonie in tutta la piastra di un diffusore in vetro curvato fa.
- Stendere le cellule mantenendo piastre sul banco e li scuotendo avanti e indietro, ruotandoli come si lavora, fino a quando è stato assorbito il liquido. Non continuare agitare le perline volta la piastra è asciutto; altrimenti inizierà a uccidere i batteri.
- Capovolgere le piastre sopra e gettare perle nel bicchiere rifiuti contenenti etanolo.
- Lasciate piastre crescere per il tempo della tua analisi (ad esempio 24 ore) a temperatura corretta per la propria analisi (ad esempio 24 ° C / RT).
- Utilizzando uno stereoscopio dissezione, contare il numero di colonie in due o più campi di vista.
- Calcolare il numero di colonie per zona, e determinare il numero di colonie presenti su ogni piastra.
- Regolare diluizioni futuri come necessario. Il numero effettivo di colonie non è importante quanto avere lo stesso numero su ciascuna piastra schermo comparabile.
7. Preparare piatti coculture
- Thaw un'aliquota giornalista (e aliquota del suolo se congelato) come al punto 5.1.
- Diluire giornalista (a concentrazioni ottimizzate nella sezione 6) in 0.1x LB o altro povero di nutrienti, soluzione isotonica.
- Per il terreno ghiacciato: Diluire a concentrazione ottimizzato nella sezione 6 in 0.1x LB o altro povero di nutrienti, soluzione isotonica.
- Per il terreno fresco: Effettuare diluizioni di liquame terreno fresco, basate sulla previsione che i cfu / ml di liquame suolo potrebbero variare da 10 a 10 -4 -9 cfu / ml.
- Spot 50 ml di terreno e giornalista diluizioni nella parte centrale del piatto dello schermo co-coltura. Inoltre, la piastra solo suolo e solo come controlli giornalista.
- Stendere con perline di vetro come descritto al punto 6,4-6,6.
- Se ci sono le condizioni di crescita noti che attivano il tuo fluorescente giornalista, striscia o un piatto il vostro reporter in queste condizioni e crescono da utilizzare come controllo positivo durante lo screening.
- Incubare a 24 ° C per 24-28 ore (o come appropriato per il giornalista / dosaggio)
8. Piastre coculture schermo per fluorescenza
- Utilizzando illuminazione chiaro, focalizzare la vostra stereoscopio in modo che le colonie sono taglienti.
- Guarda le piastre solo suolo per determinare se il campione di terreno è autofluorescenti colonie. Se è così, questo suolo può comportare un alto tasso di falsi positivi (con un concomitante aumento screening secondario).
- Utilizzare un elevato rapporto di giornalista: terreno in vostri piatti co-coltura per aumentare la probabilità che un induttore sarà circondato da più colonie giornalista, riducendo la possibilità che saranno rilevati come falsi positivi (Figura 2).
- Utilizzare una proteina fluorescente differente (uno che emette in un altro canale).
- Determinare i tempi di analisi. Per la maggior parte dei nuovi giornalisti, il calendario del potenziale induzione è sconosciuta, e quindi deve essere determinato empiricamente.
- Iniziare lo screening per fluorescenza, non appena le colonie diventano chiaramente visibili con lo stereoscopio dissezione (ingrandimento 30X ~) e continuare l'esame periodico delle piastre finché la crescita è cessata e / o fluorescenza di fondo diventa troppo alta.
- Una volta che la finestra temporale di potenziale di induzione è determinato per un particolare giornalista, dovrebbe essere simile per tutte le piastre co-coltura contengono quel giornalista, semplificando il monitoraggio delle piastre schermo. Per il B. giornalista subtilis P TAPA-YFP, il momento opportuno per esaminare le piastre è compresa tra 24-28 ore dopo la placcatura le cellule, per la B. subtilis P SSPB-YFP giornalista, è tra 26-32 ore di crescita.
- Massimizzare la vostra sensibilità fluorescenza:
- Assicuratevi che il vostro fluorescenza dissezione ambito di applicazione è in una stanza buia o circondato da tende oscuranti. Induzione sarà probabilmente meno intensa di un FP costitutivamente prodotta e richiede una maggiore sensibilitàtività di rilevare.
- Attendere che la lampada a fluorescenza per stabilizzare e gli occhi per regolare al buio prima di tentare di rilevare la fluorescenza ai tuoi piatti co-coltura (almeno 1-2 min).
- Utilizzando un controllo positivo (se ne avete uno), assicurarsi che l'ingrandimento in uso consente di rilevare la fluorescenza. L'ingrandimento è in genere meglio se il vostro campo di vista è di circa 30-50x il tipico diametro di una colonia (200-400X).
- Spegnere la luce e aprire l'otturatore per la fluorescenza.
- Dopo che i vostri occhi si sono adattati al buio, spostare lentamente il piatto avanti e indietro attraverso il vostro campo visivo, alla ricerca di punti luminosi.
- Inizia dalla parte superiore della piastra e utilizzare zigzag per spostare il lato a lato piatto come ci si sposta verso il fondo della piastra.
- La pratica spostando la piastra in campo chiaro per ottenere un senso di come lentamente a muoversi a piastra, e per essere sicuri che si coprono l'intero surArea affrontare.
- Spostare la piastra abbastanza lentamente che le colonie non diventano sfocate. E 'meglio sovracampionamento in superficie piuttosto che aree mancare.
- Dopo una scansione completa, girare la piastra di 90 ° e ripetere. Gli occhi umani sono molto bravi ad individuare anche debole fluorescenza attraverso questo metodo.
- Se si rileva la fluorescenza, fermano la piastra e tornare indietro e trovare l'area fluorescente.
- Ruotando il campo chiaro lentamente, determinare se la fluorescenza è associato a una colonia batterica (e non detriti suolo autofluorescente o componenti Media). In caso affermativo, le colonie non fluorescente prossimali alla colonia fluorescente sono organismi che inducono putativi.
9. Isolare putativi Indurre organismi
- Sono stati identificati una volta indotti (fluorescente) colonie, isolare le colonie che secernono composti inducono.
- Se una concentrazione sufficientemente elevata di colonie giornalista sono in crescita sul piatto(> 0,5:1 giornalista: cfu suolo), le colonie di induzione putativi saranno circondati da più colonie fluorescenti (di nuovo, vedi figura 2).
- Nei casi in cui la complessità della crescita coculture rende ambiguo che colonia rappresenta l'induttore, isolare multiple potenziali colonie di induzione per il successivo test nella schermata secondaria.
- Localizzare le colonie che si desidera selezionare nel centro del campo visivo.
- Se sono vicini al bordo della piastra, ruotare il piatto in modo che il bordo della piastra è fuori mano dominante (cioè se si è destri, mettere il labbro della piastra a sinistra). Questo consente di avvicinarsi alle colonie ad un angolo basso, che migliora la precisione della raccolta.
- Posizionare le piastre freschi striscia organismi inducono putativi a nelle vicinanze, così come un bicchiere di rifiuti di disfarsi punte utilizzate in.
- Lasciando la lampada a fluorescenza su, accendere la luce brillante lentamente, in modo che si sarà in grado di identificare (per forma e posizione), la colonia fluorescente e le circostanti putativi organismi inducono. Potrebbe essere necessario andare avanti e indietro con la luce un paio di volte per essere in grado di identificare le colonie che si desidera scegliere quando non c'è fluorescenza e solo luce.
- Utilizzare una bacchetta di vetro (lunga diametro x 5 mm 200 mm) per prendere una sterile, rotondo 200 microlitri punta gel-loading e tenerlo come una matita. Questo è lo strumento di prelievo che verrà utilizzato per isolare le singole colonie.
- Appoggiare il palmo della mano esterna contro il palco per stabilizzarlo sul piano di lavoro. Mettere l'altra mano sul lato interno del pollice della mano per stabilizzare il vostro strumento di raccolta.
- Se necessario, capovolgere di nuovo tra le viste fluorescenza e brightfield per identificare le colonie che si desidera scegliere.
- Mantenere la punta della pipetta al di sopra della superficie della piastra, spostare nel vostro campo visivo e centrarla sopra la colonia che si desidera selezionare. La punta sarà fuori fuoco.
- Utilizzando il bordo esterno della mano (che è appoggiato sul palco microscopio o piano di lavoro), ruotare la punta della pipetta lentamente verso la colonia di essere raccolti. Toccarlo molto leggermente, cercando di minimizzare quante altre colonie i contatti punta.
- Senza ruotare l'utensile di prelievo, realizzato su una sezione di una piastra fresca. Stendere con un tocco morbido per evitare scriccatura l'agar. Poiché il numero di cellule trasferiti da tale metodo è piuttosto piccola (le colonie sono molto più piccole di quelle tipicamente manipolato), una singola striscia continua si tradurrà in colonie isolate.
- Ripetere questo processo con altri organismi di induzione putativi.
- Incubare le piastre a 24 ° C (o la temperatura del vostro test).
10. Streak putativi inducendo organismi per ottenere colonie isolate singole
- Utilizzando uno stereoscopio, determinano - in base alla struttura delle colonie o morfologia - se ci sono diversi tipi di colonie contenuti in ciascuna della vostra ind scelto putativoucing organismi.
- Guarda le colonie usando una fase in cui è possibile illuminare le colonie sia da sopra e da sotto per rilevare potenziali differenze di colonia.
- Restreak ognuna diversa morphotype su un piatto fresco e incubare fino cresciuto.
- Restreak ancora una volta e far crescere. Se diversi morfotipi persistono, continuare a restreak alla purezza.
11. Ritestare putativi inducendo Organismi di schermo secondario
- Ritestare tutti gli organismi putativi che inducono in uno schermo secondario per determinare quali sono attivando la trascrizione reporter fluorescente. Lo schermo secondario è costituito da un prato di microcolonie del fluorescente ceppo trascrizionale giornalista, insieme con placche di comando, su cui gli organismi che inducono putativi sono patchati o macchiati.
- Impostare tre piatti identici: uno contenente un prato microcolonia della fluorescenza ceppo trascrizionale giornalista (alla stessa concentrazione di uns è stato usato durante lo screening co-coltura); uno contenente un prato microcolonia del ceppo wild-type senza un reporter fluorescenza, e uno contenente nessun prato.
- Segnare la parte superiore della schiena di ciascuna piastra per determinare l'orientamento piastra.
- Aggiungere marcatori di posizione per le patch / spot, fino a dieci organismi che inducono putativi possono essere testati su ogni set di piastre (Figura 3).
- Aliquote prato disgelo (giornalista e ceppo non fluorescente) come al punto 5.1.
- Distribuire 50 ml di una diluizione di 5 x 10 5 ufc / ml su piastre di prato (o altre diluizioni ottimizzate) con perline sterili come al punto 6.4.
- Lasciare asciugare le piastre.
- Patch o spot putativo indurre gli organismi:
- Patch selezionare se si desidera un approccio più semplice e veloce, ed è accettabile avere un numero meno preciso di cellule depositate. Per applicare la patch:
- Toccare uno stuzzicadenti sterile alla colonia di prova - non raccogliere tutte le cellule.
- Patch (fare una piccola striscia) sul piatto vuoto.
- Ripetere patch stuzzicadenti fresca sulla piastra giornalista.
- Ripetere patch stuzzicadenti fresca sulla piastra di controllo.
- Avvistamento Selezionare se si desidera un approccio quantitativo e riproducibile. Spotting consente al numero di cellule depositate da normalizzare (vedi riferimento 5 per maggiori dettagli), e permette la potenza relativa dei diversi organismi di induzione da confrontare. Da individuare:
- Risospendere putativo inducendo organismi in 1 ml di terreno liquido in una cuvetta di plastica sterile.
- Prendere l'OD 600 delle resuspensions.
- Usando la formula X = 250 ÷ (OD 600-,5), aggiungere il volume X per ciascuna risospensione a 500 ml di terreno liquido per ottenere una soluzione con un OD 600 di 0,5. Questo metodo semplifica le operazioni di pipettaggio necessari quando si eseguono più diluizioni per normalizzare OD del perché è possibile utilizzare lo stesso volume (500 ml) per tutti i diluenti.
- Spot 1 ml di ciascuna risospensione OD-normalizzata per ciascuna delle tre piastre.
- Patch selezionare se si desidera un approccio più semplice e veloce, ed è accettabile avere un numero meno preciso di cellule depositate. Per applicare la patch:
- Lasciate crescere a 24 ° C per 24-28 ore (o come appropriato per il giornalista / dosaggio).
- Usate il microscopio a fluorescenza dissezione per identificare gli organismi putativi che inducono che attivano il vostro ceppo reporter fluorescente ma non il vostro ceppo di controllo parentale. Questi isolati sono i vostri risultati positivi - i microbi ambientali che secernono sostanze che inducono il vostro fenotipo di interesse.
Risultati
Questo schermo è stato utilizzato per identificare organismi del suolo secernono sostanze che alterano la fisiologia di B. subtilis. I risultati qui descritti concentrano sul tipo di cellula matrice produttrici di B. subtilis, che produce la proteina e esopolisaccaride che sono necessari per la formazione di biofilm robusta in questo batterio. Abbiamo scelto il promotore dell'operone Tapa-sipW-ATAS per il nostro costrutto reporter fluorescente (P tapa-YFP). Questo operone codifica la proteina componente strutturale della matrice ed è upregulated durante la produzione della matrice biofilm 23. Il nostro giornalista matrice (Figura 1) è stato costruito come precedentemente descritto 19.
Precedenti studi hanno dimostrato che B. subtilis produce matrice in risposta al quorum-sensing-come molecola surfattina auto-prodotto, così come metaboliti purificati prodotti da altri batteri del terreno 20. Eravamo interessati ad espandere laStudi sé per indagare in modo più ampio, che microbi del suolo rendono metaboliti in grado di indurre la produzione di matrice B. subtilis. Noi abbiamo scelto di utilizzare diluito LB per la crescita, dal momento che questo mezzo era già noto per portare a scarsa produzione di matrice 20, fornendoci una condizione di crescita dove il nostro sforzo giornalista è stato non fluorescente. Abbiamo poi ottimizzato il numero di colonie appropriate per lo screening in queste condizioni di crescita. Al fine di ottimizzare ogni piatto dello schermo, è necessario determinare il numero di colonie crescono dal suolo e giornalista aliquote congelate e ciò che la concentrazione appropriata delle colonie e delle condizioni nutrizionali sono. Idealmente vogliamo che ogni piatto co-coltura per contenere un numero equivalente di suolo e giornalista colonie (cioè un rapporto 1:1 di giornalista: suolo) e di essere strettamente distanziati, singole colonie. Questo alto rapporto di colonie giornalista aumenta la probabilità che un induttore attiverà più colonie giornalista circostanti. Avere ac multiplacolonie induttore trati circondano una fiducia aumenta induttore colonia putativo a individuare l'attuale Indurre organismo (Figura 2). Il contenuto di nutrienti controlla l'estensione della formazione crescita / colonia mentre la diluizione dell'inoculo determina se le colonie risultanti sono opportunamente dispersi. Su un 10 cm di diametro Petri piastra standard con il mezzo povero di nutrienti, abbiamo scoperto che circa 25.000 colonie totale per piastra (50 ml di un 5 x 10 5 ufc / ml di diluizione), purché la migliore separazione di B. subtilis colonie su 0.1x LB MOPS medio (Figura 4).
Sebbene l'calcolato ufc / ml di diluizioni seriali fornisce una concentrazione approssimativa di batteri in aliquote, è necessario assicurare che la concentrazione delle colonie risultanti è appropriato quando un intero piastra si sviluppa con le cellule. Il ufc / piastra calcolata e quella effettiva ufc / piastra non sono sempre uguali (figura 4 ). Placcatura prati colonia di concentrazioni equivalenti è importante per consentire diversi ceppi del reporter da confrontare (in caso contrario, le differenze nella disponibilità di nutrienti possono alterare il loro stato fisiologico e interferire con i risultati).
Dopo aver preparato aliquote della giornalista e del suolo, li abbiamo mixato su piastre schermo co-coltura e li esaminato per fluorescenza utilizzando uno stereoscopio (Figura 5). Abbiamo anche plated controlli che sono stati inoculati solo o con il suolo o la B. subtilis ceppo P giornalista Tapa-YFP. B. subtilis produce matrice biofilm (fluorescenza) in risposta alle numerose microbi del suolo come visto dalle colonie fluorescenti dell'immagine coculture in figura 5 in. Per i terreni che abbiamo esaminato, abbiamo avuto alti tassi di successo per il giornalista P tapa-YFP. Come descritto in riferimento 5, tra il 12-67% degli isolati (da sei diversi campioni di suolo) ha avuto la capacità di induce fluorescenza nel ceppo giornalista P tapa-YFP. Questo è in contrasto con i nostri risultati non pubblicati dagli schermi analoghi utilizzando la sporulazione (P SSPB-YFP) e la competenza giornalisti (P comg-YFP). Dopo una lunga selezione (> 200.000 colonie per ogni giornalista), solo due organismi sono stati identificati che inducono sporulazione, mentre nessuno è stato identificato che inducono competenza. Così, i tassi di successo per i diversi tipi di cellule sono essere altamente variabili e possono essere difficili da prevedere in anticipo.
Abbiamo poi scelto singole colonie di induzione putativi. Le colonie sulle piastre dello schermo co-coltura sono piuttosto piccole sul medio basso di nutrienti si consiglia (diametro submillimeter). Tuttavia, è possibile prendere in modo accurato e isolare molto piccole colonie a mano (Figura 6) da un complicato schermo piatto co-coltura. Il metodo manuale che usiamo è semplice e non richiede né strumenti specializzati, né sterilizzazione fiamma. Queste colonie induttore putativi sono poi restruck all'isolamento. Poiché le piastre co-coltura sono affollate con le colonie, non è insolito - anche con molta attenzione la tecnica di raccolta - di avere più di un organismo in crescita di ciascun campione induttore putativo. Un attento esame dovrebbe consentire l'isolamento di colonie morfologicamente distinte. Tutti gli organismi che inducono putativi vengono poi testati in uno schermo secondario. Risultati positivi e negativi sia dal cerotto e metodo loco sono mostrati in Figura 3. Considerando la loro crescita denso, la nostra capacità di raccogliere fisicamente indurre colonie dalle piastre co-coltura era abbastanza buono, con circa il 50% delle colonie esaminati nel nostro schermo secondario di essere veri positivi. Ulteriori risultati da questa schermata così come il lavoro di follow-up emerge da essere stato precedentemente descritti 5.
/ Ftp_upload/50863/50863fig1.jpg "/>
Figura 1. Trascrizionale fluorescente costrutto reporter. L'ovale blu rappresenta una cellula batterica e la linea tratteggiata rappresenta suo cromosoma. Questo esempio mostra un reporter trascrizionale fluorescente per la produzione di matrice. Il locus nativo rimane intatto (P matrice-matrice, dove "P" e la freccia indica la regione del promotore), mentre il costrutto reporter (P matrice-YFP) è inserito altrove nel cromosoma in un locus neutro.
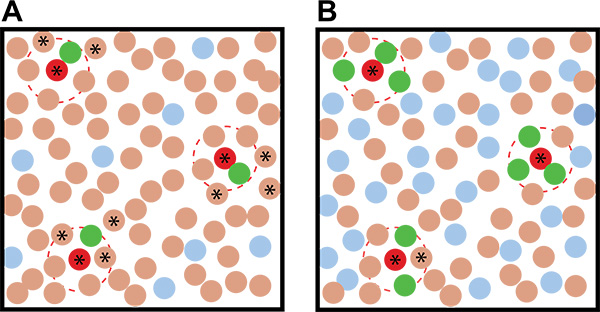
Figura 2. Esempi idealizzati di co-coltura risultati dello screening con diversi rapporti del giornalista: microbi ambientali. A) Con un basso giornalista: rapporto microbo ambientale porta ad una maggiore ambiguità nella individuazione degli organismi che inducono putativi di quando B) Un elevato giornalista: rapporto microbo ambientale viene utilizzato. I cerchi marroni rappresentano gli organismi del suolo, i cerchi rossi rappresentano gli organismi del suolo che inducono, i cerchi blu rappresentano le colonie giornalista uninduced, e le colonie verdi rappresentano colonie giornalista indotte. Le linee rosse tratteggiate indicano il raggio d'azione del metabolita indurre. Stelle indicano colonie non fluorescente che - in base alla loro vicinanza alle colonie fluorescenti - sono organismi che inducono putativi e devono essere raccolti e riprovati nella schermata secondaria.
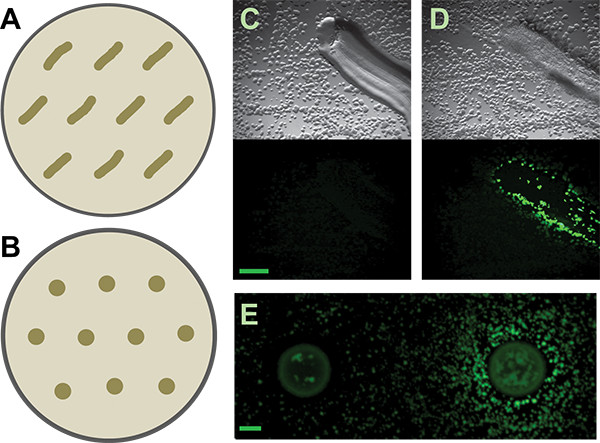
Figura 3. Schermo secondario. A e B) Schema di come distribuire patch o macchiato isolati su piastre schermo secondario, rispettivamente, per il B. giornalista matrice subtilis. Spaziatura più generoso può essere richiesto per altri giornalisti o isolati inducono, deptermina il diffusibilità delle loro metaboliti attivi. C e D) I risultati rappresentativi dal suolo patched isola e che sono negativo e positivo, rispettivamente, per indurre la B. subtilis P TAPA-YFP-reporter. Pannelli superiori sono le immagini brightfield; pannelli inferiori sono le immagini di fluorescenza. Barra della scala è di 1 mm. E) Negativo e risultati positivi dal suolo macchiato isola per lo stesso giornalista. Barra della scala è di 2 mm.

Figura 4. Determinazione della concentrazione microcolonia. La distribuzione e le dimensioni delle colonie dipenderà sia sulle concentrazioni di nutrienti e cellulari. A) Le differenze nella crescita di B. subtilis su 0.01x LB (riga superiore) rispetto a 0.08x LB (riga inferiore). Celle 0.01x LB non si formano in microcolonie, mentre ttubo sul 0.08x LB fare. (Si noti che per i nostri schermi abbiamo aumentato i livelli di nutrienti leggermente da quelli mostrati qui:. Da 0.08x LB a 0.1x LB) Queste immagini sono da 1 ml macchie di sequenziali 01:05 diluizioni alla nota ufc / ml. Estrapolando da tali concentrazioni, per ottenere le distribuzioni simili di colonie attraverso una piastra di 10 centimetri Petri richiederebbe placcatura (da sinistra): 3.200.000, 640.000 e 128.000 cfu totale per piastra. Tuttavia, avvistamento risultati in distribuzione irregolare delle cellule (sono concentrati ai bordi piatte) rispetto alla diffusione celle su tutta la piastra. Così, una volta selezionata una concentrazione di nutrienti, è importante esaminare piastre sviluppa con una varietà di concentrazioni. Barra della scala è di 0.1 mm B) Questi pannelli mostrano i risultati di diffusione (da sinistra) 50.000;. 25.000 e 5.000 ufc totale per piastra su piastre LB 0.08x. Da queste immagini, abbiamo selezionato 25.000 come nostro obiettivo numerico di ufc / piastra. Barra della scala è di 0,1 mm.

Figura 5. Co-coltura di B. subtilis P TAPA-YFP mescolato con organismi del suolo. Sovrapposizione di immagine di fluorescenza brightfield e da una piastra schermata co-coltura contenente la B. subtilis P tapa-YFP giornalista matrice mescolato con organismi del suolo. Arrowhead indica induttore putativo circondato da microcolonie fluorescenza del reporter. Barra della scala è di 1 mm.
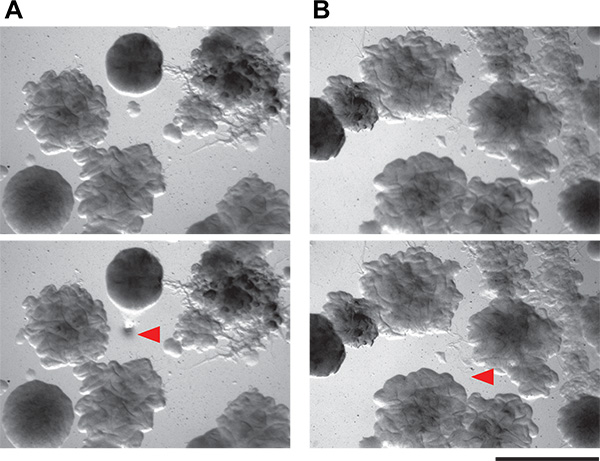
Figura 6. Dimostrazione della fattibilità di isolare piccole colonie batteriche da lastre co-coltura. A e B) Questi pannelli mostrano due campi di vista di piastre di agar contenenti comunità microbiche complesse dal suolo. Colonie piccole come 0,1 millimetri possono essere isolati utilizzando la tecnica di prelievo descrittaqui. Pannelli superiori sono il campo di vista prima colonia di raccolta e pannello di fondo sono gli stessi campi di vista dopo la colonia di raccolta. Frecce rosse indicano dove sono state rimosse le cellule.
Discussione
Uno dei limiti intrinseci di questo protocollo è che si basa sulla coltivabilità degli organismi microbici. Come è stato ben documentato 24, più la vita microbica del pianeta non può (ancora) essere coltivata nelle condizioni di coltura esplorati fino ad oggi. Così, un enorme numero di interazioni tra le specie microbiche che si stanno verificando in ambienti naturali passeranno inosservati utilizzando questo approccio. Tuttavia, poiché il nostro desiderio è quello di individuare non solo l'esistenza di tali interazioni, ma poi anche studiare i meccanismi e le molecole coinvolte nella loro mediazione, la capacità di coltivare questi microbi è una necessità. Anche all'interno di specie coltivabili, questa zona è stata scarsamente esplorato, rendendo l'approccio descritto qui un contributo prezioso come un metodo per identificare interazioni mediate chimicamente tra microbi. Inoltre, anche se questo protocollo è stato ottimizzato per lo screening matrice-induzione di Bacillus subtilis, può teoricamente essere applicata a unreporter fluorescente trascrizionale y in altre specie batteriche.
Un altro limite correlate di questo approccio è che questa schermata (per definizione) richiede co-coltura. In ambienti naturali, microbi con tassi di crescita diversi possono ancora coesistere in prossimità spaziale sfruttando diverse nicchie ambientali. Tali interazioni microbiche potrebbero non essere rilevati dal nostro schermo co-coltura, tuttavia, che consentono solo la crescita di microbi ambientali con requisiti nutrizionali e tassi di crescita simili a quelli delle specie reporter. Modifiche che separare la crescita dei potenziali organismi di induzione della crescita del ceppo giornalista sono certamente possibili. Abbiamo anche anticipato che la crescita ife di funghi - diffusi nel suolo - può causare difficoltà nella schermata di co-coltura. Mentre il breve lasso di tempo del nostro schermo con B. subtilis significava che sono stati rilevati alcuni funghi, aggiungendo composti antifungini al mezzo di crescita potrebbe minimize questa preoccupazione.
La possibilità di selezionare un fenotipo e gene idoneo per il costrutto reporter fluorescente non dovrebbe essere difficile, considerando la ricchezza di sequenziamento e dati trascrizionali già disponibili o facilmente ottenibili per molte specie batteriche. Tuttavia, una difficoltà con l'approccio qui descritto è la necessità di individuare le condizioni di crescita che minimizzano la fluorescenza di fondo del ceppo giornalista, permettendo la rilevazione di induzione fluorescenza. L'identificazione di queste condizioni deve essere fatto spesso empiricamente, anche se i dati di trascrizione possono aiutare questa ricerca (ad esempio i dati piastrelle microarray disponibili per la crescita di B. subtilis consentire l'identificazione delle condizioni in cui geni di interesse sono poco espressi 10). Per alcuni giornalisti questa ricerca empirica può essere difficile, in parte perché l'espressione di molti fenotipi batteriche è eterogenea. In altre parole, è raro trovare condizioni in cui nessuna cella all'interno della popolazione esprimono Fenotipo X. Pertanto, a seconda del numero di celle all'interno di tale sottopopolazione e la forza di espressione genica, può essere difficile identificare condizioni che forniscono sufficientemente bassa bassa fluorescenza per consentire induzione da rilevare . Un'alternativa a questa ricerca empirica per le condizioni ideali di screening può essere "accordare" i livelli di espressione del reporter mediante mutagenesi diretta. Alterando la regione del promotore e / o ribosomiale sito di legame del costrutto giornalista, i livelli di fluorescenza di fondo potrebbero essere diminuiti. Questo potrebbe ampliare l'utilità di questa schermata, consentendo anche geni con un po 'di attivazione costitutiva da esaminare per l'induzione.
Organismi volta inducono sono stati identificati e confermati in uno schermo secondario, possono essere filogeneticamente identificati mediante sequenziamento loro gene 16S rRNA. E 'anche possibile quantificare l'entità del fluorescenza con OD punto 600 normalizzato nello schermo secondario 5. Questo può fornire informazioni su quali membri della comunità producono composti che influenzano il vostro sforzo giornalista e in quale misura. Di conseguenza, questo può portare a ipotesi su cui interazioni microbiche potrebbero verificarsi in ambienti naturali e la capacità di esplorare il potenziale coevoluzione di questi organismi producono e rispondono. Altre indicazioni futuri includono chiarire la struttura della molecola secreta stesso, determinando il meccanismo (s) da cui l'organismo risponde rileva questo composto, e utilizzando come strumento chimica per modulare fenotipi batterici.
Anche con le considerazioni sopra esposte, il metodo qui descritto è un contributo significativo. Evita manodopera coinvolta nel montaggio una libreria di microbi ambientali, ma consente la loro separazione fisica e isolamento utilizzando supporti solidi. La forza di questa schermata coculture è chefornisce un metodo concettualmente e tecnicamente semplice da schermo attraverso migliaia di specie microbiche ad individuare quelli che secernono composti bioattivi di interesse, pur essendo applicabile a molte specie e fenotipi batteriche.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
L'autore ringrazia Roberto Kolter (Harvard Medical School) per la sua preziosa consulenza e assistenza durante lo sviluppo di questa schermata co-coltura. Ha anche grazie Matthew Powers per leggere il manoscritto per chiarezza, e Chia-yi Cheng per l'assistenza con l'ottenimento di Figura 6.
Materiali
| Name | Company | Catalog Number | Comments |
| Spectrophotometer | Any spectrophotomer capable of measuing OD600 absorbance values. | ||
| Luria broth, Lennox | VWR | 80017-484 | Alternative media sources may be necessary. |
| Glass beads, 3 mm | VWR | 26396-508 | |
| Gel loading tips, round | VWR | 29442-666 | |
| Glass rods | VWR | 59060-069 | |
| Fluorescence dissecting stereoscope | Zeiss | N/A | The author used a Zeiss Stemi SV6 dissection stereoscope with an EXFO X-cite 120 fluorescent light source, a long-pass YFP filter cube, an achromat 0.63X objective, 10X eyepieces, and an Axio HRC HR digital camera. Most screening was done with the focusing mount at 2.0-3.2X. Any dissecting stereoscope with fluorescence capabilities is fine, provided you have the correct filters for the FP you are using. It is best if there is a shutter that allows you to easily switch between brightfield and fluorescense, as well as a stage that allows illumination from above and below. If you want to capture images, an attached camera is also necessary. |
Riferimenti
- Berdy, J. Bioactive microbial metabolites. J. Antibiot. 58, 1-26 (2005).
- Lopez, D., Vlamakis, H., Kolter, R. Generation of multiple cell types in Bacillus subtilis. FEMS Microbiol. Rev. 33, 152-163 (2009).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Shank, E. A., et al. Interspecies interactions that result in Bacillus subtilis forming biofilms are mediated mainly by members of its own genus. Proc. Natl. Acad. Sci. U.S.A. 108, 1236-1243 (2011).
- Piston, D. W., Patterson, G. H., Lippincott-Schwartz, J., Claxton, N. S., Davidson, M. W. . Introduction to Fluorescent Proteins. , (2013).
- Chudakov, D. M., Matz, M. V., Lukyanov, S., Lukyanov, K. A. Fluorescent proteins and their applications in imaging living cells and tissues. Physiol. Rev. 90, 1103-1163 (2010).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J. Cell Sci. 120, 4247-4260 (2007).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Nicolas, P., et al. Condition-dependent transcriptome reveals high-level regulatory architecture in Bacillus subtilis. Science. 335, 1103-1106 (2012).
- Middleton, R., Hofmeister, A. New shuttle vectors for ectopic insertion of genes into Bacillus subtilis. Plasmid. 51, 238-245 (2004).
- Shimotsu, H., Henner, D. J. Construction of a single-copy integration vector and its use in analysis of regulation of the trp operon of Bacillus subtilis. Gene. 43, 85-94 (1986).
- Guerout-Fleury, A. M., Frandsen, N., Stragier, P. Plasmids for ectopic integration in Bacillus subtilis. Gene. 180, 57-61 (1996).
- Semsey, S., Blaha, B., Koles, K., Orosz, L., Papp, P. P. Site-specific integrative elements of rhizobiophage 16-3 can integrate into proline tRNA (CGG) genes in different bacterial genera. J. Bacteriol. 184, 177-182 (2002).
- Charpentier, E., et al. Novel cassette-based shuttle vector system for gram-positive bacteria. Appl. Environ. Microbiol. 70, 6076-6085 (2004).
- Yang, H. Y., Kim, Y. W., Chang, H. I. Construction of an integration-proficient vector based on the site-specific recombination mechanism of enterococcal temperate phage phiFC1. J. Bacteriol. 184, 1859-1864 (2002).
- Choi, K. H., Schweizer, H. P. mini-Tn7 insertion in bacteria with single attTn7 sites: example Pseudomonas aeruginosa. Nat. Protoc. 1, 153-161 (2006).
- Craig, N. L. Tn7: a target site-specific transposon. Mol. Microbiol. 5, 2569-2573 (1991).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (60), e3796 (2012).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Vartoukian, S. R., Palmer, R. M., Wade, W. G. Strategies for culture of 'unculturable' bacteria. FEMS Microbiol. Lett. 309, 1-7 (2010).
- Romano, J. D., Kolter, R. Pseudomonas-Saccharomyces interactions: influence of fungal metabolism on bacterial physiology and survival. J. Bacteriol. 187, 940-948 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Zengler, K., et al. Cultivating the uncultured. Proc. Natl. Acad. Sci. U.S.A. 99, 15681-15686 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon