Method Article
화학적 매개 종간의 상호 작용을 검출하는 공 배양을 사용하여
요약
박테리아는 그들의 이웃들 미생물의 생리학에 영향을 미칠 가능성이 분비되는 화합물을 생성. 여기에서 우리는 고체 미디어의 바실러스 서브 틸리 스 (Bacillus subtilis)의 형광 전사 기자 균주와 토양 미생물을 혼합하여 화학적으로 매개 종간의 상호 작용을 검출 할 수있는 공 배양 화면을 설명합니다.
초록
자연 속에서, 박테리아는 거의 독립적으로 존재하지 않으며 대신 대사 산물을 분비하여 지역 환경을 변경 다른 미생물의 다양한 배열에 의해 둘러싸여 있습니다. 이러한 대사 물질은 미생물 이웃의 생리 및 분화를 조절하는 잠재력을 가지고 스타일 복잡한 미생물 군집의 유지 가능성에 중요한 요소들이다. 우리는 화학적으로 매개 된 미생물의 상호 작용을 식별하는 형광 기반의 공동 배양 화면을 개발했다. 화면이 고체 미디어 환경 미생물과 형광 전사 기자의 변형을 결합하고 식민지가 공동 배양에서 성장 할 수 있도록 포함한다. 그것은 관심의 특정 표현형 표현하면 선택된 균주는 형광 있도록 형광 전사 기자 설계 (즉 바이오 필름 형성, 포자 형성, 독성 인자 생산, 등.) 검사는 성장 조건에서 수행 갔지이 표현형 다시 표현 (따라서 기자의 변형은 일반적으로 비 형광입니다)되지 않습니다. 환경 미생물이 표현형을 활성화 대사 산물을 분비 할 때, 한천을 통해 확산 및 형광 기자의 구조를 활성화합니다. 이 유도 - 대사 산물을 생산하는 미생물 탐지 할 수 : 그들은 형광 식민지에 가장 인접 비 형광 식민지입니다. 따라서,이 화면은 기자의 변형에서 특정 생리적 반응을 활성화 확산 대사 산물을 생산 환경 미생물의 식별을 할 수 있습니다. 이 책은 방법에 대해 설명합니다 :) 적절한 공 배양 검사 조건을 선택, b)는 기자와 검사에 대한 환경 미생물을 준비, C) 공동 배양 화면을 수행, D) 추정은 생물을 유도 분리, 전자) 보조 화면에 자신의 활동을 확인합니다. 우리는 바실러스 서브 틸리 스 (Bacillus subtilis)에있는 바이오 필름의 매트릭스 생산을 활성화 토양 생물에 대한 화면이 방법을 개발
서문
우리는 박테리아가 분비하는 대사가 이웃 미생물의 생리 및 개발에 영향을 미치는 방법에 대한 이해에 관심이 있습니다. 많은 대사 산물은 다른 미생물에 대한 자신의 생리 활성 효과를 특징으로하고 있습니다. 두 잘 설명 된 예는 다른 미생물의 해외 유전자 발현을 변경하는 다른 미생물의 성장을 억제하는 항생 물질, 및 정족수 인식 분자를 포함한다. 그러나 박테리아는 알려진 bioactivities 1이없는 다른 많은 작은 분자 천연 제품을 생산하고 있습니다. 우리는 박테리아가 진화하고 그들 대부분 세균이 존재하는 내에 복잡한 미생물 군집에서의 미생물 이웃 세포 생리학을 변조 할 수 있기 때문에 이들의 대사 산물을 생산하는 능력을 보존한다는 가설.
바실러스 서브 틸리 세포 유형
우리는 Bacil을 포함하는 화학적 매개 미생물의 상호 작용에 대한 우리의 연구 초점을 맞추고있다LU의 서브 틸리 스. 이뿐만 아니라 때문에 그람 양성 모델 박테리아와 조작에 사용할 수있는 결과 유전 도구와 같은 상태의뿐만 아니라, 때문에 특징 종류의 세포로 분화 할 수있는 능력이다. 예는 셀을 포함한다 :; 강력한 biofilm 형성에 필요한 세포 외 기질을 생산, 환경으로부터 DNA를 취할 능력, 수영 등 2 중, 포자 형성된. 이러한 유형의 세포는 각각 그들 생리 학적 및 / 또는 물리적으로 구별 그들의 유 전적으로 동일한 형제로부터 만드는 특성 전사 귤론을 표현한다. 다양한 성장 조건 하에서, 다중 셀 유형은 B. 단일 콜로니 내에 다양한 모집단 공존 서브 틸리 세포 3. 박테리아의 많은 종은 유사한 셀형 이질성을 나타낼 수 있지만,이 현상은 특히 B.에서 연구되어왔다 서브 틸리 스.
UPR 있습니다 특히, 유전자이러한 특정 B. 각에서 egulated 서브 틸리 스의 세포 유형이 확인되었습니다. 관심이 미생물의 표현형의 대부분은 직접 관찰하기 어렵거나 불가능하기 때문에 이러한 상향 조절 유전자를 확인하는 것은 여기에 설명 된 작업을 위해 필수적입니다. 예를 들어, 우리는 시각, 같은 고체 (1.5 %) 한천 플레이트에서 수영과 같은 특성을 감지 할 수는 없지만 B의 모집단 서브 틸리 세포는 그 조건 3에서 편모를 생산하고 있습니다. 또 다른 예는 바이오 필름의 매트릭스 생산이다. 매트릭스 생산 (그것이 거시적으로 주름이 식민지의 결과로) 식민지의 형태로 시각화하지만, 특정 성장 매체에, 오직 성장 4의 배수 일 이후에 할 수 있습니다. 그러나 유전자가 분화하는 동안 상향 조절되는 알고, 우리는 이러한 종류의 세포로 세포 분화를위한 마커 역할을 전사 기자를 구성 할 수 있습니다.
리포터 구조
이러한 형광 transcriptional 기자 세포 형 특정 유전자가 형광성 단백질, 예를 들어, 리포터 유전자의 생산을 구동하기위한 프로모터로 구성. 예를 들면 P의 X 유전자 X의 프로모터 영역을 나타내는 P의 (세포 수영을 위해) 노파-YFP, P 타파-YFP (바이오 필름의 매트릭스를 생산하는 세포) 및 (세포 포자 형성된 경우) P sspB-YFP을 포함한다. 표현형의 기본 규정이 그대로 유지 될 수 있도록이 기자의 구조는 염색체에 중립 궤적에 통합 (그림 1과 아래 참조)된다. 셀이 표현형을 표현 그러나, 지금, 또한 형광 단백질을 표현한다. 이것은 우리가이 생리적 반응을 활성화 미생물을 선별 할 수 있도록, 특정 표현형의 행동의 활성화 쉽게 시각화 판독을 제공합니다. 그러한 리포터는 일반적으로 미생물에 사용되고 있지만, 그것들은 대체로 지문을 확인해 화면에 적용되지 않았다이 방법 전에 미생물 사이의 Y 대사 상호 작용은 5를 설명했다.
셀 타입 별 기자 균주의 설계 및 건설에 중요한 고려 사항이 있습니다. 구조의 다른 유형이 확실히 할 수 있지만 우리는 독점적으로 전사 형광 기자를 활용했다. 우리는 두 가지 이유, 그러나, 우리의 화면에서 세포 유형의 차별화를위한 마커로 번역 융합의 사용을 권장 : 교란 원시 세포 유형 특정 단백질을 떠나 1) 욕구, 2) 인식이 확산, 세포 넓은 형광 (번역 융합과 공통) 세포 내에서 지역화 puncta에보다 감지하기 쉬울 것입니다.
리포터 유전자 선택
판독으로 전사를 사용하기로 결정 한 후, 리포터 유전자 (예 : LacZ를, 형광, 또는 루시 페라 제)를 선택해야합니다. LacZ를는 특별한 필요 최소한의 이점을 갖는다감지하는 장비를 개인별하지만, 환경 미생물 사이에 잘못된 반응의 더 높은 가능성이있다. 우리 손에, 락 토양 미생물 사이에 생물 +의 배경 수준 (, 데이터가 표시되지 토양 미생물의 10 %가 X-GAL 판에) 락 + (파란색이었다 >>) 엄청나게 높았다. 우리는 이것을하지 않았지만 그것은 매체에 X-gal을 농도를 적정하면, 이것은 X-GAL 리포터의 사용을 허용하도록 최적화 될 수있다. 루시 페라 탐지 높은 감도를 제공하며, 대부분의 직교 리포터 : 환경 미생물이 본질적으로 발광되는 거의 기회가있다. 그러나, 우리는 대부분의 멀티 웰 플레이트 만 지역화 된 영역을 스캔하도록 설계되었습니다로 어려운, 전체 페트리 접시에 걸쳐 발광 검출을 허용 우리 기관에서 장비를 식별 할 수 있습니다. 또한도 동시에 물리적 인 허용하는 방식으로 발광 식민지를 시각화하는 합병증이있을 수 있습니다유도 생물의 olation. 수탁자를 사용하여이 가능하게 한 수 있지만, 우리는 대신 B에서 작동하는 입증 된 형광 전사 기자를 사용하기로 결정 서브 틸리는, 검출 및 토양 생물 중 하위 위양성 비율의 적절한 감도를 제공하고, 시각화 및 격리 절차를 모두 쉽게 사용할 기기의 사용을 허용.
형광 선택
선택한 특정 형광 물질이 세균의 종류에 따라 달라집니다, 당신이 사용하는 한천 성장 매체, 그리고 특정 형광 필터를 사용하면 사용할 수 있습니다 설정합니다. 우리의 장비로, 우리는 발견 B. 두 서브 틸리 자신과 YFP (노란색 형광 단백질) 필터를 사용했을 때 그들이 우리의 손에 GFP (녹색 형광 단백질)에 그 기자가 우수하고, 전시 적은 형광 배경에 성장 된 한천을 식민지. 형광 단백질의 코돈 사용은자주도 당신의 세균 종에서 일을하거나, 구성 적 프로모터를 사용하여 명시 적으로 테스트하기 위해 문헌에서 알려진 형광을 선택하는 것이 중요하고, 진핵 생물에 최적화. 항상 발전 형광 단백질 변형 많은 수의 소스를 명시 적으로 실험 구에 적합한 형광 단백질을 선택에 대한 지침을 제공하는 일부 7,8의 숫자에서 검토 한 이는 6 현재 사용할 수 있습니다.
발기인 선택
프로모터의 선택은 크게 셀 형식이나 관심의 표현형에 따라 달라집니다. 같은 B. 같은 생물에 대한 서브 틸리 스, 일부 세포 형 특정 리포터 유전자는 문헌에 설립되었습니다. 다른 균주를 들어, 마이크로 어레이 또는 전사 데이터를 검사하는 것은 매우 조건에서 상향 조절되는 유전자에 대한 정보를 제공 할 필요가 어디에 관심 내가 당신의 세포 유형의 적하 목록. 최근의 연구는 B의 전사를 카탈로그 기와의 마이크로 어레이 (10)를 사용하여 104 서로 다른 성장 조건에서 서브 틸리 스. 이 논문은 유전자가 매우 적게 잘 특성화 표현형을위한 귀중한입니다, 다른 조건에서 상향 조절 된에 대한 포괄적 인 정보를 제공합니다.
오히려 그 모든 유전자에 대한 정확한 프로모터 영역을 맵핑하는 것보다, 우리는 일반적으로 단순히 프로모터와 유전자의 상류 순서 200-500 BP를 사용합니다. 정확한 순서의 길이는 게놈 문맥에 따라 달라집니다 필요한 오픈 리딩 프레임을 이웃 상류 코딩 영역을 포함하지 않도록 할 때 짧은 영역이 사용됩니다.
중립 궤적 및 통합
당신의 균주에서 기자 구조는 형광 전사 기자의 피로를 설계 마지막 질문이되어 유지하는 방법. 박테리아에서, 그 유전자는 자주 유지항생제 선택을 사용하여 플라스미드에. 그러나, 환경 미생물을 죽이는없이 공 배양 중에 항생제를 사용하는 것이 가능하지 않을 수있다. 플라스미드가 안정적으로 당신의 종의 박테리아를 유지하는 경우에, 당신의 박테리아가 심사하여 기자를 준비하는 항생제의 존재 플라스미드 매개로 기자를 포함 성장 가능하고 희망의 공 배양 자체 동안 항생제를 제거 할 수 있음을 플라스미드 것 형광 충분히 가능하도록 유지된다. 플라스미드는 쉽게 세균에 손실됩니다, 또는 스트레스 조건에서 손실 된 경우, 이것은 실행 가능한 옵션이되지 않습니다. 많은 경우에, 최적의 솔루션도 전형의 부재하에 리포터의 안정적인 유지 보수를 허용 박테리아 염색체 상으로 리포터 구조체를 통합하는 것이다. 목적 유전자의 정상적인 표현이나 규정을 방해하지 않도록 통합을 위해, 우리는 염색체에 자궁외 사이트에 통합하는 것이 좋습니다 캘리포니아N의 역할을 "중립 궤적." B.에서 서브 틸리이 통합 사이트가 유전자 것을 - 변이 된 때 - (통합 체는 항생제 선택하지 않고 확인 할 수 있도록) 특정 최소한의 미디어 표현형을 전달, 아직 리치 미디어의 성장과 포자 형성 속도를 변경하지 않고, amyE, 라카와 같은 유전자를 포함, thrC, pyrD, 된 gltA 및 SACA (전분을 이용할 수있는 능력을 반송, β-galactosides, 트레오닌, 우라실, 글루타메이트, 수크로오스, 각각) 11-13.
이러한 유전자의 통합은 B에서 몇 년 동안 안정적으로 사용되었지만 서브 틸리 스 (특히 amyE와 라카에서), 유사한 지식은 많은 다른 박테리아 종의 유전자를 사용하지 못할 수도 있습니다. 파지 부착 사이트의 사용은 중성 염색체 통합 사이트에 대한 훌륭한 대안 : 많은 종의 특정 14-16,뿐만 아니라 TN7 첨부 사이트 (AT & T의 TN7)와 같은 일반적인 통합 사이트가많은 세균 종 (17, 18)에서 확인 및 유전자 삽입을 위해 사용되어.
환경 미생물
우리는 우리의 공동 배양 화면에 대한 환경 미생물의 직접 소스로 흙을 사용합니다. 토양 미생물의 높은 다양성을 포함하고, 이러한 생물의 대부분은 천연 제품의 풍부한 원천입니다. (토양 세균의 사전 분리없이) 우리의 형광 전사 기자의 변형과 접시에 직접 배치 토양의 액체 현탁액을 사용함으로써, 우리는 매우 실험적인 접근 방식을 단순화합니다. 토양 어느 수확 후 즉시 이용 될 수도 있고, 미래의 사용을 위해 -80 ° C에 냉동. 즉시 사용이 잘 동결 살아남지 못할 것이다 것을 포함하여 미생물의 다양성이 잠재적으로 성장 할 수있는 장점을 가지고 있습니다. 그것은 사용되어야 스크린 판의 수를 증가, 이들 샘플로부터 경작 토양 미생물의 농도를 알 수없는 단점이있다. 델ayed 사용 콜로니 최적화 수가 각 화면 접시에 성장 될 수 있도록, 각각의 토양의 소스 CFU / ㎖가 미리 결정될 수있는 이점을 갖는다. 그러나, 토양 생물이 동결 생존 할 수 있어야합니다.
큰 계통 발생 학적 다양성이 우리의 행렬 유도 화면에서 확인 된 히트에서 관찰되었다 (토양 소스 즉) 검사되는 유도 풀을 다양 화하면 동일한 토양에 대한 깊이있는 심사보다 새로운 종간의 상호 작용을 식별에 더 효과가 나타나는 것을 추가 토양 소스는 오히려 더 철저하게 같은 토양 소스 (EA 생크와 R. 콜터, 하버드 의과 대학, 게시되지 않은 결과를) 심사보다 조사 하였다.
개요
우리가 여기에서 설명하는 방법은 기술적 요구 사항의 관점에서 간단합니다. 그것은 포함한다 : 1) B에 형광 전사 기자 구축 서브 틸리 나관심의 다른 박테리아 종, 2),이 기자가 활성화되지 않은되는 조건을 식별 3) (우리의 경우 토양에 있지만, 다른 소스 대신에 사용될 수있다)이 기자의 변형 및 상영하는 생물의 분취 량을 준비 4)이 혼합 고체 미디어, 5) 식별 및 추정이 생물을 유도 분리, 6)이 생물이 실제로 보조 화면이 표현형을 활성화 않는 것이 확인에 대한 미생물의 두 세트. 일단 확인이 생물과 그 대사 산물은 세균 생리학과 미생물의 상호 작용을 연구하기 위해, 박테리아의 행동을 조절하고, 잠재적 인 미래의 치료 화합물 등의 새로운 발판 역할을하는 화학 도구와 우리를 제공합니다.
프로토콜
1. 리포터 유전자를 선택하고 형광 전사 리포터를 구축
B. 서브 틸리 기준 :
- 바실러스 서브 틸리 스 (Bacillus subtilis) 형광 전사 기자의 구조를 설명하는 프로토콜에 대한 기준 19 조브 문서를 참조하십시오.
다른 세균 종의 경우 :
- 관심의 생리적 반응 중에 상향 조절되는 유전자를 식별합니다. 이는 기존 문헌 또는 특정 조건 하에서 미생물의 전사 분석에 기초 할 수있다.
- 표현형의 변화에 대한 프록시 역할을하는이 유전자의 전사 형광 기자를 구축합니다. 이러한 구조는 (도 1 참조) 적절한 형광 단백질의 생산을 구동이 상향 조절 유전자의 프로모터를 포함한다.
- 염색체에 중립 궤적으로이 구조를 통합 할 수 있습니다. 이렇게하면 그 고유 등록관심의 유전자의 ulation는 파쇄 및 환경 미생물의 성장을 방해 할 수있는 플라스미드를 선택 메커니즘 (예 : 항생제)에 대한 필요성을 피할 수 없습니다.
2. 공 배양 조건을 결정
B. 서브 틸리 P 타파-YFP 기자의 경우 :
- 사용 0.1X LB,이 기자에 대한 레녹스 이하 (1 g의 트립 톤, 0.5 g 효모 추출물, 리터 당 0.5 g의 염화나트륨) 매체, B. 이후 서브 틸리 스의 매트릭스 생산 루리아 국물 (20)에 최소한의 것입니다. 이 매체는 수 B. 5 성장 토양에서 다양한 생물 군을 허용하면서 서브 틸리 스 식민지, 준 밀리 만 관찰 크기로 성장한다.
- 잠재적 인 pH 변화를 최소화하기 위해 100 ㎜ MOPS 버퍼를 포함합니다.
다른 세균 종의 경우 :
- 사용 activatio에게 전사 데이터를 게시 또는 경험적으로 미생물의 성장을 식별하기 위해 다양한 배양 조건을 테스트하지만,형광 기자의 N은 (기자의 변형을 유발하는 미생물과 공 배양에서 재배 할 때의 활성화를 탐지 할 수 있도록 할 수 있습니다.) 무시할 수
- (예 : 토양 등) 빈 영양 환경에서 환경 미생물을 선별 할 때 높은 영양 조건 (21)와 제시 할 때 많은 빈 영양 박테리아가 성장하지 않기 때문에, (전통적으로 부유 미생물 미디어에 비해) 낮은 영양 콘텐츠와 매체를 사용합니다. 저 영양 배지는 또한 스크린의 처리량 증가, 콜로니의 크기를 감소시킨다.
- 낮은 배경 형광 좋은 광학 선명도와 매체를 선택합니다.
- 리포터 균주와 환경 미생물이 동시에 성장할 수 있도록 성장 온도를 최적화.
- 완충제의 첨가를 고려한다. 이러한 상호 작용은 흥미 아니라면 번호판 버퍼의 사용은, 생리 22에서 pH의 변화를 검출하는 매개의 가능성을 감소시킬 것이다.
3. 기자 분취 량을 준비
B. 서브 틸리 P 타파-YFP 기자의 경우 :
- 멸균 이쑤시개 나 주걱 스틱을 사용하여 신선한 LB 판에 -80 ° C 냉동 재고 행진 기자의 변형.
- 30 ℃에서 하룻밤 성장
- 고체 배지에서 성장에서 발생하는 배경 형광을 최소화하기 위해 액체 배양에 시리얼 희석을 수행
- LB의 5 ㎖의 액체 문화를 접종하고 37 ℃에서 진탕 성장
- 문화 OD ~ 0.6 (600)에 도달하면, 0.02의 OD 600에 5 ㎖ 신선한 LB로 희석.
- 문화 OD 600 ~ 0.6에 도달 할 때까지 흔들어 다시 37 ° C에서 성장.
- 직렬 성장 희석에게 3 배의 전체를 반복합니다.
- 최종 시리얼 희석 문화가 600 ~ 0.4 OD로 성장할 수 있습니다.
- 15~20%에 글리세롤을 추가합니다.
- 나누어지는 50 ~ 200 0.5 ML의 microfuge 튜브에 μL -80 ℃에서 동결
- 엄마기자의 비 형광 부모 균주 애 해당하는 분량 씩이 (가 차 심사시 필요합니다).
다른 세균 종의 경우 :
- 낮은 배경 형광이 세포를 사용하여 (즉, 기자에 사용되는 프로모터의 작은 표현이 조건에서 재배하고 있습니다.)
- (자세한 내용은 위 참조)하고 식민지의 적절한 수의 각 공 배양 화면 접시에 성장 할 수 있도록 기자 변형 알려진 CFU / ㎖ (식민지 ML 당 형성 단위)를 포함 분주 동결.
- 비 형광 모 균주에 대한 동등한 분주을 (그들은 차 심사시 필요합니다).
4. 토양 샘플을 얻기
- 노출 된 표면 토양의 상단에 0.5 cm를 폐기, 멸균 원뿔 튜브 또는 주걱을 사용하여 멸균 봉투에 흙을 수집합니다.
- 1g 당 10 ㎖의 비율로 멸균 생리 식염수 (0.85 % 염화나트륨)을 추가토양 슬러리를 만들기 위해 흙.
- 토양 입자로부터 세균을 제거 할 수있는 방법을 선택합니다 : 신선한 샘플) 즉시 사용 또는 샘플의 동결 후 B) 지연 사용.
- 즉시 사용할 수, 1 분 소용돌이 슬러리.
- 지연 사용을 위해, 혼합주기 사이에 1 분 동안 얼음에 블렌더 용기에 달려있다 배치, 세 1 분주기를 믹서기에 토양 슬러리를 혼합.
- 토양 슬러리 ~ 1 분 동안 정착하자.
- 새로운 튜브로 위 수성 레이어를 이동합니다.
- 15~20%의 최종 농도 글리세롤을 추가.
- 나누어지는 50 ~ 200 0.5 ML의 microfuge 튜브에 μL -80 ℃에서 동결
5. 냉동 기자와 토양의 분취 량의 CFU / ㎖를 결정
- 얼어 붙은 토양과 기자 나누어지는 해동. 토양 미생물은 얼음에 해동 할 수 있습니다. 때문에 B. 4 ° C에서 서브 틸리 lyses는, 그 분량 씩 낮은 온도에서 소요되는 시간을 최소화하기 위해 실온에서 빠르게 해동해야한다.
- 두 복제 세리아을0.1X LB 또는 다른 등장 버퍼 L 희석 (10 -8).
- 공 배양 검사에 사용됩니다 같은 매체의 한천 판에 각 시리얼 희석 플레이트 5 μL 명소.
- RT (또는 검사에 사용됩니다 온도)에서 성장한다.
- 다음 날, 각각의 자리에서 식민지의 수를 계산하고, 냉동 분주 각각의 CFU / ㎖을 계산합니다.
6. 스프레드 스크린 플레이트 나누어지는 농도를 확인
- 단계 5.1에서와 같이 고정 나누어지는 해동.
- 5 × 5, 1 × 10, 1 × 10 5, 2.5 × 10 5로 희석 6 및 2.5 × 10 7 CFU / ㎖.
- 개인 접시의 중앙에 각 희석의 50 μL 지점을 추가합니다. 이러한 계산 된 플레이트 당 25,000 콜로니 최적뿐만 아니라, 2 판을 수득한다 -, 5 - 최상의 실제 희석 판별 할 수 있도록, 더 적은 접어.
- 약 20 멸균 유리 (3 ㎜) 구슬로 추가조심스럽게 접시에 그들을 도청. 비즈 구부러진 유리 스프레더가보다 접시에 걸쳐 식민지를보다 균일 한 분포를 제공한다.
- 액체가 흡수 될 때까지, 벤치 탑 플레이트를 유지하고 앞뒤로 흔들어, 당신이 일로 회전하여 세포를 확산. 플레이트가 건조하면 구슬을 흔들 계속하지 마십시오, 그렇지 않은 경우는 박테리아를 죽일 시작합니다.
- 이상 판을 뒤집어 에탄올을 포함하는 폐기물 비커에 구슬을 버린다.
- 플레이트 (예 : 24 ° C / RT)하여 분석을위한 정확한 온도에서 당신의 분석 (예 : 24 시간)의 시간이 증가 할 수 있습니다.
- 해부 입체경을 사용하여, 볼의 두 개 이상의 필드 콜로니의 개수를 센다.
- 면적당 콜로니의 수를 계산하고, 각 접시에 얼마나 많은 콜로니를 결정한다.
- 필요에 따라 미래의 희석을 조정합니다. 콜로니의 실제 수는 각 비교 스크린 플레이트에 동일한 번호를 갖는만큼 중요하지 않다.
7. 공 배양 접시를 준비합니다
- 단계 5.1에서와 같이 해동 기자 나누어지는 (및 냉동 경우 토양 나누어지는).
- 0.1X LB 또는 다른 낮은 영양, 등장 성 용액 (섹션 6에 최적화 된 농도에) 기자를 희석.
- 냉동 토양 : 0.1X LB 또는 다른 낮은 영양, 등장 성 용액에서 6 절에 최적화 된 농도로 희석한다.
- 신선한 토양 : 토양 슬러리의 CFU / ㎖가 10-4에서 10-9 CFU / ㎖에 이르기까지 다양 수 있다는 예측을 기반으로 신선한 토양 슬러리의 희석을합니다.
- 스팟 공 배양 스크린 판의 중심 위에 흙과 기자 희석의 50 μL. 또한, 플레이트 형 토양 혼자 컨트롤로 기자.
- 단계 6.4-6.6에 설명 된대로 유리 구슬을 사용하여 확산.
- 당신의 형광 기자 행진을 활성화하거나 이러한 조건에서 기자 플레이트와 검사시 양성 대조군으로 사용하는 성장 알려진 성장 조건이있을 경우.
- 28 시간 (또는 기자 / 분석을위한 적절한) - (24)에 대해 24 ° C에서 알을 품다
8. 형광을위한 화면 공 배양 접시
- 식민지 날카로운 수 있도록 시야 조명을 사용하여, 입체경 초점을 맞 춥니 다.
- 토양 샘플은 식민지를 autofluorescent 여부를 확인하기 위해 토양 전용 플레이트 봐. 그렇다면,이 흙 (차 심사에 수반 증가) 오탐 (false positive)의 높은 비율의 원인이 될 수 있습니다.
- 유도들이 가양로 감지 할 수있는 기회 (그림 2) 감소, 여러 기자 식민지로 묶어야 할 가능성을 높이기 위해 공동 배양 접시에 토양 : 기자의 높은 비율을 사용합니다.
- 다른 형광 단백질 (다른 채널에 방출 한)를 사용합니다.
- 분석 타이밍을 결정합니다. 대부분의 새로운 기자의 경우, 잠재적 인 유도의시기는 알 수없는, 따라서 경험적으로 결정해야합니다.
- 곧 식민지 해부 입체경 (배율 ~ 30 배)으로 명확하게 볼되고 성장이 중단 된 및 / 또는 배경 형광이 너무 될 때까지 주기적으로 판을 검사 지속적으로 형광을위한 심사 시작합니다.
- 전위 유도 시간 창의 특정 리포터에 대해 결정되면, 그것은 스크린 판의 감시를 단순화하는 리포터를 함유하는 모든 공 배양 플레이트 유사해야한다. B.에 대한 서브 틸리 P 타파-YFP 기자는 판을 검사 할 수있는 적절한 시간은 세포를 도금 후 24 ~ 28 시간 사이에, B에 대한 서브 틸리 P sspB-YFP 기자, 그것은 성장의 26 ~ 32 시간 사이입니다.
- 당신의 형광 감도를 극대화 :
- 당신의 형광 범위를 해부 어두운 방에 있거나 정전 커튼으로 둘러싸인 확인합니다. 유도 가능성이 구조적으로 생산 FP보다 강렬하고 큰 센시가 필요합니다감지 할 수 tivity.
- 형광 램프가 안정화하는 당신의 눈이 공 배양 판 (적어도 1 ~ 2 분)에서 형광을 감지하기 전에 어둠에 적응하기위한 시간이 필요합니다.
- 긍정적 인 컨트롤을 사용하면 (해당되는 경우), 당신이 사용하는 확대는 형광을 감지 할 수 있는지 확인합니다. 배율은 일반적으로 최고의 시야각은 약 전형적인 식민지 직경 (200-400X) 30-50X 경우.
- 밝은 빛을 끄고 형광의 셔터를 엽니 다.
- 당신의 눈은 어둠으로 조정 한 후, 천천히 밝은 반점을 찾고,보기의 들판을 가로 질러 앞뒤로 판을 이동합니다.
- 플레이트의 상단에서 시작하고 접시의 바닥을 향해 이동 플레이트 좌우를 이동하는 지그재그 패턴을 사용합니다.
- 연습 판에 이동하는 방법에 천천히에 대한 감각을 얻기 위해, 당신은 전체 쉬르을 커버 있는지 확인하기 위해 시야에 접시를 이동영역에 직면하고 있습니다.
- 천천히 충분히 식민지가 흐릿하게하지 않는 것이 판을 이동합니다. 그것은 오히려 미스 지역보다 표면을 오버 샘플링하는 것이 좋습니다.
- 하나의 전체 청소 한 후, 판 90 ° 반복을 켜십시오. 인간의 눈은이 방법으로도 희미한 형광을 검출하기에 매우 좋다.
- 당신이 형광을 감지하면, 판 이동을 중지하고 다시 가서 형광 영역을 찾을 수 있습니다.
- 천천히 시야를 돌리면, 형광 박테리아의 식민지 (그리고 autofluorescent 토양 암성 또는 미디어 구성 요소)과 연결되어 있는지 여부를 결정합니다. 그렇다면, 형광 식민지에 인접 비 형광 식민지 추정 유도하는 생물이다.
9. 상상 속 유도하는 유기체를 분리
- 일단 유도 (형광) 콜로니가 확인 된, 유도 화합물을 분비하는 식민지를 분리.
- 기자 식민지의 충분히 높은 농도는 접시에 성장하는 경우(> 0.5:1 기자 : 토양 CFU), 추정 유도부 식민지 (다시 그림 2 참조) 여러 형광 식민지에 의해 포위 될 것이다.
- 경우에 위치를 공 배양 성장의 복잡성, 유도 인의 식민지가 모호하게 보조 화면의 후속 테스트를 위해 여러 가능성 유도부 식민지를 분리.
- 당신은 시야의 중앙에 픽업 할 콜로니 지역화.
- 그들은 판의 가장자리에있는 경우 판의 입술이 (당신이 오른 손잡이 경우 즉, 왼쪽에있는 플레이트의 입술을 넣어) 멀리 지배적 인 손에서되도록, 플레이트를 회전합니다. 이것은 당신이 당신의 피킹의 정확도를 향상 낮은 각도에서 식민지에 접근 할 수 있습니다.
- 사용 팁을에 버리고 근처에에에 연속으로 추정 유도 유기체뿐만 아니라 폐기물 비커에 신선한 접시를 놓습니다.
- 의 형광 램프를 떠나, 밝은 빛을 천천히 돌려당신이, (모양과 위치에 의해) 형광 식민지와 주변 추정 유도 생물을 식별 할 수 있도록하십시오. 당신은 당신이 형광 만 밝은 빛이 없을 때 선택 할 식민지를 식별 할 수 있도록 빛을 앞뒤로 몇 번 이동해야 할 수도 있습니다.
- 멸균, 라운드 200 μL 젤 로딩 팁을 손에 연필처럼 잡아 유리 막대 (200mm 길이 × 5 mm 직경)를 사용합니다. 이렇게하면 개별 식민지를 분리 할 때 사용하는 따기 도구입니다.
- 작업 표면에 안정화 단계에 대한 귀하의 바깥 쪽 손바닥을 놓습니다. 당신의 채집 도구를 안정시키기 위해 당신의 손의 안쪽, 엄지 손가락 측에 다른 손을 놓습니다.
- 필요한 경우, 당신이 선택하고자하는 식민지를 식별하기 위해 형광 및 브라이트 뷰 사이 다시 플립.
- 플레이트 표면 위의 피펫 팁을 유지하는 것은, 시야각으로 이동하고 선택하고자하는 식민지 위에 그것을 중심. 팁 초점이 될 것입니다.
- (현미경 단계 또는 작업 표면에 쉬고있다) 당신의 손의 바깥 쪽 가장자리를 사용하여, 천천히 고른 식민지에 피펫 팁을 돌리십시오. 얼마나 많은 다른 식민지에게 팁의 접촉을 최소화하기 위해 노력하고, 아주 가볍게 터치합니다.
- 신선한 판의 단면에 채집 도구, 연속 회전없이. 가우 징에게 한천을 방지하기 위해 부드러운 터치로 확산. 이 방법에 의해 전송 된 셀의 개수가 (식민지는 일반적으로 조작보다 훨씬 작습니다) 매우 작기 때문에, 하나의 연속 행진 격리 된 식민지에서 발생합니다.
- 다른 추정 유도부 생물과이 과정을 반복합니다.
- 24 ° C (또는 분석의 온도)에서 번호판을 품어.
10. 행진 상상 속 유도하는 유기체 고립 된 단일 콜로니를 구하는
- 입체경을 사용하여 결정 - 식민지 구조 또는 형태에 따라 - 당신의 상상 속 고른 공업의 각에 포함 된 다른 식민지 유형이 있는지 여부생물 ucing.
- 당신이 잠재적 인 식민지의 차이를 감지 위뿐만 아니라 아래에서 모두에서 식민지를 조명 할 수있는 단계를 사용하여 식민지 봐.
- 신선한 접시에 각각 다른 morphotype을 Restreak과 성장까지 배양한다.
- 한 번 더 Restreak 성장하자. 다른 형태 형이 계속되면, 순도 restreak을 계속합니다.
11. 보조 화면의 상상 속 유도하는 생물을 다시 테스트
- 형광 전사 기자를 활성화하는 결정하기 위해 보조 화면의 추정 유도하는 생물을 모두 다시 테스트합니다. 보조 화면이 추정 유도 유기체가 패치 또는 발견 된에 제어 플레이트와 함께 형광 전사 기자 균주의 microcolonies의 잔디,,로 구성되어 있습니다.
- 같은 농도의 형광 전사 기자 균주의 microcolony 잔디를 (포함 하나, 3 개의 동일한 번호판을 설정들)은 공 배양 검사 중에 사용되었다; 더 잔디를 함유하지 않는 한, 하나의 microcolony 형광 리포터없이 야생형 모 균주의 잔디를 함유.
- 플레이트의 방향을 결정하기 위해 각 판의 뒷면의 상단을 표시합니다.
- 패치 / 장소에 대한 위치 마커를 추가, 최대 10 추정 유도 생물 플레이트의 각 세트 (그림 3)에 테스트 할 수 있습니다.
- 해동 잔디 분주 단계 5.1에서와 같이 (기자와 비 형광 부모의 변형).
- 단계 6.4에서와 같이 멸균 구슬을 사용하여 잔디 플레이트 (또는 다른 최적화 희석)에 5 × 10 5 CFU / ㎖ 희석의 50 μl를 확산.
- 접시가 건조 보자.
- 패치 또는 추정이 생물을 유도 자리 :
- 쉽고 빠르게 접근 방식이 요구되는 경우 패치를 선택하고, 증착 세포의 적은 정확한 숫자가 허용된다면. 패치 :
- 시험을 식민지로 멸균 이쑤시개를 터치 - 모든 셀을 선택하지 않습니다.
- 빈 접시에 패치 (작은 행진을).
- 기자 접시에 신선한 이쑤시개와 패치를 반복합니다.
- 제어 판에 신선한 이쑤시개와 패치를 반복합니다.
- 양적 및 재현성 접근이 요구되는 경우 안보를 선택합니다. 스포팅 증착 세포의 수 (자세한 5를 참조 참조) 정상화 될 수 있도록하고, 비교되는 다른 유도부 생물의 상대적인 힘을 허용합니다. 자리에 :
- 재현 탁 추정은 멸균 플라스틱 큐벳에 액체 매체의 1 ml의 생물을 유도.
- OD에게 resuspensions 600 가져 가라.
- 식 X = 250 ÷ (OD 600-0.5)를 사용하여, OD 0.5 600 해결책을 얻기 위하여 액체 배지 500 ㎕를 각 재 부상에 대한 볼륨 X를 추가합니다. 동일한 체적 (50 사용할 수 있으므로, OD의 정상화 체류 희석을 수행 할 때이 방법은 필요한 피펫 단계를 간소화당신의 희석제의 모든 0 μL).
- 3 개의 판의 각 각 OD-정규화 재 부유의 자리 1 μL.
- 쉽고 빠르게 접근 방식이 요구되는 경우 패치를 선택하고, 증착 세포의 적은 정확한 숫자가 허용된다면. 패치 :
- 24 ~ 28 시간 (또는 기자 / 분석을위한 적절한) 24 ° C에서 성장하자.
- 당신의 형광 기자의 긴장하지만 당신의 부모의 통제의 피로를 활성화 추정 유도 생물을 식별하는 형광 해부 현미경을 사용합니다. 이러한 분리는 긍정적 인 히트입니다 - 관심의 표현형을 유도하는 화합물을 분비 환경 미생물.
결과
이 화면은 B.의 생리를 변경 화합물을 분비하는 토양 미생물을 확인하는 데 사용 하였다 서브 틸리 스. 여기에 기재된 결과는 B.의 행렬 생성 세포 유형에 집중 이 박테리아의 강력한 biofilm 형성에 필요한 단백질과 엑소 폴리 사카 라이드를 생산 서브 틸리 스,. 우리는 우리의 형광 기자의 구조 (P 타파-YFP)의 타파 - sipW - TASA 오페론의 프로모터를 선정했다. 이 오페론의 매트릭스 단백질의 구조적 요소를 인코딩하고 생물막 매트릭스 (23)의 생산 중에 상향 조절된다. 우리의 매트릭스 기자 (그림 1)은 이전에 19 기술로 건설되었다.
이전 작업 결과에 따르면 B. 서브 틸리는 자체 제작 쿼럼 센싱 같은 분자 surfactin뿐만 아니라 다른 토양 박테리아 (20)에 의해 생산 된 정제 된 대사 물질에 응답 행렬을 생성한다. 우리는 확장에 관심이 있었다토양 미생물이 B에서 매트릭스 생산을 유도하는 대사가 할 수 있도록하는보다 광범위하게 조사하기 위해 자체 연구 서브 틸리 스. 우리는 기자의 변형이 비 형광이었다 성장 조건으로 우리를 제공,이 매체가 이미 가난한 매트릭스 생산 (20)에 이어질 것으로 알려진 이후, 성장을위한 희석 LB를 사용하기로 결정. 그런 다음 이러한 성장 조건 하에서 스크리닝 적절한 콜로니의 개수를 최적화. 각각의 스크린 제판을 최적화하기 위해, 냉동 토양 및 리포터 분취 성장할 얼마나 많은 콜로니를 결정할 필요가있다 콜로니 및 영양 조건의 적절한 농도는 무엇이다. 밀접하게, 개별 식민지 간격 수 : 이상적으로 우리는 각각의 공 배양 접시 토양 및 기자 식민지의 상당 수 (토양 기자의 즉 1:1 비율)를 포함합니다. 기자 식민지의이 비율이 높으면 유도 여러 주변 기자 식민지를 활성화 할 가능성을 증가시킨다. 여러 교류를 갖는실제 유도부 유기체 (그림 2)를 정확히 파악에 추정 유도 식민지 증가 자신감을 둘러싼 얻어 짐 유도 식민지. 종균의 희석 얻어진 콜로니를 적절히 분산되어 있는지 여부를 결정하는 동안 영양소 함량은 성장 / 콜로니 형성의 정도를 제어한다. 저 영양 배지와 표준 10cm 직경 페트리 접시에, 우리는 접시 당 약 25,000 식민지 총 (5 × 10 5 CFU / ㎖ 희석의 50 μL)가 B의 가장 좋은 분리를 한 것으로 나타났습니다 0.1X LB MOPS 매체 (그림 4)에서 서브 틸리 스의 식민지.
시리얼 희석으로부터 계산 CFU / ㎖의 분액에서 박테리아의 대략적인 농도를 제공하지만, 전체 플레이트가 세포로 확산 될 때 생성 된 콜로니의 농도가 적절하다는 것을 보장하기 위해 필요하다. 계산 된 CFU / 플레이트와 실제 CFU / 플레이트는 항상 동일하지 않은 (그림 4 ). 해당하는 농도의 식민지 잔디를 도금하는 (그렇지 않으면 영양 가용성의 차이는 자신의 생리 상태를 변경하고 그 결과를 방해 할 수 있습니다) 다른 기자의 변종이 비교 될 수 있도록하는 것이 중요합니다.
기자와 토양의 분취 량을 준비한 후, 우리는 공 배양 화면 접시에 그들을 혼합 입체경 (그림 5)를 사용하여 형광을 위해 그 (것)들을 조사 하였다. 우리는 또한 단지 토양 B. 하나와 함께 접종 컨트롤을 도금 서브 틸리 P 타파-YFP 기자의 변형. B. 서브 틸리 그림 5에서 공 배양 이미지에 형광 식민지가 된 것과 같이 토양에서 다수의 미생물에 대한 응답으로 바이오 필름 매트릭스 (형광)을 생산하고 있습니다. 우리가 조사한 토양을 위해, 우리는 P 타파-YFP 기자에 대한 높은 적중률을했다. (여섯 가지 토양 샘플에서) 균주 12~67% 사이 문헌 5에 기재된 바와 같이 전일비하는 능력을 가지고P 타파-YFP 기자의 변형에 CE 형광. 이 포자 (P sspB-YFP)과 능력 (P COMG-YFP) 기자를 사용하여 유사한 화면에서 우리의 게시되지 않은 결과 대조적이다. 아무것도 그 능력을 유도 확인되지 동안 광범위한 검사 (각 기자에 대한> 200,000 식민지) 한 후, 두 생물은 그 포자 형성을 유도 확인되었다. 따라서, 서로 다른 세포 유형에 대한 적중률이 높은 변수가 될 수 있으며, 사전에 예측하기 어려울 수 있습니다.
우리는 각각의 추정 유도부 식민지를 들었다. 저 영양 배지에서 우리는 (서브 밀리미터 직경)을 추천 공 배양 화면 접시에 식민지는 매우 작은 수 있습니다. 그럼에도 불구하고, 정확 복잡한 화면 공 배양 접시 내에서 (도 6)를 선택하고 손으로 매우 작은 콜로니를 분리하는 것이 가능하다. 우리가 사용하는 수동 방법이 간단하고 전문 도구도가 필요하지 않습니다 화염 살균. 이러한 추정 유도 식민지는 격리에 restruck됩니다. 공 배양 플레이트는 식민지로 혼잡하고 있기 때문에, 그것은 드문 일이 아니다 - 각 추정 유도 샘플에서 성장하는 하나 이상의 생물을 가지고 - 심지어 아주 조심 따기 기술로. 주의 깊은 검사는 형태 학적으로 서로 다른 식민지의 분리를 허용해야합니다. 모든 추정 유도하는 생물은 다음 보조 화면에서 테스트됩니다. 패치 및 현물 방법 모두에서 긍정적이고 부정적인 결과는 그림 3에 나타낸다. 자신의 고밀도 성장, 물리적으로 우리의 보조 화면이 참 긍정적 인에서 조사 식민지의 약 50 %로, 꽤 좋은 공 배양 접시에서 식민지를 한 유도 수집 할 수있는 능력을 고려. 추가로이 화면의 결과뿐 아니라 신흥 후속 작업을했습니다 이전에 5를 설명했다.
/ ftp_upload/50863/50863fig1.jpg "/>
그림 1. 형광 전사 리포터 구조. 파란색 타원은 박테리아 세포를 나타내고 점선은 염색체를 나타냅니다. 이 예에서는 매트릭스의 생산을위한 형광 전사 리포터를 나타낸다. 리포터 구조체 (P 행렬-YFP)가 중립 로커스에서 염색체의 다른 삽입되는 동안 기본 궤적 ( "P"와 화살표는 프로모터 영역을 나타내는 P 행렬 - 행렬)은 그대로 남아있다.
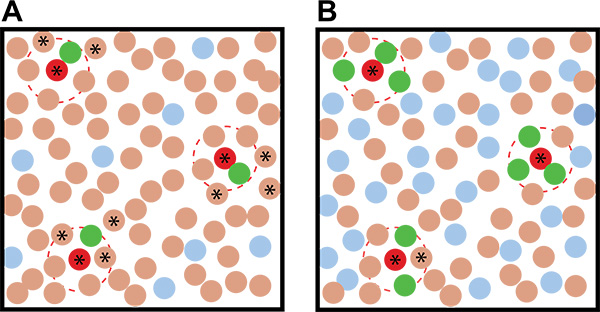
그림 2. 환경 미생물 : 기자의 다른 비율로 공 배양 검사 결과의 이상적인 예입니다. A) 저 기자 사용 : 환경 미생물의 비율은보다 추정 유도 생물을 식별에 더 많은 모호함에 이르게 할 때 B) 고 기자 : 환경 미생물의 비율을 사용합니다. 갈색 서클 빨간색 동그라미가 파란색 동그라미가 uninduced 기자 식민지를 대표 유도 토양 생물을 표현, 토양 생물을 나타내고, 녹색 식민지 유도 기자 식민지를 나타냅니다. 빨간색 점선 라인은 유도 대사의 행동 반경을 나타냅니다. 형광 식민지와의 근접 정도에 따라 - - 상상 속 생물을 유도하고 고른 보조 화면 재시험해야한다 별은 비 형광 식민지 나타냅니다.
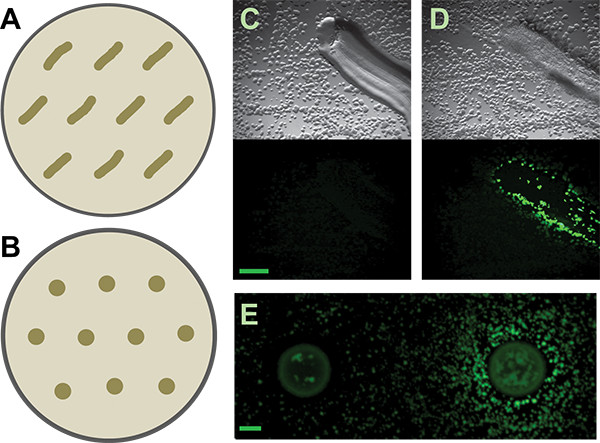
그림 3. 보조 화면. 패치 또는 발견 B. 대해 각각 보조 스크린 플레이트상에서 분리 분배하는 방법 및 B) 회로도 서브 틸리 스 매트릭스 기자. 더 관대 한 공간은 다른 기자들 또는 유도 분리, 출발을 위해 요구 될 수있다B.를 유도 각각 부정과 긍정적 인 패치 토양. C와 D) 대표 결과는 격리 자신의 활성 대사 물질의 확산에 종료 서브 틸리 P 타파-YFP - 기자. 상단 패널은 시야 이미지입니다, 낮은 패널은 형광 이미지입니다. 스케일 바는 1mm. E) 부정적이고 발견 된 토양에서 긍정적 인 결과는 같은 기자에 격리. 스케일 바 2 mm이다.

그림 4. microcolony 농도의 결정. 당신의 식민지의 분포와 크기는 영양과 세포의 농도에 모두 달려 B.의 성장.)의 차이 0.08x LB (아래 줄) 대 0.01x LB (위쪽 행)에 서브 틸리 스. 0.01x LB에 세포, microcolonies에 형성하지 않는 동안 t0.08x LB에 호스 않습니다. (우리의 스크린을 위해 우리는 여기에 표시된 것과 약간 영양 수준을 증가 참고 :. 0.08x LB에서 0.1X LB에)이 이미지 알려진 CFU / ㎖에서 연속 1시 5분 희석 1 μL 명소에서이다. 320, 640,000, 그리고 접시 당 128,000 CFU 총 : 10cm 페트리 접시에 걸쳐 식민지 비슷한 분포를 얻기 위해,이 농도에서 추정하는 것은 도금 (왼쪽부터)가 필요합니다. 그러나, 세포의 편재 (그들은 그 자리 가장자리에 집중되어있다)의 탐지 결과는 전체 플레이트에 세포를 확산 비교. 영양소 농도가 선택되면 따라서, 그것은 다양한 농도로 확산 판을 검사하는 것이 중요하다. . 스케일 바) B 0.1 mm이며이 패널) 왼쪽에서 (50,000 확산의 결과를 보여, 25,000, 그리고 0.08x LB 플레이트 접시 당 총 5,000 CFU. 이러한 이미지에서, 우리는 CFU / 판의 목표 숫자로 25,000을 선택했습니다. 스케일 바는 0.1 mm이다.

그림 5. B의 공 배양 서브 틸리 P 타파-YFP 토양 미생물과 혼합 B를 포함하는 공 배양 스크린 판에서 시야 및 형광 이미지. 오버레이 토양 미생물과 혼합 서브 틸리 P 타파-YFP 매트릭스 기자. 화살촉은 형광 기자 microcolonies에 둘러싸여 추정 유도를 나타냅니다. 스케일 바 1 mm이다.
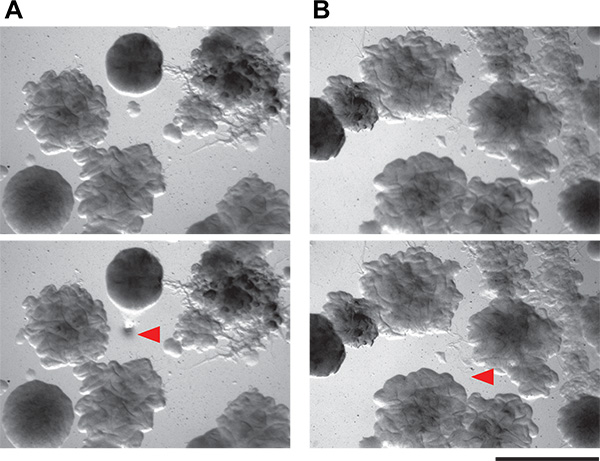
그림 6. 공 배양 접시에서 작은 박테리아 콜로니를 분리의 가능성의 데모. A와 B)이 패널은 토양에서 복잡한 미생물 군집을 포함하는 한천 플레이트의보기의 두 개의 필드를 표시합니다. 0.1 mm만큼 작을 콜로니 피킹 기재된 기술을 사용하여 단리 할 수있다여기에. 식민지 따기, 아래 패널 식민지 따기 후보기의 동일한 필드되기 전에 상단 패널은 시야각이다. 세포가 제거 된 곳 레드 화살촉 나타냅니다.
토론
이 프로토콜의 본질적인 한계 중 하나는 미생물 유기체의 cultivability에 의존하고 있다는 점이다. 도 24을 문서화 한 바와 같이, 지구상에서 가장 미생물 생명은 (아직) 날짜 탐구 배양 조건에서 재배 할 수 없습니다. 따라서, 자연 환경에서 발생하는 미생물 종 사이의 상호 작용의 거대한 숫자는이 방법을 사용하여 발견되지 않을 것입니다. 우리의 욕망은 이러한 상호 작용의 존재를 확인, 그러나 또한 그들을 중재에 관여하는 메커니즘과 분자를 연구하는 단지이기 때문에 그러나, 이러한 미생물을 배양 할 수있는 능력이 필요합니다. 심지어 경작 종 내에서,이 지역은 제대로 접근 방식은 여기에 미생물 사이의 화학적 매개 상호 작용을 식별 할 수있는 방법으로 가치있는 기여를 설명하고, 탐구하고있다. 이 프로토콜은 바실러스 서브 틸리 스의 행렬 유도 스크리닝하기 위해 최적화되어 있지만, 또한, 이론적으로 적용될 수있다다른 세균 종의 Y 전사 형광 기자.
이 방법의 또 다른 관련 제한 (정의에 의해)이 화면이 공 배양을 필요로한다는 것입니다. 다른 환경 틈새 시장을 활용하면서 자연 환경에서 서로 다른 성장률 미생물은 여전히 공간 근처에 공존 할 수 있습니다. 이러한 미생물의 작용은 단지 영양 요구 및 리포터 종 마찬가지 성장률 환경 미생물의 성장을 허용하는, 그러나, 우리의 공동 배양 화면에 의해 발견되지 않을 것이다. 리포터 균주의 성장 잠재력 유도부 유기체의 성장을 분리하는 것 변형이 확실히 가능하다. 토양에서 일반 - - 공동 문화의 화면에 문제가 발생할 수 있습니다 우리는 또한 곰팡이의 균사 성장이 것으로 예상. 반면 B. 우리의 화면의 짧은 시간 척도 서브 틸리가 성장 배지로 항진균 화합물을 첨가, 몇몇 진균이 검출되었다는 것을 의미 할 수 m이 문제를 inimize.
형광 기자의 구조에 대한 적절한 표현형 유전자를 선택하는 기능은 시퀀싱 및 전사 데이터 많은 박테리아 종 이미 가능하고 쉽게 얻을 수있는 하나의 재산을 고려, 어려운해서는 안됩니다. 그러나, 여기에 설명 된 방식으로 하나의 어려움은 형광 유도의 검출을 가능하게하여 리포터 균주의 배경 형광을 최소화 성장 조건을 확인하기 위해 필요하다. 전사 데이터가이 검색 (예를 들어 B. 서브 틸리 스의 성장에 사용할 수있는 기와 마이크로 어레이 데이터는 그 유전자가 제대로 (10)를 표현하는 조건의 식별을 허용)를 지원 할 수 있지만 이러한 조건의 식별은 종종 경험적으로 수행해야합니다. 많은 박테리아 표현형의 발현 이기종 때문에 일부 기자들에 대한 경험적 검색 부분에 도전 할 수있다. 즉, 그것은 C를 찾기 위해 희소onditions 집단 내에 세포가 그 모집단 및 유전자 발현의 강도 내의 셀의 개수에 따라, 따라서 표현형 X. 표현되지 않는 한, 그것을 유도가 검출 될 수 있도록 충분히 낮은 배경 형광을 제공하는 조건을 식별하기 어려울 수도 . 이상적인 심사 조건이 경험적 검색에 대한 대안은 "조정"돌연변이 유발을 사용하여 기자의 표현 수준에있을 수 있습니다. 프로모터 영역 및 / 또는 리포터 구조체의 리보좀 결합 부위를 변경하여, 배경 형광 수준이 감소 될 수있다. 이것은 약간의 구성 적 활성화 심지어 유전자가 유도를 조사 할 수 있도록함으로써이 화면의 유용성을 확장 할 수 있었다.
일단 유도 유기체 식별하고 보조 화면에서 확인되고, 그들은 그들의 계통 발생 학적으로 16S rRNA 유전자를 시퀀싱하여 확인 될 수있다. 그것은 fluores의 정도를 정량화하는 것이 가능하다cence 보조 화면 5 OD 600 정규화 자리를 사용하여. 이 사회의 구성원이 기자의 변형에 영향을 어느 정도까지 화합물을 생성에 대한 정보를 제공 할 수 있습니다. 따라서,이 미생물의 상호 작용이 자연 환경과 이러한 생산 및 응답 생물의 공진화 가능성을 탐구 할 수있는 능력에서 발생 될 수있는에 대한 가설을 초래할 수 있습니다. 다른 미래 경로, 분비 된 분자 자체의 구조를 해명 응답 유기체이 화합물을 감지하는 메카니즘 (들)를 결정하고, 세균성 표현형을 조절하는 화학 도구로 사용 포함한다.
고려 사항은 위의 설명도 함께, 여기에 설명 된 방법에 크게 기여합니다. 그것은 환경 미생물의 라이브러리를 조립에 관련된 노동을 피할 수 있지만, 고체 미디어를 사용하여 물리적 분리 및 분리 할 수 있습니다. 이 공 배양 화면의 힘은 그그것은 많은 박테리아 종과 표현형에 적용하면서 그 생리 활성 화합물을 분비하는 사람들을 식별하는 미생물 종의 수천을 통해 화면에 개념과 기술적으로 간단한 방법을 제공한다.
공개
저자는 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
저자 덕분에 자신의 귀중한 조언과이 공 배양 화면의 개발 과정에 도움 로베르토 콜터 (하버드 의과 대학). 그녀는 그림 6을 얻는에 대한 지원도 명확성을 위해 원고를 읽어 주셔서 감사합니다 마 힘, 그리고 치아 - 이순신 쳉.
자료
| Name | Company | Catalog Number | Comments |
| Spectrophotometer | Any spectrophotomer capable of measuing OD600 absorbance values. | ||
| Luria broth, Lennox | VWR | 80017-484 | Alternative media sources may be necessary. |
| Glass beads, 3 mm | VWR | 26396-508 | |
| Gel loading tips, round | VWR | 29442-666 | |
| Glass rods | VWR | 59060-069 | |
| Fluorescence dissecting stereoscope | Zeiss | N/A | The author used a Zeiss Stemi SV6 dissection stereoscope with an EXFO X-cite 120 fluorescent light source, a long-pass YFP filter cube, an achromat 0.63X objective, 10X eyepieces, and an Axio HRC HR digital camera. Most screening was done with the focusing mount at 2.0-3.2X. Any dissecting stereoscope with fluorescence capabilities is fine, provided you have the correct filters for the FP you are using. It is best if there is a shutter that allows you to easily switch between brightfield and fluorescense, as well as a stage that allows illumination from above and below. If you want to capture images, an attached camera is also necessary. |
참고문헌
- Berdy, J. Bioactive microbial metabolites. J. Antibiot. 58, 1-26 (2005).
- Lopez, D., Vlamakis, H., Kolter, R. Generation of multiple cell types in Bacillus subtilis. FEMS Microbiol. Rev. 33, 152-163 (2009).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Shank, E. A., et al. Interspecies interactions that result in Bacillus subtilis forming biofilms are mediated mainly by members of its own genus. Proc. Natl. Acad. Sci. U.S.A. 108, 1236-1243 (2011).
- Piston, D. W., Patterson, G. H., Lippincott-Schwartz, J., Claxton, N. S., Davidson, M. W. Introduction to Fluorescent Proteins. , (2013).
- Chudakov, D. M., Matz, M. V., Lukyanov, S., Lukyanov, K. A. Fluorescent proteins and their applications in imaging living cells and tissues. Physiol. Rev. 90, 1103-1163 (2010).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J. Cell Sci. 120, 4247-4260 (2007).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Nicolas, P., et al. Condition-dependent transcriptome reveals high-level regulatory architecture in Bacillus subtilis. Science. 335, 1103-1106 (2012).
- Middleton, R., Hofmeister, A. New shuttle vectors for ectopic insertion of genes into Bacillus subtilis. Plasmid. 51, 238-245 (2004).
- Shimotsu, H., Henner, D. J. Construction of a single-copy integration vector and its use in analysis of regulation of the trp operon of Bacillus subtilis. Gene. 43, 85-94 (1986).
- Guerout-Fleury, A. M., Frandsen, N., Stragier, P. Plasmids for ectopic integration in Bacillus subtilis. Gene. 180, 57-61 (1996).
- Semsey, S., Blaha, B., Koles, K., Orosz, L., Papp, P. P. Site-specific integrative elements of rhizobiophage 16-3 can integrate into proline tRNA (CGG) genes in different bacterial genera. J. Bacteriol. 184, 177-182 (2002).
- Charpentier, E., et al. Novel cassette-based shuttle vector system for gram-positive bacteria. Appl. Environ. Microbiol. 70, 6076-6085 (2004).
- Yang, H. Y., Kim, Y. W., Chang, H. I. Construction of an integration-proficient vector based on the site-specific recombination mechanism of enterococcal temperate phage phiFC1. J. Bacteriol. 184, 1859-1864 (2002).
- Choi, K. H., Schweizer, H. P. mini-Tn7 insertion in bacteria with single attTn7 sites: example Pseudomonas aeruginosa. Nat. Protoc. 1, 153-161 (2006).
- Craig, N. L. Tn7: a target site-specific transposon. Mol. Microbiol. 5, 2569-2573 (1991).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (60), e3796(2012).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Vartoukian, S. R., Palmer, R. M., Wade, W. G. Strategies for culture of 'unculturable' bacteria. FEMS Microbiol. Lett. 309, 1-7 (2010).
- Romano, J. D., Kolter, R. Pseudomonas-Saccharomyces interactions: influence of fungal metabolism on bacterial physiology and survival. J. Bacteriol. 187, 940-948 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Zengler, K., et al. Cultivating the uncultured. Proc. Natl. Acad. Sci. U.S.A. 99, 15681-15686 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유