Method Article
Выращивание и инъекции
В этой статье
Резюме
Метод, описанный здесь используется непосредственный впрыск энтомопатогенных бактерий в hemocoel из Manduca Sexta Личинками насекомых. M. Sexta Является коммерчески доступным и хорошо изученных насекомых. Таким образом, этот метод представляет собой простой подход к анализу хост-бактериальных взаимодействий с точки зрения одного или обоих партнеров.
Аннотация
Manduca sexta, commonly known as the tobacco hornworm, is considered a significant agricultural pest, feeding on solanaceous plants including tobacco and tomato. The susceptibility of M. sexta larvae to a variety of entomopathogenic bacterial species1-5, as well as the wealth of information available regarding the insect's immune system6-8, and the pending genome sequence9 make it a good model organism for use in studying host-microbe interactions during pathogenesis. In addition, M. sexta larvae are relatively large and easy to manipulate and maintain in the laboratory relative to other susceptible insect species. Their large size also facilitates efficient tissue/hemolymph extraction for analysis of the host response to infection.
The method presented here describes the direct injection of bacteria into the hemocoel (blood cavity) of M. sexta larvae. This approach can be used to analyze and compare the virulence characteristics of various bacterial species, strains, or mutants by simply monitoring the time to insect death after injection. This method was developed to study the pathogenicity of Xenorhabdus and Photorhabdus species, which typically associate with nematode vectors as a means to gain entry into the insect. Entomopathogenic nematodes typically infect larvae via natural digestive or respiratory openings, and release their symbiotic bacterial contents into the insect hemolymph (blood) shortly thereafter10. The injection method described here bypasses the need for a nematode vector, thus uncoupling the effects of bacteria and nematode on the insect. This method allows for accurate enumeration of infectious material (cells or protein) within the inoculum, which is not possible using other existing methods for analyzing entomopathogenesis, including nicking11 and oral toxicity assays12. Also, oral toxicity assays address the virulence of secreted toxins introduced into the digestive system of larvae, whereas the direct injection method addresses the virulence of whole-cell inocula.
The utility of the direct injection method as described here is to analyze bacterial pathogenesis by monitoring insect mortality. However, this method can easily be expanded for use in studying the effects of infection on the M. sexta immune system. The insect responds to infection via both humoral and cellular responses. The humoral response includes recognition of bacterial-associated patterns and subsequent production of various antimicrobial peptides7; the expression of genes encoding these peptides can be monitored subsequent to direct infection via RNA extraction and quantitative PCR13. The cellular response to infection involves nodulation, encapsulation, and phagocytosis of infectious agents by hemocytes6. To analyze these responses, injected insects can be dissected and visualized by microscopy13, 14.
протокол
1. Насекомое стерилизации яйцо и воспитания
- Подготовка диета по первой автоклавирования 15 г при условии, агар в 900-1000 мл H 2 O. Сразу же после автоклавирования, смешайте с 166 г пшеничного зародыша диеты и растушуйте в лаборатории блендере. Налейте в чашку (или блюд), чтобы охладиться, а затем перенести диету, чтобы алюминиевой фольги, плотно завернуть и хранить при 4 ° C.
- Прибыв на место, стерилизовать M. Sexta яйца с 250 мл 0,6% раствором хлорной извести в течение 2-3 мин в стакане держатель фильтра и устройства термос с 90 мм фильтровальной бумаги, периодически помешивая.
- Включите вакуум для слива раствором хлорной извести и мыть яйца 3-4 раза по 250 мл стерильной дистиллированной H 2 O в стирке.
- Передача яйца свежие 90 мм фильтровальной бумаги помещают в чашку Петри крышкой и дайте им высохнуть, пока они не слипаются (около 20-30 минут).
- Передача яйца на нижнюю часть пластиковых контейнеров с насекомыми диеты, размещение около 40 яиц в каждом контейнере(Рис. 1А). Яйца отделить от диеты, чтобы предотвратить попадание влаги вызванных грибковыми загрязнения. Поддерживать яйца при температуре 26 ° C с 16 часов света: 8 часов темного фотопериода. Яйца будут гореть до желтовато-белого цвета до вылупления.
- Когда инкубационное завершена, тщательно передать около 25 личинок каждый новый контейнеров с диетой на дне (рис. 1б). Важно, чтобы подобрать каждому личинки длинный черный рог с помощью щипцов, чтобы избежать причинения им вреда во время их хрупкие ранних стадиях развития. Выдержите в течение 2 дней, как указано выше. В то время как личиночная смерти необычным на этом этапе, некоторые мертвы, или, что более вероятно, связано с развитием чахлые личинки могут быть обнаружены. Такие насекомые должны быть исключены из дальнейшего исследования и пожертвовал при замораживании.
- Чтобы избежать людоедских поведения, передача личинок отдельных контейнерах с небольшими кусочками пищи (рис. 1С) и инкубировать как указано выше. Мониторинг развития насекомых, заменяя пищи и чистки кал OÜт контейнеров каждый день, пока они проходят третьей линьки личиночной (обычно 6-9 дней после вылупления). Это 4-го возраста личиночной стадии, характеризуется появлением черного крюка, как крючком на каждом proleg и повышение известности полосами вдоль тела насекомого (рис. 1D). Личинки могут значительно отличаться по размеру, но обычно весят 0,15-0,4 г при входе в 4-й этап возраста. Личинки же размера должны быть выбраны для инъекций.
2. Подготовка Бактерии для инъекций
- Расти бактериальный штамм (ы) должны быть испытаны в соответствии со стандартными процедурами в фазе роста вы хотите проверить.
- Пелле 500 мкл каждого штамма бактерий должна быть протестирована на спиннинг в течение 2 мин в микроцентрифуге при 13000 оборотов в минуту при комнатной температуре.
- Ресуспендируют клеток в 1 мл стерильной 1x фосфатным буферным раствором (PBS) и гранул снова, как и выше.
- Ресуспендируют клеток в 0,5 мл стерильного 1x PBS и измеренияУбедитесь, что оптическая плотность (ОП) суспензии. Развести всех суспензий на тот же диаметр, если это необходимо. Стерильные питательные среды также может быть использован для ресуспендирования клеток и растворение в месте 1x PBS, если это необходимо.
3. Инъекции из 4-й Личинки Instar
- Подготовьте серийный 10-кратном разведении первого бактериального штамма в 6 скважинах 96-луночный планшет в стерильные 1x PBS, используя свежие кончика пипетки для каждого разведения (рис. 2A). Конечный объем клеточной суспензии в каждую лунку должно превышать объем, необходимый для инъекций (10 мкл на насекомых), а также 20 мкл к пластине посевной (см. шаги 3,2 и 3,7).
- Пятно 10 мкл каждого разведения в течение 5 (10 -2 через 10 -6) в верхней части чашки Петри содержащие соответствующую среду роста. Наклоните пластину так, что пятна распространились в центре (рис. 2В).
- Удалите насекомых диеты и кала и место насекомых в контейнерах на льдуоколо 5 мин.
- Стерилизовать иглу шприца путем промывки 3 раза в каждом 2 трубки 70-100% этанола, после чего одна трубка стерильной H 2 O (рис. 2). Объем жидкости должен быть достаточным, чтобы погрузить иглу.
- Количественной разбавленных суспензий под микроскопом с помощью гемоцитометра. В зависимости от желаемого посевной, привлечь 10 мкл из соответствующей микропланшетным (рис. 2D).
- Тампон насекомых поверхность с 95% этанола и вводят 10 мл клеточной суспензии в насекомое под углом (меньше 45 °) за одно из брюшных ног. Будьте осторожны, не прокол кишечника и вводить содержимое прямо под слой эпидермиса (рис. 2E). Хотя некоторые потери гемолимфы (ясно, зелено-голубой жидкости) это нормально, твердых частиц и желтая жидкость выходит из места инъекции указывают на кишечнике прокол. Если это произойдет, пожертвовать насекомых и получить новую личинку повторнопоместить его.
- Повторите шаг 3,6 для каждой оставшейся насекомых в первой группе инъекций. Иглы стерилизация не нужна между насекомыми вводится с той же разбавления и штамм бактерий, если загрязнение происходит. Кроме того, повторяющиеся дозатор может быть использован для большей последовательности в объем впрыска среди образцов.
- После введения каждого насекомого с первого штамма бактерий, повторите шаг 3.2, на этот раз кровянистые выделения клеточной суспензии в середине плиты и дать им потока в нижней (рис. 2F). Инкубируйте пластины при соответствующей температуре и рассчитывать колонии для перечисления посевной. Этот второй шаг покрытие используется для проверки того, что образцы не загрязнены во время процесса впрыска, так как это может привести к разрозненных номеров колонии между первым и вторым гальванопокрытия.
- Повторите шаги с 3,1 по 3,8 для каждого штамма бактерий в эксперименте. И, наконец, вводят 3-5 насекомых стерильной 1x PBS использованием стерИль иглу в качестве отрицательной контрольной группы. Инкубируйте насекомых при 26 ° C с 16 часов света: 8 часов темного фотопериода.
- Мониторинг насекомых выживание в течение долгого времени после инъекции. Насекомое смерти характеризуется как отсутствие произвольных движений при стимуляции. Насекомые часто демонстрируют потерю аппетита, диарея (водянистые, желтые экскрементов), и / или потери воды ("потение") во время инфекции до смерти, эти характеристики могут быть Стоит отметить также.
Результаты
Представитель примере насекомых анализе смертности изображено на рисунке 3. В этом эксперименте, насекомые вводили около 50 колониеобразующих единиц (КОЕ) или дикого типа (ATCC19061) или ослабленного штамма мутанта (LRP 13) из Xenorhabdus nematophila выросла до середины логарифмической фазы (п = 6 насекомые каждого штамма). Насекомые наблюдались в течение примерно 72 часов, и процент насекомых вводят еще жива в каждой временной точке регистрируются. В этом случае ослабленного штамма выставлены четко задержки в убийстве насекомого; штамма дикого типа убили всех 6 личинок в течение 30 часов после инъекции, до смерти любого мутанта-инфицированных личинки.
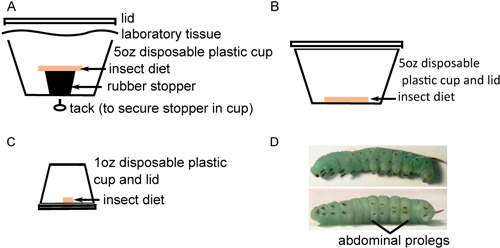
Рисунок 1. Насекомых воспитания в рамках подготовки к инъекции. A) Около 40 поверхностно-стерилизованных яиц находятся в нижней части в 5 унций чашки сстерильной диете насекомых покоится на резиновой пробкой. B) Двадцать только что вылупившиеся насекомые переносят в 5 чашек унции стерильной диете насекомых на дне, и инкубировали в течение 2 дней. C) Насекомые следующем передается индивидуально 1oz чашки с стерильной диета на дно и выдерживают до наступления срока их погашения. D) Четвертый возраста M. Sexta личинок с видными полосами вдоль тела (вверху) и черной крючков на брюшных ног (внизу).
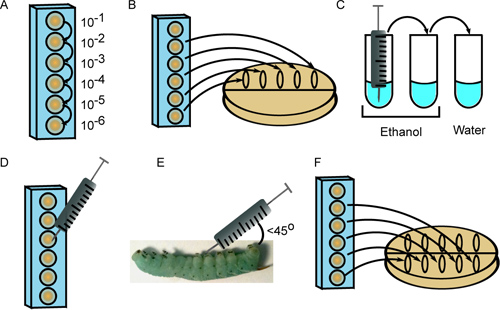
Рисунок 2. Инъекции 4-го возраста M. Sexta личинок. А) Бактерии серийно разводили в 96-луночный планшет. B) Десять микролитров несколько разведения высевают перечислить посевной. C) шприц стерилизуют 3 полоскания в этаноле (2x) и стерильную воду. D) Десять микролитров из соответствующего разбавления втягивается в шприц. E) клеточную суспензию вводят под углом 45 °Угол за первый брюшной proleg. F) Разведения снова покрытием для получения второго мера посевной.
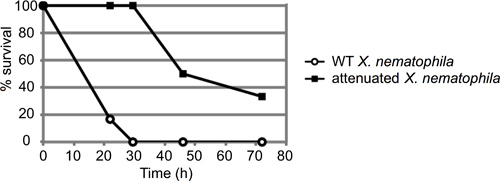
Рисунок 3. Представитель результате M. Sexta инъекции анализа. Около 50 колониеобразующих единиц (КОЕ) Xenorhabdus nematophila клеток в стационарной фазе (10 мкл от 10 -4 разведения) вводили в шесть 4-го возраста M. Sexta личинок в напряжении. Оба дикого типа и мутантного штамма (ЛРП) с установленным вирулентности дефекта вводили и насекомых контролируется на смертность в течение долгого времени. Результаты представлены как процент выживших насекомых с течением времени (в часах). Эти кривые являются статистически различны, с р-значение 0.000458 с помощью лог-рангового анализа.
Обсуждение
Непосредственный впрыск М. Sexta личинок с энтомопатогенных бактерий, как описано здесь, служит простым и эффективным средством для анализа бактериальной вирулентности. Этот метод также легко адаптируется для различных испытуемых и / или условий. Бактерии могут быть получены различными способами перед инъекцией. В случае X. nematophila, дикий тип клеток, выращенных в богатую питательными веществами Лурия-Bertani (LB) среды до середины логарифмической фазы, как правило, самой опасной, убивая все или почти все насекомые в течение 30 часов после инъекции. Клетки в стационарную фазу часто берут 5-10 часов больше времени, чтобы убить личинок. Хотя фазе роста влияет на вирулентность, общее число клеток вводили оказывается менее важным 16, с типичным посевной в диапазоне от 20 до 20000 КОЕ. В самом деле, в случае Xenorhabdus и Photorhabdus видов, а всего лишь 5 КОЕ достаточно, чтобы убить насекомое хозяин 17. Для оценки вирулентности ргореrties видов бактерий, которые устойчивы к стерилизации этанола (например, вида Bacillus), одноразовые иглы могут быть использованы для введения каждого уникального штамма в месте этанола стерилизации (шаг 3,4).
Дальнейшие корректировки этого метода могут быть связаны с изменениями в воспитании и / или манипуляции M. Sexta. Например, насекомые могут быть выращены на помидор или листья табака, как более естественный источник пищи. Кроме того, различные стадии развития М. Sexta личинки могут быть проанализированы с помощью этого метода. Четвертый личинки возраста были выбраны на основе их относительно большого размера, но меньше, личинки могут также быть введены с помощью этого метода. Пятый возраста личинки могут быть введены, однако изменения в иммунной системе на этой стадии развития оказывают конце 5-го возраста личинки большей степени, чем ранние 5-го возраста личинки 18, потенциально усложняет анализ данных.
Наконец, непосредственный впрыскметод может быть адаптирован для использования с другими видами насекомых. M. Sexta используется в качестве модели хост для высоко патогенных видов, потому что это менее восприимчивы к инфекции, чем другие (более восприимчивы) модельных организмах, таких как mellonella Galleria. G. mellonella может быть введен по методике, описанной в работе 19, однако, и могут быть полезны для анализа видов бактерий, менее опасны, чем Xenorhabdus и Photorhabdus видов.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить прошлом члены Goodrich-Блэр лаборатории: Саманта Orchard, Kimberly Cowles, Эрин Герберт-Tran, Грега Ричардса, Меган Менар, и Youngjin парка за их вклад в развитие этого протокола. Эта работа финансировалась Национальным научным фондом грантов IOS-0950873 и Национального института здоровья АЯРБ общение FAI084441Z.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Компания | Номер в каталоге | Комментарии |
| 90 мм фильтровальная бумага | Ватман | 1001 090 | |
| Стеклянный держатель фильтра | Millipore | XX1004700 | |
| Manduca Sexta яйца | Каролина биологического питания | 143880 | |
| Диета непарного шелкопряда + агар | MP Biomedicals | 0296029301 | |
| 5,5 унции. пластиковые контейнеры и крышки | Компания Solo Cup | URC55-0090 PL4-0090 | |
| 1 унция. пластиковые контейнеры и крышки | DART Container Corporation | 100pc 100PCL25 | |
| 1x PBS | 137 мм NaCl, 2,7 мМ KCl, 8 мМ Na 2 HPO 4, 1,46 мМ KH 2 PO 4, рН 7,4 | ||
| Шприц | Гамильтон | 80208 | 30 размера, 0,375 "длиной, точка стиль 2 |
Ссылки
- Bintrim, S. B., Ensign, J. C. Insertional inactivation of genes encoding the crystalline inclusion proteins of Photorhabdus luminescens results in mutants with pleiotropic phenotypes. J. Bacteriol. 180, 1261-1269 (1998).
- Schesser, J. H., Kramer, K. J., Bulla, L. A. Bioassay for homogeneous parasporal crystal of Bacillus thuringiensis using the tobacco hornworm, Manduca sexta. Appl. Environ. Microbiol. 33, 878-880 (1977).
- Péchy-Tarr, M., Bruck, D. J., Maurhofer, M., Fischer, E., Vogne, C., Henkels, M. D., Donahue, K. M., Grunder, J., Loper, J. E., Keel, C. Molecular analysis of a novel gene cluster encoding an insect toxin in plant-associated strains of Pseudomonas fluorescens. Environ. Microbiol. 10, 2368-2386 (2008).
- Nuñez-Valdez, M. E., Calderón, M. A., Aranda, E., Hernández, L., Ramírez-Gama, R. M., Lina, L., Rodríguez-Segura, Z., Gutiérrez Mdel, C., Villalobos, F. J. Identification of a putative Mexican strain of Serratia entomophila pathogenic against root-damaging larvae of Scarabaeidae (Coleoptera). Appl. Environ. Microbiol. 74, 802-810 (2008).
- Forst, S. A., Tabatabai, N. Role of the histidine kinase, EnvZ, in the production of outer membrane proteins in the symbiotic-pathogenic bacterium Xenorhabdus nematophilus. Appl. Environ. Microbiol. 63, 962-968 (1997).
- Kanost, M. R., Jiang, H., Yu, X. Q. Innate immune responses of a lepidopteran insect, Manduca sexta. Immunol. Rev. 198, 97-105 (2004).
- Yu, X. Q., Zhu, Y. F., Ma, C., Fabrick, J. A., Kanost, M. R. Pattern recognition proteins in Manduca sexta plasma. Insect Biochem. Mol. Biol. 32, 1287-1293 (2002).
- Eleftherianos, I., ffrench-Constant, R. H., Clarke, D. J., Dowling, A. J., Reynolds, S. E. Dissecting the immune response to the entomopathogen Photorhabdus. Trends Microbiol. 18, 552-560 (2010).
- Tobacco Hornworm Genome Project [Internet]. , Baylor College of Medicine. Houston, TX. Available from: http://www.hgsc.bcm.tmc.edu/content/tobacco-hornworm-genome-project (2012).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- D'Argenio, D. A., Gallagher, L. A., Berg, C. A., Manoil, C. Drosophila as a model host for Pseudomonas aeruginosa Infection. J. Bacteriol. 183, 1466-1471 (2001).
- Waterfield, N., Dowling, A., Sharma, S., Daborn, P. J., Potter, U., Ffrench-Constant, R. H. Oral toxicity of Photorhabdus luminescens W14 toxin complexes in Escherichia coli. Appl. Environ. Microbiol. 67, 5017-5024 (2001).
- Park, Y., Herbert, E. E., Cowles, C. E., Cowles, K. N., Menard, M. L., Orchard, S. S., Goodrich-Blair, H. Clonal variation in Xenorhabdus nematophila virulence and suppression of Manduca sexta immunity. Cell. Microbiol. 9, 645-656 (2007).
- Park, Y., Kim, Y., Putnam, S. M., Stanley, D. W. The bacterium Xenorhabdus nematophilus depresses nodulation reactions to infection by inhibiting eicosanoid biosynthesis in tobacco hornworms, Manduca sexta. Arch. Insect Biochem. Physiol. 52, 71-80 (2003).
- Cowles, K. N., Cowles, C. E., Richards, G. R., Martens, E. C., Goodrich-Blair, H. The global regulator Lrp contributes to mutualism, pathogenesis and phenotypic variation in the bacterium Xenorhabdus nematophila. Cell. Microbiol. 9, 1311-1323 (2007).
- Cowles, K. N., Goodrich-Blair, H. Expression and activity of a Xenorhabdus nematophila haemolysin required for full virulence towards Manduca sexta insects. Cell. Microbiol. 7, 209-219 (2005).
- Goodrich-Blair, H., Clarke, D. J. Mutualism and pathogenesis in Xenorhabdus and Photorhabdus: two roads to the same destination. Mol. Microbiol. 64, 260-268 (2007).
- Eleftherianos, I., Baldwin, H., ffrench-Constant, R. H., Reynolds, S. E. Developmental modulation of immunity: changes within the feeding period of the fifth larval stage in the defence reactions of Manduca sexta to infection by Photorhabdus. J. Insect Physiol. 54, 309-318 (2008).
- Kavanagh, K., Reeves, E. P. Exploiting the potential of insects for in vivo pathogenicity testing of microbial pathogens. FEMS Microbiol. Rev. 28, 101-112 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены