Method Article
L'élevage et de l'injection de
Dans cet article
Résumé
La méthode décrite ici utilise l'injection directe de bactéries entomopathogènes dans le hémocèle de Manduca sexta Les larves d'insectes. M. sexta Est un insecte disponible dans le commerce et bien étudié. Ainsi, cette méthode représente une approche simple pour analyser les interactions hôte-bactéries du point de vue de l'un ou des deux partenaires.
Résumé
Manduca sexta, communément connu sous le sphinx du tabac, est considéré comme un ravageur agricole important, se nourrissant de plantes solanacées, dont le tabac et la tomate. La susceptibilité de M. larves sexta à une grande variété d'espèces bactériennes entomopathogènes 1-5, ainsi que la richesse des informations disponibles sur le système immunitaire de l'insecte 6-8, et la séquence du génome attente 9 rendent un organisme bon modèle pour une utilisation dans l'étude des interactions hôte-microbe au cours de la pathogenèse. En outre, M. larves sexta sont relativement grands et faciles à manipuler et à entretenir dans le rapport de laboratoire sensibles à d'autres espèces d'insectes. Leur grande taille facilite aussi efficace tissus / hémolymphe d'extraction pour l'analyse de la réponse de l'hôte à l'infection.
La méthode présentée ici décrit l'injection directe de bactéries dans le hémocèle (cavité sang) de M. larves sexta. Cette approchepeut être utilisé pour analyser et comparer les caractéristiques de virulence de diverses espèces bactériennes, les souches, ou des mutants par simple surveillance du temps de mort de l'insecte après l'injection. Cette méthode a été développée pour étudier la pathogénicité de Xenorhabdus et des espèces Photorhabdus qui associent généralement avec les nématodes vecteurs comme un moyen de gagner l'entrée dans l'insecte. Les nématodes entomopathogènes infectent généralement les larves via digestive naturelle ou orifices respiratoires, et de libérer leurs contenus symbiotiques bactériens dans l'hémolymphe des insectes (sang) peu de temps après 10. Le procédé d'injection décrits ici contourne la nécessité d'un nématode vecteur, ainsi découpler les effets des bactéries et des nématodes sur les insectes. Cette méthode permet à l'énumération précise des matières infectieuses (cellules ou protéines) dans l'inoculum, ce qui n'est pas possible à l'aide d'autres méthodes existantes pour l'analyse entomopathogenesis, y compris entaille 11 et des essais de toxicité orale 12 L'utilité de la méthode d'injection directe comme décrit ici est d'analyser la pathogenèse bactérienne en surveillant la mortalité des insectes. Cependant, cette méthode peut facilement être étendu pour une utilisation dans l'étude des effets de l'infection sur la M. sexta système immunitaire. L'insecte réagit à l'infection par les deux réponses humorales et cellulaires. La réponse humorale comprend la reconnaissance de bactéries associées aux modèles et la production subséquente de plusieurs peptides anti-microbiens 7; l'expression de gènes codant pour ces peptides peut être surveillée à la suite de l'infection directe par l'intermédiaire d'extraction d'ARN et PCR quantitative 13. La réponse cellulaire à l'infection implique la nodulation, l'encapsulation et la phagocytose des agents infectieux par les hémocytes 6 13, 14.
Protocole
1. Stérilisation des oeufs d'insectes et d'élevage
- Préparer l'alimentation d'abord autoclave 15 g de gélose fournie dans 900-1000 ml H O. 2 Immédiatement après passage à l'autoclave, le mélange avec 166 g de nourriture de germe de blé et bien mélanger dans un mélangeur de laboratoire. Verser dans un plat (ou des plats) pour refroidir, puis transfert à l'alimentation du papier d'aluminium, enveloppez hermétiquement et conserver à 4 ° C.
- À l'arrivée, stériliser M. oeufs sexta avec 250 ml d'eau de Javel 0,6% pendant 2-3 min dans un porte-filtre en verre et appareils fiole à vide avec un papier filtre de 90 mm, en remuant de temps en temps.
- Mettez à vide pour purger l'eau de Javel et laver les oeufs 3-4 fois avec 250 ml stérile distillée H 2 O par lavage.
- Transfert des œufs frais à papier de 90 mm filtre placé dans une boîte de Pétri couvercle et laissez-les sécher jusqu'à ce qu'ils ne collent ensemble (environ 20-30 min).
- Transférer les oeufs sur le fond des récipients en plastique avec un régime alimentaire des insectes, placer environ 40 oeufs dans chaque récipient(Figure 1A). Les oeufs sont séparés de l'alimentation pour empêcher l'humidité provoquée par la contamination fongique. Maintenir les œufs à 26 ° C avec une lumière 16 h: 8 h obscurité photopériode. Oeufs permettra d'alléger d'une couleur blanc-jaune avant l'éclosion.
- Fois l'éclosion terminée, transférez environ 25 larves de chaque dans de nouveaux conteneurs avec un régime alimentaire sur le fond (figure 1B). Il est important de ramasser chaque larve par la longue corne noire à l'aide des pinces pour éviter de les endommager pendant leurs premiers stades de développement fragiles. Incuber pendant 2 jours que ci-dessus. Alors que la mort des larves est inhabituel à ce stade, certains étaient morts ou, plus probablement, un retard de croissance des larves de développement peuvent être observés. Ces insectes devraient être exclus de l'étude plus loin et sacrifiés par le gel.
- Pour éviter les comportements cannibales, les larves transférer dans des contenants individuels avec des petits morceaux de nourriture (figure 1C) et incuber comme ci-dessus. Surveiller le développement des insectes, les excréments remplacer la nourriture et le nettoyage oust de conteneurs tous les deux jours jusqu'à ce qu'ils subissent la mue des larves troisième (habituellement 6-9 jours après l'éclosion). Il s'agit de la 4 ème étape stade larvaire, caractérisé par l'apparition de noir de crochet en forme de crochets de chaque proéminence proleg et l'augmentation de bandes le long du corps de l'insecte (figure 1D). Les larves peuvent varier considérablement en taille, mais pèsent généralement de 0,15 à 0,4 g à l'entrée du stade 4 e stade larvaire. Les larves de taille similaire doit être choisi pour l'injection.
2. Préparation des bactéries pour injection
- Croître la souche bactérienne (s) pour être testés conformément aux procédures standard de la phase de croissance que vous souhaitez tester.
- Pellet 500 ul de chaque souche bactérienne à tester en faisant tourner pendant 2 min dans une microcentrifugeuse à 13.000 rpm à température ambiante.
- Resuspendre les cellules dans 1 ml de phosphate 1x solution saline stérile tamponnée (PBS) et une pastille de nouveau comme ci-dessus.
- Resuspendre les cellules dans 0,5 ml de PBS stérile 1x et mesurerque la densité optique (DO) de la suspension. Diluer les suspensions à la même OD, si nécessaire. Un milieu de croissance stérile peut également être utilisé pour la remise en suspension des cellules et de dilution en place de PBS 1x, si on le souhaite.
3. L'injection de 4 e stade larvaire
- Préparer série de 10 dilutions de la première souche bactérienne dans 6 puits d'une microplaque de 96 puits dans du PBS stérile 1x, en utilisant une pointe de pipette propre pour chaque dilution (figure 2A). Le volume final de suspension cellulaire dans chaque puits doit excéder le volume nécessaire pour l'injection (10 pi par les insectes), plus 20 ul de plaque de l'inoculum (voir les étapes 3,2 et 3,7).
- 10 ul de chaque tache de 5 dilutions (10 -2 à travers 10 -6) le long de la partie supérieure d'une boîte de Pétri contenant un milieu de croissance approprié. Incliner la plaque pour que les taches s'étendent vers le centre (figure 2B).
- Retirez l'alimentation des insectes et des excréments d'insectes et placer dans des contenants sur la glace pendantenviron 5 min.
- Stériliser l'aiguille de la seringue par un rinçage 3 fois chacune dans 2 tubes d'éthanol 70-100%, suivis par un tube stérile de H 2 O (figure 2C). Le volume de liquide doit être suffisant pour submerger l'aiguille.
- Quantifier les suspensions de cellules diluées au microscope en utilisant un hémocytomètre. Selon l'inoculum désiré, dessiner 10 pl de la microplaque convient bien (figure 2D).
- Écouvillon la surface d'insecte avec de l'éthanol 95%, et injecter la suspension dans 10 ml de cellules de l'insecte à un angle (inférieure à 45 °) l'une derrière des fausses pattes abdominales. Prenez soin de ne pas percer le tube digestif et injecter le contenu juste sous la couche épidermique (figure 2E). Alors que certains la perte d'hémolymphe (clair, vert-bleu liquide) est normal, les particules et le liquide jaune émergeant du site d'injection sont révélateurs de la perforation intestinale. Dans ce cas, sacrifier l'insecte et obtenir une nouvelle larve à nouveaule placer.
- Répéter l'étape pour chaque insecte 3,6 restante dans le groupe d'injection premier. Aiguille stérilisation n'est pas nécessaire entre chaque insecte injecte avec la même dilution et la souche de bactéries à moins de contamination. Alternativement, un distributeur de répéter peut être utilisé pour une plus grande cohérence dans le volume d'injection entre les échantillons.
- Après l'injection chaque insecte avec la première souche de bactéries, répéter l'étape 3,2, cette fois spotting suspensions cellulaires au milieu de la plaque et de les laisser s'écouler vers le bas (figure 2F). Incuber les plaques à la température appropriée et compter les colonies d'énumérer l'inoculum. Cette deuxième étape de placage est utilisé pour vérifier que les échantillons n'étaient pas contaminés pendant le processus d'injection, comme cela se traduirait par le nombre de colonies disparates entre les premier et deuxième placages.
- Répétez les étapes 3.1 à 3.8 pour chaque souche de bactéries dans l'expérience. Enfin, injecter 3-5 insectes stériles avec 1x PBS à l'aide d'un monstreaiguille ile comme un groupe témoin négatif. Incuber les insectes à 26 ° C avec une lumière 16 h: 8 h obscurité photopériode.
- Surveiller la survie des insectes au cours du temps après l'injection. Mort de l'insecte se caractérise par un manque de mouvement volontaire lors de la stimulation. Insectes présentent souvent une perte d'appétit, diarrhée (aqueuse, excréments jaune), et / ou de perte d'eau («transpiration») au cours de l'infection avant son décès; ces caractéristiques est intéressant de noter que bien.
Résultats
Un exemple représentatif d'un essai mortalité des insectes est représenté dans la figure 3. Dans cette expérience, les insectes ont été injectés avec environ 50 unités formant colonies (UFC) de l'une de type sauvage (ATCC19061) ou une souche mutante atténuée (lrp 13) de Xenorhabdus nematophila grandi au milieu de la phase logarithmique (n = 6 insectes par souche). Les insectes ont été observés pendant environ 72 heures, et le pour cent des insectes injectés encore en vie à chaque heure enregistrée. Dans ce cas, la souche atténuée présentait un retard évident dans le meurtre d'insectes, la souche de type sauvage tué toutes les larves de 6 dans les 30 heures après l'injection, avant la mort d'une larve infectée par le mutant.
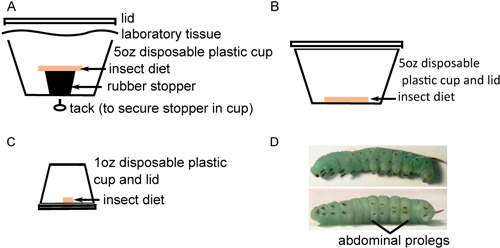
Figure 1. Élevage d'insectes en préparation pour injection. A) environ 40 oeufs stérilisés en surface sont placés au fond d'une tasse de 5 ozalimentation insecte stérile reposant sur un bouchon en caoutchouc. B) Vingt insectes nouvellement éclos sont transférés à 5 tasses oz avec un régime alimentaire insecte stérile sur le fond et incubées pendant 2 jours. C) Les insectes sont ensuite transférés individuellement dans un once tasses avec alimentation stérile sur le fond et incubés jusqu'à leur échéance. D) Quatrième stade M. larves sexta avec des rayures importantes le long du corps (en haut) et crochets noirs sur les fausses pattes abdominales (en bas).
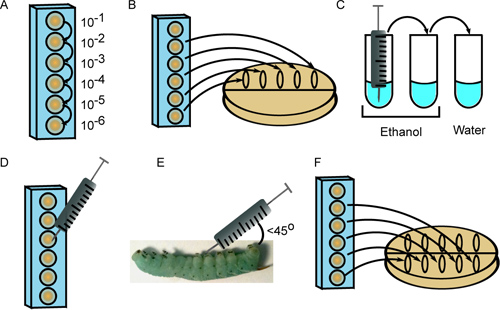
Figure 2. Injection de 4 e stade larvaire M. larves sexta. A) Les bactéries sont diluées en série dans une plaque de 96 puits. B) Dix microlitres de dilutions multiples sont plaquées à dénombrer l'inoculum. C) La seringue est stérilisé par 3 rinçages dans de l'éthanol (2x) et de l'eau stérile. D) Dix microlitres de la dilution appropriée sont aspiré dans la seringue. E) La suspension de cellules est injecté à 45 °angle derrière le premier proleg abdominale. F) Les dilutions sont étalés à nouveau à fournir une deuxième mesure de l'inoculum.
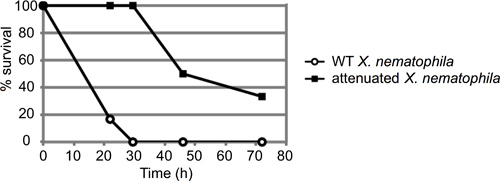
Figure 3. Résultat Représentant de M. test d'injection sexta. Environ 50 unités formant colonie (UFC) de cellules nematophila Xenorhabdus en phase stationnaire (10 ul de la dilution 10 -4) ont été injectés en six 4 e stade larvaire M. sexta larves par souche. À la fois de type sauvage et une souche mutante (PLT) avec un défaut de virulence ont été injectés et mis en place les insectes pour surveiller la mortalité au fil du temps. Les résultats sont présentés en tant que survivant insectes pour cent au cours du temps (en heures). Ces courbes sont statistiquement distincts, avec une p-value de 0.000458 via l'analyse log-rank.
Discussion
L'injection directe de M. larves avec des bactéries entomopathogènes sexta, comme décrit ici, sert comme un moyen simple et efficace pour analyser la virulence bactérienne. La méthode est également très adaptable à différents sujets de l'expérience et / ou des conditions. Les bactéries peuvent être préparés de diverses façons avant l'injection. Dans le cas de X. nematophila, les cellules de type sauvage cultivées dans riche en nutriments Luria-Bertani (LB) à la mi-phase logarithmique sont généralement les plus virulente, tuant la plupart ou tous les insectes dans les 30 heures après l'injection. Les cellules en phase stationnaire prennent souvent plus de temps à 10.05 h tuer les larves. Si la phase de croissance des répercussions virulence, le nombre total de cellules injectées semble moins importante 16, avec des inoculums typique allant de 20 à 20.000 UFC. En fait, dans le cas de Xenorhabdus et des espèces Photorhabdus, aussi peu que 5 UFC sont suffisantes pour tuer l'insecte hôte 17. Afin d'évaluer la virulence propeles parties prenantes d'espèces bactériennes résistantes à la stérilisation éthanol (espèces de Bacillus, par exemple), des aiguilles jetables peuvent être utilisés pour injecter chaque souche unique à la place de l'éthanol stérilisation (étape 3,4).
D'autres ajustements à cette méthode peut entraîner des changements dans l'élevage et / ou la manipulation de M. sexta. Par exemple, les insectes peuvent être élevés sur les feuilles de tomate ou le tabac comme source de nourriture plus naturelle. Alternativement, les différents stades de développement de M. larves sexta peuvent être dosés par cette méthode. Quatrième stade larvaire ont été choisis en fonction de leur taille relativement importante, mais les petites larves peuvent aussi être injectés par cette méthode. Cinquième stade larvaire peut être injectée, mais les modifications apportées au système immunitaire au cours de cette étape de l'élaboration de rendre la fin de 5 e stade larvaire plus sensibles que les premières larves 5 e 18, potentiellement compliquer l'analyse des données.
Enfin, l'injection directeprocédé peut être adapté pour être utilisé avec d'autres espèces d'insectes. M. sexta est utilisé comme hôte modèle pour les espèces hautement pathogènes, car il est moins sensible à l'infection que d'autres organismes modèles (plus sensible), tels que Galleria mellonella. G. mellonella peut être injecté par la méthode décrite dans ce travail 19, cependant, et peut être utile à des espèces bactériennes dosage moins virulentes que Xenorhabdus et des espèces Photorhabdus.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier les anciens membres du laboratoire de Goodrich-Blair: Samantha Orchard, Kimberly Cowles, Erin Herbert-Tran, Greg Richards, Megan Menard, et Youngjin parc pour leurs contributions à l'élaboration de ce protocole. Ce travail a été financé par la National Science Foundation subvention IOS-0950873 et le National Institutes of Health NRSA FAI084441Z bourse.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Entreprise | Numéro de catalogue | Commentaires |
| 90 Papier filtre mm | Whatman | 1001 090 | |
| Porte-filtre en verre | Millipore | XX1004700 | |
| Manduca sexta oeufs | Caroline biologique Alimentation | 143880 | |
| Diet spongieuse + agar | MP Biomédical | 0296029301 | |
| 5,5 oz contenants et couvercles de plastique | Solo Cup Company | URC55-0090-0090 PL4 | |
| 1 oz contenants et couvercles de plastique | DART Container Corporation | 100PC 100PCL25 | |
| 1x PBS | 137 mm de NaCl, 2,7 mM de KCl, 8 mM Na 2 HPO 4, 1,46 mM KH 2 PO 4, pH 7,4 | ||
| Seringue | Hamilton | 80208 | Calibre 30, 0,375 "style de point de longueur, 2 |
Références
- Bintrim, S. B., Ensign, J. C. Insertional inactivation of genes encoding the crystalline inclusion proteins of Photorhabdus luminescens results in mutants with pleiotropic phenotypes. J. Bacteriol. 180, 1261-1269 (1998).
- Schesser, J. H., Kramer, K. J., Bulla, L. A. Bioassay for homogeneous parasporal crystal of Bacillus thuringiensis using the tobacco hornworm, Manduca sexta. Appl. Environ. Microbiol. 33, 878-880 (1977).
- Péchy-Tarr, M., Bruck, D. J., Maurhofer, M., Fischer, E., Vogne, C., Henkels, M. D., Donahue, K. M., Grunder, J., Loper, J. E., Keel, C. Molecular analysis of a novel gene cluster encoding an insect toxin in plant-associated strains of Pseudomonas fluorescens. Environ. Microbiol. 10, 2368-2386 (2008).
- Nuñez-Valdez, M. E., Calderón, M. A., Aranda, E., Hernández, L., Ramírez-Gama, R. M., Lina, L., Rodríguez-Segura, Z., Gutiérrez Mdel, C., Villalobos, F. J. Identification of a putative Mexican strain of Serratia entomophila pathogenic against root-damaging larvae of Scarabaeidae (Coleoptera). Appl. Environ. Microbiol. 74, 802-810 (2008).
- Forst, S. A., Tabatabai, N. Role of the histidine kinase, EnvZ, in the production of outer membrane proteins in the symbiotic-pathogenic bacterium Xenorhabdus nematophilus. Appl. Environ. Microbiol. 63, 962-968 (1997).
- Kanost, M. R., Jiang, H., Yu, X. Q. Innate immune responses of a lepidopteran insect, Manduca sexta. Immunol. Rev. 198, 97-105 (2004).
- Yu, X. Q., Zhu, Y. F., Ma, C., Fabrick, J. A., Kanost, M. R. Pattern recognition proteins in Manduca sexta plasma. Insect Biochem. Mol. Biol. 32, 1287-1293 (2002).
- Eleftherianos, I., ffrench-Constant, R. H., Clarke, D. J., Dowling, A. J., Reynolds, S. E. Dissecting the immune response to the entomopathogen Photorhabdus. Trends Microbiol. 18, 552-560 (2010).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- D'Argenio, D. A., Gallagher, L. A., Berg, C. A., Manoil, C. Drosophila as a model host for Pseudomonas aeruginosa Infection. J. Bacteriol. 183, 1466-1471 (2001).
- Waterfield, N., Dowling, A., Sharma, S., Daborn, P. J., Potter, U., Ffrench-Constant, R. H. Oral toxicity of Photorhabdus luminescens W14 toxin complexes in Escherichia coli. Appl. Environ. Microbiol. 67, 5017-5024 (2001).
- Park, Y., Herbert, E. E., Cowles, C. E., Cowles, K. N., Menard, M. L., Orchard, S. S., Goodrich-Blair, H. Clonal variation in Xenorhabdus nematophila virulence and suppression of Manduca sexta immunity. Cell. Microbiol. 9, 645-656 (2007).
- Park, Y., Kim, Y., Putnam, S. M., Stanley, D. W. The bacterium Xenorhabdus nematophilus depresses nodulation reactions to infection by inhibiting eicosanoid biosynthesis in tobacco hornworms, Manduca sexta. Arch. Insect Biochem. Physiol. 52, 71-80 (2003).
- Cowles, K. N., Cowles, C. E., Richards, G. R., Martens, E. C., Goodrich-Blair, H. The global regulator Lrp contributes to mutualism, pathogenesis and phenotypic variation in the bacterium Xenorhabdus nematophila. Cell. Microbiol. 9, 1311-1323 (2007).
- Cowles, K. N., Goodrich-Blair, H. Expression and activity of a Xenorhabdus nematophila haemolysin required for full virulence towards Manduca sexta insects. Cell. Microbiol. 7, 209-219 (2005).
- Goodrich-Blair, H., Clarke, D. J. Mutualism and pathogenesis in Xenorhabdus and Photorhabdus: two roads to the same destination. Mol. Microbiol. 64, 260-268 (2007).
- Eleftherianos, I., Baldwin, H., ffrench-Constant, R. H., Reynolds, S. E. Developmental modulation of immunity: changes within the feeding period of the fifth larval stage in the defence reactions of Manduca sexta to infection by Photorhabdus. J. Insect Physiol. 54, 309-318 (2008).
- Kavanagh, K., Reeves, E. P. Exploiting the potential of insects for in vivo pathogenicity testing of microbial pathogens. FEMS Microbiol. Rev. 28, 101-112 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon