Method Article
Aufzucht und Injektion von
In diesem Artikel
Zusammenfassung
Die hier beschriebene Methode nutzt Direkteinspritzung entomopathogener Bakterien in die Hämocoel der Manduca sexta Insektenlarven. M. sexta Ist ein im Handel erhältlich und gut untersuchten Insekten. Somit stellt diese Methode einen einfachen Ansatz zur Analyse Host-bakterielle Wechselwirkungen aus der Perspektive eines oder beider Partner.
Zusammenfassung
Manduca sexta, die gemeinhin als Tabakschwärmer bekannt ist, wird als wichtiger landwirtschaftlicher Schädling, Fütterung auf Solanaceen einschließlich Tabak und Tomaten. Die Anfälligkeit von M. sexta-Larven zu einer Vielzahl von entomopathogenen Bakterienarten 1-5, sowie die Fülle von Informationen über das Insekt, das Immunsystem 6-8, und die anstehende Genomsequenz 9 machen es zu einem guten Modell für den Einsatz in Studium Host-Mikroben-Interaktionen während der Pathogenese. Außerdem M. sexta-Larven sind relativ groß und leicht zu manipulieren und im Labor im Vergleich zu anderen anfälligen Insektenarten halten. Ihre Größe erleichtert auch effizient Gewebe / Hämolymphe Extraktion zur Analyse des Wirts auf eine Infektion.
Die hier vorgestellte Methode beschreibt die direkte Injektion von Bakterien in die Hämocoel (Blut Hohlraum) M. sexta Larven. Dieser Ansatzkann verwendet werden, um zu analysieren und vergleichen die Virulenz Eigenschaften verschiedener Bakterienarten, Stämme oder Mutanten durch einfaches Überwachen der Zeit, um Insekten Tod nach der Injektion werden. Dieses Verfahren wurde entwickelt, um die Pathogenität von Xenorhabdus und Photorhabdus Spezies, denen in der Regel mit Nematoden-Vektoren als Mittel zum Eintrag in das Insekt gewinnen studieren. Entomopathogene Nematoden Regel infizieren Larven über natürliche Verdauungs-oder Atemöffnungen, und lassen ihre symbiotische Bakterien Inhalte in das Insekt Hämolymphe (Blut) kurz danach 10. Die Injektion hier beschriebene Verfahren umgeht den Bedarf an einem Nematoden-Vektor, wodurch Entkopplung der Wirkungen der Bakterien und Nematoden auf das Insekt. Dieses Verfahren ermöglicht eine genaue Zählung von infektiösem Material (Zellen oder Protein) innerhalb des Inokulums, was nicht möglich ist mit anderen bestehenden Methoden zur Analyse entomopathogenesis einschließlich Nicking 11 und 12 orale Toxizität Assays Die Nützlichkeit der Direkteinspritzung Verfahren wie hier beschrieben ist, um bakterielle Pathogenese durch Überwachen Insektenmortalität analysieren. Jedoch kann dieses Verfahren leicht für die Verwendung bei der Untersuchung der Auswirkungen der Infektion auf der M. erweiterbar sexta Immunsystems. Das Insekt reagiert auf eine Infektion über beide humorale und zelluläre Reaktionen. Die humorale Antwort enthält Erkennung von bakterieller-assoziiertes Muster und die anschließende Herstellung von verschiedenen antimikrobiellen Peptiden 7; die Expression von Genen, die diese Peptide können überwacht anschließende direkte Infektion durch RNA-Extraktion und quantitative PCR 13 werden. Die zelluläre Reaktion auf eine Infektion beinhaltet Nodulation, Kapselung und Phagozytose von Erregern durch Hämocyten 6 13, 14.
Protokoll
Ein. Insect Egg Sterilisation und Aufzucht
- Bereiten Ernährung durch erste Autoklavieren 15 g der bereitgestellten Agar in 900-1.000 ml H 2 O. Unmittelbar nach dem Autoklavieren Mischung mit 166 g Weizenkeime Ernährung und Mischung gut in einem Labor Mixer. Gießen Sie in einer Schüssel (oder Geschirr) zu kühlen, dann Transfer Ernährung auf eine Aluminiumfolie, fest wickeln, und bei 4 ° C.
- Nach der Ankunft, sterilisieren M. sexta Eier mit 250 ml von 0,6% Bleichlösung für 2-3 min in einem Glas Filterhalter und Thermoskanne, die mit einer 90 mm Filterpapier, dabei gelegentlich umrühren.
- Schalten im Vakuum bis Bleichlösung und waschen Eier 3-4 mal mit 250 ml sterilem destilliertem H 2 O pro Waschgang abtropfen lassen.
- Übertragen Eier an die frische 90 mm Filterpapier in einer Petrischale Deckel gelegt und trocknen lassen, bis sie nicht mehr verkleben (ca. 20-30 min).
- Übertragen Eier an der Unterseite des Kunststoff-Behälter mit Insekt Diät, dem Einbringen von etwa 40 Eiern in jedem Behälter(Abbildung 1A). Die Eier werden aus der Nahrung getrennt, um Feuchte-Pilzbefall zu verhindern. Pflegen Sie Eier bei 26 ° C mit einem 16 Stunden Licht: 8 Std. dunklen Photoperiode. Eier werden zu einem gelb-weißer Farbe vor aufzuhellen bis zum Schlüpfen.
- Wenn Schlupf abgeschlossen ist, transferieren es vorsichtig in etwa 25 Larven jeden neuen Container mit einer Diät auf der Unterseite (Abbildung 1B). Es ist wichtig zu holen jede Larve durch den langen schwarzen Horn mit einer Pinzette zu schaden sie während ihrer fragilen frühen Entwicklungsstadien. Inkubieren für 2 Tage wie oben. Während zum Tod der Larve ist in diesem Stadium ungewöhnlich ist, kann einige tot oder, noch wahrscheinlicher, entwicklungspolitisch verkümmerte Larven beobachtet werden. Solche Insekten von der weiteren Untersuchung ausgeschlossen werden und opferte durch Einfrieren.
- Um kannibalischen Verhaltensweisen, Transfer Larven einzelnen Behältern mit kleinen Stücken von Lebensmitteln (1C) zu vermeiden und inkubieren wie oben. Überwachen Insekten Entwicklung, ou ersetzen Lebensmittel-und Reinigungsmittel Kott von Containern jeden zweiten Tag, bis sie das dritte Larvenstadium häuten (in der Regel 6-9 Tage nach dem Schlüpfen) unterziehen. Dies ist die 4. Larvenstadium Larvenstadium, gekennzeichnet durch das Auftreten von schwarzen hakenartigen crochets auf jeder Proleg und erhöhte Bedeutung von Streifen entlang der Insektenkörper (1D). Die Larven können erheblich variieren in der Größe, aber wiegen in der Regel 0,15 bis 0,4 g beim Betreten des 4. Larvenstadium Bühne. Larven von ähnlicher Größe sollte zur Injektion gewählt werden.
2. Vorbereitung der Bakterien zur Injektion
- Wachsen die Bakterienstamm (en) gemäß den Standardverfahren der Wachstumsphase Sie testen möchten getestet werden.
- Pellet 500 ul jeder Bakterienstamm durch Spinnen für 2 min in einer Mikrozentrifuge bei 13.000 rpm bei Raumtemperatur getestet.
- Die Zellen in 1 ml sterilem 1x phosphatgepufferter Kochsalzlösung (PBS) und Pellet erneut wie oben.
- Die Zellen in 0,5 ml sterile 1x PBS und meadass die optische Dichte (OD) der Suspension. Verdünnte Suspensionen alle auf den gleichen Außendurchmesser, falls notwendig. Steriler Nährmedien können auch zur Resuspension und Verdünnung Zelle anstelle von 1x PBS verwendet werden, falls gewünscht.
3. Injektion von 4 th Larvenstadium
- Planen seriell 10-fach-Verdünnungen des ersten Bakterienstamm in 6 Vertiefungen einer 96-Well-Mikrotiterplatte in sterilem PBS 1x, unter Verwendung einer frischen Pipettenspitze für jede Verdünnung (Abbildung 2A). Das Endvolumen der Zellsuspension in jede Vertiefung überschreiten sollte das Volumen für die Injektion (10 ul pro Insekt) plus 20 ul der Platte das Inokulum (siehe Schritte 3.2 und 3.7) erforderlich.
- Spot 10 ul jeweils für 5 Verdünnungen (10 -2 bis 10 -6) entlang der Oberseite einer Petrischale enthält einen geeigneten Wachstumsmedium. Schwenk die Platte, so dass die Flecken auf den Mittelpunkt (2B) zu verbreiten.
- Entfernen Insektennahrung und Kot und Ort Insekten in Containern auf Eisca. 5 min.
- Sterilisieren die Nadel der Spritze durch Spülen jeweils 3 Mal in 2 Röhren von 70-100% Ethanol, gefolgt von einem Rohr aus sterilem H 2 O (Abbildung 2C). Das Volumen der Flüssigkeit muss ausreichend sein, um die Nadel eintauchen.
- Quantifizierung der verdünnten Zellsuspensionen unter einem Mikroskop mit einer Zählkammer. Je nach gewünschter Inokulum, zeichnen 10 ul aus der entsprechenden Mikrotiterplatte (2D).
- Tupfer das Insekt Oberfläche mit 95% Ethanol und 10 ml injizieren die Zellsuspension in das Insekt in einem Winkel (kleiner 45 °) hinter der einen der abdominalen prolegs. Achten Sie darauf, nicht zu durchstechen den Darm und injizieren die Inhalte direkt unter der Epidermis (Abb. 2E). Während einige Verlust von Hämolymphe (klar, grün-blaue Flüssigkeit) normal ist, sind Feinstaub und gelbe Flüssigkeit, die aus der Injektionsstelle indikativ für gut Punktion. Wenn dies geschieht, zu opfern das Insekt und eine neue Larve wiederplatzieren Sie es.
- Wiederholen Sie Schritt 3,6 für jede weitere Insekt in der ersten Injektion Gruppe. Needle Sterilisation ist nicht notwendig, zwischen den einzelnen Insekt mit der gleichen Verdünnung und Bakterienstamm injiziert, wenn Verunreinigungen auftreten. Alternativ kann ein Repetierpipette für größere Kohärenz Injektionsvolumen zwischen den Proben verwendet werden.
- Nach der Injektion jeder Insekt mit dem ersten Bakterienstamm, Schritt 3.2, diesmal Spotting Zellsuspensionen in der Mitte der Platte und ließ sie Strömung in Richtung des Bodens (2F). Inkubieren Platten bei entsprechender Temperatur und zählen Kolonien, um das Inokulum aufzuzählen. Diese zweite Plattierungsschritt verwendet, um zu überprüfen, dass die Proben nicht während des Einspritzvorgangs kontaminiert, wie dies in unterschiedlichen Kolonie Zahlen zwischen der ersten und zweiten Beschichtungen führen würde.
- Die Schritte 3.1 bis 3.8 für jeden Bakterienstamm im Experiment. Schließlich injizieren 3-5 Insekten mit sterilen 1x PBS mit einem sterile Nadel als negative Kontrollgruppe. Inkubieren Insekten bei 26 ° C mit einem 16 Stunden Licht: 8 Std. dunklen Photoperiode.
- Überwachen Insekten das Überleben im Laufe der Zeit nach der Injektion. Insect Tod wird als ein Mangel an freiwilligen Bewegung nach Stimulation aus. Insekten weisen oft Appetitlosigkeit, Durchfall (wässrig, gelb Kot), und / oder Wasser Verlust ("Schwitzen") während der Infektion vor dem Tod; diese Eigenschaften können erwähnenswert als gut.
Ergebnisse
Ein repräsentatives Beispiel eines Insektenmortalität Assay ist in Abbildung 3 dargestellt. In diesem Experiment wurden die Insekten mit etwa 50 Kolonie-bildenden Einheiten (CFU) von entweder Wildtyp (ATCC19061) oder eines abgeschwächten Mutantenstamm (lrp 13) von Xenorhabdus nematophila gezüchtet bis zur mittleren logarithmischen Phase (n = 6 Tieren pro Stamm) injiziert. Insekten wurden für ungefähr 72 h beobachtet und die Prozent der injizierten Insekten noch am Leben zu jedem Zeitpunkt aufgezeichnet. In diesem Fall zeigte die abgeschwächten Stamm eine deutliche Verzögerung in Insektenzellen Tötung, die Wildtyp-Stamm getötet Alle 6 Larven innerhalb von 30 Stunden nach der Injektion vor dem Tod eines Mutanten-infizierten Larve.
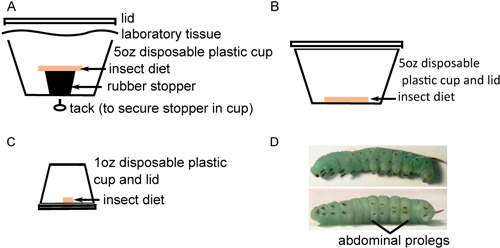
Abbildung 1. Insect Aufzucht in Vorbereitung zur Injektion. A) Über 40 oberflächensterilisiert Eier an der Unterseite eines 5 Unzen-Becher mit platziertsterile Insektennahrung ruht auf einem Gummistopfen. B) Zwanzig frisch geschlüpften Insekten zu 5 Unzen Tassen mit sterilen Insekten Diät auf der Unterseite überführt und für 2 Tage. C) Insekten sind neben individuell auf 1 Unze Becher mit sterilen Ernährung auf den Boden übertragen und inkubiert, bis sie reifen. D) Viertes Larvenstadium M. sexta-Larven mit prominenten Streifen entlang des Körpers (oben) und schwarz crochets auf den Bauch prolegs (unten).
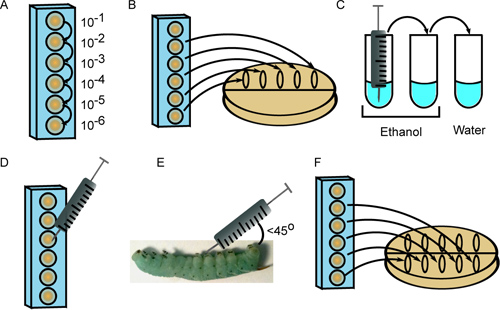
Abbildung 2. Injektion von 4 th instar M. sexta Larven. A) Bakterien werden seriell in einer 96-Well-Platte verdünnt. B) Zehn Mikroliter von mehreren Verdünnungen ausplattiert, um das Inokulum aufzuzählen. C) Die Spritze ist mit drei Spülungen in Ethanol (2x) und steriles Wasser sterilisiert. D) Zehn Mikroliter aus der entsprechenden Verdünnung in die Spritze aufgezogen. E) Die Zellsuspension wird in einem 45 ° eingespritztWinkel hinter dem ersten Bauch Proleg. F) Verdünnungen werden erneut ausplattiert, um ein zweites Maß für die Inokulum bereitzustellen.
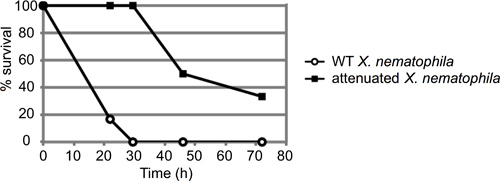
Abbildung 3. Repräsentatives Ergebnis von M. sexta Injektion Assay. Etwa 50 Kolonie-bildenden Einheiten (CFU) von Xenorhabdus nematophila Zellen in der stationären Phase (10 ul von dem 10 -4-Verdünnung) wurden in sechs 4. Larvenstadium M. eingespritzt sexta-Larven pro Stamm. Sowohl Wildtyp und Mutante (LRP) mit einem etablierten Virulenz Defekt injiziert wurden und die Insekten beobachtet für die Mortalität im Laufe der Zeit. Die Ergebnisse werden als Prozent überlebenden Insekten im Laufe der Zeit (in Stunden) berichtet. Diese Kurven sind statistisch deutlich, mit einem p-Wert von 0.000458 via Log-Rank-Analyse.
Diskussion
Die direkte Injektion von M. sexta Larven mit entomopathogene Bakterien, wie hier beschrieben, dient als einfaches und wirksames Mittel, um bakteriellen Virulenz analysieren. Das Verfahren ist auch sehr anpassungsfähig an unterschiedliche Versuchspersonen und / oder Bedingungen anzupassen. Bakterien können auf verschiedene Weise vor der Injektion hergestellt werden. Im Fall von X. nematophila sind Wildtyp-Zellen in nährstoffreichen Luria-Bertani (LB)-Medium bis zur mittleren logarithmischen Phase gezüchtet in der Regel die meisten virulent, töten die meisten oder alle Insekten innerhalb von 30 Stunden im Anschluss an Injektion. Zellen in der stationären Phase oft 5-10 h länger, um die Larven zu töten. Obwohl Wachstumsphase auswirkt Virulenz, wird die Gesamtzahl von Zellen injiziert weniger wichtig zu sein 16, mit typischen Inocula im Bereich von 20 bis 20.000 CFU. In der Tat, im Falle von Xenorhabdus und Photorhabdus Arten sind so wenig wie 5 CFU ausreichen, um zu töten das Insekt Host 17. Um zu beurteilen, die Virulenz properties von Bakterienarten, die resistent gegen Ethanol Sterilisation (zB Bacillus-Arten), können wegwerfbare Nadeln verwendet, um jeden einzigartigen Stamm anstelle von Ethanol Sterilisation (Schritt 3.4) zu injizieren.
Weitere Anpassungen dieser Methode können die Änderungen in der Aufzucht und / oder Manipulation von M. sexta. Zum Beispiel können Insekten auf Tomaten-oder Tabakblättern als weitere natürliche Nahrungsquelle aufgezogen werden. Alternativ verschiedenen Entwicklungsstadien M. sexta Larven können mit diesem Verfahren getestet werden. Vierten Larvenstadium wurden aufgrund ihrer relativ großen Größe gewählt, aber kleiner Larven können ebenfalls nach dieser Methode injiziert werden. Fünften Larvenstadium kann injiziert werden, aber die Änderungen an das Immunsystem während dieser Stufe der Entwicklung Render späten 5. Larvenstadium anfälliger als frühe 5. Larvenstadium 18, potentiell komplizieren Datenanalyse.
Schließlich ist die direkte InjektionVerfahren kann für die Verwendung mit anderen Insektenarten angepasst werden. M. sexta als Modell Gastgeber für hoch pathogene Arten verwendet, weil es weniger anfällig für Infektionen als andere (anfälliger) Modell-Organismen, wie Galleria mellonella ist. G. mellonella kann durch das Verfahren in dieser Arbeit 19 beschrieben, jedoch injiziert werden und kann nützlich sein, um Assay Bakterienspezies weniger virulent als Xenorhabdus und Photorhabdus Spezies.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren möchten letzten Mitglieder der Goodrich-Blair-Labor danken: Samantha Orchard, Kimberly Cowles, Erin Herbert-Tran, Greg Richards, Megan Menard und Youngjin Park für ihre Beiträge zur Entwicklung dieses Protokolls. Diese Arbeit wurde von der National Science Foundation IOS-0950873 und der National Institutes of Health NRSA Gemeinschaft FAI084441Z finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Firma | Katalog-Nummer | Kommentare |
| 90 mm Filterpapier | Whatman | 1001 090 | |
| Glass Filterhalter | Millipore | XX1004700 | |
| Motteneier | Carolina Biological Supply | 143880 | |
| Gypsy Moth Diet + Agar | MP Biomedicals | 0296029301 | |
| 5,5 Unzen Kunststoff-Behälter und Deckel | Solo Cup Company | URC55-0090 PL4-0090 | |
| 1 Unze Kunststoff-Behälter und Deckel | DART Container Corporation | 100PC 100PCL25 | |
| 1x PBS | 137 mm NaCl, 2,7 mM KCl, 8 mM Na 2 HPO 4, 1,46 mM KH 2 PO 4, pH 7,4 | ||
| Spritze | Hamilton | 80208 | 30 Gauge, 0,375 "Länge, zeigen style 2 |
Referenzen
- Bintrim, S. B., Ensign, J. C. Insertional inactivation of genes encoding the crystalline inclusion proteins of Photorhabdus luminescens results in mutants with pleiotropic phenotypes. J. Bacteriol. 180, 1261-1269 (1998).
- Schesser, J. H., Kramer, K. J., Bulla, L. A. Bioassay for homogeneous parasporal crystal of Bacillus thuringiensis using the tobacco hornworm, Manduca sexta. Appl. Environ. Microbiol. 33, 878-880 (1977).
- Péchy-Tarr, M., Bruck, D. J., Maurhofer, M., Fischer, E., Vogne, C., Henkels, M. D., Donahue, K. M., Grunder, J., Loper, J. E., Keel, C. Molecular analysis of a novel gene cluster encoding an insect toxin in plant-associated strains of Pseudomonas fluorescens. Environ. Microbiol. 10, 2368-2386 (2008).
- Nuñez-Valdez, M. E., Calderón, M. A., Aranda, E., Hernández, L., Ramírez-Gama, R. M., Lina, L., Rodríguez-Segura, Z., Gutiérrez Mdel, C., Villalobos, F. J. Identification of a putative Mexican strain of Serratia entomophila pathogenic against root-damaging larvae of Scarabaeidae (Coleoptera). Appl. Environ. Microbiol. 74, 802-810 (2008).
- Forst, S. A., Tabatabai, N. Role of the histidine kinase, EnvZ, in the production of outer membrane proteins in the symbiotic-pathogenic bacterium Xenorhabdus nematophilus. Appl. Environ. Microbiol. 63, 962-968 (1997).
- Kanost, M. R., Jiang, H., Yu, X. Q. Innate immune responses of a lepidopteran insect, Manduca sexta. Immunol. Rev. 198, 97-105 (2004).
- Yu, X. Q., Zhu, Y. F., Ma, C., Fabrick, J. A., Kanost, M. R. Pattern recognition proteins in Manduca sexta plasma. Insect Biochem. Mol. Biol. 32, 1287-1293 (2002).
- Eleftherianos, I., ffrench-Constant, R. H., Clarke, D. J., Dowling, A. J., Reynolds, S. E. Dissecting the immune response to the entomopathogen Photorhabdus. Trends Microbiol. 18, 552-560 (2010).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- D'Argenio, D. A., Gallagher, L. A., Berg, C. A., Manoil, C. Drosophila as a model host for Pseudomonas aeruginosa Infection. J. Bacteriol. 183, 1466-1471 (2001).
- Waterfield, N., Dowling, A., Sharma, S., Daborn, P. J., Potter, U., Ffrench-Constant, R. H. Oral toxicity of Photorhabdus luminescens W14 toxin complexes in Escherichia coli. Appl. Environ. Microbiol. 67, 5017-5024 (2001).
- Park, Y., Herbert, E. E., Cowles, C. E., Cowles, K. N., Menard, M. L., Orchard, S. S., Goodrich-Blair, H. Clonal variation in Xenorhabdus nematophila virulence and suppression of Manduca sexta immunity. Cell. Microbiol. 9, 645-656 (2007).
- Park, Y., Kim, Y., Putnam, S. M., Stanley, D. W. The bacterium Xenorhabdus nematophilus depresses nodulation reactions to infection by inhibiting eicosanoid biosynthesis in tobacco hornworms, Manduca sexta. Arch. Insect Biochem. Physiol. 52, 71-80 (2003).
- Cowles, K. N., Cowles, C. E., Richards, G. R., Martens, E. C., Goodrich-Blair, H. The global regulator Lrp contributes to mutualism, pathogenesis and phenotypic variation in the bacterium Xenorhabdus nematophila. Cell. Microbiol. 9, 1311-1323 (2007).
- Cowles, K. N., Goodrich-Blair, H. Expression and activity of a Xenorhabdus nematophila haemolysin required for full virulence towards Manduca sexta insects. Cell. Microbiol. 7, 209-219 (2005).
- Goodrich-Blair, H., Clarke, D. J. Mutualism and pathogenesis in Xenorhabdus and Photorhabdus: two roads to the same destination. Mol. Microbiol. 64, 260-268 (2007).
- Eleftherianos, I., Baldwin, H., ffrench-Constant, R. H., Reynolds, S. E. Developmental modulation of immunity: changes within the feeding period of the fifth larval stage in the defence reactions of Manduca sexta to infection by Photorhabdus. J. Insect Physiol. 54, 309-318 (2008).
- Kavanagh, K., Reeves, E. P. Exploiting the potential of insects for in vivo pathogenicity testing of microbial pathogens. FEMS Microbiol. Rev. 28, 101-112 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten