Method Article
Allevamento e iniezione di
In questo articolo
Riepilogo
Il metodo qui descritto utilizza l'iniezione diretta di batteri entomopatogeni nella hemocoel di Manduca sexta Larve di insetti. M. Sexta È un insetto disponibile in commercio e ben studiata. Quindi, questo metodo rappresenta un approccio semplice per analizzare interazioni host-batteriche dalla prospettiva di uno o entrambi i partner.
Abstract
Manduca sexta, comunemente noto come il hornworm tabacco, è considerato un parassita agricolo significativo, nutrendosi di piante solanacee tra cui tabacco e pomodoro. La suscettibilità di M. larve sexta ad una varietà di specie di batteri entomopatogeni 1-5, così come la ricchezza di informazioni disponibili riguardo al sistema immunitario dell'insetto 6-8, e la sequenza del genoma in attesa di 9 ne fanno un organismo buon modello per l'uso in studio delle interazioni ospite-microbo durante la patogenesi. Inoltre, M. larve sexta sono relativamente grandi e facili da manipolare e mantenere nel relativo laboratorio per altre specie sensibili insetti. Loro grandi dimensioni facilita anche efficiente tessuto / emolinfa estrazione per analisi della risposta dell'ospite all'infezione.
Il metodo qui presentato descrive l'iniezione diretta di batteri nella hemocoel (cavità sangue) di M. Sexta larve. Questo approcciopuò essere utilizzato per analizzare e confrontare le caratteristiche di virulenza di varie specie batteriche, ceppi mutanti, o semplicemente controllare il tempo di morte insetto dopo l'iniezione. Questo metodo è stato sviluppato per studiare la patogenicità di Xenorhabdus e specie Photorhabdus che associano di norma con i vettori di nematodi come mezzo per entrare in l'insetto. Nematodi entomopatogeni in genere infettano le larve tramite digestivo naturale o aperture respiratorie, e di rilasciare il loro contenuto simbiotici batteriche nella emolinfa insetto (sangue) poco dopo 10. Il metodo descritto qui di iniezione evita il bisogno di un vettore nematode, quindi sganciare gli effetti dei batteri e nematodi sul insetto. Questo metodo permette di conteggio accurato del materiale infetto (cellule o proteine) entro l'inoculo, che non è possibile utilizzare altri metodi esistenti per analizzare entomopathogenesis, compresi nick 11 e saggi di tossicità orale 12 L'utilità del metodo di iniezione diretta, come descritto qui è analizzare patogenesi batterica monitorando mortalità insetto. Tuttavia, questo metodo può essere facilmente espanso per uso a studiare gli effetti di infezione sul M. sexta sistema immunitario. L'insetto risponde alle infezioni tramite sia le risposte umorali e cellulari. La risposta umorale comprende il riconoscimento di batteri associati modelli e conseguente produzione di vari peptidi antimicrobici 7, l'espressione di geni che codificano questi peptidi possono essere monitorati dopo infezione diretta tramite estrazione di RNA e PCR quantitativa 13. La risposta cellulare di infezione coinvolge nodulazione, incapsulamento, e fagocitosi di agenti infettivi attraverso emociti 6 13, 14.
Protocollo
1. Uovo Sterilizzazione Insetti e allevamento
- Preparare dieta prima autoclave 15 g di agar fornito in 900-1,000 ml H 2 O. Subito dopo la sterilizzazione in autoclave, mescolare con 166 g di dieta germe di grano e mescolate bene in un frullatore laboratorio. Versare in un piatto (o piatti) per raffreddare, poi il trasferimento dieta per un foglio di alluminio, aderire bene, e conservare a 4 ° C.
- All'arrivo, sterilizzare M. uova Sexta con 250 ml di soluzione di candeggina 0,6% per 2-3 minuti in un supporto di vetro e filtro beuta apparato per il vuoto con carta da filtro di 90 millimetri, mescolando occasionalmente.
- Accendere il vuoto per drenare soluzione di candeggina e lavare le uova 3-4 volte con 250 ml sterile distillata H 2 O per lavaggio.
- Trasferimento uova fresche 90 mm carta filtro posto in un coperchio piastra Petri e consentire loro di asciugare fino a che non sono più stretti stretti (circa 20-30 minuti).
- Trasferire le uova al fondo dei contenitori in plastica con dieta insetto, ponendo circa 40 uova in ciascun contenitore(Figura 1A). Le uova sono separati dalla dieta per evitare che l'umidità indotta contaminazione fungina. Mantenere le uova a 26 ° C con una luce 16 ore: 8 ore fotoperiodo scuro. Uova alleggerirà di un colore giallo-colore bianco prima della schiusa.
- Quando schiusa è completa, trasferire accuratamente circa 25 larve per ciascun nuovi contenitori con dieta sul fondo (Figura 1B). E 'importante prendere ogni larva dal lungo corno nero con pinze per evitare di danneggiare durante i loro fragili prime fasi di sviluppo. Incubare per 2 giorni come sopra. Mentre la morte delle larve è insolito in questa fase, alcuni morti o, più probabilmente, larve evolutivamente stentata si può osservare. Insetti dovrebbero essere esclusi da ulteriori studi e sacrificato per congelamento.
- Per evitare comportamenti cannibali, larve di trasferire in contenitori singoli con piccoli pezzi di cibo (Figura 1C) e incubare come sopra. Monitorare lo sviluppo degli insetti, feci sostituzione cibo e la pulizia out di contenitori a giorni alterni fino a che non subiscono la terza muta larvale (in genere 6-9 giorni dopo la schiusa). Questo è il 4 ° stadio larvale instar, caratterizzata dalla comparsa di nero ganciformi crochets di ciascun risalto proleg e maggiore di strisce lungo il corpo dell'insetto (Figura 1D). Le larve può variare notevolmente in dimensioni, ma di solito pesano 0,15-0,4 g entrando nella fase 4 ° stadio. Le larve di dimensioni simili dovrebbe essere scelto per l'iniezione.
2. Preparazione di batteri per preparazioni iniettabili
- Coltivare il ceppo batterico (s) da sottoporre a prova secondo le procedure standard per la fase di crescita che si desidera verificare.
- Pellet 500 pl di ciascun ceppo batterico da testare per la filatura per 2 minuti in una microcentrifuga a 13.000 rpm a temperatura ambiente.
- Risospendere le cellule in 1 ml di fosfato sterile 1x salina tamponata (PBS) e pellet nuovamente come sopra.
- Risospendere le cellule in 0,5 ml di PBS sterile 1x e misurache la densità ottica (OD) della sospensione. Diluire tutte le sospensioni allo stesso OD, se necessario. Mezzi di crescita sterili possono essere utilizzati anche per la risospensione delle cellule e diluizione in luogo di PBS 1x, se desiderato.
3. Iniezione di larve 4 ° Instar
- Preparare seriali 10-diluizioni del ceppo batterico prima in 6 pozzetti di una piastra a 96 pozzetti per microtitolazione in 1x PBS sterile, utilizzando un puntale per pipetta per ogni diluizione (Figura 2A). Il volume finale della sospensione di cellule in ciascun pozzetto deve superare il volume richiesto per iniezione (10 microlitri per insetti) più 20 microlitri per l'inoculo piastra (vedere i passi 3,2 e 3,7).
- Spot 10 microlitri ciascuna per 5 diluizioni (10 -2 attraverso 10 -6) lungo la parte superiore di una piastra Petri contenente un appropriato mezzo di crescita. La piastra in modo che le macchie diffondersi al centro (Figura 2B).
- Rimuovere dieta insetti e feci e insetti posto in contenitori in ghiaccio percirca 5 min.
- Sterilizzare l'ago della siringa con il risciacquo 3 volte in 2 tubi di 70-100% etanolo, seguito da una provetta sterile di H 2 O (Figura 2C). Il volume di liquido deve essere sufficiente per sommergere l'ago.
- Quantificare le sospensioni di cellule diluite sotto un microscopio con un emocitometro. A seconda della inoculo desiderato, elaborare 10 microlitri dal pozzetto microtitolo (Figura 2D).
- Tampone superficie insetto con etanolo al 95%, e iniettare il 10 ml di sospensione cellulare in insetto con un angolo (inferiore a 45 °) dietro una delle prolegs addominali. Fare attenzione a non forare l'intestino e iniettare il contenuto appena sotto lo strato epidermico (Figura 2E). Mentre una certa perdita di emolinfa (chiaro, verde-blu liquido) è normale, le particelle e il liquido giallo che emerge dal sito di iniezione sono indicativi di foratura budello. Se ciò si verifica, sacrificare l'insetto e ottenere una nuova larva di riposizionarlo.
- Ripetere il punto 3.6 per ogni insetto restante del gruppo prima iniezione. Dell'ago sterilizzazione non è necessario tra ogni insetto iniettato con la stessa diluizione e ceppo di batteri meno contaminazione. In alternativa, un dispensatore può essere utilizzata per maggiore coerenza nel volume di iniezione tra i campioni.
- Dopo aver iniettato ogni insetto con il ceppo di batteri prima, ripetere la fase 3.2, questa volta avvistare sospensioni cellulari nel centro del piatto e facendo loro flusso verso il basso (Figura 2F). Incubare le piastre a temperatura adeguata e contare le colonie per enumerare l'inoculo. Questo passaggio seconda placcatura viene utilizzato per verificare che i campioni non sono stati contaminati durante il processo di iniezione, poiché ciò comporterebbe residenti sono diversi tra placcature primo e secondo.
- Ripetere i passaggi da 3.1 al 3.8 per ogni ceppo di batteri nell'esperimento. Infine, iniettare 3-5 insetti con sterile 1x PBS usando una sterago ile come gruppo di controllo negativo. Insetti incubare a 26 ° C con una luce 16 ore: 8 ore fotoperiodo scuro.
- Monitorare la sopravvivenza degli insetti nel tempo dopo l'iniezione. La morte degli insetti si caratterizza come una mancanza di movimento volontario dopo stimolazione. Insetti spesso mostrano perdita di appetito, diarrea (acquosa, escrementi giallo), e / o perdita di acqua ("sudare") durante l'infezione prima della morte, queste caratteristiche può essere interessante notare come bene.
Risultati
Un esempio rappresentativo di un saggio mortalità insetto è illustrato in Figura 3. In questo esperimento, gli insetti sono stati iniettati con circa 50 unità formanti colonie (CFU) sia di tipo selvatico (ATCC19061) o un ceppo mutante attenuato (LRP 13) di Xenorhabdus nematophila cresciuto a metà fase log (n = 6 insetti per ceppo). Insetti sono stati osservati per circa 72 ore, e la percentuale di insetti iniettati ancora vivi a ciascun timepoint registrata. In questo caso, il ceppo attenuato esibito un ritardo chiara uccisione degli insetti, il ceppo selvatico ucciso tutti 6 larve entro 30 ore dopo l'iniezione, prima della morte di qualunque mutante infetto larva.
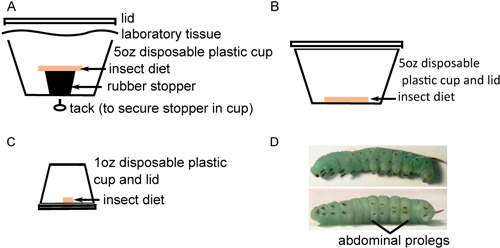
Figura 1. Allevamento Insect in preparazione iniettabile. A) Circa 40 uova sterilizzati in superficie sono posti sul fondo di un bicchiere 5 once condieta insetto sterile riposo su un tappo di gomma. B) Venti insetti appena nati sono trasferiti a 5 tazze oz con dieta insetto sterile sul fondo e incubate per 2 giorni. C) Gli insetti sono accanto trasferiti singolarmente per 1 oz tazze con la dieta sterile sul fondo e incubate fino alla loro scadenza. D) In quarto luogo instar M. larve sexta con strisce di rilievo lungo il corpo (in alto) e uncinetti nere sui prolegs addominali (in basso).
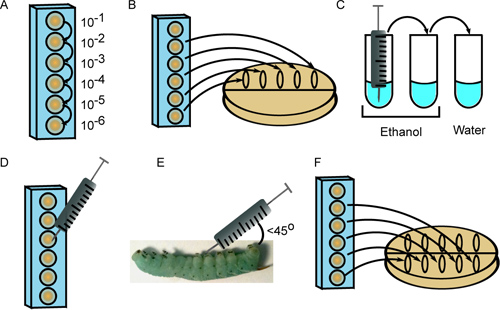
Figura 2. Iniezione di 4 ° instar M. Sexta larve. A) I batteri vengono diluiti serialmente in una piastra a 96 pozzetti. B) Dieci microlitri di diluizioni più sono placcati per enumerare l'inoculo. C) La siringa è sterilizzato con 3 risciacqui in etanolo (2x) e acqua sterile. D) Dieci microlitri della diluizione appropriata sono disegnati nella siringa. E) La sospensione cellulare viene iniettato a 45 °angolo dietro la prima proleg addominale. F) diluizioni vengono piastrate nuovamente per fornire una seconda misura di inoculo.
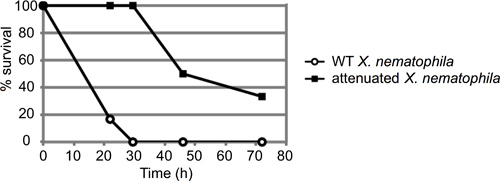
Figura 3. Risultato Rappresentante di M. sexta iniezione test. Circa 50 unità formanti colonie (CFU) di Xenorhabdus nematophila cellule in fase stazionaria (10 microlitri dalla diluizione 10 -4) sono state iniettate in sei 4 ° instar M. sexta larve per ceppo. Sia wild type e di un ceppo mutante (LRP) con un difetto virulenza stabilito sono stati iniettati e gli insetti controllati per la mortalità nel corso del tempo. I risultati sono riportati come percentuale insetti sopravvissuti nel tempo (in ore). Queste curve sono statisticamente distinti, con un p-value di 0.000458 tramite log-rank analisi.
Discussione
L'iniezione diretta di M. larve sexta con batteri entomopatogeni, come descritto qui, serve come un mezzo semplice ed efficace per analizzare la virulenza batterica. Il metodo è anche forte adattabilità a diversi soggetti sperimentali e / o condizioni. I batteri possono essere preparati in diversi modi prima dell'iniezione. Nel caso di X. nematophila, le cellule coltivate in di tipo selvatico ricco di sostanze nutritive Luria-Bertani (LB) medio a metà-log fase sono in genere i più virulento, uccidendo la maggior parte o tutti gli insetti entro 30 ore dopo l'iniezione. Le cellule in fase stazionaria spesso prendono 5-10 ore più tempo per uccidere le larve. Sebbene la fase di crescita impatta virulenza, il numero totale di cellule iniettate appare meno importante 16, con inoculi tipico da 20 a 20.000 CFU. Infatti, nel caso di specie e Xenorhabdus Photorhabdus, anche solo 5 CFU sono sufficienti per uccidere insetti all'host 17. Per valutare la virulenza propeproprietā di specie batteriche che sono resistenti alla sterilizzazione etanolo (ad esempio, specie Bacillus), aghi monouso può essere utilizzato per iniettare ciascun ceppo unico in luogo di sterilizzazione etanolo (punto 3.4).
Ulteriori adeguamenti a questo metodo possono comportare variazioni nelle allevamento e / o manipolazione di M. sexta., ad esempio, gli insetti possono essere allevati su foglie di pomodoro o tabacco come fonte di cibo più naturale. In alternativa, nelle varie fasi di sviluppo di M. sexta larve possono essere dosati con questo metodo. Quarta larve instar sono stati scelti sulla base della loro dimensione relativamente grande, ma più piccola larve possono anche essere iniettato con questo metodo. Quinto larve instar può essere iniettato, però le modifiche al sistema immunitario durante questa fase di sviluppo rendono fine 5 ° larve instar più sensibili i primi di larve instar 5 ° 18, potenzialmente complicare l'analisi dei dati.
Infine, l'iniezione direttametodo può essere adattato per l'uso con altre specie di insetti. M. sexta viene usato come modello per un host specie altamente patogeni perché è meno suscettibile di infezione di altri (più sensibili) organismi modello, come mellonella Galleria. G. mellonella può essere iniettato con il metodo descritto in questo lavoro 19, tuttavia, e può essere utile per le specie batteriche dosaggio meno virulento Xenorhabdus e specie Photorhabdus.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare i membri passati del Goodrich Blair-lab: Samantha Orchard, Kimberly Cowles, Erin Herbert-Tran, Greg Richards, Megan Menard, e Youngjin Parco per il loro contributo allo sviluppo di questo protocollo. Questo lavoro è stato finanziato dalla National Science Foundation concessione IOS-0950873 e il National Institutes of Health NRSA comunione FAI084441Z.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Azienda | Numero di catalogo | Commenti |
| 90 mm Carta filtro | Whatman | 1001 090 | |
| Vetro portafiltri | Millipore | XX1004700 | |
| Manduca sexta uova | Carolina Biological Supply | 143880 | |
| Dieta Gypsy Moth + agar | MP Biomedicals | 0296029301 | |
| 5,5 once contenitori di plastica e coperchi | Solo Cup Società | URC55-0090-0090 PL4 | |
| 1 oncia contenitori di plastica e coperchi | DART Container Corporation | 100PC 100PCL25 | |
| 1x PBS | 137 millimetri NaCl, 2,7 mM KCl, 8 mM Na 2 HPO 4, 1,46 mM KH 2 PO 4, pH 7.4 | ||
| Siringa | Hamilton | 80208 | 30 gauge, 0,375 "lunghezza, stile, punto 2, |
Riferimenti
- Bintrim, S. B., Ensign, J. C. Insertional inactivation of genes encoding the crystalline inclusion proteins of Photorhabdus luminescens results in mutants with pleiotropic phenotypes. J. Bacteriol. 180, 1261-1269 (1998).
- Schesser, J. H., Kramer, K. J., Bulla, L. A. Bioassay for homogeneous parasporal crystal of Bacillus thuringiensis using the tobacco hornworm, Manduca sexta. Appl. Environ. Microbiol. 33, 878-880 (1977).
- Péchy-Tarr, M., Bruck, D. J., Maurhofer, M., Fischer, E., Vogne, C., Henkels, M. D., Donahue, K. M., Grunder, J., Loper, J. E., Keel, C. Molecular analysis of a novel gene cluster encoding an insect toxin in plant-associated strains of Pseudomonas fluorescens. Environ. Microbiol. 10, 2368-2386 (2008).
- Nuñez-Valdez, M. E., Calderón, M. A., Aranda, E., Hernández, L., Ramírez-Gama, R. M., Lina, L., Rodríguez-Segura, Z., Gutiérrez Mdel, C., Villalobos, F. J. Identification of a putative Mexican strain of Serratia entomophila pathogenic against root-damaging larvae of Scarabaeidae (Coleoptera). Appl. Environ. Microbiol. 74, 802-810 (2008).
- Forst, S. A., Tabatabai, N. Role of the histidine kinase, EnvZ, in the production of outer membrane proteins in the symbiotic-pathogenic bacterium Xenorhabdus nematophilus. Appl. Environ. Microbiol. 63, 962-968 (1997).
- Kanost, M. R., Jiang, H., Yu, X. Q. Innate immune responses of a lepidopteran insect, Manduca sexta. Immunol. Rev. 198, 97-105 (2004).
- Yu, X. Q., Zhu, Y. F., Ma, C., Fabrick, J. A., Kanost, M. R. Pattern recognition proteins in Manduca sexta plasma. Insect Biochem. Mol. Biol. 32, 1287-1293 (2002).
- Eleftherianos, I., ffrench-Constant, R. H., Clarke, D. J., Dowling, A. J., Reynolds, S. E. Dissecting the immune response to the entomopathogen Photorhabdus. Trends Microbiol. 18, 552-560 (2010).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- D'Argenio, D. A., Gallagher, L. A., Berg, C. A., Manoil, C. Drosophila as a model host for Pseudomonas aeruginosa Infection. J. Bacteriol. 183, 1466-1471 (2001).
- Waterfield, N., Dowling, A., Sharma, S., Daborn, P. J., Potter, U., Ffrench-Constant, R. H. Oral toxicity of Photorhabdus luminescens W14 toxin complexes in Escherichia coli. Appl. Environ. Microbiol. 67, 5017-5024 (2001).
- Park, Y., Herbert, E. E., Cowles, C. E., Cowles, K. N., Menard, M. L., Orchard, S. S., Goodrich-Blair, H. Clonal variation in Xenorhabdus nematophila virulence and suppression of Manduca sexta immunity. Cell. Microbiol. 9, 645-656 (2007).
- Park, Y., Kim, Y., Putnam, S. M., Stanley, D. W. The bacterium Xenorhabdus nematophilus depresses nodulation reactions to infection by inhibiting eicosanoid biosynthesis in tobacco hornworms, Manduca sexta. Arch. Insect Biochem. Physiol. 52, 71-80 (2003).
- Cowles, K. N., Cowles, C. E., Richards, G. R., Martens, E. C., Goodrich-Blair, H. The global regulator Lrp contributes to mutualism, pathogenesis and phenotypic variation in the bacterium Xenorhabdus nematophila. Cell. Microbiol. 9, 1311-1323 (2007).
- Cowles, K. N., Goodrich-Blair, H. Expression and activity of a Xenorhabdus nematophila haemolysin required for full virulence towards Manduca sexta insects. Cell. Microbiol. 7, 209-219 (2005).
- Goodrich-Blair, H., Clarke, D. J. Mutualism and pathogenesis in Xenorhabdus and Photorhabdus: two roads to the same destination. Mol. Microbiol. 64, 260-268 (2007).
- Eleftherianos, I., Baldwin, H., ffrench-Constant, R. H., Reynolds, S. E. Developmental modulation of immunity: changes within the feeding period of the fifth larval stage in the defence reactions of Manduca sexta to infection by Photorhabdus. J. Insect Physiol. 54, 309-318 (2008).
- Kavanagh, K., Reeves, E. P. Exploiting the potential of insects for in vivo pathogenicity testing of microbial pathogens. FEMS Microbiol. Rev. 28, 101-112 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon