Method Article
Criação e injeção de
Neste Artigo
Resumo
O método descrito aqui utiliza a injecção directa de bactérias entomopatogênicos no hemocelo de Manduca sexta Larvas de insetos. M. sexta É um inseto disponível comercialmente e bem estudado. Assim, este método representa uma abordagem simples para analisar interacções hospedeiro-bacteriana a partir da perspectiva de um ou de ambos os parceiros.
Resumo
Manduca sexta, vulgarmente conhecido como o hornworm tabaco, é considerada uma importante praga agrícola, alimentando-se de plantas solanáceas, incluindo o tabaco e tomate. A susceptibilidade de M. sexta larvas para uma variedade de espécies bacterianas entomopatogênicos 1-5, bem como a riqueza da informação disponível sobre o sistema imunitário do insecto 6-8, e a sequência do genoma pendente 9 torná-lo um organismo modelo bom para ser utilizado no estudo de interacções hospedeiro-microorganismo durante a patogênese. Além disso, M. sexta larvas são relativamente grandes e fáceis de manipular e manter no laboratório relação a outras espécies de insetos suscetíveis. O seu grande tamanho, também facilita a extracção dos tecidos / hemolinfa eficiente para a análise da resposta do hospedeiro à infecção.
O método aqui apresentado descreve a injecção directa de bactérias no hemocelo (cavidade de sangue) de M. larvas sexta. Esta abordagempode ser utilizado para analisar e comparar as características de virulência em várias espécies bacterianas, estirpes ou mutantes, por simplesmente controlar o tempo até à morte de insectos após a injecção. Este método foi desenvolvido para o estudo da patogenicidade de Xenorhabdus Photorhabdus e espécies, que normalmente se associam com os vectores de nematóides como um meio de ganhar a entrada do insecto. Nematóides entomopatogênicos tipicamente infectar larvas através digestivo natural ou aberturas respiratórias, e liberar os seus conteúdos simbióticas bacterianas no inseto hemolinfa (sangue) pouco depois 10. O método de injecção aqui descrito evita a necessidade de um vector nemátodo, assim, desengatar os efeitos das bactérias e nematóides sobre o insecto. Este método permite a enumeração exacta de material infeccioso (células ou proteínas) dentro do inoculo, que não é possível utilizar outros métodos existentes para a análise de entomopathogenesis, incluindo nicking 11 e ensaios de toxicidade oral 12 A utilidade do método de injecção directa, tal como descrito aqui é analisar patogênese bacteriana por monitorização da mortalidade de insectos. No entanto, este método pode ser facilmente expandido para uso no estudo dos efeitos da infecção com o M. sexta sistema imunitário. O insecto responde à infecção por meio de ambas as respostas humoral e celular. A resposta humoral inclui o reconhecimento de bactérias associadas a padrões e subsequente produção de diversos péptidos antimicrobianos 7, a expressão de genes que codificam estes péptidos pode ser monitorizada após a infecção directa através de extração de RNA e PCR quantitativa 13. A resposta celular à infecção envolve nodulação, encapsulamento, e a fagocitose dos agentes infecciosos por hemócitos 6 13, 14.
Protocolo
1. Esterilização ovo do inseto e criação
- Na preparação de dietas, primeiro autoclave 15 g de agar fornecida em 900-1.000 ml de H 2 O. Imediatamente após a mistura em autoclave, com 166 g de dieta de gérmen de trigo e de mistura bem em um misturador de laboratório. Despeje em um prato (ou pratos) para esfriar, em seguida, transferir dieta para folha de alumínio, enrole firmemente, loja e a 4 ° C.
- Após a chegada, esterilizar M. Sexta ovos com 250 ml de solução de lixívia a 0,6% durante 2-3 min em um suporte de filtro de vidro e um aparelho com um frasco de vácuo de papel filtro de 90 milímetros, agitando ocasionalmente.
- Ligue vácuo a drenagem da solução de lixívia de lavagem e ovos 3-4 vezes com 250 ml estéril H2O destilada por lavagem.
- Transferir os ovos para 90 mm de papel de filtro fresco colocado numa placa de Petri tampa e deixe secar até que já não vara juntos (cerca de 20-30 min).
- Transferir os ovos para a parte inferior dos recipientes de plástico com uma dieta de insectos, colocando aproximadamente 40 ovos em cada recipiente(Figura 1A). Os ovos são separados a partir da dieta para prevenir a humidade induzida contaminação fúngica. Manter os ovos, a 26 ° C com uma luz hr 16: 8 horas fotoperíodo escuro. Ovos irá iluminar a uma cor amarelo-branco antes da eclosão.
- Quando incubação estiver completa, transferir cuidadosamente cerca de 25 larvas cada uma para novos recipientes com dieta sobre a parte inferior (Figura 1B). É importante para pegar cada larva pelo chifre longo preto usando uma pinça para evitar prejudicá-los durante suas frágeis primeiras fases de desenvolvimento. Incubar durante 2 dias, como anteriormente. Embora a morte larval é incomum nesta fase, alguns mortos ou, mais provavelmente, larvas developmentally atrofiado pode ser observado. Tais insectos devem ser excluídos do estudo e sacrificados por congelamento.
- Para evitar os comportamentos de canibalismo, larvas de transferência para recipientes individuais, com pequenos pedaços de comida (Figura 1C) e incubar como acima. Acompanhar o desenvolvimento do inseto, fezes substituindo alimentos e limpeza UOt de embalagens de todos os dias até que eles sofrem a muda larval terceiro (geralmente 6-9 dias após a eclosão). Esta é a 4 º instar larval, caracterizada pelo aparecimento de preto do gancho como crochets em cada proeminência proleg e aumento de listras ao longo do corpo de insectos (Figura 1D). As larvas podem variar consideravelmente de tamanho, mas normalmente pesam 0,15-,4 g ao entrar na 4 ª etapa estádio. Larvas de tamanho similar deve ser escolhido para injecção.
2. Preparação de bactérias para Injeção
- Crescer a estirpe bacteriana (s) a ser testado de acordo com os procedimentos padrão para a fase de crescimento que pretende testar.
- Pellet ul 500 de cada estirpe bacteriana a ser testado por fiação durante 2 min numa microcentrífuga a 13.000 rpm, à temperatura ambiente.
- Ressuspender as células em 1 ml de fosfato salino tamponado estéril 1x (PBS) e de pelotas de novo como acima.
- Ressuspender as células em 0,5 ml de 1x PBS estéril e meacerteza a densidade óptica (DO) da suspensão. Diluir todas as suspensões para o mesmo diâmetro externo, se necessário. Meio de crescimento estéril pode também ser utilizado para a ressuspensão das células e diluição em lugar de 1x PBS, se desejado.
3. Injeção de 4 larvas ínstares
- Prepare seriais diluições de 10 vezes da primeira estirpe bacteriana em 6 poços de uma placa de microtitulação de 96 poços em PBS 1x estéril, utilizando-se uma ponta de pipeta nova para cada diluição (Figura 2A). O volume final da suspensão de células em cada poço deve exceder o volume necessário para a injecção (10 ul por insectos) mais 20 uL para a placa de inoculo (ver passos 3.2 e 3.7).
- Ul 10 cada ponto durante 5 diluições (10 ~ 2 a 10 -6) ao longo do topo de uma placa de Petri contendo um meio de crescimento adequado. Inclinar a placa, de modo que os pontos se espalhar para o centro (Figura 2B).
- Remover dieta de insetos e fezes e insetos lugar em recipientes com gelo paracerca de 5 min.
- Esterilizar a agulha da seringa, por lavagem 3 vezes cada em 2 tubos de etanol 70-100%, seguido de um tubo estéril de H 2 O (Figura 2C). O volume do líquido deve ser suficiente para submergir a agulha.
- Quantificar as suspensões de células diluídas sob um microscópio usando um hemocitómetro. Dependendo do inoculo desejado, extrair 10 ul do microtitulação bem apropriado (Figura 2D).
- Cotonete superfície do insecto com etanol a 95%, e injectar a 10 ml de suspensão celular para o insecto a um ângulo (inferior a 45 °) para trás a uma das patas falsas abdominais. Tome cuidado para não perfurar o intestino e injetar o conteúdo logo abaixo da camada epidérmica (Figura 2E). Embora alguma perda de hemolinfa (líquido límpido, verde, azul) é normal, as partículas eo líquido amarelo que emerge do local de injecção são indicativos de punção do intestino. Se isso ocorrer, sacrificar o insecto e obter um novo larva de recolocá-lo.
- Repetir o passo 3.6 para cada insecto remanescente no grupo da primeira injecção. Agulha de esterilização não é necessária entre cada insecto injectado com a mesma diluição e estirpe de bactérias a menos que a contaminação ocorre. Alternativamente, um dispensador de repetição podem ser usados para uma maior consistência no volume de injecção, entre as amostras.
- Após a injecção de cada insecto com a primeira linhagem de bactérias, repita a etapa 3.2, desta vez manchar as suspensões de células no meio do prato e deixá-los fluir para a parte inferior (Figura 2F). Incubar as placas a temperatura adequada e contar colônias para enumerar o inóculo. Esta etapa de revestimento segundo é usado para verificar que as amostras não foram contaminadas durante o processo de injecção, uma vez que tal resultará em números de colónias diferentes entre os primeiro e segundo revestimentos.
- Repita os passos 3.1 a 3.8 para cada estirpe de bactérias no experimento. Finalmente, injetar 3-5 com insetos estéreis 1x PBS usando uma sterile agulha como grupo controle negativo. Incubar os insectos a 26 ° C com uma luz hr 16: 8 hr fotoperíodo escuro.
- Monitorar sobrevivência do inseto ao longo do tempo após a injeção. Morte de insectos é caracterizada como uma falta de movimento voluntário após estimulação. Insetos freqüentemente apresentam perda de apetite, diarreia (fezes, aguado amarelo), e / ou perda de água ("suor") durante a infecção antes da morte; essas características pode-se notar também.
Resultados
Um exemplo representativo de um ensaio de mortalidade dos insectos é descrito na Figura 3. Nesta experiência, os insectos foram injectados com cerca de 50 unidades formadoras de colónias (CFU) de um ou outro tipo selvagem (ATCC19061) ou uma estirpe mutante atenuada (lrp 13) de Xenorhabdus nematophila crescido a fase mid-log (n = 6 por insectos estirpe). As larvas foram observadas para, aproximadamente, 72 horas, e a percentagem de insectos vivos injectados em cada instante de tempo gravado. Nesse caso, a estirpe atenuada exibiu um atraso na morte clara de insectos, a estirpe de tipo selvagem matou todas as larvas no prazo de 6 30 horas pós-injecção, antes da morte de qualquer larva mutante infectado.
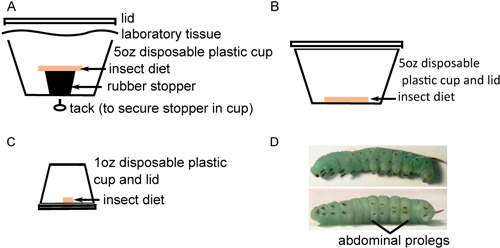
Figura 1. Insect criação, em preparação para a injecção. A) Cerca de 40 ovos de superfície-esterilizados são colocados no fundo de um copo com 5 ozdieta do inseto estéril descansando em uma rolha de borracha. B) Vinte insectos recém-nascidos são transferidas para copos de 5 onças com uma dieta de insectos estéreis sobre a parte inferior e incubadas durante 2 dias. C) Os insetos são transferidos individualmente próxima a 1 oz copos com dieta estéril no fundo e incubados até que amadureçam. D) quarto estádio de M. sexta larvas com listras proeminentes ao longo do corpo (acima) e crochês pretas nas patas falsas abdominais (baixo).
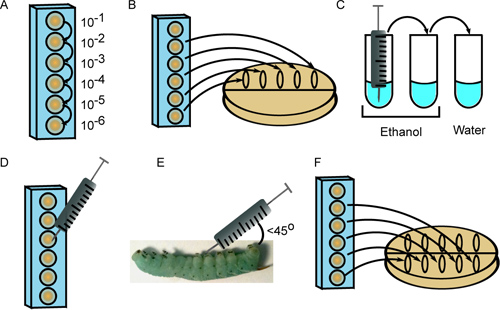
Figura 2. Injeção de 4 º instar M. larvas sexta. A) As bactérias são diluídos em série numa placa de 96 poços. B) dez microlitros de diluições múltiplas são plaqueadas para enumerar o inoculo. C) A seringa é esterilizado com 3 lavagens em etanol (2x) e água estéril. D) dez microlitros da diluição adequada são atraídos para a seringa. E) A suspensão de células é injectada a uma ° 45ângulo atrás da primeira proleg abdominal. F) As diluições são plaqueadas novamente para fornecer uma segunda medida do inóculo.
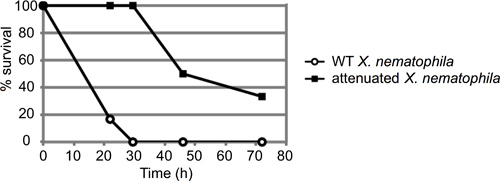
Figura 3. Resultado Representante de M. sexta ensaio de injecção. Cerca de 50 unidades formadoras de colónias (UFC) de células Xenorhabdus nematophila em fase estacionária (10 ul de uma diluição 10 -4) foram injectados seis 4 º instar M. sexta larvas por estirpe. Tanto o tipo selvagem e de uma estirpe mutante (LRP) com um defeito virulência estabelecido foram injectados e os insectos monitorizados quanto a mortalidade ao longo do tempo. Os resultados são apresentados como percentagem insectos sobreviventes ao longo do tempo (em horas). Essas curvas são estatisticamente diferentes, com um valor-p de 0.000458 através de análise de log-rank.
Discussão
A injecção directa de M. sexta larvas com bactérias entomopatogênicos, como aqui descrito, serve como um meio simples e eficaz para analisar a virulência bacteriana. O método também é altamente adaptável para se adequar a diferentes sujeitos experimentais e / ou condições. As bactérias podem ser preparados de várias maneiras, antes da injecção. No caso de X. nematophila, células selvagens cultivadas em rico em nutrientes Luria-Bertani (LB) até meados de log-fase são tipicamente o mais virulento, matando a maioria ou todos os insetos dentro de 30 horas após a injeção. As células em fase estacionária, muitas vezes levar 5-10 horas mais tempo para matar as larvas. Embora fase de crescimento influencia a virulência, o número total de células injectadas parece ser menos importante 16, com inóculos típico que varia de 20 a 20.000 CFU. Na verdade, no caso de espécies e Xenorhabdus Photorhabdus, tão poucos como 5 CFU são suficientes para matar o insecto hospedeiro 17. A fim de avaliar a virulência properties de espécies bacterianas que são resistentes a esterilização etanol (por exemplo, espécies de Bacillus), agulhas descartáveis podem ser usadas para injectar cada estirpe original em lugar de esterilização etanol (passo 3.4).
Ajustes adicionais para este método pode envolver alterações na criação e / ou manipulação de M. sexta. Por exemplo, os insectos podem ser criadas em folhas de tomate ou tabaco como uma fonte de alimento mais natural. Alternativamente, os diferentes estágios de desenvolvimento de M. sexta larvas podem ser analisadas por este método. Larvas de quarto instar foram escolhidas com base no seu tamanho relativamente grande, mas menor larvas também podem ser injectados por este método. Quinta larvas pode ser injetado, no entanto as alterações no sistema imunológico durante esta fase do desenvolvimento tornam tarde 5 ª larvas mais suscetíveis do que cedo larvas de 5 º 18, potencialmente complicando análise de dados.
Finalmente, a injeção diretamétodo pode ser adaptado para uso com outras espécies de insectos. M. sexta é usado como um modelo para o hospedeiro de espécies altamente patogénicas, porque é menos susceptível a infecções do que outros organismos (mais susceptíveis), tais como o modelo mellonella Galleria. G. mellonella pode ser injectada através do método descrito neste trabalho 19, no entanto, e pode ser útil para as espécies bacterianas de ensaio menos virulentos do que Xenorhabdus e espécies Photorhabdus.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer aos membros anteriores do laboratório Goodrich-Blair: Samantha Orchard, Kimberly Cowles, Erin Herbert-Tran, Greg Richards, Megan Menard, e Youngjin Parque por suas contribuições para o desenvolvimento deste protocolo. Este trabalho foi financiado pela National Science Foundation concessão IOS-0950873 e os Institutos Nacionais de Saúde NRSA comunhão FAI084441Z.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Companhia | Número de catálogo | Comentários |
| Papel de 90 milímetros filtro | Whatman | 1001 090 | |
| Vidro do porta-filtro | Millipore | XX1004700 | |
| Manduca sexta ovos | Carolina Alimentação Biológica | 143880 | |
| Dieta Gypsy Moth agar + | Biomedicals MP | 0296029301 | |
| 5,5 onças recipientes de plástico e tampas | Empresa Individual Cup | URC55-0090-0090 PL4 | |
| 1 onça recipientes de plástico e tampas | DART Container Corporation | 100PC 100PCL25 | |
| 1x PBS | 137 mM de NaCl, 2,7 mM KCl, 8 mM de Na 2 HPO 4, 1,46 mM KH 2 PO 4, pH 7,4 | ||
| Seringa | Hamilton | 80208 | Calibre 30, 0,375 "Comprimento estilo de ponto, 2 |
Referências
- Bintrim, S. B., Ensign, J. C. Insertional inactivation of genes encoding the crystalline inclusion proteins of Photorhabdus luminescens results in mutants with pleiotropic phenotypes. J. Bacteriol. 180, 1261-1269 (1998).
- Schesser, J. H., Kramer, K. J., Bulla, L. A. Bioassay for homogeneous parasporal crystal of Bacillus thuringiensis using the tobacco hornworm, Manduca sexta. Appl. Environ. Microbiol. 33, 878-880 (1977).
- Péchy-Tarr, M., Bruck, D. J., Maurhofer, M., Fischer, E., Vogne, C., Henkels, M. D., Donahue, K. M., Grunder, J., Loper, J. E., Keel, C. Molecular analysis of a novel gene cluster encoding an insect toxin in plant-associated strains of Pseudomonas fluorescens. Environ. Microbiol. 10, 2368-2386 (2008).
- Nuñez-Valdez, M. E., Calderón, M. A., Aranda, E., Hernández, L., Ramírez-Gama, R. M., Lina, L., Rodríguez-Segura, Z., Gutiérrez Mdel, C., Villalobos, F. J. Identification of a putative Mexican strain of Serratia entomophila pathogenic against root-damaging larvae of Scarabaeidae (Coleoptera). Appl. Environ. Microbiol. 74, 802-810 (2008).
- Forst, S. A., Tabatabai, N. Role of the histidine kinase, EnvZ, in the production of outer membrane proteins in the symbiotic-pathogenic bacterium Xenorhabdus nematophilus. Appl. Environ. Microbiol. 63, 962-968 (1997).
- Kanost, M. R., Jiang, H., Yu, X. Q. Innate immune responses of a lepidopteran insect, Manduca sexta. Immunol. Rev. 198, 97-105 (2004).
- Yu, X. Q., Zhu, Y. F., Ma, C., Fabrick, J. A., Kanost, M. R. Pattern recognition proteins in Manduca sexta plasma. Insect Biochem. Mol. Biol. 32, 1287-1293 (2002).
- Eleftherianos, I., ffrench-Constant, R. H., Clarke, D. J., Dowling, A. J., Reynolds, S. E. Dissecting the immune response to the entomopathogen Photorhabdus. Trends Microbiol. 18, 552-560 (2010).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- D'Argenio, D. A., Gallagher, L. A., Berg, C. A., Manoil, C. Drosophila as a model host for Pseudomonas aeruginosa Infection. J. Bacteriol. 183, 1466-1471 (2001).
- Waterfield, N., Dowling, A., Sharma, S., Daborn, P. J., Potter, U., Ffrench-Constant, R. H. Oral toxicity of Photorhabdus luminescens W14 toxin complexes in Escherichia coli. Appl. Environ. Microbiol. 67, 5017-5024 (2001).
- Park, Y., Herbert, E. E., Cowles, C. E., Cowles, K. N., Menard, M. L., Orchard, S. S., Goodrich-Blair, H. Clonal variation in Xenorhabdus nematophila virulence and suppression of Manduca sexta immunity. Cell. Microbiol. 9, 645-656 (2007).
- Park, Y., Kim, Y., Putnam, S. M., Stanley, D. W. The bacterium Xenorhabdus nematophilus depresses nodulation reactions to infection by inhibiting eicosanoid biosynthesis in tobacco hornworms, Manduca sexta. Arch. Insect Biochem. Physiol. 52, 71-80 (2003).
- Cowles, K. N., Cowles, C. E., Richards, G. R., Martens, E. C., Goodrich-Blair, H. The global regulator Lrp contributes to mutualism, pathogenesis and phenotypic variation in the bacterium Xenorhabdus nematophila. Cell. Microbiol. 9, 1311-1323 (2007).
- Cowles, K. N., Goodrich-Blair, H. Expression and activity of a Xenorhabdus nematophila haemolysin required for full virulence towards Manduca sexta insects. Cell. Microbiol. 7, 209-219 (2005).
- Goodrich-Blair, H., Clarke, D. J. Mutualism and pathogenesis in Xenorhabdus and Photorhabdus: two roads to the same destination. Mol. Microbiol. 64, 260-268 (2007).
- Eleftherianos, I., Baldwin, H., ffrench-Constant, R. H., Reynolds, S. E. Developmental modulation of immunity: changes within the feeding period of the fifth larval stage in the defence reactions of Manduca sexta to infection by Photorhabdus. J. Insect Physiol. 54, 309-318 (2008).
- Kavanagh, K., Reeves, E. P. Exploiting the potential of insects for in vivo pathogenicity testing of microbial pathogens. FEMS Microbiol. Rev. 28, 101-112 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados