Method Article
Crianza y la inyección de
En este artículo
Resumen
El método descrito aquí utiliza la inyección directa de bacterias entomopatógenos en el hemocele de Manduca sexta Larvas de insectos. M. sexta Es un insecto disponibles comercialmente y bien estudiado. Por lo tanto, este método representa un método simple para analizar bacterianas interacción huésped-desde la perspectiva de uno o ambos socios.
Resumen
Manduca sexta, comúnmente conocido como el gusano del tabaco, se considera una plaga agrícola importante, se alimentan de plantas solanáceas, incluyendo tabaco y tomate. La susceptibilidad de M. larvas sexta a una variedad de especies bacterianas entomopatógenos 1-5, así como la gran cantidad de información disponible sobre el sistema inmunológico del insecto 6-8, y la secuencia del genoma pendiente 9 lo convierten en un organismo modelo bueno para el uso en el estudio de la interacción huésped-microbio durante la patogénesis. Además, M. sexta larvas son relativamente grandes y fáciles de manipular y mantener en el laboratorio en relación a otras especies de insectos susceptibles. Su gran tamaño también facilita eficiente tejido / hemolinfa de extracción para el análisis de la respuesta del huésped a la infección.
El método aquí presentado describe la inyección directa de bacterias en el hemocele (cavidad sangre) de M. sexta larvas. Este enfoquese puede utilizar para analizar y comparar las características de virulencia de diversas especies bacterianas, cepas o mutantes simplemente monitorizar el tiempo a la muerte del insecto después de la inyección. Este método fue desarrollado para estudiar la patogenicidad de Xenorhabdus y Photorhabdus especies, que suelen asociar con vectores de nematodos como un medio para ganar la entrada en el insecto. Nematodos entomopatógenos típicamente infectan larvas vía digestiva natural o aberturas respiratorias, y liberan su contenido de bacterias simbióticas en la hemolinfa del insecto (sangre) poco después 10. El método de inyección aquí descrito evita la necesidad de un vector de nematodos, así desacoplar los efectos de las bacterias y nematodos en el insecto. Este método permite la enumeración precisa de material infeccioso (células o proteínas) en el inóculo, que no es posible con otros métodos existentes para el análisis de entomopathogenesis, incluyendo formación de muescas 11 y los ensayos de toxicidad por vía oral 12 La utilidad del método de inyección directa como se describe aquí es analizar la patogénesis bacteriana mediante la supervisión de mortalidad de los insectos. Sin embargo, este método puede ser fácilmente ampliado para su uso en el estudio de los efectos de la infección en el M. sexta sistema inmune. El insecto responde a la infección a través de ambas respuestas humoral y celular. La respuesta humoral se incluye el reconocimiento de bacterias asociadas con los patrones y la subsiguiente producción de diversos péptidos antimicrobianos 7, la expresión de genes que codifican estos péptidos pueden ser monitoreados posterior a la infección directa a través de la extracción de RNA y PCR cuantitativa 13. La respuesta celular a la infección implica la nodulación, encapsulación, y la fagocitosis de agentes infecciosos por hemocitos 6 13, 14.
Protocolo
1. Esterilización de Insectos huevo y Cría
- Preparar dieta por primera autoclave 15 g de agar proporcionado en la 900-1,000 ml H 2 O. Inmediatamente después de la esterilización en autoclave, se mezclan con 166 g de germen de trigo dieta y mezcla bien en un mezclador de laboratorio. Vierta en un plato (o platos) para enfriar y transferir dieta para papel de aluminio, envolver herméticamente, y se almacena a 4 ° C.
- A su llegada, esterilizar M. Sexta huevos con 250 ml de solución de lejía al 0,6% durante 2-3 min en un soporte de filtro de vidrio y aparatos termo con un papel de filtro de 90 mm, revolviendo de vez en cuando.
- Encienda el vacío para drenar la solución de lejía y lavado de los huevos de 3-4 veces con 250 ml de agua estéril destilada H 2 O por lavado.
- Traslado huevos a papel nuevo de 90 mm filtro colocado en una placa de Petri tapa y deje que se sequen hasta que ya no estamos juntos (unos 20-30 minutos).
- Transferir los huevos a la parte inferior de los recipientes de plástico con dieta de insectos, colocando aproximadamente 40 huevos en cada envase(Figura 1A). Los huevos se separan de la dieta para evitar que la humedad inducida por la contaminación fúngica. Mantenga los huevos a 26 ° C con una luz de 16 horas: 8 hr fotoperíodo oscuro. Los huevos se aclarará a un color amarillo-blanco antes de la eclosión.
- Cuando la incubación es completa, transferir cuidadosamente aproximadamente 25 larvas cada uno de los nuevos contenedores con la dieta en la parte inferior (Figura 1B). Es importante recoger cada larva por el cuerno largo y negro con unas pinzas para evitar dañar a ellos durante sus primeras etapas de desarrollo frágiles. Incubar durante 2 días como anteriormente. Si bien la muerte larval es inusual en esta etapa, algunos muertos o, más probablemente, larvas de desarrollo atrofiado puede ser observado. Tales insectos deben excluirse del estudio y se sacrificaron por congelación.
- Para evitar comportamientos caníbales, larvas transfiera a recipientes individuales con pequeños trozos de alimentos (Figura 1 C) y se incuba como antes. Supervisar el desarrollo de insectos, heces sustitución de alimentos y limpieza out de recipientes cada día hasta que se someten a la tercera muda larval (normalmente 6-9 días después de la eclosión). Este es el 4 º instar etapa larval, que se caracteriza por la aparición de negros en forma de gancho crochets en cada prominencia Proleg y aumento de rayas a lo largo del cuerpo del insecto (Figura 1D). Las larvas pueden variar considerablemente en tamaño, pero normalmente pesan 0.15 a 0.4 g al entrar en la 4 ª etapa instar. Las larvas de tamaño similar debe ser elegido para la inyección.
2. Preparación de bacterias para Inyección
- Crecer la cepa bacteriana (s) a ensayar de acuerdo con procedimientos estándar para la fase de crecimiento que se desea probar.
- Pellet 500 l de cada cepa bacteriana para ser probado por hilado durante 2 min en una microcentrífuga a 13.000 rpm a temperatura ambiente.
- Resuspender las células en 1 ml de 1x solución salina tamponada con fosfato estéril (PBS) y el sedimento de nuevo como anteriormente.
- Resuspender las células en 0,5 ml de PBS 1x estéril y meaAsegúrese de que la densidad óptica (DO) de la suspensión. Diluir las suspensiones para el mismo diámetro exterior, si es necesario. Medios estériles de crecimiento también se puede utilizar para la resuspensión celular y la dilución en lugar de PBS 1x, si se desea.
3. Inyección de 4 º estadio las larvas
- Preparar serie 10-veces diluciones de la cepa bacteriana primero en 6 pocillos de una placa de microtitulación de 96 pocillos, en PBS 1x estéril, usando una punta de pipeta nueva para cada dilución (Figura 2A). El volumen final de la suspensión celular en cada pocillo debe exceder el volumen necesario para la inyección (10 l por insectos), además de 20 l para la placa de inóculo (ver los pasos 3,2 y 3,7).
- Punto 10 l cada uno de 5 diluciones (10 -2 a través de 10 -6) a lo largo de la parte superior de una placa de Petri que contiene un medio de crecimiento apropiado. Inclinar la placa de modo que los puntos se extendió al centro (Figura 2B).
- Retire dieta de insectos y excrementos e insectos lugar en recipientes con hielo paraaproximadamente 5 min.
- Esterilizar la aguja de la jeringa mediante enjuague 3 veces cada una en 2 tubos de 70-100% de etanol, seguidos por un tubo estéril de O H 2 (Figura 2C). El volumen de líquido debe ser suficiente para sumergir la aguja.
- Cuantificar las suspensiones de células diluidas con un microscopio utilizando un hemocitómetro. Dependiendo del inóculo deseado, dibujar 10 l de la microtitulación correspondientes pocillos (Figura 2D).
- Torunda la superficie de insecto con 95% de etanol, y se inyecta la suspensión de 10 ml de células en el insecto en un ángulo (de menos de 45 °) detrás de la una de las patas abdominales abdominales. Tener cuidado de no perforar el intestino e inyectar el contenido justo debajo de la capa epidérmica (2E Figura). Si bien una cierta pérdida de hemolinfa (claro, verde-azul líquido) es normal, las partículas y el líquido amarillo que emerge de la zona de inyección son indicativos de punción intestino. Si esto ocurre, sacrificar el insecto y obtener una larva de nuevo para volvercolocarlo.
- Repita el paso 3.6 para cada insecto restante en el grupo de la primera inyección. Aguja de la esterilización no es necesaria entre cada insecto inyecta con la misma dilución y la cepa de bacterias a menos que se produzca contaminación. Alternativamente, un dispensador de repetición se puede utilizar para una mayor consistencia en el volumen de inyección entre las muestras.
- Después de inyectar cada insecto con la primera cepa de bacteria, repita el paso 3,2, esta vez manchado suspensiones de células en el medio de la placa y dejar que el flujo hacia la parte inferior (Figura 2F). Incubar las placas a temperatura adecuada y contar las colonias de enumerar el inóculo. Este paso chapado segunda se utiliza para verificar que las muestras no estaban contaminadas durante el proceso de inyección, ya que esto daría lugar a números de colonias dispares entre los chapados primero y segundo.
- Repetir los pasos a través de 3,1 3,8 para cada cepa de bacteria en el experimento. Finalmente, se inyectan 3-5 insectos con PBS 1x estéril utilizando un sterile aguja como un grupo de control negativo. Incubar los insectos a 26 ° C con una luz de 16 horas: 8 hr fotoperíodo oscuro.
- Supervisar la supervivencia del insecto con el tiempo después de la inyección. La muerte del insecto se caracteriza por una falta de movimiento voluntario a la estimulación. Los insectos suelen presentar pérdida del apetito, diarrea (excremento aguado, de color amarillo), y / o pérdida de agua ("sudor") durante la infección antes de la muerte; estas características puede ser digno de mención también.
Resultados
Un ejemplo representativo de un ensayo de mortalidad de los insectos se representa en la Figura 3. En este experimento, los insectos fueron inyectados con aproximadamente 50 unidades formadoras de colonias (UFC) de tipo salvaje (ATCC19061) o un mutante de la cepa atenuada (lrp 13) de Xenorhabdus nematophila crecer hasta la fase logarítmica media (n = 6 insectos por cepa). Los insectos fueron observados durante aproximadamente 72 horas, y registró el porcentaje de insectos inyectados sigue vivo en cada punto de tiempo. En este caso, la cepa atenuada exhibió un claro retraso en la muerte de los insectos, la cepa de tipo salvaje murieron todas las larvas 6 dentro de 30 horas después de la inyección, antes de la muerte de cualquier mutante larva infectada.
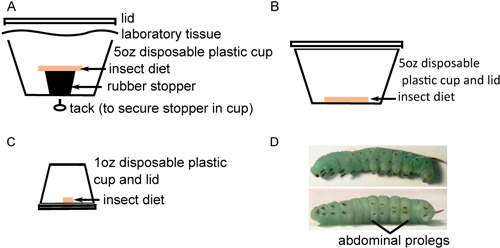
Figura 1. Cría de insectos en preparación para inyección. A) aproximadamente 40 huevos esterilizados en superficie se colocan en el fondo de una taza con 5 ozdieta del insecto estéril descansa sobre un tapón de goma. B) Veinte insectos recién eclosionados se transfieren a 5 tazas oz con la dieta del insecto estéril en la parte inferior y se incubaron durante 2 días. C) Los insectos se transfirieron individualmente próximo a 1 oz tazas con dieta estéril en la parte inferior y se incubaron hasta que maduran. D) En cuarto instar de M. sexta larvas con rayas prominentes a lo largo del cuerpo (arriba) y crochet negras en las patas abdominales abdominales (parte inferior).
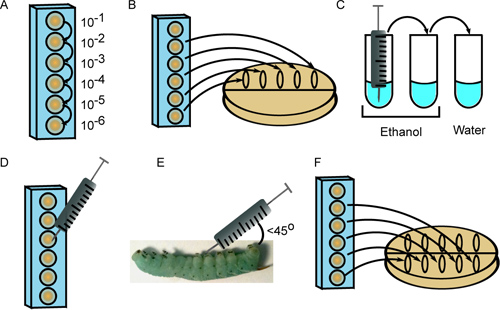
Figura 2. Inyección de 4 º instar M. sexta larvas. A) Las bacterias se diluyen en serie en una placa de 96 pocillos. B) Diez microlitros de múltiples diluciones se siembran para enumerar el inóculo. C) La jeringa se esteriliza con 3 lavados en etanol (2x) y agua estéril. D) Diez microlitros de la dilución apropiada se dibujan en la jeringa. E) La suspensión de células se inyecta a una ° 45ángulo detrás de la Proleg abdominal primero. F) Las diluciones se sembraron de nuevo para proporcionar una segunda medida del inóculo.
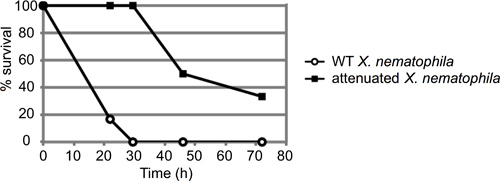
Figura 3. Representante resultado de M. sexta ensayo de inyección. Acerca de 50 unidades formadoras de colonias (UFC) de Xenorhabdus nematophila células en fase estacionaria (10 l de la dilución 10 -4) se inyectaron en seis 4 º instar de M. sexta larvas por cepa. Tanto de tipo salvaje y una cepa mutante (PRL) con un defecto virulencia establecido fueron inyectados y seguimiento de los insectos para la mortalidad en el tiempo. Los resultados se informan como porcentaje superviviente insectos en el tiempo (en horas). Estas curvas son estadísticamente diferentes, con un p-valor de 0.000458 a través de análisis de log-rank.
Discusión
La inyección directa de M. larvas sexta con bacterias entomopatógenos, como se describe aquí, sirve como un medio sencillo y eficaz para analizar la virulencia bacteriana. El método es también muy adaptable para adaptarse a diferentes sujetos experimentales y / o condiciones. Las bacterias se pueden preparar de diversas maneras antes de la inyección. En el caso de X. nematophila, las células de tipo salvaje cultivadas en rica en nutrientes Luria-Bertani (LB) a mitad de la fase log son típicamente los más virulentos, matando la mayoría o todos los insectos dentro de 30 horas después de la inyección. Las células en fase estacionaria a menudo toman más tiempo 5-10 horas para matar las larvas. Aunque la fase de crecimiento afecta la virulencia, el número total de células inyectadas parece ser menos importante 16, con inóculos típico que va desde 20 a 20.000 CFU. De hecho, en el caso de Xenorhabdus y especies Photorhabdus, tan pocos como 5 CFU son suficientes para matar el insecto huésped 17. Con el fin de evaluar la virulencia properties de especies bacterianas que son resistentes a la esterilización etanol (por ejemplo, especies de Bacillus), agujas desechables se puede utilizar para inyectar cada cepa única en lugar de la esterilización etanol (paso 3,4).
Nuevos ajustes a este método puede implicar cambios en la crianza y / o manipulación de M. Sexta. Por ejemplo, los insectos pueden ser criados en hojas de tomate o tabaco como fuente de alimento más natural. Alternativamente, las diferentes etapas de desarrollo de M. larvas sexta puede ensayarse mediante este método. Larvas de cuarto instar fueron elegidos en base a su tamaño relativamente grande, pero más pequeño larvas también se puede inyectar por este método. Quinto estadio las larvas se puede inyectar, sin embargo, los cambios en el sistema inmune durante esta etapa del desarrollo rinda tarde 5 º estadio las larvas más susceptibles que los principios de 5 º estadio las larvas 18, complicando potencialmente el análisis de datos.
Por último, la inyección directamétodo puede ser adaptado para su uso con otras especies de insectos. M. sexta se utiliza como un modelo de acogida para las especies altamente patógenos debido a que es menos susceptible a la infección que otros organismos modelo (más sensible), tales como Galleria mellonella. G. mellonella puede ser inyectado por el método descrito en este trabajo 19, sin embargo, y puede ser útil para las especies bacterianas de ensayo menos virulenta que Xenorhabdus y especies Photorhabdus.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a los miembros anteriores del laboratorio Goodrich-Blair: Samantha Orchard, Cowles Kimberly, Erin Herbert-Tran, Greg Richards, Menard Megan y Parque Youngjin por sus contribuciones al desarrollo de este protocolo. Este trabajo fue financiado por la National Science Foundation de subvención IOS-0950873 y los Institutos Nacionales de Salud NRSA compañerismo FAI084441Z.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Empresa | Número de catálogo | Comentarios |
| 90 mm papel de filtro | Whatman | 1001 090 | |
| Filtro de vidrio titular | Millipore | XX1004700 | |
| Manduca sexta huevos | Carolina Biological Supply | 143880 | |
| Dieta Gypsy Moth agar + | MP Biomedicals | 0296029301 | |
| 5,5 oz envases de plástico y tapas | Solo Cup Company | URC55-0090-0090 PI4 | |
| 1 oz envases de plástico y tapas | Dart Container Corporation | 100PC 100PCL25 | |
| 1x PBS | 137 mM NaCl, 2,7 mM KCl, 8 mM Na 2 HPO 4, 1,46 mM KH 2 PO 4, pH 7,4 | ||
| Jeringa | Hamilton | 80208 | Calibre 30, 0,375 "de largo, estilo, punto 2 |
Referencias
- Bintrim, S. B., Ensign, J. C. Insertional inactivation of genes encoding the crystalline inclusion proteins of Photorhabdus luminescens results in mutants with pleiotropic phenotypes. J. Bacteriol. 180, 1261-1269 (1998).
- Schesser, J. H., Kramer, K. J., Bulla, L. A. Bioassay for homogeneous parasporal crystal of Bacillus thuringiensis using the tobacco hornworm, Manduca sexta. Appl. Environ. Microbiol. 33, 878-880 (1977).
- Péchy-Tarr, M., Bruck, D. J., Maurhofer, M., Fischer, E., Vogne, C., Henkels, M. D., Donahue, K. M., Grunder, J., Loper, J. E., Keel, C. Molecular analysis of a novel gene cluster encoding an insect toxin in plant-associated strains of Pseudomonas fluorescens. Environ. Microbiol. 10, 2368-2386 (2008).
- Nuñez-Valdez, M. E., Calderón, M. A., Aranda, E., Hernández, L., Ramírez-Gama, R. M., Lina, L., Rodríguez-Segura, Z., Gutiérrez Mdel, C., Villalobos, F. J. Identification of a putative Mexican strain of Serratia entomophila pathogenic against root-damaging larvae of Scarabaeidae (Coleoptera). Appl. Environ. Microbiol. 74, 802-810 (2008).
- Forst, S. A., Tabatabai, N. Role of the histidine kinase, EnvZ, in the production of outer membrane proteins in the symbiotic-pathogenic bacterium Xenorhabdus nematophilus. Appl. Environ. Microbiol. 63, 962-968 (1997).
- Kanost, M. R., Jiang, H., Yu, X. Q. Innate immune responses of a lepidopteran insect, Manduca sexta. Immunol. Rev. 198, 97-105 (2004).
- Yu, X. Q., Zhu, Y. F., Ma, C., Fabrick, J. A., Kanost, M. R. Pattern recognition proteins in Manduca sexta plasma. Insect Biochem. Mol. Biol. 32, 1287-1293 (2002).
- Eleftherianos, I., ffrench-Constant, R. H., Clarke, D. J., Dowling, A. J., Reynolds, S. E. Dissecting the immune response to the entomopathogen Photorhabdus. Trends Microbiol. 18, 552-560 (2010).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- D'Argenio, D. A., Gallagher, L. A., Berg, C. A., Manoil, C. Drosophila as a model host for Pseudomonas aeruginosa Infection. J. Bacteriol. 183, 1466-1471 (2001).
- Waterfield, N., Dowling, A., Sharma, S., Daborn, P. J., Potter, U., Ffrench-Constant, R. H. Oral toxicity of Photorhabdus luminescens W14 toxin complexes in Escherichia coli. Appl. Environ. Microbiol. 67, 5017-5024 (2001).
- Park, Y., Herbert, E. E., Cowles, C. E., Cowles, K. N., Menard, M. L., Orchard, S. S., Goodrich-Blair, H. Clonal variation in Xenorhabdus nematophila virulence and suppression of Manduca sexta immunity. Cell. Microbiol. 9, 645-656 (2007).
- Park, Y., Kim, Y., Putnam, S. M., Stanley, D. W. The bacterium Xenorhabdus nematophilus depresses nodulation reactions to infection by inhibiting eicosanoid biosynthesis in tobacco hornworms, Manduca sexta. Arch. Insect Biochem. Physiol. 52, 71-80 (2003).
- Cowles, K. N., Cowles, C. E., Richards, G. R., Martens, E. C., Goodrich-Blair, H. The global regulator Lrp contributes to mutualism, pathogenesis and phenotypic variation in the bacterium Xenorhabdus nematophila. Cell. Microbiol. 9, 1311-1323 (2007).
- Cowles, K. N., Goodrich-Blair, H. Expression and activity of a Xenorhabdus nematophila haemolysin required for full virulence towards Manduca sexta insects. Cell. Microbiol. 7, 209-219 (2005).
- Goodrich-Blair, H., Clarke, D. J. Mutualism and pathogenesis in Xenorhabdus and Photorhabdus: two roads to the same destination. Mol. Microbiol. 64, 260-268 (2007).
- Eleftherianos, I., Baldwin, H., ffrench-Constant, R. H., Reynolds, S. E. Developmental modulation of immunity: changes within the feeding period of the fifth larval stage in the defence reactions of Manduca sexta to infection by Photorhabdus. J. Insect Physiol. 54, 309-318 (2008).
- Kavanagh, K., Reeves, E. P. Exploiting the potential of insects for in vivo pathogenicity testing of microbial pathogens. FEMS Microbiol. Rev. 28, 101-112 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados