Method Article
Бедренная артериального и венозного Катетеризация для забора крови, медикаментов и сознавая, кровяное давление и измерения пульса
В этой статье
Резюме
Хронический катетеризации сосудов у крыс часто требуется для администрации веществ, получить кровь в течение периода времени или для прямого сознательного измерения кровяного давления. Бедренная артериальной катетеризации крысы и соответствующие измерения давления крови в сознательном животных будут продемонстрированы.
Аннотация
В нескольких областях знаний, доступ к системе кровообращения в ходе лабораторных исследований не требуется. Фармакологические исследования на крысах использованием хронически имплантированными катетерами разрешение исследователю эффективно и гуманно управлять веществ, выполнить повторный забор крови и помогает в сознательном прямые измерения артериального давления и частоты сердечных сокращений. Как только катетер имплантируется долгосрочных выборки возможно. Проходимость катетера и жизнь зависит от нескольких факторов, включая блокировку раствор, используемый, приливы режим и катетер материала. Это видео покажет методологии бедренной артерии и венозной катетеризации крысы. Кроме того видео продемонстрирует использование бедренной венозных и артериальных катетеров для забора крови, приема препарата и использование артериального катетера в проведении измерений артериального давления и частоты сердечных сокращений в сознательном свободно движущихся крысы. Троса и упряжь придает поворотная система позволит животным, хоиспользоваться и образцов, взятых исследователь с минимальным ущербом для животных. Для поддержания проходимости катетера, тщательный ежедневный уход из катетера требуется использование блокировки решений (100 ед / мл гепаринизированной физиологический раствор), машино-земля тупым кончиком иглы шприца и использование шприца фильтры свести к минимуму возможные загрязнения. При тщательном асептического хирургические методы, соответствующие материалы катетер и осторожно методы обслуживания катетер, можно поддерживать патент катетеры и здоровых животных в течение длительного периода времени (несколько недель).
протокол
1. Перед началом хирургической процедуры
Примечание: Перед началом любого животного процедур убедитесь, что вы получили соответствующее разрешение через учреждения / организации. Как и во всех выживания операции, убедитесь, что операция проводится в стерильных условиях и соответствующие обезболивающие и антибиотики, необходимые используются для успешного результата.
- Перед началом процедуры катетеризации оценивать катетеры, смывая их стерильным физиологическим раствором, чтобы обеспечить их патента.
- Обезболить крысы.
- Подготовка крысы для хирургического вмешательства.
- Бритье меха от хирургического регионов, которые включают в себя заднюю часть шеи (между лопатками) и внутренней области ног.
- Использование Бетадин и 70% этанола, скраб, соответственно, скраб бритая хирургических регионов, начиная с центра и делая круговые наружу развертки. Повторятьэто в 3 раза для каждого региона, заканчивая окончательной чистки с 70% этанола.
- Место животное на стерильной поверхности и место стерильную драпировка перед хирургическим областях. (Использование Пресс-н-Seal является идеальной хирургической драпировки позволяет следователю для мониторинга животного на протяжении всей процедуры.)
- Убедитесь, что все хирургические инструменты для хирургического вмешательства были стерилизованы.
2. Подготовка Хирургическая Области катетера
- С крысы укладки склонны (на животе), составляют примерно ½ дюйма (12 мм) горизонтальный разрез на задней части шеи на уровне лопаток ножницами или скальпелем, затем тупым рассекают подкожную "карман" в назад примерно размером квартала. Это будет использоваться как область на месте небольшое количество труб, что позволит компенсировать рост животных и / или движения, то есть так, что катетер не надел и, таким образом удаляется из артерии было местог дюйма (В качестве альтернативы этот шаг может быть выполнен непосредственно перед туннелированием катетер.)
- Место крысу на спину (спине) и сделайте разрез в паховой области [приблизительный ½ дюйма (12 мм) разрез по естественным углом задние ноги.
- Блант рассекать отделить соединительной ткани (рис. 1) (можно использовать тупым кончиком ножниц, hemostats, ватные тампоны и т.д.) (обычно путем проведения вашего тупым наконечником ножницы и / или ватные тампоны на 45 градусов, что обеспечивает более легкое локализации из области интереса) до бедренной артерии и вены подвергаются.
- Вены темно-красного цвета, а артерии яснее и ярче, чем вены. Нерва, который проходит вдоль артерии беловатые по тону.
- Блант рассекают в области ног, чтобы сделать небольшие открытые области под кожу (например, карманные, примерно размером с квартал) по внутренней стороне ноги для размещения небольшой участок catheteГ (опять же с учетом движения животных и роста животного, если хроническая размещения).
- Место преднатяжителями в области разреза, так что вы можете полностью просмотреть артерии и вены.
- Использование тонких кончик пинцетом осторожно отдельных нервов (беловатого цвета), которая, совместно бедренную артерию от артерии и вены. (Рис. 2) Будьте осторожны, чтобы не порезать или повредить нерв.
- Отдельные артерия и вена как единое целое, пытаясь выставить примерно ¼ дюйма (5-7 мм) длина части артерии / вены.
- Повторите процесс в отделении вены от артерий. Держите хирургических инструментов (например, штраф пинцет наконечник) перпендикулярно судов и отдельных судей в параллельном режиме. Это помогает избежать разрывов, покалывание или повреждение сосудов. Размещая штраф пинцетом осторожно кончиком между артерией и веной снизу и медленно открытие щипцов и повторяя это, вы будете медленно, отдельные сосуды. Примечание: если у вас слезу или соблюдать некоторыекровотечение использовать стерильный ватный тампон и / или 2 х 2 марлю и давление на область пока кровотечение не остановилось, а затем продолжить с хирургией.
3. Туннельный катетер
- Место стерильного физиологического раствора пропитанной 2 х 2 марлевые за разреза и превратить животное к его животу.
- Место Рочестер Pean щипцы (длинные прямые щипцы) в разрез на спине, что было сделано ранее, и руководство щипцы подкожно вниз по спине до уровня бедра [обеспечения кончики hemostats указаны вверх, (не по направлению к позвоночнику ), чтобы избежать травм спинного мозга]. Примерно в хип регионе свою очередь, кровоостанавливающего кончиком, направленным к разрез, который был сделан в области ног и нажмите кончиком hemostats из подготовленных разрез ногу.
- Аккуратно понять конце катетера (не конец, который будет вставлен в артерии / вены) с пинцетом и аккуратно выньте катетер через резонатор, который был сделани в конечном счете из шеи разрез.
- Место соответствующие притупляются наконечника иглы шприц с 20 Ед / мл гепарина / солевой на конец соответствующего катетеры и заполнить катетеры (убедитесь, что Есть нет воздушных пузырьков) с гепарином / солевом растворе. Еще раз проверьте, что катетеры патент и никакого ущерба пришел к катетеров. Оставьте шприцы прилагается к концу катетера линий для обеспечения воздух не в состоянии войти в катетер линий и превратить крысу на спину еще раз.
4. Вставка Катетеры в бедренную вену и артерии (рис. 3)
- Место сложенный лист стерильный 4,0 шелк / резьба под бедренную вену, а затем разрезал шелк в сложенном конца. Там теперь будут два куска шелка в вену. Или же, 2 место кусков шелка под 4,0 вены в индивидуальном порядке.
- Отдельные шелка, что вы под вены, одна часть к ноге (дистального конца), а другой по отношению к телу. Тт.е. свободные лигатуры на стороне ближе к телу, то с помощью небольших hemostats, держитесь шелка и тянуть учил, но не затягивайте узел. Вытяните другой кусок шелка, насколько это возможно по отношению к ноге (дистального конца) и увязать это в тройной узел, держитесь шелка с небольшой hemostats и тянуть учили. Этот метод позволит вены наполняются кровью, что делает его легче сделать разрез, что требуется для вставки катетер (этап 4).
- Место 1-2 капли раствора лидокаина на вены.
- Использование Vanna микро-рассечение ножницами, сделайте небольшой надрез в вену около ¼ до конца и на 45 градусов.
- Место с острым концом пинцета (45 пинцетов) в разрез и с помощью другой пары щипцов, тщательно корма в вену катетер. Аккуратно откройте щипцы, которые размещаются в вену, так как это позволит исследователю осторожно положите венозный катетер под пинцетом и в вену.
- Когда катетер вставлен полностью (соответствуюx. 6-7 см) (при принятии катетер знак размещается на катетер, чтобы помочь хирургу в определении, когда катетер вставлен) (это места венозного катетера в брюшную полой вены), затянуть передний лигатуры вокруг вены и катетер, связывая тройной узел (убедитесь, что он не загораживает вен). Использование шелка шва рядом нога (задняя лигатуры), чтобы снова безопасный катетер (тройной узел) и обеспечить размещение. Медленно отступать шприца, пока не будет малой кровью видна в катетер, который помогает гарантировать, что шов узлами не слишком плотно, и что катетер функциональным. После проверки, нажмите на поршень, пока кровь больше не видна в катетер.
Примечание: можно вставить 2 катетера в бедренную вену, если необходимо. - Повторите шаги 9-13 на место бедренной артерии катетер со следующими исключениями:
- Галстук шелк ближайший к ноге (задние) с тройным узлом и тянуть таунравом, прежде чем связывать свободные лигатуры рядом с телом (передней) до принятия разрез для установки катетера. Это позволит артерии наполняются кровью облегчая резать. Обеспечить проксимальных шов вытягивается учили закупорить артерию до резки артерии. Это позволит избежать потери крови, когда надрез.
- Вставьте артериального катетера примерно 5 см от бедренной артерии (это места катетера в брюшную аорту).
- При обеспечении катетер с шов, убедитесь, что шов не слишком плотно и окклюзии катетера.
5. Хирургическое Итоговое
- Сделать копейки квартал размером петли в катетеров и место на внутренней стороне ноги (цикл должен вписываться в районе, который был тупым расчлененный ранее). После размещения и катетеры, закрепите их с 1-2 стежков 5,0 хирургический шов в мышечный слой.
- Закрыть разрез с 4,0 Ethilon с несплошных suturх годов.
- Включите крыса на его животе и сделать еще один цикл в катетеры размером с квартал и место в карман расчлененные в спину. Закрыть разрез шва.
- Использование капли vetbond, безопасный катетер в спину.
- Зажим катетеры около спины разрез с мягким hemostats и удалять шприцы от концов.
- Fit крысы с троса типа куртку, кепку катетеры (для поддержания гепарин замок), и удалить мягкой hemostats.
- Для долгосрочного поддержания заменить катетер физиологическим раствором с 20 Ед / мл гепарина / солевом растворе.
6. Поддержание катетера (стерильные перчатки во время процедуры)
- Зажим катетера с мягким пинцетом.
- Удаление катетера вилку.
- Место тупым наконечником шприца с замком раствор на катетер.
- Разжимать щипцами.
- Заполните катетер с замком решение (объем предварительно Определяетrmined, обычно 0,3 мл).
- Зажим катетер в то время как промывка, чтобы предотвратить обратный поток крови в катетера и удалить шприц.
- Замените катетер вилку.
- Разжимать пинцетом и аккуратно вставьте вилку в слегка чтобы убедиться в отсутствии крови на кончике катетера.
7. Забор крови (стерильные перчатки во время процедуры)
Зажим катетера с мягким пинцетом.
- Удаление катетера вилку.
- Медленно снять блокировку решения с использованием тупых наконечником шприца и выбросить.
- Прикрепить выборки шприц к катетеру и медленно снять образца.
- Зажим катетера с мягким пинцетом и поместить шприц с замком раствор на катетер и заново заполнить катетер с замком решение.
- Зажим катетера при повторном заполнении катетер с решением.
- Вставьте катетер вилку.
- Удалить мягким пинцетом и аккуратно нажмите т Он подключить немного дальше.
8. Инфузионная наркотиками
- Зажим катетера с мягким пинцетом.
- Удаление катетера вилку.
- Медленно снять блокировку решения с использованием тупых наконечником шприца и выбросить.
- Прикрепить наркотиков заполненный шприц к катетеру и настаивать вещества в животных.
- можно использовать 3-ходовой кран, а также промежуточные если несколько инъекций не требуется, что требует меньше жидкости инфузии в животное.
- можно также приложить постоянное насос шприца вливания с стерильный фильтр для непрерывного вливания.
- Зажим с мягким пинцетом и поместить шприц с замком раствор на катетер и заново заполнить катетер с замком решение.
- Зажим катетера при повторном заполнении катетер с решением.
- Вставьте катетер вилку.
- Удалить мягким пинцетом и аккуратно вставьте вилку в чуть дальше.
- Зажим артериальный катетер с мягким пинцетом и удалить катетер вилку.
- Прикрепить артериальной линии датчик давления.
- Следуйте производства инструкции по использованию программного обеспечения для сбора кровяное давление.
- В конце периода мониторинга кровяного давления, используя мягкий зажим пинцет катетера и отсоедините от датчика.
- Флеш катетер с замком решение и заменить катетер подключить как описано выше.
10. Представитель Результаты
Представитель измеряет кровяное давление было взято из сознательных свободно движущихся животных и представлена на рисунке 4. Фенилэфрин (3 мкг / кг, внутривенно), альфа-1 адренергических рецепторов, вводился в бедренную вену линии для повышения артериального давления, одновременно измерения кровяного давления из бедренной артериальной линии. Фентоламин (4 мг / кг, внутривенно),неселективных альфа-адренергических антагонистов, был затем вводят для снижения кровяного давления.

Рисунок 1. Блант рассечения тканей. С крысой на спине, вы сделали около ½ дюйма (12 мм) разрез на угол задней ноги и с помощью тупых ножниц или hemostats вы тупые рассекать соединительной ткани, чтобы разоблачить бедренную артерию и вену.
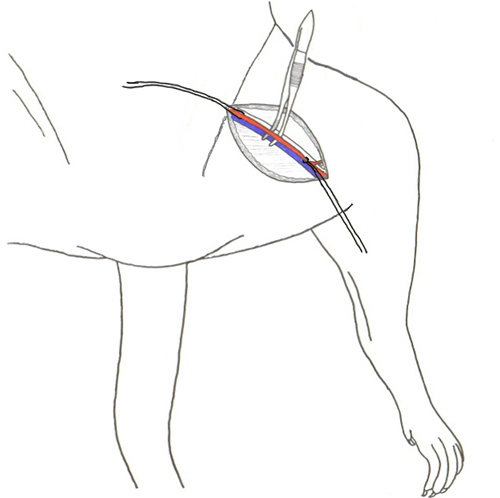
Рисунок 2. Разделение бедренную артерию и вену из соединительной ткани.

Рисунок 3. Катетера. Использование Vanna микро-рассечение ножницами месте небольшой надрез примерно четверть пути через судна на 45 градусов (вверху) и место острым концом щипцов в гоРазрез е и пользуясь еще пару щипцов кормить катетер в сосуд (в центре). Наконец, по завершении размещения катетера шва катетер на месте (внизу).
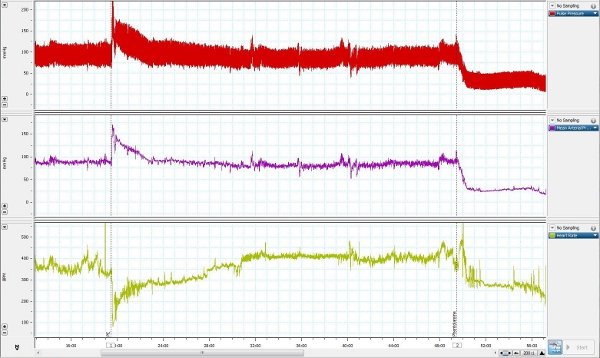
Рисунок 4. Представителю измерить давление крови, взятой из сознательных свободно движущихся животных.
Обсуждение
Артериальная катетеризация вены и исторически использовались как остро и хронически монитора артериального давления, анализ крови и доставить вещества в экспериментальной животной модели крысы 1-4. Основное преимущество этих хирургических контрольно-измерительных приборов является то, что позволяет осуществлять мониторинг процедур, в том числе, забор крови, приема препарата и мониторинга артериального давления, которая будет проводиться с минимальными нарушениями и / или стресса для животных 1. Многочисленные исследователи написали протоколы и имеют конкретные методики по которой их лаборатория выполняет хирургическую процедуру 5-8. Видео и иллюстрации демонстрируют то, что наша лаборатория оказалась успешной в отношении бедренной артериальной и венозной катетеризации процедуры.
Крысы широко используются в лаборатории для множества научных исследований из-за их небольшого размера и удобны в обращении. Есть несколько мест, где хроническийКатетер может быть размещен внутри животных, в том числе яремной вены, брюшной аорты, сонной артерии и бедренной артерии, чтобы назвать несколько. Крыса бедренной место для хронических результаты катетеризации к увеличению длины катетера и имел быстрый восстановление предоперационной веса животного по сравнению с другими местах катетер 9.
Многочисленные исследователи использовали постоянных катетеров для острого, а также хронических забора крови 1-5,11-13. Во многих исследованиях нескольких крови привлекает которые требуются от животных и внешних катетеризации / катетеризации является одной методологии, которая выгодна из-за отсутствия ее травматический характер, причем это может быть сделано в то время как животное находится в сознании, таким образом, не ограничивается эффекты анестетиков , а также животных можно свободно движущихся 1,10. Лучший способ с помощью которого можно получить образцы крови и измерения гормонов стресса у грызунов уже давно обсуждается 6,13. Что касается фармакокинетические Studiэс, катетеризация исследования животного позволяет повторять забора крови с минимальным ограничением при использовании хронически имплантировали катетер системы. Кроме того, исследования показали снижение базальной концентрации адреналина, норадреналина и дофамина в плазме свободно движущихся крысах (катетер яремной) по сравнению с животными, которые были обработаны (30 секунд) и сдержанной или (5 минут) 14. Дополнительный метод с помощью которого можно различить увеличение напряжения путем измерения плазменной кортикостерона уровнях. Ранее было высказано предположение, что даже после трех-четырех дней хирургических время восстановления, что плазменные уровни кортикостерона был повышен в хронической канюлированные крысы 15. Тем не менее, в последнее время улучшения в методологии определили, что Есть никаких различий в исходных уровней кортикостерона плазмы в яремную вену канюлю крыс по сравнению с крысами uncannulated 16. Кроме того, ВЭЖХ методологии кортикостерона анализ также показал, что corticosterодин повышенные уровни ограничением напряжения, однако, стабильным после катетеризации яремной 16.
Дополнительное использование хронической катетеризации является измерение артериального давления и частоты сердечных сокращений у грызунов. Есть несколько методик, которые используются для измерения артериального давления и частоты сердечных сокращений у крыс, они включают неинвазивные хвост манжеты методологии, процедур и радиотелеметрии прямой постоянных катетеров. Каждый метод имеет свои преимущества и недостатки, которые подробно описаны в других публикациях. Пребывающего заполненные жидкостью катетеры могут быть имплантированы в несколько артерий в крысу. Бедренная артерия является лишь одним из артерии, которая может быть использована для этой меры. Для артериального давления / сердце меры скорости, дистального конца катетера соединен с калиброванный датчик давления. Катетер может быть размещен в защитной весной, что связано с поворотным чтобы позволить свободное движение животного, либо прикреплен к кнопке хирургическойКэлли имплантируют животному. Постоянных катетеров имеют то преимущество, минимизируя длительного стресса на животных 17,18. Кроме того материалы недороги, калибровка легко давление мер и непрерывного долгосрочные меры могут быть получены в условиях относительно низкого напряжения для многих недель 19. Мы были бы упущением, если бы мы не упомянули, что Есть недостатки этой техники, в том числе, это хирургическим путем инвазивной техники, поддержание катетер, необходимые для поддержания проходимости, повреждение артерии из-за имплантации катетера и Потенциал инфекции, чтобы назвать несколько.
Для хронического меры артериального давления прямого записи с хронически-имплантированных артериальных катетеров более технически сложными, но являются более точными, и может быть сделано непрерывно, не нарушая животного. Хвост-манжета измерения менее точны, однако они не требуют хирургического вмешательства, а также может повторитьиздание Хвост-манжета методики требуют обработки, а также нагрев животных, чтобы расширить хвост судов для облегчения обнаружения импульса 20. Обращение и добавил тепловой стресс может влиять на измерения артериального давления, таким образом, не являющихся действительно точные меры. Более того, без прямой хвост манжеты метод не позволяет легко одновременного забора крови или введения препарата.
Дополнительный метод, по которому прямое измерение может быть достигнуто использованием телеметрической методологии. Телеметрия позволяет получать высококачественные записи артериального давления (и другие меры) непрерывно в течение длительного периода времени в сознательном свободно движущихся животных без ограничений или анестетики 18. Тем не менее, устройств телеметрии в то время как идеальный стоят очень дорого. По сравнению с телеметрией, катетеризация преимущества включают: снижение "установки" и эксплуатационные расходы, возможность легко управлять средствами и легко взять образцы крови у бодрствующих свободно движущихся животных. Administratионных наркотиков и веществ, а также получение образцов крови от исследования животных может быть сделано в то время как минимально тревожным животным, таким образом минимизируя нагрузку на животных и позволяет более точно измерить.
Раскрытие информации
Производство и свободного доступа этого видео-статью спонсируется ADInstruments.
Благодарности
Авторы хотели бы выразить признательность д-р Эндрю Кинг, кандидатских и Катрина Кинга за вклад иллюстраций. NIH грант: R00HL087927.
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Тип | Компания | Номер в каталоге |
| Артериальная катетер | Потребляемый | ГАИ Инфузионные | RFA-01 |
| Венозного катетера | Потребляемый | Научно товаров, Inc | BB518-20 и BB31785-V / 2 |
| 27 г 1 / 2 "тупой иглой | Оборудование | Комплексная дозирования Solutions, Inc | 9991113 |
| 23г 1 / 2 "тупой иглой | Оборудование | Комплексная дозирования Solutions, Inc | 9991109 |
| PowerLab/8SP | Оборудование | ADInstruments | w.adinstruments.com/products/hardware/research/product/PL3508 / "целевых =" _blank "> ML765 |
| Четыре моста | Оборудование | ADInstruments | ML118 |
| LabChart 7,2 | Программное обеспечение | ADInstruments | |
| ВР преобразователь с краном и кабельного | Оборудование | ADInstruments | MLT844 |
| Одноместный поворотный канал | Оборудование | Instech | 375/22PS |
| Одноосный-Counter Баланс шарнирное крепление | Оборудование | Instech | CM375BP |
| Covance Инфузионные Harness | Оборудование | Instech | CIH105 |
| Настольная изофлюрана Группа Анестезия | Оборудование | Protech International, Inc | 61020 |
| Маска грызунов Анестезия | Оборудование | Protech International, Inc | RAM-02 |
| Палата грызунов Индукционная | Оборудование | Protech International, Inc | RIC-01 |
| Анестезия газовый фильтр канистра | Оборудование | Protech Международногодр., Inc | 80120 |
| Настольная ламинарного потока Гуда | Оборудование | Sentry Air Systems, Inc | SS-200-WSL |
| Остер Золотой A5 | Оборудование | Остер Профессиональное оборудование | 78005-140 |
| Волоконно-оптический свет с двойным Руководство гусиной шее | Оборудование | LW Научные, Inc | МБА-1502-DGG1 |
| Deltaphase Изотермические Pad | Оборудование | Braintree Научные | 39DP |
| Хлопок-чаевые Аппликаторы | Потребляемый | Солон Manufacturing Company | 36200 |
| Марлевые губки 2 "х2" | Потребляемый | Кендалл пасности | 2146 |
| 5-0 Нейлон Шовный | Потребляемый | Ethicon | 661G |
| 4-0 Шовный Шелкового | Потребляемый | Deknatel | 8-S, 136075-0208 |
| Ткань Клей | Потребляемый | 3М | 1469SB |
| Splinter & Фиксация Пинцет | Оборудование | Джордж Тиманн & компании | 160-55 |
| Пинцет Студенческая тканей | Оборудование | Инструменты изобразительных наук, Inc | 91121-12 |
| Micro Пинцет / Пинцет Bracken | Оборудование | Джордж Тиманн & компании | 10-1942 |
| Ультра тонкие щипцы Грефе | Оборудование | Инструменты изобразительных наук, Inc | 11152-10 |
| Олсен-Хегар иглодержатель | Оборудование | Инструменты изобразительных наук, Inc | 12002-12 |
| Студенческая Halsted-Mosquito Hemostat | Оборудование | Инструменты изобразительных наук, Inc | 91308-12 |
| Рочестер Pean группур | Оборудование | Биомедицинских исследований Instruments, Inc | 31-1640 |
| Студенческая Хирургические ножницы | Оборудование | Инструменты изобразительных наук, Inc | 91402-12 |
| Дюмон Пинцет | Оборудование | Инструменты изобразительных наук, Inc | 11251-35 |
| Micro Пройдя Ножницы | Оборудование | Джордж Тиманн & компании | 160-210 |
| Косоглазие Ножницы | Оборудование | Инструменты изобразительных наук, Inc | 14075-11 |
| Хартман Hemostat | Оборудование | Инструменты изобразительных наук, Inc | 13003-10 |
| Ткань Ножницы | Оборудование | Джордж Тиманн & компании | 160-150 |
| Ретрактор | Оборудование | Сшитое |
Ссылки
- Tabata, Y., Chang, T. M. Intermittent vascular access for extracorporeal circulation in conscious rats: a new technique. Artif. Organs. 6, 213-215 (1982).
- Chester, J. F., Weitzman, S. A., Malt, R. A. Implantable device for drug delivery and blood sampling in the rat. J. Appl. Physiol. 59, 1665-1666 (1985).
- Koeslag, D., Humphreys, A. S., Russell, J. C. A technique for long-term venous cannulation in rats. J. Appl. Physiol. 57, 1594-1596 (1984).
- Hall, R. I., Ross, L. H., Bozovic, M., Grant, J. P. A simple method of obtaining repeated venous blood samples from the conscious rat. J. Surg. Res. 36, 92-95 (1984).
- Burt, M. E., Arbeit, J., Brennan, M. F. Chronic arterial and venous access in the unrestrained rat. Am. J. Physiol. 238, H599-H603 (1980).
- Cocchetto, D. M., Bjornsson, T. D. Methods for vascular access and collection of body fluids from the laboratory rat. J. Pharm. Sci. 72, 465-492 (1983).
- Rigalli, A., E, D. L. V. . Experimental surgical models in the laboratory rat. , (2009).
- Waynforth, H. B. . F.P.A. Experimental and surgical tehcnique in the rat. , (2007).
- Yoburn, B. C., Morales, R., Inturrisi, C. E. Chronic vascular catheterization in the rat: comparison of three techniques. Physiol. Behav. 33, 89-94 (1984).
- Staub, J. F., Coutris, G. A technique for multiple, high-rate blood samplings via an external cannula in rats. J. Appl. Physiol. 46, 197-199 (1979).
- Steffens, A. B. A method for frequent sampling of blood and continuous infusion of fluids in the rat without disturbing the animal. Physiol. Behav. 4, 833-836 (1969).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain. Res. Brain. Res. Protoc. 10, 84-94 (2002).
- Vahl, T. P. Comparative analysis of ACTH and corticosterone sampling methods in rats. Am. J. Physiol. Endocrinol. Metab. 289, E823-E828 (2005).
- Buhler, H. U., da Prada, M., Haefely, W., Picotti, G. B. Plasma adrenaline, noradrenaline and dopamine in man and different animal species. J. Physiol. 276, 311-320 (1978).
- Fagin, K. D., Shinsako, J., Dallman, M. F. Effects of housing and chronic cannulation on plasma ACTH and corticosterone in the rat. Am. J. Physiol. 245, E515-E520 (1983).
- Ling, S., Jamali, F. Effect of cannulation surgery and restraint stress on the plasma corticosterone concentration in the rat: application of an improved corticosterone HPLC assay. J. Pharm. Pharm. Sci. 6, 246-251 (2003).
- Fink, G. D., Bryan, W. J., Mann, M., Osborn, J., Werber, A. Continuous blood pressure measurement in rats with aortic baroreceptor deafferentation. Am. J. Physiol. 241, H268-H272 (1981).
- Van Vliet, B. N., Chafe, L. L., Antic, V., Schnyder-Candrian, S., Montani, J. P. Direct and indirect methods used to study arterial blood pressure. J. Pharmacol. Toxicol Methods. 44, 361-373 (2000).
- Wang, J., Tempini, A., Schnyder, B., Montani, J. P. Regulation of blood pressure during long-term ouabain infusion in Long-Evans rats. Am. J. Hypertens. 12, 423-426 (1999).
- Bunag, R. D. Facts and fallacies about measuring blood pressure in rats. Clin. Exp. Hypertens. A. 5, 1659-1681 (1983).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены