Method Article
Cateterismo arterial e venoso femoral para coleta de sangue, Drug Administration e Pressão Arterial Consciente e Medidas de freqüência cardíaca
Neste Artigo
Resumo
Cateterização crônica dos vasos sangüíneos no rato é muitas vezes necessária para a administração de substâncias, obter amostra de sangue durante um período de tempo ou para medições de pressão direta consciente sangue. Cateterismo arterial femoral do rato e medidas correspondentes da pressão arterial em que o animal consciente será demonstrado.
Resumo
Em vários campos de estudo, o acesso ao sistema circulatório em estudos de laboratório é necessário. Estudos farmacológicos em ratos usando cateteres implantados cronicamente permitir uma pesquisadora para efetivamente administrar substâncias e humanamente, realizar coleta de sangue repetidas e auxilia na consciência medições diretas da pressão arterial e freqüência cardíaca. Uma vez que o cateter é implantado de amostragem a longo prazo é possível. Vida e permeabilidade do cateter depende de múltiplos factores, incluindo a solução de bloqueio utilizado, o esquema de lavagem e material do cateter. Este vídeo vai demonstrar a metodologia da artéria femoral e cateterização venosa do rato. Além disso, o vídeo vai demonstrar o uso do cateter venoso femoral e arterial para coleta de sangue, administração de drogas e uso do cateter arterial em tomar medidas de pressão arterial e frequência cardíaca em ratos conscientes livremente em movimento. A corda e aproveitar ligado a um sistema giratório vai permitir que o animal a ser houtilizados e têm amostras colhidas pelo pesquisador com o mínimo de interrupção para o animal. Para manter a permeabilidade do cateter, manutenção diária cuidadosa do cateter é necessário utilizando solução de bloqueio (100 U / ml solução salina heparinizada), máquina de terra sem corte agulhas de seringa ponta ea utilização de filtros de seringa para minimizar a contaminação potencial. Com o cuidado de assepsia técnicas cirúrgicas, materiais de cateteres e técnicas adequadas de manutenção cuidadosa do cateter, é possível sustentar cateteres de patentes e os animais saudáveis por longos períodos de tempo (várias semanas).
Protocolo
1. Antes de iniciar Procedimento Cirúrgico
Nota: Antes de começar qualquer procedimento animais garantir que você tenha obtido a permissão apropriada através da sua instituição / organização. Tal como acontece com todas as cirurgias de sobrevivência, certifique-se que a cirurgia é realizada sob condições estéreis ea medicação para a dor e antibióticos apropriados necessários são usados para um bom resultado.
- Antes de iniciar o procedimento de cateterismo avaliar os cateteres por rubor-los com soro fisiológico estéril para assegurar que são patentes.
- Anestesiar o rato.
- Prepare o rato para o procedimento cirúrgico.
- Raspar os pêlos das regiões cirúrgicos, que incluem a parte de trás do pescoço (entre as omoplatas) e na região da perna interior.
- Betadine e usando um matagal etanol 70%, respectivamente, esfrega as regiões raspada cirúrgica começando no centro e fazer uma varredura para fora circular. Repetir3 vezes para cada região, terminando com uma limpeza final com etanol 70%.
- Colocar o animal em uma superfície estéril e drape lugar estéril sobre áreas cirúrgicas. (O uso de Press-n-Seal é um draping ideal cirúrgico permitindo que o investigador para monitorar o animal durante todo o procedimento.)
- Garantir que todos os instrumentos cirúrgicos para o procedimento cirúrgico ter sido esterilizados.
2. Preparação de áreas cirúrgicas para colocação do cateter
- Com o rato, que prona (em seu estômago), fazer cerca de uma polegada e meia (12 mm) incisão horizontal na parte de trás do pescoço ao nível das escápulas com tesoura ou um bisturi, então blunt dissecar um subcutânea "de bolso" em parte de trás aproximadamente o tamanho de um quarto. Este será utilizado como uma área para colocar uma pequena quantidade de tubulação que irá compensar o crescimento dos animais e / ou movimento, ou seja, para que o cateter não é puxado e, portanto, sobre removido da artéria era lugard polegadas (Alternativamente, esta etapa pode ser realizada imediatamente antes do túnel do cateter.)
- Coloque o rato sobre suas costas (decúbito dorsal) e fazer uma incisão na região inguinal [aproximada ½ incisão (12 mm) polegadas ao longo do ângulo natural da perna.
- Blunt dissecar para separar o tecido conjuntivo (Figura 1) (pode usar blunt-ponta tesoura, hemostats, cotonetes, etc) (em geral, mantendo o blunt tesouras com ponta e / ou cotonetes em um ângulo de 45 graus o que garante a fácil localização da região de interesse) até a artéria ea veia femoral estão expostos.
- A veia é vermelho escuro na cor e na artéria é mais clara e mais brilhante do que a veia. O nervo que corre ao longo da artéria é esbranquiçada no tom.
- Blunt dissecar na região das pernas para fazer uma pequena região aberta abaixo da pele (bolso ou seja, aproximadamente o tamanho de um quarto) ao longo do interior da perna para a colocação de uma pequena seção do cateterismor (mais uma vez de levar em conta o movimento de animais e de crescimento do animal, se a colocação crônica).
- Coloque os afastadores na área da incisão para que você possa ver a plena artéria e veia.
- Usando uma pinça de ponta fina suavemente separar o nervo (de cor esbranquiçada), que é ao longo da artéria femoral longe da artéria e veia. (Figura 2) Tenha cuidado para não cortar ou danificar o nervo.
- Separado da artéria e veia como uma unidade, tentando expor um comprimento de cerca de ¼ polegada seção (mm 5-7) da artéria / veia.
- Repita o processo em separar a veia da artéria. Mantenha seus instrumentos cirúrgicos (pinça ponta fina ie) perpendicular aos vasos e separar os vasos em paralelo. Isso ajuda a evitar rasgar, picar ou danificar os vasos. Ao colocar a pinça de ponta fina suavemente entre a artéria e veia por baixo e, lentamente, abrindo a pinça e repetir isso, você irá lentamente separam os navios. Nota: se você fizer lágrima ou observar algunssangramento use um cotonete estéril e / ou 2 x 2 gaze e uma pressão sobre a área até que o sangramento parou, em seguida, continuar com a cirurgia.
3. Tunelização do cateter
- Salina estéril embebido lugar 2 x 2 gaze sobre a incisão e virar o animal ao seu estômago.
- Coloque o Rochester Pean fórceps (uma pinça longa reta) na incisão na parte de trás que foi feito anteriormente e orientar a fórceps por via subcutânea nas costas ao nível dos quadris [assegurar as pontas dos hemostats são apontados para cima, não (para a coluna ) para evitar ferir a medula espinhal]. Aproximadamente na região do quadril por sua vez a ponta hemostat para a incisão que foi feita na região da perna e empurre a ponta da hemostats fora da incisão perna preparado.
- Gentilmente segure o fim dos cateteres (não o final, que será inserido na artéria / veia) com a pinça e puxe os cateteres através da cavidade que foi feitoe, finalmente, a incisão no pescoço.
- Coloque a seringa agulha apropriada ponta embotada preenchido com Heparina 20 U / ml / salina na extremidade dos cateteres respectivos e preencher os cateteres (garantir que não há bolhas de ar) com o heparinizado / salina. Mais uma vez verificar que os cateteres são patentes e nenhum dano chegou à cateteres. Deixe as seringas anexado ao final das linhas de cateter para garantir que nenhum ar é capaz de entrar em linhas de cateter e transformar o rato sobre suas costas, mais uma vez.
4. Inserindo os cateteres na veia femoral e da artéria (Figura 3)
- Coloque um pedaço dobrado de 4,0 estéril seda / thread sob a veia femoral e depois cortar a seda no final dobrado. Haverá agora dois pedaços de seda sob a veia. Ou, em alternativa, coloque 2 peças de 4,0 seda sob a veia individualmente.
- Separar os de seda que você colocou sob a veia, uma peça para a perna (extremidade distal) eo outro para o corpo. Tou seja, uma ligadura frouxa no lado mais próximo ao corpo, em seguida, usando hemostats pequenos, segure e puxe a seda ensinou, mas não apertar o nó. Puxe o outro pedaço de seda, tanto quanto possível para a perna (extremidade distal) e amarrar este com um nó triplo, segure a seda com hemostats pequenos e puxe ensinado. Este método permitirá que a veia se encher de sangue, tornando mais fácil para fazer a incisão que é exigido para a inserção do cateter (passo 4).
- Colocar 1-2 gotas de lidocaína para a veia.
- Usando o Vanna micro-dissecar tesoura, faça uma pequena incisão na veia, aproximadamente ¼ através de e em um ângulo de 45 graus.
- Coloque uma pinça de ponta fina (45 fórceps) na incisão e usando um par de fórceps; cuidado alimentar no cateter da veia. Abra cuidadosamente a forceps que são colocados na veia, pois isso permitirá ao pesquisador posicionar o cateter venoso sob a fórceps e na veia.
- Quando o cateter está totalmente inserido (adex. Centímetros 6-7) (ao fazer o cateter uma marca é colocado no cateter para ajudar o cirurgião na identificação quando o cateter está totalmente inserido) (isto coloca o cateter venoso em veia cava abdominal), aperte a ligadura da veia anterior em torno de e cateter, dando um nó triplo (garantir que não é a oclusão da veia). Use o fio de seda perto da perna (ligadura posterior) para novamente garantir o cateter (nó triplo) e assegurar a colocação. Lentamente, chamar de volta a seringa até que haja um pouco de sangue visível no cateter, que ajuda a garantir que os nós de sutura não estão muito apertadas e que o cateter é funcional. Após a verificação, o êmbolo até que o sangue não é mais visível no cateter.
Nota: é possível inserir dois cateteres na veia femoral, se necessário. - Repita os passos 9-13 para colocar um cateter na artéria femoral com as seguintes exceções:
- Amarrar o mais próximo de seda para a perna (posterior) com um nó triplo e puxe taught antes de amarrar a ligadura soltos perto do corpo (anterior) antes de fazer a incisão para a colocação do cateter. Isto permitirá que a artéria se encha de sangue tornando-o mais fácil de cortar. Garantir a sutura proximal é puxado ensinou a oclusão da artéria antes de cortar a artéria. Isso irá evitar a perda de sangue quando o corte é feito.
- Inserção do cateter arterial aproximadamente 5 cm da artéria femoral (que coloca o cateter na aorta abdominal).
- Ao fixar o cateter com a sutura, certifique-se a sutura não é muito apertado e oclusão do cateter.
5. Cirúrgica Encerramento
- Faça um centavo para fazer um loop tamanho trimestre em cateteres e coloque no interior da perna (o loop deve caber na área, que foi contundente dissecados anterior). Depois de colocar dois cateteres, prenda-os com 1-2 pontos de sutura cirúrgica 5,0 na camada muscular.
- Fechar a incisão com 4,0 Ethilon com os não-contínua sutures.
- Vire o rato em seu estômago e fazer outro ciclo no cateteres sobre o tamanho do quarto e colocar no bolso dissecados nas costas. Fechar a incisão com sutura.
- Usando uma gota de vetbond, segura os cateteres nas costas.
- Prenda o cateter próximo à incisão de volta com hemostats acolchoadas e remover as seringas a partir das extremidades.
- Fit o rato com uma jaqueta tether tipo, boné dos cateteres (para manter o bloqueio de heparina), e remover o hemostats acolchoada.
- Para manutenção a longo prazo substituir solução salina com cateter 20 heparina U / ml / salina.
6. Manutenção do cateter (luvas estéreis deve ser usado durante o procedimento)
- Braçadeira do cateter com uma pinça almofadada.
- Remova o plugue do cateter.
- Coloque uma seringa sem corte com solução de bloqueio para o cateter.
- Liberação do fórceps.
- Preencher o cateter com a solução de bloqueio (volume é pré-determined-tipicamente 0,3 ml).
- Prenda o cateter ao liberar para evitar qualquer refluxo de sangue para a ponta do cateter e retire a seringa.
- Recoloque o plugue do cateter.
- Unclamp a pinça e empurre o plug-in um pouco de sangue para garantir que não está na ponta do cateter.
7. Amostragem de sangue (luvas estéreis deve ser usado durante o procedimento)
Braçadeira do cateter com uma pinça almofadada.
- Remova o plugue do cateter.
- Retire lentamente solução de bloqueio usando uma seringa sem corte e descarte.
- Anexar seringa de amostragem para o cateter e, lentamente, retirar a amostra.
- Braçadeira do cateter com uma pinça almofadada e coloque uma seringa com solução de bloqueio para o cateter e re-encher o cateter com a solução de bloqueio.
- Prenda o cateter enquanto re-encher o cateter com a solução.
- Re-insira a ficha do cateter.
- Remova a pinça almofadada e empurre t ele ligar um pouco mais.
8. Infusão de drogas
- Braçadeira do cateter com uma pinça almofadada.
- Remova o plugue do cateter.
- Retire lentamente solução de bloqueio usando uma seringa sem corte e descarte.
- Anexar seringa cheia de drogas para o cateter e infundir a substância no animal.
- pode-se usar uma torneira de 3 vias, bem como um intermediário se múltiplas injeções são necessárias, exigindo assim menos fluido de infusão para o animal.
- um também pode anexar uma bomba de seringa de infusão constante com um filtro estéril para infusão contínua.
- Braçadeira com uma pinça almofadada e coloque uma seringa com solução de bloqueio para o cateter e re-encher o cateter com a solução de bloqueio.
- Prenda o cateter enquanto re-encher o cateter com a solução.
- Re-insira a ficha do cateter.
- Remova a pinça almofadada e empurre o plug-in um pouco mais.
- Prenda o cateter arterial com uma pinça almofadada e retire o plugue do cateter.
- Anexar a linha arterial para o transdutor de pressão.
- Siga as instruções do fabricante para usar o software para a coleta de pressão arterial.
- Na conclusão do período de monitoramento da pressão arterial, usando uma pinça almofadada braçadeira do cateter e desconectar-se do transdutor.
- Lave o cateter com a solução de bloqueio e substituir a ficha cateter como descrito acima.
10. Resultados representante
A medida da pressão arterial representante foi retirado de um animal consciente movimentando-se livremente e é apresentado na Figura 4. Fenilefrina (3 ug / kg, iv), um agonista dos receptores alfa 1 adrenérgicos, foi administrado para a linha de veia femoral para aumentar a pressão arterial e, simultaneamente, medir a pressão arterial a partir da linha femoral arterial. Fentolamina (4 mg / kg, iv),um antagonista alfa-adrenérgico não seletivo, foi então administrado para reduzir a pressão arterial.

Figura 1. Dissecção do tecido. Com o rato em suas costas, você terá feito cerca de uma polegada e meia (12 mm) incisão sobre o ângulo da perna e usando uma tesoura sem corte ou sem corte hemostats você vai dissecar o tecido conjuntivo para expor a artéria ea veia femoral.
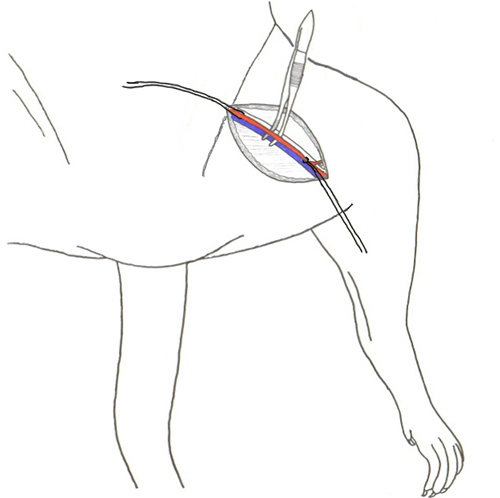
Figura 2. Separação da artéria femoral e da veia do tecido conjuntivo.

Figura 3. Colocação do cateter. Vanna usando micro-tesouras de dissecação lugar de uma pequena incisão de aproximadamente ¼ do caminho o navio em um ângulo de 45 graus (em cima) e coloque uma pinça de ponta fina em diaincisão e e usando um par de pinças de alimentação do cateter dentro do vaso (meio). Por último, após a conclusão da colocação do cateter de sutura do cateter no lugar (abaixo).
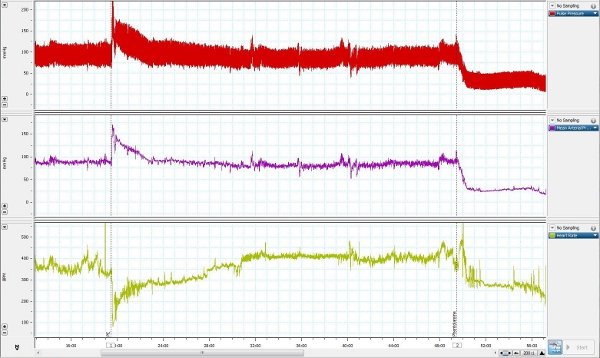
Figura 4. Medir a pressão Representante de sangue retiradas de um animal consciente movimentando-se livremente.
Discussão
Arterial e cateterização da veia têm sido historicamente usado para forma aguda e crônica monitor de pressão arterial amostra de sangue, e fornecer substâncias no modelo experimental de ratos animais 1-4. Uma grande vantagem destes instrumentações cirúrgico é que ele permite que os procedimentos de monitoramento, incluindo, o sangue a administração da droga de amostragem e monitorização da pressão arterial, a ser realizado com perturbações mínimas e / ou estresse para o animal 1. Numerosos investigadores escreveram protocolos e têm metodologias específicas pelas quais seu laboratório realiza o procedimento cirúrgico 5-8. O vídeo e ilustrações demonstrar o que o nosso laboratório tem encontrado para ser bem sucedido no que diz respeito ao arterial femoral e procedimento de cateterização venosa.
Ratos são comumente usados em laboratório para uma multidão de estudos científicos, devido ao seu pequeno tamanho e comodidade no manuseio. Há vários locais onde uma crônicacateter pode ser colocado dentro de um animal, incluindo a veia jugular, aorta abdominal, artéria carótida e da artéria femoral, para citar alguns. A localização rat femoral para os resultados do cateterismo crônica em aumento do tempo de permeabilidade do cateter e teve a recuperação mais rápida do pré-cirúrgica peso do animal em comparação com outros locais cateter 9.
Numerosos investigadores têm usado cateteres para coleta de sangue aguda e crónica 1-5,11-13. Em muitos estudos de sangue são necessários vários empates de um animal e canulação externo / cateterismo é uma metodologia que é vantajoso devido à sua natureza não-traumática, além disso ele pode ser feito enquanto o animal estiver consciente, portanto, não está limitado pelos efeitos de anestésicos e também o animal pode ser livremente mover 1,10. O melhor método pelo qual a obter amostras de sangue e para medir os hormônios do estresse em roedores tem sido debatido por muito tempo 6,13. Com relação à farmacocinética studies, o cateterismo do animal permite a pesquisa de amostragem de sangue repetidas com restrição mínima ao utilizar um sistema de cateter implantado cronicamente. Além disso, estudos têm demonstrado redução da concentração basal de adrenalina, noradrenalina e dopamina no plasma de ratos movimentando-se livremente (cateter jugular) em comparação com animais que foram tratados (30 segundos) e ou restringido (5 minutos) 14. Um método adicional pelo qual a discernir aumentos do estresse é através da medição dos níveis plasmáticos de corticosterona. Anteriormente, foi sugerido que, mesmo após 3-4 dias de tempo de recuperação cirúrgica que os níveis plasmáticos de corticosterona foram elevadas no rato crônica canulados 15. No entanto, as recentes melhorias na metodologia determinaram que não há diferenças nos níveis plasmáticos de corticosterona base nos ratos veia jugular canulada em comparação com ratos não canulados 16. Além disso, HPLC metodologia para análise de corticosterona também revelou que corticóidesuma níveis são elevados por estresse restrição, no entanto, estável após cateterismo jugular 16.
Um uso adicional de cateterismo crônica é a medição da pressão arterial e freqüência cardíaca em roedores. Há várias metodologias que são utilizadas para medir a pressão arterial e frequência cardíaca em ratos, que incluem a não-invasivo metodologias tail cuff, os procedimentos de radiotelemetria e direta algaliação. Cada método tem suas vantagens e desvantagens, que são descritos em detalhes em outras publicações. Habitação cheias de líquido cateteres podem ser implantados em múltiplas artérias dentro do rato. A artéria femoral é apenas uma artéria que pode ser utilizado para esta medida. Para as medidas da pressão arterial / freqüência cardíaca, a extremidade distal do cateter é conectado a um transdutor de pressão calibrada. O cateter pode ser abrigado em uma mola de proteção que está ligado a um suporte giratório para permitir a livre circulação do animal, ou ligado a uma Surgi botãocamente implantado para o animal. Algaliação têm a vantagem de minimizar o estresse de longo prazo sobre o animal 17,18. Além disso, os materiais são baratos, a calibração é fácil para medidas de pressão e contínua medidas a longo prazo podem ser obtidos em condições de estresse relativamente baixa por semanas numerosas 19. Seríamos negligentes se não mencionar que existem desvantagens para esta técnica, inclusive, é uma técnica cirúrgica invasiva, a manutenção do cateter é necessária para manter a permeabilidade danos, à artéria devido à implantação do cateter ea potencial de infecção para citar alguns.
Para as medidas de gravações crônica da pressão arterial direta de cronicamente implantados cateteres arteriais são mais tecnicamente desafiador, mas são mais precisos e pode ser feito continuamente, sem perturbar o animal. Cauda-manguito medições são menos precisos, porém eles não necessitam de cirurgia e também pode ser repetidaed. Cauda-manguito metodologias exigem manipulação, além de aquecimento do animal para dilatar os vasos da cauda para facilitar a detecção do pulso 20. Manuseio e estresse por calor adicionado pode afetar medidas de pressão arterial, portanto, não prevê medidas verdadeiramente precisa. Além disso, o não-direta método cauda-manguito não permite coleta de sangue fácil simultânea ou administração da droga.
Um método adicional pelo qual medida direta pode ser alcançado é utilizando a metodologia de telemetria. Telemetria permite gravações de alta qualidade da pressão arterial (e outras medidas) continuamente por longos períodos de tempo no consciente animais movimentando-se livremente sem restrições ou anestésicos 18. No entanto, dispositivos de telemetria, enquanto ideal são muito dispendiosos. Quando comparado com a telemetria, os benefícios do cateterismo são: diminuição da "setup" e os custos operacionais, a capacidade de facilmente administrar drogas e facilmente tirar amostras de sangue em animais conscientes movimentando-se livremente. O administradoion de drogas e substâncias, e obtenção de amostras de sangue do animal de pesquisa pode ser feito enquanto minimamente perturbar o animal, minimizando o estresse para o animal e permitindo uma medida mais exata.
Divulgações
Produção e acesso gratuito deste vídeo-artigo é patrocinado pela ADInstruments.
Agradecimentos
Os autores gostariam de agradecer o Dr. Andrew King, PhD e Katrina King for a contribuição das ilustrações. NIH concede: R00HL087927.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Tipo | Companhia | Número de catálogo |
| Cateter arterial | Consumível | SAI Infusion | RFA-01 |
| Cateter Venoso | Consumível | Commodities Scientific, Inc. | BB518-20 & BB31785-V / 2 |
| 27g 1 / 2 "Needle Blunt | Equipamento | Integrada Dispensing Solutions, Inc. | 9991113 |
| 23g 1 / 2 "Needle Blunt | Equipamento | Integrada Dispensing Solutions, Inc. | 9991109 |
| PowerLab/8SP | Equipamento | ADInstruments | w.adinstruments.com/products/hardware/research/product/PL3508 / "target =" _blank "> ML765 |
| Quad Ponte | Equipamento | ADInstruments | ML118 |
| LabChart 7,2 | Software | ADInstruments | |
| BP Transdutor com torneira & Cable | Equipamento | ADInstruments | MLT844 |
| Swivel Canal único | Equipamento | Instech | 375/22PS |
| Balanço do Eixo-Counter única Swivel Mount | Equipamento | Instech | CM375BP |
| Covance Harness Infusion | Equipamento | Instech | CIH105 |
| Tabela Unidade de Anestesia Top isoflurano | Equipamento | Protech International, Inc. | 61020 |
| Máscara de Anestesia de roedores | Equipamento | Protech International, Inc. | RAM-02 |
| Câmara de Indução de roedores | Equipamento | Protech International, Inc. | RIC-01 |
| Canister anestesia Gás Filtro | Equipamento | Protech Internacionalal, Inc. | 80120 |
| Tabletop capela de fluxo laminar | Equipamento | Sentry Air Systems, Inc. | SS-200-WSL |
| Oster A5 Ouro | Equipamento | Oster Professional Products | 78005-140 |
| Luz de fibra óptica com Guia Gooseneck dupla | Equipamento | LW Scientific, Inc. | ILL-1502-DGG1 |
| Deltaphase Pad isotérmico | Equipamento | Braintree Scientific | 39DP |
| Com ponta de algodão Aplicadores | Consumível | Solon Manufacturing Company | 36200 |
| Esponjas de gaze 2 "x2" | Consumível | Rança Kendall | 2146 |
| Náilon 5-0 | Consumível | Ethicon | 661G |
| Sutura de seda 4-0 | Consumível | DekNatel | 8-S, 136075-0208 |
| Adesivo tecido | Consumível | 3M | 1469SB |
| Splinter & Fixação Pinças | Equipamento | George Tiemann & Company | 160-55 |
| Tissue Forceps estudante | Equipamento | Belas Ciência Tools, Inc. | 91121-12 |
| Micro Pinça / Bracken Pinça | Equipamento | George Tiemann & Company | 10-1942 |
| Extra Fine Pinça Graefe | Equipamento | Belas Ciência Tools, Inc. | 11152-10 |
| Olsen-Hegar Porta Agulha | Equipamento | Belas Ciência Tools, Inc. | 12002-12 |
| Estudante de pinça hemostática Halsted-Mosquito | Equipamento | Belas Ciência Tools, Inc. | 91308-12 |
| Rochester Pean Forçap | Equipamento | Biomedical Research Instruments, Inc. | 31-1640 |
| Tesoura Cirúrgica estudante | Equipamento | Belas Ciência Tools, Inc. | 91402-12 |
| Pinça Dumont | Equipamento | Belas Ciência Tools, Inc. | 11251-35 |
| Micro Tesoura Dissecting | Equipamento | George Tiemann & Company | 160-210 |
| Tesoura estrabismo | Equipamento | Belas Ciência Tools, Inc. | 14075-11 |
| Hemostat Hartman | Equipamento | Belas Ciência Tools, Inc. | 13003-10 |
| Tesoura de tecido | Equipamento | George Tiemann & Company | 160-150 |
| Retrator | Equipamento | Custom Made |
Referências
- Tabata, Y., Chang, T. M. Intermittent vascular access for extracorporeal circulation in conscious rats: a new technique. Artif. Organs. 6, 213-215 (1982).
- Chester, J. F., Weitzman, S. A., Malt, R. A. Implantable device for drug delivery and blood sampling in the rat. J. Appl. Physiol. 59, 1665-1666 (1985).
- Koeslag, D., Humphreys, A. S., Russell, J. C. A technique for long-term venous cannulation in rats. J. Appl. Physiol. 57, 1594-1596 (1984).
- Hall, R. I., Ross, L. H., Bozovic, M., Grant, J. P. A simple method of obtaining repeated venous blood samples from the conscious rat. J. Surg. Res. 36, 92-95 (1984).
- Burt, M. E., Arbeit, J., Brennan, M. F. Chronic arterial and venous access in the unrestrained rat. Am. J. Physiol. 238, H599-H603 (1980).
- Cocchetto, D. M., Bjornsson, T. D. Methods for vascular access and collection of body fluids from the laboratory rat. J. Pharm. Sci. 72, 465-492 (1983).
- Rigalli, A., E, D. L. V. . Experimental surgical models in the laboratory rat. , (2009).
- Waynforth, H. B. . F.P.A. Experimental and surgical tehcnique in the rat. , (2007).
- Yoburn, B. C., Morales, R., Inturrisi, C. E. Chronic vascular catheterization in the rat: comparison of three techniques. Physiol. Behav. 33, 89-94 (1984).
- Staub, J. F., Coutris, G. A technique for multiple, high-rate blood samplings via an external cannula in rats. J. Appl. Physiol. 46, 197-199 (1979).
- Steffens, A. B. A method for frequent sampling of blood and continuous infusion of fluids in the rat without disturbing the animal. Physiol. Behav. 4, 833-836 (1969).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain. Res. Brain. Res. Protoc. 10, 84-94 (2002).
- Vahl, T. P. Comparative analysis of ACTH and corticosterone sampling methods in rats. Am. J. Physiol. Endocrinol. Metab. 289, E823-E828 (2005).
- Buhler, H. U., da Prada, M., Haefely, W., Picotti, G. B. Plasma adrenaline, noradrenaline and dopamine in man and different animal species. J. Physiol. 276, 311-320 (1978).
- Fagin, K. D., Shinsako, J., Dallman, M. F. Effects of housing and chronic cannulation on plasma ACTH and corticosterone in the rat. Am. J. Physiol. 245, E515-E520 (1983).
- Ling, S., Jamali, F. Effect of cannulation surgery and restraint stress on the plasma corticosterone concentration in the rat: application of an improved corticosterone HPLC assay. J. Pharm. Pharm. Sci. 6, 246-251 (2003).
- Fink, G. D., Bryan, W. J., Mann, M., Osborn, J., Werber, A. Continuous blood pressure measurement in rats with aortic baroreceptor deafferentation. Am. J. Physiol. 241, H268-H272 (1981).
- Van Vliet, B. N., Chafe, L. L., Antic, V., Schnyder-Candrian, S., Montani, J. P. Direct and indirect methods used to study arterial blood pressure. J. Pharmacol. Toxicol Methods. 44, 361-373 (2000).
- Wang, J., Tempini, A., Schnyder, B., Montani, J. P. Regulation of blood pressure during long-term ouabain infusion in Long-Evans rats. Am. J. Hypertens. 12, 423-426 (1999).
- Bunag, R. D. Facts and fallacies about measuring blood pressure in rats. Clin. Exp. Hypertens. A. 5, 1659-1681 (1983).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados