Method Article
Femoral arterielle und venöse Katheterisierung zur Blutentnahme, Drug Administration und Conscious Blutdruck und Herzfrequenz-Messungen
In diesem Artikel
Zusammenfassung
Chronische Katheterisierung von Blutgefäßen in der Ratte ist oft für die Verwaltung von Stoffen erforderlich, erhalten Blutprobe über einen Zeitraum oder für den direkten bewussten Blutdruckmessungen. Femoralarterie Katheterisierung der Ratte und entsprechende Messungen des Blutdrucks in der bewussten Tier nachgewiesen werden.
Zusammenfassung
In mehreren Bereichen der Studie, die das Kreislaufsystem in Laborstudien Zugang erforderlich ist. Pharmakologische Studien an Ratten mit chronisch implantierten Kathetern ermöglichen ein Forscher, um effektiv und human zu verwalten Substanzen, führen wiederholte Blutentnahme und hilft bei der bewussten direkten Messungen von Blutdruck und Herzfrequenz. Sobald der Katheter implantiert langfristige Probenahme ist möglich. Durchgängigkeit und Katheter Leben hängt von mehreren Faktoren ab, einschließlich der Sperre Lösung, Spülen Regime und Katheter Material. Dieses Video demonstriert die Methodik der Femoralarterie und Katheterisierung der Ratte. Darüber hinaus wird das Video demonstrieren die Verwendung der femoralen venösen und arteriellen Katheter zur Blutentnahme, Medikamentengabe und die Nutzung des arteriellen Katheter in den Messungen von Blutdruck und Herzfrequenz in eine bewusste frei beweglichen Ratten. Eine Leine und Geschirr an einem Schwenk-System wird damit das Tier ho werdeneingesetzt und haben Proben entnommen, indem die Forscher mit minimalen Unterbrechungen für das Tier. Zur Aufrechterhaltung Durchgängigkeit des Katheters ist eine sorgfältige tägliche Pflege des Katheters erforderlich mit Lock-Lösung (100 U / ml heparinisierten Kochsalzlösung), maschinell geschliffen stumpfe Spitze Injektionsnadeln und die Verwendung von Spritzenvorsatzfilter, Verunreinigungen zu minimieren. Mit einer sorgfältigen aseptischen chirurgischen Techniken, richtige Katheter Materialien und sorgfältige Wartung Katheter-Techniken ist es möglich, Patent-Katheter und gesunde Tiere für längere Zeit (mehrere Wochen) aufrecht zu erhalten.
Protokoll
1. Vor Beginn Surgical Procedure
Hinweis: Vor Beginn jedes Tier Verfahren sicher, dass Sie die entsprechende Berechtigung durch Ihre Institution / Organisation erhalten. Wie bei allen Überleben Operationen, stellen Sie sicher, dass die Operation unter sterilen Bedingungen durchgeführt wird und die entsprechende Schmerzmittel und Antibiotika nötig sind für ein erfolgreiches Ergebnis verwendet.
- Vor Beginn der Katheterisierung Verfahren bewerten die Katheter durch Spülen sie mit einer sterilen Kochsalzlösung, um sicherzustellen, sie sind offen.
- Anesthetize der Ratte.
- Bereiten Sie die Ratte für den chirurgischen Eingriff.
- Shave das Fell von der chirurgischen Regionen, die die Rückseite des Halses (zwischen den Schulterblättern) und dem inneren Schenkel Region zählen.
- Mit Betadine und einem 70% igem Ethanol schrubben bzw. scheuern die rasierte chirurgischen Regionen beginnend in der Mitte und eine kreisförmige Schwung nach außen. WiederholenDieses 3-mal für jede Region, endet mit einem abschließenden Reinigung mit 70% Ethanol.
- Legen Sie das Tier auf eine sterile Oberfläche und legen sterilen Tuch über OP-Bereich. (Die Verwendung von Press-n-Seal ist eine ideale chirurgische Abdeckung ermöglicht dem Forscher, um das Tier während des gesamten Verfahrens zu überwachen.)
- Sicherstellen, dass alle chirurgischen Instrumente für den chirurgischen Eingriff sterilisiert worden sind.
2. Vorbereitung der OP-Bereiche für Katheterplatzierung
- Mit der Ratte über anfällig (auf dem Bauch), machen etwa ein ½-Zoll (12 mm) horizontaler Schnitt auf der Rückseite des Halses auf der Ebene der Schulterblätter mit einer Schere oder ein Skalpell, dann stumpfen sezieren eine subkutane "pocket" in der Rückseite in etwa die Größe von einem Viertel. Dies wird als ein Bereich genutzt werden, um eine kleine Menge an Schläuchen, die für das Wachstum der Tiere und / oder Bewegung zu kompensieren findet, dh so, dass der Katheter nicht auf herausgezogen und somit entfernt von der Arterie war es Platzd in. (Alternativ kann dieser Schritt unmittelbar vor dem Tunnel der Katheter durchgeführt werden.)
- Legen Sie die Ratte auf den Rücken (Rückenlage) und einen Einschnitt in der Leistengegend [ungefähre ½ Zoll (12 mm) Schnitt entlang der natürlichen Neigung des Hinterbein.
- Blunt sezieren, um das Bindegewebe (Abb. 1) trennen (können stumpfen Spitze Schere, Hämostatika, Wattestäbchen, etc. verwenden) (in der Regel, indem Sie den stumpfen Spitzen Schere und / oder einem Wattestäbchen in einem 45 Grad-Winkel dies sorgt für einfachere Lokalisierung der region of interest), bis die Arteria und Vena femoralis freigelegt werden.
- Die Vene wird dunkel in der Farbe rot und die Arterie ist klarer und heller als die Vene. Die Nerven, die entlang der Arterie läuft ist weißlich in Ton.
- Blunt sezieren im Beinbereich zu einer kleinen offenen Bereich unter der Haut (zB Tasche, etwa die Größe von einem Viertel) an der Innenseite des Beines zu machen für die Platzierung eines kleinen Ausschnitts des catheter (wieder zu berücksichtigen Tierbewegungen zu nehmen und das Wachstum des Tieres, wenn chronische Platzierung).
- Setzen Sie den Haken in den Schnitt-Bereich, so dass Sie in vollem Umfang können die Arterie und Vene.
- Mit feiner Spitze Pinzette vorsichtig trennen die Nerven (weißlich), die entlang der Femoralarterie weg von der Arterie und Vene ist. (Abbildung 2) Achten Sie darauf, nicht geschnitten oder Schäden an den Nerven.
- Trennen Sie die Arterie und Vene als eine Einheit und versucht, eine ca. ¼ inch (5-7 mm) Länge Abschnitt der Arterie / Vene freizulegen.
- Wiederholen Sie den Vorgang bei der Trennung der Vene von der Arterie. Halten Sie Ihre chirurgischen Instrumente (dh feine Spitze Pinzette), die senkrecht zu den Schiffen und trennen die Schiffe in parallel. Dies hilft bei der Vermeidung Reißen, Stechen oder Beschädigung der Gefäße. Indem Sie die feine Spitze Pinzette vorsichtig zwischen Arterie und Vene von unten und langsam Öffnen der Zange und Wiederholung dieser, werden Sie langsam trennen die Schiffe. Hinweis: wenn Sie reißen oder beobachten einigeBlutungen mit einem sterilen Wattestäbchen und / oder 2 x 2 Gaze und Druck auf den Bereich, bis die Blutung gestoppt wurde, dann mit der Operation fortsetzen.
3. Tunneling der Katheter
- Legen steriler Kochsalzlösung getränkt 2 x 2 Gaze über den Schnitt und drehen Sie das Tier auf seinem Magen.
- Legen Sie die Rochester Pean Pinzette (lange Gerade Pinzette) in den Einschnitt auf der Rückseite, die bisher gemacht wurde und Führung der Zange subkutan den Rücken hinunter auf die Ebene der Hüfte [sicherzustellen, dass die Spitzen der Hämostatika up sind, hingewiesen (nicht in Richtung der Wirbelsäule ) nicht zu verletzen das Rückenmark]. Bei etwa der Hüfte drehen Sie den hemostat Spitze in Richtung der Schnitt, die in das Bein Region gemacht wurde und drücken Sie die Spitze des Hämostatika aus dem vorbereiteten Bein Schnitt.
- Fassen Sie das Ende der Katheter (nicht das Ende, das in die Arterie / Vene eingeführt wird) mit der Zange und ziehen Sie den Katheter durch den Hohlraum, was gemachtund schließlich aus dem Hals Einschnitt.
- Legen Sie die entsprechende abgestumpft-Spitze Spritze mit 20 U / ml Heparin / Kochsalzlösung auf das Ende des jeweiligen Katheter gefüllt und füllen die Katheter (sicherstellen, dass keine Luftblasen) mit dem heparinisierten / Kochsalzlösung. Wieder einmal überprüfen, ob die Katheter-Patents sind und keine Schäden an den Kathetern zu kommen. Verlassen Sie die Spritzen an das Ende des Katheters Linien, damit keine Luft in der Lage, in den Katheter Linien und biegen die Ratte auf den Rücken wieder.
4. Einsetzen der Katheter in die Femoral Vene und Arterie (Abb. 3)
- Legen Sie ein gefaltetes Stück sterile 4,0 Seide / Faden unter der V. femoralis und dann schneiden die Seide auf das gefaltete Ende. Es gibt jetzt zwei Stücke aus Seide unter die Vene werden. Oder alternativ, Platz 2 Stück von 4,0 Seide unter die Vene einzeln.
- Trennen Sie die Seide, die Sie unter der Vene gelegt, ein Stück in Richtung des Beines (distalen Ende) und die andere in Richtung des Körpers. Tdh eine lose Ligatur auf der Seite, die dem Körper, dann mit kleinen Hämostatika, fassen Sie die Seide und ziehen gelehrt, aber nicht festziehen des Knotens. Ziehen Sie das andere Stück Seide so weit wie möglich in Richtung des Beines (distalen Ende) und binden diese in einen dreifachen Knoten, fassen Sie die Seide mit kleinen Hämostatika und ziehen gelehrt. Diese Methode erlaubt die Vene mit Blut zu füllen, so dass es einfacher, die den Schnitt, die zum Einführen des Katheters (Schritt 4) erforderlich sind zu machen.
- 1-2 Tropfen von Lidocain auf die Vene.
- Mit dem Vanna Mikro-Präparierschere, einen kleinen Einschnitt in die Vene ca. ¼ über und in einem Winkel von 45 Grad.
- Legen Sie spitzen Pinzette (45 Pinzetten) in den Einschnitt und mit einem anderen Pinzette, sorgfältig in die Vene Katheter zu ernähren. Öffnen Sie vorsichtig die Pinzette, die in die Vene gelegt werden, da dies ermöglicht dem Forscher, sanft Ort der Katheter unter der Zange und in die Vene.
- Wenn der Katheter vollständig eingeführt ist (entx. 6-7 cm) (Bei der Herstellung der Katheter eine Markierung auf dem Katheter gelegt, um dem Chirurgen bei der Identifizierung, wenn der Katheter vollständig eingeführt ist behilflich) (dies legt den Katheter in die Bauch-Hohlvene), ziehen Sie die vordere Ligatur um die Vene und Katheter, binden einen dreifachen Knoten (sicherstellen, dass es nicht das Verschließen der Vene). Verwenden Sie den Seidenfaden in der Nähe des Beines (posterior Ligatur) wieder sichern den Katheter (triple Knoten) und sorgen für die Platzierung. Langsam ziehen wieder die Spritze, bis es ein wenig Blut sichtbar in den Katheter, die sicherstellen, dass die Naht Knoten nicht zu eng, und dass der Katheter ist funktional hilft. Nach der Überprüfung, drücken Sie den Kolben, bis das Blut nicht mehr sichtbar in den Katheter.
Hinweis: Es ist möglich bis 2 Katheter in die Vena femoralis einfügen, wenn nötig. - Wiederholen Sie die Schritte 9-13, um eine Femoralarterie Katheter mit folgenden Ausnahmen Ort:
- Binden Sie die Seide am nächsten zu dem Bein (hinten) mit einem dreifachen Knoten und ziehen taught vor Bindung der lockeren Ligatur in der Nähe des Körpers (anterior) bevor der Schnitt für die Platzierung von Kathetern. Dadurch wird die Arterie mit Blut macht es leichter zu schneiden füllen. Sicherstellen, dass die proximale Naht gezogen wird gelehrt, um die Arterie vor verschließen zum Schneiden der Arterie. Dadurch wird vermieden, Blutverlust, wenn der Schnitt gemacht wird.
- Legen Sie den arteriellen Katheter ca. 5 cm aus der Femoralarterie (dies legt den Katheter in der Aorta).
- Bei der Befestigung des Katheters mit der Naht sicher, dass die Naht nicht zu eng und das Verschließen des Katheters.
5. Chirurgische Wrap-up
- Machen Sie einen Cent zu Quartal große Schleife in der Kathetern und auf der Innenseite des Beins (die Schleife in den Bereich, der stumpf seziert früher war fit). Nach der Platzierung beider Katheter, sichern Sie sie mit 1-2 Stichen von 5,0 chirurgisches Nahtmaterial in die Muskelschicht.
- Schließen Sie den Schnitt mit 4,0 Ethilon mit nicht-kontinuierlichen Sutures.
- Schalten Sie die Ratte auf den Bauch und machen eine weitere Schleife in den Katheter über die Größe von einem Viertel und in der Tasche im Rücken seziert. Schließen Sie den Schnitt mit einer Naht.
- Mit einem Rückgang von vetbond, sichern Sie den Katheter in den Rücken.
- Klemmen Sie den Katheter in der Nähe der Rückseite Schnitt mit gepolstertem Hämostatika und entfernen Sie die Spritzen von den Enden.
- Fit der Ratte mit einem Halteseil-type-Jacke, Mütze die Katheter (die Heparin-Lock zu erhalten), und entfernen Sie die gepolsterte Hämostatika.
- Für die langfristige Wartung ersetzen Katheter Kochsalzlösung mit 20 U / ml Heparin / Kochsalzlösung.
6. Wartung der Katheter (Sterile Handschuhe sollten während des Eingriffs getragen werden)
- Klemmen Sie den Katheter mit gepolsterten Zange.
- Entfernen Sie den Katheter anschließen.
- Legen Sie eine stumpfe Spitze Spritze mit Schloss-Lösung auf den Katheter.
- Ausspannen Pinzette.
- Füllen Sie den Katheter mit dem Schloss-Lösung (Volumen ist pre-Determined-typisch 0,3 ml).
- Klemmen Sie den Katheter, während Spülung keine Rückfluss von Blut in die Katheterspitze zu verhindern und entfernen Sie die Spritze.
- Ersetzen Sie den Katheter anschließen.
- Ausspannen Pinzette und schieben Sie den Stecker in leicht um sicherzustellen, kein Blut in die Spitze des Katheters.
7. Blutprobenentnahme (Sterile Handschuhe sollten während des Eingriffs getragen werden)
Klemmen Sie den Katheter mit gepolsterten Zange.
- Entfernen Sie den Katheter anschließen.
- Ziehen Sie langsam Lock-Lösung mit einem stumpfen Spitze Spritze und entsorgen.
- Bringen Probenahme Spritze an den Katheter langsam zurückziehen Probe.
- Klemmen Sie den Katheter mit gepolsterten Zange und legen Sie eine Spritze mit Schloss-Lösung auf den Katheter und re-fill den Katheter mit dem Schloss-Lösung.
- Klemmen Sie den Katheter, während das Nachfüllen der Katheter mit der Lösung.
- Setzen Sie den Katheter anschließen.
- Entfernen Sie den gepolsterten Zange und schieben t er plug in etwas weiter.
8. Drug Infusion
- Klemmen Sie den Katheter mit gepolsterten Zange.
- Entfernen Sie den Katheter anschließen.
- Ziehen Sie langsam Lock-Lösung mit einem stumpfen Spitze Spritze und entsorgen.
- Bringen Medikament gefüllte Spritze an den Katheter und ziehen den Stoff in das Tier.
- Man kann mit einem 3-Wege-Hahn sowie ein Zwischenprodukt, wenn mehrere Injektionen erforderlich sind, erfordern somit weniger Flüssigkeit als Infusion in das Tier.
- kann man auch legen eine konstante Infusionsspritzenpumpe mit einem sterilen Filter für kontinuierliche Infusionen.
- Clamp mit gepolsterten Zange und legen Sie eine Spritze mit Schloss-Lösung auf den Katheter und re-fill den Katheter mit dem Schloss-Lösung.
- Klemmen Sie den Katheter, während das Nachfüllen der Katheter mit der Lösung.
- Setzen Sie den Katheter anschließen.
- Entfernen Sie den gepolsterten Zange und schieben Sie den Stecker in ein kleines Stück weiter.
- Klemmen Sie den arteriellen Katheter mit gepolsterten Zange und entfernen Sie den Katheter anschließen.
- Befestigen Sie den arteriellen Linie auf den Druckaufnehmer.
- Follow Herstellung Anweisungen zur Verwendung der Software für den Blutdruck Sammlung.
- Zum Abschluss der Überwachung des Blutdrucks Zeitraum, mit gepolsterten Zange Klammer des Katheters aus und trennen Sie vom Wandler.
- Spülen Sie den Katheter mit dem Schloss-Lösung und ersetzt die Katheterstopfen wie oben beschrieben.
10. Repräsentative Ergebnisse
Ein Vertreter der Blutdruck gemessen wurde von einer bewussten frei beweglichen Tieren genommen und ist in Abbildung 4 dargestellt. Phenylephrin (3 ug / kg, iv), einen Alpha-1-adrenergen-Rezeptor-Agonist, wurde in die Vena femoralis Linie, um den Blutdruck zu erhöhen verabreicht werden, bei gleichzeitiger Messung des Blutdrucks aus der Femoralarterie Linie. Phentolamin (4 mg / kg, iv)einem nicht selektiven alpha-adrenerge Antagonist, wurde dann verabreicht werden, um den Blutdruck zu senken.

Abbildung 1. Stumpfe Präparation von Gewebe. Mit der Ratte auf den Rücken, werden Sie ungefähr eine ½ Zoll (12 mm) Schnitt auf den Winkel der Hinterlauf gemacht haben und mit stumpfen Schere oder Hämostatika Sie stumpfen sezieren das Bindegewebe um die Arteria und Vena femoralis aussetzen wird.
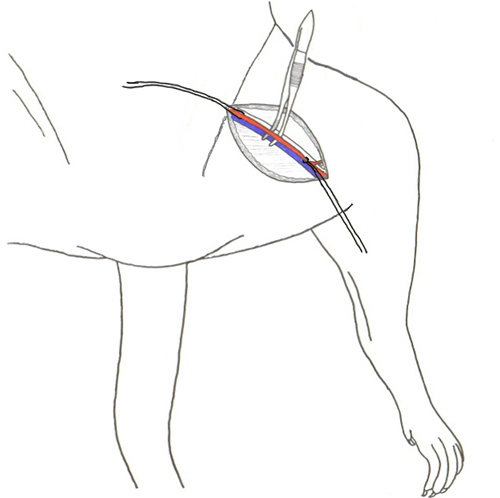
Abbildung 2. Trennung von Arteria und Vena femoralis aus Bindegewebe.

Abbildung 3. Katheterplatzierung. Mit Vanna Mikro-Präparierscheren Ort einen kleinen Schnitt ca. ¼ der Weg durch das Schiff zu einem Winkel von 45 Grad (oben) und Platz spitzen Pinzette in the Schnitt und mit einer anderen Pinzette füttern den Katheter in das Gefäß (Mitte). Schließlich, nach Abschluss der Platzierung des Katheters Nahtmaterial der Katheter (unten).
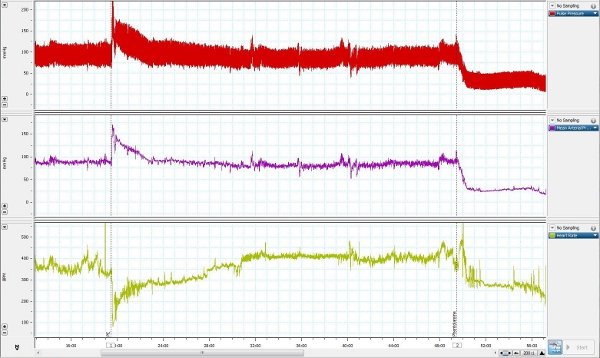
Abbildung 4. Representative Blutdruck messen Sie von einer bewussten frei beweglichen Tier entnommen.
Diskussion
Arterielle und Venenkatheterverfahren haben in der Vergangenheit sowohl akut und chronisch-Monitor Blutdruck, Blut-Probe eingesetzt und liefern Substanzen in der experimentellen Ratten-Tiermodell 1-4. Ein großer Vorteil dieser OP-Besetzungen ist, dass es Verfahren zur Überwachung, einschließlich Blutentnahme, Medikamentengabe und Überwachung des Blutdrucks, um mit minimalen Störungen und / oder Stress für das Tier 1 durchgeführt werden kann. Zahlreiche Forscher haben Protokolle geschrieben und haben spezielle Methoden, mit denen ihr Labor führt die Operation 5-8. Das Video und Illustrationen zeigen, was unser Labor gefunden hat, erfolgreich zu sein im Hinblick auf die femoralen arteriellen und venösen Katheterisierung Verfahren.
Ratten werden in der Regel im Labor für eine Vielzahl von wissenschaftlichen Studien wegen ihrer geringen Größe und Bequemlichkeit in der Handhabung verwendet. Es gibt mehrere Orte, an denen eine chronischeKatheter kann innerhalb eines Tieres gestellt werden, einschließlich der Halsschlagader, Bauchschlagader, Halsschlagader und der Femoralarterie, um nur einige zu nennen. Die Ratte femoral Standort für chronische Katheterisierung führt zu einer erhöhten Länge der Katheter Durchgängigkeit und hatte die schnellste Erholung der präoperativen Tier Gewicht im Vergleich zu anderen Standorten Katheter 9.
Zahlreiche Forscher haben verwendet Verweilkatheter für akute sowie chronische Blutentnahme 1-5,11-13. In vielen Studien mehrere Blutabnahmen sind eines Tieres erforderlich und externe Kanülierung / Katheterisierung ist eine Methodik, die vorteilhaft aufgrund ihrer nicht-traumatischer Natur ist, außerdem kann es geschehen, während das Tier bei Bewusstsein ist, wird also nicht durch die Wirkung von Anästhetika beschränkt und auch das Tier frei bewegen 1,10. Die beste Methode, mit der Blutproben zu erhalten und zu Stresshormone bei Nagern zu messen ist seit langem 6,13 debattiert. Im Hinblick auf die Pharmakokinetik studies erlaubt Katheterisierung der Forschung Tier wiederholt Blutproben mit minimaler Zurückhaltung bei der Verwendung eines chronisch implantierten Katheter-System. Darüber hinaus haben Studien reduzierte basale Konzentrationen von Adrenalin, Noradrenalin und Dopamin im Plasma von sich frei bewegenden Ratten (Vena Katheter) im Vergleich zu Tieren, die behandelt worden sind (30 Sekunden) und oder zurückhaltend (5 Minuten) 14 gezeigt. Eine weitere Methode, mit der Zunahme der Belastung zu erkennen, um durch Messung Plasma Corticosteron Ebenen. Bisher wurde vermutet, dass auch nach drei Minuten vor vier Tagen chirurgischen Recovery-Zeiten, dass Plasma-Corticosteron Ebenen in der chronischen kanülierten Ratten 15 wurden erhöht. Allerdings haben die jüngsten Verbesserungen in der Methodik ermittelt, dass es keine Unterschiede in der Baseline-Plasma-Corticosteron Ebenen in die Jugularvene kanülierten Ratten im Vergleich zu uncannulated Ratten 16. Darüber hinaus HPLC-Methode für Corticosteron Analyse ergab auch, dass corticosterFallstecker durch Zurückhaltung Stress erhöht, aber stabil, nachdem Vena Katheterisierung 16.
Ein zusätzlicher Einsatz von chronischer Katheterisierung ist die Messung von Blutdruck und Herzfrequenz bei Nagetieren. Es gibt mehrere Methoden, die genutzt werden, um den Blutdruck und die Herzfrequenz in der Ratte zu messen sind, dazu gehören die nicht-invasive Schwanz Manschette Methoden, Radiotelemetrie Verfahren und direkte Verweilkatheter. Jede Methode hat ihre Vor-und Nachteile, die im Detail in anderen Publikationen beschrieben sind. Indwelling Flüssigkeit gefüllte Katheter kann in mehrere Arterien innerhalb der Ratte implantiert werden. Die Femoralarterie ist nur eine Arterie, die für diese Maßnahme verwendet werden können. Für Blutdruck / Herzfrequenz misst, ist das distale Ende des Katheters mit einem kalibrierten Druckmessumformer verbunden. Der Katheter kann in eine schützende Feder, die an einem Schwenkarm verbunden ist, um freie Bewegung des Tieres erlauben untergebracht werden, oder an eine Schaltfläche chirurgischentisch an das Tier implantiert. Dauerkatheter haben den Vorteil der Minimierung der langfristigen Belastung des Tieres 17,18. Neben den Materialien sind preiswert, ist die Kalibrierung einfach für Druck misst und kontinuierliche langfristige Maßnahmen können unter den Bedingungen der relativ geringen Belastung für viele Wochen 19 bezogen werden. Wir wäre nachlässig, wenn wir nicht erwähnen, dass es Nachteile dieser Technik, einschließlich, es ist ein chirurgisch-invasive Technik ist, ist die Wartung des Katheters erforderlich, um die Durchgängigkeit, Schäden an der Arterie durch die Implantation des Katheters und die Aufrechterhaltung Potenzial der Infektion um einige zu nennen.
Bei chronischen Maßnahmen des Blutdrucks direkte Aufnahmen von chronisch implantierten arteriellen Katheter sind technisch anspruchsvoll, aber sind genauer und kann kontinuierlich, ohne die Tiere getan werden. Tail-Manschette Messungen sind weniger genau, aber sie nicht operiert werden und kann auch wiederholthg. Tail-Manschette Methoden erfordern sowie Handhabung Erwärmung des Tieres bis zum Schwanz Schiffe erweitern, um den Nachweis der Puls 20 zu erleichtern. Handhabung und den zusätzlichen Hitzestress kann Auswirkungen auf den Blutdruck-Messungen, also nicht, dass wirklich genau misst. Außerdem sieht die non-direct tail-cuff-Methode nicht zulassen, einfach gleichzeitige Blutentnahme oder Medikamentengabe.
Eine weitere Methode, durch die direkte Maßnahme erreicht werden kann, ist mit telemetrischen Methoden. Telemetry ermöglicht hochwertige Aufnahmen des Blutdrucks (und andere Maßnahmen) kontinuierlich für längere Zeit in der bewussten frei beweglichen Tieren ohne Zurückhaltung oder Anästhetika 18. Allerdings, Telemetrie-Geräte, während ideal sind sehr teuer. Wenn die Telemetrie Vergleich gehören Katheterisierung Vorteile: verringerte "setup" und Betriebskosten, die Fähigkeit, leicht zu verwalten Drogen und leicht nehmen Blutproben in bewusster frei beweglichen Tieren. Die administriertion von Medikamenten und Substanzen, und, um Blutproben aus der Forschung Tier kann geschehen, während minimal der Tiere zu stören, damit Minimierung von Stress für das Tier und damit für eine genauere Messung werden.
Offenlegungen
Produktions-und Free Access dieses Video-Artikel ist von ADInstruments gesponsert.
Danksagungen
Die Autoren danken Dr. Andrew King, PhD und Katrina König für den Beitrag der Abbildungen erkennen. NIH: R00HL087927.
Materialien
| Name | Company | Catalog Number | Comments |
| Name | Typ | Firma | Katalog-Nummer |
| Arteriellen Katheter | Verbrauchsmaterial | SAI Infusion | RFA-01 |
| Venenkatheter | Verbrauchsmaterial | Scientific Commodities, Inc. | BB518-20 & BB31785-V / 2 |
| 27g 1 / 2 "stumpfen Nadel | Ausrüstung | Integrierte Dispensing Solutions, Inc. | 9991113 |
| 23g 1 / 2 "stumpfen Nadel | Ausrüstung | Integrierte Dispensing Solutions, Inc. | 9991109 |
| PowerLab/8SP | Ausrüstung | ADInstruments | w.adinstruments.com/products/hardware/research/product/PL3508 / "target =" _blank "> ML765 |
| Quad-Brücke | Ausrüstung | ADInstruments | ML118 |
| LabChart 7,2 | Software | ADInstruments | |
| BP Transducer mit Hahn & Cable | Ausrüstung | ADInstruments | MLT844 |
| Single Channel Swivel | Ausrüstung | Instech | 375/22PS |
| Single Axis-Counter Balance Swivel Mount | Ausrüstung | Instech | CM375BP |
| Covance Infusion Harness | Ausrüstung | Instech | CIH105 |
| Table Top Isofluran-Narkose-Einheit | Ausrüstung | Protech International, Inc. | 61020 |
| Rodent Anesthesia Mask | Ausrüstung | Protech International, Inc. | RAM-02 |
| Rodent Induction Kammer | Ausrüstung | Protech International, Inc. | RIC-01 |
| Anästhesie Gas Filterbehälter | Ausrüstung | Protech Internationalenal, Inc. | 80120 |
| Tabletop Laminar Flow Hood | Ausrüstung | Sentry Air Systems, Inc. | SS-200-WSL |
| Oster Golden A5 | Ausrüstung | Oster Professional Products | 78005-140 |
| Fiber Optic Light mit Dual-Schwanenhals-Führer | Ausrüstung | LW Scientific, Inc. | ILL-1502-DGG1 |
| Deltaphase Isotherme Pad | Ausrüstung | Braintree Scientific | 39DP |
| Wattestäbchen | Verbrauchsmaterial | Solon Manufacturing Company | 36200 |
| Gazetupfer 2 "x2" | Verbrauchsmaterial | Kendall cherheit | 2146 |
| 5-0 Nylonfaden | Verbrauchsmaterial | Ethicon | 661G |
| 4-0 Seidenfaden | Verbrauchsmaterial | Deknatel | 8-S, 136075-0208 |
| Gewebekleber | Verbrauchsmaterial | 3M | 1469SB |
| Splinter & Fasszange | Ausrüstung | George Tiemann & Company | 160-55 |
| Studentische Tissue Zange | Ausrüstung | Feine Science Tools, Inc. | 91121-12 |
| Micro Pinzetten / Pinzette Bracken | Ausrüstung | George Tiemann & Company | 10-1942 |
| Extra Fine Graefe Zange | Ausrüstung | Feine Science Tools, Inc. | 11152-10 |
| Olsen-Hegar Nadelhalter | Ausrüstung | Feine Science Tools, Inc. | 12002-12 |
| Studentische Halsted-Mosquito Hemostat | Ausrüstung | Feine Science Tools, Inc. | 91308-12 |
| Rochester Pean Kraftp | Ausrüstung | Biomedical Research Instruments, Inc. | 31-1640 |
| Studentische Chirurgische Schere | Ausrüstung | Feine Science Tools, Inc. | 91402-12 |
| Dumont Pinzetten | Ausrüstung | Feine Science Tools, Inc. | 11251-35 |
| Micro Präparierscheren | Ausrüstung | George Tiemann & Company | 160-210 |
| Strabismus Schere | Ausrüstung | Feine Science Tools, Inc. | 14075-11 |
| Hartman Hemostat | Ausrüstung | Feine Science Tools, Inc. | 13003-10 |
| Tissue Scissors | Ausrüstung | George Tiemann & Company | 160-150 |
| Retractor | Ausrüstung | Custom Made |
Referenzen
- Tabata, Y., Chang, T. M. Intermittent vascular access for extracorporeal circulation in conscious rats: a new technique. Artif. Organs. 6, 213-215 (1982).
- Chester, J. F., Weitzman, S. A., Malt, R. A. Implantable device for drug delivery and blood sampling in the rat. J. Appl. Physiol. 59, 1665-1666 (1985).
- Koeslag, D., Humphreys, A. S., Russell, J. C. A technique for long-term venous cannulation in rats. J. Appl. Physiol. 57, 1594-1596 (1984).
- Hall, R. I., Ross, L. H., Bozovic, M., Grant, J. P. A simple method of obtaining repeated venous blood samples from the conscious rat. J. Surg. Res. 36, 92-95 (1984).
- Burt, M. E., Arbeit, J., Brennan, M. F. Chronic arterial and venous access in the unrestrained rat. Am. J. Physiol. 238, H599-H603 (1980).
- Cocchetto, D. M., Bjornsson, T. D. Methods for vascular access and collection of body fluids from the laboratory rat. J. Pharm. Sci. 72, 465-492 (1983).
- Rigalli, A., E, D. L. V. . Experimental surgical models in the laboratory rat. , (2009).
- Waynforth, H. B. . F.P.A. Experimental and surgical tehcnique in the rat. , (2007).
- Yoburn, B. C., Morales, R., Inturrisi, C. E. Chronic vascular catheterization in the rat: comparison of three techniques. Physiol. Behav. 33, 89-94 (1984).
- Staub, J. F., Coutris, G. A technique for multiple, high-rate blood samplings via an external cannula in rats. J. Appl. Physiol. 46, 197-199 (1979).
- Steffens, A. B. A method for frequent sampling of blood and continuous infusion of fluids in the rat without disturbing the animal. Physiol. Behav. 4, 833-836 (1969).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain. Res. Brain. Res. Protoc. 10, 84-94 (2002).
- Vahl, T. P. Comparative analysis of ACTH and corticosterone sampling methods in rats. Am. J. Physiol. Endocrinol. Metab. 289, E823-E828 (2005).
- Buhler, H. U., da Prada, M., Haefely, W., Picotti, G. B. Plasma adrenaline, noradrenaline and dopamine in man and different animal species. J. Physiol. 276, 311-320 (1978).
- Fagin, K. D., Shinsako, J., Dallman, M. F. Effects of housing and chronic cannulation on plasma ACTH and corticosterone in the rat. Am. J. Physiol. 245, E515-E520 (1983).
- Ling, S., Jamali, F. Effect of cannulation surgery and restraint stress on the plasma corticosterone concentration in the rat: application of an improved corticosterone HPLC assay. J. Pharm. Pharm. Sci. 6, 246-251 (2003).
- Fink, G. D., Bryan, W. J., Mann, M., Osborn, J., Werber, A. Continuous blood pressure measurement in rats with aortic baroreceptor deafferentation. Am. J. Physiol. 241, H268-H272 (1981).
- Van Vliet, B. N., Chafe, L. L., Antic, V., Schnyder-Candrian, S., Montani, J. P. Direct and indirect methods used to study arterial blood pressure. J. Pharmacol. Toxicol Methods. 44, 361-373 (2000).
- Wang, J., Tempini, A., Schnyder, B., Montani, J. P. Regulation of blood pressure during long-term ouabain infusion in Long-Evans rats. Am. J. Hypertens. 12, 423-426 (1999).
- Bunag, R. D. Facts and fallacies about measuring blood pressure in rats. Clin. Exp. Hypertens. A. 5, 1659-1681 (1983).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten