Method Article
Простой протокол Chelex для выделения ДНК из
В этой статье
Резюме
Быстрый и доступный способ извлечения паразита малярии качества и векторной ДНК из образцов комаров описано. Опираясь на свойства хелатирующие смолы Chelex, простой метод позволяет генотипирования малярийных паразитов в комара средней кишки и слюнных желез фаз, а также молекулярная идентификация Anopheles Видов-двойников с помощью ПЦР.
Аннотация
Endemic countries are increasingly adopting molecular tools for efficient typing, identification and surveillance against malaria parasites and vector mosquitoes, as an integral part of their control programs1,2,3,4,5. For sustainable establishment of these accurate approaches in operations research to strengthen malaria control and elimination efforts, simple and affordable methods, with parsimonious reagent and equipment requirements are essential6,7,8. Here we present a simple Chelex-based technique for extracting malaria parasite and vector DNA from field collected mosquito specimens.
We morphologically identified 72 Anopheles gambiae sl. from 156 mosquitoes captured by pyrethrum spray catches in sleeping rooms of households within a 2,000 km2 vicinity of the Malaria Institute at Macha. After dissection to separate the head and thorax from the abdomen for all 72 Anopheles gambiae sl. mosquitoes, the two sections were individually placed in 1.5 ml microcentrifuge tubes and submerged in 20 μl of deionized water. Using a sterile pipette tip, each mosquito section was separately homogenized to a uniform suspension in the deionized water. Of the ensuing homogenate from each mosquito section, 10 μl was retained while the other 10 μl was transferred to a separate autoclaved 1.5 ml tube. The separate aliquots were subjected to DNA extraction by either the simplified Chelex or the standard salting out extraction protocol9,10. The salting out protocol is so-called and widely used because it employs high salt concentrations in lieu of hazardous organic solvents (such as phenol and chloroform) for the protein precipitation step during DNA extraction9.
Extracts were used as templates for PCR amplification using primers targeting arthropod mitochondrial nicotinamide adenine dinucleotide dehydrogenase (NADH) subunit 4 gene (ND4) to check DNA quality11, a PCR for identification of Anopheles gambiae sibling species10 and a nested PCR for typing of Plasmodium falciparum infection12. Comparison using DNA quality (ND4) PCR showed 93% sensitivity and 82% specificity for the Chelex approach relative to the established salting out protocol. Corresponding values of sensitivity and specificity were 100% and 78%, respectively, using sibling species identification PCR and 92% and 80%, respectively for P. falciparum detection PCR. There were no significant differences in proportion of samples giving amplicon signal with the Chelex or the regular salting out protocol across all three PCR applications. The Chelex approach required three simple reagents and 37 min to complete, while the salting out protocol entailed 10 different reagents and 2 hr and 47 min' processing time, including an overnight step. Our results show that the Chelex method is comparable to the existing salting out extraction and can be substituted as a simple and sustainable approach in resource-limited settings where a constant reagent supply chain is often difficult to maintain.
протокол
1. Подготовительные Препарирование Mosquito Образцы
- Место комаров на небольшой резке парафильмом и крепление на рассекает микроскопом.
- Крышка в капле деионизированной водой, чтобы смягчить ткань.
- Надрезать комаров туши именно в стык между грудной клеткой и животом, таким образом, никующие от головы и грудной клетки от брюшной части.
- Передача каждого расчлененный комаров раздел в чистую автоклаве 1,5 мл микроцентрифужных трубки prelabeled с москитной ID номер детали и соответствующие указатели для обозначения секции кузова (например, «М» для средней кишки разделе; "HT" для головы и грудной клетки разделе).
- Откажитесь парафильмом и тщательно протрите столик микроскопа с 70% алкоголя, смоченной Kimwipe перед обработкой следующего комаров.
2. Экстракции ДНК из образцов Mosquito
- Внесите 20 мкл деионизированной воды в трубку образца и использование пипетки для измельчения подводных комаров раздел в ООНiform подвески.
- Добавить 100 мкл из автоклавного 1X PBS / 1% сапонина решение гомогената образца и микс от нежного мгновенного встряхиванием.
- Выдержите при комнатной температуре в течение 20 мин.
- Центрифуга при 20000 х г в течение 2 минут и отбросить супернатант.
- Ресуспендируют осадок в 100 мкл 1X PBS.
- Центрифуга раз при 20000 х г в течение 2 минут и отбросить супернатант.
- По нежным встряхивания (5 сек), ресуспендируют осадок в 75 мкл стерильной деионизированной воды и 25 мкл 20% вес / объем Chelex-100 смола подвеска в деионизированной воде.
- Пирс отверстие в крышке пробирки с использованием стерильной иглой 23G подкожных вспыхнул в горелку.
- Кипятите образец подвески на водяной бане с плавающей стойки (или в нагревательный блок) в течение 10 мин.
- Центрифуга на 20000 мкг, в течение 1 мин и передачи последующие раствор ДНК в prelabeled флаконе хранение для использования в качестве шаблона в приложениях ПЦР.
3. Plasmodium тропической генотипирования и AnophelesSPP. Молекулярная идентификация
- Добавить 2,5 мкл экстракта ДНК Chelex в 25 мкл реакции ПЦР, чтобы проверить качество ДНК 11, выявлению видов Anopheles 10 и генотип P. 12 тропической средней кишки и слюнных желез инфекций.
- Чтобы максимизировать доходность ампликона, особенно для P. тропической обнаружения, включают 1.5X бычьего сывороточного альбумина (БСА) в ПЦР. Следующие реакционной смеси рекомендуется: (2,5 мкл шаблон, 0,25 мкМ праймера, 1,5 мкМ хлорида магния, 200 мкМ дНТФ, 1X ПЦР буфера, 1,5 BSA и 1.0U Taq ДНК-полимеразы, в 25 мкл объема).
- Чтобы проверить качество ДНК в экстракте, усиливать области членистоногих митохондриальной дегидрогеназы никотинамид-аденин-динуклеотид (NADH) субъединицы 4 (ND4) гена (праймеры ND4FW [5'-GTD YAT TTA TGA TTR CCT AA-3 '] и ND4RV [5' СТТ-CGD СТТ против часовой стрелки ADW CGT TC-3 ']; ожидать продукта 400bp) 11,13.
- Чтобы отличить Anopheles Гамбииэлектронной SL. видов-двойников (an. gambiae СС и. arabiensis только), усиливают области фланговые SNPs в межгенные прокладку (IGS) области, (праймеры ООН [5'-GTGTGCCCCTTCCTCGATGT-3 '], GA [5'-CTGGTTTGGTCGGCACGTTT- 3 '], AR [5'-AAGTGTCCTTCTCCATCCTA-3']; ожидать продукта 390bp gambiae сс, 315bp arabiensis) 10,11.
- Для набора P. тропической антифолат полиморфизмов лекарственной устойчивостью, выполнить ПЦР для амплификации области фланговые аминокислотных кодонов 108, 51, 59, 16 и 164 в паразита дигидрофолатредуктазы (DHFR) генов:
Первичный праймеры тура: M1 [5'-TTTATGATGGAACAAGTCTGC-3 '] и M5 [5'-AGTATATACATCGCTAACAGA-3']
Вторичный круглый праймеров: M3 [5'-TTTATGATGGAACAAGTCTGCGACGTT-3 '] с F / [5'-AAATTCTTGATAAACAACGGAAACCTTTTA-3']
Или
F [5'-GAAATGTAATTCCCTAGATATGGAATATT-3] с M4 [5'-TTAATTTCCCAAGTAAAACTATTAGAGCTTC-3 ']).
Также усиливаются области, содержащей аминокислотных кодонов 436, 437, 540, 581м 613 в P. тропической дигидроптероатсинтазы синтетазы (ДГП) генов:
Первичный круглый праймеры R2 [5'-AACCTAAACGTGCTGTTCAA-3 '] с R / [5'-AATTGTGTGATTTGTCCACAA3'];
Вторичный круглый праймеры
J: [5'-'TGCTAGTGTTATAGATATAGGTGGAGAAAGC-3'] с K / [5'-CTATAACGAGGTATTGCATTTATTGCAAGAA-3 ']
Или
K: [5'-TGCTAGTGTTATAGATATAGGATGAGCATC-3 '] с K /,
Или
L [5'-ATAGGATACTATTTGATATTGATATTGGACCAGGATTCG-3 '] с L / [5'-5TATTACAACATTTTGATCATTCGCGCAACCGG-3 »] 12. - Тема 4 мкл ампликонов в аллель-специфических ферментов рестрикции пищеварения в 30 мкл реакции в соответствии с инструкциями завода-изготовителя, для обнаружения наркотиков антифолат, связанные с резистентностью полиморфизм 12.
- Тема 5 мкл ПЦР ампликона (или 15 мкл ограничение дайджест) на полосу бромистого этидия окрашенных 2% агарозном геле для электрофореза (100 - 120В) и визуализации полос в УФ-просвечивания.
Результаты
Примеры результатов ПЦР для комаров качество экстракта ДНК (рис. 1), Anopheles arabiensis молекулярной идентификации (рис. 2) и P. тропической обнаружения (рис. 3) показывает, что упрощенный метод Chelex дает аналогичные результаты в стандартный протокол высаливания 10, несмотря на гораздо меньшее число шагов (табл. 1). При сопоставимом качестве ДНК в соответствующие выдержки это не удивительно, что положительный пример цены по отношению к. gambiae видов-двойников, а также цены паразитарной инфекции не были статистически отличаться в зависимости от теста хи-квадрат McNemar (Рисунок 3).
Чувствительность (%) рассчитывали как TP / (TP + FN) * 100, где TP означает истинно положительных и FN обозначает ложные негативы. Специфичность (%) была определена как TN / (TN + FP) * 100, где TN обозначает истинную негативов и FP обозначает ложных срабатываний. ДНК качества (ND4) ПЦР показал 93% чувствительность и 82% специфичность для Chelex подхода по сравнению с установленными высаливания протокол как золотой стандарт. Соответствующие значения чувствительность и специфичность составили 100% и 78%, соответственно, с использованием идентификации видов-двойников ПЦР и 92% и 80%, соответственно, для P. тропической обнаружения ПЦР.
Кроме того БСА в реакционной смеси в результате общего увеличения положительных ПЦР (рис. 3) в связи с рельефом ПЦР ингибиторов 14, как для упрощенного Chelex и регулярно высаливания протокол. Однако это увеличение не было статистически значимым, за исключением ДНК качества (ND4 ПЦР) на Chelex экстракты (р = 0,039). Аллель конкретные ограничения ферментативного расщепления на P. тропической DHFR (или другого гена-мишени) ампликона позволяет генотипирования средней кишки и слюнных желез заболевания малярией лекарственной устойчивости аллели (рис. 4; слюнных желез данные не показаны).
| Простая процедура Chelex | Стандартная процедура высаливания | ||
| Шаги | Реагенты | Шаги | Реагенты |
| PBS
Chelex-100 бусин |
| Диэтилпирокарбонатом (DEPC)
8 М ацетата калия Этанол 0,1 X Saline цитрат натрия (SSC) буфера РНКазы (10 мкг / мл) |
| Общее время: 37 мин | Общее время звучания: 2 часа 47 мин, плюс ночь | ||
Таблица 1. Шаг за шагом сравнению реагентов и времени требования к простой протокол Chelex и стоятьARD высаливания метод для выделения ДНК из образцов комаров.

Рисунок 1. ND4 ПЦР митохондриальной ДНК сравнения качества от упрощенной Chelex "C" и стандартный высаливания "M" экстрактов образцов Anopheles arabiensis поле. NC, отрицательный контроль; M1 и C1, C2 и M2, M3 и C3, и M4 и C4 в паре высаливания и Chelex выдержки из той же. Образцы arabiensis комаров. L, 100 б.п. ДНК лестнице.
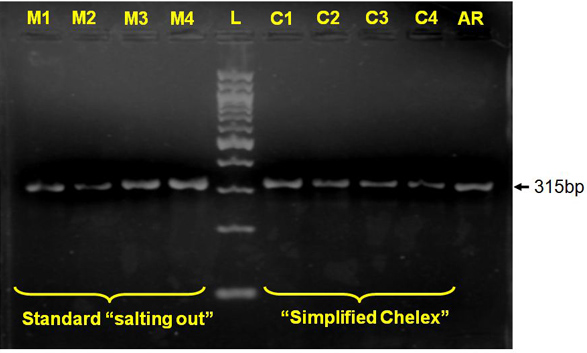
Рисунок 2 Молекулярная идентификация ПЦР для arabiensis Anopheles C1 и M1, M2 и C2, C3 и M3, M4 и C4 обозначают соответствующие ампликона от высаливания "М" и упрощенного Chelex "C" ДНК экстракты для тех же образцов комаров;.. AR, Anopheles arabiensisПоложительный контроль, L, 100 б.п. ДНК лестнице.

Рисунок 3. Обнаружение срабатываний на Chelex и высаливания ДНК экстракты для комаров образцы поля, с ПЦР для молекулярной идентификации Anopheles arabiensis (AR) 10, членистоногих NADH дегидрогеназы ген 4 (ND4) ДНК-тест качества 11 и антифолат P лекарственной устойчивостью . тропической DHFR генотипирования 12 (F-M4). Результаты показали анализы для запуска с или без BSA в реакционной смеси. Хи-квадрат McNemar был использован для определения различий между процентом положительных ПЦР с ДНК, выделенной из упрощенной Chelex и стандартные высаливания протоколы были статистически значимыми.
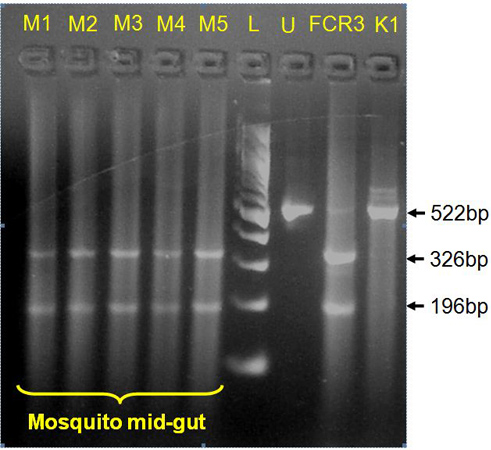
Рисунок 4. Применение упрощенной Chelex протокол в генотипирования P. тропической инфекции в комаров (средней кишки данных показан) для аллелей лекарственной устойчивостью. BstN Я пищеварения на ампликона фланговые кодон 108 из P. тропической ген DHFR 12 показывает cycloguanil устойчивых мутантов в S108T комаров образцов (M1-M5; средней кишки данные показаны). U, непереваренные 522 б.п. ампликона; FCR3, лабораторных стандартных P. тропической позитивный клон контроль проведения S108T; K1, P. тропической лаборатории стандартных клонов отрицательный контроль проведения cycloguanil чувствительных S108N, L, 100 б.п. ДНК лестнице.
Обсуждение
Упрощенный метод Chelex представленные здесь позволяет добыче качества Anopheles SPP и P. тропической ДНК из образцов комаров поддаются разнообразных приложений ПЦР. Эта техника может быть использована для молекулярной идентификации комаров переносчиком малярии и наблюдение за лекарственной устойчивостью P. аллелей в тропической комаров для национальных программ борьбы с малярией. Преимущества упрощенной техникой Chelex включают простоту, меньше реагентов и, следовательно, стоимости, безопасности и короче время обработки (37 мин), чем стандартные протоколы, такие как метод высаливания 10 (2 ч 47 мин и в течение ночи шага, таблица 1). Указанные преимущества и минимальные требования реагента (3 реагентов) по сравнению с текущим стандартным протоколом (10 реагентов, таблица 1) 11,15, сделать упрощенные Chelex протокола особенно дружелюбны к эндемичным лабораториях страны, где постоянно реагентовцепочками поставок часто трудно поддерживать. Ограничение метода является то, что, как стандартный протокол, это было также подлежат ПЦР ингибиторов известно, происходят в организме комара покрова 16. Тем не менее, это легко освобождается от включения BSA в анализах. BSA также успешно использоваться в качестве усиления усилителя с ингибиторами в других приложениях ПЦР 17,18.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы выражают благодарность начальников, старост и общин Macha для их unwaveing сотрудничают во комаров коллекции образцов поле. Доктор Дуг Норрис и Ревекка Kent предлагается бесценный опыт на высаливания протокол. Эта работа финансировалась по борьбе с малярией Johns Hopkins научно-исследовательский институт экспериментальной системы грантов. Комар и паразитов ДНК-лаборатория стандартов, любезно подаренных MR4, американский тип и культуры Collection.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (по желанию) |
| Chelex-100, 50-100 сухой сетки | BioRad | # 143-2832 | |
| Saponin | SIGMA | 142-7425 | |
| BSA | New England Biolabs | B9001S |
Ссылки
- Bonnet, M., et al. Efficacy of antimalarial treatment in Guinea: in vivo study of two artemisinin combination therapies in Dabola and molecular markers of resistance to sulphadoxine-pyrimethamine in N'Zerekore. Malar. J. 6, 54 (2007).
- Nsimba, B., et al. Sulphadoxine/pyrimethamine versus amodiaquine for treating uncomplicated childhood malaria in Gabon: a randomized trial to guide national policy. Malar. J. 7, 31 (2008).
- Oyewole, I. O., et al. Behaviour and population dynamics of the major anopheline vectors in a malaria endemic area in southern Nigeria. J. Vector Borne Dis. 44, 56-64 (2007).
- Harris, I., et al. A large proportion of asymptomatic Plasmodium infections with low and sub-microscopic parasite densities in the low transmission setting of Temotu Province, Solomon Islands: challenges for malaria diagnostics in an elimination setting. Malar. J. . 9, 254 (2010).
- Ouedraogo, A. L., et al. Substantial contribution of submicroscopical Plasmodium falciparum gametocyte carriage to the infectious reservoir in an area of seasonal transmission. PLoS ONE. 4, e8410 (2009).
- Birx, D., de Souza, M., Nkengasong, J. N. Laboratory challenges in the scaling up of HIV, TB, and malaria programs: The interaction of health and laboratory systems, clinical research, and service delivery. Am. J. Clin. Pathol. 131, 849-851 (2009).
- Ishengoma, D. R., et al. Health laboratories in the Tanga region of Tanzania: the quality of diagnostic services for malaria and other communicable diseases. Ann. Trop. Med. Parasitol. 103, 441-453 (2009).
- Alonso, P. L., et al. A research agenda for malaria eradication: vector control. PLoS Med. 8, e1000401 (2011).
- Grimberg, J., et al. A simple and efficient non-organic procedure for the isolation of genomic DNA from blood. Nucleic Acids Res. 17, 8390 (1989).
- Scott, J. A., Brogdon, W. G., Collins, F. H. Indentification of single specimens of the Anopheles gambiae complex by polymerase chain reaction. American Journal of Tropical Medicine and Hygiene. 49, 520-529 (1993).
- Kent, R. J., Norris, D. E. Identification of mammalian blood meals in mosquitoes by a multiplexed polymerase chain reaction targeting cytochrome B. Am. J. Trop. Med. Hyg. 73, 336-342 (2005).
- Duraisingh, M. T., Curtis, J., Warhurst, D. C. Plasmodium falciparum: detection of polymorphisms in the dihydrofolate reductase and dihydropteroate synthetase genes by PCR and restriction digestion. Exp. Parasitol. 89, 1-8 (1998).
- Gorrochotegui-Escalante, N., Munoz, M. L., Fernandez-Salas, I., Beaty, B. J., Black, W. C. T. Genetic isolation by distance among Aedes aegypti populations along the northeastern coast of Mexico. Am. J. Trop. Med. Hyg. 62, 200-209 (2000).
- Kreader, C. A. Relief of amplification inhibition in PCR with bovine serum albumin or T4 gene 32 protein. Appl. Environ. Microbiol. 62, 1102-1106 (1996).
- Norris, D. E., Shurtleff, A. C., Toure, Y. T., Lanzaro, G. C. Microsatellite DNA polymorphism and heterozygosity among field and laboratory populations of Anopheles gambiae ss (Diptera Culicidae). J. Med. Entomol. 38, 336-340 (2001).
- Schriefer, M. E., Sacci, J. B., Wirtz, R. A., Azad, A. F. Detection of polymerase chain reaction-amplified malarial DNA in infected blood and individual mosquitoes. Exp. Parasitol. 73 (91), 311-316 (1991).
- Al-Soud, W. A., Radstrom, P. Purification and characterization of PCR-inhibitory components in blood cells. J. Clin. Microbiol. 39, 485-493 (2001).
- Hyun, C., Filippich, L. J., Hughes, I. The inhibitory effect of pentobarbitone on reverse transcription-PCR. J. Biochem. Biophys. Methods. 62, 63-68 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены