Method Article
Un protocole Chelex simple pour l'extraction d'ADN à partir de
Dans cet article
Résumé
Un moyen rapide et abordable pour extraire le parasite du paludisme et de la qualité de l'ADN du vecteur à partir d'échantillons de moustiques est décrite. Capitalisant sur les propriétés de chélation de résine Chelex, la méthode simple permet le génotypage des parasites du paludisme dans les phases de moustiques glandes de l'intestin moyen et salivaires, ainsi que l'identification moléculaire de l' Anopheles Fratrie espèces par PCR.
Résumé
Les pays d'endémie sont de plus en plus l'adoption d'outils moléculaires pour le typage efficace, l'identification et la surveillance contre les parasites du paludisme et les moustiques vecteurs, en tant que partie intégrante de leurs programmes de lutte 1,2,3,4,5. Pour l'établissement durable de ces approches précises dans les opérations de recherche afin de renforcer la lutte antipaludique et les efforts d'élimination, les méthodes simples et abordables, avec le réactif parcimonieux et les besoins en équipement sont essentiels 6,7,8. Nous présentons ici un simple Chelex technique basée sur l'extraction de l'ADN du parasite du paludisme et de vecteur à partir d'échantillons prélevés sur le terrain de moustiques.
Nous morphologiquement identifié 72 Anopheles gambiae sl. De 156 moustiques capturés par pyrèthre bombe insecticide dans les cabines de ménages dans une 2,000 km 2 à proximité de l'Institut du paludisme à Macha. Après dissection de séparer la tête et le thorax de l'abdomen pour tous les gam 72 Anophelesgambiae sl. moustiques, les deux parties ont été placés individuellement dans des tubes de 1,5 ml microtubes et immergé dans 20 ul d'eau déminéralisée. Utiliser un embout de pipette stérile, chaque section séparément moustique a été homogénéisé à une suspension uniforme dans l'eau déminéralisée. De l'homogénat découlant de chaque section de moustique, 10 pi a été retenu tandis que l'autre 10 pi a été transféré dans un autoclave séparé tube de 1,5 ml. Les aliquotes séparées ont été soumis à l'extraction d'ADN, soit par le Chelex simplifiée ou de la norme relargage d'extraction protocole 9,10. Le protocole de relargage est dite et largement utilisée car elle emploie des concentrations élevées de sel au lieu de dangereux solvants organiques (tels que le phénol et le chloroforme) pour l'étape de précipitation des protéines au cours de l'extraction d'ADN 9.
Les extraits ont été utilisés comme matrices pour l'amplification par PCR en utilisant des amorces ciblant les arthropodes déshydrogénase mitochondriale nicotinamide adénine dinucléotidenase (NADH) 4 sous-unité du gène (ND4) pour vérifier 11 Qualité ADN, la PCR pour l'identification des espèces d'anophèles gambiae frères et sœurs de 10 et une PCR nichée pour le typage des infections à Plasmodium falciparum 12. Comparaison avec la qualité de l'ADN (ND4) PCR a montré une sensibilité de 93% et une spécificité de 82% pour l'approche Chelex par rapport à la place relargage protocole. Les valeurs correspondantes de sensibilité et de spécificité étaient de 100% et 78%, respectivement, en utilisant frère identification des espèces PCR et 92% et 80%, respectivement pour P. falciparum détection par PCR. Il n'y avait aucune différence significative dans la proportion d'échantillons de signal donnant amplicon avec le Chelex ou le relargage régulier protocole dans toutes les applications PCR trois. L'approche nécessaire Chelex trois réactifs simples et 37 min pour compléter, tandis que l'. Relargage protocole comportait 10 réactifs différents et 2 h et 47 min de temps de traitement ", comprenant une étape de nuit Nos résultats montrent èmeà la méthode Chelex est comparable à celui existant relargage d'extraction et peut être remplacé par une approche simple et durable en pays à ressources limitées où un réactif de la chaîne d'approvisionnement constant est souvent difficile à maintenir.
Protocole
1. Dissection préparatoire de spécimens de moustiques
- Moustique lieu sur une petite coupe de parafilm et de montage sur microscope à dissection.
- Couverture en goutte d'eau déminéralisée pour assouplir les tissus.
- Inciser la carcasse moustique précisément à la jonction entre le thorax et l'abdomen, ainsi entailler large de la tête et du thorax de la section abdominale.
- Transférer chaque section moustiques disséqués dans un autoclave propre tube de 1,5 ml préalablement marqué avec les détails de moustiques numéro d'identification et convenablement marqués pour désigner section de corps (par exemple "m" pour la mi-gut article; "ht" pour la tête et le thorax section).
- Jeter parafilm et essuyer soigneusement la platine du microscope avec Kimwipe 70% humecté d'alcool avant de traiter le moustique prochaine.
2. Extraction de l'ADN de spécimens de moustiques
- Pipeter 20 ul d'eau déminéralisée dans le tube échantillon et la pointe de pipette utilisation pour moudre la section des moustiques immergé dans un nonsuspension iForm.
- Ajouter 100 ul de PBS 1X autoclavé / solution de saponine à 1% homogénat de l'échantillon et mélanger au vortex momentanée douce.
- Incuber à température ambiante pendant 20 min.
- Centrifuger à 20000 xg pendant 2 min et éliminer le surnageant.
- Resuspendre le culot dans 100 ul de PBS 1X.
- Centrifuger de nouveau à 20.000 xg pendant 2 min et éliminer le surnageant.
- Au vortex doux (5 sec), resuspendre le culot dans 75 pl d'eau déminéralisée stérile et 25 ul de 20% p / v de suspension de résine Chelex-100 dans de l'eau déminéralisée.
- Pierce trou dans le couvercle du tube de prélèvement stérile avec aiguille hypodermique 23G flambé au bec Bunsen.
- Suspension d'échantillon bouillir au bain-marie sur une grille flottante (ou dans le bloc de chauffage) pendant 10 min.
- Centrifuger à 20000 xg, pendant 1 min et une solution de transfert d'ADN qui a suivi dans le flacon de stockage préalablement marqué pour être utilisé comme modèle dans les applications PCR.
3. Plasmodium falciparum génotypage et Anophelesspp. Identification moléculaire
- Ajouter 2,5 ul de l'extrait d'ADN Chelex dans 25 pi de réactions de PCR pour vérifier la qualité de l'ADN 11, identifier les espèces d'anophèles 10 et le génotype P. 12 infections à P. falciparum glandes de l'intestin moyen et salivaires.
- Pour maximiser le rendement amplicon, en particulier pour P. détection de P. falciparum, notamment 1.5X albumine de sérum bovin (BSA) dans la PCR. La composition de réaction suivante est recommandée: (2,5 modèle ul, 0,25, 1,5 uM amorces chlorure de magnésium uM dNTP, 200 uM, 1X tampon PCR, 1,5 BSA et la polymérase Taq ADN 1.0U, en 25 volumes pi).
- Pour vérifier la qualité de l'ADN dans l'extrait, amplifier la région de la déshydrogénase mitochondriale des arthropodes nicotinamide adénine dinucléotide (NADH) sous-unité 4 (ND4) gène (amorces ND4FW [5'-TGA GTD YAT TTA TTR CCT AA-3 '] et ND4RV [5' DMC-CTT CTT CCW ADW CGT TC-3 ']; attendez produit 400 pb) 11,13.
- Afin de différencier les anophèles gambiee sl espèces jumelles. (An. gambiae ss et An. arabiensis. seulement), amplifier région flanquante SNP dans l 'espaceur intergénique (IGS), (amorces des Nations Unies [5'-GTGTGCCCCTTCCTCGATGT-3'], GA [5'-CTGGTTTGGTCGGCACGTTT- 3 '], AR [5'-AAGTGTCCTTCTCCATCCTA-3'], attendez-390bp produit Un gambiae ss, An. arabiensis 315bp) 10,11.
- Pour le typage P. falciparum polymorphismes antifolates résistance aux médicaments, effectuer des PCR nichée pour amplifier la région flanquant codons d'acides aminés 108, 51, 59, 16 et 164 de la réductase de dihydrofolate parasite (DHFR):
Amorces rondes primaires: M1 [5'-TTTATGATGGAACAAGTCTGC-3 '] et M5 [5'-AGTATATACATCGCTAACAGA-3']
Secondaires amorces rondes: M3 [5'-TTTATGATGGAACAAGTCTGCGACGTT-3 '] avec F / [5'-AAATTCTTGATAAACAACGGAAACCTTTTA-3']
Ou
F [5'-GAAATGTAATTCCCTAGATATGGAATATT-3] avec M4 [5'-TTAATTTCCCAAGTAAAACTATTAGAGCTTC-3 ']).
Aussi amplifier la région contenant des codons d'acides aminés 436, 437, 540, 581 unnd 613 dans le p falciparum synthétase dihydroptéroate (DHPS) gène:
Primaire ronde amorces R2 [5'-AACCTAAACGTGCTGTTCAA-3 '] avec R / [5'-AATTGTGTGATTTGTCCACAA3'];
Secondaires amorces rondes
J: [5'-'TGCTAGTGTTATAGATATAGGTGGAGAAAGC-3'] avec K / [5'-CTATAACGAGGTATTGCATTTATTGCAAGAA-3 ']
Ou
K: [5'-TGCTAGTGTTATAGATATAGGATGAGCATC-3 '] avec K /,
Ou
L [5'-ATAGGATACTATTTGATATTGATATTGGACCAGGATTCG-3 '] avec L / [5'-5TATTACAACATTTTGATCATTCGCGCAACCGG-3'] 12. - Sujet 4 amplicon ul d'allèles spécifiques digestions par des enzymes de restriction dans 30 pi de réactions suivant les instructions du fabricant, pour détecter les médicaments antifolates associées à la résistance polymorphismes 12.
- Sujet 5 pi d'amplicon de PCR (ou 15 pi de digestion de restriction) par voie de bromure d'éthidium gel d'agarose coloré 2% à électrophorèse (100 - 120V) et visualiser les bandes sous lumière ultraviolette.
Résultats
Des exemples de résultats de tests de PCR pour l'ADN extrait de la qualité de moustiques (figure 1), Anopheles arabiensis moléculaire d'identification (figure 2) et P. falciparum détection (figure 3) montrent que la méthode Chelex simplifié donne des résultats similaires à la norme relargage protocole 10, en dépit des mesures beaucoup moins (tableau 1). Avec une qualité d'ADN comparable dans les extraits respectives, il n'est pas surprenant que les taux de positivité échantillon par rapport à un. espèces jumelles gambiae ainsi que les taux d'infection parasitaire n'étaient pas statistiquement différente en fonction de McNemar test du chi carré (figure 3).
Sensibilité (%) a été calculé comme VP / (VP + FN) * 100, où TP désigne les vrais positifs et des faux négatifs FN indique. Spécificité (%) a été déterminée comme VN / (VN + FP) * 100, où TN indique vrais négatifs et de faux positifs FP indique. La qualité de l'ADN (ND4) PCR a montré une sensibilité de 93% et une spécificité de 82% pour l'approche Chelex par rapport à la norme établie or relargage protocole. Les valeurs correspondantes de sensibilité et de spécificité étaient de 100% et 78%, respectivement, en utilisant frère identification des espèces PCR et 92% et 80%, respectivement pour P. falciparum détection par PCR.
L'ajout de BSA aux mélanges de réaction a entraîné une augmentation générale de positifs par PCR (figure 3) en raison du relief d'inhibiteurs de PCR 14, à la fois pour le Chelex simplifiée et régulière relargage protocole. Toutefois, cette augmentation n'était pas statistiquement significative, sauf pour la qualité de l'ADN (PCR ND4) sur des extraits Chelex (p = 0,039). Allèle-spécifique digestion par des enzymes de restriction sur P. falciparum DHFR (ou gène cible) amplicon permet le génotypage de l'intestin moyen et salivaires des glandes infections palustres pour les allèles de résistance aux médicaments (Figure 4, les données des glandes salivaires non présentées).
| Procédure simple Chelex | Norme relargage de procédure | ||
| Mesures | Réactifs | Mesures | Réactifs |
| PBS
Chelex-100 perles |
| Diéthylpyrocarbonate (DEPC)
8 M d'acétate de potassium L'éthanol 0,1 X citrate de sodium salin (SSC) tampon RNAse (10 pg / ml) |
| TEMPS TOTAL: 37 min | Durée totale: 2 h 47 min, plus du jour au lendemain | ||
Tableau 1. Étape par étape de comparaison des réactifs et des exigences de temps pour le protocole Chelex simple et seard relargage méthode d'extraction d'ADN à partir d'échantillons de moustiques.

Figure 1. ND4 mitochondrial PCR comparaison de la qualité de l'ADN simplifié Chelex "C" et la norme relargage "M" sur des échantillons extraits Anopheles arabiensis sur le terrain. NC, témoin négatif; M1 et C1, C2 et M2, M3 et C3, et C4 et M4 sont appariés relargage et extraits du Chelex Une même. spécimens de moustiques arabiensis. L, 100 pb échelle d'ADN.
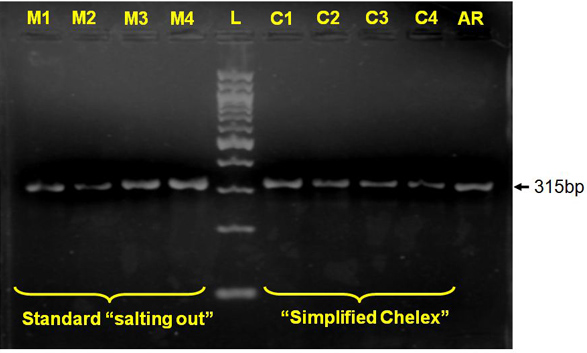
Figure 2 moléculaire PCR pour l'identification Anopheles arabiensis C1 et M1, M2 et C2, C3 et M3, M4 et C4 désigner amplicon respectif de relargage "M" et simplifié Chelex extraits d'ADN "C" pour les spécimens de moustiques mêmes;.. AR, Anopheles arabiensiscontrôle positif, L, 100 pb échelle d'ADN.

Figure 3. Détection de points positifs sur Chelex et le relargage des extraits d'ADN pour les échantillons de moustiques sur le terrain, avec des techniques de PCR pour l'identification moléculaire des Anopheles arabiensis (AR) 10, arthropodes gène NADH déshydrogénase 4 (ND4) test de qualité DNA 11, et la résistance aux médicaments antifolate P . falciparum DHFR génotypage 12 (F-M4). Les résultats présentés pour les tests s'exécutent avec ou sans BSA dans le mélange réactionnel. McNemar test du chi carré a été utilisé pour déterminer si les différences entre pour cent des PCR positives à partir d'ADN extrait de la Chelex simplifié et la norme relargage protocoles étaient statistiquement significatives.
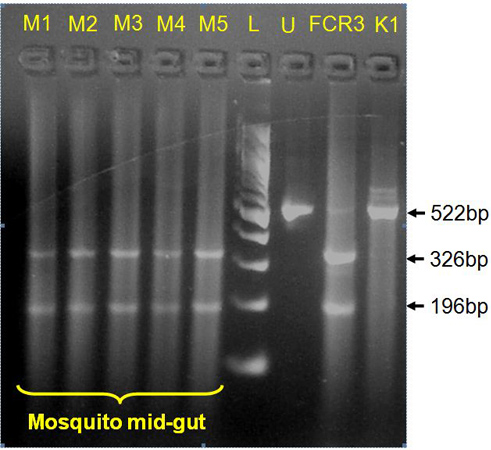
Figure 4. Application du protocole simplifié Chelex dans le génotypage P. infections à P. falciparum chez les moustiques (de l'intestin moyen des données représentées) pour les allèles de résistance aux médicaments. BstN je digestion sur amplicon d'accompagnement codon 108 du P. falciparum gène DHFR 12 montre mutants résistants S108T cycloguanil dans des échantillons de moustiques (M1-M5, l'intestin moyen des données présentées). U, non digérés 522 pb amplicon; FCR3, de laboratoire standard P. clone falciparum contrôle positif portant S108T; K1, P. falciparum standard de laboratoire de contrôle comptable négative cycloguanil clone sensible S108N, L, 100 pb échelle d'ADN.
Discussion
La méthode Chelex simplifiée présentée ici permet l'extraction de la qualité des anophèles et P. ADN falciparum à partir de spécimens de moustiques qui se prêtent à diverses applications PCR. Cette technique peut être utilisée pour l'identification moléculaire des moustiques vecteurs du paludisme et de la surveillance de la pharmacorésistance P. allèles falciparum chez les moustiques des programmes nationaux de lutte contre le paludisme. Les avantages de la technique simplifiée Chelex comprennent la simplicité, moins de réactifs et donc le coût, la sécurité et le temps de traitement plus court (37 min) de protocoles standard tels que la méthode de relargage 10 (2 h 47 min et une étape du jour au lendemain, tableau 1). Les avantages mentionnés ci-dessus et les exigences minimales de réactifs (3 réactifs) par rapport au protocole standard actuel (10 réactifs, tableau 1) 11,15, rendre le protocole Chelex simplifiée particulièrement convivial pour les laboratoires des pays d'endémie où un réactif constantchaîne d'approvisionnement est souvent difficile à maintenir. Une limitation de cette méthode est que, comme le protocole standard, il est également soumis à des inhibiteurs de PCR connus pour se produire dans le tégument moustique 16. Toutefois, cela est facilement soulagée par l'inclusion de BSA dans les essais. BSA a également été utilisé avec succès comme un exhausteur d'amplification des inhibiteurs contre dans les applications de PCR autres 17,18.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier les chefs, sous-chefs et les communautés de Macha pour leur unwaveing coopérer lors de moustiques collections d'échantillons sur le terrain. Dr Doug Norris et Rebecca Kent a offert une précieuse expertise sur le protocole de relargage. Ce travail a été financé par la Johns Hopkins Malaria Research Institute pilote de système de subvention. Mosquito et parasites ADN normes de laboratoire ont été fournies gracieusement par MR4, American Type Culture Collection &.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Chelex-100, 50-100 mesh sec | BioRad | # 143-2832 | |
| Saponine | SIGMA | 142-7425 | |
| BSA | New England Biolabs | B9001S |
Références
- Bonnet, M., et al. Efficacy of antimalarial treatment in Guinea: in vivo study of two artemisinin combination therapies in Dabola and molecular markers of resistance to sulphadoxine-pyrimethamine in N'Zerekore. Malar. J. 6, 54 (2007).
- Nsimba, B., et al. Sulphadoxine/pyrimethamine versus amodiaquine for treating uncomplicated childhood malaria in Gabon: a randomized trial to guide national policy. Malar. J. 7, 31 (2008).
- Oyewole, I. O., et al. Behaviour and population dynamics of the major anopheline vectors in a malaria endemic area in southern Nigeria. J. Vector Borne Dis. 44, 56-64 (2007).
- Harris, I., et al. A large proportion of asymptomatic Plasmodium infections with low and sub-microscopic parasite densities in the low transmission setting of Temotu Province, Solomon Islands: challenges for malaria diagnostics in an elimination setting. Malar. J. . 9, 254 (2010).
- Ouedraogo, A. L., et al. Substantial contribution of submicroscopical Plasmodium falciparum gametocyte carriage to the infectious reservoir in an area of seasonal transmission. PLoS ONE. 4, e8410 (2009).
- Birx, D., de Souza, M., Nkengasong, J. N. Laboratory challenges in the scaling up of HIV, TB, and malaria programs: The interaction of health and laboratory systems, clinical research, and service delivery. Am. J. Clin. Pathol. 131, 849-851 (2009).
- Ishengoma, D. R., et al. Health laboratories in the Tanga region of Tanzania: the quality of diagnostic services for malaria and other communicable diseases. Ann. Trop. Med. Parasitol. 103, 441-453 (2009).
- Alonso, P. L., et al. A research agenda for malaria eradication: vector control. PLoS Med. 8, e1000401 (2011).
- Grimberg, J., et al. A simple and efficient non-organic procedure for the isolation of genomic DNA from blood. Nucleic Acids Res. 17, 8390 (1989).
- Scott, J. A., Brogdon, W. G., Collins, F. H. Indentification of single specimens of the Anopheles gambiae complex by polymerase chain reaction. American Journal of Tropical Medicine and Hygiene. 49, 520-529 (1993).
- Kent, R. J., Norris, D. E. Identification of mammalian blood meals in mosquitoes by a multiplexed polymerase chain reaction targeting cytochrome B. Am. J. Trop. Med. Hyg. 73, 336-342 (2005).
- Duraisingh, M. T., Curtis, J., Warhurst, D. C. Plasmodium falciparum: detection of polymorphisms in the dihydrofolate reductase and dihydropteroate synthetase genes by PCR and restriction digestion. Exp. Parasitol. 89, 1-8 (1998).
- Gorrochotegui-Escalante, N., Munoz, M. L., Fernandez-Salas, I., Beaty, B. J., Black, W. C. T. Genetic isolation by distance among Aedes aegypti populations along the northeastern coast of Mexico. Am. J. Trop. Med. Hyg. 62, 200-209 (2000).
- Kreader, C. A. Relief of amplification inhibition in PCR with bovine serum albumin or T4 gene 32 protein. Appl. Environ. Microbiol. 62, 1102-1106 (1996).
- Norris, D. E., Shurtleff, A. C., Toure, Y. T., Lanzaro, G. C. Microsatellite DNA polymorphism and heterozygosity among field and laboratory populations of Anopheles gambiae ss (Diptera Culicidae). J. Med. Entomol. 38, 336-340 (2001).
- Schriefer, M. E., Sacci, J. B., Wirtz, R. A., Azad, A. F. Detection of polymerase chain reaction-amplified malarial DNA in infected blood and individual mosquitoes. Exp. Parasitol. 73 (91), 311-316 (1991).
- Al-Soud, W. A., Radstrom, P. Purification and characterization of PCR-inhibitory components in blood cells. J. Clin. Microbiol. 39, 485-493 (2001).
- Hyun, C., Filippich, L. J., Hughes, I. The inhibitory effect of pentobarbitone on reverse transcription-PCR. J. Biochem. Biophys. Methods. 62, 63-68 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon